普洱茶由大叶种茶[(Camellia sinensisn.) var.assamiea (Masters) Kitmaura]为原料制成[1],晒青茶经后发酵加工,汤色浓郁,味道醇厚,陈香特色明显[2-3]。此外,国内外的研究也发现,普洱熟茶具有保健作用或生物活性,如降脂、瘦身、抗氧化、抗菌等[4]。普洱熟茶之所以具有独特风味与良好的保健功能,是因为其独特的后发酵(post-fermentation)工艺。后发酵是普洱熟茶加工的关键工序,是其品质特征和保健功能形成的核心步骤[5],由于采用自然接种方式发酵,发酵原料、器皿、加工环境等均未进行杀菌处理,微生物可能来自毛茶、环境(水、空气、加工车间、器皿)以及加工人员等,其现状是参与发酵的微生物来源多样,种类不可控。
强化发酵是将一两种外源微生物或人工合成的微生物菌群接入到未经灭菌的原料中进行发酵,以期提高发酵产品的品质[6]。课题组前期已应用强化发酵提升普洱熟茶品质,如强化接种地衣芽孢杆菌L1发酵中茶褐素、茶红素、可溶性糖类品质得分显著提升,CG、EC、GCG、C等6种儿茶素含量显著降低(P<0.05)[7];接种枝犁头霉A1中的茶褐素、可溶性糖分含量明显增加,而C、EC、GCG、EGCG等7种儿茶素含量显著降低(P<0.05),增加了甜味和厚重感在茶汤中所占的分值,苦味和酸味所占的分值也有所减少[8]。这说明强化发酵是普洱茶质量和安全的提升途径。
作为人类最早驯化的微生物,酿酒酵母(Saccharomyces cerevisiae)在多种食品发酵中得到广泛应用,是安全有益的微生物。酿酒酵母广泛用于果蔬、谷物、奶制品、豆类、肉类、水产发酵[9]。普洱茶发酵过程中出现的酒酿酵母菌也被发现,谢美华等[10]已将酿酒酵母、根霉菌(Rhizopus sp.)、黑曲霉(Aspergillus niger)等微生物从普洱茶渥堆发酵样品中分离出来。张阳等[11]还发现,黑曲霉在整个发酵过程中居于主导地位,与之类似的还有酿酒酵母、光孢青霉(Penicillium glabrum)等。优势酵母菌由赵腾飞等[12]从普洱茶渥堆发酵样品中分离出来的,经过纯菌接种和发酵试验表明,由纯种酵母菌株发酵的茶样,香气甜美,口感微苦,但也有生津感,并带有甘甜的特性。可使生茶中的多酚类物质含量有效降低,茶褐素含量增加;单治国等[13]以酵母菌为原料发酵后的普洱茶,在散发浓郁陈香的同时,口感醇厚,甘甜爽口。茶多酚、氨基酸和茶红素的含量相对于固态发酵的绿色木霉、黑曲霉和少根根霉这3种微生物来说是最高的。酿酒酵母强化接菌发酵普洱茶研究表明酿酒酵母是一种安全的,可以用于提高普洱茶品质的微生物。但是,普洱茶发酵是一个长达1~2个月的过程,一般通过翻堆控制发酵进程,前人都是在发酵开始时(下堆阶段)接入酿酒酵母,因而什么阶段接入酿酒酵母发酵值得进一步研究。本文将从普洱茶中分离鉴定得到的酿酒酵母P002分不同发酵阶段接种于茶叶中,接菌强化发酵普洱茶,对发酵样品的感官特征、化学成分及微生物群落结构进行分析,以期评估该菌用于普洱茶强化接菌发酵的可行性,为提高普洱茶品质提供试验依据。
1 材料与方法
1.1 材料与试剂
普洱普山茶叶有限公司提供一芽二叶、三叶的晒青茶原料;苯丙氨酸(Phe)、丙氨酸(Ala)、脯氨酸(Pro)、赖氨酸(Lys)、亮氨酸(Leu)、异亮氨酸(Ile)、精氨酸(Arg)、半胱氨酸(Cys)、酪氨酸(Tyr)、苏氨酸(Thr)、甲硫氨酸(Met)、甘氨酸(Gly)、谷氨酸Glu)、组氨酸(His)、丝氨酸(Ser)、天冬氨酸(Asp)、茶氨酸(Thea)、没食子酸(GA)、表没食子儿茶素(EGC)、表儿茶素没食子酸酯(ECG)、表没食子儿茶素没食子酸酯(EGCG)、儿茶素(C)、表儿茶素(EC)、儿茶素没食子酸酯(CG)、没食子儿茶素没食子酸酯(GCG)、没食子儿茶素(GC)、咖啡碱(CA)、没食子酸(GA)、鞣花酸(EA)、杨梅素(Myr)、木犀草素(Lut)、槲皮素(Que)、山奈酚(Kea)、茶氨酸(Thea)、茶碱(Theo)等标准品,成都曼思特生物科技有限公司;酵母菌 DNA 提取试剂盒,庄盟国际有限公司(北京);麦芽汁培养基,环凯微生物科技有限公司(广东);DNA聚合酶(2×Rapid Taq Master Mix),诺唯赞生物科技公司(南京);DNA Ladder Marker(DNA分子质量标准试剂)、5×Loading Buffer for Agarosegels(DNA 染料),上海捷瑞生物工程公司;DNA引物,擎科生物科技有限公司(北京)。
1.2 仪器与设备
CT15RE型离心机,日立公司;LRHS-250-Ⅱ型生化培养箱,上海跃进医疗器械有限公司;SW-CJ-1B型超级工作台,苏州安泰空气技术有限公司;JM-80电热恒温水浴锅,上海丹阳包装机械;CP214型电子分析天平,奥豪斯仪器(上海)有限公司;756CRT型紫外可见分光光度计,上海菁华科技仪器有限公司;1200型高速液相色谱,配TSKgel ODS-80TM色谱柱(4.6 mm×250 mm,5 μm),安捷伦公司;DW-86L626型医用低温保存箱,青岛海尔生物医疗股份有限公司;Trident 960型基因扩增仪,力新仪器(上海)有限公司;YS6 060型色差仪,深圳市三恩时科技有限公司;XB.K.25型血球计数板,上海求精生化试剂仪器有限公司。
1.3 试验方法
1.3.1 酿酒酵母P002鉴定
对菌株P002进行ITS序列DNA测序分析,根据其ITS的DNA序列进行系统发育分析,确定菌株P002的分类地位。
1.3.2 酿酒酵母P002优化发酵试验
优化接菌阶段试验:在10 L蒸馏水中加入30 kg晒青茶,将晒青茶分为5层装入发酵筐(50 cm×40 cm×60 cm),不同接菌阶段对应不同层,每次翻堆前顺次接入茶叶质量0.1%的发酵剂,以5 d为周期进行茶叶发酵,每一周期翻堆接菌并静置发酵,为期25 d。对茶样进行五点取样,样本存于-80 ℃冰箱,其中接菌样品命名为F1~F4;将每一翻自然发酵的样品(未接入酿酒酵母P002)命名为CK。每组样品进行3个重复。
1.3.3 酿酒酵母P002强化发酵普洱茶放大试验
强化发酵普洱茶试验:称取30 kg晒青毛茶,量取茶样质量30%的纯净水进行潮水静置12 h,次日适当补水,保证茶叶潮水到位。将茶叶装入发酵筐(50 cm×40 cm×60 cm),第四翻接入茶叶质量0.1%的发酵剂,进行为期25 d的静置发酵。对茶样进行五点取样,样本存于-80 ℃冰箱,其中接菌样品命名为S1;将未接入酿酒酵母P002自然发酵的样品命名为CK。每组样品进行3个重复。
1.3.4 茶叶化学成分测定及感官审评
根据GB/T 8305—2013《茶 水浸出物》测定水浸出物含量;根据GB/T 8314—2013《茶 游离氨基酸总量的测定》测定游离氨基酸含量;根据GB/T 8313—2018测定茶多酚含量;蒽酮硫酸法测定可溶性糖含量[14],茶色素含量[15],测定儿茶素组分、咖啡碱及氨基酸组分含量高效液相色谱法[16],审评茶叶样品由5位评茶员进行,根据GB/T 23 776—2018采用定量描述分析法[17]评价茶汤特征滋味,同时对茶汤的颜色用色差仪进行测定。
1.3.5 微生物多样性分析
采用接种发酵普洱茶样品的真菌DNA提取试剂盒提取,聚合酶链式反应(PCR)应用DNA聚合酶(2×Rapid Taq Master Mix)进行。其中,以引物ITS5-1737F和ITS2-2043R扩增真菌ITS1的V2区。委托诺禾致源科技股份有限公司(北京),对PCR产物应用Illumina MiSeq测序平台进行基因测序。对嵌合体序列等疑问序列通过QIIME软件检查并剔除,对获得的序列选择序列比对工具按97%的相似度进行聚类和OTU划分,计算Alpha多样性指数,评估每个样本的多样性水平。
1.4 数据处理
统计分析和数据处理选用IBM SPSS Statistics 22.0软件,以平均值±标准差表示数据;主成分分析选用SIMCA 14.1软件。
2 结果与分析
2.1 酿酒酵母P002的鉴定
麦芽汁琼脂培养基接种菌株P002,培养期3 d后菌落呈乳白色圆形,色泽均匀,表面润泽光滑(图1-a);菌形卵圆形,直径8~15 μm,出芽生殖明显(图1-c);ITS系统发生学分析发现,P002与Saccharomyces cerevisiae (MK439 496.1)(LC413 770.1)等聚为一支(图1-b),因此认定P002为酿酒酵母(S.cerevisiae)。
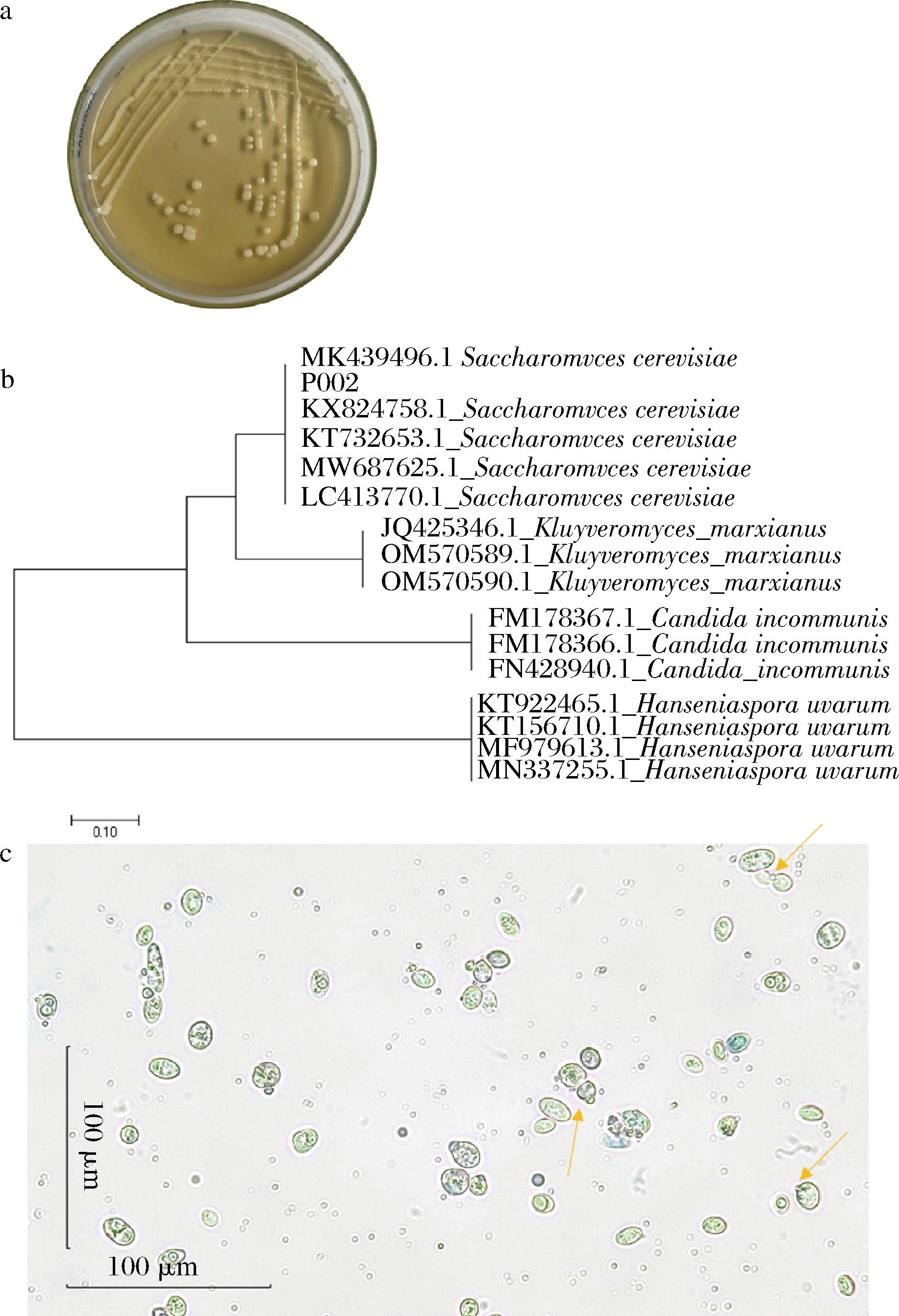
a-酿酒酵母P002的菌落形态;b-真菌ITS 核苷酸序列系统发育树;c-显微形态(400×,“→”表示出芽生殖)
图1 酿酒酵母P002的鉴定
Fig.1 Identification of Saccharomyces cerevisiae P002
2.2 强化发酵接菌阶段优化
为了应用酿酒酵母P002发酵普洱茶,首先在第1~第4次翻堆阶段时,分别接入茶叶质量0.1%的发酵剂,发酵普洱茶,得到5组发酵样品。感官审评结果见图2。由图2-a可知干茶外形除CK茶样色泽灰褐、含梗、条索较松外,其余茶样干茶外形均为色泽乌褐、含梗、条索较松。茶汤颜色中CK、F2、F3和F4为红褐明亮;F2的汤色为乌褐明亮。叶底均为乌褐色、有红梗红叶。由图2-b得出结果,CK(63.35±0.02)和F2(63.72±1.18)的L*值较高,说明其亮度较高;F1(46.25±0.03)的a*值较高,说明其汤色更红颜色更深;CK的b*值(91.56±0.2)较高,说明其黄色程度更高。
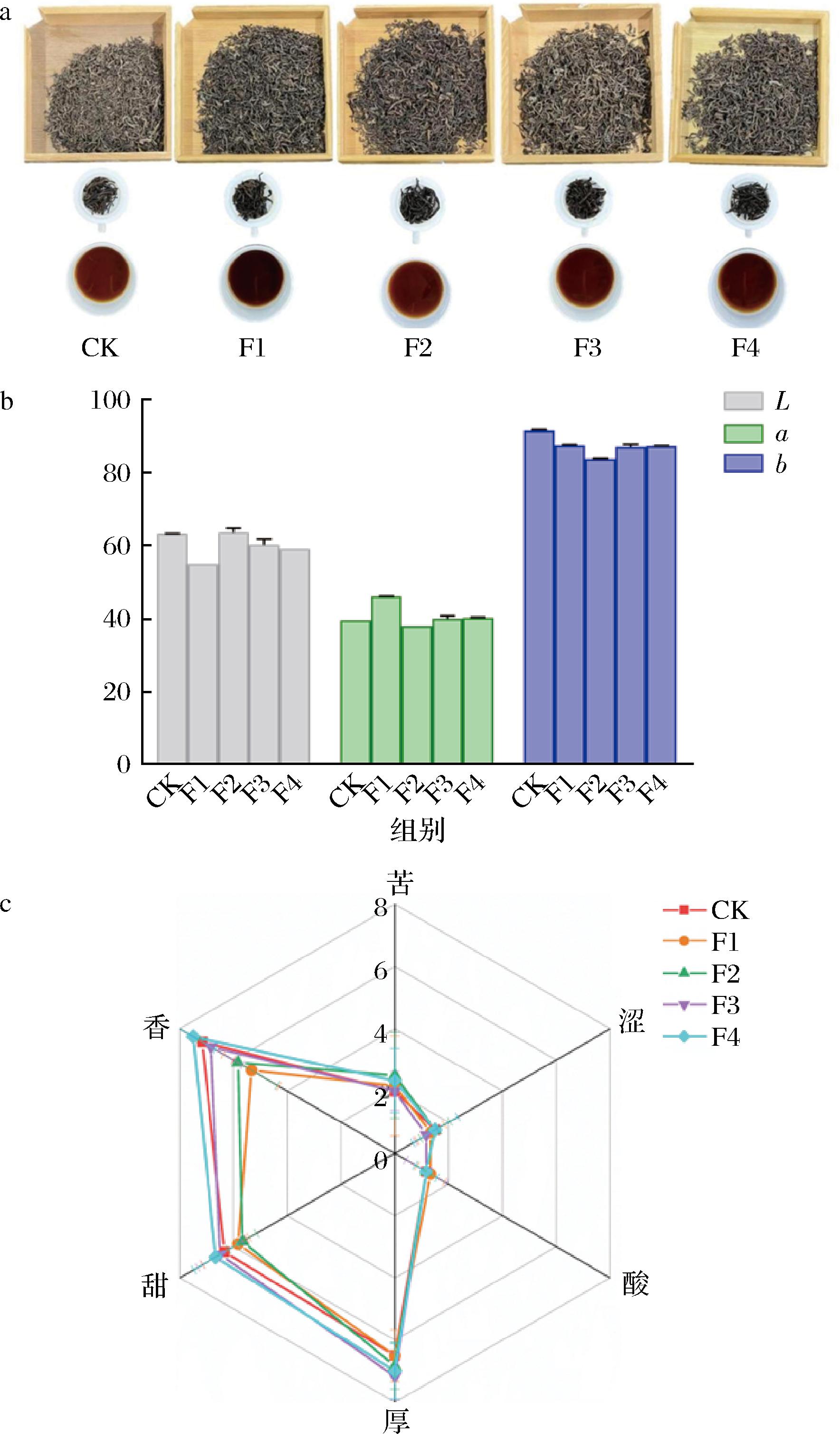
a-发酵样干茶、茶汤、叶底的感官特征;b-发酵样茶汤的颜色参数;c-发酵样茶汤的滋味特征
图2 发酵茶样感官审评结果
Fig.2 Result of sensory evaluation of fermented tea leaves
对发酵茶样的苦、涩、酸、厚、甜和香度进行评分,结果见图2-c,F4茶样在香气(7.50±0.84)、甜度(6.67±0.82)和厚度(7.00±0.89)上都比CK及其他阶段接菌茶样分数高(P<0.05),说明其在品质上发生了变化导致香气更明显,甜度更高,更醇厚。F4茶样酸味(1.17±0.41)分数比CK茶样分数低,说明F4接菌导致的成分变化减弱了茶叶的酸味。F1茶样和F2茶样在香气[(5.33±1.03)、(5.83±1.47)]和甜度[(5.83±0.41)、(5.67±0.52)]评分都低于CK茶样,说明在F1和F2的茶样香气和甜度都不如CK茶样,这两翻接入酵母菌对滋味的提升作用不佳。整体而言,第4翻接入酵母菌进行强化发酵,茶味最佳,符合单治国等[13]研究得出的酒酿酵母菌发酵茶味醇厚甘爽的结论,因此,初步确定了第4翻接入酵母菌的方法。
对发酵样品的含水量、水浸出物、可溶性糖、茶多酚、游离氨基酸及儿茶素等化学成分进行进一步测定(表1和图3)。发酵茶样的可溶性糖含量为4.08%~6.42%。F1、F2与CK相比可溶性糖含量显著降低(P<0.05),推测酵母菌可能将可溶性糖当作碳源消耗[18],F4的可溶性糖含量显著升高(P<0.05),推测在第四翻接入酵母菌会促进糖类物质的生成。F2茶样的茶多酚含量为46.20~77.40 mg/g,加入酵母菌发酵后F1、F2和F3的茶多酚含量显著降低。接入酵母菌样品中,茶褐素含量均增加,其中F1和F4的茶褐素含量显著增加(P<0.05)。推测接入酵母菌进一步促进茶褐素的生成。发酵过程中,接入酿酒酵母可以增加茶褐素含量,不接菌和接菌茶样游离氨基酸含量变化情况也与赵腾飞等[12]研究一致,酿酒酵母可将茶多酚分解产生单糖而改变可溶性糖及茶多酚的含量[10]。
表1 茶样化学成分含量
Table 1 Contents of chemical compositions in tea samples

名称含水量/%水浸出物/%可溶性糖/%茶多酚/(mg/g)游离氨基酸/(mg/g)不接菌(CK)9.73±0.28bc42.97±3.00b5.69±0.52c77.40±10.30b9.39±3.01bcd第一翻接菌(F1)11.10±0.80a38.73±0.95cde4.30±0.22ef46.20±6.23cd8.88±1.10cde第二翻接菌(F2)9.29±0.08c34.56±1.29g4.08±0.45ef48.24±6.09cd12.13±0.80a第三翻接菌(F3)9.66±0.23bc39.17±0.84cd5.48±0.55c55.94±2.87c10.52±2.36abc第四翻接菌(F4)9.95±0.18bc40.71±0.68bc6.42±0.20b70.94±0.81b8.15±0.70def
注:同一列小写字母表示样品间差异显著(P<0.05)。
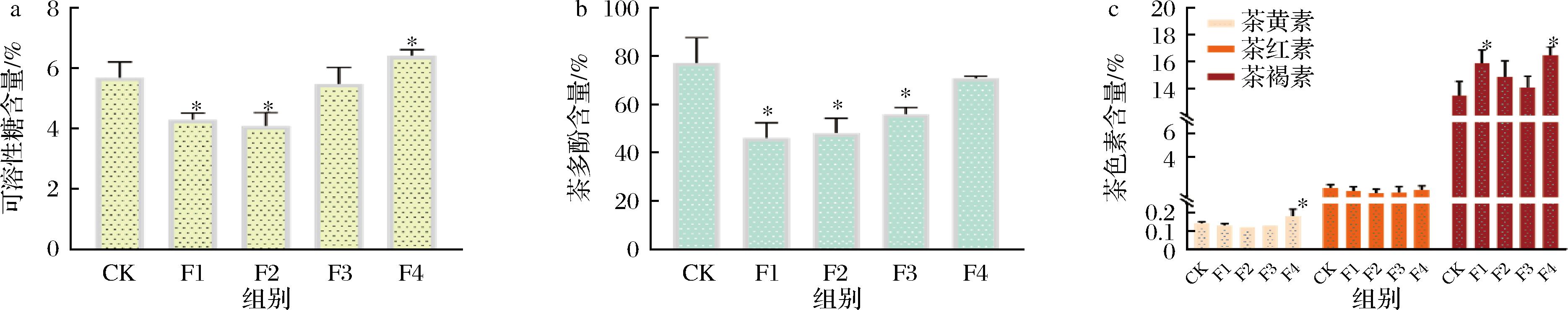
a-可溶性糖含量;b-茶多酚含量;c-茶色素含量
图3 茶样可溶性糖、茶多酚和茶色素含量
Fig.3 Contents of soluble sugar,tea polyphenols,and tea pigment in tea samples
注:“*”表示样品间差异显著(P<0.05)。
应用高效液相色谱法测定茶样中儿茶素和氨基酸含量(图4)。发酵茶样的儿茶素含量为7.48~12.05 mg/g,F4的儿茶素含量显著增加,其中,F4中GC、C、EC和CG的含量显著高于CK(P<0.05)。茶样的黄酮及黄酮苷类含量为0.02~0.10 mg/g,F4中花旗松素、杨梅素、木犀草素和山奈酚含量显著增加(P<0.05)。茶样的酚酸含量为0.31~1.36 mg/g,F4的鞣花酸含量显著增加(P<0.05)。茶样的生物碱含量为5.53~8.42 mg/g,F4的咖啡碱和茶碱含量显著增加(P<0.05)。茶样的茶氨酸含量为0.34~1.02 mg/g,F4的茶氨酸和天冬氨酸含量显著降低(P<0.05)。推测酿酒酵母对咖啡碱的生物合成有帮助[19]。

图4 发酵茶样中36种茶叶特征成分含量
Fig.4 The contents of characteristic components in 36 fermented tea samples
注:同一行小写字母表示样品间差异显著(P<0.05)。
综上,F4茶样的香气较为明显,甜度较高,较为醇厚,同时酸味较低;可溶性糖、茶褐素、儿茶素、花旗松素、杨梅素、木犀草素、山奈酚、鞣花酸、咖啡碱和茶碱含量均有明显提高(P<0.05)。因此,第4翻接入酿酒酵母P002的茶样品质最佳,确定第4翻接菌的方法。
2.3 酿酒酵母P002强化发酵普洱茶
确认第4翻接入酵母的方法,并扩大进行强化接菌发酵。采用麦芽汁培养基,对发酵样品的真菌菌落计数,研究发酵过程真菌的生长情况(图5)。由表2可知,空白样的真菌菌落数最少,为4.9×104 CFU/g。人工接入酵母菌后S1酵母菌为7.8×105 CFU/g。由此可知接入酵母菌发酵的茶样,干燥后存在大量酵母菌,表明酵母菌可以在普洱茶的渥堆发酵过程中存活,并作用于发酵过程。
表2 茶样酵母菌落数
Table 2 Yeast colony number in tea sample

茶样同一稀释度平均菌落数/(CFU/g)CK4.9×104S17.8×105∗
注:“*”表示样品间差异显著(P<0.05)(下同)。
图5 菌落计数平板
Fig.5 The plates count of yeast colony
测定强化发酵样品的含水量、水浸出物、可溶性糖、茶多酚、游离氨基酸、黄酮、儿茶素及生物碱等化学成分(表3和表4)。强化发酵样品的ECG、C、EC、花旗松素、芦丁、咖啡碱和茶碱的含量显著高于自然发酵茶叶(P<0.05),该结果与强化发酵接菌阶段优化茶样检测结果一致,表明强化发酵可以提高茶叶品质,且与之前报道一致[20]。进一步证明在茶叶中接入酿酒酵母强化发酵可以提高普洱熟茶的品质。
表3 普洱茶样品中生化成分含量
Table 3 Contents of biochemical compounds in Pu-erh tea samples
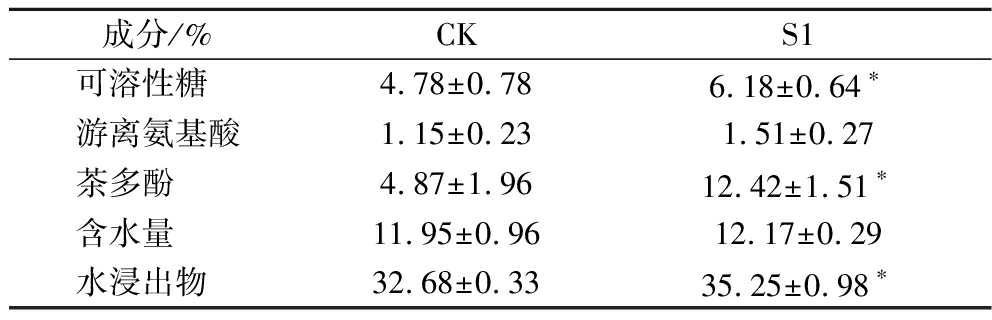
成分/%CKS1可溶性糖 4.78±0.786.18±0.64∗游离氨基酸1.15±0.231.51±0.27茶多酚 4.87±1.9612.42±1.51∗含水量 11.95±0.9612.17±0.29水浸出物 32.68±0.3335.25±0.98∗
表4 普洱茶样品中黄酮、儿茶素、生物碱、酚酸的含量 单位:mg/g
Table 4 Contents of flavone,catechins,alkaloids,and phenolic acids in Pu-erh tea samples
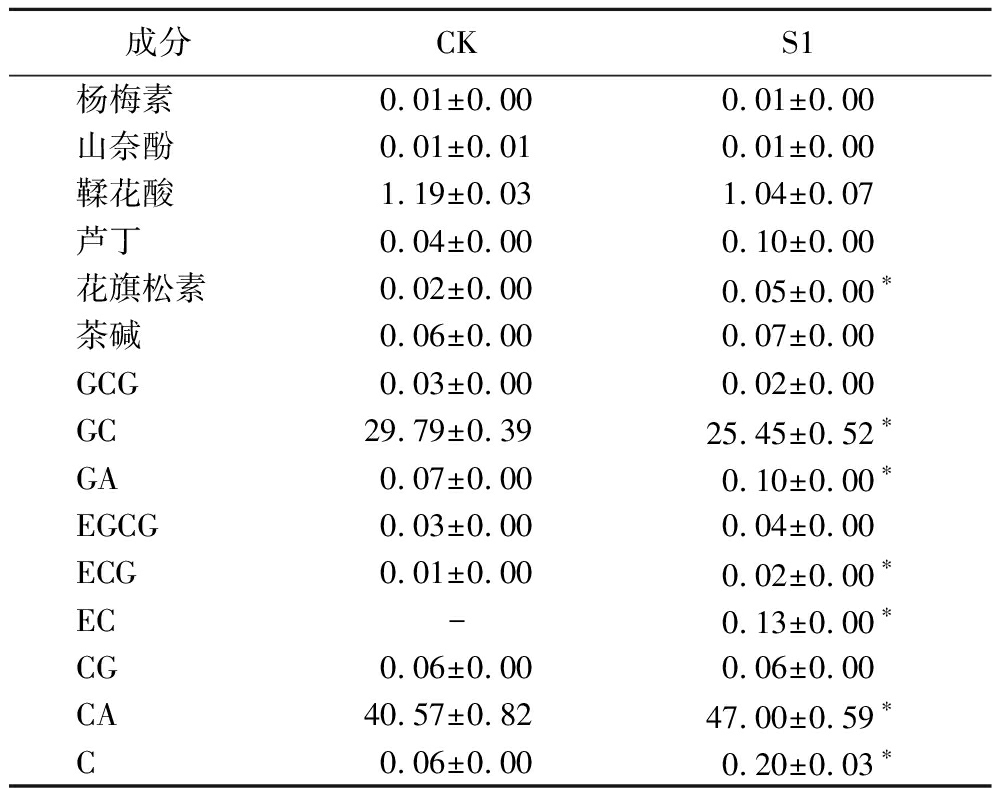
成分CKS1杨梅素0.01±0.000.01±0.00山奈酚0.01±0.010.01±0.00鞣花酸1.19±0.031.04±0.07芦丁0.04±0.000.10±0.00花旗松素0.02±0.000.05±0.00∗茶碱0.06±0.000.07±0.00GCG0.03±0.000.02±0.00GC29.79±0.3925.45±0.52∗GA0.07±0.000.10±0.00∗EGCG0.03±0.000.04±0.00ECG0.01±0.000.02±0.00∗EC-0.13±0.00∗CG0.06±0.000.06±0.00CA40.57±0.8247.00±0.59∗C0.06±0.000.20±0.03∗
注:-表示未检出。
对强化接菌发酵样进行群落结构分析。由主成分分析可知发酵样CK与S1聚为不同两簇(图6-a),两样品中优势菌为酵母目和散囊菌目,相对丰度分别达到了99.14%和99.53%(图6-b)。相对于CK,酿酒酵母强化显著改变了微生物的相对丰度,其中酵母目由CK的45.66%增加到73.31%,而散囊菌目的相对丰度由53.48%降低到26.22%。

a-真菌群落的主成分分析;b-真菌目水平群落结构
图6 茶叶样品中微生物群落结构
Fig.6 Microbial community structure in tea samples
3 结论
在晒青茶中接种酿酒酵母P002,与其他阶段强化接菌发酵样相比,经第4翻强化接菌发酵后,其茶多酚、茶褐素和可溶性糖含量显著增加(P<0.05);与传统自然发酵相比,GC、C、EC、CG、花旗松素、杨梅素、木犀草素、山奈酚、鞣花酸、咖啡碱和茶碱的含量显著提高(P<0.05);茶汤的香气、甜味、厚重感数值都有所上升,酸味数值也有所下降。酿酒酵母P002强化发酵,增加了酵母目真菌的相对丰度,降低了散囊菌目的相对丰度。因此,接种酿酒酵母P002进行的强化发酵,可改变发酵微生物群落结构和茶叶特征成分含量,进而提高感官品质。
[1] LIU J Y,HE D,XING Y F,et al.Effects of bioactive components of Pu-erh tea on gut microbiomes and health:A review[J].Food Chemistry,2021,353:129439.
[2] 华晓雨,陶爽,孙盛楠,等.植物次生代谢产物-酚类化合物的研究进展[J].生物技术通报,2017,33(12):22-29.
HUA X Y,TAO S,SUN S N,et al.Research progress on phenolic compounds of plant secondary metabolites[J].Biotechnology Bulletin,2017,33(12):22-29.
[3] ZHANG L,HAN Z S,GRANATO D.Polyphenols in foods:Classification,methods of identification,and nutritional aspects in human health[J].Advances in Food and Nutrition Research,2021,98:1-33.
[4] WANG S N,QIU Y,GAN R Y,et al.Chemical constituents and biological properties of Pu-erh tea[J].Food Research International,2022,154:110899.
[5] 赵明,周玲,李家华,等.普洱茶英文科技论文研究概述[J].中国农学通报,2013,29(35):400-408.
ZHAO M,ZHOU L,LI J H,et al.Review of the English scientific papers about Pu-erh tea[J].Chinese Agricultural Science Bulletin,2013,29(35):400-408.
[6] SADH P K,KUMAR S,CHAWLA P,et al.Fermentation:A boon for production of bioactive compounds by processing of food industries wastes (by-products)[J].Molecules,2018,23(10):2560.
[7] 刘琨毅,王利妍,安江珊,等.接种地衣芽孢杆菌发酵的普洱茶品质与微生物群落分析[J].食品科学技术学报,2022,40(2):108-118.
LIU K Y,WANG L Y,AN J S,et al.Analysis of quality and microbial communities of Pu-Erh Tea through inoculation fermentation with Bacillus licheniformis[J].Journal of Food Science and Technology,2022,40(2):108-118.
[8] 刘琨毅,王利妍,安江珊,等.伞枝犁头霉纯菌与强化发酵普洱茶研究[J].食品研究与开发,2022,43(10):202-209.
LIU K Y,WANG L Y,AN J S,et al.Pure culture and enhanced fermentation of Pu-erh tea through inoculation with Absidia corymbifera[J].Food Research and Development,2022,43(10):202-209.
[9] 陈历水.酵母菌与中国特色发酵食品[M].北京:中国轻工业出版社,2021.
CHEN L S.Yeast and Chinese Characteristic Fermented Food[M].Beijing:China Light Industry Press,2021.
[10] 谢美华,陈华红,陈玉红,等.几种普洱茶发酵微生物对茶多酚代谢的初步研究[J].食品科技,2013,38(5):82-85.
XIE M H,CHEN H H,CHEN Y H,et al.A primary study on tea polyphenol metabolism of some fungi strains isolated from Pu-er tea[J].Food Science and Technology,2013,38(5):82-85.
[11] 张阳,赵树欣,梁慧珍,等.普洱茶发酵过程中真菌群落结构的变化分析[J].中国酿造,2012,31(1):122-125.
ZHANG Y,ZHAO S X,LIANG H Z,et al.Changes of fungal community in Puer tea fermentation[J].China Brewing,2012,31(1):122-125.
[12] 赵腾飞,郭学武,张长霞,等.酵母菌纯种发酵普洱茶初探[J].食品科技,2012,37(2):57-60.
ZHAO T F,GUO X W,ZHANG C X,et al.Influence of advantage Saccharomycetes to Puer tea fermentation[J].Food Science and Technology,2012,37(2):57-60.
[13] 单治国,张春花,周红杰,等.不同菌种固态发酵对普洱茶化学成分和感官品质的影响[J].福建茶叶,2019,41(10):6-8.
SHAN Z G,ZHANG C H,ZHOU H J,et al.Effects of solid state fermentation with different strains on chemical composition and sensory quality of Pu-erh Tea[J].Tea in Fujian,2019,41(10):6-8.
[14] ZHAO M,ZHANG D L,SU X Q,et al.An integrated metagenomics/metaproteomics investigation of the microbial communities and enzymes in solid-state fermentation of Pu-erh tea[J].Scientific Reports,2015,5:10117.
[15] WANG Q P,PENG C X,GONG J S.Effects of enzymatic action on the formation of theabrownin during solid state fermentation of Pu-erh tea[J].Journal of the Science of Food and Agriculture,2011,91(13):2412-2418.
[16] ZHAO M,SU X Q,NIAN B,et al.Integrated meta-omics approaches to understand the microbiome of spontaneous fermentation of traditional Chinese Pu-erh tea[J].mSystems,2019,4(6):e00680-e00619.
[17] FAN F Y,HUANG C S,TONG Y L,et al.Widely targeted metabolomics analysis of white peony teas with different storage time and association with sensory attributes[J].Food Chemistry,2021,362:130257.
[18] CANONICO L,GALLI E,AGARBATI A,et al.Starmerella bombicola and Saccharomyces cerevisiae in wine sequential fermentation in aeration condition:Evaluation of ethanol reduction and analytical profile[J].Foods,2021,10(5):1047.
[19] JIN L,BHUIYA M W,LI M M,et al.Metabolic engineering of Saccharomyces cerevisiae for caffeine and theobromine production[J].PLoS One,2017,9(8):e105368.
[20] 刘琨毅,王利妍,安江珊,等.阿曲霉接菌发酵普洱茶的研究[J].轻工学报,2014,37(4):1-9.
LIU K Y,WANG L Y,AN J S,et al.Research on the fermentation of Pu-erh tea through inoculation with Aspergillus amstelodami[J].Journal of Light Industry,2014,37(4):1-9.