发酵技术在中药生产中应用广泛,现代中药发酵研究已成为当前中药领域研究热点之一[1-2]。中药发酵技术是采用现代生物工程技术,在人体外建立一个“工业化肠胃系统”,通过添加人体肠道内的多种益生菌,把大分子的中间物质,分解和转化成为能够被直接吸收的有效小分子物质。中药发酵菌株乳酸菌具有改善肠道菌群,降低胆固醇,增强人体免疫力的功效,且乳酸菌发酵还能改善食品风味。此外,中药发酵后产品可一定程度上减少毒副作用[3-8]。虽然中药发酵在我国具有几千年悠久历史,但是采用纯菌种微生物发酵改性中药材在近几十年才兴起,可以说是方兴未艾,需要进一步拓展和深入。梅晓丹等[9-10]、王喻淇等[11]采用液态发酵技术对黄精覆盆子,玫瑰花、玫瑰咖、枸杞子及生姜进行乳酸菌发酵,并对开发的饮品化学成分进行超高效液相色谱-高分辨质谱法(ultra performance liquid chcromatography-high resolution mass spectrum,UPLC-HRMS)鉴定分析,明确了中药发酵产品对食疗和保健的正向作用。张妍等[12]以2种乳酸菌为发酵剂,以玉米及其副产物饮料为研究对象,利用非靶向代谢组技术对饮料发酵前后小分子质量物质变化进行了对比分析,结果发现,玉米及其副产物饮料发酵前后存在较大的代谢物差异。
利用中药发酵技术创新求变,功能性转化为卖点突出、形式新颖的产品是值得我们探索的新方向。竹叶青酒是中国唯一的露酒传统名酒,具有独特的草本古方,其出自明末清初的大学者傅山,源于传统中医药学、药食同源的理论与实践经验指导,具有极强的现代功能食品优势[13]。竹叶青酒是以汾酒为基酒,配以淡竹叶(竹叶)、菊花、栀子等十几味中药材浸泡而成。现代研究表明,得益于山西杏花村得天独厚的汾酒微生物体系,以及传承千年的古法工艺酿造而成的竹叶青酒具有显著的保肝、护胃、清心、除烦、消食之功效,它的健康功效成分已获得8项国家发明专利[14]。
鉴于酒是物质与精神融合的风味嗜好品,目前在竹叶青酒与中药材健康逻辑的研究上仍缺少有效论证。本研究以竹叶青传统组方以及药食同源文化为根本,选择现代发酵中药技术(液态深层发酵),优选3株纯种益生菌与竹叶青药食同源组方进行双向发酵,制备无糖、高黄酮、零酒精新型中药发酵液。研究采用超高效液相色谱-高分辨质谱法(ultra performance liquid chcromatography-high resolution mass spectrum,UPLC-HRMS)对竹叶青药食同源组方发酵前后的化学成分进行分析,以期从活性成分变化的角度初步揭示竹叶青组方配伍的科学内涵。
1 材料与方法
1.1 材料与试剂
色谱乙腈(≥99.5%)、色谱甲醇(≥99.5%)、色谱甲酸(>99.0%),阿拉丁试剂(上海)有限公司;植物乳杆菌(Lactobacillus plantarum,CGMCC 17054,来自发酵泡菜)、发酵乳杆菌(Lactobacillus fermentum,CGMCC 22774,来自健康人体肠道)、青春双歧杆菌(Bifidobacterium adolescentis,CICC 6178,来自成人肠道),中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)、中国工业微生物菌种保藏管理中心(CICC);中药组方含淡竹叶、菊花、陈皮、栀子、丁香、砂仁,山西杏花村汾酒厂股份有限公司。
1.2 仪器与设备
Vanquish UHPLC超高压液相色谱仪、Q Exactive HF-X质谱仪,Thermo;5430R低温高速离心机,Eppendorf;ACQUITY UPLC HSST3色谱柱(2.1 mm×100 mm,1.8 μm),Waters;LT-36VLC8恒温恒湿培养箱,PERCIVAL;ZHJH-C1109C超净工作台,ZHCHENG;MAC-350P高压灭菌锅,SANYO;Milli Q Plus超级纯水仪,Bio-Rad。
1.3 实验方法
1.3.1 供试品溶液的制备
工艺路线及参数:中药超微粉碎(粉碎度200目)、生物酶解(40 ℃,1 h)、提取灭菌(80 ℃,30 min)、厌氧发酵(30 ℃,48 h,pH:5.5~3.5,接种量106CFU/mL)、低温灭菌(80 ℃,30 min)、离心(浊度<100 NTU)、口感调配。
1.3.2 样本提取方法
样本在4 ℃环境下缓慢解冻后,取竹叶青组方发酵液(发酵前、后)(上机名称依次为:ZYQBF、ZYQLF)600 μL于不同的1.5 mL EP管中,加400 μL纯甲醇溶液,涡旋混匀后,再用40%甲醇水溶液分别稀释2倍,离心15 min (16 000×g,4 ℃),取上清液分析。
1.3.3 色谱与质谱条件
色谱条件:样品采用Vanquish UHPLC系统ACQUITY UPLC HSS T3色谱柱进行分离;柱温35 ℃;流速0.3 mL/min;进样量2 μL;流动相组成:0.1%甲酸水溶液(A)-0.1%甲酸乙腈溶液(B);梯度洗脱程序:0~17 min,5% B~98% B;17~17.2 min,98% B~5% B;17.2~20 min,5% B;整个分析过程中样品置于4 ℃自动进样器中。为避免仪器检测信号波动而造成的影响,采用随机顺序进行样本的连续分析。样本队列中插入QC样品,用于监测和评价系统的稳定性及实验数据的可靠性。
质谱条件:采用Q-Exactive系列质谱仪进行样本一级、二级谱图的采集。样品经由Vanquish UHPLC系统分离后,进行质谱分析,分别采用电喷雾电离正离子和负离子模式进行检测。ESI源及质谱设置参数如下:电喷雾电压(+):3.8 kV,电喷雾电压(-):3.0 kV;毛细管温度:320 ℃;鞘气流速:13.5 L/min;辅助气流速:6 L/min;辅助加热器温度:370 ℃;一级质荷比扫描范围:90~1 300 m/z;数据依赖性MS/MS:Top 10;循环数:10。
1.3.4 数据处理
原始数据经ProteoWizard转换成.mzXML格式,然后采用XCMS软件进行峰对齐、保留时间校正和提取峰面积。对XCMS提取得到的数据首先进行代谢物结构鉴定、数据预处理,然后进行实验数据质量评价,最后再进行数据分析。数据分析内容包括主成分分析(principal component analysis,PCA)、偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA)、正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)和差异代谢物筛选等内容。OPLS-DA模型得到的变量权重值(variable important inprojection,VIP)能够用于衡量各代谢物的表达模式对各组样本分类判别的影响强度和解释能力,挖掘具有生物学意义的差异代谢物分子。在本研究中,差异代谢物筛选标准设定为:OPLS-DA模型得到的VIP>1且P<0.05。
1.3.5 网络药理学分析
选取竹叶青组方发酵液发酵后显著增加的成分以及发酵后新生成的成分,进行网络药理学分析,以初步探讨其潜在的作用机制。使用SwissTargetPrediction软件[15]预测化合物的靶点,使用clusterProfiler[16]对靶点功能进行GO生物学过程(biological process,BP)、细胞组分(cell components,CC)、分子功能(molecular function,MF)和KEGG富集分析,显著性阈值设定为BH法校正后P<0.05。
1.4 统计分析
统计分析均采用R语言(版本4.4.2)进行,数据以均值±标准误表示。组间差异显著性通过Student T-test进行比较,P<0.05表示具有统计学意义。
2 结果与分析
2.1 竹叶青组方发酵液化学成分鉴定
根据设定的液相色谱及质谱条件,取发酵后样品进样分析。图1为竹叶青组方发酵液在正、负离子模式下的总离子流色谱图,对正离子模式下的主要峰进行标记,获得25个峰(峰1~25),对负离子模式下的主要峰进行标记,获得32个峰(峰26~54、12、14)。在电喷雾一级谱中获得标记峰的相对分子质量信息,通过多级串联质谱分析并结合保留时间及相关文献对各主要分子离子峰进行指认,最终确定46个化合物,对应峰的相关信息见表1。鉴定所得的46个化合物包括24个苯丙素类和聚酮类化合物(其中19个是黄酮类化合物,5个是异黄酮类化合物),9个脂类和类脂分子(其中有4个萜类),4个氨基酸、肽及类似物,3个脂肪酸,4个有机氧化合物(2个醇及多元醇,2个碳水化合物及其结合物),1个苯类,及1个有机氮化合物(季铵盐类)(表1)。
表1 竹叶青组方发酵液化学成分的基本信息
Table 1 Basic information of chemical components of Zhuyeqing formula fermentation broth
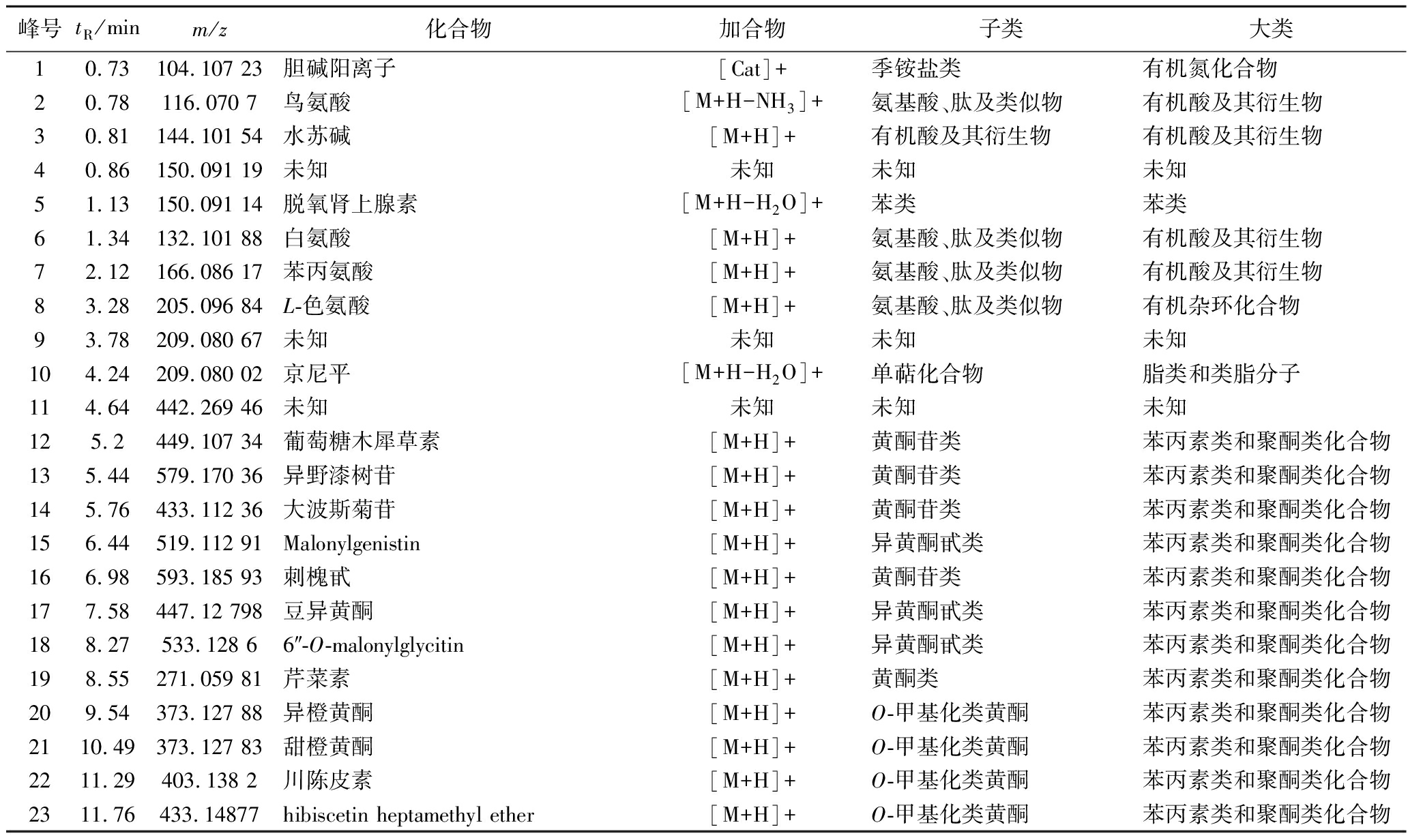
峰号tR/minm/z化合物加合物子类大类10.73104.107 23胆碱阳离子[Cat]+季铵盐类有机氮化合物20.78116.070 7鸟氨酸[M+H-NH3]+氨基酸、肽及类似物有机酸及其衍生物30.81144.101 54水苏碱[M+H]+有机酸及其衍生物有机酸及其衍生物40.86150.091 19未知未知未知未知51.13150.091 14脱氧肾上腺素[M+H-H2O]+苯类苯类61.34132.101 88白氨酸[M+H]+氨基酸、肽及类似物有机酸及其衍生物72.12166.086 17苯丙氨酸[M+H]+氨基酸、肽及类似物有机酸及其衍生物83.28205.096 84L-色氨酸[M+H]+氨基酸、肽及类似物有机杂环化合物93.78209.080 67未知未知未知未知104.24209.080 02京尼平[M+H-H2O]+单萜化合物脂类和类脂分子114.64442.269 46未知未知未知未知125.2449.107 34葡萄糖木犀草素[M+H]+黄酮苷类苯丙素类和聚酮类化合物135.44579.170 36异野漆树苷[M+H]+黄酮苷类苯丙素类和聚酮类化合物145.76433.112 36大波斯菊苷[M+H]+黄酮苷类苯丙素类和聚酮类化合物156.44519.112 91Malonylgenistin[M+H]+异黄酮甙类苯丙素类和聚酮类化合物166.98593.185 93刺槐甙[M+H]+黄酮苷类苯丙素类和聚酮类化合物177.58447.12 798豆异黄酮[M+H]+异黄酮甙类苯丙素类和聚酮类化合物188.27533.128 66″-O-malonylglycitin[M+H]+异黄酮甙类苯丙素类和聚酮类化合物198.55271.059 81芹菜素[M+H]+黄酮类苯丙素类和聚酮类化合物209.54373.127 88异橙黄酮[M+H]+O-甲基化类黄酮苯丙素类和聚酮类化合物2110.49373.127 83甜橙黄酮[M+H]+O-甲基化类黄酮苯丙素类和聚酮类化合物2211.29403.138 2川陈皮素[M+H]+O-甲基化类黄酮苯丙素类和聚酮类化合物2311.76433.14877hibiscetin heptamethyl ether[M+H]+O-甲基化类黄酮苯丙素类和聚酮类化合物
续表1
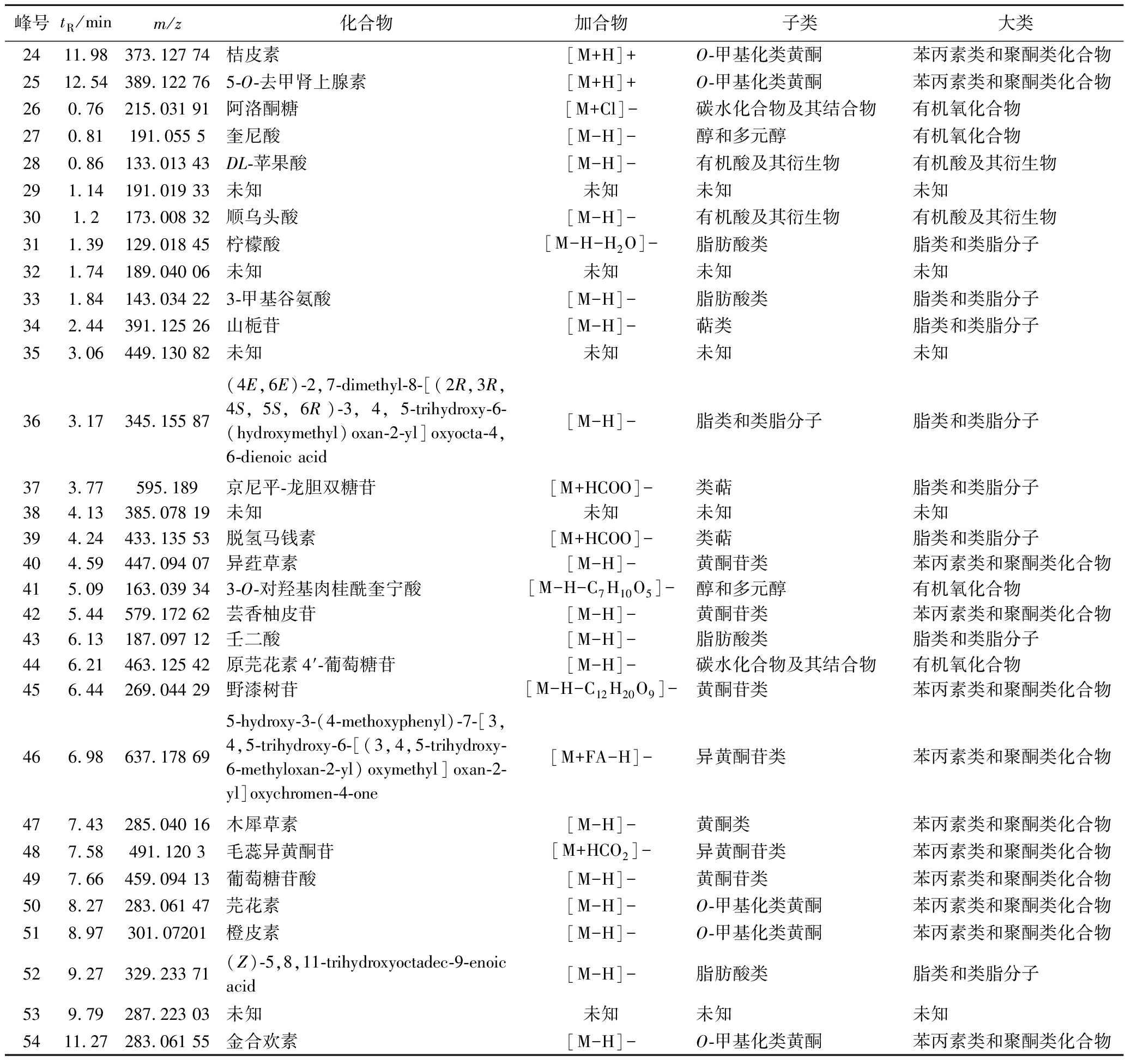
峰号tR/minm/z化合物加合物子类大类2411.98373.127 74桔皮素[M+H]+O-甲基化类黄酮苯丙素类和聚酮类化合物2512.54389.122 765-O-去甲肾上腺素[M+H]+O-甲基化类黄酮苯丙素类和聚酮类化合物260.76215.031 91阿洛酮糖[M+Cl]-碳水化合物及其结合物有机氧化合物270.81191.055 5奎尼酸[M-H]-醇和多元醇有机氧化合物280.86133.013 43DL-苹果酸[M-H]-有机酸及其衍生物有机酸及其衍生物291.14191.019 33未知未知未知未知301.2173.008 32顺乌头酸[M-H]-有机酸及其衍生物有机酸及其衍生物311.39129.018 45柠檬酸[M-H-H2O]-脂肪酸类脂类和类脂分子321.74189.040 06未知未知未知未知331.84143.034 223-甲基谷氨酸[M-H]-脂肪酸类脂类和类脂分子342.44391.125 26山栀苷[M-H]-萜类脂类和类脂分子353.06449.130 82未知未知未知未知363.17345.155 87(4E,6E)-2,7-dimethyl-8-[(2R,3R,4S,5S,6R)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyocta-4,6-dienoic acid[M-H]-脂类和类脂分子脂类和类脂分子373.77595.189京尼平-龙胆双糖苷[M+HCOO]-类萜脂类和类脂分子384.13385.078 19未知未知未知未知394.24433.135 53脱氢马钱素[M+HCOO]-类萜脂类和类脂分子404.59447.094 07异荭草素[M-H]-黄酮苷类苯丙素类和聚酮类化合物415.09163.039 343-O-对羟基肉桂酰奎宁酸[M-H-C7H10O5]-醇和多元醇有机氧化合物425.44579.172 62芸香柚皮苷[M-H]-黄酮苷类苯丙素类和聚酮类化合物436.13187.097 12壬二酸[M-H]-脂肪酸类脂类和类脂分子446.21463.125 42原芫花素4′-葡萄糖苷[M-H]-碳水化合物及其结合物有机氧化合物456.44269.044 29野漆树苷[M-H-C12H20O9]-黄酮苷类苯丙素类和聚酮类化合物466.98637.178 695-hydroxy-3-(4-methoxyphenyl)-7-[3,4,5-trihydroxy-6-[(3,4,5-trihydroxy-6-methyloxan-2-yl)oxymethyl]oxan-2-yl]oxychromen-4-one[M+FA-H]-异黄酮苷类苯丙素类和聚酮类化合物477.43285.040 16木犀草素[M-H]-黄酮类苯丙素类和聚酮类化合物487.58491.120 3毛蕊异黄酮苷[M+HCO2]-异黄酮苷类苯丙素类和聚酮类化合物497.66459.094 13葡萄糖苷酸[M-H]-黄酮苷类苯丙素类和聚酮类化合物508.27283.061 47芫花素[M-H]-O-甲基化类黄酮苯丙素类和聚酮类化合物518.97301.07201橙皮素[M-H]-O-甲基化类黄酮苯丙素类和聚酮类化合物529.27329.233 71(Z)-5,8,11-trihydroxyoctadec-9-enoic acid [M-H]-脂肪酸类脂类和类脂分子539.79287.223 03未知未知未知未知5411.27283.061 55金合欢素[M-H]-O-甲基化类黄酮苯丙素类和聚酮类化合物

a-正离子;b-负离子
图1 竹叶青组方发酵液正离子和负离子模式的总离子流图
Fig.1 Total ion current of positive ion and negative ion modes of Zhuyeqing formula fermentation broth
2.2 竹叶青组方发酵前后差异成分确认
竹叶青的药食同源组方药材中含大量黄酮类、萜类、生物碱、多糖、皂苷等有效成分,均具有较好的抗氧化活性,可调节和增强机体特异性及非特异性免疫功能,抑制自由基的产生。经乳酸菌深度发酵后,中药成分溶出率提高了5.3倍,各类成分种类及含量均发生不同程度的变化。实验结果表明发酵前后样品的各色谱峰的响应强度与保留时间基本重叠,说明发酵前后样品在整体化学成分类别上变异程度较小。高分辨非靶代谢组学主成分分析显示,实验样本组内聚集度高,组间分离明显,说明实验结果可靠,组间有明显差异(图2-a,图2-b)。发酵前后样品在正、负离子模式下的OPLS-DA模型得分如图2-c和图2-d所示,可见OPLS-DA模型能较好地区分2组样本。为了避免有监督模型在建模过程中发生过拟合,采用置换检验对模型进行检验,以保证模型的有效性。图2-e和图2-f分别展示了发酵前后样品在正、负离子模式下OPLS-DA模型的置换检验图,随着置换保留度逐渐降低,随机模型的R2和Q2均逐渐下降,说明原模型不存在过拟合现象,模型稳健性良好。
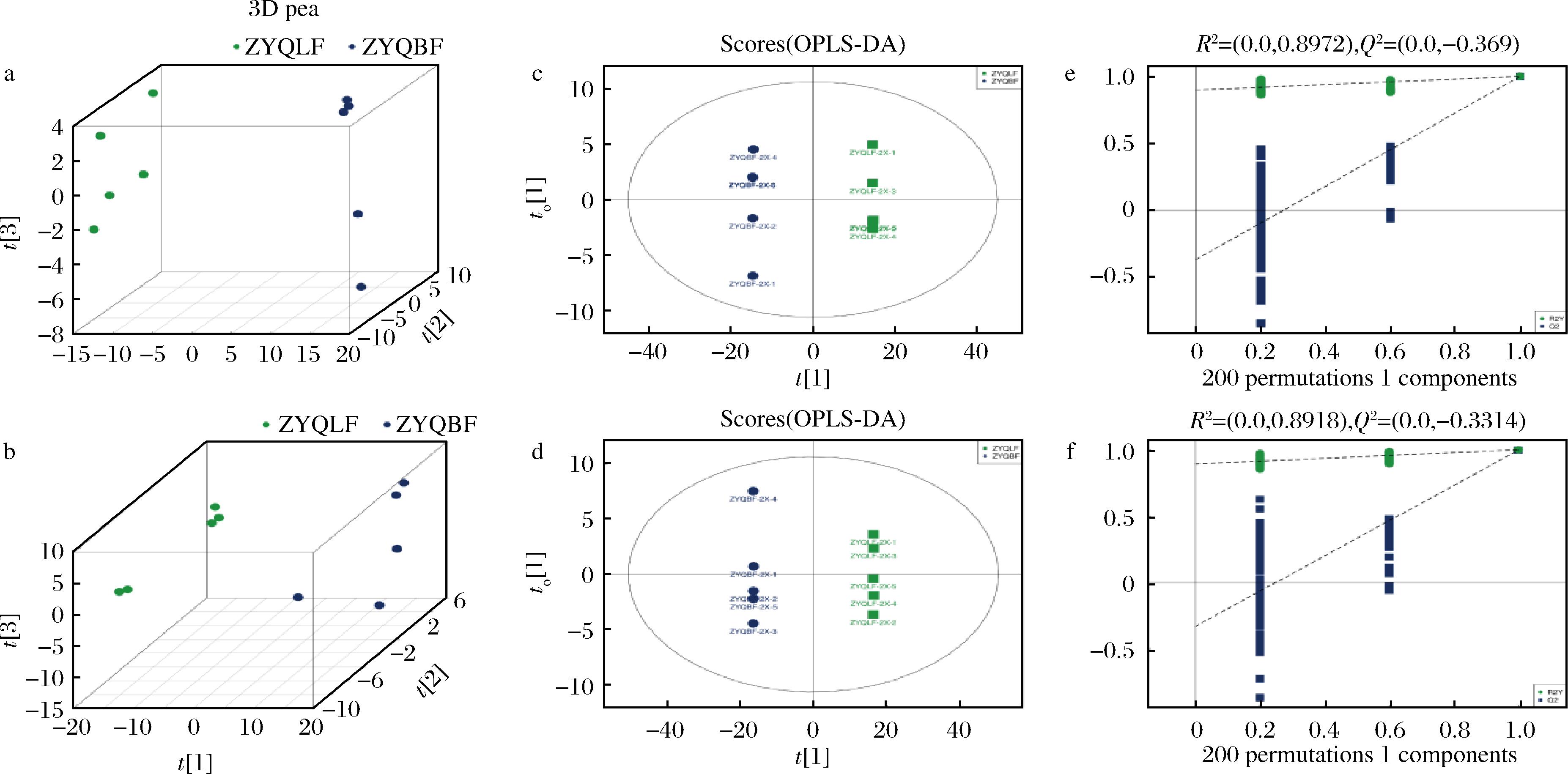
a-正离子模式PCA得分图;b-负离子模式PCA得分图;c-正离子模式OPLS-DA模型图;d-负离子模式OPLS-DA模型图;e-正离子模式OPLS-DA模型置换检验图;f-负离子模式OPLS-DA模型置换检验图
图2 竹叶青组方发酵前后的正、负离子模式多维统计分析
Fig.2 Multidimensional statistical analysis of positive and negative ion modes before and after of Zhuyeqing formula fermentation broth
本研究以OPLS-DA VIP>1且P<0.05为显著性差异代谢物筛选标准,在正离子模式下筛选到50个差异代谢物,有8个成分在发酵后含量上升,有42个成分在发酵后含量下降。包括27个苯丙素类和聚酮类化合物(其中21个是黄酮类化合物,4个异黄酮类化合物),4个有机杂环化合物,3个脂类和类脂分子,3个核苷酸及其衍生物,3个有机酸及其衍生物,2个有机氮化合物,以及2个有机氧化合物(图3-a)。在负离子模式下筛选到41个差异代谢物(图3-b),有9个成分在发酵后含量上升,有32个成分在发酵后含量下降。包括16个苯丙素类和聚酮类化合物(其中11个是黄酮类化合物,2个是异黄酮类化合物),13个有机氧化合物,7个有机酸及其衍生物,4个脂类和类脂分子,以及1个核苷酸及其衍生物。
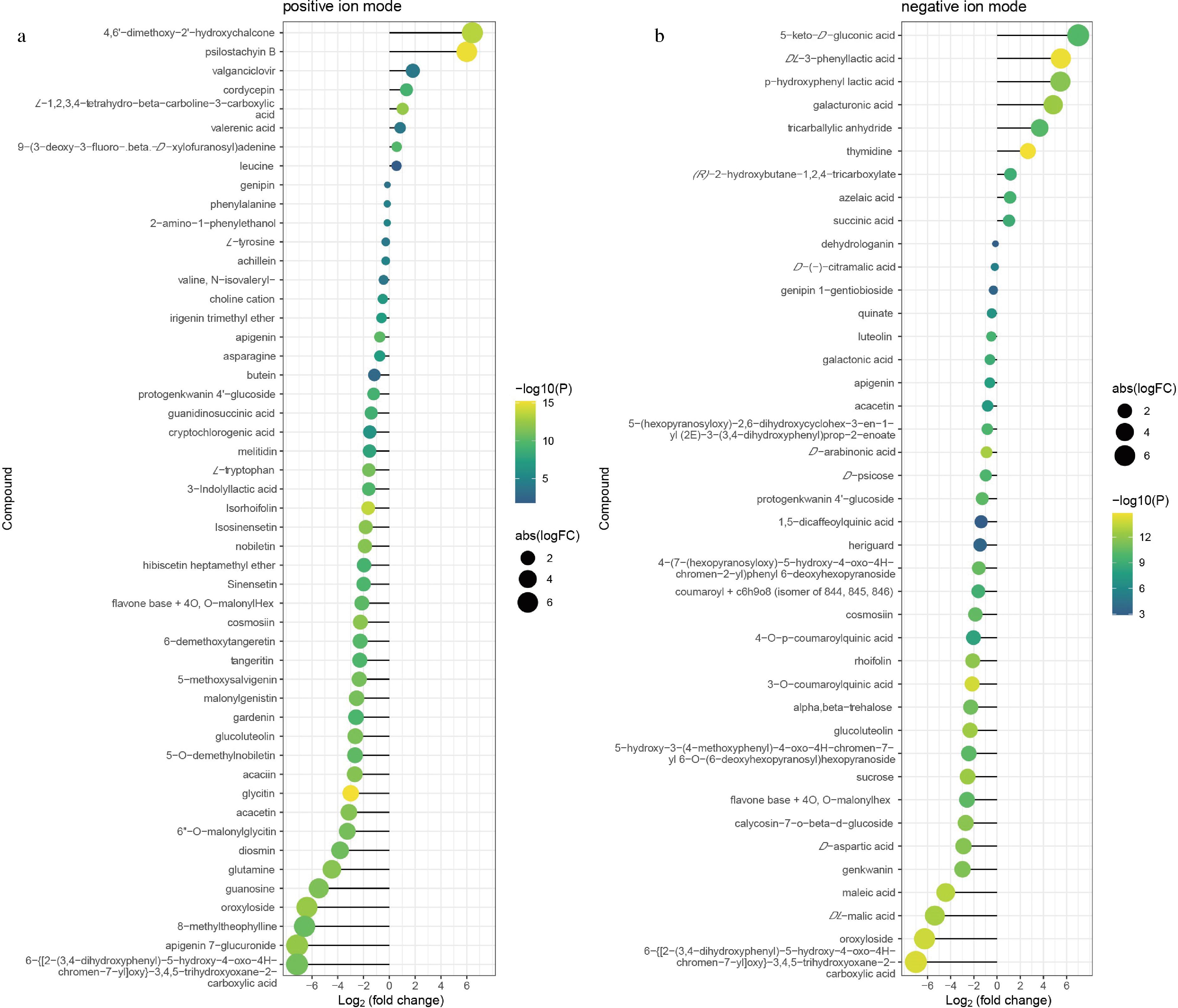
a-正离子模式差异分析气泡图;b-负离子模式差异分析气泡图
图3 竹叶青组方发酵前后正离子和负离子模式的代表性化合物差异分析气泡图
Fig.3 Bubble diagram of the difference analysis of representative compounds in positive and negative ion modes before and after of Zhuyeqing formula fermentation broth
注:图中横坐标表示差异代谢物的log2 FC值,即差异代谢物的差异倍数以2为底取对数的值,纵坐标表示显著性差异代谢物。圆圈越大表示FC越大;右侧颜色梯度表示P值大小,P<0.05,颜色越深P值越小。
2.3 发酵前后差异成分丰度变化
以OPLS-DA VIP>1且P<0.05为显著性差异代谢物筛选标准,在正离子模式下,竹叶青组方发酵后代表性上调化合物如图4-a所示,分别为:4,6′-二甲氧基-2′-羟基查尔酮(4,6′-dimethoxy-2′-hydroxychalcone),松叶水苏烯B(psilostachyin B),缬更昔洛韦(valganciclovir),虫草素(cordycepin),L-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid;发酵后代表性下调化合物如图4-b所示,分别为:6-{[2-(3,4-dihydroxyphenyl)-5-hydroxy-4-oxo-4H-chromen-7-yl]oxy}-3,4,5-trihydroxyoxane-2-carboxylic acid,芹菜素7-葡糖苷酸(apigenin 7-glucuronide),8-甲基茶碱(8-methyltheophylline),千层纸苷(oroxyloside),鸟嘌呤(guanosine),外源类多效唑(paclobutrazol)。
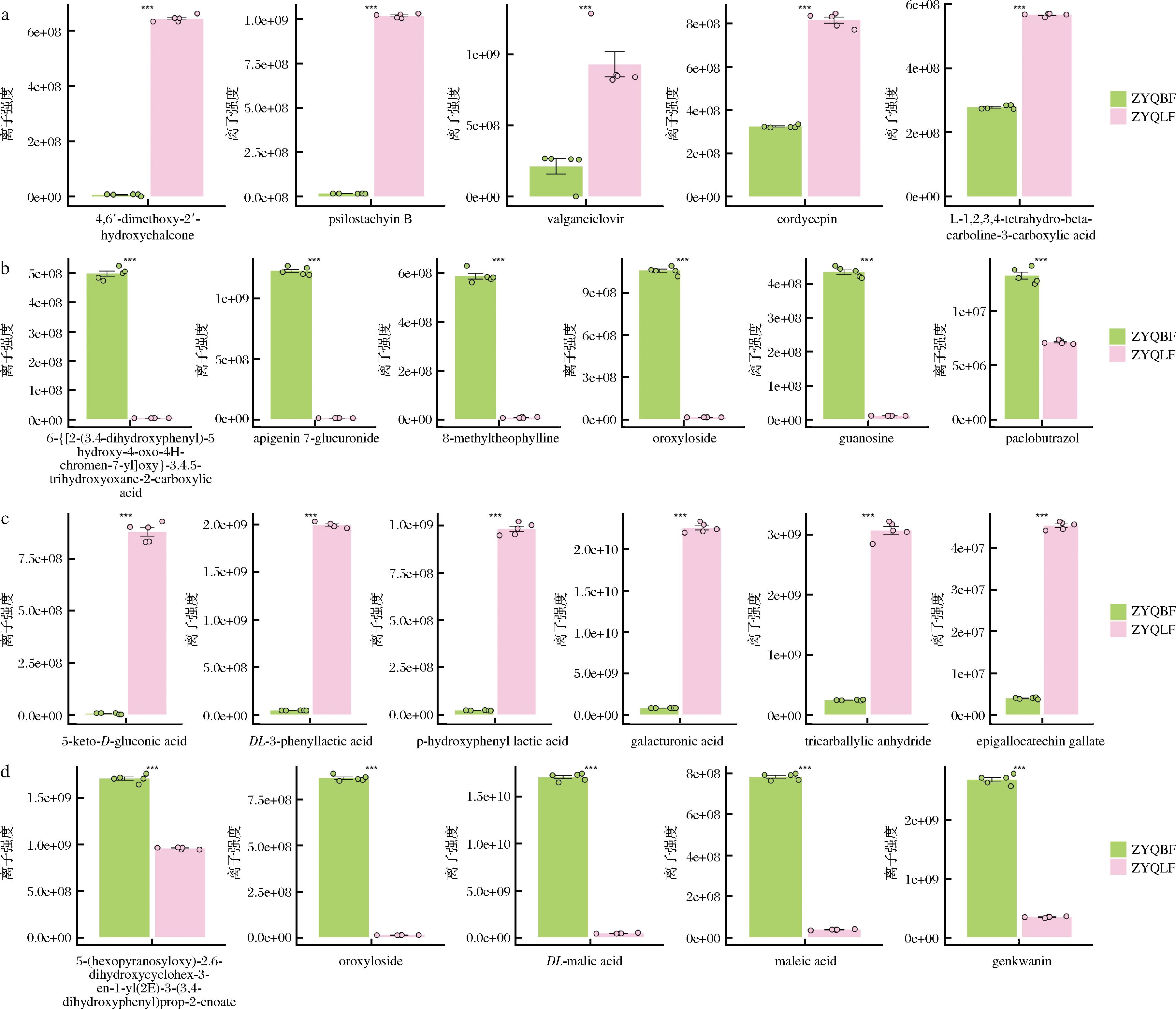
a-正离子模式代表性上调化合物柱状图;b-正离子模式代表性下调化合物柱状图;c-负离子模式代表性上调化合物柱状图;d-负离子模式代表性下调化合物柱状图
图4 竹叶青组方发酵后正、负离子模式代表性上调化合物和下调化合物
Fig.4 Representative up-regulated and down-regulated compounds in positive and negative ion modes of Zhuyeqing formula fermentation broth
注:ZYQBF表示竹叶青组方发酵前;ZYQLF表示竹叶青组方发酵后;与发酵前比较,***表示P<0.001(下同)。
在负离子模式下,竹叶青组方发酵后代表性上调化合物如图4-c所示,分别为:5-酮-D-葡萄糖酸(5-keto-D-gluconic acid),DL-3-苯乳酸(DL-3-phenyllactic acid),对羟基苯乳酸(P-hydroxyphenyl lactic acid),半乳糖酸(galacturonic acid),tricarballylic anhydride,表没食子儿茶素(epigallocatechin gallate);发酵后代表性下调化合物如图4-d所示,分别为:5-(hexopyranosyloxy)-2,6-dihydroxycyclohex-3-en-1-yl,(2E)-3-(3,4-dihydroxyphenyl)prop-2-enoate,葡萄糖苷酸(oroxyloside),DL-苹果酸(DL-malic acid),马来酸(maleic acid),芫花素(genkwanin)。
非靶代谢组学分析显示,竹叶青组方发酵液经发酵后新产生70个化学成分(P<0.05),其中43个成分由正离子模式鉴定所得,27个成分由负离子模式鉴定所得(图5)。正离子模式新增代表性成分如图5-b所示,分别为:14,17,20-trihydroxy-1-oxowitha-2,5,24-trienolide,trans-3,5-dimethoxy-4-hydroxycinnamaldehyde,5-aminohexylamine,3-(1-hydroxyethyl)-2,3,6,7,8,8a-hexahydropyrrolo[1,2-a]pyrazine-1,4-dione,8-hydroxy-3-(4-ketopentyl)isochroman-1-one;负离子模式新增代表性成分如图5-d所示,分别为:大豆甙元(daidzein),胆碱阳离子(cyanin cation),(3E)-4-(1-hydroxy-2,6,6-trimethyl-4-oxocyclohex-2-en-1-yl)but-3-en-2-yl 2-O-hexopyranosylhexopyranoside,吡咯-2-羧酸(pyrrole-2-carboxylic acid),龙胆酸(gentisic acid)、黄豆黄素苷(glycitin)。

a-正离子模式新增化合物热图;b-正离子模式代表性新增化合物柱状图;c-负离子模式代新增化合物热图;d-负离子模式代表性新增化合物柱状图
图5 竹叶青组方发酵后正、负离子模式新增化合物热图和代表性化合物;
Fig.5 Heatmaps of new compounds and representative compounds in positive and negative ion modes after fermentation of Zhuyeqing formula
非靶代谢组学差异性分析显示,经乳酸发酵以黄酮类成分的变化最为显著,发酵将大分子糖苷类物质转化为易吸收的小分子苷元,如黄酮苷在发酵过程中微生物产酶的作用下发生水解反应,使大豆苷水解为相应的苷元——大豆苷元更利于有效成分在体内发生广泛的代谢和转化[17];发酵后新物质黄豆黄素苷具有防止心脑血管疾病、抗衰老和防止酒精中毒作用[18];发酵后有机酸类、氨基酸肽类会显著增加,参与乳酸发酵过程相关的有机酸类特征物质如苹果酸、柠檬酸与马来酸酸等会显著下降,而苯乳酸、对羟基苯乳酸与壬二酸等会显著增加,同时可有效改善发酵液风味,氨基酸肽类如白氨酸、L-亮氨酸、阿魏酸等作为良好的膳食添加剂对人体有较高生物活性[19];其他活性物质如表没食子儿茶素没食子酸酯、虫草素及萜类内酯松叶水苏烯B等在提高人体免疫功力、延缓衰老、抗疲劳等方面广受消费者接受[19-20];新型甜味剂新橙皮苷二氢查耳酮等也有显著提升[22];这些生物源素小分子可直接作用于人体,具有强大的免疫激活力,同时极大地改善了药材口感,饮用体验更好。
2.4 竹叶青组方发酵后关键成分网络药理学分析
选取竹叶青组方发酵后显著增加的5个代表性成分松叶水苏烯B、胸腺嘧啶核苷、苯乳酸、4,6′-二甲氧基-2′-羟基查尔酮和半乳糖酸,以及发酵后新增的5个代表性成分大豆甙元、14,17,20-trihydroxy-1-oxowitha-2,5,24-trienolide、胆碱阳离子、(3E)-4-(1-hydroxy-2,6,6-trimethyl-4-oxocyclohex-2-en-1-yl)but-3-en-2-yl 2-O-hexopyranosylhexopyranoside和trans-3,5-dimethoxy-4-hydroxycinnamaldehyde进行网络药理学研究。化合物-靶点网络如图6所示,竹叶青组方发酵液发酵后含量显著提升的8个化学成分(2个化合物未预测到作用靶点)作用于217个靶点节点。对这些化学成分的靶点进行GO富集与KEGG通路分析富集,取排名前五的条目进行结果显示,竹叶青组方发酵液的靶点显著富集在神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、TRP通道的炎症介质调节(inflammatory mediator regulation of TRP channels)、钙信号通路(calcium signaling pathway)等信号通路上,通过调控以上潜在的信号通路,进一步影响循环系统血管功能(vas-cular process in circulatory system)、MAP激酶活性(regulation of MAP kinase activity)、细胞钙离子稳态(cellular calcium ion homeostasis)等生物学过程以及膜筏(membrane raft)、膜微区(membrane microdomain)、膜(membrane region)等细胞组分,从而发挥神经递质受体活性(neurotransmitter receptor activity)、G蛋白偶联受体活性(G protein-coupled amine receptor activity)、内肽酶活性(endopeptidase activity)等分子功能(图7)。其中靶点预测最多的化合物是松叶水苏烯B,表明这个化合物潜在调节作用较大。
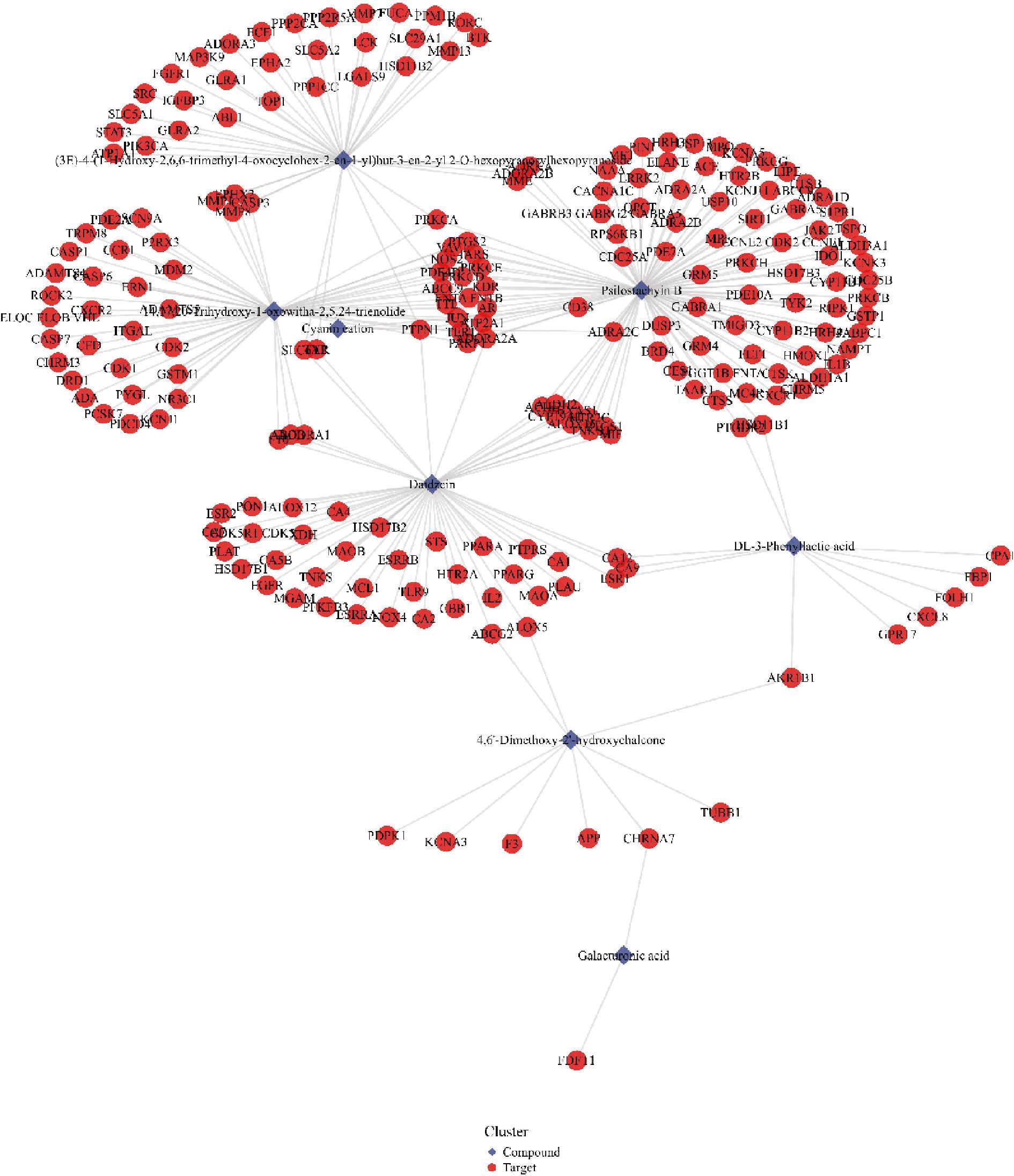
图6 竹叶青组方发酵液关键成分的化合物-靶点网络图
Fig.6 Compound target network diagram of key components in the fermentation broth of Zhuyeqing formula fermentation broth
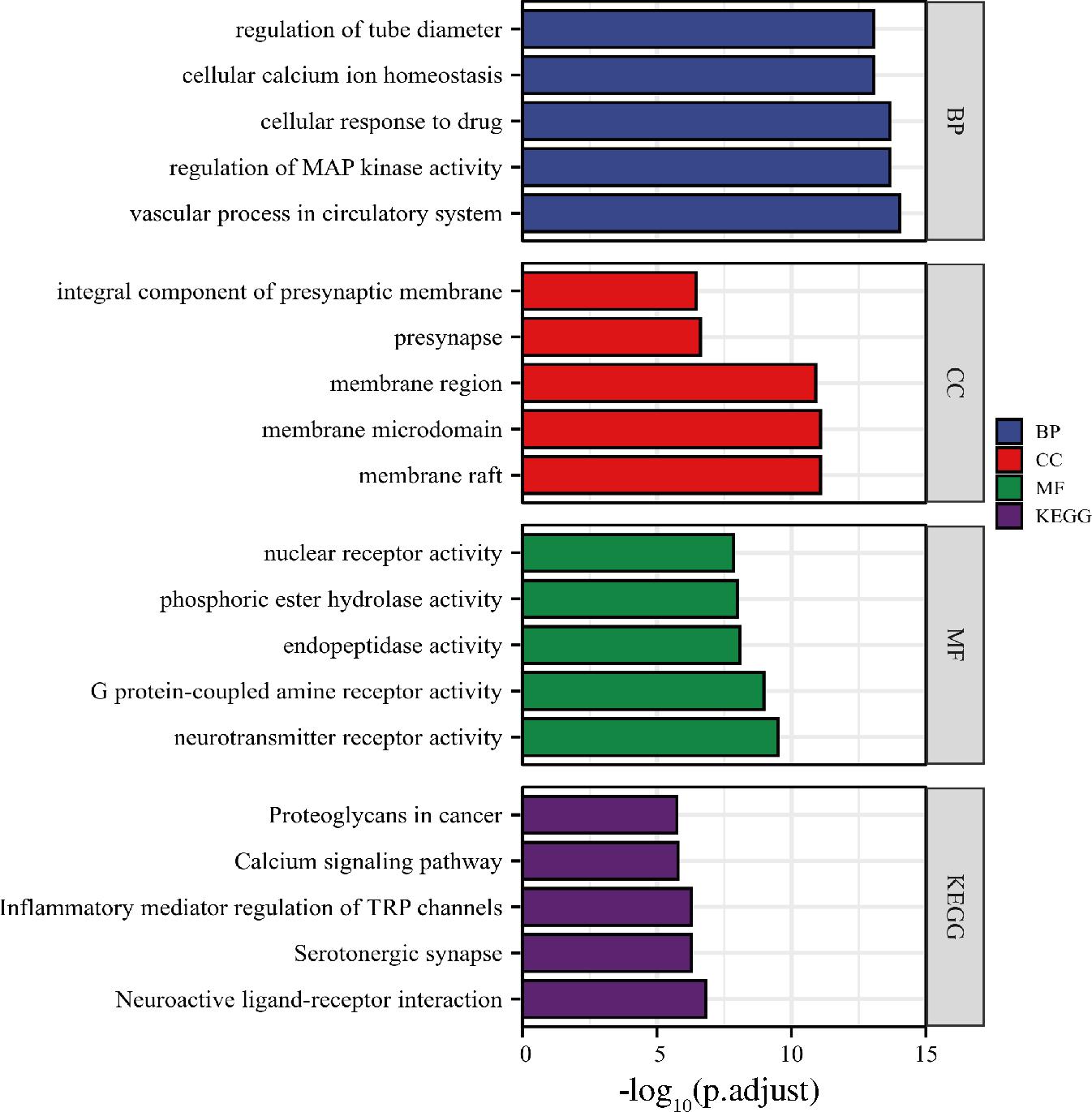
图7 竹叶青组方发酵液关键靶点功能富集分析图
Fig.7 Functional enrichment analysis of key targets in the fermentation broth of Zhuyeqing formula fermentation broth
网络药理学分析体现了中药多成分、多靶点、多途径的作用特点。研究首次发现了竹叶青药食同源组方可能在调节神经递质受体活性的作用,对于抒解抑郁人群有一定正向调理作用。
3 结论
本研究采用UPLC-HRMS高分辨液质联用技术,对竹叶青组方经乳酸发酵后样本的主要化学成分进行了鉴定,获得46个主要化学成分,表明了其成分多样性的特点。通过高分辨非靶代谢组学技术比较了竹叶青组方发酵液发酵前后的化学成分,各类成分种类及含量均发生不同程度的变化,获得91个在发酵前后显著变化的差异成分,其中以黄酮类成分的变化最为显著。进一步从提高活性成分含量、经过生物转化产生新的活性物质、减轻药物毒性、风味提升等方面进行成分分类评价。研究初步阐明竹叶青组方发酵液的化学成分与药理作用,为其进一步开发利用提供了科学依据,并为现代中药微生物发酵研究提供了参考和借鉴。
[1] 胥敏,吴纯洁,严丹,等.中药发酵技术传承与创新的探索[J].中国实验方剂学杂志,2015,21(23):230-234.
XU M,WU C J,YAN D,et al.Exploration for inheritance and innovation of fermentation technology of traditional Chinese medicine[J].Chinese Journal of Experimental Traditional Medical Formulae,2015,21(23):230-234.
[2] 孟凡涛,刘冬菊.研究中药发酵炮制法[J].世界最新医学信息文摘,2018,18(10):8-9.
MENG F T,LIU D J.To study the method of fermentation of Chinese medicine[J].World Latest Medicine Information,2018,18(10):8-9.
[3] 江青东,聂芙蓉.中药发酵的特点及研究现状[J].现代牧业,2021,5(4):47-50;56.
JIANG Q D,NIE F R.Chinese medicine fermentation characteristics and latest research current status[J].Modern Animal Husbandry,2021,5(4):47-50;56.
[4] 艾素,汤伟,郭若琳,等.微生物发酵中草药及其活性物质的研究进展[J].中国中药杂志,2019,44(6):1110-1118.
AI S,TANG W,GUO R L,et al.Research progress on Chinese herbal medicine fermentation and profile of active substances derived[J].China Journal of Chinese Materia Medica,2019,44(6):1110-1118.
[5] 陈旸,王义,孙亮,等.植物乳杆菌发酵转化人参皂苷的研究[J].中国中药杂志,2014,39(8):1435-1440.
CHEN Y,WANG Y,SUN L,et al.Fermentation transformed ginsenoside by Lactobacillus plantarum[J].China Journal of Chinese Materia Medica,2014,39(8):1435-1440.
[6] 蒋洪亮,麻浩,何丽芳,等.发酵虫草菌粉多糖成分的理化性质及其对ConA抑制L-O2细胞增殖活性的影响[J].中国现代中药,2018,20(6):680-683.
JIANG H L,MA H,HE L F,et al.Physicochemical properties of homogeneous polysaccharide extracted from fermented Cordyceps powder and It′s antagonism of inhibition effect on cell proliferation activity of L-O2[J].Modern Chinese Medicine,2018,20(6):680-683.
[7] 苏贵龙.益生菌FGM发酵对黄芪根、茎、叶主要活性成分含量的影响研究[D].北京:中国农业科学院,2017.
SU G L.The effect of fermentation with FGM strain on the main active ingredients in Astragalus root,stem and leaf[D].Beijing:Chinese Academy of Agricultural Sciences,2017.
[8] 肖日传,王德勤,张传平.中药发酵研究现状及展望[J].广东药科大学学报,2020,36(6):897-902.
XIAO R C,WANG D Q,ZHANG C P.Research status and prospect on fermentation of traditional Chinese medicine[J].Journal of Guangdong Pharmaceutical University,2020,36(6):897-902.
[9] 梅晓丹,李洁,王喻淇,等.黄精覆盆子发酵饮品化学成分的UPLC-HRMS分析[J].中国现代中药,2020,22(4):615-621.
MEI X D,LI J,WANG Y Q,et al.Identification of compounds in polygonati rhizoma and rubi fructus fermentation drinks by UPLC-HRMS[J].Modern Chinese Medicine,2020,22(4):615-621.
[10] 梅晓丹,王喻淇,刘子菡,等.发酵前后生姜中姜辣素类成分的UHPLC-HRMS鉴定分析[J].中华中医药杂志,2020,35(4):1990-1995.
MEI X D,WANG Y Q,LIU Z H,et al.Identification and analysis of gingerols in ginger before and after fermentation by UHPLC-HRMS[J].China Journal of Traditional Chinese Medicine and Pharmacy,2020,35(4):1 990-1 995.
[11] 王喻淇,梅晓丹,李洁,等.玫瑰花 玫瑰茄 枸杞子复合发酵液化学成分的HPLC-HRMS分析[J].中国现代中药,2020,22(3):363-371.
WANG Y Q,MEI X D,LI J,et al.Study on chemical constituents of Rosa rugosa Thunb.,Hibiscus sabdariffa L.and Lycium barbarum L.before and after fermentation[J].Modern Chinese Medicine,2020,22(3):363-371.
[12] 张妍,赵昕琪,王天琪,等.非靶向代谢组技术研究饮料发酵前后物质变化[J].食品与发酵工业,2021,47(22):115-120.
ZHANG Y,ZHAO X Q,WANG T Q,et al.Component changes in corn beverage before and after fermentation analyzed by non-targeted metabolomics technique[J].Food and Fermentation Industries,2021,47(22):115-120.
[13] 高红英.竹叶青酒母液的功效成分研究[D].沈阳:沈阳药科大学,2014.
GAO H Y.Study on the active constituents from Zhuyeqing mother liquor[D].Shenyang:Shenyang Pharmaceutical University,2014.
[14] 曹瑞红,雷振河.论竹叶青酒与医疗保健的渊源关系[J].酿酒科技,2018(1):104-112.
CAO R H,LEI Z H.Relations between Zhuyeqing liquor and health care[J].Liquor-Making Science &Technology,2018(1):104-112.
[15] DAINA A,MICHIELIN O,ZOETE V.SwissTargetPrediction:Updated data and new features for efficient prediction of protein targets of small molecules[J].Nucleic Acids Research,2019,47(W1):W357-W364.
[16] YU G C,WANG L G,HAN Y Y,et al.clusterProfiler:An R package for comparing biological themes among gene clusters[J].Omics:A Journal of Integrative Biology,2012,16(5):284-287.
[17] 白永亮,段金廒,宿树兰,等.桑叶干燥过程中黄酮类和生物碱类成分动态变化分析[J].中药材,2014,37(7):1158-1163.
BAI Y L,DUAN J A,SU S L,et al.Analysis of dynamic changes of flavonoids and alkaloids during different drying process of Morus alba leaves[J].Journal of Chinese Medicinal Materials,2014,37(7):1158-1163.
[18] UESUGI T,TODA T,TSUJI K,et al.Comparative study on reduction of bone loss and lipid metabolism abnormality in ovariectomized rats by soy isoflavones,daidzin,genistin,and glycitin[J].Biological &Pharmaceutical Bulletin,2001,24(4):368-372.
[19] 胡益勇,徐晓玉.阿魏酸的化学和药理研究进展[J].中成药,2006,28(2):253-255.
HU Y Y,XU X Y.Research progress in chemistry and pharmacology of ferulic acid[J].Chinese Traditional Patent Medicine,2006,28(2):253-255.
[20] 仉燕崃,李楠,韩国柱,等.表没食子儿茶素没食子酸酯的研究进展[J].中草药,2006,37(2):303-306.
ZHANG Y L,LI N,HAN G Z,et al.Advance of researches on epigallocatechin gallate[J].Chinese Traditional and Herbal Drugs,2006,37(2):303-306.
[21] 杨杰,陈顺志.虫草素研究进展[J].中国生化药物杂志,2008,29(6):414-417.
YANG J,CHEN S Z.Progress in the study on Cordycepin[J].Chinese Journal of Biochemical Pharmaceutics,2008,29(6):414-417.
[22] 雷琳,黄宝华,卢宇靖,等.新橙皮苷二氢查耳酮的调味应用及其生理活性研究进展[J].中国调味品,2014,39(12):41-47.
LEI L,HUANG B H,LU Y J,et al.Research progress of flavor modifying and physiological activity of neohesperidin dihydrochalcone[J].China Condiment,2014,39(12):41-47.