微生物污染是食品加工业面临的一个持续挑战[1]。部分致病性细菌常见于食品加工表面及内部,导致食品基料受微生物污染的风险增加[2],进而引起交叉污染以及食品感官特征的变化[3]。生物被膜是黏附在生物或非生物表面的微生物聚集体[4],由多糖,蛋白质和由封闭微生物分泌的细胞外DNA(eDNA,Environment DNA)组成[5],并对抗菌剂(消毒剂)呈现一定抗性[3]。成熟生物被膜中的细菌细胞可以不断分散并附着在另一个表面上,导致细菌污染物的传播以及微生物存活的可能性[6],并增强随后的食品交叉污染。
酶试剂最近因其对生物被膜细胞外聚合物(extracellular polymeric substance,EPS)基质的降解作用而受到越来越多的关注。酶可以通过破坏生物被膜基质的完整性导致细胞从生物被膜中释放来潜在地靶向和松弛生物被膜EPS基质[7]。根据生物被膜基质的主要组成,可以使用不同的酶,包括碳水化合物酶、脂肪酶、核酸酶和蛋白酶[6]。DNase I和蛋白酶K处理可减少蜡样芽孢杆菌和单核细胞增生李斯特菌的生物被膜[8-9],CRAIGEN等[10]证明了α-淀粉酶处理对金黄色葡萄球菌生物被膜的抑制和去除作用。
然而,由于EPS的复杂结构,单独酶处理可能无法完全清除生物被膜[11]。因此,建议使用酶混合物和其他补充方法,例如氯处理。次氯酸钠具有良好的广谱杀菌活性,能够穿透细菌的细胞膜进入细胞内部,从而使细菌缺乏生存必需的酶而失去活性[12]。尽管以前的研究已经证明了单一使用酶或者消毒剂对生物被膜清除功效,但使用二者相结合对细菌生物被膜的清除研究仍然较少[10]。
本研究旨在探究含氯消毒剂与酶联合对几种常见致病菌生物被膜的杀灭作用,通过微孔板分光光度计进行不同细菌生物被膜能力的筛选,平板计数法和流式细胞仪比较2种处理方式对生物被膜的清除效果,以期获得不同处理方式对生物被膜清除的差异性。
1 材料与方法
1.1 菌种与材料
本实验所使用的菌株Bacillus pumilus CICC 10900来自于中国工业微生物菌种保藏管理中心;Staphylococcus aureus ATCC 6538、Bacillus subtilis ATCC 9372、Staphylococcus aureus ATCC 8095、Salmonella.typhimurium ATCC 14028、Listeria monocytogenes ATCC 27708、Listeria monocytogenes ATCC 13932来自美国典型菌种保藏中心;Bacillus cereus CMCC 63303、Salmonella enteritidis CMCC 50035来自于中国医学细菌菌种保藏管理中心。所有受试菌株在实验之前被贮存在30%的甘油中,温度为-80 ℃。实验使用304级不锈钢试样(面积2 cm2,厚1 mm)。
胰蛋白胨大豆琼脂培养基(tryptonesoyagar,TSA),胰蛋白胨大豆肉汤培养基(trypticasesoy broth,TSB),Baird-Parker琼脂、亚碲酸钾卵黄增菌液,陆桥科技有限公司;肉膏蛋白胨肉汤(luriaber tani,LB),陆桥科技有限公司;酵母浸粉(yeastextract,YE),上海生工生物工程股份有限公司;PBS、Armadillo 96-WellPCR Plates,赛默飞世尔科技有限公司;70%异丙醇,天津渤化化学试剂有限公司;表面清洁剂(JYM-302),惠州市佳一美金属表面处理材料有限公司;α-amylase、proteinase K,上海Sigma-Aldrich;DNase I,南京诺唯赞生物科技股份有限公司。
1.2 仪器与设备
5430R型冷冻离心机,德国Eppendorf有限公司;BPMJ-150F型恒温恒湿培养箱,上海一恒科学仪器有限公司;SX-500型高压蒸汽灭菌锅,日本Tomy有限公司;DHG-9240AS层流柜,嘉兴市中新医疗仪器有限公司;BioTeK/epoc微孔板分光光度计、NovoCyte2060R流式细胞仪,安捷伦科技有限公司。
1.3 实验方法
1.3.1 不同细菌菌株生物被膜形成能力
参考KIM等[13]通过结晶紫染色测定法测定细菌菌株的生物被膜形成能力,并在此基础上进行了轻微的修改。简而言之,每种细菌悬浮液10 μL(初始浓度106 CFU/mL),加入至聚苯乙烯96孔微量滴定板中的3个孔中。每个孔补充200 μL TSB+YE或LB+YE(分别对应枯草芽孢杆菌CICC 10900、金黄色葡萄球菌ATCC 6538)培养液,另外3个仅含有培养液(非接种培养基)的孔用作每个微量滴定板的阴性对照。37 ℃孵育24 h,弃去液体部分,并用250 μL PBS轻轻冲洗每个孔,并在层流柜中风干20 min。将每个孔用200 μL 0.25%(体积分数)结晶紫溶液处理30 min,250 μL PBS轻轻洗涤3次以除去未吸收的结晶紫。洗涤后,将每个孔中剩余的结晶紫溶解在200 μL 95%乙醇中,然后在室温下孵育10 min。取每个孔中的100 μL试样转移到新的96孔微量滴定板中,并使用微孔板分光光度计在595 nm处测量吸光度。
1.3.2 不同酶对生物被膜形成以及成熟生物被膜的影响
测试所选酶(α-amylase、proteinase K、DNase I)对生物被膜形成的抑制作用(作为预酶处理),200 μL混合液(10 μL浓度为106CFU/mL细菌悬浮液+190 μL TSB+YE或LB+YE培养液)将和2种受试菌株中的每一种被添加到96微孔板中,不含酶处理溶液的组作为阴性对照,37 ℃孵育48 h,孵育后,如1.3.1节所述进行结晶紫染色测定。最终使用的酶浓度如下:0.1%(体积分数) DNaseⅠ,1%(体积分数) proteinase K和20 mg/mL α-amylase。处理后,用移液器除去含有酶的培养基,用250 μL PBS洗涤1次,准备进行定量或进一步处理[14]。评估酶对成熟生物被膜的清除效果(作为酶后处理),在37 ℃孵育48 h后,用200 μL新鲜培养液替换细菌悬浮液。加入每种酶,然后在37 ℃下孵育1 h。孵育后,如1.3.1节所述进行结晶紫染色测定及计算吸光度值。
1.3.3 蛋白酶与次氯酸钠联合对不锈钢上细菌生物被膜的清除
1.3.3.1 菌悬液的制备及试样预处理
将供试的枯草芽孢杆菌CICC 10900、金黄色葡萄球菌ATCC 6538分别于TSA+YE、BP培养基划线37 ℃培养48 h,挑取单菌落分别置于TSB+YE、LB+YE(10 mL)液体培养基中,经37 ℃、12 h振荡培养至指数后期,4 ℃,7 000 r/min离心5 min,PBS清洗3次,悬浮于等体积0.85% NaCl溶液中,梯度稀释制得106 CFU/mL菌悬液,4 ℃存放。
1.3.3.2 生物被膜制备
不锈钢试样预处理:表面清洁剂和异丙醇(70%)分别浸泡30 min并用清水充分洗涤,干燥后置于高压蒸汽灭菌锅121 ℃,15 min。生物被膜制备的方法按照MAZAHERI等[15]和RIPOLLES-AVILA等[16]的方法并做了修改,将50 μL菌株的悬浮液无菌接种于不锈钢试样的表面,将接种过菌液的不锈钢片放置在无菌培养皿中,加入3 mL TSB+YE或LB+YE、37 ℃孵育72 h,每隔36 h弃去原先的液体培养基,并用3 mL无菌水轻轻洗涤不锈钢试样,以清除松散或未附着的细胞,并补充3 mL TSB+YE或LB+YE至表面,再次将试样放置在湿度室中以完成孵育期。
1.3.3.3 生物被膜分离
用3 mL无菌蒸馏水冲洗接种的样品表面2次,以去除任何未附着的细胞。将试样放入新的无菌培养器皿中,其中处理溶液(酶、4.5% NaClO及联合处理)覆盖表面,施用15 min[16]。用3 mL无菌蒸馏水一式两份洗涤表面,目的是消除未附着的细胞,处理后,立即将不锈钢试样沉积在含有30 g无菌玻璃珠的50 mL Dey-Engley中和肉汤中,并用台式涡旋混合器以最大速度搅拌1 min。对照组:用3 mL无菌蒸馏水洗涤不锈钢表面2次,并直接置于无菌烧瓶中,用玻璃珠和10 mL中和剂溶液涡旋,无需消毒处理。
1.3.4 生物被膜细菌计数
取处理过的样品混合液1份和9份NaCl制得1∶10稀释液,并吸取100 μL适宜浓度稀释液分别涂布于TSA+YE、BP培养基。一式三份测量每个样品和每个稀释度。
1.3.5 流式细胞术(flow cytometry,FCM)分析
将未经处理和处理过的生物被膜细胞悬浮到0.85% NaCl溶液中,涡旋3~5 s,弃上清液,加入同体积的PBS缓冲液,5 000 r/min、4 ℃、离心5 min,使用PBS缓冲液再次洗涤。染色。对于上步骤的获得的细胞沉淀,加入1 mL CalceinAM/PI检测工作液。37 ℃避光孵育30 min准备两管额外的细胞样品,每管只加入1种染料(CalceinAM或PI),用于流式单染的补偿调节,染色后,将样品置于冰上,1 h内进行FCM分析。
1.4 数据处理与统计分析
测试样本一式三份,应用Microsoft Excel 2019软件数据统计和计算均值,采用One-Way ANOVA比较在P<0.05水平的差异显著性,使用Graphpad Prism 8.5软件(GraphPad软件公司,美国)作图。
2 结果与分析
2.1 不同细菌微生物在聚苯乙烯96微孔板上的生物被膜形成能力
由于细菌菌株间特异性的存在,导致不同细菌形成生物被膜能力有所差异[17]。根据它们的吸光度将生物被膜形成的能力分为4组:高度黏附(OD595>3.0),强烈黏附(3.0>OD595>2.0),中度黏附(2.0>OD595>1.0),弱黏附力(OD595<1.0)[13]。在本研究中,枯草芽孢杆菌CICC 10900、金黄色葡萄球菌ATCC 6538是强黏附性的菌株;蜡样芽孢杆菌CMCC 63303、枯草芽孢杆菌ATCC 9372、金黄色葡萄球菌ATCC 8095、鼠伤寒沙门氏菌ATCC 14028、单增李斯特菌ATCC 27708中度黏附,肠炎沙门氏菌CMCC 50035和单增李斯特菌ATCC 13932是本研究中黏附性最弱的菌株(图1)。选择黏附性较强的枯草芽孢杆菌 CICC 10900、金黄色葡萄球菌ATCC 6538菌株进行下一步的实验,以评估酶对不同菌株生物被膜的清除功效。
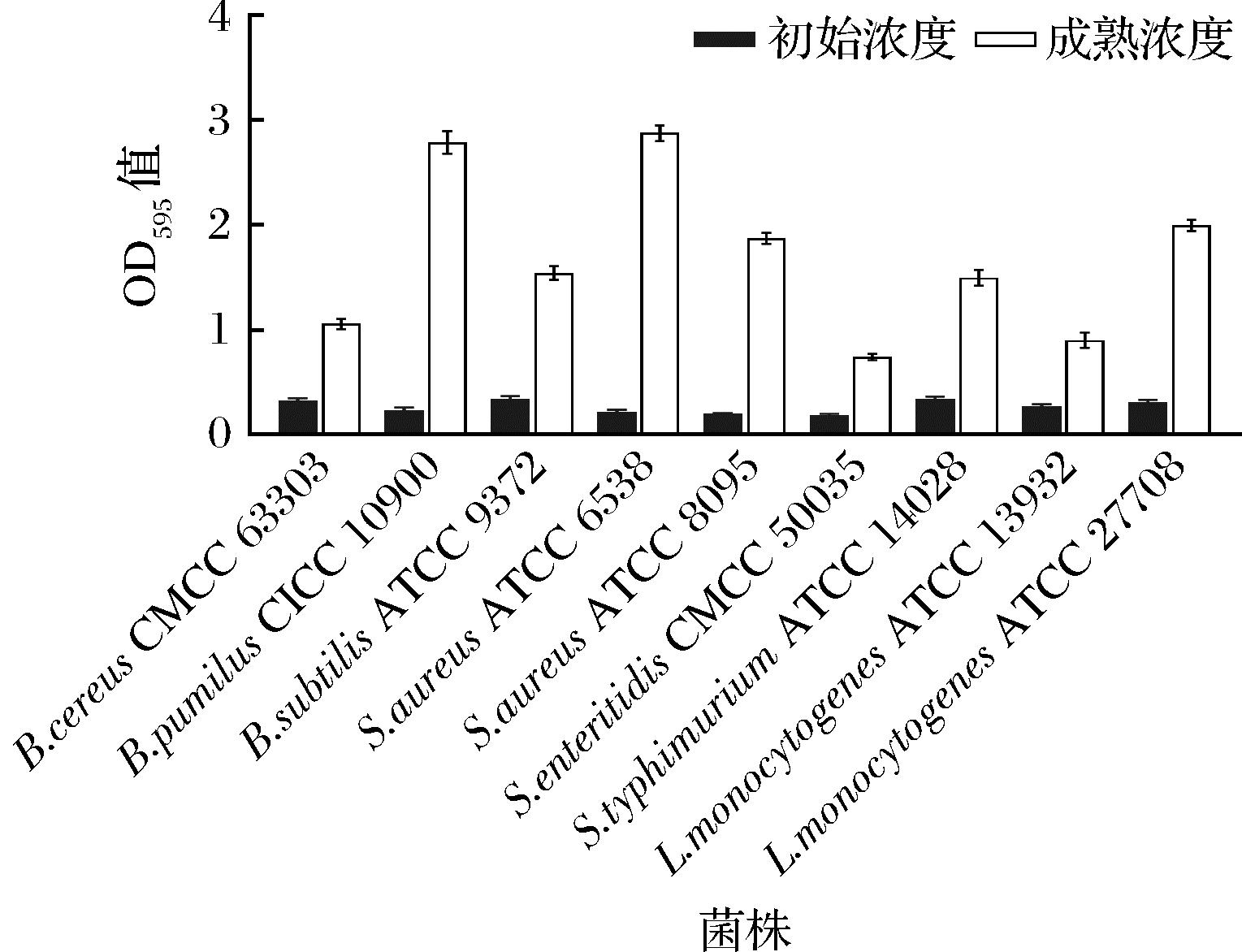
图1 不同菌株在聚苯乙烯96板上的生物被膜形成能力
Fig.1 Biofilm formation ability of different strains of bacteria on polystyrene 96 plates
2.2 作用于细菌生物被膜次氯酸钠使用浓度的确定
图2显示生物被膜的清除效率与NaCIO浓度提升呈正相关,造成枯草芽孢杆菌CICC10900和金黄色葡萄球菌ATCC 6538下降了约0.45 lg CFU/cm2~2.09 lg CFU/cm2和0.39 lg CFU/cm2~2.61 lg CFU/cm2。由于生物被膜与含氯类消毒剂都带有相同的负电荷,使得含氯类分子更容易渗透进生物被膜内部,改变细胞膜的通透性,以及氧化蛋白质或者破坏磷酸脱氢酶,使糖代谢失调,最终导致菌体死亡[18]。次氯酸钠中的次氯酸根会水解生成次氯酸,具有一定的氧化性。程曦[19]采用不同浓度次氯酸钠应用于供水管网时发现余氯浓度越高,铸铁管壁腐蚀越严重;当钢铁受到腐蚀会导致其腐蚀物脱落,其不利影响包括:a)促进生物膜生长;b)在以后的消毒程序中需要更多的氯清除;c)腐蚀物可能会混入物料中[20];张雅君等[21]研究表明在紫外线剂量相同的条件下,碳钢的腐蚀速率会随着次氯酸钠投放量的增加而加大,过高浓度的次氯酸钠会对食品基料以及后期的清理带来负面影响[22]。

图2 不同梯度次氯酸钠对细菌生物被膜的清除能力
Fig.2 Removal ability of NaClO on bacterial biofilm at different concentration degrees
2.3 酶在生物被膜形成过程中以及对成熟生物被膜的抗性研究
结果显示,这些酶能够抑制生物被膜的形成或降解预先形成的生物被膜基质(图3、图4),与对照组相比,proteinase K和α-amylase在应用于生物被膜形成过程中的抑制作用分别是最有效的和最低效的。酶抑制或降解生物被膜基质的能力依赖于物种和菌株类型[13],这体现在分别使吸光度下降了0.575 OD值~1.047 OD值和-0.006 OD值~0.261 OD值。在本研究中,施加α-amylase作用于枯草芽孢杆菌CICC 10900基本没有抑制效果,这一结果和GILAN等[23]相似,部分酶的参与会促进红球菌C208菌株生物被膜的发育,体现在吸光度比没有酶参与时高出2倍,并且导致黏液,多层和稳健性增加;在有蛋白水解酶(胰蛋白酶、糜蛋白酶和蛋白酶K)参与的情况下,两株梭杆菌的生物膜形成能力得到加强[13]。这些结果的原因涉及到酶对介导细胞外DNA分泌的蛋白酶的积极调节,部分酶可以通过调节活跃的细胞自溶和DNA释放来促进生物被膜的形成[10]。
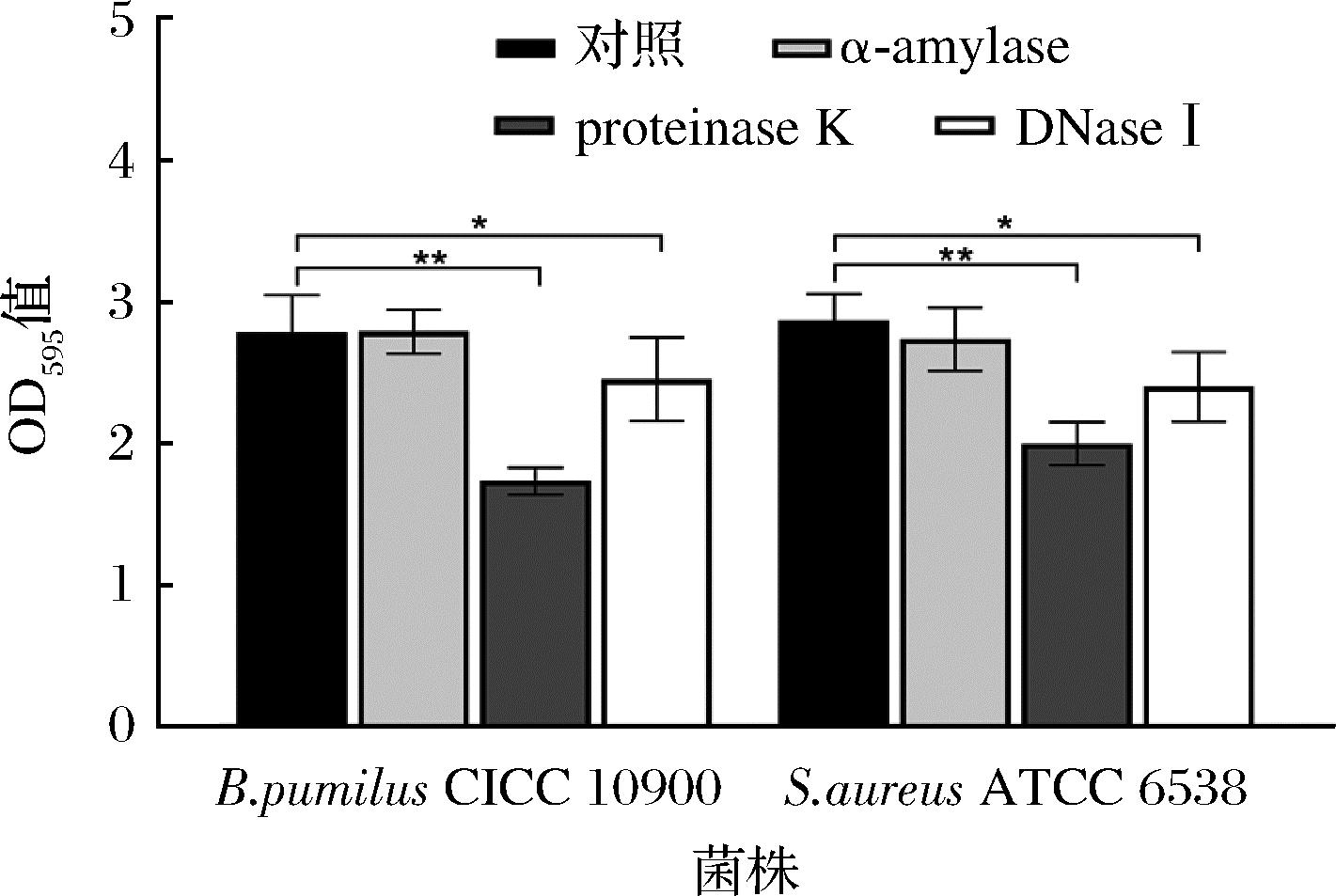
图3 聚苯乙烯96孔板上生物被膜形成过程中预酶处理
Fig.3 Pre-enzyme treatment during biofilm formation on polystyrene 96-well plates
注:误差棒代表标准偏差(n=3);*表示P<0.05,**表示P<0.01,***表示P<0.001(下同)。
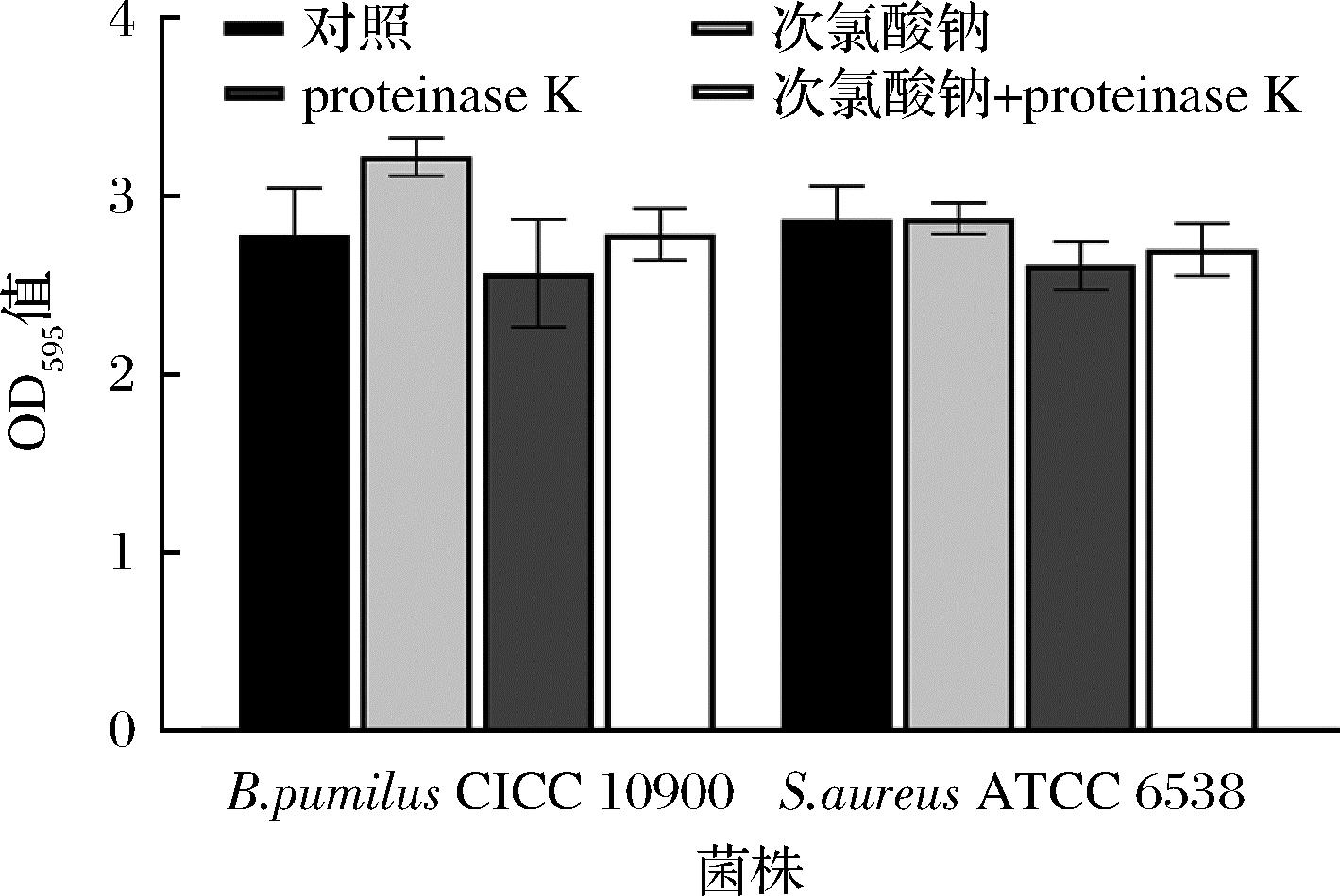
图4 聚苯乙烯96孔板上酶对成熟生物被膜的清除
Fig.4 Removal of mature biofilms by enzymes on polystyrene 96-well plates
图3显示,与生物被膜形成期间相比,这些酶对预先存在的生物被膜的效果较差。例如,α-amylase对受试菌株的成熟生物被膜基本没有抑制效果;proteinase K在预酶处理实验中的能够很好地对生物被膜的形成产生制约,但应用到成熟生物被膜时其功能性也被减弱;与对照组(无酶参与)相比,枯草芽孢杆菌CICC 10900在α-amylase的参与下产生了更多的生物被膜基质;DAKHEEL等[24]研究表明经蛋白酶K(100 μg/mL)处理后金黄色葡萄球菌的生物被膜减少,而高质量浓度的蛋白酶K(1 mg/mL)促进了大多数测试分离物的生物被膜形成。这些观察结果可以解释为酶会降解细胞分泌的细胞外蛋白酶,而这些蛋白酶负责生物被膜的分散。另一种解释可能是高浓度酶的自溶和eDNA释放,导致生物被膜的形成能力增强[23]。
这些结果表明,酶的抗生物被膜功效因生物被膜形成阶段的不同而体现出差异,在生物被膜形成期间,酶处理往往比对成熟生物被膜更有效。这一发现的原因可能是酶在EPS早期阶段中比在成熟的生物被膜中更容易减少或抑制细胞间和细胞与表面的联系[10]。在成熟的生物被膜中,酶能使附着在表面的细胞从一个部位移到另一个部位[5]。总的来说,与α-amylase和DNase I相比,蛋白酶K处理可是更有效的抑制生物被膜发展和降解成熟生物被膜的酶。
2.4 酶和次氯酸钠联合处理对成熟生物被膜的清除
由于多糖的复杂结构以及生物膜基质的异质成分,很难单独用酶或者消毒剂来彻底清除[11]。此外,酶的活性会受到pH值、温度、底物等因素的影响,与其他蛋白酶相比,蛋白酶K在一系列环境条件下的具有更好的稳定性[9];因此选用proteinase K和次氯酸钠处理不锈钢试样上的两种细菌生物被膜以评估协同清除效应。如图5所示,proteinase K,次氯酸钠和联合处理分别导致枯草芽孢杆菌CICC 10900、金黄色葡萄球菌ATCC 6538浓度降低了0.64~3.08 lg CFU/cm2、0.81~2.19 lg CFU/cm2、0.66~1.9 lg CFU/cm2。与单一处理(proteinase K和次氯酸钠)相比,proteinase K可以帮助次氯酸钠等二级制剂更有效地渗透生物被膜,增强对细菌细胞的清除功效。另一项研究指出[25],相较于单独处理,纤维素酶(20 mg/mL)与十六烷基三甲基溴化铵联合对沙门氏菌生物被膜具有协同作用;HOGAN等[26]使用α-amylase,V8 protease以及serrapeptase的单酶处理对金黄色葡萄球菌生物被膜没有降解作用,而使用每种酶与抗生素结合24 h可实现2~6个对数位的减少。这些结果表明,联合处理可以使氯等消毒剂更容易穿透生物被膜基质并清除掉酶分散的细胞。
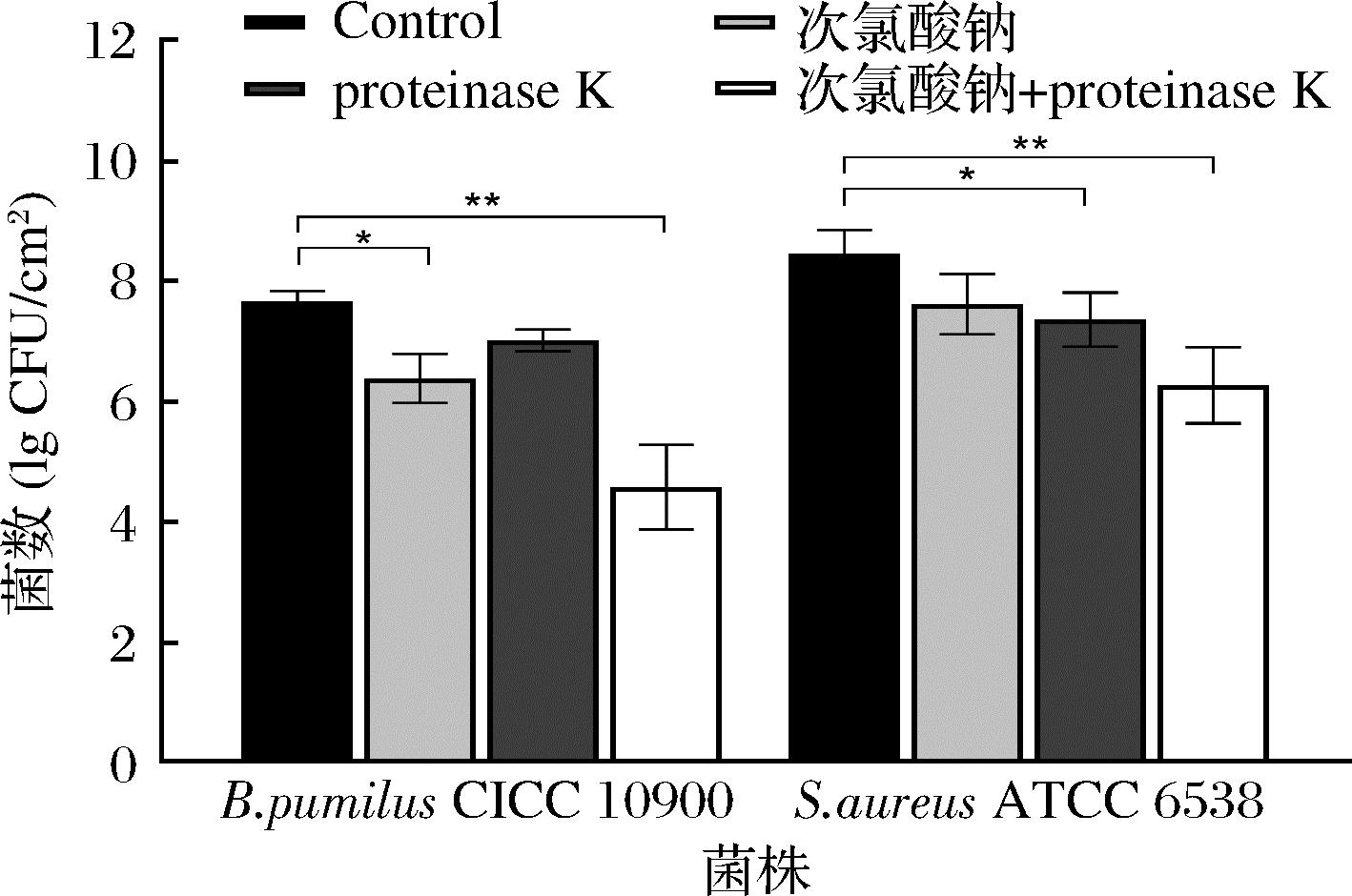
图5 proteinase K和次氯酸钠联合处理对成熟生物被膜的清除
Fig.5 Removal of mature biofilms by combined treatment with proteinase K and NaClO
2.5 FCM测定不同处理后细菌生物被膜的细胞活力
对样品进行的Calcein-AM和PI双染结果如图6所示。图中表示有不同染色特性的4种亚群:第一个位于左下象限,对应未染上色的细胞或裂解细胞碎片;第二个位于左上象限,对应PI标记的死细胞;第三个位于右下象限,代表Calcein-AM标记的活细胞;第四个位于右上象限,表示PI/Calcein-AM双染的损伤细胞,仍然具有酯酶活性,但是细胞膜受到损伤,PI可穿过细胞膜,可以认定是亚致死细胞破坏。

A-金黄色葡萄球菌ATCC 6538;B-枯草芽孢杆菌CICC 10900
图6 Proteinase K和次氯酸钠联合处理对成熟生物被膜的清除
Fig.6 Remova l of mature biofilms by combined treatment with proteinase K and NaClO
空白组的生物被膜细胞如图6-A、图6-B所示,超过35.83%、38.57%的的新鲜细胞都集中在右下限。而经过不同处理溶液方式处理的细胞,其左上象限里的细胞明显增加,可以看出这3种处理方式对2种细菌生物被膜细胞均能够起到一定的损伤作用。在使用单一proteinase K、次氯酸钠或者proteinase K+次氯酸钠进行处理时,金黄色葡萄球菌ATCC 6538、枯草芽孢杆菌CICC 10900死细胞数主要其中在左上象限,数目分别为7.09%、22.43%、31.33%和12.04%、23.45%、37.78%,代表了生物被膜细胞经不同处理溶液处理后成为失去细胞活性的凋亡细胞。经酶处理后细胞膜的完整性会受到损伤,导致细胞内容物流出,细胞裂解死亡[27],这会帮助次氯酸钠等消毒剂更好地渗透,从而起到协同效应;YU等[28]使用流式细胞仪表征超声和二氧化氯对清除金黄色葡萄球菌生物膜的协同作用,结果表明流式细胞仪表征超声处理的清除率仅为18.72%,而联合处理后的金黄色葡萄球菌细胞的灭活率为99.03%。该结果与本研究相似,相比单一处理,proteinase K+次氯酸钠的组合造成了更多的细胞死亡,因此,在应对细菌生物被膜时,联合处理是更有效的清除方式。
3 结论
细菌菌种间生物被膜有着一定的EPS特异性,导致不同细菌菌株形成生物被膜的能力存在差异,枯草芽孢杆菌CICC 10900、金黄色葡萄球菌ATCC 6538是受试菌株中形成生物被膜能力较强的2株(3.0>OD595值>2.0)。在生物被膜形成期间,酶处理往往比对成熟生物被膜更有效,大多数测试的酶都能对受试菌种产生一定的清除效果,但部分酶的参与会导致细菌产生更多的生物被膜基质,酶抑制或降解生物被膜基质的能力会可能依赖于物种和菌株类型。经酶处理后细胞膜的完整性会受到损伤,这会帮助次氯酸钠等消毒剂更好地渗透,从而起到协同效应。相较于单一处理,NaCIO和酶联合的方式是不锈钢表面细菌生物被膜的更有效的清除选择。因此在清除细菌生物被膜时,不仅仅是局限于单一的制剂处理,而应当考虑更多的组合方式。
[1] 吴丽娜,刘昀阁,张一敏,等.乳酸和过氧乙酸对大肠杆菌O157∶H7生物膜的抑制作用及其机制[J].食品科学,2022,43(9):10-18.
WU L N,LIU Y G,ZHANG Y M,et al.Inhibitory effects and mechanisms of lactic acid and peracetic acid on Escherichia coli O157∶H7 biofilm formation[J].Food Science,2022,43(9):10-18.
[2] PURTY S,SARANATHAN R,PRASHANTH K,et al.The expanding spectrum of human infections caused by Kocuria species:A case report and literature review[J].Emerging Microbes &Infections,2013,2(10):e71.
[3] YANG Y S,MIK -KRAJNIK M,ZHENG Q W,et al.Biofilm formation of Salmonella enteritidis under food-related environmental stress conditions and its subsequent resistance to chlorine treatment[J].Food Microbiology,2016,54:98-105.
-KRAJNIK M,ZHENG Q W,et al.Biofilm formation of Salmonella enteritidis under food-related environmental stress conditions and its subsequent resistance to chlorine treatment[J].Food Microbiology,2016,54:98-105.
[4] 王园,孙琳珺,程颖,等.食品加工环境胁迫因素对单核细胞增生李斯特菌生物膜形成的影响研究进展[J].食品科学,2021,42(21):246-255.
WANG Y,SUN L J,CHENG Y,et al.Progress in the study of the effect of food processing environmental stresses on Listeria monocytogenes biofilm formation[J].Food Science,2021,42(21):246-255.
[5] LIM E S,LEE J E,KIM J S,et al.Isolation of indigenous bacteria from a cafeteria kitchen and their biofilm formation and disinfectant susceptibility[J].LWT,2017,77:376-382.
[6] BRIDIER A,SANCHEZ-VIZUETE P,GUILBAUD M,et al.Biofilm-associated persistence of food-borne pathogens[J].Food Microbiology,2015,45:167-178.
[7] COUGHLAN L M,COTTER P D,HILL C,et al.New weapons to fight old enemies:Novel strategies for the (Bio)control of bacterial biofilms in the food industry[J].Frontiers in Microbiology,2016,7:1641.
[8] HUSSAIN M,OH D H.Impact of the isolation source on the biofilm formation characteristics of Bacillus cereus[J].Journal of Microbiology and Biotechnology,2018,28(1):77-86.
[9] NGUYEN U T,BURROWS L L.DNase I and proteinase K impair Listeria monocytogenes biofilm formation and induce dispersal of pre-existing biofilms[J].International Journal of Food Microbiology,2014,187:26-32.
[10] CRAIGEN B,DASHIFF A,KADOURI D E.The use of commercially available alpha-amylase compounds to inhibit and remove Staphylococcus aureus biofilms[J].The Open Microbiology Journal,2011,5:21-31.
[11] 王飞飞,吴豪益,林晨,等.基于食源性细菌群体淬灭的生物膜控制研究进展[J].食品科学,2020,41(19):290-295.
WANG F F,WU H Y,LIN C,et al.Research progress of biofilm control based on population quenching of food-borne bacteria[J].Food Science,2020,41(19):290-295.
[12] 曹勤,胡兴利,黄晓斌,等.次氯酸钠消毒在自来水厂中的应用及优化[J].中国给水排水,2016,32(15):91-94;98.
CAO Q,HU X L,HUANG X B,et al.Application and optimization of sodium hypochlorite disinfection in waterworks[J].China Water &Wastewater,2016,32(15):91-94;98.
[13] KIM M J,LIM E S,KIM J S.Enzymatic inactivation of pathogenic and nonpathogenic bacteria in biofilms in combination with chlorine[J].Journal of Food Protection,2019,82(4):605-614.
[14] LIM E S,NAM S J,KOO O K,et al.Protective role of Acinetobacter and Bacillus for Escherichia coli O157∶H7 in biofilms against sodium hypochlorite and extracellular matrix-degrading enzymes[J].Food Microbiology,2023,109:104125.
[15] MAZAHERI T,CERVANTES-HUAM N B R H,TURITICH L,et al.Removal of Listeria monocytogenes biofilms on stainless steel surfaces through conventional and alternative cleaning solutions[J].International Journal of Food Microbiology,2022,381:109888.
N B R H,TURITICH L,et al.Removal of Listeria monocytogenes biofilms on stainless steel surfaces through conventional and alternative cleaning solutions[J].International Journal of Food Microbiology,2022,381:109888.
[16] RIPOLLES-AVILA C,RAMOS-RUBIO M,HASCOЁT A S,et al.New approach for the removal of mature biofilms formed by wild strains of Listeria monocytogenes isolated from food contact surfaces in an Iberian pig processing plant[J].International Journal of Food Microbiology,2020,323:108595.
[17] HEINI N,STEPHAN R,FILTER M,et al.Temperature-dependent growth characteristics of Bacillus thuringiensis in a ratatouille food model[J].Journal of Food Protection,2020,83(5):816-820.
[18] 张立夫,张炜煜,王艳秋,等.不同浓度含氯消毒剂对炭疽芽胞杆菌杀灭效果的探讨[J].中国卫生检验杂志,2023,33(4):385-387;392.
ZHANG L F,ZHANG W Y,WANG Y Q,et al.Study on the killing effectiveness of chlorine containing disinfectants at different concentrations for Bacillus anthracis[J].Chinese Journal of Health Laboratory Technology,2023,33(4):385-387;392.
[19] 程曦.液氯和次氯酸钠消毒剂在供水管网中消毒效果的评估研究[D].扬州:扬州大学,2020.
CHENG X.Evaluation of disinfection effect of liquid chlorine and sodium hypochlorite disinfectants in water supply network[D].Yangzhou:Yangzhou University,2020.
[20] JEE D Y,HA J W.Inactivation of Escherichia coli O157∶H7,Salmonella typhimurium,and Listeria monocytogenes on stainless steel by synergistic effects of tap water-based neutral electrolyzed water and lactic acid[J].Food Microbiology,2023,112:104233.
[21] 张雅君,苏乃特,许萍,等.紫外线强化次氯酸钠消毒对再生水管网腐蚀的影响[J].中国给水排水,2015,31(9):79-83.
ZHANG Y J,SU N T,XU P,et al.Effect of sodium hypochlorite disinfection strengthened by ultraviolet on pipeline corrosion in reclaimed water distribution system[J].China Water &Wastewater,2015,31(9):79-83.
[22] 朱洪日.副溶血弧菌生物膜的形成特性及消毒剂的清除作用[D].大连:大连工业大学,2018.
ZHU H R.The formation characteristics of the biofilm of vibrio parahaemolyticus and the scavenging effect of disinfectants[D].Dalian:Dalian Polytechnic University,2018.
[23] GILAN I,SIVAN A.Effect of proteases on biofilm formation of the plastic-degrading actinomycete Rhodococcus ruber C208[J].FEMS Microbiology Letters,2013,342(1):18-23.
[24] DAKHEEL K H,ABDUL RAHIM R,NEELA V K,et al.Methicillin-resistant Staphylococcus aureus biofilms and their influence on bacterial adhesion and cohesion[J].BioMed Research International,2016,2016:4708425.
[25] WANG H H,WANG H W,XING T,et al.Removal of Salmonella biofilm formed under meat processing environment by surfactant in combination with bio-enzyme[J].LWT-Food Science and Technology,2016,66:298-304.
[26] HOGAN S,ZAPOTOCZNA M,STEVENS N T,et al.Potential use of targeted enzymatic agents in the treatment of Staphylococcus aureus biofilm-related infections[J].Journal of Hospital Infection,2017,96(2):177-182.
[27] LI Q X,YU S N,HAN J Z,et al.Synergistic antibacterial activity and mechanism of action of nisin/carvacrol combination against Staphylococcus aureus and their application in the infecting pasteurized milk[J].Food Chemistry,2022,380:132009.
[28] YU H,LIU Y,YANG F W,et al.Synergistic efficacy of high-intensity ultrasound and chlorine dioxide combination for Staphylococcus aureus biofilm control[J].Food Control,2021,122:107822.