紫外线辐射是引起皮肤外源性老化的重要因素之一,中波紫外线(ultraviolet B,UVB)的穿透力较浅,对表皮细胞的毒性更强、损伤程度更大[1]。过度暴露于UVB会引起皮肤粗糙、色素沉着和炎症反应,甚至导致皮肤恶性肿瘤的发生[2]。皮肤长期遭受UVB辐射会造成细胞内活性氧(reactive oxygen species,ROS)的积累。一方面,ROS的过量积累可上调皮肤细胞内促凋亡因子Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)的表达,下调抗凋亡因子B淋巴细胞瘤/白血病-2(B cell lymphoma-2,Bcl-2)的表达,并激活半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,caspase-3)、半胱氨酸天冬氨酸蛋白酶-9(cystein-asparate protease-9,Caspase-9)和p53,进而诱导细胞凋亡,加速皮肤衰老[3-4]。另一方面,ROS的过量积累促使核因子-κB(nuclear factor kappa B,NF-κB)的激活,导致肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)等炎性细胞因子的分泌,诱发皮肤炎症反应进而引起皮肤光损伤[5]。可见,细胞凋亡与炎症反应是UVB诱导皮肤光损伤的重要因素。
皮肤长期暴露于紫外线照射产生过多ROS,引起细胞凋亡与炎症反应,加快皮肤衰老的速度。人们可通过减少与紫外线的接触或涂抹防晒剂来防止皮肤光损伤的发生[6]。防晒剂分为传统的物理防晒剂、化学防晒剂和新型天然植物防晒剂。物理防晒剂一般停留在皮肤表面,沉积形成白色层,会影响皮脂腺及汗腺分泌而给皮肤造成负担,化学防晒剂易破坏皮肤屏障、引起皮肤过敏等,且使用时要充分考虑与皮肤的结合度[7]。天然植物活性成分对皮肤作用温和、安全性高且药效持久稳定,已成为抗光损伤物质开发领域的研究热点[8]。研究表明,植物油脂具有抗炎、抗氧化等多种活性,加之其绿色环保、使用安全和易被皮肤吸收等优势,可作为天然防晒剂的理想原料进一步开发和利用。例如,山茶油、牡丹籽油、橄榄油等植物油脂已被作为防晒剂原料应用于化妆品中[9-10]。
枸杞(Lycium barbarum L.)为茄科、枸杞属植物,卵状菱形,有“红宝”之称,作为我国传统的药食同源植物,主要分布在我国宁夏、青海等西北地区[11-12]。随着枸杞汁、枸杞酒等产品产量的增长,大量枸杞废渣(含有大量枸杞籽)带来的环境污染和资源浪费问题日益突出。枸杞籽油是从枸杞籽中提取获得的一种功能性油脂,含有不饱和脂肪酸、维生素E、类胡萝卜素和磷脂等天然活性成分,具有抗氧化、延缓衰老、缓解抑郁和增强免疫功能的药理作用[13-16]。研究和开发枸杞籽油不仅能解决废渣污染问题,而且具有较大的经济效益和社会效益。LI等[13]证明枸杞籽油具有自由基清除能力,因此,它具有一定抗皮肤光损伤的潜力。然而,关于枸杞籽油对人角质形成细胞的抗光损伤作用研究尚未见报道。
因此,本研究在测定枸杞籽油中主要活性成分含量的基础上,以UVB诱导的人永生化角质形成细胞(human immortalized keratinocytes,HaCaT)为光损伤模型,通过检测细胞存活率、ROS含量、细胞凋亡率、细胞凋亡相关因子和炎症因子来探讨枸杞籽油对UVB诱导的光损伤HaCaT细胞的防护作用,以期为天然抗光损伤物质的开发提供科学依据,为枸杞籽油的有效利用提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
HaCaT细胞,武汉普诺赛生命科技有限公司;枸杞籽油,青海康普生物科技有限公司。
1.1.2 试剂
HaCaT专用培养基[含体积分数为15%的胎牛血清(fetal calf serum,FBS)]、胰蛋白酶、磷酸缓冲液(phosphate buffered saline,PBS)、MEM培养基、青霉素-链霉素混合液,武汉普诺赛生命科技有限公司;增强型细胞活力检测试剂盒(cell counting kit-8,CCK-8)、ROS荧光法试剂盒、一步法TUNEL流式凋亡检测试剂盒、TNF-α、IL-1β和IL-6酶联免疫吸附测定(enzyme linked-immuno-sorbent assay,ELISA)试剂盒,武汉伊莱瑞特生物科技股份有限公司;总RNA提取试剂盒、FastKing一步法除基因组cDNA第一链合成预混试剂、SuperReal彩色荧光定量预混试剂,天根生化科技(北京)有限公司;Tween-80,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
HF100细胞培养箱,上海力申科学仪器有限公司;Happy-TL21台式高速冷冻离心机,长沙东旺实验仪器有限公司;Ti2荧光倒置显微镜,伯泰科技有限公司;L125紫外辐射仪,深圳市林上科技有限公司;1510酶标仪,赛默飞世尔科技(中国)科技有限公司;KH-600E超声波清洗仪,昆山禾创仪器有限公司;B90883流式细胞仪,贝克曼库尔特生物科技(苏州)有限公司;SYNERGY LX多功能酶标仪,美国伯腾仪器有限公司。
1.3 实验方法
1.3.1 枸杞籽油主要活性成分的测定
分别按照GB 5009.168—2016、GB 5009.83—2016、DB64/T 1514—2017、《保健食品中功效成分检测方法》和GB 5009.82—2016(第一法)提供的方法测定枸杞籽油中脂肪酸、β-胡萝卜素、玉米黄质、叶黄素、谷甾醇以及维生素E的含量。
1.3.2 HaCaT细胞培养
HaCaT细胞采用含15% FBS的HaCaT细胞专用培养基于37 ℃、5%(体积分数)CO2的三气培养箱中培养,待细胞融合度至80%进行传代,取对数生长期的细胞进行后续实验[17]。
1.3.3 HaCaT细胞UVB光损伤模型的构建
参考KUNCHANA等[18]的方法并略有改动。HaCaT细胞以1.5×104个/孔接种于96孔板,于37 ℃、5% CO2培养24 h,将原有的HaCaT细胞专用培养基更换为无血清MEM培养基继续培养4 h后弃去,用少量PBS覆盖HaCaT细胞,进行UVB照射,照射剂量分别为0、20、40、60、80、100 mJ/cm2,每个剂量设置6个复孔。照射结束后将PBS更换为无血清MEM培养基继续培养24 h后每孔加入10 μL CCK-8,于37 ℃,5% CO2孵育1 h,450 nm处测定HaCaT细胞存活率,将细胞存活率为正常细胞存活率50%的UVB剂量作为后续实验照射剂量[17]。
1.3.4 HaCaT细胞存活率的测定
1.3.4.1 枸杞籽油对HaCaT细胞存活率的影响
HaCaT细胞以1.5×104个/孔接种于96孔板,于37 ℃、5% CO2条件下培养24 h。将原有的HaCaT细胞专用培养基更换为含有质量浓度为75、150、300、600、1 200 μg/mL枸杞籽油的无血清MEM培养基(0.01% Tween-80助溶)和0.01%Tween-80(溶于无血清MEM培养基)于37 ℃、5% CO2培养4 h,将上清更换为无血清MEM培养基继续培养24 h,每个浓度设置6个重复。采用CCK-8法检测HaCaT细胞存活率,方法同1.3.3节。
1.3.4.2 枸杞籽油对UVB诱导的光损伤HaCaT细胞存活率的影响
HaCaT细胞以1.5×104个/孔接种于96孔板,于37 ℃、5% CO2培养24 h。对照组:HaCaT细胞既不进行UVB照射,也不加入枸杞籽油;模型组:HaCaT细胞只进行UVB照射,不加入枸杞籽油;枸杞籽油组:HaCaT用含有不同质量浓度枸杞籽油(75、150、300、600 μg/mL,0.01% Tween-80助溶)的无血清MEM培养基于37 ℃、5% CO2孵育4 h。模型组和枸杞籽油组HaCaT细胞弃去上清液后加入少量PBS,以40 mJ/cm2的UVB剂量进行照射。照射结束后,将各组HaCaT细胞培养液更换为无血清MEM培养基,继续于37 ℃、5% CO2培养24 h,每组分别设置6个复孔[17]。CCK-8法检测HaCaT细胞存活率,方法同1.3.3节。
1.3.5 枸杞籽油对UVB诱导的光损伤HaCaT细胞中ROS水平的影响
HaCaT细胞培养、不同浓度枸杞籽油孵育及UVB处理同1.3.4.2节,用2′,7′-二氯荧光素二乙酸酯(2′,7′-dichlorofuorescin diacetate,DCFH-DA)荧光探针检测细胞内的ROS水平[19]。用缓冲液按1∶750(体积比)稀释DCFH-DA,弃去无血清MEM培养基,用缓冲液(试剂三)洗涤3次,加入适当体积的DCFH-DA(试剂一),于37 ℃避光孵育40 min,采用荧光酶标仪于500 nm/525 nm处测定荧光强度。
1.3.6 枸杞籽油对UVB诱导的光损伤HaCaT细胞凋亡率的影响
HaCaT细胞以5×105个/孔接种于6孔板,于37 ℃、5% CO2培养24 h,不同浓度枸杞籽油孵育及UVB处理同1.3.4.2节。弃去无血清MEM培养基,收集HaCaT细胞,按照一步法TUNEL流式凋亡检测试剂盒说明书操作,采用流式细胞仪检测HaCaT细胞凋亡情况[20]。
1.3.7 枸杞籽油对UVB诱导的光损伤HaCaT细胞炎症因子含量的影响
HaCaT细胞培养、不同浓度枸杞籽油孵育及UVB处理同1.3.4.2节,按ELISA检测试剂盒操作说明书分别测定对照组、模型组和枸杞籽油组HaCaT细胞上清液中TNF-α、IL-1β和IL-6的含量,于450 nm处测定吸光值。
1.3.8 枸杞籽油对UVB诱导的光损伤HaCaT细胞凋亡和炎症相关因子mRNA相对表达的影响
HaCaT细胞培养同1.3.6节,不同浓度枸杞籽油孵育及UVB处理同1.3.4.2节。弃去无血清MEM培养基,每孔加入适量PBS冲洗2~3次,弃去PBS后加入1 mL裂解液RZ裂解细胞,抽打若干次至溶液透明。按照总RNA提取试剂盒说明书提取RNA,依据cDNA逆转录试剂盒说明书将RNA逆转录为cDNA。RT-PCR反应检测HaCaT细胞凋亡相关因子Bcl-2、Bax、Caspase-3、Caspase-9、p53和促炎因子TNF-α、IL-1β、IL-6的mRNA表达。RT-PCR反应体系为正向和反向引物各0.6 μL,ddH2O 6.3 μL,cDNA 2.5 μL,2×SuperReal Color Premix(SYBR Green)10 μL进行反应,反应条件:95 ℃ 15 min(预变性),95 ℃ 10 s(变性),60 ℃ 20 s(退火/延伸),40个循环。在扩增程序中读取Ct值,按照2-ΔΔCt分析法,计算各组mRNA的相对表达[21]。计算如公式(1)所示:
ΔΔCt=处理组(Ct目的基因-Ct内参基因)-对照组(Ct目的基因-Ct内参基因)
(1)
表1 qRT-PCR引物序列
Table 1 qRT-PCR primer sequences

目的基因引物序列(5′-3′)Bcl-2-FGGATCCAGGATAACGGAGGCBcl-2-RGGGCCAAACTGAGCAGAGTCBax-FTGGAGCTGCAGAGGATGATTGBax-RGAAGTTGCCGTCAGAAAACATGCaspase-3-RTTCATTATTCAGGCCTGCCGAGGCaspase-3-FTTCTGACAGGCCATGTCATCCTCACaspase-9-FTAACAGGCAAGCAGCAAAGTCaspase-9-RACCAAATCCTCCAGAACCAAP53-FTAACAGTTCCTGCATGGGCGGCP53-RAGGACAGGCACAAACACGCACCTNF-α-FGAGGCCAAGCCCTGGTATGTNF-α-RCGGGCCGATTGATCTCAGCIL-6-FTAATGGGCATTCCTTCTTCTIL-6-RTGTCCTAACGCTCATACTTTTIL-1β-FCCAGGGACAGGATATGGAGCIL-1β-RTTCAACACGCAGGACAGGTACAGβ-actin-FCCAACCGCGAGAAGATGAβ-actin-RCCAGAGGCGTACAGGGATAG
1.4 数据统计分析
实验数据以平均值±标准差![]() 表示,采用SPSS 26.0统计软件统计分析,组间比较采用ANOVA方差分析,多组间比较采用LSD检验,P<0.05表示具有显著差异;P<0.01,表示具有极显著差异。
表示,采用SPSS 26.0统计软件统计分析,组间比较采用ANOVA方差分析,多组间比较采用LSD检验,P<0.05表示具有显著差异;P<0.01,表示具有极显著差异。
2 结果与分析
2.1 枸杞籽油主要活性成分含量
枸杞籽油中含有大量不饱和脂肪酸,其中亚油酸和油酸含量最高,分别达到67.4%和19.2%;此外,谷甾醇和维生素E分别含有42%和27.4 mg/100 g;还含有少量的β-胡萝卜素、玉米黄质和叶黄素。这些活性成分可为枸杞籽油抗UVB诱导的皮肤光损伤提供良好的物质基础,结果见表2。
表2 枸杞籽油活性成分含量
Table 2 Content of active components in Lycium barbarum seed oil
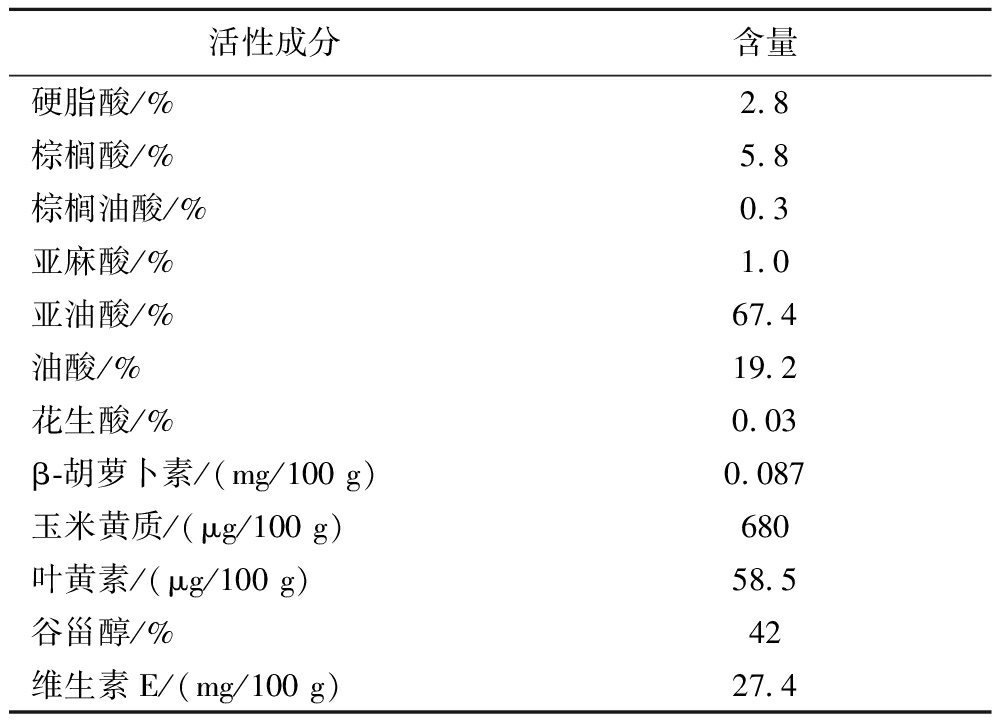
活性成分含量硬脂酸/%2.8棕榈酸/%5.8棕榈油酸/%0.3亚麻酸/%1.0亚油酸/%67.4油酸/%19.2花生酸/%0.03β-胡萝卜素/(mg/100 g)0.087玉米黄质/(μg/100 g)680叶黄素/(μg/100 g)58.5谷甾醇/%42维生素E/(mg/100 g)27.4
2.2 不同UVB照射剂量对HaCaT细胞存活率的影响
如图1所示,与对照组(0 mJ/cm2)相比,不同UVB照射后HaCaT细胞存活率极显著降低(P<0.01),且UVB照射剂量越强,细胞存活率越低。经40 mJ/cm2 UVB照射后,细胞存活率为对照组的50%左右,因此,本实验采用UVB照射强度为40 mJ/cm2作为后续实验照射剂量。
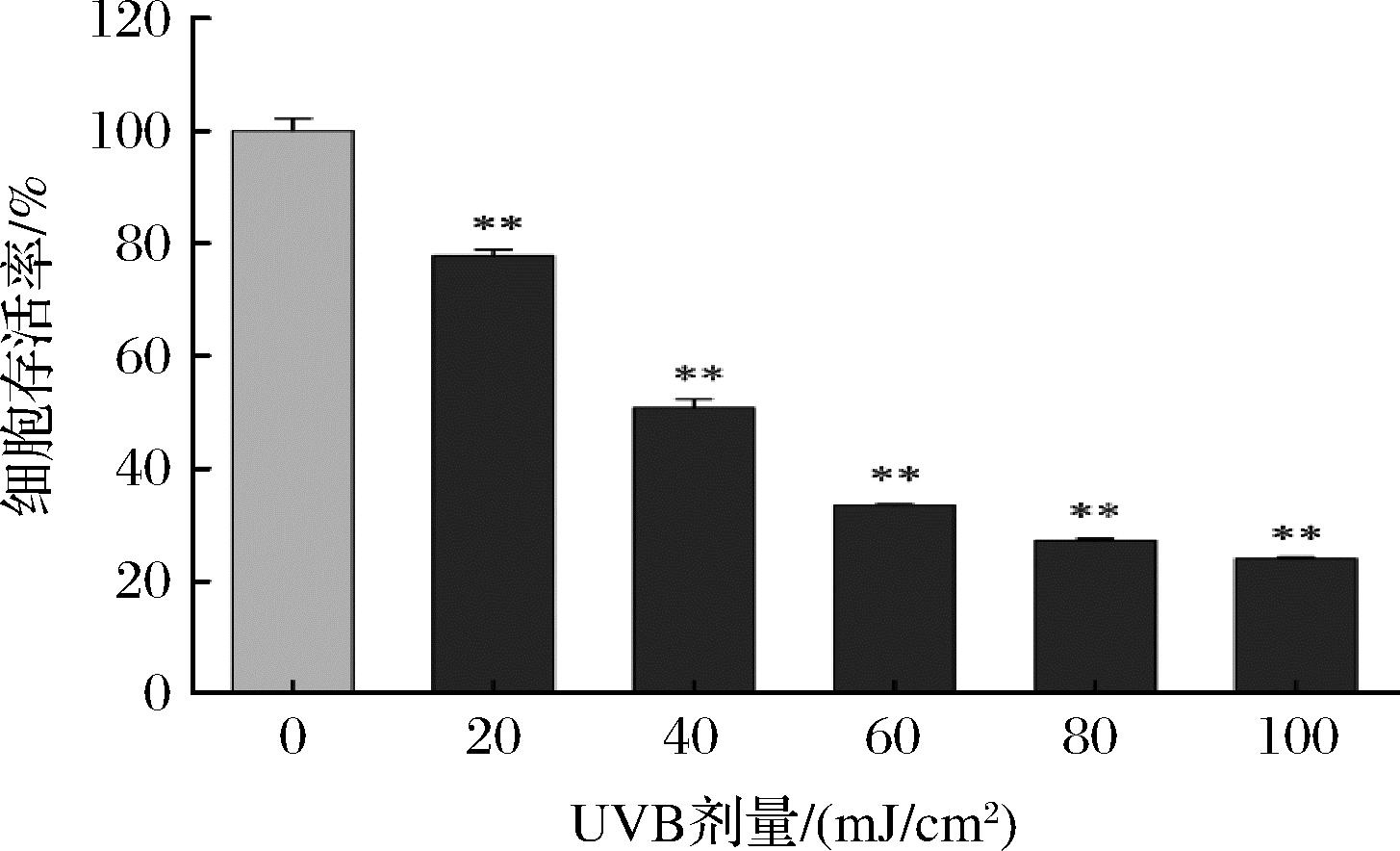
图1 不同UVB照射剂量对HaCaT细胞存活率的影响
Fig.1 Effect of different UVB irradiation doses on the viability of HaCaT cells
注:与0 mJ/cm2 UVB组相比,**表示P<0.01。
2.3 枸杞籽油对HaCaT细胞存活率的影响
2.3.1 不同浓度枸杞籽油和0.01% Tween-80对HaCaT细胞存活率的影响
由图2可知,相比于对照组,质量浓度为75、150、300、600、1 200 μg/mL的枸杞籽油(0.01% Tween-80助溶)和0.01% Tween-80对HaCaT细胞存活率均无明显影响。选择0.01% Tween-80助溶的75、150、300、600 μg/mL的枸杞籽油进行后续实验。
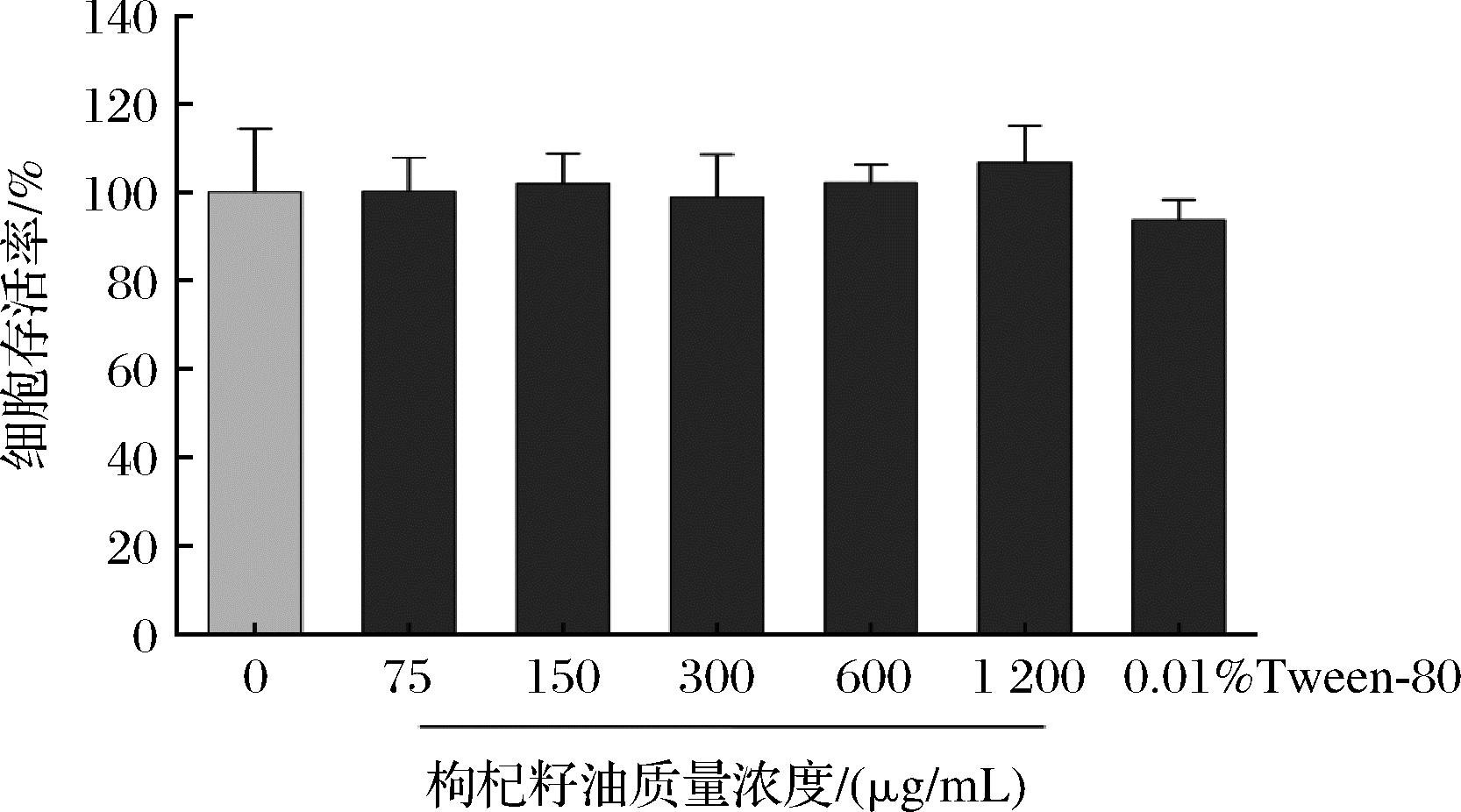
图2 不同浓度枸杞籽油和0.01% Tween-80对HaCaT细胞存活率的影响
Fig.2 Effects of different concentrations of Lycium barbarum seed oil and 0.01% Tween-80 on the viability of HaCaT cells
2.3.2 不同浓度枸杞籽油对UVB诱导的光损伤HaCaT细胞存活率的影响
如图3所示,与对照组相比,经UVB(40 mJ/cm2)照射后,模型组HaCaT细胞存活率极显著下降(P<0.01),为正常细胞的50%左右。与模型组相比,75 μg/mL枸杞籽油处理后的细胞存活率显著升高(P<0.05),150、300、600 μg/mL枸杞籽油处理后的细胞存活率极显著升高(P<0.01),且细胞存活率随着枸杞籽油浓度的增加而升高。可见,枸杞籽油可明显提高UVB诱导的光损伤HaCaT细胞存活率。
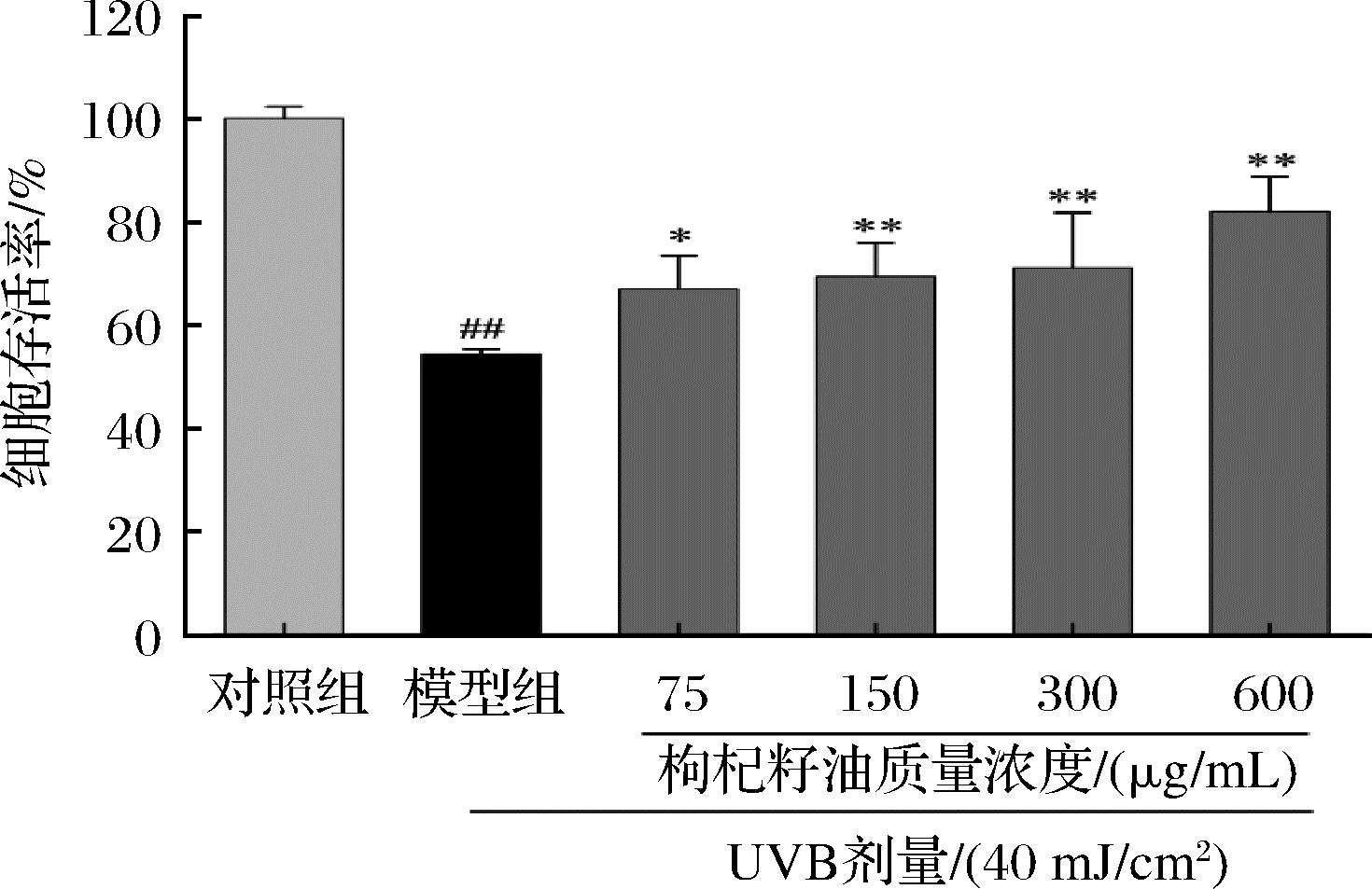
图3 枸杞籽油对UVB诱导的光损伤HaCaT细胞存活率的影响
Fig.3 Effect of Lycium barbarum seed oil on the viability of UVB-induced photodamaged HaCaT cells
注:与对照组相比,##表示P<0.01;与模型组相比,*表示P<0.05,**表示P<0.01(下同)。
2.4 枸杞籽油对UVB诱导的光损伤HaCaT细胞内ROS水平的影响
图4显示,与对照组相比,模型组HaCaT细胞内ROS水平极显著升高(P<0.01)。而相比模型组,经75、150、300、600 μg/mL枸杞籽油处理后细胞内ROS水平显著降低(P<0.05)。说明枸杞籽油可明显降低UVB诱导的光损伤HaCaT细胞内的ROS水平。
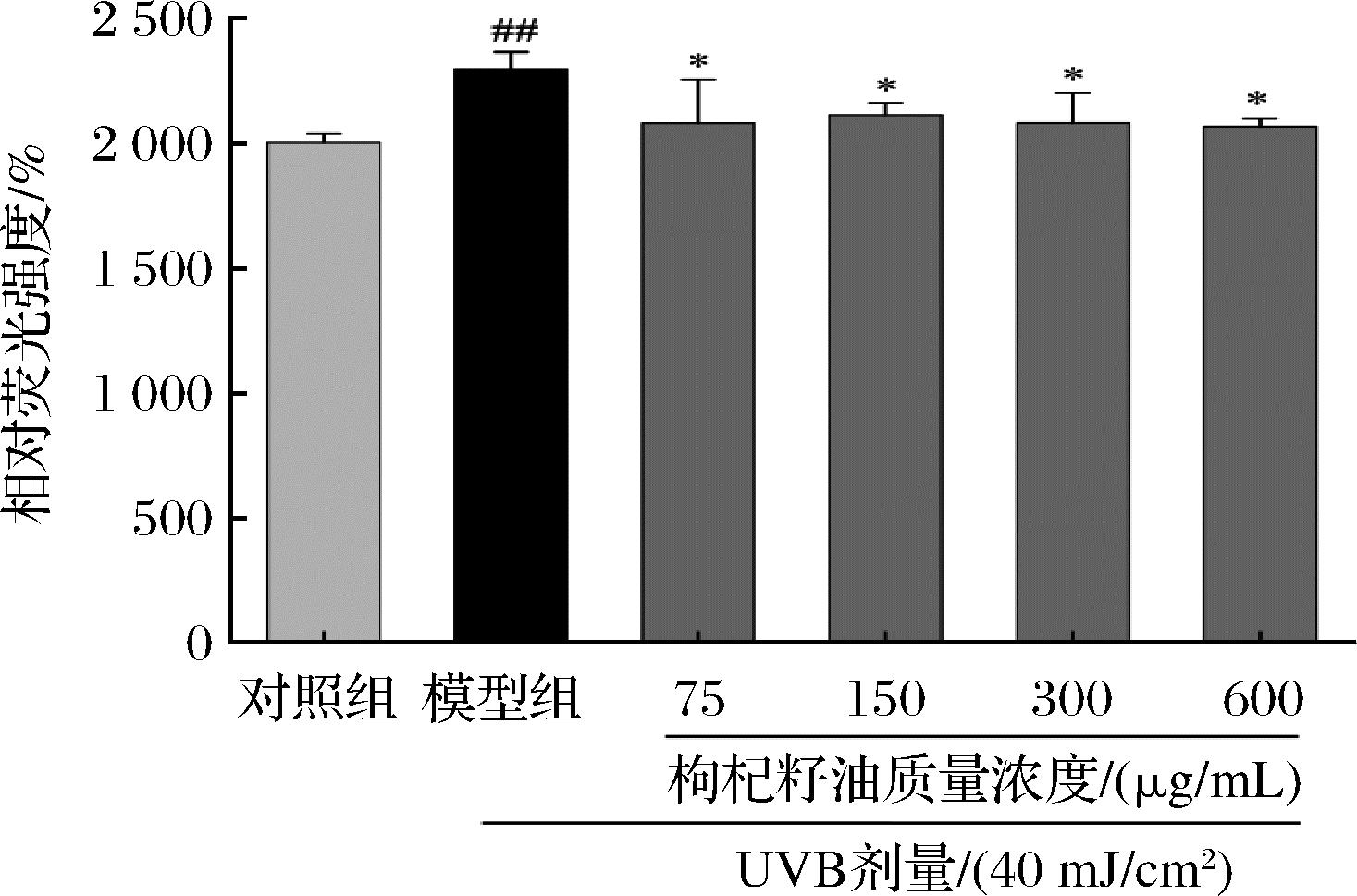
图4 枸杞籽油对UVB诱导的光损伤HaCaT细胞内ROS水平的影响
Fig.4 Effect of Lycium barbarum seed oil on the ROS level of UVB-induced photodamaged HaCaT cells
2.5 枸杞籽油对UVB诱导的光损伤HaCaT细胞凋亡率的影响
由图5可知,模型组HaCaT细胞凋亡率与对照组相比极显著升高(P<0.01),而与模型组相比,经75、150、300、600 μg/mL枸杞籽油处理后的细胞凋亡率极显著降低(P<0.01)。说明40 mJ/cm2UVB照射能增加HaCaT细胞凋亡率,而枸杞籽油可有效抑制UVB诱导的细胞凋亡。
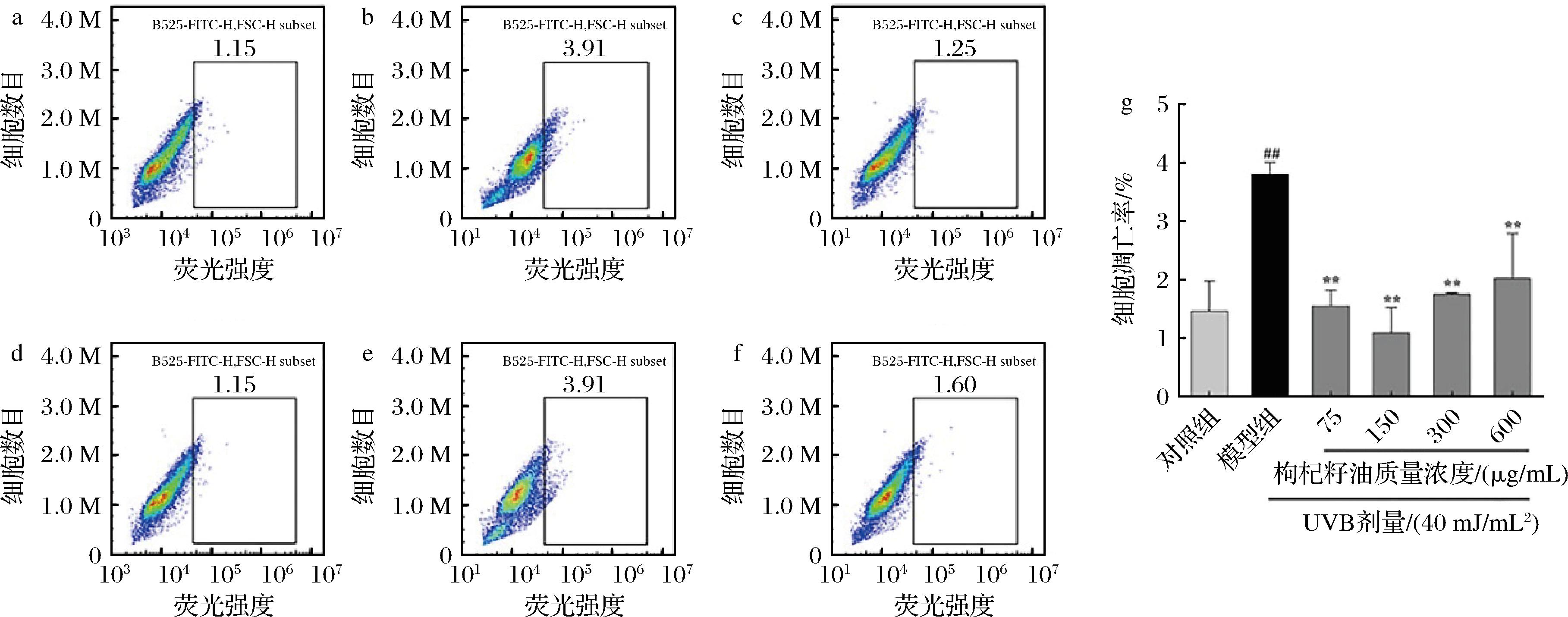
a-对照组;b-模型组;c-75 μg/mL;d-150 μg/mL;e-300 μg/mL;f-600 μg/mL;g-枸杞籽油对UVB诱导的光损伤HaCaT细胞凋亡率的影响
图5 枸杞籽油对UVB诱导的光损伤HaCaT细胞凋亡率的影响
Fig.5 Effect of Lycium barbarum seed oil on apoptosis rate of UVB-induced photodamaged HaCaT cells
2.6 枸杞籽油对UVB诱导的光损伤HaCaT细胞中凋亡相关因子mRNA相对表达的影响
与对照组相比,模型组细胞中Bcl-2 mRNA相对表达水平极显著降低(P<0.01),Bax、Caspase-3、Caspase-9和p53极显著升高(P<0.01);与模型组相比,经枸杞籽油处理的各组细胞中Bcl-2 mRNA相对表达水平极显著升高(P<0.01),Bax、Caspase-3、Caspase-9和p53 mRNA相对表达极显著降低(P<0.01)(图6)。该结果表明,枸杞籽油可通过增加UVB诱导的光损伤HaCaT细胞中抗凋亡因子Bcl-2 mRNA的表达,减少促凋亡因子Bax和Caspase-3、Caspase-9、p53 mRNA的表达抑制UVB照射引起的细胞凋亡。
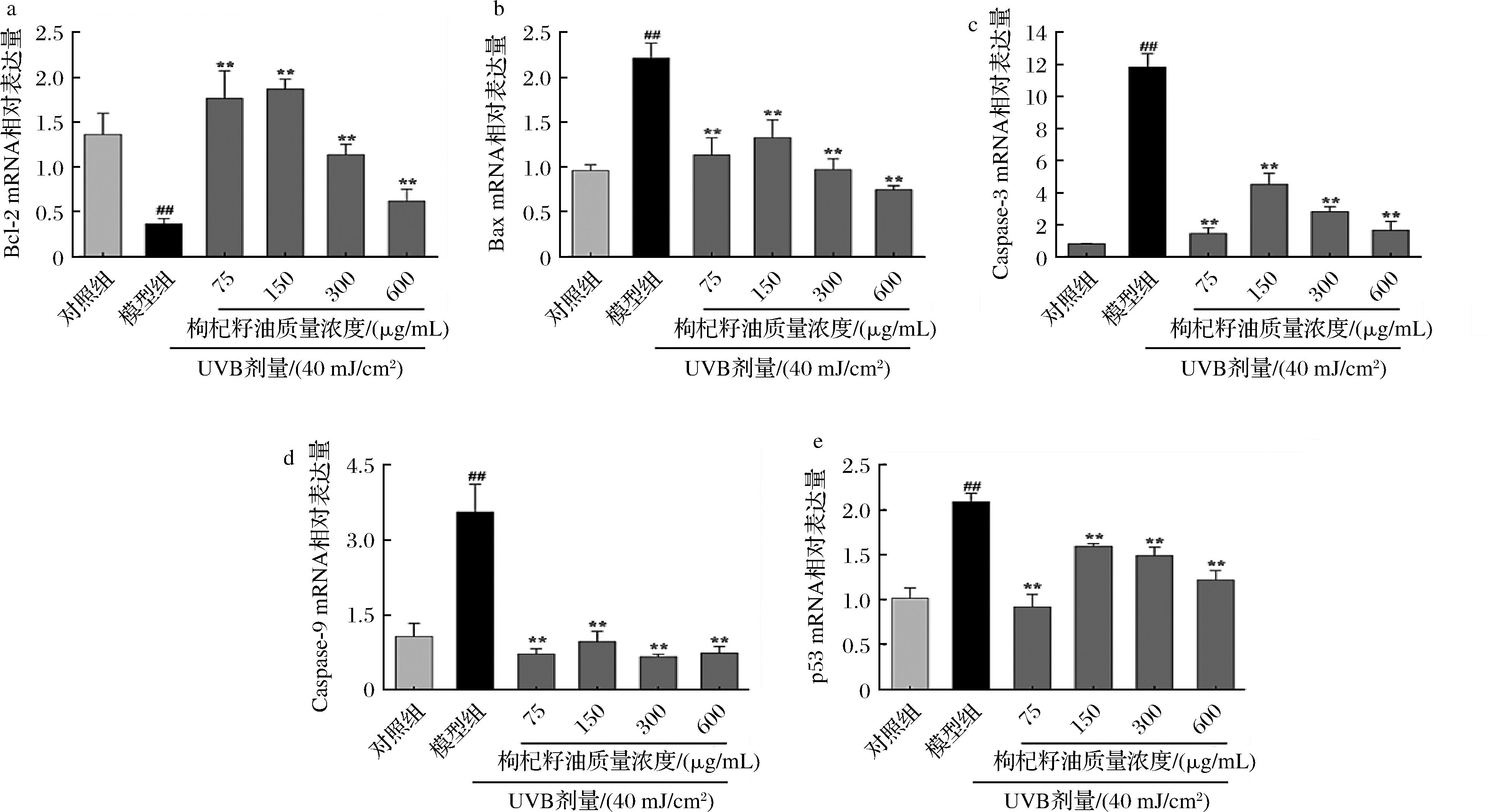
a-Bcl-2;b-Bax;c-Caspase-3;d-Caspase-9;e-p53
图6 枸杞籽油对UVB诱导的光损伤HaCaT细胞中凋亡相关因子mRNA相对表达的影响
Fig.6 Effect of Lycium barbarum seed oil on the relative expression of apoptosis-related factors mRNA in UVB-induced photodamaged HaCaT cells
2.7 枸杞籽油对UVB诱导的光损伤HaCaT细胞炎症因子的影响
图7-a~图7-c显示,与对照组相比,经UVB照射后,HaCaT细胞中TNF-α、IL-1β和IL-6的蛋白含量极显著升高(P<0.01);而与模型组相比,75、150、300、600 μg/mL枸杞籽油处理后细胞中TNF-α、IL-1β和IL-6的蛋白含量极显著下降(P<0.01)。图7-d~图7-f结果表明,与对照组相比,模型组HaCaT细胞TNF-α、IL-1β和IL-6 mRNA相对表达极显著升高(P<0.01);与模型组相比,枸杞籽油则极显著降低了TNF-α、IL-1β和IL-6 mRNA的相对表达(P<0.01)。说明枸杞籽油能降低HaCaT细胞中炎症因子的含量和mRNA相对表达减轻UVB引起的炎症反应。
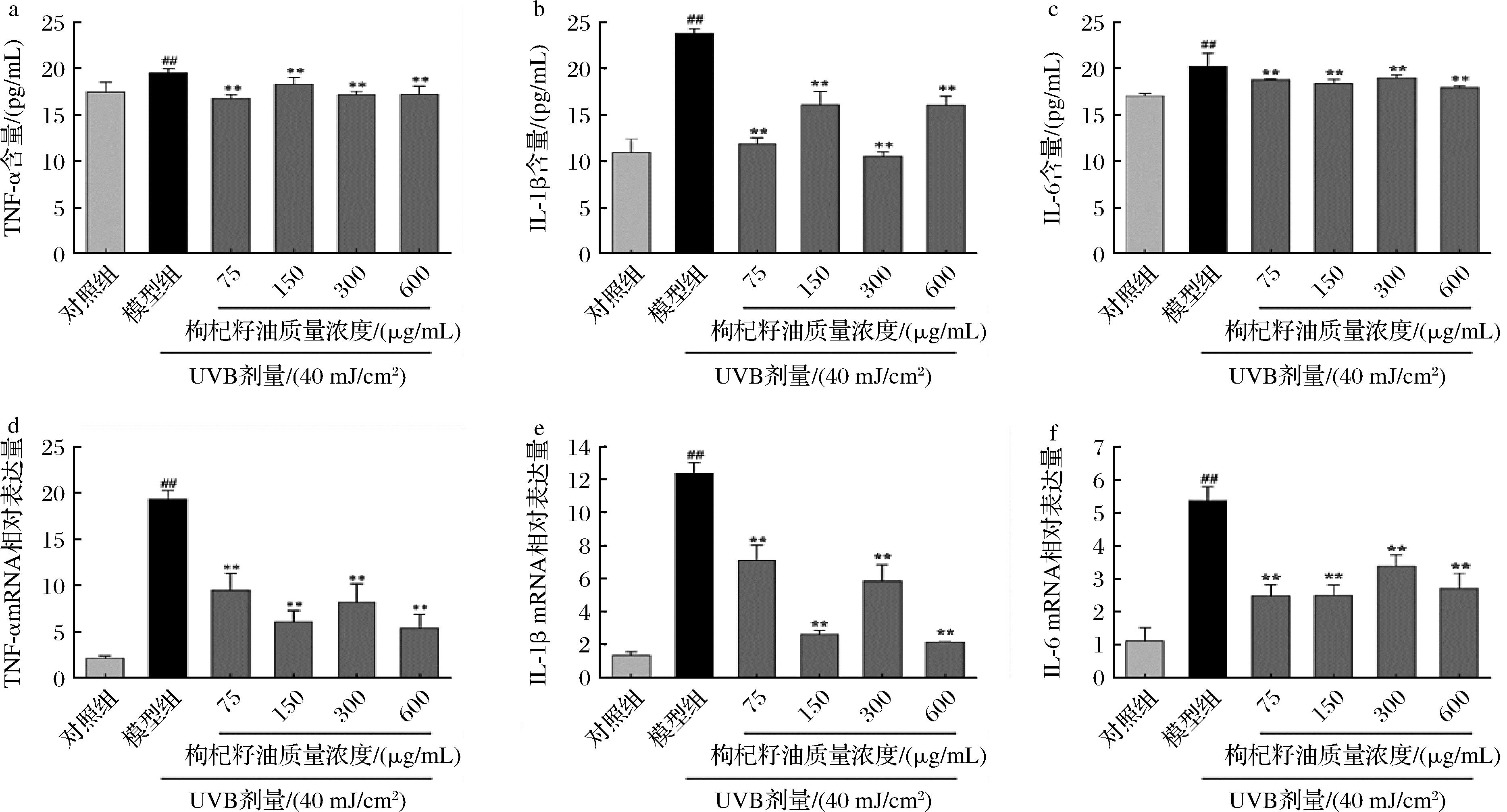
a-TNF-α含量;b-IL-1β含量;c-IL-6含量;d-TNF-α mRNA相对表达;e-IL-1β mRNA相对表达;f-IL-6 mRNA相对表达
图7 枸杞籽油对UVB诱导的光损伤HaCaT细胞炎症因子的影响
Fig.7 Effect of Lycium barbarum seed oil on the relative expression of inflammation factors mRNA in UVB-induced photodamaged HaCaT cells
3 结论与讨论
枸杞籽油具有不饱和脂肪酸、类胡萝卜素、维生素E和植物甾醇等活性成分[22-23],这些活性成分可通过不同途径缓解皮肤损伤。研究表明,油酸和亚油酸都具有良好的抗衰老作用,油酸与人体脂肪酸结构相似,可改变皮肤角质层脂质结构,增加脂质流动性,促进有效物质的渗透;亚油酸则在阻止脂质过氧化损伤方面起关键作用[24]。叶黄素可通过降低IL-6、TNF-α和环氧合酶-2(cyclooxygenase-2,COX-2)这些促炎介质发挥对紫外线辐射的HaCaT细胞的防护作用[25]。植物甾醇也能缓解皮肤炎症反应并保护其免受紫外线伤害[26]。维生素E可显著减少紫外线辐射导致的红斑、水肿和皮肤过敏,并抑制紫外线辐射引起的皮肤癌的发生[27]。本研究中,枸杞籽油中的油酸和亚油酸含量最高,分别为19.2%和67.4%,叶黄素、谷甾醇、维生素E含量分别为58.5 μg/100 g、42%、27.4 mg/100 g。这些活性成分可为枸杞籽油抗UVB诱导的HaCaT细胞光损伤提供一定物质基础。
UVB辐射后使细胞产生过量ROS,进而诱导凋亡相关蛋白的表达,加速细胞凋亡[28]。Bcl-2基因家族在细胞凋亡调控中起关键作用。其中,Bcl-2与Bax功能相互拮抗,Bcl-2抑制细胞凋亡,Bax加速细胞凋亡[29]。此外,过量的ROS会激活位于线粒体膜上的Bcl-2家族,使线粒体内细胞色素C氧化酶(cytochrome C oxidase,Cyto-C)释放到细胞质内并激活Caspase蛋白家族,启动Caspase级联反应,进而影响特定凋亡信号分子诱导细胞凋亡发生[30]。Caspase家族中Caspase-9作为凋亡始动子起到关键作用,它在Cyto-C的参与下可激活Caspase-3,活化的Caspase-3可酶解凋亡抑制蛋白,最终导致细胞凋亡[31]。p53在细胞凋亡过程中主要通过对线粒体膜上Bcl-2家族蛋白的转录调控,改变线粒体膜电位,最终激活Caspase-3并启动细胞凋亡级联反应[32]。本研究结果显示,枸杞籽油可通过显著降低UVB诱导的HaCaT细胞凋亡率及相关因子Bax、Caspase-3、Caspase-9和p53 mRNA的表达,促进抗凋亡因子Bcl-2 mRNA的表达来抑制UVB诱导的HaCaT细胞凋亡的发生,进而发挥抗UVB光损伤作用。MUZAFFER等[33]研究发现胡桃可下调UVB诱导的光损伤HaCaT细胞中Bax、Caspase-3、Caspase-9和p53 mRNA的表达,上调Bcl-2 mRNA的表达,该研究结果与本研究一致。
角质细胞占据人皮肤表皮细胞的90%,具有分泌细胞因子的功能[34]。UVB作用于HaCaT细胞,导致多种炎症因子如TNF-α、IL-1β和IL-6的产生[35]。机体发生炎症反应时,TNF-α是出现最早的起关键作用的炎症因子,它能促进其他炎症细胞因子的合成和释放;IL-1β是具有免疫调节和执行宿主防御功能的炎症因子;IL-6具有与IL-1β相似的生物学效应[36]。本研究证实了枸杞籽油可显著降低UVB诱导的光损伤HaCaT细胞中TNF-α、IL-1β和IL-6 mRNA的表达和蛋白含量。苏牧楠等[37]研究发现纳豆提取物可明显降低UVB照射后HaCaT细胞中TNF-α、IL-1β和IL-6的蛋白含量,张艳晴[38]发现铁皮石斛超滤组分可抑制UVB诱导的光损伤HaCaT细胞中TNF-α、IL-1β和IL-6 mRNA相对表达。本研究结果与上述文献报道相似。
综上所述,枸杞籽油可通过调控细胞凋亡和减轻炎症反应缓解UVB诱导的HaCaT细胞光损伤。主要通过提高HaCaT细胞存活率,抑制ROS过量生成,降低HaCaT细胞凋亡率,促进抗凋亡因子Bcl-2、降低促凋亡因子Bax和Caspase-3、Caspase-9、p53 mRNA的表达,减少炎症因子TNF-α、IL-1β和IL-6的蛋白含量和mRNA的表达,而枸杞籽油所含的不饱和脂肪酸、类胡萝卜素、谷甾醇和维生素E为其抗UVB所致的光损伤提供了物质基础。这为枸杞籽油的进一步开发利用提供新的思路,为天然植物油脂抗光损伤提供了一定的科学理论依据。
[1] HU B,CASTILLO E,HAREWOOD L,et al.Multifocal epithelial tumors and field cancerization from loss of mesenchymal CSL signaling[J].Cell,2012,149(6):1207-1220.
[2] LI L Y,HUANG T,LAN C,et al.Protective effect of polysaccharide from Sophora japonica L.flower buds against UVB radiation in a human keratinocyte cell line (HaCaT cells)[J].Journal of Photochemistry and Photobiology.B,Biology,2019,191:135-142.
[3] WANG Y N,LI W X,XU S K,et al.Protective skin aging effects of cherry blossom extract (Prunus Yedoensis) on oxidative stress and apoptosis in UVB-irradiated HaCaT cells[J].Cytotechnology,2019,71(2):475-487.
[4] 马月瑭.矢车菊素-3-葡萄糖苷对HaCaT细胞光损伤的ROS、p53调控机制初步研究[D].广州:暨南大学,2015.
MA Y T.Protective effect of cyanidin-3-glucoside against ultraviolet B radiation induced cell damage in human HaCaT keratinocytes through the regulation of ROS,p53[D].Guangzhou:Jinan University,2015.
[5] HAN M,LI H,KE D,et al.Mechanism of Ba Zhen Tang delaying skin photoaging based on network pharmacology and molecular docking[J].Clinical,Cosmetic and Investigational Dermatology,2022,15:763-781.
[6] 萧振邦.源于褐藻铁钉菜的一种甘油糖脂抑制UVB诱导HaCaT细胞光老化的机制研究[D].湛江:广东海洋大学,2021.
XIAO Z B.Study on the mechanism of a glycerolipid from Sargassum fuciformis inhibiting UVB-induced photoaging of HaCaT cells[D].Zhanjiang:Guangdong Ocean University,2021.
[7] 张婷婷,张琰,刘梅,等.中药及天然植物防晒作用研究进展[J].中华中医药学刊,2014,32(3):556-558.
ZHANG T T,ZHANG Y,LIU M,et al.Review of Chinese medicine and natural products′ effects on Sun protection[J].Chinese Archives of Traditional Chinese Medicine,2014,32(3):556-558.
[8] 杨玲玲,黄荣,毛峰.植物防晒剂的筛选和应用研究[J].广东化工,2020,47(4):15-17.
YANG L L,HUANG R,MAO F.Screening and application of plant sunscreen agents[J].Guangdong Chemical Industry,2020,47(4):15-17.
[9] BAKRY A M,ABBAS S,ALI B,et al.Microencapsulation of oils:A comprehensive review of benefits,techniques,and applications[J].Comprehensive Reviews in Food Science and Food Safety,2016,15(1):143-182.
[10] 马晓原,赵永红,刘慧民.天然植物油在防晒化妆品中的功效研究进展[J].中国油脂,2021,46(1):71-75.
MA X Y,ZHAO Y H,LIU H M.Progress in efficacy of natural vegetable oils in sunscreen cosmetics[J].China Oils and Fats,2021,46(1):71-75.
[11] 苏宇静,王辉.枸杞籽油开发应用[J].中国油脂,2004,29(8):56-58.
SU Y J,WANG H.Development and application of wolfberry seed oil[J].China Oils and Fats,2004,29(8):56-58.
[12] 李国银.枸杞色素提取与特性研究以及内蒙古地区枸杞品质分析[D].呼和浩特:内蒙古农业大学,2009.
LI G Y.Study on the extraction and characteristic of fructus lycii pigment and the quality analysis of fructus lycii planted in inner mongolia[D].Hohhot:Inner Mongolia Agricultural University,2009.
[13] LI G L,SHI J Y,SUO Y R,et al.Supercritical CO2 cell breaking extraction of Lycium barbarum seed oil and determination of its chemical composition by HPLC/APCI/MS and antioxidant activity[J].LWT-Food Science and Technology,2011,44(4):1172-1178.
[14] 杨张杰,王宇欣,陈冬梅,等.枸杞籽油对小鼠睾丸支持细胞衰老模型的抗炎作用[J].山东大学学报(医学版),2020,58(12):15-22.
YANG Z J,WANG Y X,CHEN D M,et al.Effects of Lycium barbarum seed oil (LBSO) on anti-inflammation in the aging Sertoli cells of mice (TM4 cells)[J].Journal of Shandong University (Health Sciences),2020,58(12):15-22.
[15] 郑婕,薛旻秋,权洪峰,等.枸杞籽油对CUS致小鼠应激行为的保护作用[J].中国药理学通报,2019,35(1):110-116.
ZHENG J,XUE M Q,QUAN H F,et al.Beneficial effects of Lycium barbarum seed oil on chronically stressed mice[J].Chinese Pharmacological Bulletin,2019,35(1):110-116.
[16] 段雨劼,胡余明,姚松银,等.枸杞籽油和亚麻籽油混合物对小鼠增强免疫功能的影响[J].中国食品卫生杂志,2016,28(6):743-746.
DUAN Y J,HU Y M,YAO S Y,et al.Effects of mixture of lycium seed oil and flaxseed oil on immune function in mice[J].Chinese Journal of Food Hygiene,2016,28(6):743-746.
[17] 尹星星,王学红,田文慧,等.树莓粗多糖对UVB诱导HaCaT细胞光损伤的防护作用[J].中国生物化学与分子生物学报,2022,38(10):1359-1369.
YIN X X,WANG X H,TIAN W H,et al.Protective effects of raspberry crude polysaccharides on UVB-induced photodamage in HaCaT cells[J].Chinese Journal of Biochemistry and Molecular Biology,2022,38(10):1359-1369.
[18] KUNCHANA K,JARISARAPURIN W,CHULAROJMONTRI L,et al.Potential use of amla (Phyllanthus emblica L.) fruit extract to protect skin keratinocytes from inflammation and apoptosis after UVB irradiation[J].Antioxidants,2021,10(5):703.
[19] 段奕,倪昌雯,王敏华,等.7-羟基异黄酮对HaCaT细胞增殖活性和UVB诱导光损伤的影响[J].大理大学学报,2022,7(4):34-39.
DUAN Y,NI C W,WANG M H,et al.Effects of the 7-hydroxyisoflavone in the proliferative activity of HaCaT cells and UVB-induced photodamage[J].Journal of Dali University,2022,7(4):34-39.
[20] CHENG Y,WANG G Y,ZHAO L M,et al.Periplocymarin induced colorectal cancer cells apoptosis Via impairing PI3K/AKT pathway[J].Frontiers in Oncology,2021,11:753598.
[21] 张丽宏,傅云,廖建,等.甘草酸抑制UVB诱导HaCaT细胞凋亡的机制研究[J].西部中医药,2019,32(4):24-28.
ZHANG L H,FU Y,LIAO J,et al.Study on the mechanism of glycyrrhizic acid inhibiting HaCaT cellular apoptosis induced by UVB[J].Western Journal of Traditional Chinese Medicine,2019,32(4):24-28.
[22] 吴素萍.枸杞籽油功能及其制取[J].粮油加工与食品机械,2005(6):45-46.
WU S P.Function of Lycium barbarum seed oil and its preparation[J].Machinery for Cereals,Oil and Food Processing,2005(6):45-46.
[23] 杨张杰.枸杞籽油激活SIRT3改善亚急性衰老大鼠睾丸及支持细胞氧化应激的研究[D].银川:宁夏医科大学,2021.
YANG Z J.Effects of Lycium barbarum seed oil on alleviating oxidative stress of testis in sub-acutely aging rats and Sertoli cells(TM4) via SIRT3[D].Yinchuan:Ningxia Medical University,2021.
[24] 王姝畅.山茶籽油抗皮肤衰老作用及机制研究[D].上海:上海交通大学,2019.
WANG S C.Anti-aging effect and mechanism of Camellia oleifera oil[D].Shanghai:Shanghai Jiao Tong University,2019.
[25] VICENTINI F T M C,HE T Y,SHAO Y,et al.Quercetin inhibits UV irradiation-induced inflammatory cytokine production in primary human keratinocytes by suppressing NF-κB pathway[J].Journal of Dermatological Science,2011,61(3):162-168.
[26] 彭莺,刘福祯,高欣.天然植物甾醇的应用与提取工艺[J].化工进展,2002,21(1):49-53.
PENG Y,LIU F Z,GAO X.Research on and application of phytosterols[J].Chemical Industry and Engineering Progress,2002,21(1):49-53.
[27] GALLARDO V,MU OZ M,RU
OZ M,RU Z M A.Formulations of hydrogels and lipogels with vitamin E[J].Journal of Cosmetic Dermatology,2005,4(3):187-192.
Z M A.Formulations of hydrogels and lipogels with vitamin E[J].Journal of Cosmetic Dermatology,2005,4(3):187-192.
[28] 张春红,杨帆,杜锡贤,等.落新妇苷对永生化人角质形成细胞HaCaT增殖、凋亡的影响及机制探讨[J].山东医药,2015,55(46):20-22.
ZHANG C H,YANG F,DU X X,et al.Effects of astilbin on cell proliferation and apoptosis of human keratinocytes HaCaT and the mechanism[J].Shandong Medical Journal,2015,55(46):20-22.
[29] 张丽宏,傅云,廖建,等.甘草苷对中波紫外线诱导人皮肤角质形成细胞凋亡的影响[J].中国实验方剂学杂志,2018,24(6):96-101.
ZHANG L H,FU Y,LIAO J,et al.Effect of liquiritin on UVB-induced apoptosis of human keratinocytes[J].Chinese Journal of Experimental Traditional Medical Formulae,2018,24(6):96-101.
[30] 傅云.甘草苷对UVB诱导HaCaT细胞光老化的保护作用及机制研究[D].哈尔滨:黑龙江中医药大学,2018.
FU Y.Protective effects and the mechanism of liquiritini on UVB induced photoaging in HaCaT[D].Harbin:Heilongjiang University of Chinese Medicine,2018.
[31] 覃静净,樊卓,王丹丹,等.黄芩素对人表皮鳞癌A431细胞线粒体凋亡通路的影响[J].广西医学,2017,39(12):1895-1899.
QIN J J,FAN Z,WANG D D,et al.Effect of baicalein on mitochondrial apoptosis pathway in human epidermal squamous cell carcinoma A431 cells[J].Guangxi Medical Journal,2017,39(12):1895-1899.
[32] 孙琪,朴成玉,陈丹丹,等.补骨脂酚对UVB诱导HaCaT细胞凋亡因子p53和caspase-3表达的影响[J].中国美容医学,2017,26(7):37-40.
SUN Q,PIAO C Y,CHEN D D,et al.Effect of bacuchiol on UVB induced HaCaT cell apoptosis and p53,caspase-3 expression[J].Chinese Journal of Aesthetic Medicine,2017,26(7):37-40.
[33] MUZAFFER U,PAUL V I,PRASAD N R,et al.Juglans regia L.protects against UVB induced apoptosis in human epidermal keratinocytes[J].Biochemistry and Biophysics Reports,2018,13:109-115.
[34] ZHONG H,REN Z L,WANG X Y,et al.Stagewise keratinocyte differentiation from human embryonic stem cells by defined signal transduction modulators[J].International Journal of Biological Sciences,2020,16(8):1450-1462.
[35] GENDRISCH F,ESSER P R,SCHEMPP C M,et al.Luteolin as a modulator of skin aging and inflammation[J].BioFactors,2021,47(2):170-180.
[36] 张丽宏,傅云,王业秋,等.甘草酸对光老化HaCaT细胞的保护作用及炎症因子影响[J].中医药信息,2018,35(2):9-12.
ZHANG L H,FU Y,WANG Y Q,et al.Protective role of glycyrrhizic acid on light aging cells of HaCaT and its influence to inflammatory cytokines[J].Information on Traditional Chinese Medicine,2018,35(2):9-12.
[37] 苏牧楠,倪芳,张卫红,等.纳豆提取物对UVB诱导HaCaT细胞炎症因子表达的影响[J].香料香精化妆品,2020(5):56-59.
SU M N,NI F,ZHANG W H,et al.Influence of natto extract on the expression of inflammatory cytokines in HaCaT cells irradiated with UVB[J].Flavour Fragrance Cosmetics,2020(5):56-59.
[38] 张艳晴.铁皮石斛超滤组分体外抗光老化活性评价及机制初探[D].无锡:江南大学,2022.
ZHANG Y Q.Evaluation and preliminary study on the of anti-photoaging activity of ultrafiltration components of Dendrobium officinale in vitro[D].Wuxi:Jiangnan University,2022.