水产品中的游离氨基酸在脱羧酶脱羧作用下形成生物胺,主要有苯丙胺、腐胺、尸胺、组胺、酪胺和亚精胺等[1]。食用具有高含量的生物胺食品会导致人恶心呕吐、血压不正常和腹泻等不良症状,伤害神经和心血管系统,引起严重的公共健康和安全问题[2]。在水产品进行贮藏过程中,温度和时间是影响生物胺的重要因素,而低温条件有利于延缓水产品腐败和生物胺的积累[3]。王静玉等[4]认为生物胺可作为水产品新鲜度的重要指标,其研究表明腐胺、尸胺和酪胺与pH、TVBN、TBA、TVC呈高度相关并认为3种生物胺可作为南美白对虾的特征生物胺。
鳊鱼是一种产量较高的淡水鱼,2022年产量达到6 241万t,且富含优质蛋白质、不饱和脂肪酸和维生素D等物质,营养价值较高[5]。南美白对虾是产量最高、食用最广泛的虾类之一,是一种高蛋白、高矿物质、高不饱和脂肪酸且营养均衡的优质蛋白质源[6]。花蛤一般指菲律宾帘蛤,是一种浅海养殖贝类,具有蛋白质含量高,脂肪含量低,不饱和脂肪酸较高,易被人体消化吸收等优点,深受喜爱,近年来成为我国主要的海产养殖经济贝类之一[7]。分别选择鳊鱼、南美白对虾和花蛤探讨贮藏温度下生物胺的变化具有一定的代表性。
在食用过程中,贮藏是鱼虾贝类水产品加工过程的第一道重要工序,是鱼虾贝类加工的前提,它直接影响鱼虾贝类等水产品的品质与经济效益。在贮藏过程中水产品在微生物代谢酶的作用下使蛋白质发生降解、游离氨基酸流失,从而生物胺大量积累[8]。研究表明微生物、外界环境(pH、温度、盐含量等)及贮藏条件影响着鱼肉中生物胺的形成[9]。BILGIN等[10]认为水产品中生物胺含量的变化与pH、总挥发性盐基氮(total volatile basic nitrogen,TVBN)、硫代巴比妥酸(thiobarbituric acid,TBA)、菌落总数(total viable counts,TVC)等相关。本实验分析比较鳊鱼、南美白对虾和花蛤在4 ℃和25 ℃下贮藏过程中生物胺的变化,并对贮藏过程中生物胺和新鲜度指标(pH、TBA、TVBN、TVC)进行了皮尔逊相关分析,为生物胺的监测提供理论基础。
1 材料与方法
1.1 材料与试剂
鳊鱼[体重(1 400±100) g,体长(40.20±4.10) cm]、南美白对虾[体重(50±2) g,体长(12.7±1.30) cm],花蛤(均匀大小),均为鲜活产品,上海市浦东新区南汇新城镇黄卫兴水产店。
9种生物胺标准品、丹磺酰氯(dansyl chloride,DNS-Cl)、乙腈(HPLC)、乙醚(AR)和三氯甲烷(AR)、丙酮(AR)、正丁醇(AR)、正己烷(AR)、氨水(AR)(250 g/L)和乙酸铵(HPLC)。
1.2 仪器与设备
Waters2685高效液相色谱仪、Symmetry C18(柱长250 mm,柱内径4.6 mm,柱填料粒径5 μm),美国Waters公司;H2050R高速冷冻离心机,长沙湘仪有限公司;Kjeltec2300全自动凯氏定氮仪,丹麦FOSS公司。
1.3 实验方法
1.3.1 样品制备
鳊鱼、南美白对虾和花蛤购买后低温1 h以内运回实验室,保证其鲜活。将鳊鱼去头、去内脏、去皮后取背肉;南美白对虾去头和虾线后取样;花蛤去壳后取样。样品均保存于聚乙烯袋中。放入-80 ℃冰箱备用。
1.3.2 pH,TBA,TVBN和菌落总数的测定
pH的测定参考GB 5009.237—2016中水产品中牡蛎pH的测定和ZHANG等[11]方法并略作修改,称取5.00 g样品,加入50 mL蒸馏水进行均质,并在10 000 r/min的条件下离心10 min,过滤取上清液测定pH。
TBA的测定参考FAUSTMAN等[12]的方法进行测定。
TVBN的测定参考GB 5009.228—2016方法测定[13]。
TVC的测定参考GB 4789.2—2016方法[14]略作修改。称取样品2.00 g,加入18 mL无菌生理盐水(8.5 g/L)均质2 min后,用生理盐水进行10倍稀释,取1 mL连续稀释液涂于平板计数琼脂上,37 ℃下培养48 h,结果以lg CFU/g表示。
1.3.3 生物胺的测定
根据GB 5009.208—2016食品中生物胺测定方法并参考DONG等[15]方法略作修改。称5.00 g的样品与20 mL TCA溶液(50 g/L)混合均质2 min,超声30 min,离心10 min(5 000 r/min)。将上清液转移至50 mL容量瓶中,并用TCA溶液定容。移取上述提取液10 mL,加入10 mL正己烷除去脂肪,超声10 min后静置分层,弃去上层有机相。移取5 mL除脂后的溶液并振荡混匀超声10 min后,离心5 min (8 000 r/min)。收集上清液,用NaOH(2 mol/L)将溶液pH调节至12,超声5 min,待衍生。
参考WANG等[16]方法并略作修改,分别移取上述提取液和混标液各1.0 mL,依次加入1 mL饱和NaHCO3溶液、100 μL 1 mol/L NaOH溶液和1 mL DNS-Cl溶液(10 mg/mL,溶于丙酮),振荡混匀,超声2 min后于60 ℃水浴反应30 min。衍生完毕后,加入200 μL氨水(25%),超声1 min,避光静置30 min以终止衍生。再向溶液中分别加入0.5 g NaCl,超声至其溶解,加入5 mL乙醚,振荡混匀,超声2 min,静置分层,吸出上层有机相(乙醚层),在40 ℃水浴吹干,加入1 mL乙腈超声至残留物溶解,过0.22 μm滤膜至进样瓶,待测。
高效液相梯度洗脱程序,如表1所示。
表1 生物胺分析的梯度洗脱程序
Table 1 Gradient elution program for biogenic amine analysis
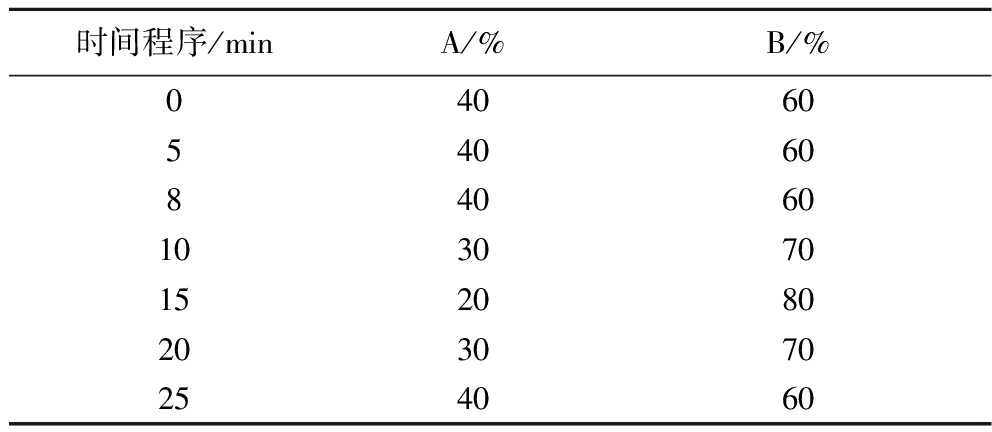
时间程序/minA/%B/%040605406084060103070152080203070254060
注:A:10 mmol/L乙酸铵溶液;B:乙腈。
1.3.4 研究方法
根据测定鳊鱼、南美白对虾和花蛤的生物胺含量结果,将鳊鱼、南美白对虾和花蛤进行贮藏实验。根据不同贮藏温度下生物胺及新鲜度指标的产生过程,在4 ℃下(0、2、4、6、8 d)和25 ℃(0、0.5、1、1.5、2 d)测定3种水产品中生物胺的含量及相关新鲜度指标的变化,以确定3种水产品在不同贮藏条件下的安全性变化。鳊鱼在4 ℃贮藏下记为B4,在25 ℃贮藏记为B25;南美白对虾在4 ℃贮藏下记为X4,在25 ℃贮藏记为X25;花蛤在4 ℃贮藏下记为H4,在25 ℃贮藏记为H25。
1.4 数据分析
Origin lab 2019绘图,Excel 2010和SPSS 26.0软件分析单因素,P<0.05为差异显著,P>0.05为差异不显著。
2 结果与分析
2.1 生物胺的变化
生物胺是由微生物通过脱羧、转胺化等酶促反应代谢游离氨基酸而产生[17],与水产品品质及货架期有关。鳊鱼、南美白对虾和花蛤在4 ℃与25 ℃贮藏条件下生物胺变化如图1和图2所示。
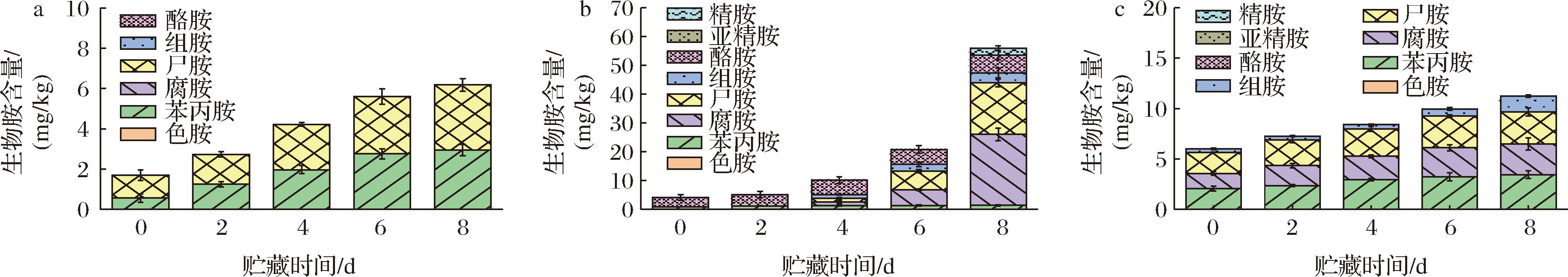
a-鳊鱼;b-南美白对虾;c-花蛤
图1 鳊鱼、南美白对虾和花蛤在4 ℃贮藏条件下生物胺的变化
Fig.1 Changes of biogenic amines of bream,white shrimp,and clam under storage at 4 ℃
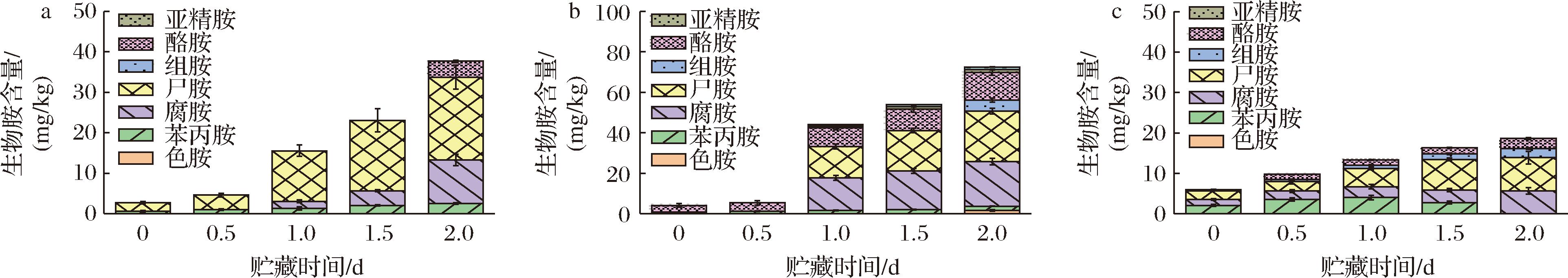
a-鳊鱼;b-南美白对虾;c-花蛤
图2 鳊鱼、南美白对虾和花蛤在25 ℃贮藏条件下生物胺的变化
Fig.2 Changes of biogenic amines of bream,white shrimp,and clam under storage at 25 ℃
由图1-a可知,在4 ℃贮藏条件下,鳊鱼中只检测到了苯丙胺和尸胺,贮藏8 d时,尸胺含量达到了3.24 mg/kg,生物胺总量由1.70 mg/kg增加到了6.18 mg/kg;由图2-a可知,鳊鱼在25 ℃贮藏2 d,生物胺种类由2种(苯丙胺、尸胺)增加到了4种(苯丙胺、尸胺、腐胺和酪胺),总量由1.7 mg/kg增加到了37.69 mg/kg,其中腐胺、尸胺和酪胺贮藏2 d的含量分别达到了10.76、20.51和2.48 mg/kg。相比之下,苯丙胺的增长较为缓慢,最终总含量为3.94 mg/kg。
由图1-b可知,在4 ℃贮藏条件下,南美白对虾中检出苯丙胺、酪胺、组胺、尸胺、腐胺和精胺,贮藏8 d时,南美白对虾中的生物胺总量由4.05 mg/kg增长到55.91 mg/kg。其中,腐胺、尸胺和酪胺的积累量相对较大(P<0.05),最终含量分别达到24.65、17.87和6.00 mg/kg;而苯丙胺、组胺和精胺的含量都缓慢增加,最终含量分别为1.37、3.42和2.34 mg/kg;由图2-b可知而南美白对虾在25 ℃贮藏时,其生物胺总量在2 d就达到了72.52 mg/kg。其中,腐胺、尸胺和酪胺的积累量显著增加(P<0.05),2 d的最终含量分别达到22.02、25.02和13.76 mg/kg;苯丙胺和色胺最终含量为2.13、1.56 mg/kg;在2 d时检测到组胺,其含量达到5.45 mg/kg。
由图1-c可知,在4 ℃贮藏条件下,新鲜花蛤中检出苯丙胺、腐胺、尸胺和微量组胺,贮藏8 d时,花蛤中的生物胺总量由6.00 mg/kg增长到了11.25 mg/kg,其中苯丙胺、腐胺和尸胺积累量相对较大,最终含量分别为3.45、3.04和3.18 mg/kg,组胺最终含量为1.58 mg/kg。由图2-c可知,花蛤在25 ℃贮藏条件下贮藏2 d,生物胺含量由6.00 mg/kg增加到了21.35 mg/kg,其中腐胺、尸胺的积累量显著增加(P<0.05),最终含量达到了5.68和8.25 mg/kg,而苯丙胺在贮藏1.5 d时消失,最终含量为2.76 mg/kg,酪胺在贮藏0.5 d时出现,最终含量为2.45 mg/kg,组胺含量随着贮藏时间的延长而缓慢上升,最终含量为2.21 mg/kg。
综上所述,在4 ℃贮藏条件下,生物胺总量排序为:南美白对虾>花蛤>鳊鱼;在25 ℃贮藏条件下,生物胺总量排序为:南美白对虾>鳊鱼>花蛤。在贮藏过程中生物胺含量的增加,这可能是因为微生物随着贮藏时间的延长而快速生长,产生大量游离氨基酸,为氨基酸脱羧反应提供了大量底物,进而导致生物胺含量的增加[18]。而无论在何种贮藏条件下贮藏,虾肉中的生物胺含量都是最高的,这可能是由于虾肉中的游离氨基酸含量高于鱼肉和贝肉,随着贮藏时间的延长,内源性和外源性氨基酸脱羧酶作用于游离氨基酸上形成生物胺并不断积累[19],因此虾类产生的生物胺总量远高于鱼类和贝类。
在贮藏中期,鳊鱼和花蛤中检测出酪胺,酪胺的产生和积累可能是因为贮藏后期出现乳酸菌大量生长,产生酪氨酸脱羧酶而发生脱羧作用[20]。在花蛤和南美白对虾中检测出少量组胺,可能是由于贮藏条件及原料的影响,但最终含量均未超过标准限量值(30 mg/kg),这可能是由于前体氨基酸相对较低,所以其组胺含量形成相对较低[1,21]。
JIA等[22]研究表明鲢鱼在4 ℃贮藏下,组胺、尸胺和腐胺变化最明显,而本实验中鳊鱼中是腐胺和尸胺变化显著,其次是酪胺,这可能与原料、贮藏条件及微生物种类有关。生物胺与微生物代谢酶有关,而微生物的生长又与外界环境有关[23]。由以上分析可知,贮藏条件强烈影响着水产品中生物胺水平。
2.2 贮藏过程中pH、TVBN、TBA、TVC的变化
2.2.1 pH
由图3可知,随着贮藏时间的延长,鳊鱼和南美白对虾的pH不断上升,pH范围为6.7~7.1。pH的升高可能与微生物大量繁殖生长使TVBN、生物胺等含氮类碱性物质含量增加有关[24]。YU等[25]也有类似的研究结果,即草鱼在贮藏后期pH呈上升趋势。而新鲜花蛤的pH值为7.02±0.02,接近中性,符合新鲜肌肉组织特性。随着贮藏时间的延长,花蛤的pH不断下降。在25 ℃贮藏2 d降低到5.44,在4 ℃贮藏8 d降低到6.28。花蛤中的pH降低可能是因为贝类肌肉中的糖原酵解产生乳酸以及三磷酸腺苷等物质分解产生磷酸等酸性物质,导致pH值下降[26]。pH≤5.2,则认为贝肉已经开始腐坏,不可食用[27]。综上所述,可以通过pH的变化来评价水产品的新鲜度,但影响pH变化的因素过多,要结合其他的指标综合评价。
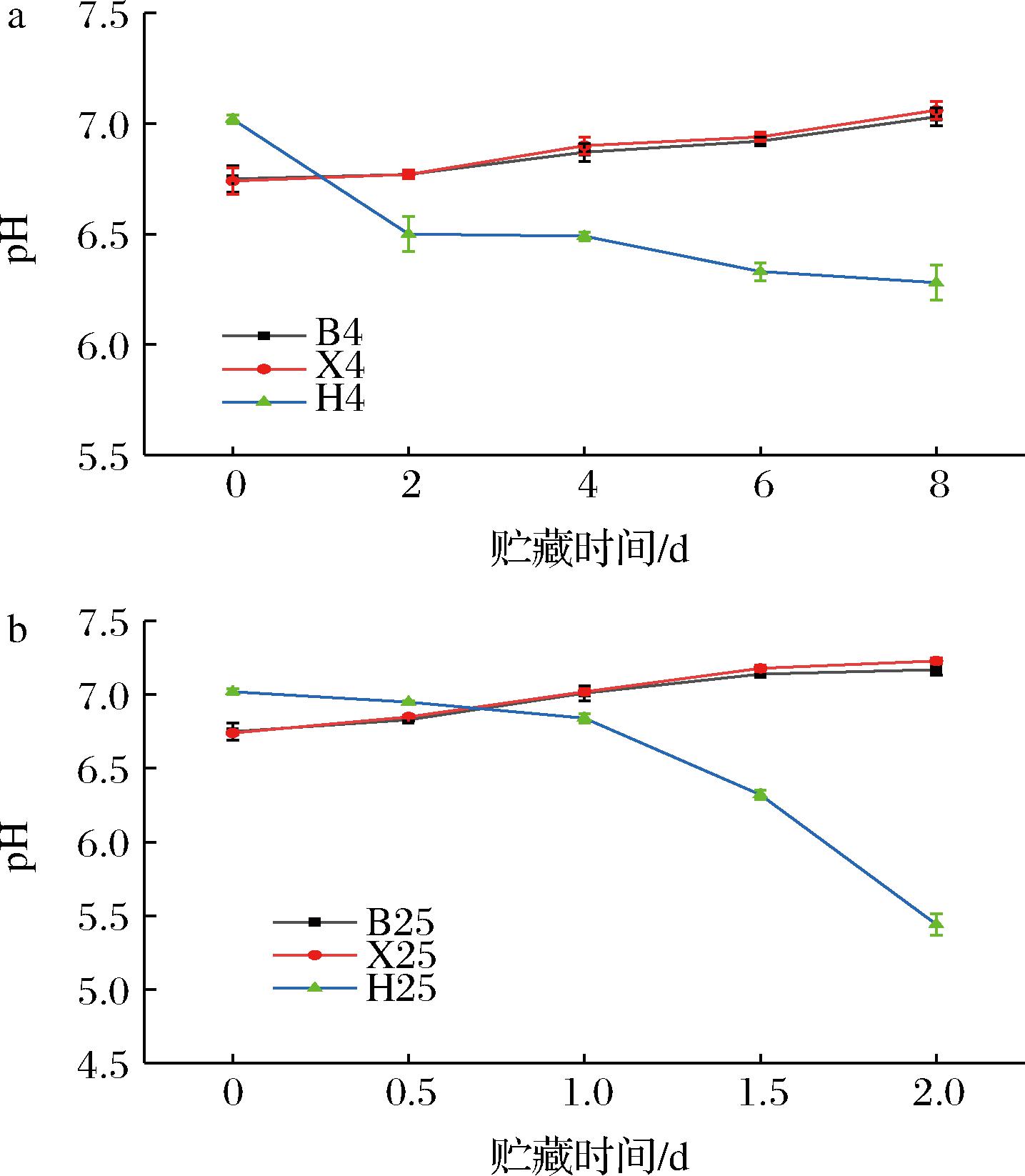
a-4 ℃;b-25 ℃
图3 鳊鱼、南美白对虾和花蛤在4 ℃和25 ℃贮藏条件下pH的变化
Fig.3 pH changes of bream,white shrimp,and clam under storage conditions of 4 ℃ and 25 ℃
2.2.2 TVBN
在贮藏过程中,蛋白质在微生物、酶的作用下,产生氨、胺类等含氮的碱性有毒物质,它们以TVBN的形式存在与水产品中,其含量可作为评价水产品的一项重要指标[28]。鱼虾贝类是高蛋白低脂肪的水产品,在贮藏过程中容易发生微生物生长,腐败等品质变化,导致TVBN含量直线上升[29]。根据GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》,淡水鱼虾TVBN新鲜临界值为20 mg/kg,贝类TVBN新鲜临界值为15 mg/kg。由图4-a可知,在4 ℃贮藏条件下,南美白对虾和花蛤分别在第6天和第8天超过新鲜临界值;由图4-b可知,在25 ℃贮藏条件下,鳊鱼、南美白对虾和花蛤分别在第1天、第1.5天和第1天超过新鲜临界值。从TVBN含量可以看出,4 ℃贮藏这3种水产品比25 ℃贮藏可延长6 d。LI等[30]认为TVBN的增加与贮藏温度、时间及微生物的分解作用有关。这可能是由于低温抑制了微生物的生长和繁殖从而抑制或减缓了微生物读蛋白质的降解和腐败作用[31],使得在4 ℃贮藏条件下TVBN增加趋势较慢。这一结果与郝若伊等[32]研究表明4 ℃贮藏条件下可有效抑制鲍鱼中的TVBN含量增加的结果相吻合。
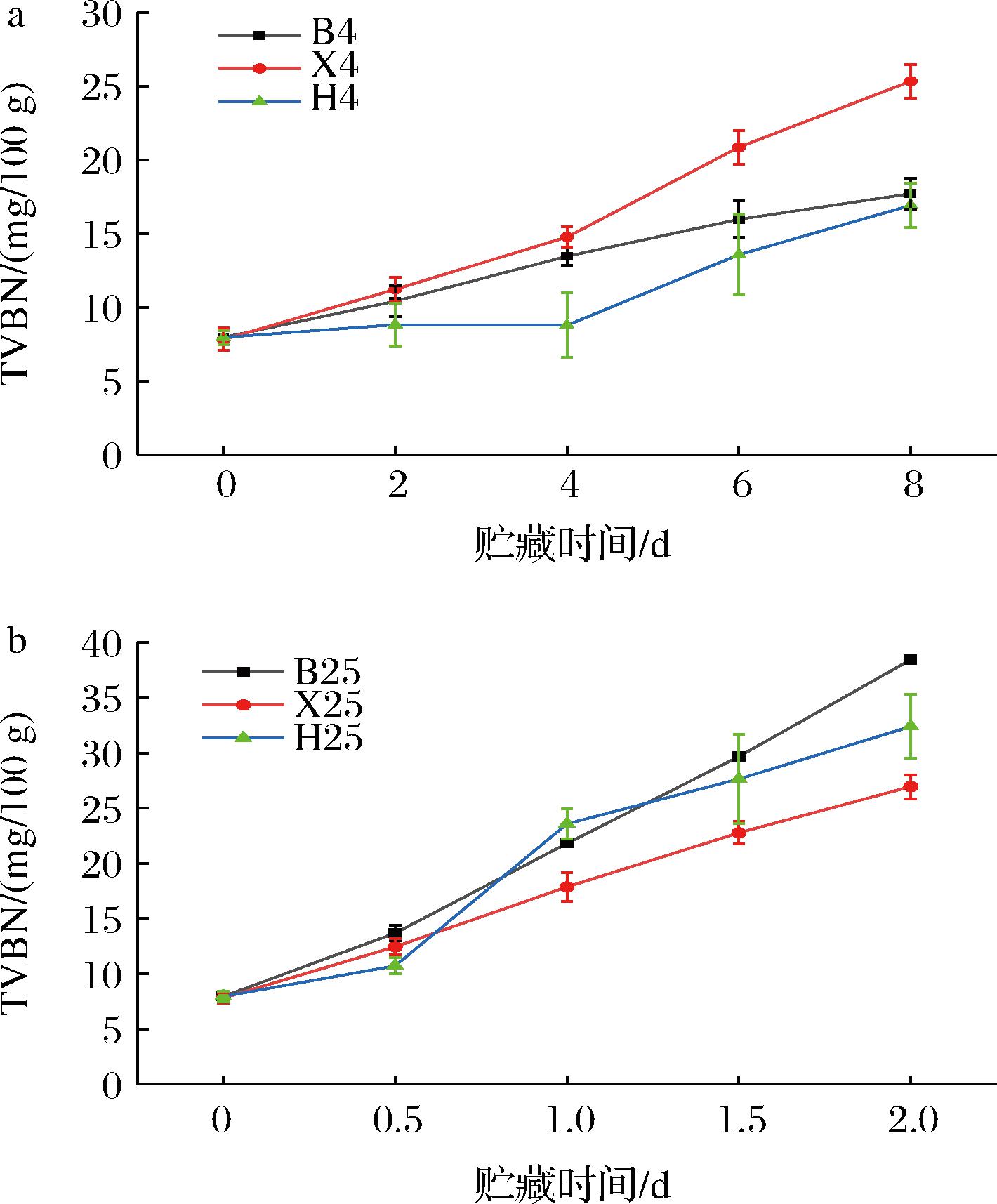
a-4 ℃;b-25 ℃
图4 鳊鱼、南美白对虾和花蛤在4 ℃和25 ℃贮藏条件下TVBN的变化
Fig.4 Changes of TVBN of bream,white shrimp,and clam under storage conditions of 4 ℃ and 25 ℃
2.2.3 TBA
TBA是反映水产品及水产制品中脂质氧化的一个重要指标,其大小与脂肪氧化和酸败程度成正相关[33]。鱼肉中的TBA>1 mg MDA/kg时会产生难以接受的气味[34]。由图5-a可知,鳊鱼、南美白对虾和花蛤在4 ℃下贮藏0~8 d,其TBA增长较慢,在第8天时分别达到了(1.265±0.04)、(2.45±0.05)、(2.185±0.11) mg MDA/kg。由图5-b可知,鳊鱼25 ℃贮藏2 d时TBA达到了(2.407±0.18) mg MDA/kg。花蛤在25 ℃贮藏2 d TBA达到了(2.407±0.18) mg MDA/kg。这与鲁珺[35]研究表明温度升高可加速脂质氧化的结果一致。在25 ℃贮藏条件下,南美白对虾TBA在1.5 d 前显著升高(P<0.05),可能因为虾肉中不饱和脂肪酸的氧化产物丙二醛与胺类、蛋白质或其他脂质氧化副产物醛类之间的相互作用[36]。
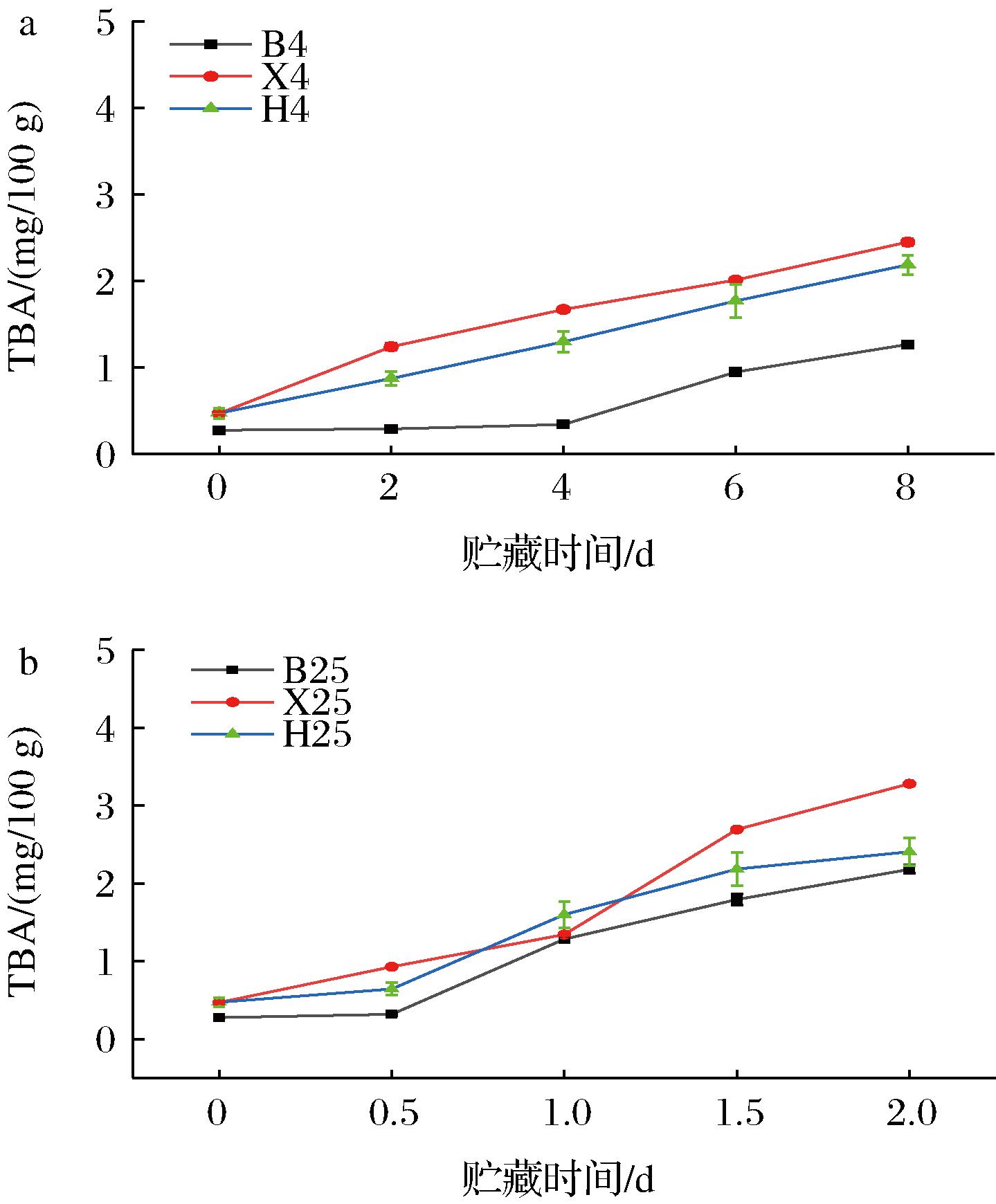
a-4 ℃;b-25 ℃
图5 鳊鱼、南美白对虾和花蛤在4 ℃和25 ℃贮藏条件下TBA的变化
Fig.5 Changes of TBA of bream,white shrimp,and clam under storage conditions of 4 ℃ and 25 ℃
2.2.4 TVC
TVC是检测水产品腐败程度的重要指标[37],水产品中的蛋白质被氧化分解后产生的大量游离氨基酸,会促进微生物的大量繁殖[38]。水产品菌落总数限量标准为6 lg CFU/g[39]。新鲜鳊鱼、南美白对虾和花蛤的初始菌落总数TVC分别为(3.59±0.08) lg CFU/g、(3.70±0.06) lg CFU/g、(3.89±0.12) lg CFU/g,品质良好。由图6-a可知,在4 ℃贮藏条件下,3种水产品分别在第6天(5.67 lg CFU/g)和第8天(5.37 lg CFU/g)接近水产品菌落总数限量值(6 lg CFU/g)。由图6-b可知,在25 ℃贮藏条件下,3种水产品的贮藏时间排序为:花蛤(1.5 d)>鳊鱼(1 d)>南美白对虾(0.5 d)。根据微生物指标可以看出,低温能够抑制微生物的生长繁殖,使水产品中的菌落数目降低,根据TVC临界值,可以得出4 ℃比25 ℃贮藏条件下可使鱼虾贝类等水产品的货架期延长6 d。
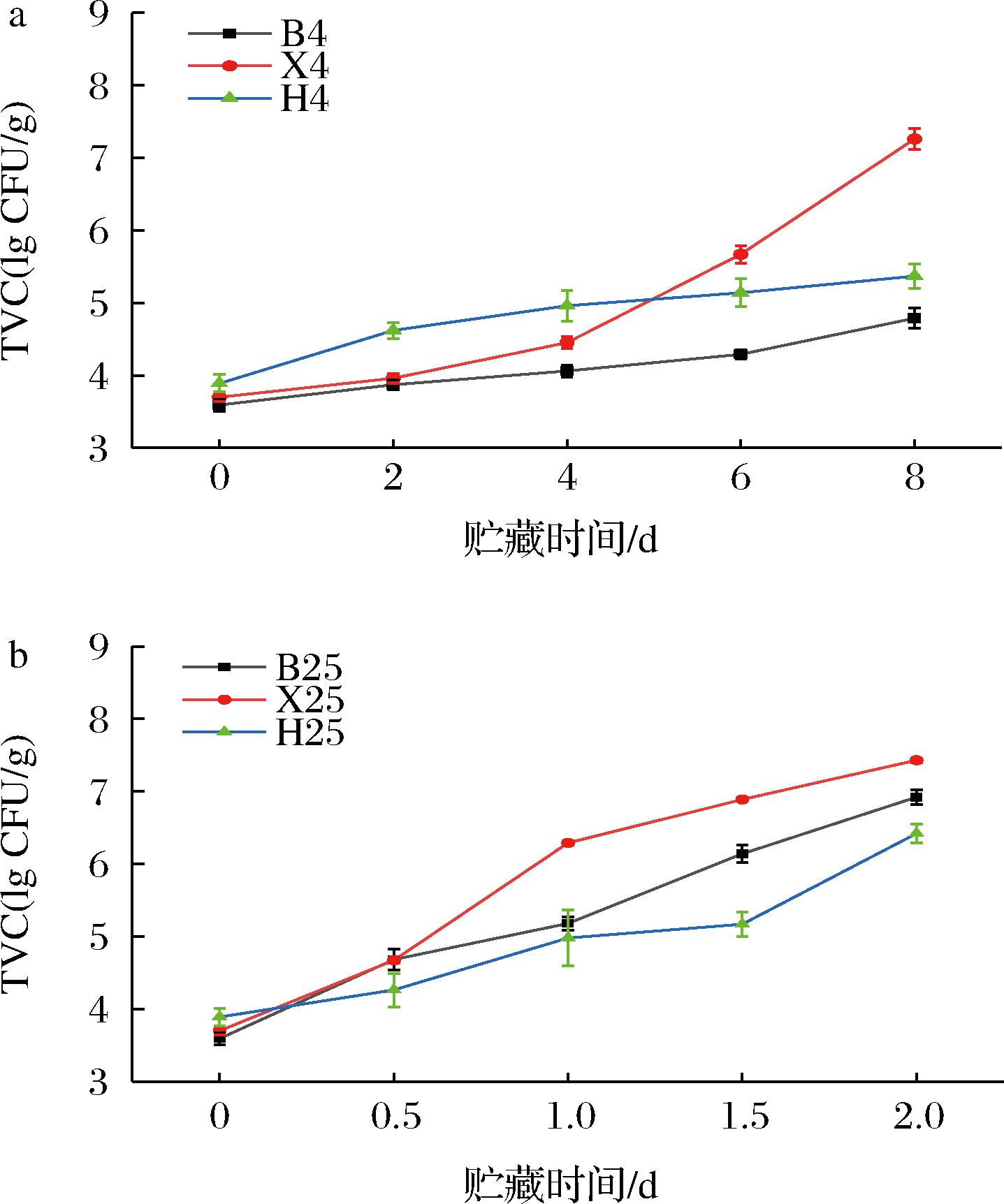
a-4 ℃;b-25 ℃
图6 鳊鱼、南美白对虾和花蛤在4 ℃和25 ℃贮藏条件下TVC的变化
Fig.6 Changes of TVC of bream,white shrimp,and clam under storage conditions of 4 ℃ and 25 ℃
2.3 贮藏过程中生物胺含量与pH、TVBN、TBA、TVC的相关性
由表2可知,在4 ℃贮藏条件下,鳊鱼中苯丙胺和尸胺与TBA和TVC均表现出显著相关性(P<0.05),与pH和TVBN表现出极显著相关性(P<0.01);生物胺总量则与pH、TVBN、TBA和TVC均表现出极显著相关性(P<0.01),因此将苯丙胺和尸胺作为其特征生物胺;南美白对虾中腐胺、尸胺、酪胺、精胺、亚精胺和生物胺总量与pH、TVBN、TBA、和TVC均表现出显著相关性(P<0.05),相关系数高于0.779;组胺与TVBN、TBA和TVC表现出极显著相关性(P<0.01),而与pH无相关性,因此可将腐胺、尸胺、酪胺、精胺、亚精胺和生物胺总量作为南美白对虾在4 ℃条件下贮藏中的货架期参考指标;花蛤中的色胺、腐胺、尸胺、组胺和生物胺总量均与pH、TVBN、TVC、TBA表现出显著相关性(P<0.05),相关系数高于0.837;酪胺与pH无相关性,与TVBN、TVC、TBA表现出显著相关。因此,可将色胺、腐胺、尸胺、组胺和生物胺总量作为花蛤在4 ℃贮藏条件下的特征生物胺。
表2 4 ℃贮藏条件下鳊鱼和南美白对虾中生物胺含量与pH、TVBN、TBA和TVC的相关性
Table 2 Correlation between biogenic amine content and pH,TVBN,TBA,and TVC in bream and Penaeus vannamei at 4 ℃
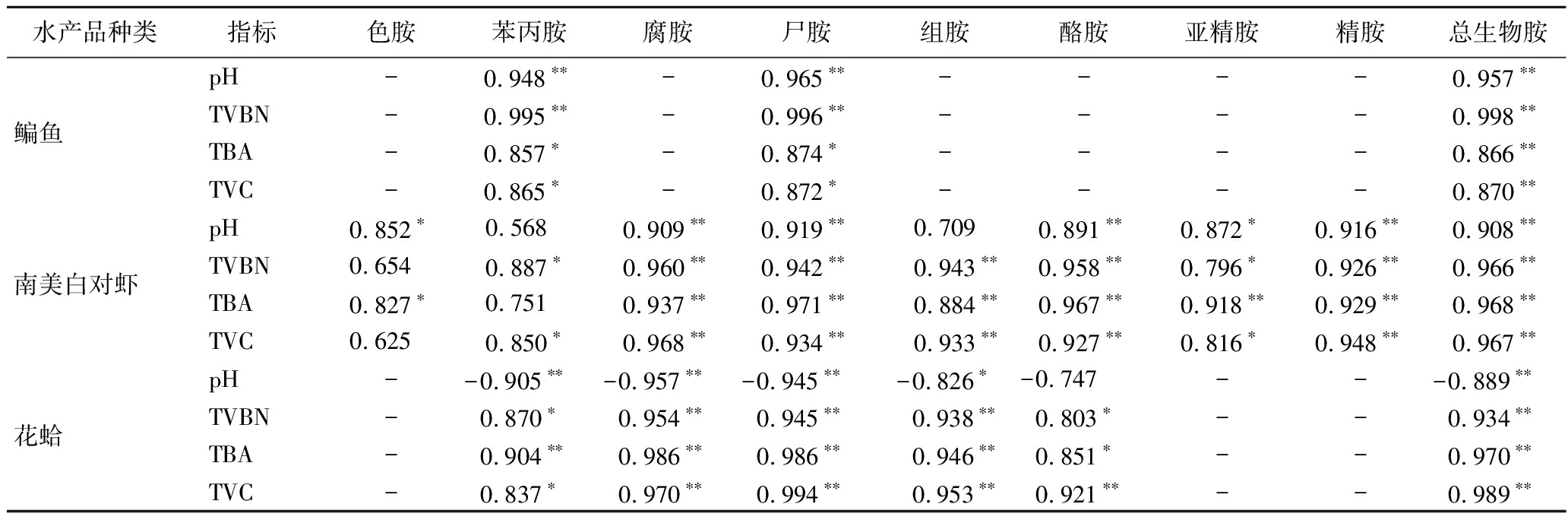
水产品种类指标色胺苯丙胺腐胺尸胺组胺酪胺亚精胺精胺总生物胺鳊鱼pH-0.948∗∗-0.965∗∗----0.957∗∗TVBN-0.995∗∗-0.996∗∗----0.998∗∗TBA-0.857∗-0.874∗----0.866∗∗TVC-0.865∗-0.872∗----0.870∗∗南美白对虾pH0.852∗0.568 0.909∗∗0.919∗∗0.7090.891∗∗0.872∗0.916∗∗0.908∗∗TVBN0.6540.887∗0.960∗∗0.942∗∗0.943∗∗0.958∗∗0.796∗0.926∗∗0.966∗∗TBA0.827∗0.7510.937∗∗0.971∗∗0.884∗∗0.967∗∗0.918∗∗0.929∗∗0.968∗∗TVC0.6250.850∗0.968∗∗0.934∗∗0.933∗∗0.927∗∗0.816∗0.948∗∗0.967∗∗花蛤pH--0.905∗∗ -0.957∗∗ -0.945∗∗ -0.826∗-0.747 ---0.889∗∗ TVBN-0.870∗0.954∗∗0.945∗∗0.938∗∗0.803∗--0.934∗∗TBA-0.904∗∗0.986∗∗0.986∗∗0.946∗∗0.851∗--0.970∗∗TVC-0.837∗0.970∗∗0.994∗∗0.953∗∗0.921∗∗--0.989∗∗
注:-表示无相关性;**表示有极显著相关性(P<0.01);*表示有显著相关性(P<0.05)(下同)。
由表3可知,在25 ℃贮藏条件下,鳊鱼中苯丙胺、腐胺、尸胺和生物胺总量与pH、TVBN、TBA和TVC均表现出极显著相关性(P<0.01)。其中的酪胺与pH和TVC表现出显著相关性(P<0.05),与TVBN和TBA则表现出极显著相关性(P<0.01),说明在25 ℃贮藏条件下,可将苯丙胺、腐胺、尸胺和生物胺总量作为鳊鱼25 ℃贮藏条件下的货架期参考指标。南美白对虾中苯丙胺、腐胺、尸胺、组胺、酪胺、精胺、亚精胺和生物胺总量与pH、TVBN、TBA和TVC均表现出显著相关性(P<0.05),相关系数高于0.761;色胺与TBA和TVC无相关性,因此可将苯丙胺、腐胺、尸胺、组胺、酪胺、精胺、亚精胺和生物胺总量作为南美白对虾25 ℃条件下贮藏中的货架期参考指标。在25 ℃贮藏条件下,花蛤中的腐胺、尸胺、组胺和生物胺总量均与pH、TVBN、TBA、TVC表现出极显著相关性(P<0.01),酪胺与pH表现为显著相关性(P<0.05),与TVBN、TBA、TVC表现为极显著相关性(P<0.01),而苯丙胺与TVBN和TBA无显著相关性,因此,可以将苯丙胺、腐胺、尸胺、组胺和生物胺总量作为花蛤在25 ℃条件下贮藏的货架期参考指标。
表3 25 ℃贮藏条件下鳊鱼和南美白对虾中生物胺含量与pH、TVBN、TBA和TVC的相关性
Table 3 Correlation between biogenic amine content and pH,TVBN,TBA,and TVC in bream and Penaeus vannamei at 25 ℃
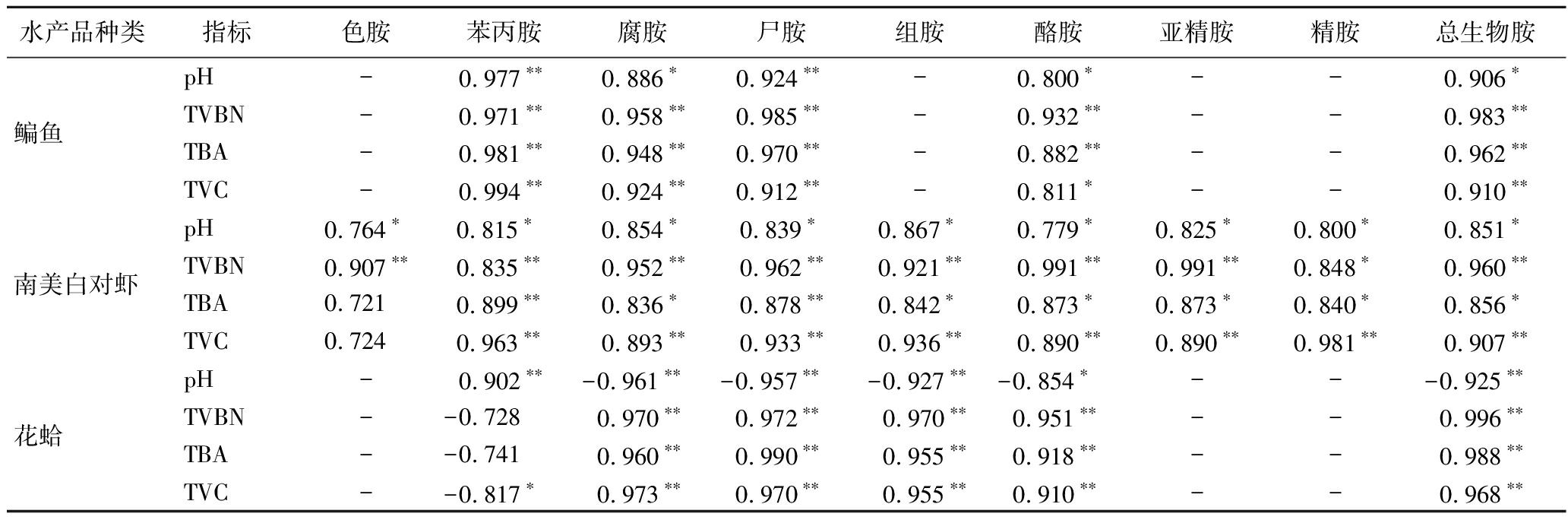
水产品种类指标色胺苯丙胺腐胺尸胺组胺酪胺亚精胺精胺总生物胺鳊鱼pH-0.977∗∗0.886∗0.924∗∗-0.800∗--0.906∗TVBN-0.971∗∗0.958∗∗0.985∗∗-0.932∗∗--0.983∗∗TBA-0.981∗∗0.948∗∗0.970∗∗-0.882∗∗--0.962∗∗TVC-0.994∗∗0.924∗∗0.912∗∗-0.811∗--0.910∗∗南美白对虾pH0.764∗0.815∗ 0.854∗0.839∗0.867∗0.779∗0.825∗0.800∗0.851∗TVBN0.907∗∗0.835∗∗0.952∗∗0.962∗∗0.921∗∗0.991∗∗0.991∗∗0.848∗0.960∗∗TBA0.7210.899∗∗0.836∗0.878∗∗0.842∗0.873∗0.873∗0.840∗0.856∗TVC0.7240.963∗∗0.893∗∗0.933∗∗0.936∗∗0.890∗∗0.890∗∗0.981∗∗0.907∗∗花蛤pH-0.902∗∗-0.961∗∗ -0.957∗∗ -0.927∗∗-0.854∗ ---0.925∗∗ TVBN--0.7280.970∗∗0.972∗∗0.970∗∗0.951∗∗--0.996∗∗TBA--0.7410.960∗∗0.990∗∗0.955∗∗0.918∗∗--0.988∗∗TVC--0.817∗0.973∗∗0.970∗∗0.955∗∗0.910∗∗--0.968∗∗
目前在GB 2733—2015《食品安全国家标准 鲜、冻动物性水产品》中,关于鲜度的理化指标仅有组胺限量和挥发性盐基氮含量限量。在本实验中,不仅以组胺含量的变化和挥发性盐基氮含量的变化为检测指标,而且还检测出其他胺类具有显著变化,且与pH、TVBN、TVC、TBA等均有显著相关性。对于水产品鲜度的检测提供了更多的可行性方法。
3 结论
冷藏条件(4 ℃)下贮藏,鳊鱼中只有苯丙胺和尸胺,且含量增加显著;南美白对虾中含量变化显著的生物胺为腐胺和尸胺;花蛤中变化显著的生物胺为腐胺、尸胺和组胺。常温条件(25 ℃)下贮藏,鳊鱼、南美白对虾中主要生物胺为腐胺、尸胺和酪胺,花蛤中主要生物胺为腐胺和酪胺,且随着时间延长,虾类产生的生物胺总量远远高于鱼类和贝类。鳊鱼、南美白对虾和花蛤的TVBN、TBA、TVC随着贮藏时间的延长呈上升趋势,而花蛤中的pH随着贮藏时间的延长而呈下降趋势,鳊鱼和南美白对虾对pH呈上升趋势。按照微生物指标判定鳊鱼、南美白对虾和花蛤在25 ℃贮藏条件下的可食期为1~1.5 d;在4 ℃贮藏条件下的可食期为6~8 d。说明在冷藏条件下,鱼虾贝类的可食期可延长5~6 d。鳊鱼中苯丙胺和尸胺含量均与pH、TVBN、TBA和TVC呈显著相关性,可作为鳊鱼贮藏过程中新鲜度指标;南美白对虾中腐胺、尸胺、酪胺和生物胺总量的变化与pH、TVBN、TBA和TVC呈现显著相关性,可作为南美白对虾在贮藏过程中新鲜度指标;花蛤中腐胺、尸胺、组胺和生物胺总量与pH、TVBN、TVC和TBA呈现显著相关性,可作为花蛤在贮藏条件下新鲜度指标。本研究为鳊鱼、南美白对虾和花蛤在冷藏(4 ℃)和常温(25 ℃)不同贮藏温度下的最佳货架期提供了有效风险监测和新鲜度指标依据。
[1] 顾会咏,甘伯中,任发政,等.Lactobacillus salivarius REN菌株的产胺测定与抗生素耐药性评价[J].甘肃农业大学学报,2013,48(4):124-130.
GU H Y,GAN B Z,REN F Z,et al.Evoluation of biogenic amine productivity and antibiotic resistance of Lactobacillus salivarius REN[J].Journal of Gansu Agricultural University,2013,48(4):124-130.
[2] LIU B,CAO Z N,QIN L H,et al.Investigation of the synthesis of biogenic amines and quality during high-salt liquid-state soy sauce fermentation[J].LWT,2020,133:109835.
[3] HU Y,HUANG Z Y,LI J,et al.Concentrations of biogenic amines in fish,squid and octopus and their changes during storage[J].Food Chemistry,2012,135(4):2604-2611.
[4] 王静玉,曲映红,刘志东,等.不同贮藏条件下南美白对虾中生物胺的变化[J].食品与发酵工业,2021,47(6):42-48.
WANG J Y,QU Y H,LIU Z D,et al.Changes of biogenic amines in white shrimp (Litopenaeus vannamei) at different storage conditions[J].Food and Fermentation Industries,2021,47(6):42-48.
[5] 丁亚涛,汪之和,王林林,等.MS-222对鳊鱼麻醉保活运输效果的研究[J].水产科学,2019,38(3):296-304.
DING Y T,WANG Z H,WANG L L,et al.Effect of MS-222 on survival of bream fish during anaesthesia transportation[J].Fisheries Science,2019,38(3):296-304.
[6] DAI W L,GU S Q,XU M J,et al.The effect of tea polyphenols on biogenic amines and free amino acids in bighead carp (Aristichthys nobilis) fillets during frozen storage[J].LWT-Food Science and Technology,2021,150:111933.
[7] ZHOU Z,ZHANG Y Y,GAO J X,et al.Metabolomic approaches to analyze the seasonal variations of amino acid,5′-nucleotide,and lipid profile of clam (Ruditapes philippinarum)[J].LWT,2021,148:111709.
[8] 张立飞,孙明浩,华成黎,等.发酵食品中生物胺的形成、检测及其防控策略的研究进展[J].食品与发酵工业,2023,49(3):329-339.
ZHANG L F,SUN M H,HUA C L,et al.Research progress on the production,detection and prevention of biogenic amine in fermented food[J].Food and Fermentation Industries,2023,49(3):329-339.
[9] 何璇,马堃,哈斯,等.食品中生物胺形成与抑制的研究进展[J].食品与发酵工业,2021,47(18):294-300.
HE X,MA K,HA S,et al.Research progress on the formation and inhibition of biogenic amines in food[J].Food and Fermentation Industries,2021,47(18):294-300.
[10] BILGIN B,GENÇCELEP H.Determination of biogenic amines in fish products[J].Food Science &Biotechnology,2015,24(5):1907-1913.
[11] ZHANG Q L,LIN S L,NIE X H.Reduction of biogenic amine accumulation in silver carp sausage by an amine-negative Lactobacillus plantarum[J].Food Control,2013,32(2):496-500.
[12] FAUSTMAN C,SPECHT S M,MALKUS L A,et al.Pigment oxidation in ground veal:Influence of lipid oxidation,iron and zinc[J].Meat Science,1992,31(3):351-362.
[13] WANG R F,HU X Y,AGYEKUMWAA A K,et al.Synergistic effect of kojic acid and tea polyphenols on bacterial inhibition and quality maintenance of refrigerated sea bass (Lateolabrax japonicus) fillets[J].LWT,2021,137:110452.
[14] RAMEZANI Z,ZAREI M,RAMINNEJAD N.Comparing the effectiveness of chitosan and nanochitosan coatings on the quality of refrigerated silver carp fillets[J].Food Control,2015,51:43-48.
[15] DONG H,XIAO K J.Modified QuEChERS combined with ultra high performance liquid chromatography tandem mass spectrometry to determine seven biogenic amines in Chinese traditional condiment soy sauce[J].Food Chemistry,2017,229(15):502-508.
[16] WANG J Y,LIU Z D,QU Y H.Ultrasound-assisted dispersive solid-phase extraction combined with reversed-phase high-performance liquid chromatography-photodiode array detection for the determination of nine biogenic amines in canned seafood[J].Journal of Chromatography A,2021,1636:461768.
[17] GUO Y Y,YANG Y P,PENG Q et al.Biogenic amines in wine:A review[J].International Journal of Food Science &Technology,2015,50(7):1523-1532.
[18] MAKARIOS-LAHAM I K,LEE T C.Protein hydrolysis and quality deterioration of refrigerated and frozen seafood due to obligately psychrophilic bacteria[J].Journal of Food Science,1993,58(2):310-313.
[19] AFLAKI F,GHOULIPOUR V,SAEMIAN N,et al.Chemometrics approaches to monitoring of biogenic amines changes in three fish species[J].Journal of Aquatic Food Product Technology,2017,26(1):43-53.
[20] HAZARDS E.Scientific opinion on risk based control of biogenic amine formation in fermented foods[J].EFSA Journal,2011,9(10):2939.
[21] DEBEER J,BELL J W,NOLTE F,et al.Histamine limits by country:A survey and review[J].Journal of food protection,2021,84(9):1610-1628.
[22] JIA S L,LI Y,ZHUANG S,et al.Biochemical changes induced by dominant bacteria in chill-stored silver carp (Hypophthalmichthys molitrix) and GC-IMS identification of volatile organic compounds[J].Food Microbiology,2019,84:103248.
[23] BARGOSSI E,GARDINI F,GATTO V,et al.The capability of tyramine production and correlation between phenotypic and genetic characteristics of enterococcus faecium and enterococcus faecalis strains[J].Frontiers in Microbiology,2015,6:1371.
[24] HAO R Y,LIU Y,SUN L M,et al.Sodium alginate coating with plant extract affected microbial communities,biogenic amine formation and quality properties of abalone (Haliotis Discus hannai Ino) during chill storage[J].LWT-Food Science and Technology,2017,81:1-9.
[25] YU D W,LI P Y,XU Y S,et al.Physicochemical,microbiological,and sensory attributes of chitosan-coated grass carp (Ctenopharyngodon idellus) fillets stored at 4 degrees C[J].International Journal of Food Properties,2017,20(2):390-401.
[26] 章银良,夏文水.超高压对腌鱼保藏的影响[J].安徽农业科学,2007,35(9):2 636-2 638.
ZHANG Y L,XIA W S.Effect of ultra-high pressure on preservation of salted fish[J].Journal of Anhui Agricultural Sciences,2007,35(9):2 636-2 638.
[27] HE H,ADAMS R M,FARKAS D F,et al.Use of high-pressure processing for oyster shucking and shelf-life extension[J].Journal of Food Science,2002,67(2):640-645.
[28] KACHELE R,ZHANG M,GAO Z X,et al.Effect of vacuum packaging on the shelf-life of silver carp (Hypophthalmichthys molitrix) fillets stored at 4 ℃[J].LWT-Food Science and Technology,2017,80:163-168.
[29] 姜鹤.虾贝类内源酶性质及保鲜研究[D].大连:大连工业大学,2016.
JIANG H.Study on the digestive enzyme properties of shrimp and shellfish and preservation[D].Dalian:Dalian Polytechnic University,2016.
[30] LI Y,JIA S L,HONG H,et al.Assessment of bacterial contributions to the biochemical changes of chill-stored blunt snout bream (Megalobrama amblycephala) fillets:Protein degradation and volatile organic compounds accumulation[J].Food Microbiology,2020,91:103495.
[31] 吴雪丽,刘红英,韩冬娇.冰温结合生物保鲜剂对扇贝的保鲜效果[J].食品科学,2014,35(10):273-277.
WU X L,LIU H Y,HAN D J.Effect of controlled freezing point storage combined with biological preservative on quality maintenance of scallops[J].Food Science,2014,35(10):273-277.
[32] 郝若伊,张公亮,王佳莹,等.4 ℃、20 ℃贮藏下鲍鱼品质变化[J].食品与发酵工业,2017,43(6):72-77.
HAO R Y,ZHANG G L,WANG J Y,et al.Quality change of abalone (Haliotis discus hannai) during 4 ℃and 20 ℃[J].Food and Fermentation Industries,2017,43(6):72-77.
[33] LI W J,WANG C,JU J,et al.Effects of modified atmosphere packaging combined with tea polyphenol treatment on the quality of grass carp during cold storage[J].IOP Conference Series:Earth and Environmental Science,2020,559:012029.
[34] ZHU Y C,MA L Z,YANG H,et al.Super-chilling (-0.7 ℃) with high-CO 2 packaging inhibits biochemical changes of microbial origin in catfish (Clarias gariepinus) muscle during storage[J].Food Chemistry,2016,206(1):182-190.
[35] 鲁珺.液氮深冷速冻对带鱼和银鲳品质及其肌肉组织的影响[D].杭州:浙江大学,2015.
LU J.Effect of cryogenic freezing by liquid nitrogen on the quality and microstructure of hairtail and silver pomfret[D].Hangzhou:Zhejiang University,2015.
[36] 林二妹.不同冻藏温度及反复冻结-解冻对明虾贮藏品质影响研究[D].福州:福建农林大学,2016.
LIN E M.The Study of different freezing temperature and repeated freeze-thaw on storage quality of prawn[D].Fuzhou:Fujian Agriculture and Forestry University,2016.
[37] LYU R Q,HUANG X Y,AHETO H J,et al.Analysis of fish spoilage by gas chromatography-mass spectrometry and electronic olfaction bionic system[J].Journal of Food Safety,2018,38(6):e12557.
[38] YOKOYAMA Y,SAKAGUCHI M,KAWAI F,et al.Changes in concentration of ATP-related compounds in various tissues of oyster during ice storage[J].NIPPON SUISAN GAKKAISHI,1992,58(11):2125-2136.
[39] AUBOURG S P,QUITRAL V,ANGÉLICA LARRA N M,et al.Autolytic degradation and microbiological activity in farmed Coho salmon (Oncorhynchus kisutch) during chilled storage[J].Food Chemistry,2007,104(1):369-375.
N M,et al.Autolytic degradation and microbiological activity in farmed Coho salmon (Oncorhynchus kisutch) during chilled storage[J].Food Chemistry,2007,104(1):369-375.