结直肠癌(colorectal cancer,CRC)是世界第三大癌症,其发病率和死亡率仅次于肺癌与乳腺癌[1],流行病学统计显示截止2022年1月,美国有超过140万患者被诊断为CRC,仅在2022年就有151 030例CRC新增病例,并且自21世纪初CRC的发展趋向年轻化[2-3]。CRC成因复杂,大量研究表明肠炎、红肉及低膳食纤维的摄入、肠道菌群等对CRC的发病有一定影响[4-5]。临床上,对CRC患者主要采取手术切除、放疗及化疗手段,但其产生的副作用(骨髓抑制、恶病质、腹泻等)会降低疗效,也不利于预后恢复[6-7]。因此,寻找更好的策略以降低CRC发病风险是很有必要的。
肠道菌群在CRC的发展过程中起着重要的作用[8]。当外界环境发生改变时(如:饮食习惯、药物影响等[9]),肠道菌群稳态可能会被打破,引发相关肠道疾病(溃疡性肠炎、肠易激综合征等),进而诱导结肠癌的发生。DENG等[10]报道,黄连素通过改善小鼠肠道菌群组成、抑制炎症性癌转化信号从而减缓CRC的发展。MALLA[11]也指出菌群失调会促进结肠癌细胞的增殖和转移,肠道菌群通过调节其代谢产物影响CRC的发展。
大麦若叶(barley leaf,BL)是大麦生长到20~30 cm时的嫩叶,属于麦属禾本科,富含膳食纤维、天然维生素、活性酵素及多种活性成分,具有抗氧化、降血脂、降血压等功能[12]。BL的天然营养成分对肠道健康有着潜在的促进作用。LI等[13]报道,BL可以促进肠道蠕动、增强肠屏障功能从而减轻溃疡性结肠炎和菌群失调。但BL对CRC发展的影响还有待进一步研究。
本研究通过建立CT26移植瘤小鼠模型、氧化偶氮甲烷/葡聚糖硫酸钠(azoxymethane/dextran sodium sulfate,AOM/DSS)诱导的结直肠癌小鼠模型及细胞模型来探究BL对CRC发展的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 实验动物
SPF级Balb/c雄性小鼠(5周龄,体重18~20 g)、SPF级C57BL/6 N雄性小鼠[5周龄,体重(20±1) g],北京维通利华实验动物技术有限公司。
1.1.2 实验细胞
小鼠结肠癌细胞CT26、人源结肠癌细胞HCT116及HT29、小鼠表皮细胞JB 6P+,美国典型培养物保藏中心。
1.1.3 抗体
环氧化酶2(cyclooxygenase-2,COX-2,#12282)、表皮生长因子受体(epidermal growth factor receptor,EGFR,#4267)、p-AKT(Ser473,磷酸化蛋白激酶B,#4060),CST;AKT(蛋白激酶B,#A2696)、p-ERK(磷酸化细胞外调节蛋白激酶,#AP0974)、ERK(细胞外调节蛋白激酶,#4782)、β-actin(肌动蛋白,#AC038),ABclonal;兔二抗(#SA00001-2)、鼠二抗(#SA00001-1),proteintech。
1.1.4 实验试剂
氧化偶氮甲烷(azoxymethane,AOM)、噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)试剂,Sigma-Aldrich;硫酸葡聚糖钠盐(dextran sulfate sodium,DSS),MP Biomedicals;五氟尿嘧啶(5-fluorouracil,5-Fu)、二甲基亚砜(dimethyl sulfoxide,DMSO),Solarbio;乙酸钠、丙酸钠、丁酸钠,国药集团化学试剂有限公司;BCA蛋白浓度测定试剂盒,碧云天生物技术公司;表皮细胞生长因子表皮生长因子(epidermal growth factor,EGF)重组蛋白,ThermoFisher。
1.2 仪器与设备
Eppendorf移液枪、1510 Multiscan GO全波长酶标仪、Forma 371型CO2细胞培养箱,美国Thermo;Fluor Chem FC3凝胶成像系统,美国Proteinsimple;石蜡包埋机、切片机,德国徕卡;切片扫描仪,匈牙利3DHistech;真空冻干机,美国LABCONCO;Western Blot电泳仪、转膜仪、PCR仪,美国Bio-Rad;倒置显微镜,日本尼康;高通量组织研磨仪,新芝;UV-2000紫外分析割胶仪,上海天能;GCMS-QP2100气相色谱-质谱联用仪、超微量分光光度计,日本岛津。
1.3 实验方法
1.3.1 动物实验
CT26移植瘤小鼠模型建立:5周龄SPF级Balb/c雄性小鼠饲养于江南大学实验动物中心SPF屏障环境[SYXK(苏)2016-0045],适应一周后,小鼠右前肢皮下注射CT26细胞,106 cells/只。小鼠随机分组为:空白组、模型组、BL组(5% BL)、5-Fu组、联用组(5-Fu+5% BL),每组10只。其中,5-Fu剂量为25 mg/(kg·3 d),腹腔注射;BL以未经过任何纯化的粗粉形式,按质量分数5%添加到标准饲料(CD)中。定期测量小鼠肿瘤体积和体重。给药处理19 d后,根据动物福利原则处死小鼠,并收集小鼠肿瘤、肝脏、脾脏、肾脏、血清等样本。肿瘤体积依据公式(1)计算:
肿瘤体积=0.5×长径×短径×短径
(1)
AOM/DSS诱导的结直肠癌小鼠模型建立:5周龄SPF级C57BL/6N雄性小鼠在屏障环境适应一周后,随机分组:空白组、模型组(AOM/DSS)、L BL干预组(AOM/DSS+2.5% BL)、H BL干预组(AOM/DSS+5% BL)、H BL组(5% BL),每组10只。其中,模型组及干预组小鼠单次腹腔注射10 mg/kg AOM,7 d后以3% DSS的饮用水挑战一周,BL以未经过任何纯化的粗粉形式,按质量分数2.5%和5%添加到标准饲料(CD)中。每天观察小鼠生活状态,定期测量小鼠体重。实验结束后,根据动物福利原则处死小鼠,并收集结肠组织、肝脏、脾脏、肾脏、血清等样本。
1.3.2 小鼠结肠组织苏木精-伊红染色实验
AOM/DSS诱导的结直肠癌小鼠的结直肠组织,纵向剖开摊平,肠内壁朝上,由肛门端向盲肠端紧密卷起,经过固定、脱水、透明、浸蜡、包埋和切片步骤完成标本的制作。标本经过烤片、二甲苯脱蜡、复水、苏木精-伊红染色、脱水、透明及中性树胶封片后,在切片扫描仪下观察。
1.3.3 细胞毒性实验
将JB 6P+细胞按5 000 cells/孔铺于96孔板中,过夜后,将培养基更换为含不同浓度短链脂肪酸钠的MEM培养基(1、3、10 mmol/L)。24 h后,加入20 μL MTT(5 mg/mL)孵育4 h。然后弃去液体并加入DMSO复溶,振荡后测定490 nm处的吸光值,每组设置6个复孔。受试短链脂肪酸钠为乙酸钠、丙酸钠和丁酸钠。
1.3.4 细胞增殖实验
将HCT116和HT29细胞按5 000 cells/孔铺于96孔板中,过夜后,更换培养基为含不同浓度短链脂肪酸钠的DMEM培养基(1、3、10 mmol/L)。分别于24、48、72 h,加入20 μL MTT(5 mg/mL)孵育4 h。后续操作同1.3.3节。
1.3.5 蛋白提取
JB 6P+细胞蛋白提取:将JB 6P+细胞等量接种在6 cm培养皿中,细胞密度达80%左右时进行饥饿处理,24 h后,加入不同终浓度的短链脂肪酸钠(1、3、10 mmol/L)预处理1.5 h,随后加入终质量浓度为20 ng/mL的EGF刺激15 min。刺激完成后,弃去培养基、PBS洗2次、加入RIPA裂解液进行裂解、裂解液转移至1.5 mL EP管中,然后经过超声破碎、离心、转移上清液至新的EP管中。根据说明书测定蛋白浓度并统一定量,然后加入5×loading buffer于95 ℃下金属浴5 min使蛋白变性,得到蛋白样品。
小鼠结肠组织蛋白提取:称取20 mg结肠组织,加入30倍体积的RIPA裂解液,充分研磨破碎后,后续操作同细胞样本。
1.3.6 Western Blot分析
20 μg蛋白样品经10% SDS-PAGE电泳分离后转移至PVDF膜上,用封闭液(含5% BSA的TBST溶液)封闭1.5 h后4 ℃过夜孵育一抗,孵育完成后TBST洗涤(3次,每次5 min),然后常温孵育二抗2 h,孵育完成后TBST洗涤(3次,每次5 min),最后加入显影液,避光显影20 s后,置于成像仪下观察。
1.3.7 短链脂肪酸含量测定
小鼠盲肠内容物进行真空冷冻干燥,称取冻干后的内容物20~50 mg,加入500 μL饱和NaCl静置30 mim并振荡均匀,加入40 μL 10%(体积分数)硫酸溶液酸化后再加入1 mL乙醚并振荡均匀,然后离心取上层乙醚相(12 000 r/min,4 ℃,15 min),加入0.25 g无水硫酸钠并静置15 min后以相同条件离心。将上层乙醚相转移至气相小瓶中,上机分析。采用GC-MS测定短链脂肪酸的含量,通过检测不同浓度混合短链脂肪酸标准品,以峰面积为横坐标、标准品浓度为纵坐标绘制出标准曲线,进而计算出样品中短链脂肪酸浓度。
1.3.8 小鼠粪便肠道菌群的测定
依据MP粪便DNA提取试剂盒说明书提取小鼠粪便中的DNA,DNA样本进行PCR扩增V3~V4区,然后通过1.5%琼脂糖凝胶电泳进行纯化,在500 bp处切取目标条带并使用胶回收试剂盒回收DNA。依据Qubit Assay Tubes试剂盒说明书建立文库,然后在通过Miseq Reagent Kit v3上机测序,得到文库数据。测得的肠道菌群下机数据用微生物生态定量研究平台(QIIME2)进行测序分析。
1.3.9 上皮细胞恶性转化实验
配制终浓度为10%胎牛血清、0.5%琼脂和1×BME的底层培养基,以3 mL/孔铺于6孔板,凝固后备用;按JB 6P+单细胞悬液和底层培养基体积比为1∶2配制上层培养体系,以1 mL/孔(含1×104 cells)铺上层,完全凝固后放入CO2培养箱中培养14 d,并拍照统计细胞克隆数。实验组分为:空白组、模型组(EGF,20 ng/mL)及不同浓度短链脂肪酸钠干预组(1、3、10 mmol/L),每组3个平行。受试短链脂肪酸钠为乙酸钠、丙酸钠和丁酸钠。
1.4 统计分析
用Graphpad Prism 8软件进行数据分析统计,认为P<0.05的分析结果具有显著性差异,实验结果中*表示P<0.05,**表示P<0.01,***表示P<0.001,****表示P<0.000 1,ns表示无显著性差异。
2 结果与分析
2.1 大麦若叶对移植瘤小鼠的影响
本研究建立了CT26移植瘤小鼠模型,用5-Fu及BL干预以探究BL对肿瘤生长及化疗药物5-Fu抗肿瘤活性的影响。图1-a为动物实验示意图,实验结果发现,BL干预不影响小鼠体重变化(图1-b),不影响肿瘤生长,也不影响5-Fu的抗肿瘤活性(图1-d与图1-e);值得注意的是,膳食补充BL可以提高小鼠的存活率(图1-c、肿瘤体积超过1 000 mm3视为小鼠死亡),减缓移植瘤小鼠及5-Fu造成的结直肠缩短(图1-f),缓解癌性脾肿大(图1-g)。
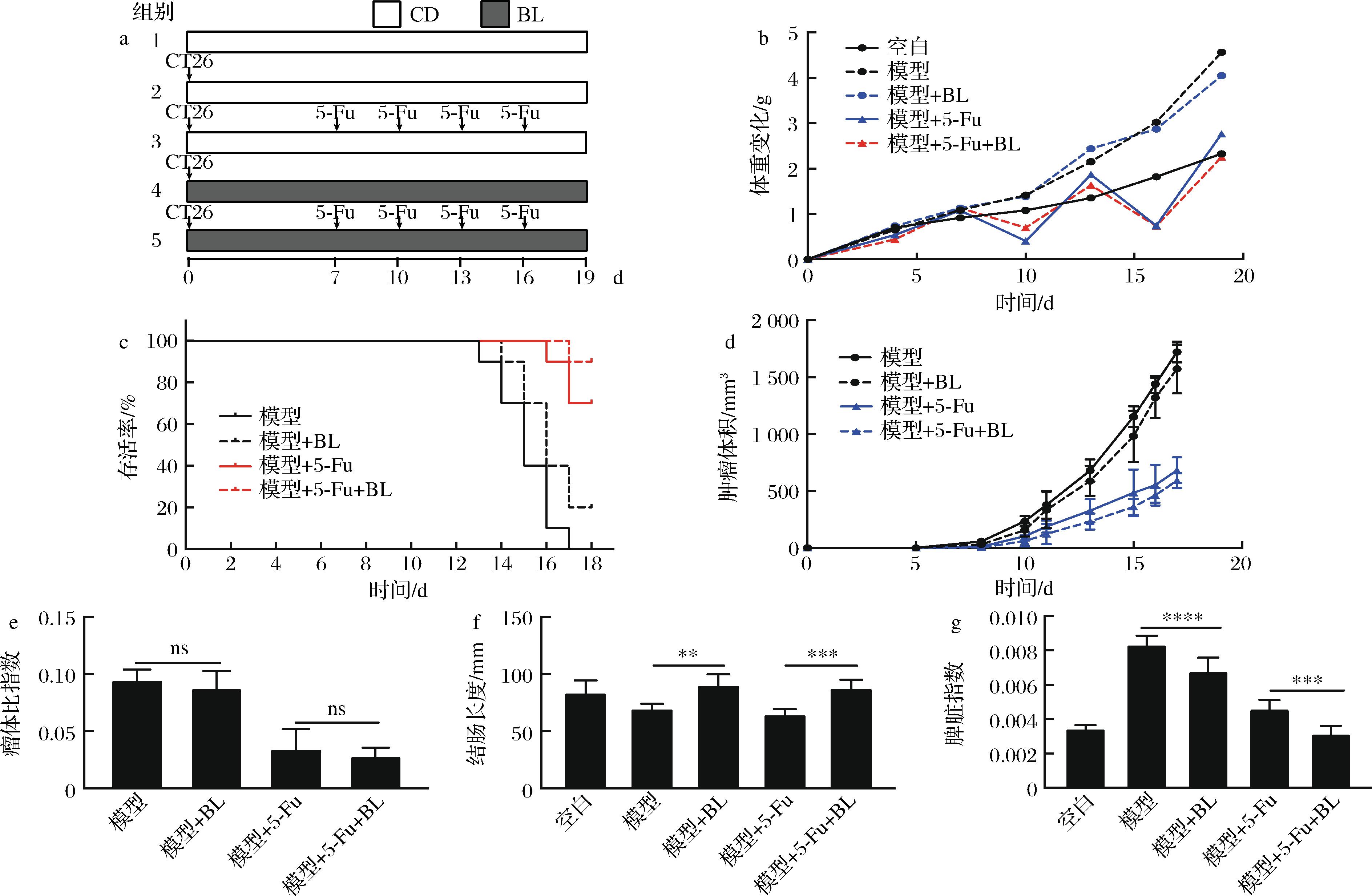
a-动物实验示意图;b-小鼠体重变化;c-小鼠生存曲线;d-小鼠肿瘤体积变化;e-瘤体比指数;f-小鼠结肠长度;g-小鼠脾脏指数
图1 大麦若叶对CT26移植瘤的影响
Fig.1 Effects of BL on CT26 transplanted tumor
2.2 大麦若叶减缓AOM/DSS诱导的结直肠肿瘤发生
BL对移植瘤小鼠的肿瘤生长无影响,因此本研究又建立了AOM/DSS诱导的结直肠癌小鼠模型以探究BL对原发性结直肠癌是否具有预防作用。图2-a为动物实验示意图;图2-b为小鼠体重变化,经过9周的膳食干预,空白组平均体重为27.12 g,模型组为24.44 g,模型+L BL组为26.01 g,模型+H BL组为26.67 g,H BL组为27.23 g,结果说明BL干预显著减轻了AOM/DSS诱导导致的小鼠体重下降;图2-c和图2-d显示,BL干预能显著减轻AOM/DSS诱导导致的小鼠结直肠缩短;图2-e~图2-g反映了小鼠结直肠肿瘤生长情况,结果表明5% BL干预使肿瘤数量由12.10个降低到6.80个、直径大于2 mm的肿瘤数量占比由61.55%降低到36.98%,BL干预显著减轻了结直肠肿瘤负荷;进一步对小鼠结直肠组织进行病理学分析,如图3所示,模型组小鼠结直肠厚度明显增加、隐窝结构破坏、有较大的腺瘤产生且病灶处的细胞形态明显改变,而BL干预后显著减轻了这些变化。以上实验结果说明,膳食摄入BL能减缓结直肠癌的发展。
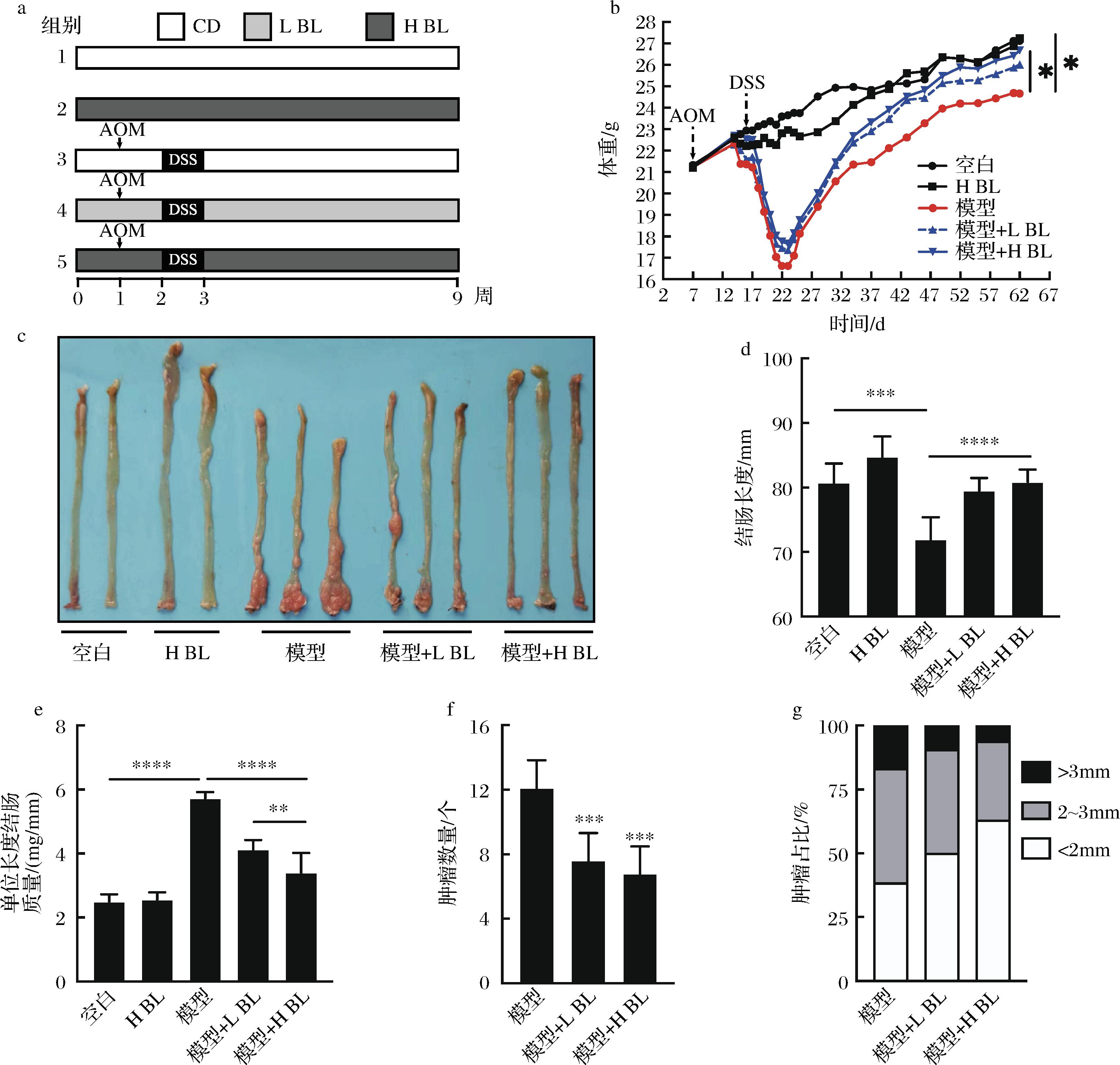
a-动物实验示意图;b-小鼠体重变化;c-小鼠结肠组织;d-小鼠结肠长度;e-小鼠单位长度结肠质量;f-小鼠结肠组织肿瘤数量;g-小鼠结肠组织不同体积的肿瘤占比
图2 大麦若叶对AOM/DSS诱导的结直肠肿瘤影响
Fig.2 Effects of BL on tumorigenesis induced by AOM/DSS
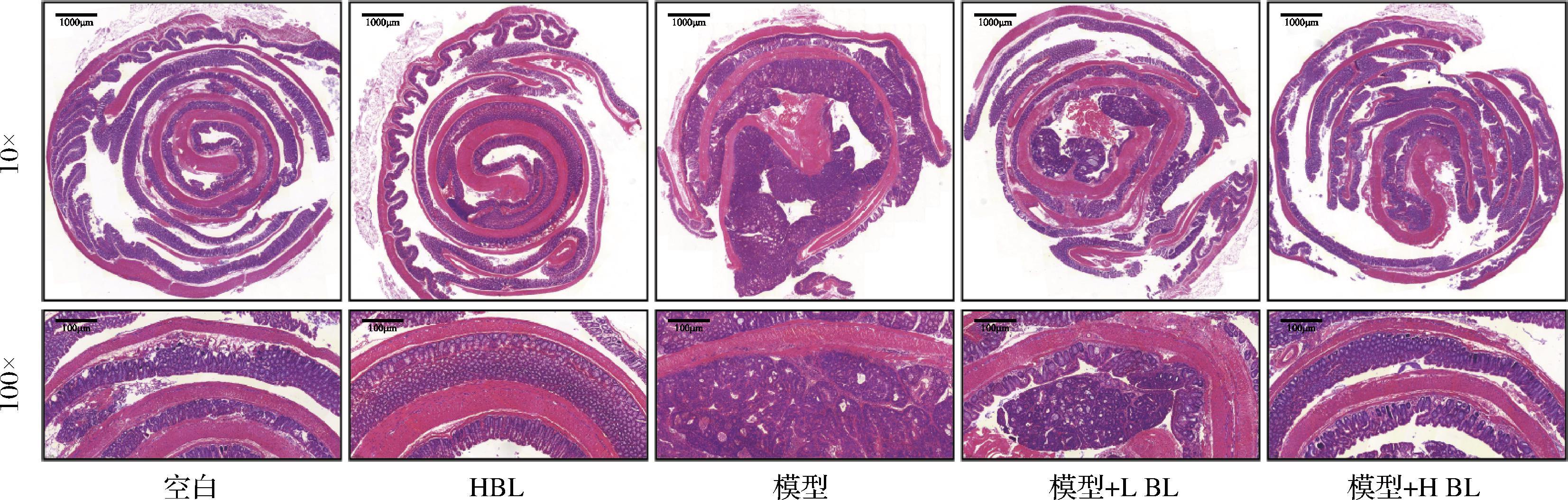
图3 小鼠结直肠组织病理切片分析
Fig.3 Histopathological analysis of mouse colorectal tissue
2.3 大麦若叶降低肿瘤发生相关蛋白表达水平
COX-2和EGFR是重要的CRC致癌基因,在CRC发展过程中高表达。本研究通过Western Blot检测AOM/DSS诱导的原发性结直肠癌小鼠结直肠组织中COX-2与EGFR的蛋白表达水平,如图4所示,模型组的COX-2和EGFR表达水平显著增高,而BL干预显著降低其表达水平,这进一步说明膳食摄入BL可以减缓结直肠肿瘤的发生。

图4 小鼠结肠组织Western Blot分析
Fig.4 Western Blot analysis of mouse colorectal tissue
2.4 大麦若叶减轻肠道菌群失调
肠道微生物在CRC发展过程中起着重要作用。为了研究CRC发展期间BL对肠道菌群的影响,本研究对小鼠粪便中的肠道菌群进行了分析。图5-a为小鼠肠道菌群α多样性分析,结果显示AOM/DSS诱导降低了肠道菌群的均匀度和丰富度,而BL干预显著改善了这一变化;图5-b为β多样性分析(基于Bray-curits距离的PCoA分析),结果显示BL干预改变了结直肠肿瘤小鼠肠道菌群结构;图5-c和图5-d为门水平和属水平的肠道菌群组成,各组小鼠肠道菌群中门水平优势菌群主要由拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)组成,其次为变形菌门(Proteobacteria)、疣微菌门(Verrucomiccrobia)、脱铁杆菌门(Deferribacteres)、放线菌门(Actinobacteria)等,经BL干预,拟杆菌门丰度升高、变形菌门丰度降低,属水平上主要由乳杆菌属(Lactobacillus)、拟杆菌属(Bacteroides)、阿克曼菌属(Akkermansia)、Muribaculaceae、另枝菌属(Alistipes)、瘤胃球菌科UCG014属(Ruminococcaceae UCG-014)、毛螺菌科NK4A136属(Lachnospiraceae NK4A136 group)等组成,BL干预提高了拟杆菌属、另枝菌属、瘤胃球菌科UCG014属、毛螺菌科的丰度;图5-e为LEfSe分析(α=0.05,LDA=2.0),结果显示BL干预组的差异菌群数显著多于模型组,高剂量BL干预组显著富集了肠杆菌属(Enterorhabdus)、拟杆菌属(Bacteroides)、Butyricimonas、瘤胃球菌科(Ruminococcaceae)等,高剂量BL组主要富集了拟普雷沃氏菌属(Alloprevotella)、普雷沃氏菌属(Prevotellaceae)、另枝菌属(Alistipes)、毛螺菌科UCG006属(Lachnospiraceae UCG-006)等,这些菌群在肠道内可以促进膳食纤维的分解产生短链脂肪酸。
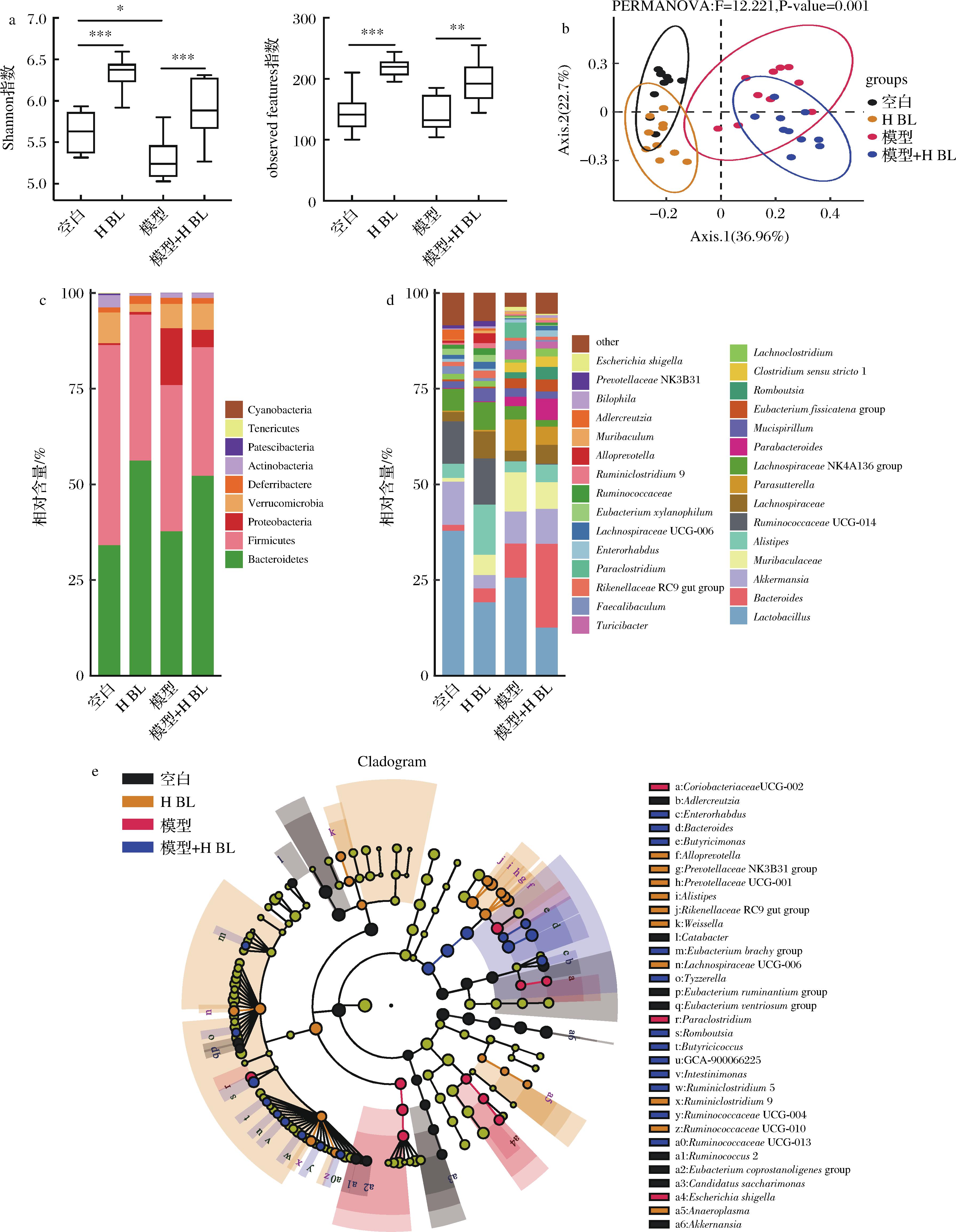
a-小鼠肠道菌群α多样性分析;b-小鼠肠道菌群β多样性分析;c-门水平小鼠肠道菌群组成;d-属水平小鼠肠道菌群组成;e-小鼠肠道菌群LEfSe分析
图5 大麦若叶对肠道菌群的影响
Fig.5 Effects of BL on gut microbiota
2.5 大麦若叶摄入增加短链脂肪酸的含量
膳食摄入BL改善了菌群失调,促进了产短链脂肪酸菌群的富集,同时BL含有丰富的膳食纤维,因此本研究进一步探究了BL对AOM/DSS诱导模型小鼠体内短链脂肪酸(short-chain fatty acids,SCFAs)水平的影响。如图6所示,经过5% BL干预后,乙酸含量由70.03 μmol/g提高至177.6 μmol/g,丙酸含量由14.94 μmol/g提高至54.25 μmol/g,丁酸含量由27.22 μmol/g提高至103.6 μmol/g,异丁酸含量由1.84 μmol/g提高至2.59 μmol/g,戊酸含量由2.06 μmol/g提高至3.79 μmol/g,BL显著提升了小鼠盲肠内容物中短链脂肪酸水平。短链脂肪酸在盲肠中由肠道菌群发酵膳食纤维产生,然后通过载体介导机制以阴离子形式进入肠上皮被吸收并发挥其生物学功能[14],而异丁酸与戊酸的含量很低,因此后续聚焦于乙酸钠、丙酸钠及丁酸钠对结直肠癌发展的影响。
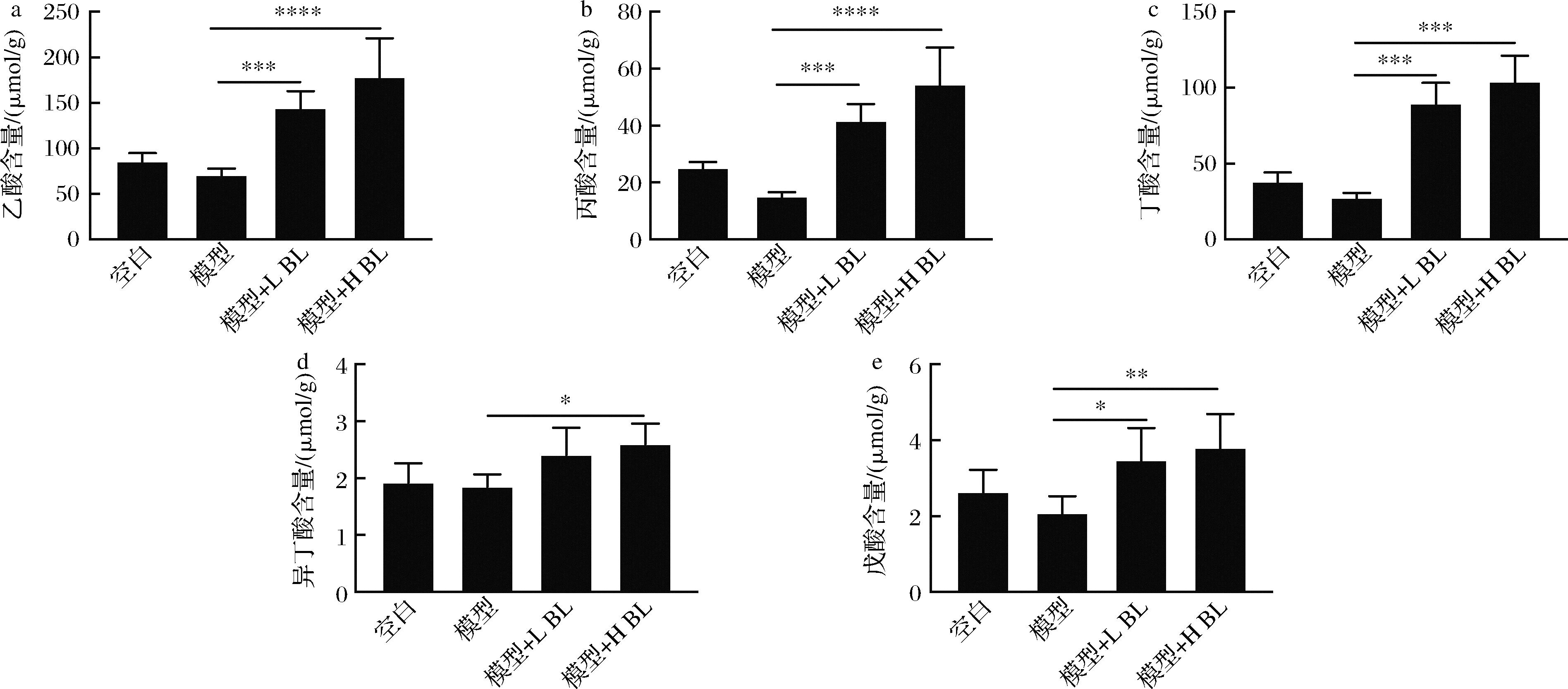
a-乙酸含量;b-丙酸含量;c-丁酸含量;d-异丁酸含量;e-戊酸含量
图6 小鼠盲肠内容物中短链脂肪酸含量
Fig.6 Concentration of SCFA in mouse cecal contents
2.6 短链脂肪酸盐对结直肠癌细胞增殖的影响
结肠癌细胞的恶性增殖是CRC发展的关键步骤,本研究选取结肠癌细胞系HCT116和HT29来探究短链脂肪酸对结直肠癌细胞增殖的影响。如图7所示,3种短链脂肪酸钠对HCT116和HT29细胞增殖均有抑制作用,且呈时间依赖及剂量依赖,其中丁酸钠的抑制作用最为明显,48 h时1 mmol/L丁酸钠将HCT116细胞活力抑制到42.85%、HT29为21.75%,3 mmol/L的丁酸钠将HCT116细胞活力抑制到11.43%、HT29为8.70%,10 mmol/L的丁酸钠将HCT116细胞活力抑制到5.70%、HT29为1.60%。
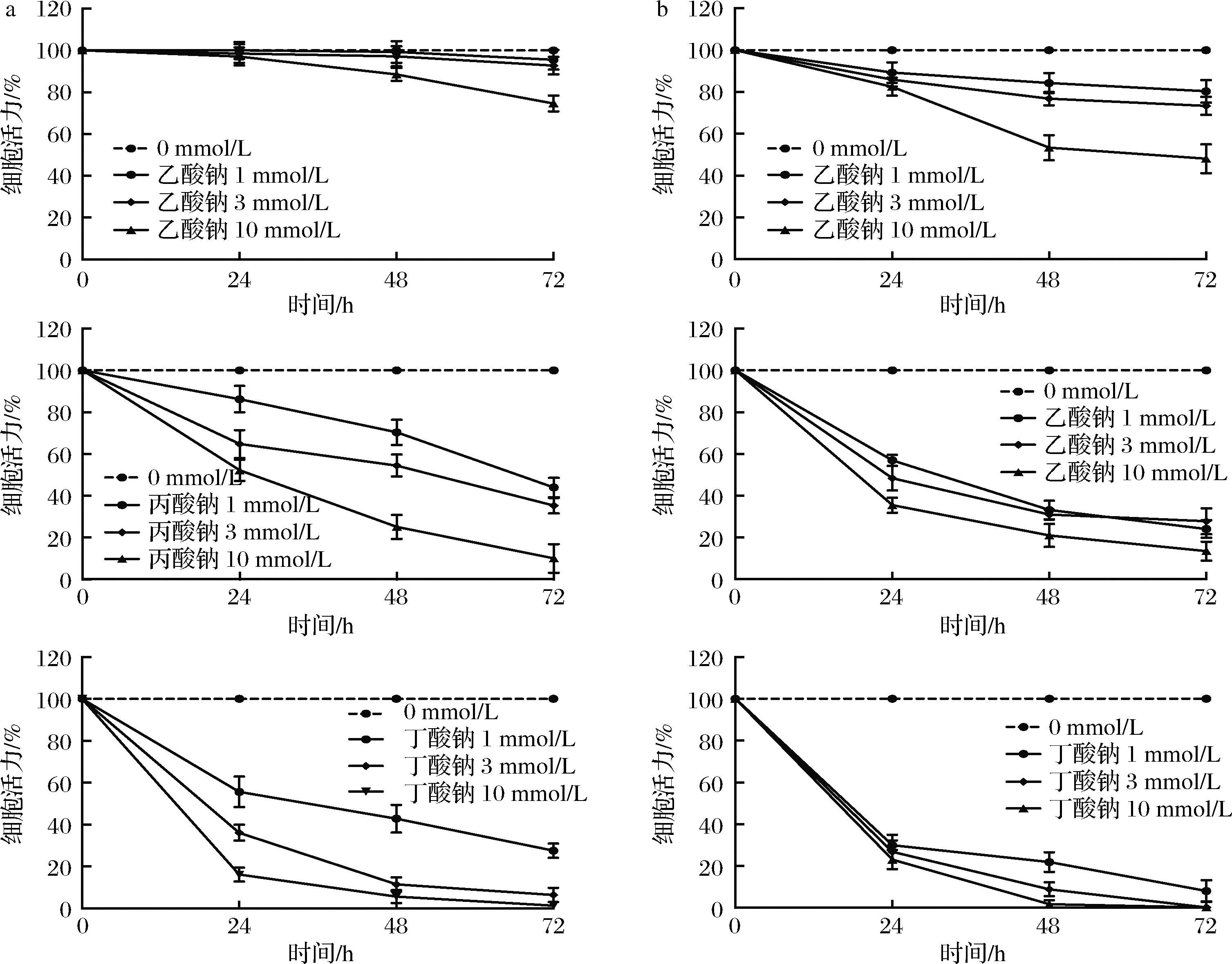
a-不同浓度乙酸钠(上)、丙酸钠(中)和丁酸钠(下)对HCT116细胞活力的影响;b-不同浓度乙酸钠(上)、丙酸钠(中)和丁酸钠(下)对HT29细胞活力的影响
图7 短链脂肪酸钠对HCT116和HT29细胞活力的影响
Fig.7 Effects of SCFAs sodium on cell activity of HCT116 and HT29
2.7 短链脂肪酸盐对JB 6P+细胞活力影响
本实验意在探究乙酸钠、丙酸钠及丁酸钠对JB 6P+细胞活力的影响。
实验结果表明,1、3、10 mmol/L的乙酸钠、丙酸钠及丁酸钠对JB 6P+细胞活力无明显抑制作用(图8)。

图8 短链脂肪酸钠对JB 6P+细胞活力的影响
Fig.8 Effects of SCFAs sodium on cell activity of JB 6P+
2.8 短链脂肪酸盐对上皮细胞恶性转化的影响
CRC发展过程中细胞癌变的第一步就是上皮细胞的恶性转化,JB 6P+细胞是小鼠表皮癌前病变状态的上皮细胞,通过刺激因子的诱导会发生恶性转化。本研究用EGF诱导JB 6P+细胞发生恶性转化并加入不同浓度的乙酸钠、丙酸钠及丁酸钠进行干预。如图9所示,JB 6P+细胞经EGF刺激后发生了恶性转化并形成了单细胞克隆,而乙酸钠、丙酸钠及丁酸钠干预后显著降低了克隆数。实验结果说明乙酸钠、丙酸钠及丁酸钠可以抑制上皮细胞的恶性转化。

a-不同浓度乙酸钠、丙酸钠和丁酸钠对JB 6P+细胞恶性转化的影响;b-细胞克隆数统计
图9 短链脂肪酸钠对上皮细胞恶性转化的影响
Fig.9 Effects of SCFAs sodium on malignant transformation of epithelial cells
2.9 短链脂肪酸盐对上皮细胞恶性转化过程相关信号通路的影响
EGF可以激活PI3K/AKT、MAPK/ERK信号通路,本研究进一步探究了短链脂肪酸钠对JB 6P+细胞恶性转化过程相关信号通路的影响。如图10所示,EGF显著上调了p-AKT和p-ERK表达水平,3种短链脂肪酸钠均显著抑制p-AKT表达,丙酸钠和丁酸钠显著抑制p-ERK表达且呈剂量依赖。
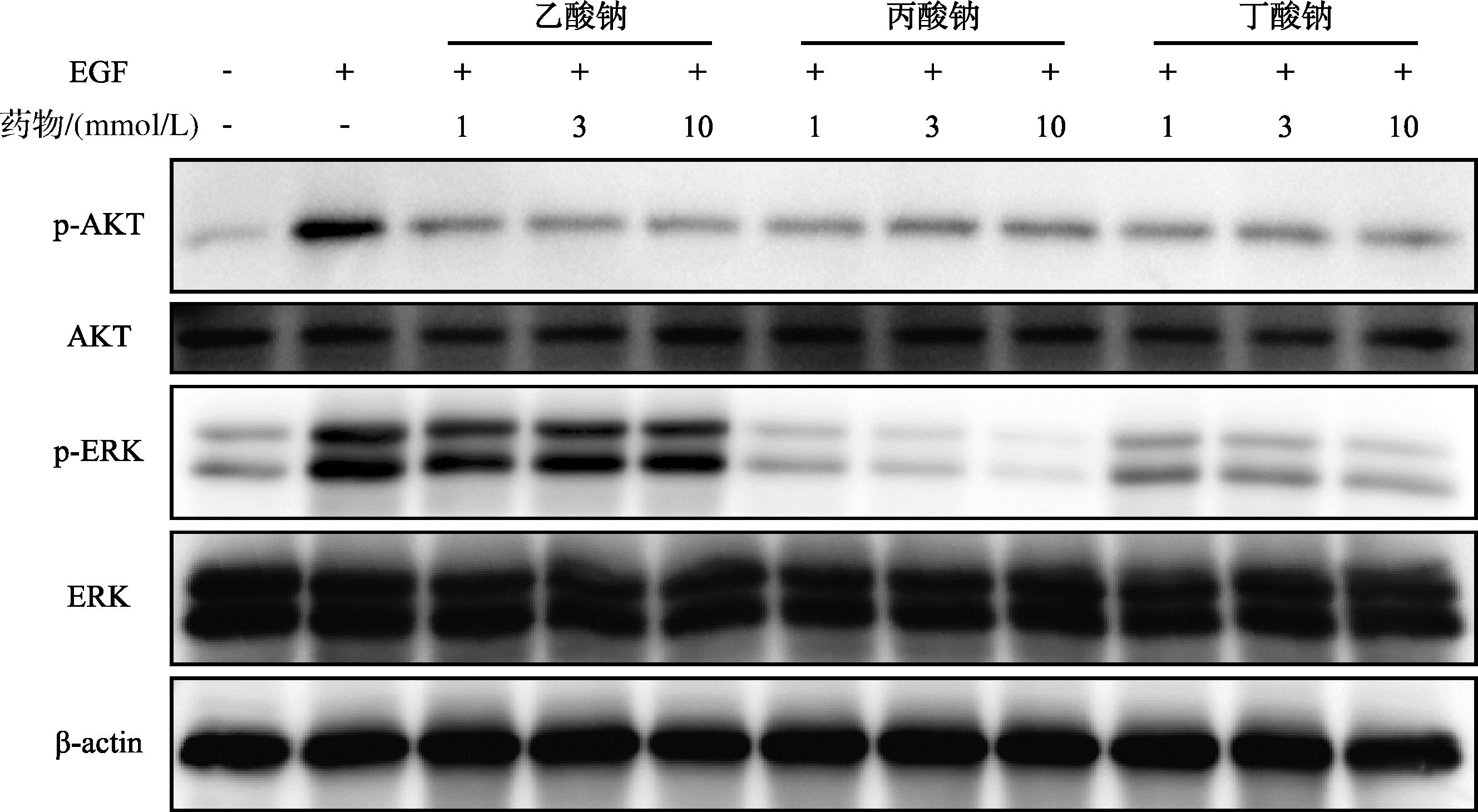
图10 短链脂肪酸钠对PI3K/AKT和MAPK/ERK信号通路的影响
Fig.10 Effects of SCFAs sodium on PI3K/AKT and MAPK/ERK pathway
3 讨论
CRC是一种结肠炎相关的恶性肿瘤,严重威胁人们的健康[15]。虽然其发病机制尚未明确,但饮食可能是一种重要的影响因素[16],如:加工肉类、红肉的摄入会增加CRC的发病风险,而高膳食纤维、水果的摄入则会降低CRC的发病风险[17]。TIAN等[18]指出,BL中的膳食纤维通过调节肠道菌群减缓溃疡性结肠炎,但BL在溃疡性结肠炎相关癌变的作用尚不明确。本研究主要探讨了BL对结直肠癌的预防作用,并发现BL通过改善菌群失调、调节肠道菌群代谢产生短链脂肪酸,进而抑制上皮细胞恶性转化及结肠癌细胞增殖以减缓CRC的发生。
本研究先建立了移植瘤小鼠模型并以5-Fu治疗来模拟临床上结直肠肿瘤患者的化疗[19],以考察BL对移植瘤及5-Fu化疗的影响。结果发现,BL不影响移植瘤的生长和5-Fu的抗肿瘤活性,因此本研究又考察了BL对原发性结直肠癌的影响。AOM/DSS诱导的结直肠癌是一种模拟人类结直肠癌的动物模型[20],该模型已被广泛用于研究CRC潜在的发病机制和治疗靶点。本研究结果表明,BL能减缓结直肠肿瘤的发生。炎症性肠病是CRC发病重要的影响因素,其中包括溃疡性结肠炎和克罗恩病,因此抑制炎症反应也是预防CRC的一个重要手段。此前,有研究报道BL可以缓解DSS诱导的溃疡性肠炎[13],这为其对CRC发展的影响提供了研究基础。参与炎症-癌症转化过程的生物学因子有很多,COX-2就是一个重要的靶标分子,在炎症及癌症发展过程中存在高表达,有研究报道COX-2选择性抑制剂可能是一类新的治疗结直肠癌的药物[21]。此外,EGFR作为重要的原癌基因在CRC发展过程中起着重要的作用,有研究报道EGFR介导的巨噬细胞活化会促进结肠炎相关的肿瘤发生[22]。而本研究结果显示BL可以降低COX-2和EGFR的蛋白表达。总之,本研究在动物模型上验证了BL可以减缓结直肠癌的发展。高膳食纤维饮食会降低结肠癌的发病风险[23],本研究结果发现BL干预改善了AOM/DSS诱导引起的菌群失调,促进拟杆菌、毛螺菌、胃瘤球菌等产短链脂肪酸菌群的富集,进一步检测盲肠内容物中的短链脂肪酸水平也发现BL显著提高了短链脂肪酸的含量。一般来说,结直肠肿瘤的形成会经过肠上皮细胞癌变、癌变细胞恶性增殖、异型增生、最终形成结直肠肿瘤,而短链脂肪酸对CRC的预防具有潜在的保护作用[24]。因此,本研究考察了短链脂肪酸对上皮细胞恶性转化以及结直肠癌细胞增殖的影响,结果显示乙酸钠、丙酸钠及丁酸钠通过抑制上皮细胞恶性转化及结直肠癌细胞的增殖来减缓CRC的发展。为进一步探究短链脂肪酸钠抑制上皮细胞恶性转化的分子机制,本研究考察了PI3K/AKT和MAPK/ERK信号通路,这2种信号通路在很多人类癌症疾病中都被激活[25],是调节细胞增殖、分化及凋亡的关键信号通路[26]。本研究发现短链脂肪酸钠是通过调节p-AKT及p-ERK表达来抑制上皮细胞恶性转化。
4 结论
本研究表明,BL可以预防AOM/DSS诱导的结直肠癌发生,改善肠道菌群失调,调节肠道菌群代谢短链脂肪酸,并进一步抑制肿瘤细胞增殖以及上皮细胞的恶性转化;BL不影响移植瘤的生长也不影响化疗药物5-Fu的抗肿瘤活性,但其可以改善小鼠生存状态、缓解癌性脾肿大及5-Fu造成的结肠缩短。本文研究成果为结直肠癌的预防提供了一个新的策略。
[1] SIEGEL R L,MILLER K D,FUCHS H E,et al.Cancer statistics,2022[J].CA:A Cancer Journal for Clinicians,2022,72(1):7-33.
[2] MILLER K D,NOGUEIRA L,DEVASIA T,et al.Cancer treatment and survivorship statistics,2022[J].CA:a Cancer Journal for Clinicians,2022,72(5):409-436.
[3] XIA C F,DONG X S,LI H,et al.Cancer statistics in China and United States,2022:Profiles,trends,and determinants[J].Chinese Medical Journal,2022,135(5):584-590.
[4] FARVID M S,SIDAHMED E,SPENCE N D,et al.Consumption of red meat and processed meat and cancer incidence:A systematic review and meta-analysis of prospective studies[J].European Journal of Epidemiology,2021,36(9):937-951.
[5] ABU-GHAZALEH N,CHUA W J,GOPALAN V.Intestinal microbiota and its association with colon cancer and red/processed meat consumption[J].Journal of Gastroenterology and Hepatology,2021,36(1):75-88.
[6] WU C.Systemic therapy for colon cancer[J].Surgical Oncology Clinics of North America,2018,27(2):235-242.
[7] MACDONALD J S.Adjuvant therapy for colon cancer[J].CA:a Cancer Journal for Clinicians,1997,47(4):243-256.
[8] GARRETT W S.The gut microbiota and colon cancer[J].Science,2019,364(6446):1133-1135.
[9] VERNIA F,LONGO S,STEFANELLI G,et al.Dietary factors modulating colorectal carcinogenesis[J].Nutrients,2021,13(1):143.
[10] DENG J Q,ZHAO L L,YUAN X Y,et al.Pre-administration of berberine exerts chemopreventive effects in AOM/DSS-induced colitis-associated carcinogenesis mice via modulating inflammation and intestinal microbiota[J].Nutrients,2022,14(4):726.
[11] MALLA R R.Microbiome conundrum in colon cancer:Development,progression,and therapeutics[J].Critical Reviews in Oncogenesis,2020,25(2):129-139.
[12] KAMIYAMA M,SHIBAMOTO T.Flavonoids with potent antioxidant activity found in young green barley leaves[J].Journal of Agricultural and Food Chemistry,2012,60(25):6260-6267.
[13] LI D T,FENG Y,TIAN M L,et al.Gut microbiota-derived inosine from dietary barley leaf supplementation attenuates colitis through PPARγ signaling activation[J].Microbiome,2021,9(1):83.
[14] SIVAPRAKASAM S,BHUTIA Y D,YANG S P,et al.Short-chain fatty acid transporters:Role in colonic homeostasis[J].Comprehensive Physiology,2017,8(1):299-314.
[15] SUNG H,FERLAY J,SIEGEL R L,et al.Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA:a Cancer Journal for Clinicians,2021,71(3):209-249.
[16] THANIKACHALAM K,KHAN G.Colorectal cancer and nutrition[J].Nutrients,2019,11(1):164.
[17] YANG Y F,YANG L,ZHOU L P,et al.A critical review of the effect of dietary fiber intake on the prevention of colorectal cancer in Eastern Asian countries[J].Journal of Healthcare Engineering,2021:6680698.
[18] TIAN M L,LI D T,MA C,et al.Barley leaf insoluble dietary fiber alleviated dextran sulfate sodium-induced mice colitis by modulating gut microbiota[J].Nutrients,2021,13(3):846.
[19] WANG C H,YANG S X,GAO L,et al.Carboxymethyl pachyman (CMP) reduces intestinal mucositis and regulates the intestinal microflora in 5-fluorouracil-treated CT26 tumour-bearing mice[J].Food &Function,2018,9(5):2695-2704.
[20] SNIDER A J,BIALKOWSKA A B,GHALEB A M,et al.Murine model for colitis-associated cancer of the colon[J].Methods in Molecular Biology,2016,1438:245-254.
[21] TAKETO M M.COX-2 and colon cancer[J].Inflammation Research,1998,47(2):112-116.
[22] HARDBOWER D M,COBURN L A,ASIM M,et al.EGFR-mediated macrophage activation promotes colitis-associated tumorigenesis[J].Oncogene,2017,36(27):3807-3819.
[23] MONIRI N H,FARAH Q.Short-chain free-fatty acid G protein-coupled receptors in colon cancer[J].Biochemical Pharmacology,2021,186:114483.
[24] GOMES S D,OLIVEIRA C S,AZEVEDO-SILVA J,et al.The role of diet related short-chain fatty acids in colorectal cancer metabolism and survival:Prevention and therapeutic implications[J].Current Medicinal Chemistry,2020,27(24):4087-4108.
[25] REVATHIDEVI S,MUNIRAJAN A K.Akt in cancer:Mediator and more[J].Seminars in Cancer Biology,2019,59:80-91.
[26] GUO Y J,PAN W W,LIU S B,et al.ERK/MAPK signalling pathway and tumorigenesis[J].Experimental and Therapeutic Medicine,2020,19(3):1997-2007.