黄羽肉鸡是目前国内出栏量最大的肉鸡品种,主要分为快速型黄羽肉鸡、中速型黄羽肉鸡和慢速型黄羽,其中慢速型黄羽肉鸡主要用于炖制中国传统鸡汤。鸡汤由于味道鲜美,在传统饮食文化中,既可作为美食直接食用,也可作为烹调加工中的调味品。香味是鸡汤最主要的特征风味品质之一,汤中香味活性物质包括3-甲硫基丙醛、2-甲基-3-巯基呋喃、甲基吡嗪、2-乙基-4-甲基噻唑、己醛、(E)-2-壬烯醛[1]、(E,E)-2,4-壬二烯醛、(E,E)-2,4-癸二烯醛和(E,Z)-2,4-癸二烯醛[2]。研究发现除了少量含硫含氮的美拉德反应产物外,鸡汤中香味活性物质主要为脂肪族醛类物质,这些风味物质主要通过脂肪氧化产生,且具有较高的疏水性,易溶于脂肪难溶于水。此外,前期研究发现炖制过程中鸡汤中香味物质损失80%[3],通过调控汤中香味物质的关键载体-油滴的大小实现了增强鸡汤吸附香味物质的能力,导致香味物质含量增加了200%[4]。油滴是汤中香味活性物质的关键载体,已有报道表明当油滴体积分数超过1%时,食品中油滴吸附香味物质的能力可得到成倍的提升[5],而鸡汤中脂肪含量0.2%~0.4%[6-7],因此提高加热过程中汤中脂肪含量将是解决鸡汤炖制过程香味逸失的关键。
高压均质和超声是调控水包油乳液中油滴含量的常规乳化方法。高压均质可通过高速冲击、强剪切力等改变蛋白质吸附量和蛋白质在界面上的相互作用,实现乳液的稳定[8],但高压均质对硬件设备要求高且能量转化效率低。超声波通过空化效应及空化效应引起的物理效应促进蛋白质吸附在油滴表面。与高压均质相比,超声设备便携性和通用性较高。通常情况,超声结合低温条件来制备乳液,一方面低温对蛋白质构象影响较小,另一方面可避免因热导致乳液絮凝等。热超声作为超声在食品加工中新的应用发展方向之一,可显著改善肉制品风味品质。已经有研究表明,与非超声组相比,超声温度98 ℃、超声30 min制备的鸡骨汤所需的熬煮时间缩短了1/3,且矿物元素含量显著增加[9]。超声水浴加热显著提高肉汤中干物质和粗蛋白含量,鸡汤的风味和感官评分显著提高[10]。这些结果表明热超声技术可加速炖制过程中肉中蛋白质等组分转移到汤中的速率,进而缩短熬制时间,但仍未证实是否能够形成稳定的乳液。此外,在比目鱼骨汤的研究中发现,热超声制作的鱼骨汤比常规制作的鱼骨汤更浓稠,质地更均均匀,说明超声辅助炖制可能会有促进乳化的作用[11],具体机制尚不清楚。
明胶是鸡汤中主要结构蛋白,超声后,粒径降低,表面疏水性增加,导致明胶在水相中的迁移速率增加,降低了乳液界面能垒;且当油/水界面层中明胶有序结构(螺旋和折叠)数量增多时,界面覆盖率增加,这些界面行为可改善其乳化能力,提高乳液稳定性[12],主要因为蛋白质的界面行为决定了所形成的界面蛋白膜分子特性,如膜厚度、致密性及黏弹性等。虽然热超声对明胶结构的影响尚不清楚,但已有报道表明加热过程中,明胶受热降解,粒径变小,表面疏水基团含量增加,有序结构增加[13]。因此推测超声辅助加热具有制备对热稳定的明胶乳液的潜力。
综上所述,本文利用超声辅助加热技术,明胶作为乳化剂,制备明胶大豆油乳液,探究在热处理条件下,不同超声时间(0、20、40、60 min)处理制备出的明胶乳液稳定性的变化。通过对乳液粒径、絮凝指数、乳析指数、显微结构、Zeta电位等指标的测定,评估热超声时间对乳液微观结构和宏观稳定性的影响。研究结果可为鸡汤的风味调控提供理论依据,进一步为拓展乳液在热加工领域的应用提供借鉴。
1 材料与方法
1.1 材料与试剂
明胶(药用级),上海阿拉丁生化有限公司;大豆油(食品级),中粮福临门食品营销有限公司;无水乙醇(分析纯),上海振兴化工一厂;牛血清蛋白(分析纯),上海伯奥生物科技有限公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)(分析纯),国药集团化学试剂有限公司。
1.2 仪器与设备
JA2103 N分析天平,上海民桥精密科学仪器公司;HJ-3控温磁力搅拌器,江苏金城国胜实验仪器厂;Allegra-64R离心机,美国贝科曼库尔特公司;Mastersizer2000激光粒度仪、Nano ZS 90粒度仪,英国马尔文公司;JY 92 IIN超声细胞破碎仪,宁波新芝生物科技股份有限公司;IX51倒置显微镜,日本奥林巴斯公司;PE-Lambda35紫外分光光度计,美国珀金埃尔默公司。
1.3 实验方法
1.3.1 样品的制备
1.3.1.1 明胶溶液的制备
准确称取0.5 g明胶,用80 mL蒸馏水溶解,在60 ℃条件下,用HJ-3磁力搅拌器搅拌30 min,使明胶充分水化溶解。溶解后定容到100 mL容量瓶里,得到浓度为5 g/L的明胶溶液。
1.3.1.2 乳液的制备
将5 mL大豆油缓慢加入95 mL制备的明胶溶液中,制得油相体积比为5%(体积分数)的溶液。利用超声细胞破碎仪对配制的乳液进行超声处理,利用水浴保持乳液温度在90~95 ℃,总加热时间为2 h。从加热开始计时是,分别超声0、20、40、60 min。为了保持加热温度和超声参数保持稳定,在实际操作过程中,先加热10 min,再保温超声10 min为1个循环;超声20 min即为循环2次。超声细胞破碎仪具体测量参数为:超声工作0.5 s/次、间隙0.2 s、超声功率500 W、振幅杆直径为6 mm。
1.3.2 乳液离心稳定性的测定
1.3.2.1 乳析指数(chromatography index,CI)的测定
参考赵秋菊[14]的测定方法。取4 mL乳液置于离心管中,使用Allegra-64R离心机(10 000 r/min),在15 ℃下离心30 min。离心后,用注射器准确量取水析层的体积V1。计算如公式(1)所示:
(1)
式中:CI为乳析指数;V1为离心后水析层体积,mL;V2为离心管中乳液总体积,mL。
1.3.2.2 乳液稳定系数(emulsion stability index,ESI)的测定
参考李慧娜等[15]的测定方法。用注射器吸取1.3.2.1节制备的离心后的乳液1 mL。将离心前乳液和离心后水析层底部乳液各稀释10倍,再用PE-Lambda35紫外分光光度计测定吸光度,波长540 nm。计算如公式(2)所示:
(2)
式中:ESI为乳液稳定系数;A0为离心前乳状液的吸光度;A1为离心后乳状液的吸光度。
1.3.3 界面蛋白负载量测定
1.3.3.1 蛋白含量的测定
用双缩脲法测定乳液蛋白的含量。取1 mL样品于10 mL离心管中,加入0.5 mL CCl4和5 mL的0.05 mol/L KOH,室温振荡10 min,4 000 r/min离心10 min,取1 mL上清液,加入4 mL双缩脲试剂,混匀,室温放置30 min。再取一个离心管加入1 mL蒸馏水和4 mL双缩脲作为空白对照,于540 nm处进行比色测定,以牛血清蛋白作标准曲线。测定乳液蛋白质含量为C0。
1.3.3.2 界面蛋白负载量的测定
取3 mL乳液于培养皿中冻干3 d,记录冻干前后质量差M0,由公式(3)得到乳液油相体积分数。由公式(4)得到界面蛋白表面负载量。
(3)
(4)
式中:M0为乳液冻干前后质量差,mg;Ci为总蛋白质浓度,mg/mL;C0为乳液蛋白质浓度,mg/mL;φ为乳液中油相体积分数,%;d[3,2]为乳液平均粒径,μm;ρ为大豆油密度,mg/mL;Γ为界面蛋白负载量,mg/m2。
1.3.4 乳液粒径的测定
采用Mastersizer 2000激光粒度仪,研究超声20、40、60 min乳液粒径分布。参考王丽娟[16]的研究方法,具体测量参数设定为:测定温度25 ℃、颗粒折射率1.470、搅拌桨转速2 000 r/min、分散剂折射率1.330、颗粒吸收率0.001。每个样品测定3次,取平均值。
1.3.5 乳液Zeta电位的测定
取1 mL新制乳液,将其稀释200倍,备用。用Nano ZS 90粒度仪在25 ℃的测定条件下,对乳滴液滴表面的Zeta电位进行测定。具体测定参数方法同1.3.4节。每个样品测定3次,取平均值。
1.3.6 乳液液滴显微结构观察
取5 μL乳液于载玻片上,将22 mm×22 mm盖玻片置于乳液上方,使用倒置显微镜确定超声0、20、40、60 min的明胶乳液的液滴尺寸分布。
1.4 数据统计与分析
实验独立重复3次。数据表示为平均值±标准差,运用SPSS Statistics 24(IBM,SPSS 24.0,California,USA)对数据进行统计分析,使用单因素方差分析(ANOVA)对数据进行分析,随后采用Duncan法对未超声组(对照组)与热超声组的数据进行多重比较分析显著性差异(P<0.05)。
2 结果与分析
2.1 乳液油相体积分数
图1为不同热超声时间对乳液油相体积分数的影响。随着热超声时间的延长,油相体积分数从0.42%增加到4.88%,这一结果与QI等[13]报道超声增加鸡汤中油相体积分数的结果类似,可见热超声也可显著提高乳液中油相体积分数。且由于油滴是汤中香味物质的关键载体,当油滴体积分数超过1%时,汤中油滴吸附香味物质的能力远大于蛋白质的作用,因此该结果也表明热超声具有增强鸡汤吸附香味物质的潜力。

TU-0-热超声时间0 min;TU-20-热超声时间20 min;TU-40-热超声时间40 min;TU-60-热超声时间60 min
图1 热超声时间对乳液油相体积分数的影响
Fig.1 Effect of thermo-ultrasound time on the oil volume fraction of emulsions
注:所有结果以平均值±标准差表示,不同字母代表样品间存在显著性差异(P <0.05)(下同)。
2.2 乳液离心稳定性
图2为不同热超声时间对明胶乳液乳析指数和乳液稳定系数的影响。CI可提供乳液中油滴与水相聚集和分离程度的信息,乳液稳定系数与乳液抵抗油滴聚集和絮凝的能力有关。观察离心30 min后不同处理组的乳液,发现未超声的溶液离心后没有明显变化。而热超声20、40、60 min的乳液均发生乳析,顶部为乳析层,底部为水析层。热超声40 min处理制备的明胶乳液的乳析指数最小,表明此时乳液稳定性最高,这与赵秋菊等[14]报道超声对反相乳液稳定性的影响相类似。热超声20、40、60 min后,ESI分别为7.2%、62.6%、57.7%,热超声40 min稳定系数最高,这与乳析指数的结果相一致。热超声40 min后稳定系数显著提高,可能是由于热超声促进了乳液中蛋白质的吸附,提高了乳液的稳定性[17]。热超声60 min后稳定系数下降,可能由于热超声时间过长,导致明胶乳化油滴稳定性能力下降,虽然鸡汤中脂肪含量显著增加[18]。
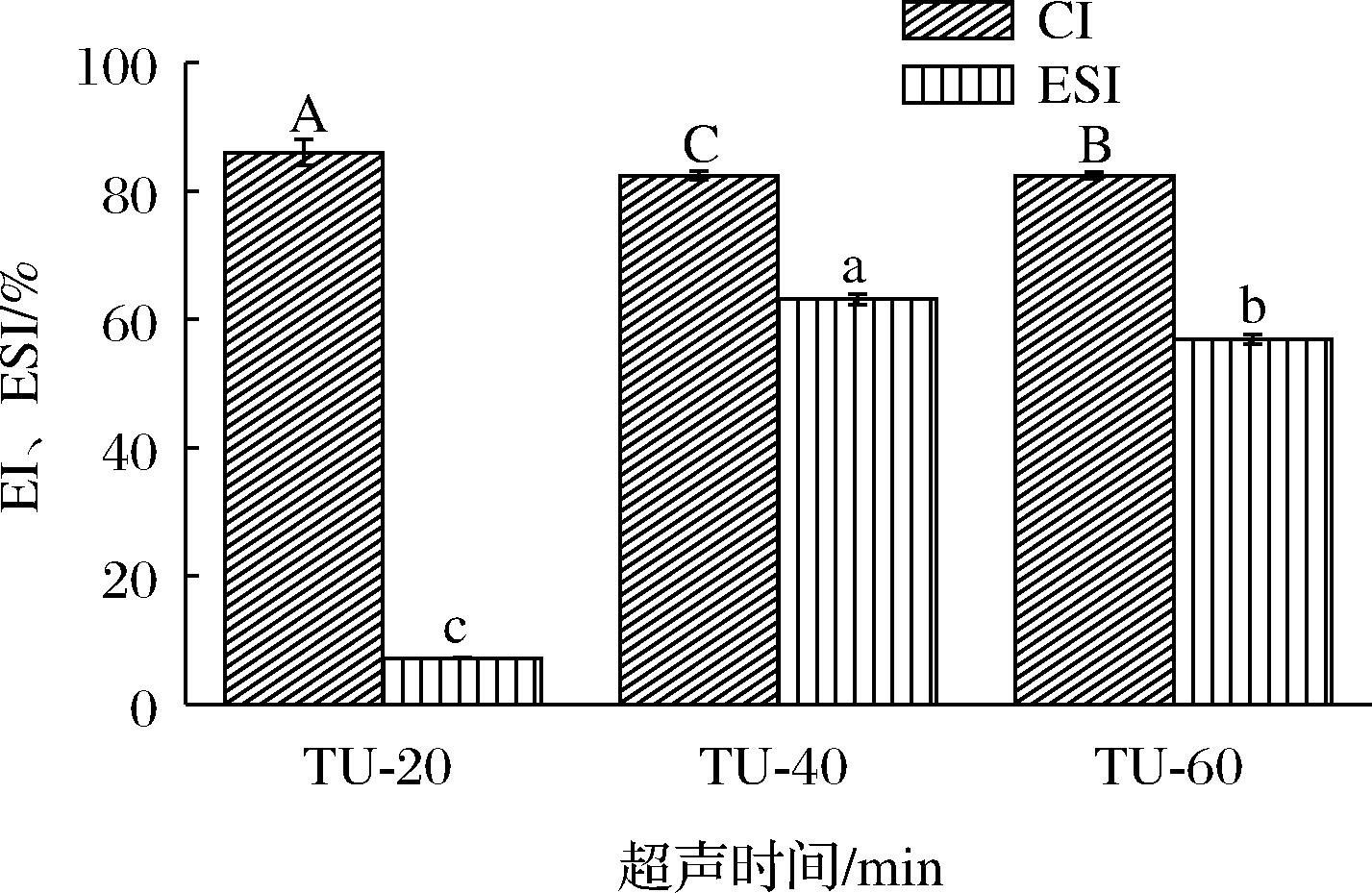
图2 热超声时间对明胶乳液CI和ESI的影响
Fig.2 Effect of thermo-ultrasound time on the creaming index and emulsion stability of gelatin-stabilized emulsions
2.3 明胶乳液物理稳定性分析
2.3.1 乳液粒径
表1为热超声时间对明胶乳液粒径的影响。热超声时间延长,比表面积值显著增加,D[3,2]、D[4,3]、D[v,0.1]、D[v,0.5]、D[v,0.9]的值显著降低,这与ZHU等[11]报道的超声时间乳液粒径影响的结果相类似。结合乳液油相体积分数和乳液稳定系数的结果,暗示热超声对乳液的乳液形成的影响可能与常规超声的影响是相类似的,适度热超声可增强乳液稳定性。随着热超声时间延长,超声波空化作用可以将油滴破碎成细小颗粒,然后蛋白质围绕在小油滴周围以保持小颗粒,同时减少了粒子间相互碰撞,因为可以较好地保持在粒径较小的状态[19]。
表1 不同热超声时间的明胶乳液平均粒径变化
Table 1 Effect of thermo-ultrasound time on the average particle size of gelatin-stabilized emulsions

超声时间/min比表面积/(m2/g)D[3,2]/μmD[4,3]/μmD[v,0.1]/μmD[v,0.5]/μmD[v,0.9]/μm00.04±19.35a144.53±20.77a199.31±27.78a101.85±15.99a185.72±13.79a321.12±34.43a206.57±0.24b0.91±0.03b1.31±0.07b0.46±0.04b1.20±0.09b2.31±0.17b408.58±0.07c0.70±<0.01c1.00±0.01c0.37±<0.01c0.85±<0.01c1.78±<0.01c608.72±0.02c0.69±<0.01c1.00±0.01c0.37±<0.01c0.82±<0.01c1.69±0.01c
注:所有结果以平均值±标准差表示;同一列不同字母代表样品间存在显著性差异(P<0.05)。
此外,超声改变明胶蛋白质结构,随着时间延长,三螺旋结构减少,无规螺旋/三螺旋的比率降低,明胶表面疏水性和α-螺旋增加[20],这可能促进明胶在油滴表面吸附,这也有助于减小油滴粒径,当两者结合时,说明热超声处理对明胶粒径也有积极影响。
热超声60 min后,乳析指数和稳定性结果表明此时乳液稳定性显著下降,这是由于脂肪含量显著增加了10%所致。一般来说,稳定性下降表明乳液粒径增加[17],但此时乳液比表面积、D[3,2]、D[4,3]、D[v,0.1]、D[v,0.5]、D[v,0.9]没有显著差异。前期研究表明,乳液稳定性主要与静电作用和空间位阻有关,因此这个结果表明热超声60 min后,乳液粒径虽然没有显著差异,但静电作用和空间位阻可能有显著变化。
2.3.2 乳液微观结构
图3为热超声时间对乳液显微结构的影响。与未超声乳液相比,热超声后乳液中油滴颗粒明显变小。随着热超声时间延长,乳滴分布更加均匀,这与高压均质制备的明胶乳液的结果相似[12]。这与粒径和乳析指数的结果相一致。总的来说,热超声可形成稳定的水包油乳液,油滴体积分数可达到4.88%,形成的粒径与ZHU等[21]报道的高压均质制备相同油滴体积分数的明胶乳液粒径结果相类似和LI等[17]报道超声制备相同油滴体积分数的明胶乳液粒径结果相类似。热超声40 min,制备的乳液粒径更小,稳定性更高。
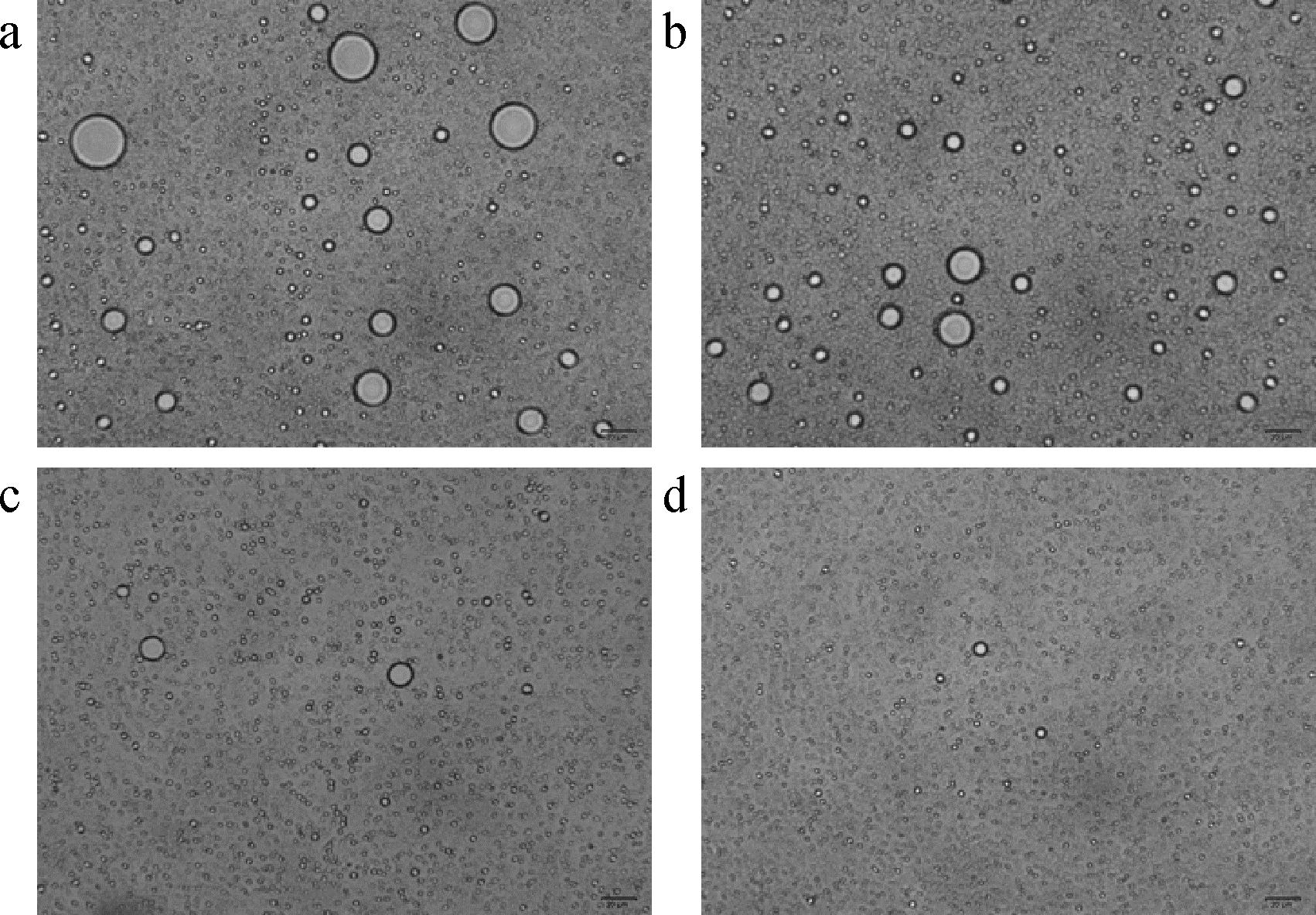
a-热超声0 min处理乳液微观结构;b-热超声20 min处理乳液微观结构;c-热超声40 min处理乳液微观结构;d-热超声60 min处理乳液微观结构
图3 热超声时间对乳液显微结构的影响
Fig.3 Effect of thermo-ultrasound time on the microstructure of gelatin-stabilized emulsions
2.3.3 乳液Zeta电位
图4为热超声时间对乳液Zeta电位的影响。随着超声时间延长,明胶乳液的Zeta电位绝对值显著下降。与未超声乳液相比,热超声处理制备的乳液Zeta电位绝对值下降超过40%。这是因为未超声溶液中油脂含量较少(0.42%),蛋白质主要分散在连续相中,因此Zeta电位主要反映的是蛋白质的电荷密度。热超声处理后,分散在连续相吸附在油滴表面,导致油滴体积分数增加到4.88%,此时吸附在油滴表面的明胶中带负电荷的氨基酸残基,如天冬氨酸和谷氨酸,参与界面蛋白膜的形成,导致负电荷基团被埋藏,进而导致热超声后乳液Zeta电位下降40%以上。
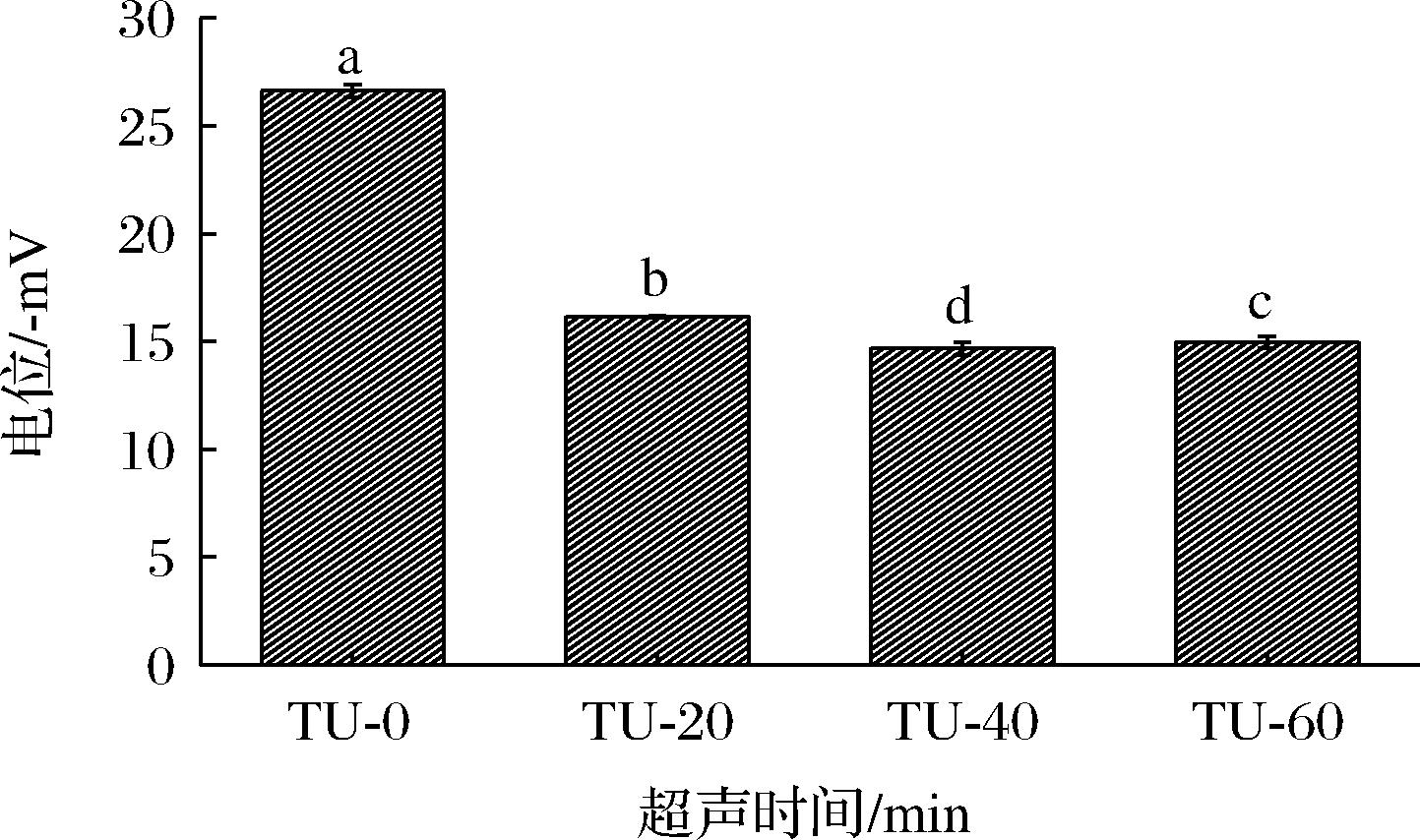
图4 热超声时间对明胶乳液的Zeta电位的影响
Fig.4 Effect of thermo-ultrasound time on the Zeta potential of gelatin-stabilized emulsions
随着热超声时间延长,Zeta电位绝对值先下降再增加,热超声40 min组Zeta电位绝对值最低。通常来说,Zeta电位绝对值下降,表明此时乳液中静电斥力下降,这是乳液稳定性降低的重要因素,但热超声40 min制备的乳液稳定性最高,这可能与维持乳液稳定的另一个重要因素-空间位阻有关。热超声40 min制备的乳液Zeta电位绝对值下降可能是因为更多的明胶负电基团参与界面膜的形成,导致此时乳液稳定性增加。热超声60 min后,乳液Zeta电位绝对值显著增加,但此时乳液稳定性显著降低,这可能因为参与界面膜形成的明胶含量降低,导致稳定性下降和明胶带负电荷基团的增加。
2.4 界面蛋白负载量
界面蛋白负载量Γ是影响油滴凝结稳定性的重要参数。一般地,Γ越高,乳液抗凝结的稳定性就越好[22],因此其提供了更好的空间位阻。乳液界面蛋白负载量随热超声时间的变化情况如图5所示。结果表明,当热超声处理时间由20 min延长到40 min时,乳液界面蛋白负载量由5.34 mg/m2显著增加到7.35 mg/m2,当热超声处理时间延长到60 min后,乳液界面蛋白负载量显著降低到5.82 mg/m2,这与邵云[22]加热对大豆蛋白界面蛋白负载量的研究结果类似。这个结果也解释了,热超声40 min制备的乳液稳定性最高,因其提供了更强的空间位阻作用。界面蛋白负载量的增加可归因于超声波诱导的明胶改性[23],包括明胶疏水基团的解聚和暴露和有序结构含量的增加,这有利于加速明胶向油水界面的迁移[24],从而增加明胶吸附到油水界面的吸附量,并降低了界面张力,进而增加乳液稳定性。
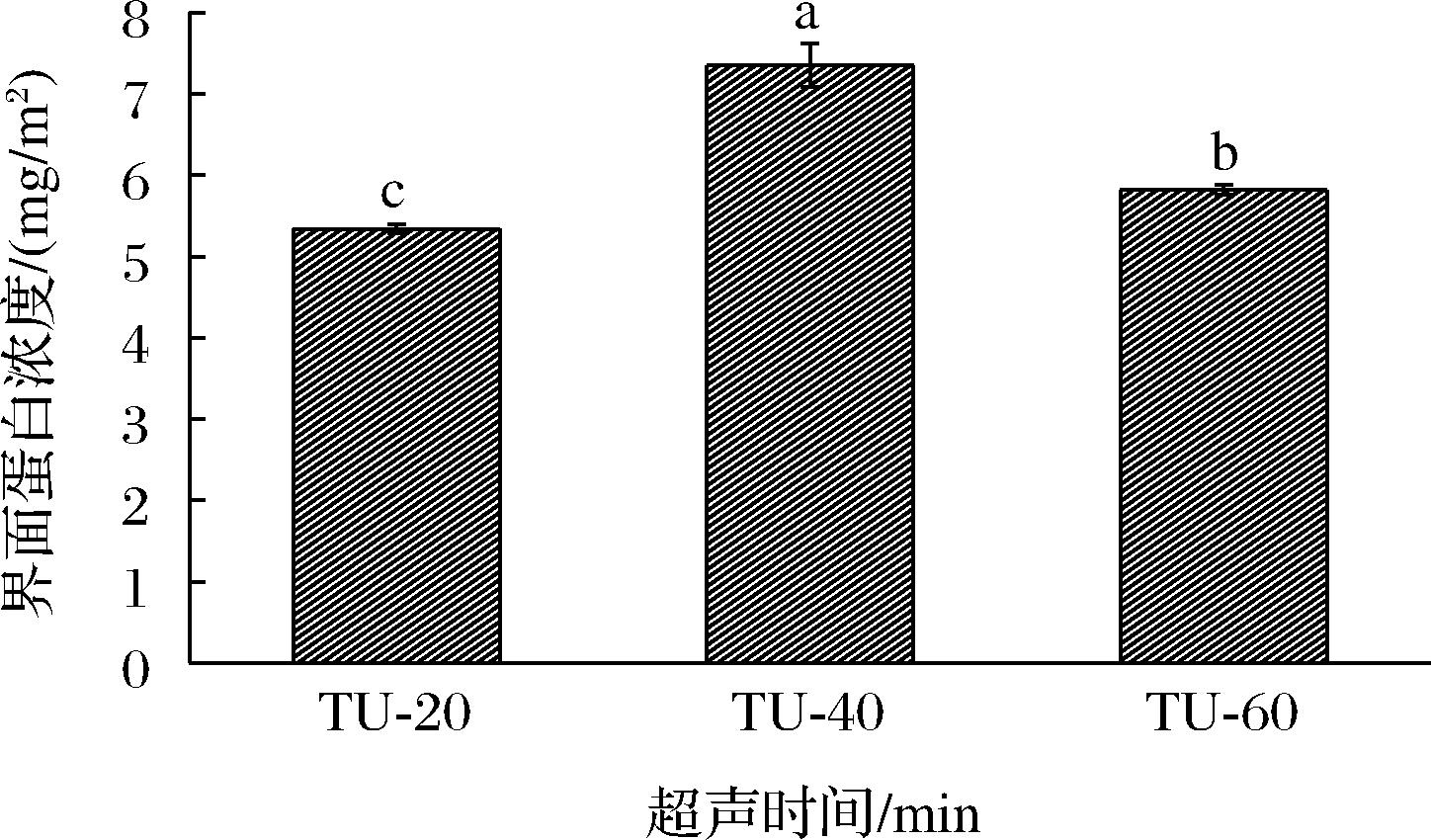
图5 热超声时间对乳液界面蛋白负载量影响
Fig.5 Effect of thermo-ultrasound time on the surface protein load of gelatin-stabilized emulsions
综上所述,热超声可以促进肉汤在热加工过程中的乳化,但过多的热超声波会导致乳状液稳定性降低。这些结果与常规超声处理的乳剂的结果相似,表明适度热超声可增强乳液稳定性。
3 结论
与传统低温超声相比,热超声也可形成稳定的水包油乳液。热超声处理40 min后,鸡汤中油滴的体积分数从0.42%增加到4.88%,此时稳定性最高。这是因为热超声导致更多的蛋白吸附在油滴表面,提供了更强的空间位阻。油滴是鸡汤中香味物质的关键载体,因此研究结果暗示,热超声技术可能为鸡汤的风味调控提供理论依据,进一步为拓展乳液在热加工领域的应用提供借鉴。
[1] RENNARD B O,ERTL R F,GOSSMAN G L,et al.Chicken soup inhibits neutrophil chemotaxis in vitro[J].Chest,2000,118(4):1150-1157.
[2] 张艳,夏杨毅,何翠,等.基于肉鸡性别的鸡汤挥发性物质主成分分析[J].食品与机械,2016,32(7):23-28.
ZHANG Y,XIA Y Y,HE C,et al.Principal component analysis of volatile compounds in chicken soup based on the gender of broiler[J].Food &Machinery,2016,32(7):23-28.
[3] 张小强,田亚东,康相涛,等.固始鸡汤主要营养成分分析[J].食品工业科技,2008,29(1):268-270.
ZHANG X Q,TIAN Y D,KANG X T,et al.[J].Analysis of primary nutritive compositions in Gushi chicken soup[J].Science and Technology of Food Industry,2008,29(1):268-270.
[4] QI J,XU Y,XIE X F,et al.Gelatin enhances the flavor of chicken broth:A perspective on the ability of emulsions to bind volatile compounds[J].Food Chemistry,2020,333:127463.
[5] MEYNIER A,LECOQ C,GENOT C.Emulsification enhances the retention of esters and aldehydes to a greater extent than changes in the droplet size distribution of the emulsion[J].Food Chemistry,2005,93(1):153-159.
[6] QI J,YAN H M,XU Y,et al.Effect of short-term frozen storage of raw meat on aroma retention of chicken broth:A perspective on physicochemical properties of broth[J].LWT-Food Science and Technology,2022,162:113480.
[7] QI J,DU C,YAO X N,et al.Enrichment of taste and aroma compounds in braised soup during repeated stewing of chicken meat[J].LWT-Food Science and Technology,2022,168:113926.
[8] WANG Z J,CHANG Z M,ZANG C,et al.Comparison of the characteristic of soybean protein-phosphatidylcholine nanoemulsion by ultrasound and high pressure homogenization[J].Journal of Chinese Institute of Food Science and Technology,2019,19(8):157-165.
[9] KIMURA T,SUGAHARA T,FUKUYA Y,et al.Effects of ultrasonication on the mineral composition for preparation of chicken-bone soup stock[J].Journal for the Integrated Study of Dietary Habits,1997,8(1):36-41.
[10] JUNG S,JO K,LEE S,et al.Effect of ultrasound treatment on the quality properties of chicken breast meat and the broth from Korean chicken soup (Baeksuk)[J].Korean Journal of Agricultural Science,2019,46(3):539-548.
[11] ZHU W H,HE W,WANG W X,et al.Effects of thermoultrasonic treatment on characteristics of micro-nano particles and flavor in Greenland halibut bone soup[J].Ultrasonics Sonochemistry,2021,79:105785.
[12] SILVA K C G,SATO A C K.Sonication technique to produce emulsions:The impact of ultrasonic power and gelatin concentration[J].Ultrasonics Sonochemistry,2019,52:286-293.
[13] QI J,ZHANG W W,FENG X C,et al.Thermal degradation of gelatin enhances its ability to bind aroma compounds:Investigation of underlying mechanisms[J].Food Hydrocolloids,2018,83:497-510.
[14] 赵秋菊.反相乳液法制备机械活化淀粉接枝丙烯酸高吸水树脂的研究[D].南宁:广西大学,2014.
ZHAO Q J.Synthesis of mechanical activated starch graft acrylic acid superabsorbent in inverse emulsion[D].Nanning:Guangxi University,2014.
[15] 李慧娜,田少君,章绍兵.大豆分离蛋白和浓缩蛋白乳液体系稳定性的比较[J].河南工业大学学报(自然科学版),2017,38(4):6-13.
LI H N,TIAN S J,ZHANG S B.Comparative study on stability of soybean protein isolate and soybean protein concentrate emulsion systems[J].Journal of Henan University of Technology (Natural Science Edition),2017,38(4):6-13.
[16] 王丽娟.玉米醇溶蛋白胶体颗粒的制备及应用研究[D].广州:华南理工大学,2014.
WANG L J.Farbication of zein colloid particles and their applications[D].Guangzhou:South China University of Technology,2014.
[17] LI K,FU L,ZHAO Y Y,et al.Use of high-intensity ultrasound to improve emulsifying properties of chicken myofibrillar protein and enhance the rheological properties and stability of the emulsion[J].Food Hydrocolloids,2020,98:105275.
[18] QI J,JIA C K,ZHANG W W,et al.Ultrasonic-assisted stewing enhances the aroma intensity of chicken broth:A perspective of the aroma-binding behavior of fat[J].Food Chemistry,2023,398:133913.
[19] LI Y J,XIANG D,et al.Stability of oil-in-water emulsions performed by ultrasound power or high-pressure homogenization[J].PLoS One,2019,14(3):e0213189.
[20] LIU H H,WANG B,BARROW C J,et al.Relating the variation of secondary structure of gelatin at fish oil-water interface to adsorption kinetics,dynamic interfacial tension and emulsion stability[J].Food Chemistry,2014,143:484-491.
[21] ZHU Y,LI Y,WU C L,et al.Stability mechanism of two soybean protein-phosphatidylcholine nanoemulsion preparation methods from a structural perspective:A Raman spectroscopy analysis[J].Science Report,2019,9(1):6985.
[22] 邵云.大豆蛋白稳定乳液的物化性质及油脂氧化稳定性研究[D].广州:华南理工大学,2014.
SHAO Y.Physicochemical properties and oxidation stability of oil-in-water emulsions stabilized by soy protein[D].Guangzhou:South China University of Technology,2014.
[23] SHA L,KOOSIS A O,WANG Q L,et al.Interfacial dilatational and emulsifying properties of ultrasound-treated pea protein[J].Food Chemistry,2021,350:129271.
[24] QI J,WANG H H,ZHANG W W,et al.Identification and characterization of the proteins in broth of stewed traditional Chinese yellow-feathered chickens[J].Poultry Science,2018,97(5):1852-1860.