蛋氨酸,又称甲硫氨酸,有D型和L型2种存在形式,均具有生物活性[1]。蛋氨酸被MUELLER首次从酪蛋白中分离出来,被认为是α-氨基-N-丁酸的γ-甲硫基衍生物,是人和动物体中唯一的含硫必需氨基酸,在机体中具有非常重要的生理功能[2]。目前,蛋氨酸已经被广泛应用于各种工业生产中,如饲料、预防肝损伤药物、运动补充剂和婴幼儿制剂等众多食品药品中[3]。现行的蛋氨酸合成方法主要为化学合成法,但是化学合成法的产物为D型和L型外消旋混合物,分离十分困难,不能满足一些高精尖行业的需求,而且对环境污染严重[4-5]。所以迫使人们使用微生物发酵法替代化学合成法[6],但由于蛋氨酸生物合成途径和代谢调节机制较为复杂,给蛋氨酸产生菌的选育带来了很大困难。蛋氨酸生物合成常用菌有大肠杆菌和谷氨酸棒杆菌,HUANG等[7]通过优化丝氨酸合成途径和使用优化过的大肠杆菌W3110,经过补料分批发酵,在48 h内蛋氨酸产量可达到16.86 g/L,使用谷氨酸棒杆菌生产蛋氨酸产量最高约为9.88 g/L[8],该产量对于工业化生产应用还有一定差距,因此对于蛋氨酸高产菌株的选育仍然有待深入研究。
内生菌一般包括内生细菌、内生真菌和内生放线菌,研究发现植物内生菌广泛存在,自VOGL从黑麦草种子内分离出第一株内生真菌以来,植物内生菌就作为一种新的微生物资源受到了广泛关注[9]。因为内生菌和宿主之间可能存在水平基因转移的作用,使得内生菌具有合成其宿主产生的活性化学成分类似物的潜力,是重要次生代谢物的储存库[10]。据报道,盐肤木为众多亚热带常见森林植物种子中蛋氨酸含量较高的一种植物,酸水解法处理测得的蛋氨酸含量高达36.89 mg/g,是开发新型高产蛋氨酸蛋白基因资源的优良选择[11]。因此,本研究尝试从盐肤木种子中挖掘具有产蛋氨酸能力的内生菌,将其应用于蛋氨酸的生物合成领域。
首先从蛋氨酸含量较高的盐肤木种子中分离出内生菌,再利用不同的培养基筛选出高产蛋氨酸的菌株。然后以筛选出的菌株为出发菌株,对出发菌株进行蛋氨酸结构类似物和60Co-γ射线诱变育种,再采用传统方式优化培养基,为实现蛋氨酸的工业生产提供一定的理论依据,有益于下一步研究。
1 材料与方法
1.1 材料与试剂
盐肤木当年新鲜种子,购于淘宝;蛋氨酸标准品、法尼醇、亮氨酸,上海源叶生物科技有限公司;LB培养基、YPD培养基、PDA培养基,国药集团化学试剂有限公司;邻苯二甲醛、β-巯基乙醇、二甲基亚砜、结晶紫,上海阿拉丁生化科技股份有限公司;甲醇、乙腈、三乙胺,武汉弗顿控股有限公司;Ezup柱式细菌基因组DNA抽提试剂盒,生工生物工程股份有限公司;DL2000 Plus DNA Marker,南京诺唯赞生物科技股份有限公司。所有分离用有机溶剂均为分析纯。
1.2 仪器与设备
TS-100B台式恒温振荡器,上海天呈实验仪器制造有限公司;Agilent1100高效液相色谱仪,美国安捷伦公司;SJB-CJ-1FX生物超净工作台,苏州佳宝净化设备有限公司;Thermo酶标仪,美国赛摩飞世尔科技公司;智能生化培养箱SPX-1000,宁波赛福实验仪器有限公司;Olympus光学显微镜,奥林巴斯有限公司;
1.3 实验方法
1.3.1 盐肤木种子中高产蛋氨酸内生菌的筛选
取新鲜的盐肤木种子,在75%(体积分数)乙醇中浸泡l min,无菌水漂洗3次后用5%(体积分数)NaClO消毒2 min,再用无菌水冲洗3~4次,无菌滤纸吸干[12]。在无菌工作台中用研钵研磨种子,将研磨获得的液体,按照1、10、100、1 000倍稀释,取100 μL,分别在LB、YPD、PDA固态培养基上涂板。LB平板置于37 ℃培养,YPD和PDA平板置于28 ℃培养。将从培养基上获取获得的内生菌菌株,挑取单克隆,分别接种于5 mL的LB、YPD和PDB液体培养基,120 r/min,培养72 h。培养结束后,取种子液1 mL,分别接种于对应的100 mL液体培养基中,培养72 h,之后通过蛋氨酸含量测定,筛选出高产蛋氨酸的菌株。
1.3.2 盐肤木种子中高产蛋氨酸内生菌菌种鉴定
将筛选出的高产蛋氨酸菌株进行细胞学鉴定。从种子内部取内生菌,在培养72 h左右时进行革兰氏染色,确定该菌株为革兰氏阳性菌。基因测序:使用Ezup柱式细菌基因组DNA抽提试剂盒进行DNA提取。用于16S rRNA的PCR反应的引物为一对通引物,一般细菌鉴定选择通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR反应体系为:5×SF Buffer 4 μL,dNTPs(0.02 mol/L)1 μL,正、反向引物(10 μmol/L)各0.4 μL,DNA模板2 μL,Phanta酶(1 U/50 μL)0.4 μL,ddH2O 11.8 μL。PCR扩增程序如下:94 ℃ 5 min→(94 ℃ 30 s→56 ℃ 30 s→72 ℃ 1 min)×30个循环→72 ℃ 10 min→4 ℃保温。PCR产物的纯化和测序由上海生工生物技术公司完成,将菌株LB-2序列在NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cg)上进行BLAST比对分析,在GenBank中下载相近典型菌株的16S rRNA基因序列,利用MEGA X软件,采用邻接法(neighbor-joining)进行1 000次自展分析(bootstrap analysis),构建基于16S rRNA基因序列的系统发育树[13]。
1.3.3 生物量的测定
量取40 mL的发酵液,离心,向沉淀中加入少量的蒸馏水使得菌体悬浮,倒入已记录过质量的玻璃培养皿中。将培养皿放在烘箱中烘干,直到前后2次称量质量不再发生变化,记录质量。比较前后2次的质量差,即为40 mL发酵液中生物体的质量。
1.3.4 蛋氨酸含量的检测
用高效液相色谱法测定蛋氨酸含量。Agilent 1200色谱仪,色谱柱C18,流动相A相(1 L):无水乙酸钠5 g,四氢呋喃5 mL,三乙胺200 μL,pH为7.2。流动相B相(1 L):无水乙酸钠5 g,超纯水200 mL,甲醇400 mL,乙腈400 mL,pH为7.2。紫外检测器检测波长338 nm,柱温40 ℃,流速1.0 mL/min。配制质量浓度为1 mg/mL的蛋氨酸标准品,使用前稀释成浓度为1、10、20、50、100、200、500、1 000 μg/mL等8个梯度,0.22 μm微孔滤膜过滤后进样测定。得到回归方程y=1.594 1x+0.289 9,R2=0.999 6。将发酵液经0.22 μm的滤膜过滤,加入液相小瓶,样品准备完毕。样品采用自动衍生化程序,衍生试剂包括:1 μL样品+5 μL硼酸+1 μL OPA+32 μL水。梯度洗脱程序见表1,洗脱时间为38 min。
表1 梯度洗脱程序
Table 1 Gradient elution procedure
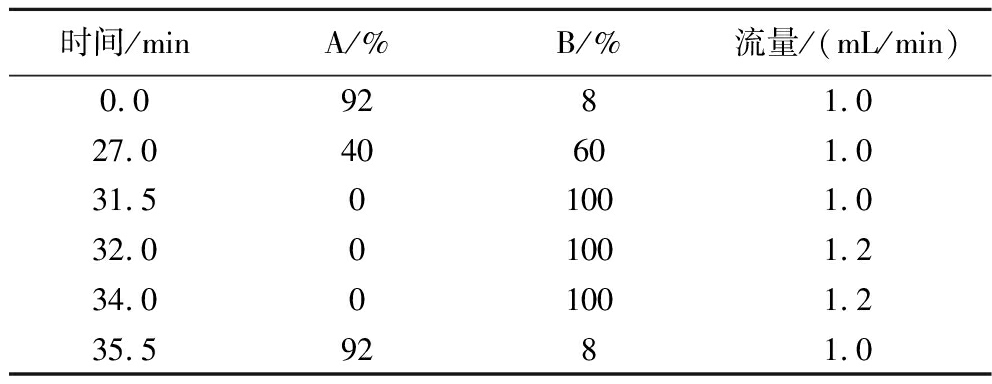
时间/minA/%B/%流量/(mL/min)0.09281.027.040601.031.501001.032.001001.234.001001.235.59281.0
1.3.5 亮氨酸抑制浓度确定
据报道,闵伟红等[14]和林小秋等[15]以亮氨酸作为蛋氨酸的结构类似物,进行蛋氨酸抗结构类似物突变株的筛选,使蛋氨酸产量得到明显提高。本研究以高产蛋氨酸菌株LB-2为出发菌株,用亮氨酸筛选抗蛋氨酸结构类似物突变株。配制亮氨酸质量浓度分别为0、2、4、6、8 g/L的LB培养基平板,从LB培养基斜面上挑取菌落到LB液体培养基中培养到对数期。稀释104倍,取200 μL涂板,37 ℃培养48 h。比较LB-2菌株在不同浓度下的亮氨酸的生长状况,由此确定筛选培养基中应该添加的亮氨酸的质量浓度。
1.3.6 60Co-γ射线诱变及诱变菌株的筛选
取5 mL对数期的LB-2菌液离心,弃上清液,生理盐水洗涤3次,最后悬浮于生理盐水中,使得OD600为0.5左右。采用200雷姆剂量的60Co-γ射线对其进行照射诱变,将经过辐照后的菌液分别用生理盐水稀释105、106、107倍,并涂布在含有一定质量浓度亮氨酸的筛选培养基平板中,挑选菌落直径比较大的单克隆菌体,采用点菌的方式分别点植在LB固体培养基和含有亮氨酸的筛选培养基上进行发酵,37 ℃、220 r/min,培养48 h。选择对亮氨酸抑制作用不敏感的突变菌株,测定发酵液中蛋氨酸的含量,挑选出蛋氨酸产量最高的菌株。
1.3.7 单因素试验
固定单因素试验条件为葡萄糖15 g/L、硫酸钠1.5 g/L、法尼醇75 μmol/L,研究向培养基中加入不同含量的葡萄糖(5、10、15、20、25 g/L)、硫酸钠(0.5、1.0、1.5、2.0、2.5 g/L)和法尼醇(25、50、75、100、125 μmol/L)对LB-2-13菌株蛋氨酸产量的影响。
1.3.8 响应面法优化试验
通过单因素试验确定选取葡萄糖、硫酸钠、法尼醇3个因素进行编码,得出各因素的交互作用,并求出各因素的最佳水平,实验设计及结果见表2。
表2 Box-Behnken试验因素及水平
Table 2 Factors and levels in Box-Behnken experimental design
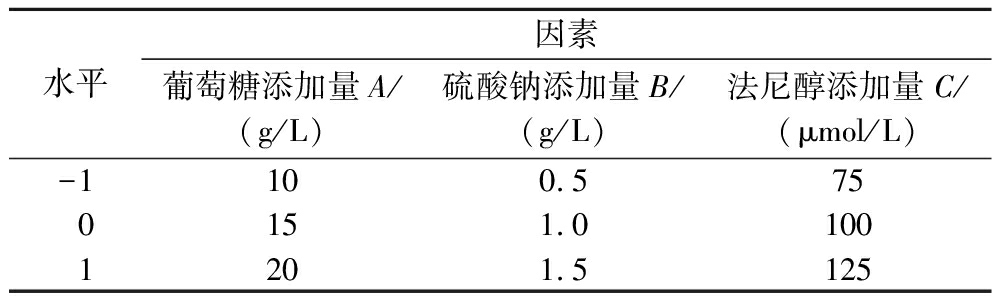
水平因素葡萄糖添加量A/(g/L)硫酸钠添加量B/(g/L)法尼醇添加量C/(μmol/L)-1100.5750151.01001201.5125
1.4 数据分析
采用SPSS 20.0软件对数据进行差异显著性检验和相关性分析,Origin 2021软件作图,利用软件Design-Expert 10进行试验设计和分析,每个试验重复3次。
2 结果与分析
2.1 盐肤木种子中高产蛋氨酸内生菌的筛选和鉴定
植物内生菌的代谢产物非常丰富,是许多生物活性代谢物的重要来源,这些代谢产物表现出了抗菌、抗糖尿病、杀虫和抗关节炎等活性[16]。在以往研究中,蛋氨酸生产常用菌株有大肠杆菌、谷氨酸棒杆菌、枯草芽孢杆菌和百合棒杆菌等[17]。本研究从先前的研究报道中得到启发[18],首次使用盐肤木内生菌作为蛋氨酸的生产菌株。从图1可以看出盐肤木种子中培养筛选出的11种菌株在LB、PDA、YPD 3种平板中单克隆呈现出不同颜色和形态,LB平板上呈现黄绿色,PDA平板上呈现白色或者褐色,YPD平板上呈现浅褐色或棕褐色。对筛选出的11种菌株进行命名,根据所使用培养基的不同,分别命名为LB-1、LB-2、LB-3、LB-4、LB-5、YPD-1、YPD-2、YPD-3、PDA-1、PDA-2、PDA-3。从图2可以看出这11株内生菌均可产生蛋氨酸,LB平板上的菌株生产蛋氨酸的能力更高,LB-2产蛋氨酸的能力最强,可达0.92 g/L。

图1 分离的菌株在不同平板上的形态特征
Fig.1 Morphological characteristics of the isolated strains on different plates
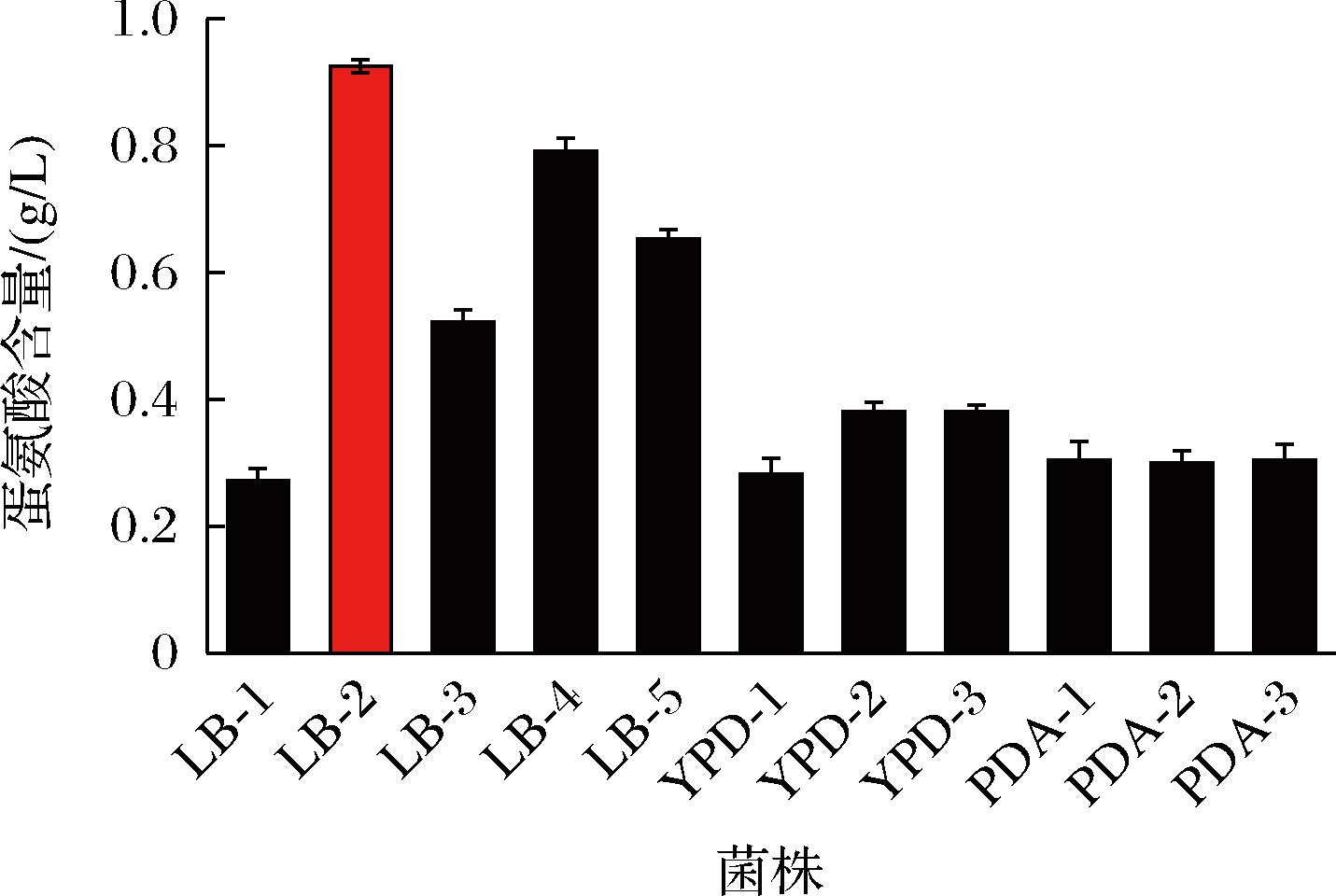
图2 盐肤木种子内生菌株发酵液蛋氨酸含量
Fig.2 Methionine content of fermentation broth from endophytic strains of Rhus chinensis seeds
用琼脂糖凝胶电泳观察PCR扩增产物。如图3-a所示,菌株ITS序列扩增产物在约1 600 bp的位置有明显的条带,且无其他杂质存在。
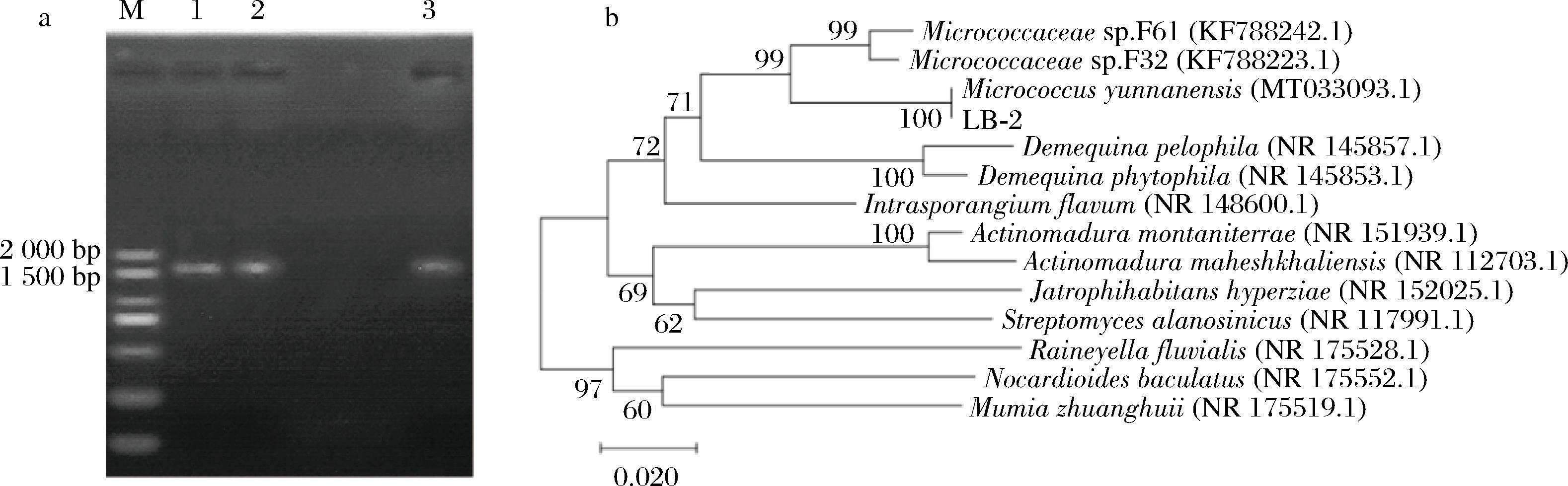
a-PCR扩增产物电泳结果;b-基于16S rRNA基因序列构建的系统发育树
图3 LB-2菌种鉴定
Fig.3 LB-2 strain identification
注:M-DL2000 DNA Marker;1~3-LB-2,LB-4,LB-5 PCR扩增产物。
将所得16S rRNA 基因序列在NCBI数据库中进行同源性比对,与菌株LB-2相似度最高的菌株为Micrococcus luteus strain NCTC 2665(NR 075062.2,相似度为99%)、Micrococcus aloeverae strain AE-6(NR 134088.1,相似度为99%)。图3-b为LB-2菌株的系统进化树,由图可知,LB-2与Micrococcus yunnanensis(MT033093.1)的同源性最高,达到了100%。结合形态特征和16S rRNA 基因序列同源性,确定LB-2菌株为微球菌属。
2.2 亮氨酸抑制浓度的确定
筛选抗结构类似物突变株是使相关酶的调节基因或变构酶的结构基因发生突变,使结构类似物不能再与阻遏物或变构酶结合,即结构类似物不再抑制突变株的生长,从而解除反馈调节[19]。从图4可以看出,菌株在加入了6 g/L亮氨酸的平板中的菌落大小为空白对照平板中的一半,且数量上也要少很多,说明含有6 g/L亮氨酸的LB培养基对菌体的生长有一定的抑制作用,可以选用为筛选培养基。
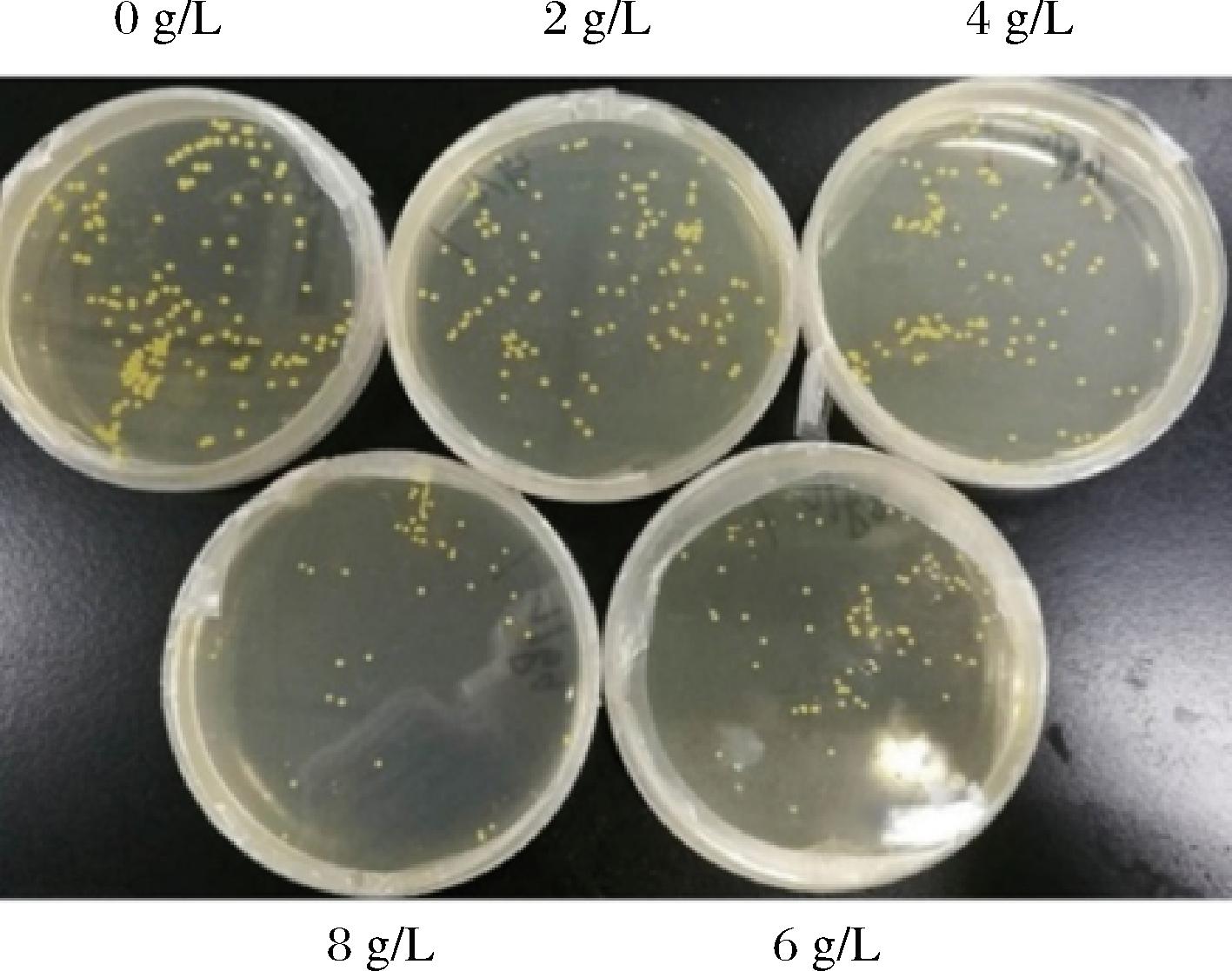
图4 不同质量浓度的亮氨酸对菌落生长的影响
Fig.4 Effect of leucine mass concentration on colony growth
2.3 60Co-γ射线诱变菌株的筛选
60Co-γ射线是一种高能电磁波,它产生的电离辐射可以直接或间接改变DNA的结构[20]。有研究表明,通过对阿库曲霉G1-3进行60Co-γ射线照射,葡萄糖苷酶的产量从1.94 U/mL增加到7.02 U/mL[21]。据报道,黑曲霉DSM 26641中的β-1,4-endoxylanase酶活性因60Co-γ辐射而大大提升[22]。实验标号0和33为原始菌株,如图5所示,13和25号菌株无论是蛋氨酸产量还是生物量都明显高于其他菌株,尤其是13号菌株,蛋氨酸产量达到了1.52 g/L。经过60Co-γ射线诱变和6 g/L亮氨酸筛选之后,一些突变菌株产蛋氨酸的能力得到明显提升。
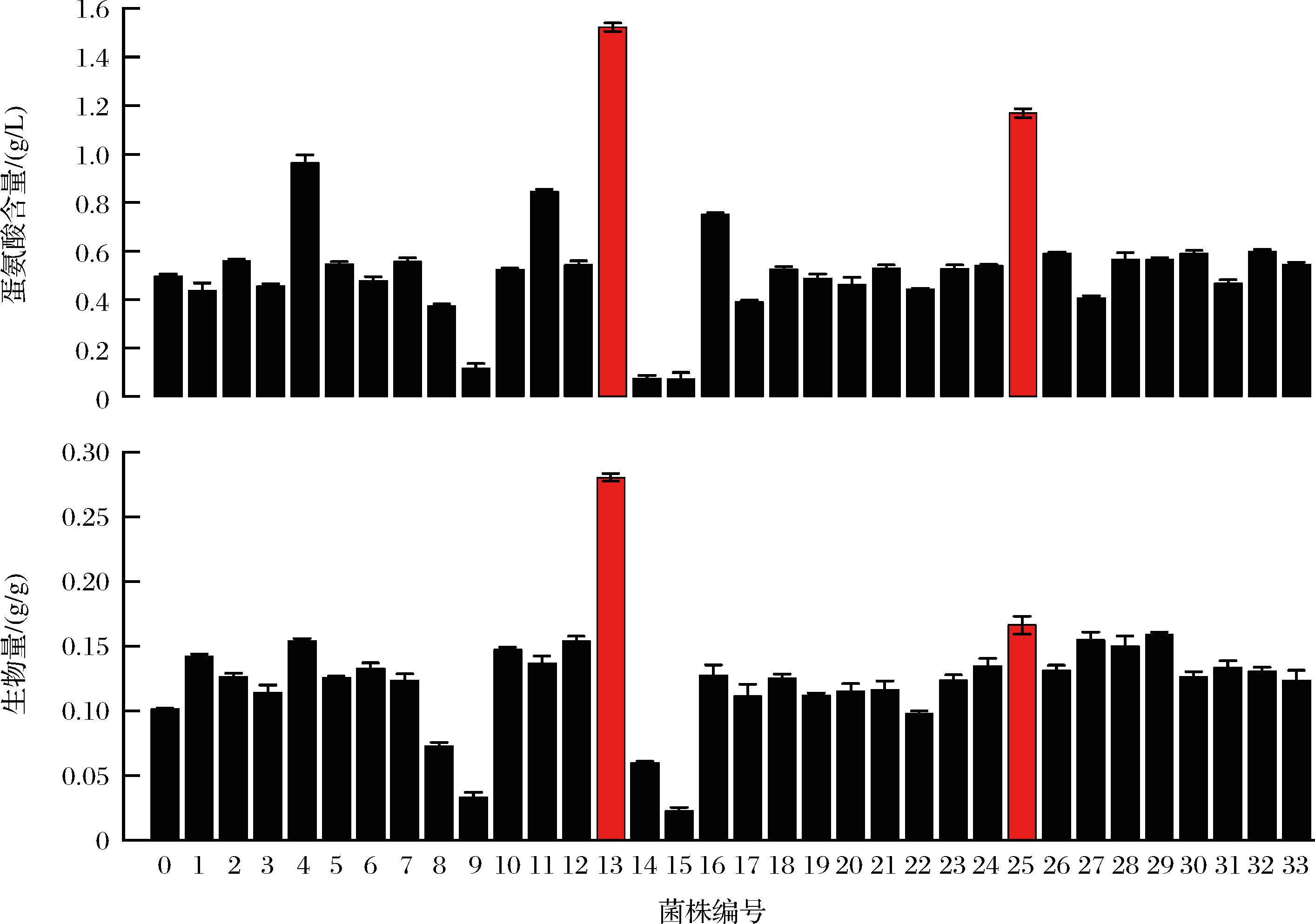
a-诱变菌株不同菌株的蛋氨酸产量;b-诱变菌株不同菌株的生物量
图5 诱变菌株的蛋氨酸含量及生物量
Fig.5 Methionine content and biomass of mutagenic strain
2.4 单因素试验结果
2.4.1 葡萄糖添加量对LB-2-13蛋氨酸产量的影响
葡萄糖在蛋氨酸生物合成过程中具有非常重要的作用,不仅为微生物的生长提供能量,还作为原料直接参与蛋氨酸的合成。葡萄糖通过糖酵解等途径转化为乙酰辅酶A,进入TCA循环,生成草酰乙酸盐,通过天冬氨酸氨基转移酶将代谢通量导向天冬氨酸。利用一系列酶,连续还原天冬氨酸末端羧基合成高丝氨酸,最终得到蛋氨酸[23]。如图6-a所示,当葡萄糖添加量超过10 g/L时,发酵液中的生物量开始明显降低,可能是因为随着葡萄糖质量浓度的提升,发酵液中的渗透压也随之提升,渗透压过高会导致微生物失水而发生质壁分离,从而导致生物量降低。随着葡萄糖添加量的增加,发酵液中蛋氨酸含量呈现先上升后下降的趋势,当添加量为15 g/L时蛋氨酸含量达到最高。最终确定最适葡萄糖添加量为15 g/L。
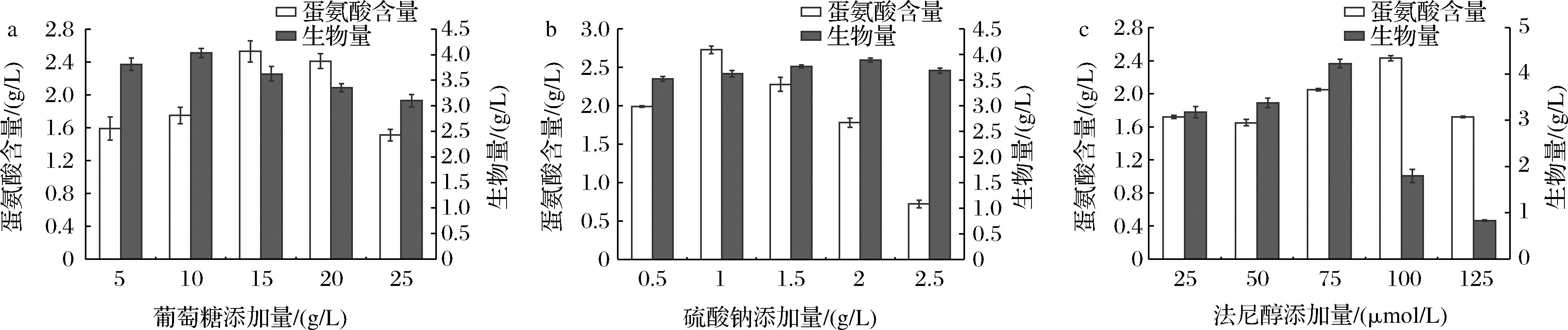
a-葡萄糖添加量对蛋氨酸参量的影响;b-硫酸钠添加量对蛋氨酸参量的影响;c-法尼醇添加量对蛋氨酸参量的影响
图6 不同因素对蛋氨酸产量的影响
Fig.6 Effects of different factors on methionine yield
2.4.2 硫酸钠添加量对LB-2-13蛋氨酸产量的影响
蛋氨酸中硫的主要来源是硫的同化,硫的同化主要指的是![]() 被转运体运输到细胞中之后,在硫酸腺苷酸转移酶(ATP sulfurylase,cysDN)的作用下生成5-磷酸腺苷硫酸盐(adenosine-5-phosphosulfate,APS),然后在腺苷硫酸盐激酶(APS kinase,cysC)的作用下形成3′-磷酸腺苷-5-磷酸硫酸盐(3′-phosphoadenosine-5-phosphosulfate,PAPS),之后被还原酶还原为H2S,H2S可以直接参与蛋氨酸的合成[24-25]。本试验选择含有
被转运体运输到细胞中之后,在硫酸腺苷酸转移酶(ATP sulfurylase,cysDN)的作用下生成5-磷酸腺苷硫酸盐(adenosine-5-phosphosulfate,APS),然后在腺苷硫酸盐激酶(APS kinase,cysC)的作用下形成3′-磷酸腺苷-5-磷酸硫酸盐(3′-phosphoadenosine-5-phosphosulfate,PAPS),之后被还原酶还原为H2S,H2S可以直接参与蛋氨酸的合成[24-25]。本试验选择含有![]() 的硫酸钠做为硫源,硫酸钠添加量对LB-2-13菌生长和蛋氨酸产量的影响如图6-b所示,当硫酸钠添加量为1 g/L时,蛋氨酸产量最高,因此确定最适硫酸钠添加量为1 g/L。有研究发现还原
的硫酸钠做为硫源,硫酸钠添加量对LB-2-13菌生长和蛋氨酸产量的影响如图6-b所示,当硫酸钠添加量为1 g/L时,蛋氨酸产量最高,因此确定最适硫酸钠添加量为1 g/L。有研究发现还原![]() 比
比![]() 所需的能量更少,硫代硫酸盐有可能成为工业发酵的优化培养基中硫源的更优选择[26]。本文在前期研究中尝试使用硫代硫酸钠代替硫酸钠作为硫源,但发酵完成后发现以硫酸钠作为硫源的培养基中蛋氨酸含量更高,可能是因为蛋氨酸在微球菌中硫同化内部途径所需关键酶与大肠杆菌和酿酒酵母中不同,所需的能量也不同。最终选择硫酸钠作为硫源。
所需的能量更少,硫代硫酸盐有可能成为工业发酵的优化培养基中硫源的更优选择[26]。本文在前期研究中尝试使用硫代硫酸钠代替硫酸钠作为硫源,但发酵完成后发现以硫酸钠作为硫源的培养基中蛋氨酸含量更高,可能是因为蛋氨酸在微球菌中硫同化内部途径所需关键酶与大肠杆菌和酿酒酵母中不同,所需的能量也不同。最终选择硫酸钠作为硫源。
2.4.3 法尼醇添加量对LB-2-13蛋氨酸产量的影响
法尼醇是由真菌物种白色念珠菌分泌的一种群体感应分子,主要在白色念珠菌生物膜生长期间起到生理作用,它还可以对其他细菌的生理活动起到一定的调控作用,例如调节细胞生理特征、形态、抗菌性等[27]。LOPES等[28]研究发现法尼醇同样能够影响耐甲氧西林金黄色葡萄球菌等细菌生物膜的形成,与生物膜中重要蛋白质具有显著的结合亲和力。本研究利用法尼醇对细菌生物膜的影响,找到促进微球菌中蛋氨酸高产的一种创新方式。从图6-c可以看出,加入100 μmol/L法尼醇时蛋氨酸含量最高,因此确定最适法尼醇添加量为100 μmol/L。适量的法尼醇显著提高了微球菌中蛋氨酸的产量,具体原因可以从以下几个方面考虑:首先,有研究显示,适量的法尼醇可以增加金黄色葡萄球菌中的溶氧量[29],微球菌是需氧菌,法尼醇通过增加微球菌中的溶氧量,产生足够的能量用于蛋氨酸合成途径中关键酶的合成以及蛋氨酸的运输。其次,法尼醇可以通过影响微球菌生物膜的形成,改变生物膜的蛋白成分,从而影响蛋氨酸的转运过程。另外,最直接的影响就是法尼醇对微球菌中蛋氨酸合成途径的调控,法尼醇在培养基中随着发酵过程的进行被微球菌慢慢积累,从而改变合成途径中关键酶的基因表达,以实现蛋氨酸的高产。
2.5 响应面试验结果
为了进一步提高LB-2-13菌株的蛋氨酸产量,利用Box-Behnken设计法对筛选出的3个因素进行优化,试验设计及结果见表3。
表3 响应面试验设计及结果
Table 3 Response surface experimental design and results
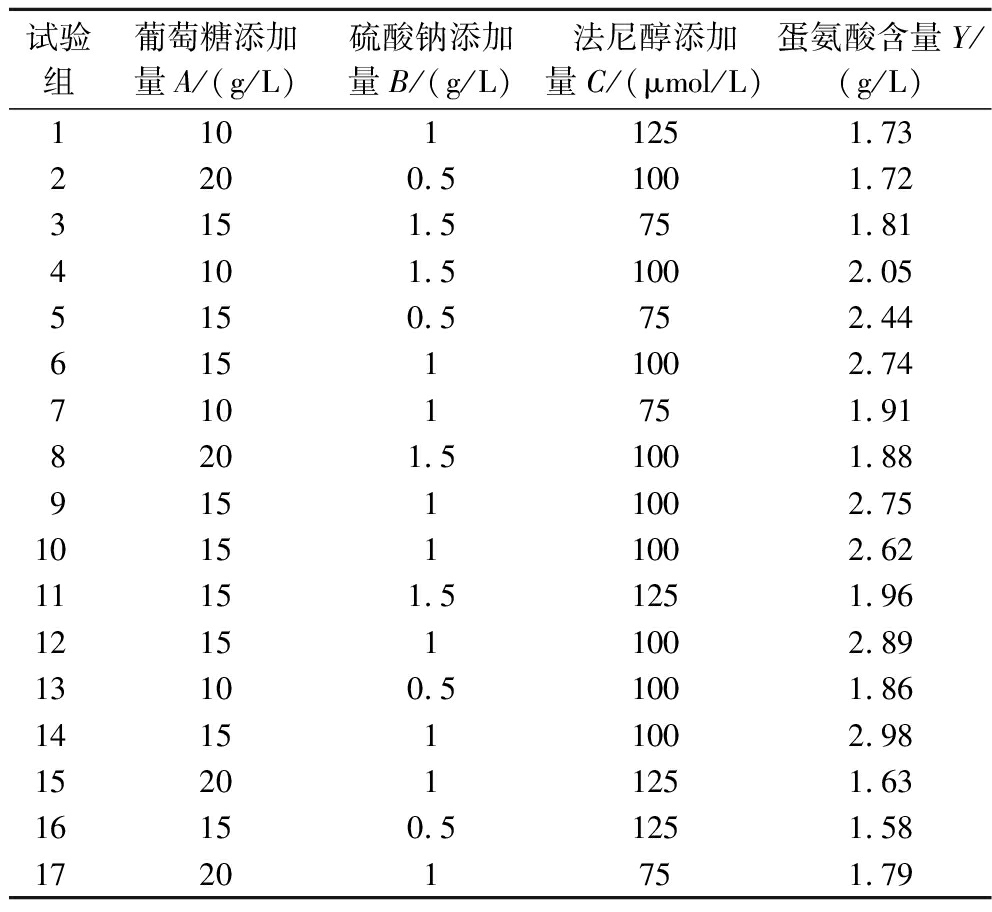
试验组葡萄糖添加量A/(g/L)硫酸钠添加量B/(g/L)法尼醇添加量C/(μmol/L)蛋氨酸含量Y/(g/L)11011251.732200.51001.723151.5751.814101.51002.055150.5752.4461511002.747101751.918201.51001.8891511002.75101511002.6211151.51251.96121511002.8913100.51001.86141511002.98152011251.6316150.51251.5817201751.79
各因素经过回归拟合,得到回归方程:Y=2.80-0.066A+0.013B-0.13C-7.50AB+5.00AC+0.25BC-0.55A2-0.37B2-0.48C2。从表4可以看出,响应值模型P值小于0.05,该二次项方程模型显著;同时该模型失拟项P值大于0.05,说明模型失拟项不显著,可以较好地拟合实验数据。响应值可信度分析的模型相关系数R2为0.96,表示该模型相关度很好;变异系数为6.66%,表示该模型置信度较高,可以反映试验的真实性。综上所述,该回归模型对响应值的拟合程度较高,方程能够较好地反映响应值与自变量的关系。
表4 回归方程的方差分析
Table 4 ANOVA for regression equations
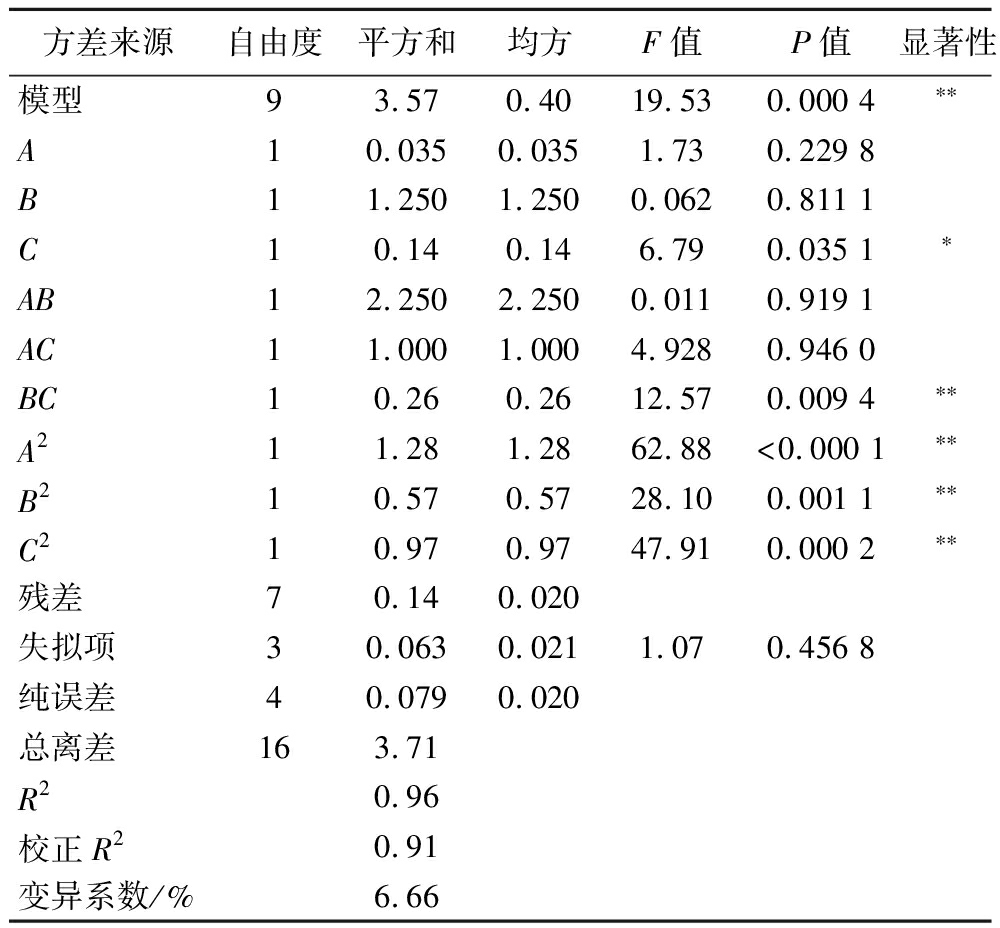
方差来源自由度平方和均方F值P值显著性模型93.570.4019.530.000 4∗∗A10.0350.0351.730.229 8B11.2501.2500.0620.811 1C10.140.146.790.035 1∗AB12.2502.2500.0110.919 1AC11.0001.0004.9280.946 0BC10.260.2612.570.009 4∗∗A211.281.2862.88<0.000 1∗∗B210.570.5728.100.001 1∗∗C210.970.9747.910.000 2∗∗残差70.140.020失拟项30.0630.0211.070.456 8纯误差40.0790.020总离差163.71R20.96校正R20.91变异系数/%6.66
注:**表示差异极显著(P<0.01),*表示差异显著(P<0.05)。
为了更直观地反映各因素对响应值的影响,对回归模型进行响应面图分析。当多种因素交互作用时,三维曲面图可直观反映响应值的变化趋势。从图7可知,随着葡萄糖、硫酸钠和法尼醇添加量的增加,蛋氨酸含量呈现先增加后减少的趋势,通过比较3因素的P值可知,各因素对蛋氨酸产量的影响大小为:C>A>B,即法尼醇添加量>葡萄糖添加量>硫酸钠添加量。通过试验优化得到的培养基配方为:葡萄糖14.70 g/L,硫酸钠0.98 g/L,法尼醇96.35 μmol/L,预测得到的最高蛋氨酸含量为2.81 g/L。在此条件下进行最佳工艺验证试验,测定发酵液中蛋氨酸含量,平行测定3次试验结果为2.85 g/L,与预测值接近,证明此模型可以用于LB-2-13菌株生产蛋氨酸培养基条件的优化。
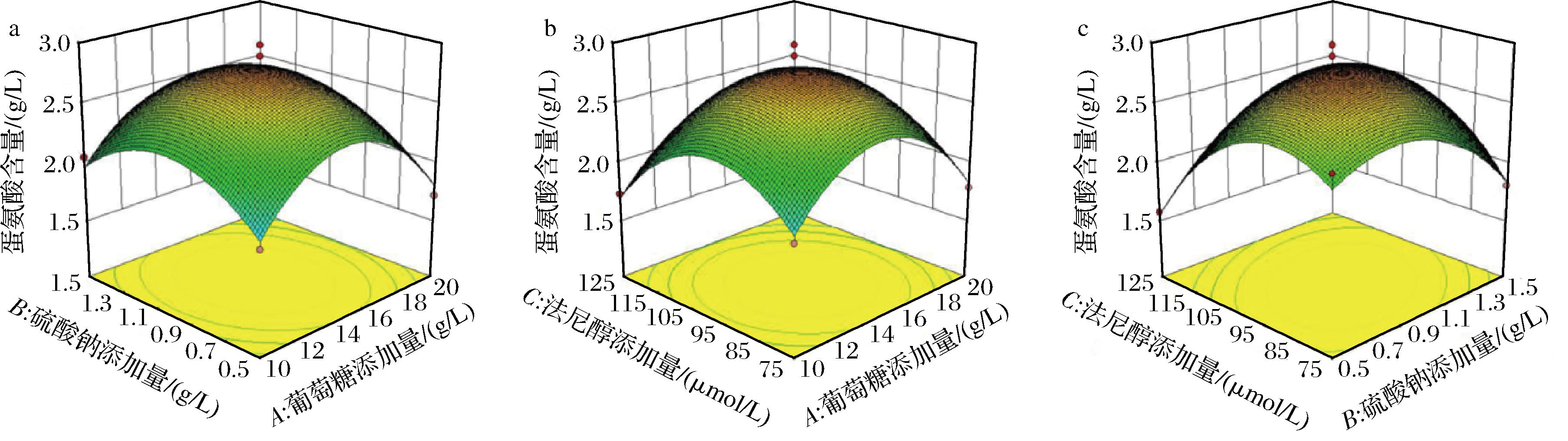
a-葡萄糖-硫酸钠交互作用;b-葡萄糖-法尼醇交互作用;c-硫酸钠-法尼醇交互作用
图7 葡萄糖、硫酸钠和法尼醇添加量两两交互作用对LB-2-13菌株蛋氨酸产量的影响
Fig.7 Effects of the interaction of glucose,sodium sulfate,and farnesol additions on methionine yield in LB-2-13 bacteria
3 结论
本文从盐肤木种子中分离内生菌进行蛋氨酸发酵培养,筛选出高产菌株LB-2。之后选择LB-2菌株为出发菌株,采用60Co-γ射线、蛋氨酸结构类似物进行诱变筛选,最终得到高产菌株LB-2-13。实验结果表明,同等发酵条件下,突变菌株比野生菌株的蛋氨酸产量增加了162.72%。培养基的优化,是微生物发酵中最常见的优化方式,在单因素试验的基础上,使用响应面优化LB-2-13菌蛋氨酸合成的培养条件,得出在葡萄糖14.70 g/L,硫酸钠0.98 g/L,法尼醇96.35 μmol/L的条件下,蛋氨酸的产值最高,产值可以达到2.85 g/L,比未优化前增长了约88%。为早日实现蛋氨酸生物合成工业化生产提供理论依据。
但在不同的微生物中,蛋氨酸的合成途径存在一定差异,如高丝氨酸在大肠杆菌中被高丝氨酸-O-琥珀酰基转移酶(homoserine succinyltransderase,metA)和高丝氨酸激酶(homoserine kinase,HK)催化形成O-琥珀酰-L-高丝氨酸和O-磷酸-L-高丝氨酸,而在谷氨酸棒杆菌中则被高丝氨酸乙酰转移酶(homoserine acetyltransferase,HAT)催化形成O-乙酰-L-高丝氨酸[30]。蛋氨酸在微球菌中也应有独特的合成途径,但目前对其合成途径没有深入了解,并且蛋氨酸生物合成过程中还受到硫同化内部途径关键酶、转运体、反馈抑制、阻遏蛋白、NADPH和ATP等多种物质及机制的调控。此外,在发酵过程中,还受到营养元素和培养条件的影响。在后续研究中,研究者可以从蛋氨酸在微球菌内的合成途径着手,掌握合成途径中关键酶和重要前体物质,使用RT-PCR检测合成途径中关键酶的基因表达水平。通过基因改造的方式解除关键物质的反馈调节,提高关键酶的酶活,实现对各个前体物质的综合调控,进一步提高微球菌中蛋氨酸的产量。
[1] BOLTEN C J,SCHRÖDER H,DICKSCHAT J,et al.Towards methionine overproduction in Corynebacterium glutamicum-methanethiol and dimethyldisulfide as reduced sulfur sources[J].Journal of Microbiology and Biotechnology,2010,20(8):1196-1203.
[2] 魏磊.代谢工程策略合成甲硫氨酸的研究[D].杭州:浙江工业大学,2020.
WEI L.Study on methionine synthesis by metabolic engineering strategy[D].Hangzhou:Zhejiang University of Technology,2020.
[3] ZHANG Y Y,JELLESCHITZ J,GRUNE T,et al.Methionine restriction-Association with redox homeostasis and implications on aging and diseases[J].Redox Biology,2022,57:102464.
[4] 石程,程存归.固-液相转移催化法合成蛋氨酸[J].化学工程师,1999,13(2):5-6.
SHI C,CHENG C G.Synthesis of methionine by solid-liquid phase transfer catalytic alkylation[J].Chemical Engineer,1999,13(2):5-6.
[5] 刘诗梦,韩彩静,高云娜,等.蛋氨酸特异性合成途径关键酶—高丝氨酸O-酰基转移酶的研究进展[J].食品科学,2019,40(11):261-267.
LIU S M,HAN C J,GAO Y N,et al.Recent progress in the study of homoserine O-acyltransferase,the key enzyme in the methionine biosynthesis pathway[J].Food Science,2019,40(11):261-267.
[6] KUMAR D,SUBRAMANIAN K,BISARIA V S,et al.Effect of cysteine on methionine production by a regulatory mutant of Corynebacterium lilium[J].Bioresource Technology,2005,96(3):287-294.
[7] HUANG J F,SHEN Z Y,MAO Q L,et al.Systematic analysis of bottlenecks in a multibranched and multilevel regulated pathway:The molecular fundamentals of L-methionine biosynthesis in Escherichia coli[J].ACS Synthetic Biology,2018,7(11):2577-2589.
[8] LI Y,AI Y Q,ZHANG J Z,et al.A novel expression vector for Corynebacterium glutamicum with an auxotrophy complementation system[J].Plasmid,2020,107:102476.
[9] ALI B,HAFEEZ A,JAVED M A,et al.Role of endophytic bacteria in salinity stress amelioration by physiological and molecular mechanisms of defense:A comprehensive review[J].South African Journal of Botany,2022,151:33-46.
[10] SANTHOSH C R,NUTHAN B R,MAHADEVAKUMAR S,et al.Endophytic Association:What,Why and How.Academic Press[M].New York:Academic Press,2023:457-486.
[11] 陈宏伟,杨进军,饶力群,等.119种植物种子蛋氨酸含量分析[J].广西植物,2012,32(4):557-560.
CHEN H W,YANG L J,RAO J Q,et al.Analysis of methionine contents in seeds of 119 plants[J].Guihaia,2012,32(4):557-560.
[12] 杜慧娟,王伯初,米鹏程,等.药用植物内生菌的分离及抗菌活性的初步研究[J].氨基酸和生物资源,2008,30(1):61-64;69.
DU H J,WANG B C,MI P C,et al.Isolation of endophytes in pharmaceutical plants and pilot study of its antimicrobial activity[J].Amino Acids & Biotic Resources,2008,30(1):61-64;69.
[13] KUMAR S,STECHER G,LI M,et al.MEGA X:Molecular evolutionary genetics analysis across computing platforms[J].Molecular Biology and Evolution,2018,35(6):1547-1549.
[14] 闵伟红,林小秋,冯琦,等.抗蛋氨酸结构类似物突变株的筛选[J].吉林大学学报(理学版),2009,47(4):840-845.
MIN W H,LIN X Q,FENG Q,et al.Screening of methionine analogue resistant mutant[J].Journal of Jilin University(Science Edition),2009,47(4):840-845.
[15] 林小秋,冯琦,张东环,等.抗乙硫氨酸突变株产蛋氨酸发酵工艺条件的优化[J].食品科学,2009,30(3):243-248.
LIN X Q,FENG Q,ZHANG D H,et al.Optimization of fermentation conditions for methionine production by ethionine-resistant mutant[J].Food Science,2009,30(3):243-248.
[16] TIWARI P,KANG S,BAE H.Plant-endophyte associations:Rich yet under-explored sources of novel bioactive molecules and applications[J].Microbiological Research,2023,266:127241.
[17] 王隆洋,闵伟红.利用生物技术生产甲硫氨酸的研究进展[J].食品科学,2016,37(3):280-285.
WANG L Y,MIN W H.Progress and prospects for methionine bioproduction[J].Food Science,2016,37(3):280-285.
[18] 方珍娟,张晓霞,马立安.植物内生菌研究进展[J].长江大学学报(自科版),2018,15(10):41-45.
FANG Z J,ZHANG X X,MA L A.Research progress of endophytic bacteria in plants[J].Journal of Yangtze University(Natural Science Edition),2018,15(10):41-45.
[19] LANGEDIJK J A G M,TOLENAARS D,BOLIER R,et al.Inhibition of autotaxin by bile salts and bile salt-like molecules increases its expression by feedback regulation[J].Biochimica et Biophysica Acta (BBA)-Molecular Basis of Disease,2021,1867(11):166239.
[20] WANG Y X,WANG J Q,ZHANG X X,et al.Genomic and transcriptomic analysis of Bacillus subtilis JNFE1126 with higher nattokinase production through ultraviolet combined 60Co-γ ray mutagenesis[J].LWT,2021,147:111652.
[21] XI R P,QI Y Q,ZHANG B X,et al.Mutagenesis of Aspergillus aculeatus by 60Co-γ irradiation for high production of potential ILs-tolerant cellulase[J].BioResources,2020,15(3):6974-6988.
[22] OTTENHEIM C,WERNER K A,ZIMMERMANN W,et al.Improved endoxylanase production and colony morphology of Aspergillus niger DSM 26641 by γ-ray induced mutagenesis[J].Biochemical Engineering Journal,2015,94:9-14.
[23] TANG X L,CHEN L J,DU X Y,et al.Regulation of homoserine O-succinyltransferase for efficient production of L-methionine in engineered Escherichia coli[J].Journal of Biotechnology,2020,309:53-58.
[24] NAKATANI T,OHTSU I,NONAKA G,et al.Enhancement of thioredoxin/glutaredoxin-mediated L-cysteine synthesis from S-sulfocysteine increases L-cysteine production in Escherichia coli[J].Microbial Cell Factories,2012,11:62.
[25] RÜCKERT C.Sulfate reduction in microorganisms-recent advances and biotechnological applications[J].Current Opinion in Microbiology,2016,33:140-146.
[26] CHEN Z G,ZHANG X,LI H J,et al.The complete pathway for thiosulfate utilization in Saccharomyces cerevisiae[J].Applied and Environmental Microbiology,2018,84(22):e01241-e01218.
[27] WANG X L,ZHANG L L,CHEN N,et al.The effects of quorum sensing molecule farnesol on the yield and activity of extracellular polysaccharide from Grifola frondosa in liquid fermentation[J].International Journal of Biological Macromolecules,2021,191:377-384.
[28] LOPES A P,DE OLIVEIRA CASTELO BRANCO R R,DE ALC?NTARA OLIVEIRA F A,et al.Antimicrobial,modulatory,and antibiofilm activity of tt-farnesol on bacterial and fungal strains of importance to human health[J].Bioorganic &Medicinal Chemistry Letters,2021,47:128192.
[29] KONG E F,TSUI C,KUCHAR KOV
KOV S,et al.Modulation of Staphylococcus aureus response to antimicrobials by the Candida albicans quorum sensing molecule farnesol[J].Antimicrobial Agents and Chemotherapy,2017,61(12):e01573-17.
S,et al.Modulation of Staphylococcus aureus response to antimicrobials by the Candida albicans quorum sensing molecule farnesol[J].Antimicrobial Agents and Chemotherapy,2017,61(12):e01573-17.
[30] ROTEM O,BIRAN D,RON E Z.Methionine biosynthesis in Agrobacterium tumefaciens:Study of the first enzyme[J].Research in Microbiology,2013,164(1):12-16.