胃溃疡消化性溃疡是最普遍的胃肠道疾病之一,影响着社会上4%~5%的人[1]。消化道溃疡会导致包括腹痛、腹胀、食欲不振、恶心呕吐等多种症状产生。幽门螺杆菌感染、饮酒、吸烟、过度使用非甾体抗炎药、心理和生理压力等多种因素都会导致胃溃疡[2]。急性和慢性过量饮酒均会增加消化道出血和胃溃疡发生的风险[3]。乙醇诱导胃损伤机制涉及胃氧化应激、炎症和细胞凋亡[4]。据报道,乙醇代谢产生过量活性氧引起氧化应激,促进胃酸与胃蛋白酶分泌,损害黏液屏障,扰乱黏膜微循环导致胃黏膜中炎症细胞浸润[5-6]。
自噬是细胞在自噬相关基因的调控下利用溶酶体降解自身不必要或受损细胞成分的过程,对于控制细胞稳态和提供能量具有重要意义。CHANG等[7]研究发现乙醇可以通过下调mTOR信号通路激活自噬,并适应性地改善乙醇诱导的人胃黏膜上皮细胞 (human gastric mucosal epithelial cell,GES-1)的凋亡和氧化损伤[7]。因此,细胞自噬与凋亡在改善胃黏膜损伤中起重要作用。
小麦肽是小麦蛋白的酶解产物,比小麦蛋白具有更高的工业应用性和生物活性。研究表明,服用小麦肽可以通过抗氧化、抗炎和促进GES-1的存活等机制抑制乙醇引起的胃黏膜损伤[8]。但是在乙醇诱导的小鼠胃黏膜损伤的模型中,小麦肽对胃黏膜细胞自噬相关的机制还没有详细研究。因此本研究的目的是评估小麦肽对乙醇诱导胃部病变的潜在作用,此外,研究了小麦肽对乙醇诱导的小鼠胃黏膜细胞自噬相关通路PI3K/AKT/mTOR信号通路调节的影响。
1 材料与方法
1.1 材料与试剂
小麦肽,中国食品发酵工业研究院;还原型谷胱甘肽(glutathione,reduced,GSH)测定试剂盒,南京建成生物工程研究所产品;超氧化物歧化酶(superoxide dismutase,SOD)、BCA蛋白检测试剂盒、青霉素-链霉素溶液(100×)、CCK-8试剂盒、一氧化氮检测试剂盒,上海碧云天生物技术有限公司;丙二醛(malondialdehyde,MDA)测定试剂盒,北京索莱宝科技有限公司产品;4%多聚甲醛组织固定液,武汉塞维尔科技;Dulbecco′s modified eagle medium (DMEM)高糖培养基,Hyclone;胎牛血清(fetal bovine serum,FBS),GIBCO;PVDF膜,默克公司;细胞培养皿、96孔板、6孔板,康宁公司;蛋白抗体PI3K、mTOR、p-mTOR、AKT、p-AKT、IL-1β、髓过氧化物酶 (myeloperoxidase,MPO)、LC3、β-actin,Proteintech 中国公司;蛋白抗体p-PI3K,Cell Signaling Technology;其他试剂均为国产分析纯。
1.2 动物实验
选取60只6周龄雄性KM小鼠,体重(28±1) g,北京斯贝福生物技术有限公司[SCXK(京)2019-0010]。适应性喂养5 d,饲养条件:动物房温度(20±2) ℃,湿度(45±5)%,12 h日光灯明暗交替循环,自由进食和饮水。正式实验开始前将小鼠随机分配为5组,空白组(Control),乙醇模型组(Ethanol),小麦肽低剂量组(L-WP),小麦肽中剂量组(M-WP),小麦肽高剂量组(H-WP),每组12只。根据人体动物剂量换算公式换算,低、中、高剂量实验组每天分别灌喂小麦肽(0.3、0.6、0.9 g/kg体重),空白组和模型组每天灌喂等量去离子水。在小麦肽干预3 d后,在每天小麦肽灌胃后1 h开始慢性乙醇(40%)的摄入(7 mL/kg体重),共18 d,空白组除外,空白组给予等剂量的生理盐水。试验方法根据之前的文献确定,并做出了部分调整[9-10]。实验第21天灌喂结束后将小鼠禁食过夜,第22天使用异氟烷麻醉剂麻醉小鼠,眼球采血收集全血后脱臼断颈处死,沿大曲度打开小鼠胃组织后置于液氮速冻或于4%多聚甲醛组织固定液中。所有动物实验严格遵守实验伦理原则和要求。
1.2.1 胃黏膜损伤指数测定
胃黏膜损伤的严重程度根据先前描述的方法计算胃溃疡指数[11]:0:无损伤;1:黏膜红斑;2:小溃疡(<1 mm);3:中度溃疡(1~2 mm);4:大面积溃疡(2~3 mm);5:超大面积溃疡(≥3 mm)。随后,收集胃组织并提交用于组织学检查和生化分析。
1.2.2 生化指标检测
取出储存在-80 ℃的胃组织。将组织浸泡在试剂盒中提供的提取物中,用动物组织匀浆器在低温下制备成10%浓度的组织匀浆,用于后续测试。使用商业试剂盒分析组织中的MDA、GSH、NO水平和SOD酶活性,并按蛋白质浓度进行归一化处理。
1.2.3 胃组织病理学观察
将固定在4%多聚甲醛中的组织标本取出,在乙醇和二甲苯中脱水,并嵌入石蜡中。将石蜡切成5 μm厚的切片,放在涂有10%聚赖氨酸的载玻片上。带有切片的载玻片在50 ℃下培养45 min,以提高组织切片对玻璃的附着力,然后用苏木精和伊红染色,然后用光镜进行常规形态学分析。
1.3 细胞实验
1.3.1 细胞培养
GES-1细胞购自国家实验细胞资源共享平台(北京,中国)。细胞在恒温培养箱中培养,温度为37 ℃,含有5%的二氧化碳。生长培养基为DMEM/HIGH GLUCOSE,辅以10%(体积分数)胎牛血清和1%(体积分数)青霉素-链霉素溶液。
1.3.2 细胞存活率
小麦肽对GES-1细胞活力的影响是通过CCK-8方法测定的。将细胞接种在96孔板中,密度为每孔1×104,培养24 h。用不同质量浓度的小麦肽(0、50、100、200、400、600、1 200、1 800 μg/mL)处理细胞24 h和乙醇(0、1%、2%、3%、4%、5%、6%,体积分数)处理细胞12 h,每个浓度设5次重复。在每个孔中加入10 μL CCK-8,继续孵化1.5 h。使用用多功能酶标仪在450 nm处测量吸光度,以反映细胞活力。细胞活力的计算如公式(1)所示:
细胞存活率![]()
(1)
1.3.3 细胞氧化应激状态检测
将细胞接种在6孔板中,密度为每孔1×106,待细胞完全贴壁后。用不同浓度的小麦肽预培养24 h后,每孔加入5%的乙醇,培养12 h,将GES-1细胞破碎。根据制造商的说明,使用检测试剂盒测量细胞MDA、GSH水平和SOD酶活性。
1.3.4 蛋白质免疫印迹检测
胃组织蛋白的收集。小鼠胃组织溶于RIPA裂解液并彻底均质,然后在14 000×g(5 min,4 ℃)下离心,以获得总蛋白。使用BCA方法测量蛋白质浓度。GES-1细胞蛋白收集:GES-1细胞在冰上用裂解缓冲液裂解,用BCA方法测量蛋白质浓度。然后用10%的聚丙烯酰胺十二烷基硫酸钠聚丙烯酰胺凝胶电泳装载样品,并转移到聚偏二氟乙烯膜上,然后用30 mL 5%的脱脂奶粉将膜封闭2 h。之后,用TBST清洗聚偏二氟乙烯膜,在4 ℃下与第一抗体摇晃孵育过夜。用TBST清洗聚偏二氟乙烯膜,用第二抗体孵育2 h后,用强化化学发光检测系统对蛋白条带进行可视化,使用图像分析软件进行分析。
1.4 数据处理与分析
所有实验数据均以平均值±SE表示。结果通过单程方差分析(ANOVA)进行分析。使用Origin 2021(OriginLab公司,Northampton,MA,USA)进行Tukey检验。P<0.05被作为统计学意义的标准。
2 结果与分析
2.1 体重和饲料摄入量变化
图1-a显示小鼠灌胃乙醇后体重变化。酒精干预显著抑制了小鼠体重增加(P<0.05)。在小麦肽干预结束后,H-WP组的小鼠体重显著高于乙醇模型组(P<0.05)。由图1-b中小鼠饲料摄入量变化发现,乙醇处理后各组小鼠饲料摄入量不存在显著差异。由图1-c损伤指数评分可以看出,用0.3、0.6、0.9 g/kg小麦肽处理的小鼠胃损伤指数为15.01、14.30、11.67,小麦肽能够以剂量依赖的方式显著降低胃黏膜损伤(P<0.05)。这些结果表明小麦肽可有效降低乙醇给药引起的胃损伤的严重程度。

a-21 d小鼠体重变化;b-小鼠饲料摄入量变化;c-小鼠胃组织损伤指数
图1 小麦肽对乙醇诱导小鼠体重、饲料摄入量、胃黏膜损伤评分的影响
Fig.1 Effect of wheat peptides on ethanol-induced body weight,feed intake,and gastric mucosal damage scores in mice
注:不同的字母表示样品组之间存在显著差异(P<0.05)(下同)。
2.2 小麦肽对乙醇处理小鼠胃组织MDA、SOD、GSH和NO水平的影响
小麦肽预处理对氧化应激标志物的影响如图2所示,数据表明,乙醇摄入导致氧化应激加重,脂质过氧化反应增加。与对照组相比,乙醇模型组,MDA水平显著升高108%(P<0.05),SOD活性和GSH含量显著降低37.82%和46.29%(P<0.05)。小麦肽预处理逆转了乙醇处理导致的胃组织抗氧化能力抑制作用,与模型组相比,小麦肽预处理显著提高了H-WP组内SOD活性(42.29%)和GSH含量(67.59%),以及M-WP组内GSH含量(73.32%)(P<0.05)。小麦肽预处理显著降低了H-WP与M-WP组内MDA水平(P<0.05),H-WP组MDA含量降低至空白组水平。NO含量在乙醇处理后显著升高(P<0.05),中、高剂量中小鼠胃组织内NO含量显著降低(P<0.05)。这些结果表明乙醇诱导了胃内氧化应激发生,小麦肽组胃组织内MDA和NO含量显著降低,SOD活性与GSH含量显著提高,说明小麦肽具有良好的抗氧化活性,减轻由氧化应激诱导的胃溃疡。
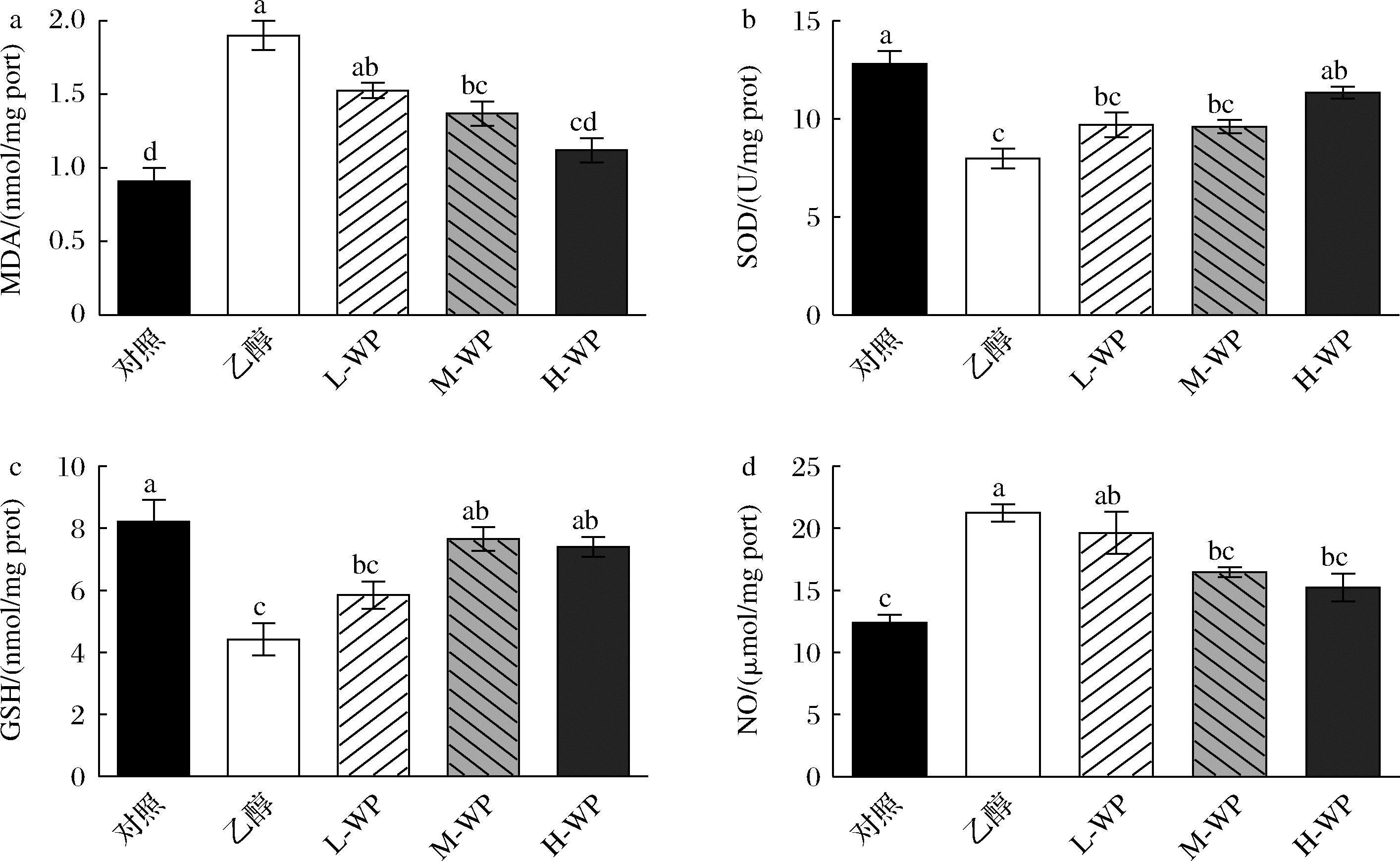
a-MDA;b-SOD;c-GSH;d-NO
图2 小麦肽对乙醇诱导小鼠胃组织内脂质过氧化水平、抗氧化酶活性和NO含量的影响
Fig.2 Effect of wheat peptides on ethanol-induced lipid peroxidation levels,antioxidant enzyme activity,and NO content in mouse gastric tissues
2.3 组织学检查
空白对照组胃组织形态结构较为完整,胃腺组织清晰可见,细胞排列紧密,没有明显组织损伤(图3-a)。模型组胃组织出现明显胃黏膜上皮黏膜损伤严重,固有层糜烂严重,腺体排列紊乱,上皮组织受到严重破坏(图3-b)。小麦肽预处理对胃黏膜具有保护作用,其中0.3 g/kg小麦肽处理后,小鼠胃组织上皮细胞脱落减少,胃黏膜固有层糜烂减轻,胃组织损伤较为严重(图3-c)。0.6 g/kg组小鼠胃组织上皮细胞脱落减少,部分位置存在轻微糜烂,腺体排列整齐,胃组织黏膜损伤减轻。0.9 g/kg的小麦肽预处理对胃组织溃疡具有显著改善作用,腺体结构完整,细胞排列完整,局部存在细胞脱落(图3-d和图3-e)。
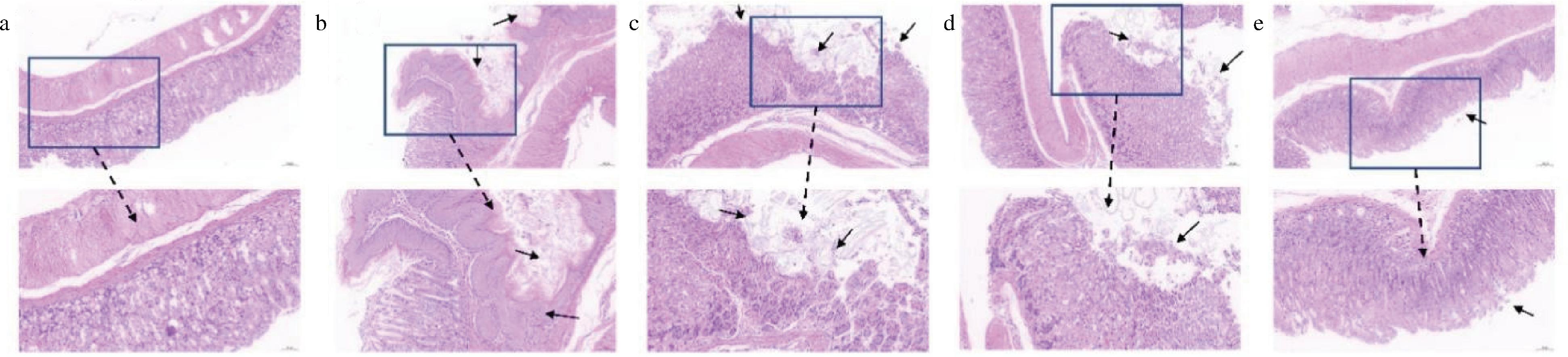
a-对照;b-乙醇;c-L-WP;d-M-WP;e-H-WP
图3 小麦肽对乙醇诱导小鼠胃组织病理学损伤的影响
Fig.3 Effects of wheat peptides on histopathological lesions of gastric damage in mice exposed to absolute ethanol
2.4 小麦肽对乙醇诱导胃组织炎症的影响
炎症是乙醇诱导胃黏膜损伤的重要因素,我们检测了乙醇诱导小鼠胃黏膜损伤后,胃组织中炎症相关蛋白IL-1β、IL-6、TNF-α和MPO的相对表达变化(图4)。乙醇处理后,模型组中促炎因子(IL-1β、IL-6、TNF-α)与MPO蛋白表达量显著提高(P<0.05)。小麦肽预处理抑制了乙醇诱导胃组织炎症,3个小麦肽组中IL-1β、TNF-α与MPO表达水平显著降低(P<0.05)。炎症因子IL-6在中、高剂量小麦肽处理后显著降低。因此,小麦肽可能通过降低乙醇诱导的炎症反应改善胃黏膜损伤。
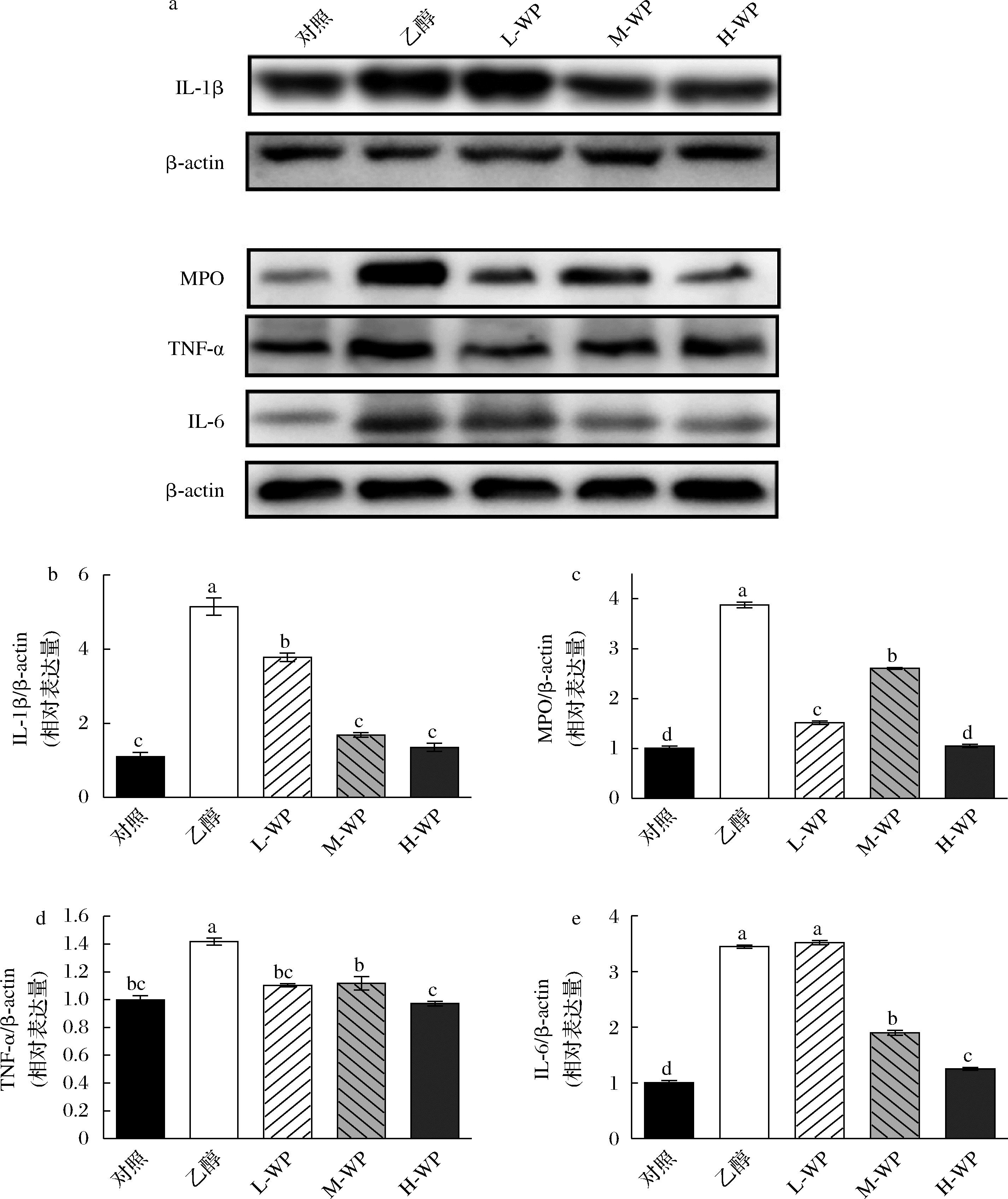
a-组织中炎症因子相对表达量;b-IL-1β;c-MPO;d-TNF-α;e-IL-6
图4 小麦肽对乙醇诱导小鼠胃组织炎症的影响
Fig.4 Effect of wheat peptides on ethanol-induced inflammation in mouse gastric tissues
2.5 小麦肽对GES-1存活率的影响
实验使用CCK-8法评估小麦肽与乙醇对GES-1细胞的毒性作用。如图5所示,通过添加不同浓度的乙醇,选择适合的乙醇浓度建立细胞损伤模型。实验结果显示,当乙醇体积分数达到5%时,GES-1细胞活力显著下降(图5-a),因此,实验添加5%浓度乙醇以建立细胞损伤模型。用依次增加浓度的小麦肽处理细胞24 h,CCK-8结果显示,孵育24 h后,200 μg/mL及以上的小麦肽处理显著增加了GES-1细胞存活率,质量浓度为50、100 μg/mL的小麦肽对GES-1细胞活力无显著影响(P>0.05)。在细胞部分实验中,我们确定3个浓度小麦肽(50、100、200 μg/mL)进行后续实验(图5-b)。
为验证小麦肽对乙醇诱导GES-1细胞损伤的保护作用。实验检测了使用小麦肽预处理后,乙醇对GES-1细胞存活率影响,结果如图5-c所示,小麦肽处理显著改善了乙醇诱导的细胞活性降低(P<0.05)。这表明小麦肽添加对乙醇导致的GES-1细胞损伤具有保护作用。
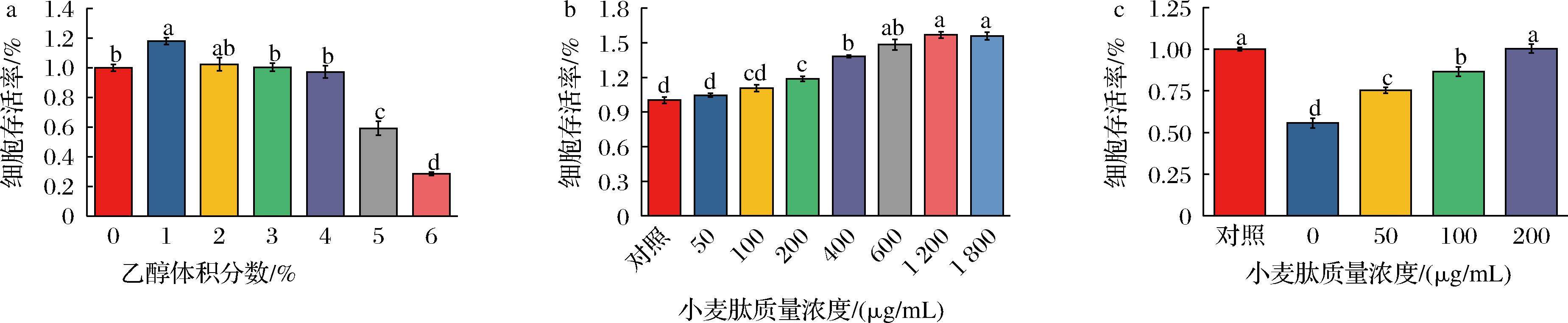
a-乙醇对GES-1细胞存活率的影响;b-小麦肽对GES-1细胞存活率的影响;c-小麦肽预处理后5%乙醇对GES-1细胞存活率的影响
图5 CCK-8法检测不同浓度小麦肽及乙醇对GES-1细胞的影响
Fig.5 Effect of different concentrations of wheat peptides and ethanol on GES-1 cells by CCK-8 assay
2.6 小麦肽对乙醇诱导GES-1抗氧化能力的影响
与动物实验一致,细胞实验检测了GES-1细胞内SOD酶活力与GSH、MDA 含量。如图6所示,与空白对照组相比,乙醇模型组MDA含量显著升高(P<0.05),SOD酶活力与GSH含量显著降低(P<0.05)。不同浓度的小麦肽处理显著抑制了细胞中MDA含量升高,SOD酶活力和GSH含量显著升高。因此,小麦肽能够有效改善乙醇诱导的GES-1细胞内脂质过氧化反应。
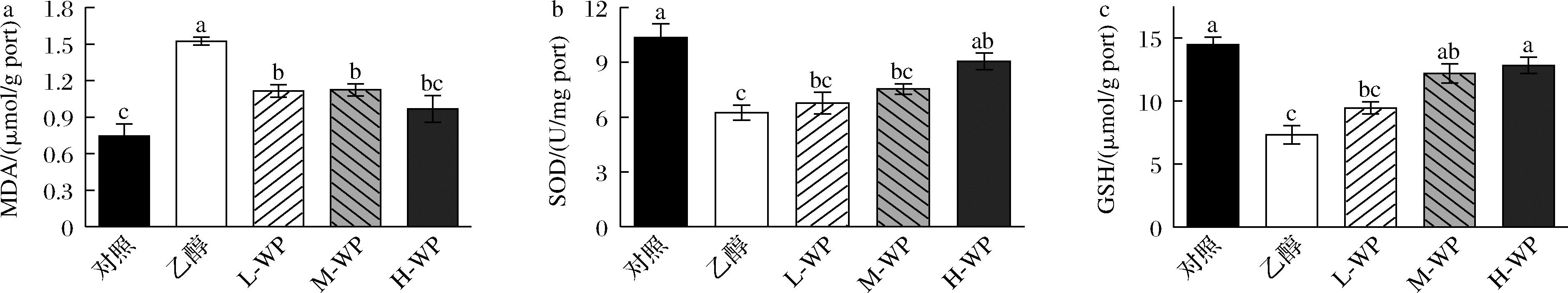
a-MDA;b-SOD;c-GSH
图6 小麦肽对乙醇诱导GES-1细胞内脂质过氧化水平、抗氧化酶活性的影响
Fig.6 Effect of wheat peptides on ethanol-induced lipid peroxidation levels and antioxidant enzyme activity GES-1
2.7 小麦肽通过PI3K/AKT/Mtor通过激活减轻乙醇诱导胃黏膜上皮损伤
PI3K/AKT/mTOR级联参与自噬过程的调节已通过多种胃病理学模型的不断发展的研究得到证实。为探究小麦肽对乙醇诱导胃损伤模型中的自噬相关过程调节作用,实验检测了PI3K/AKT/mTOR通路蛋白表达相对变化。实验发现,与空白对照组相比,乙醇添加激活了PI3K/AKT/mTOR通路相关蛋白表达,p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR 显著提高(图7-a)。小麦肽逆转了乙醇对PI3K/AKT/mTOR通路激活的激活作用,相对于乙醇模型组,小麦肽p-PI3K/PI3K、p-AKT/AKT、p-mTOR/mTOR显著降低。LC3-Ⅱ水平对应自噬水平,因此,我们通过Western Blot检测LC3-Ⅱ表达量来分析细胞自噬发生水平。结果如图7-b所示,中、高剂量的小麦肽预处理组中自噬调控核心蛋白LC3-Ⅱ表达量显著增加(P<0.05)。
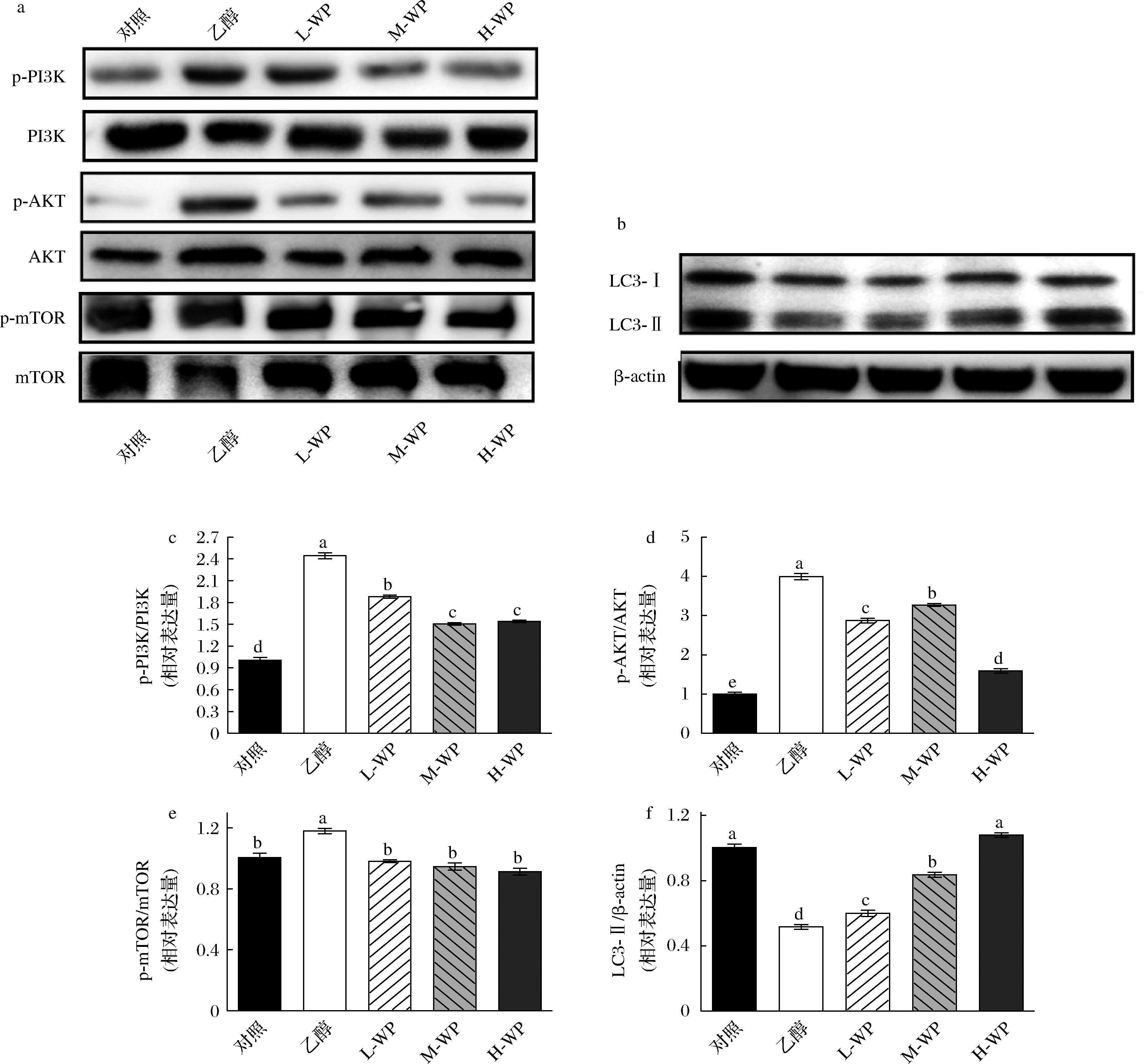
a-PI3K/AKT/mTOR蛋白相对表达量;b-LC3-Ⅱ蛋白相对表达量;c-PI3K;d-AKT;e-mTOR;f-LC3-Ⅱ
图7 小麦肽对GES-1细胞自噬相关蛋白表达的影响
Fig.7 Effect of wheat peptides on the expression of autophagy-related proteins in GES-1 cells
3 结论
酒精是导致胃黏膜上皮损伤甚至胃溃疡的主要外源因素之一,在之前的研究中,酒精可以通过抑制胃细胞自噬反应加剧胃黏膜上皮损伤[7]。小麦肽已被证明具有抗炎、抗氧化特性[12]。本研究的主要发现是小麦肽可以通过减轻乙醇抑制胃组织细胞自噬反应改善胃黏膜损伤。目前研究中,小麦肽在体内研究中改善了乙醇诱导的胃组织损伤,降低了组织内脂质过氧化反应和促炎因子的表达。在体外模型中,小麦肽同样具有较好的抗氧化能力,同时可以抑制PI3K/AKT/mTOR 通路,提高LC3-Ⅱ蛋白表达,研究结果表明,细胞自噬反应可能是小麦肽改善胃黏膜屏障损伤的潜在机制。
乙醇在胃中被吸收时,胃中存在的酒精脱氢酶会催化乙醇产生乙醛,而胃中存在的黄嘌呤氧化酶会催化乙醛的代谢,产生自由基[13],这在酒精诱导胃黏膜损伤中发挥重要作用。当活性氧代谢物过量产生超过内源性保护因素(如SOD和GSH)时,会导致脂质过氧化发生,从而导致蛋白质的功能丧失和改变,破坏膜组织。小麦肽是一种抗氧化肽,可以通过增强抗氧化酶活力,清除氧化自由基,抑制脂质过氧化发生;此外,小麦肽还具有亚铁离子螯合能力,调节NF-κB和NRF2相关通路改善细胞氧化损伤。在本实验中,小麦肽预处理显著提高了体内体外实验中细胞内SOD活力和GSH水平,抑制了乙醇诱导的NO含量增加。上述结果表明,小麦肽可以通过增强抗氧化能力和降低NO含量保护乙醇造成的胃黏膜损伤。
氧化应激与炎症存在于多种消化道疾病中,氧化应激会引起细胞蛋白和DNA损伤、脂质过氧化发生,破坏胃黏膜屏障功能,通透性增加,导致有害物质转移,诱发炎症产生[10,14-15],此外,活性氧还会诱导NF-κB与MAPK通路激活,诱导破坏性炎症的产生[16]。因此,本实验检测了小麦肽对炎症因子和中性粒浸润标志MPO的表达的影响[17-18]。中性粒细胞浸润在损伤和炎症过程中起着至关重要的作用,它在各种组织中聚集和释放组织破坏物质,包括胃黏膜病变[19]。在本研究中,观察到乙醇处理小鼠胃内MPO表达量显著升高,小麦肽降低了胃内MPO蛋白相对表达水平。抑制中性粒细胞渗入是一种重要的抗炎机制,小麦肽可以通过减少中性粒细胞浸润,改善胃黏膜损伤。此外,小麦肽预处理可以明显抑制IL-1β等促炎因子的产生,减轻胃部炎症的发生。这些结果与之前的研究一致[20]。
自噬是一个动态的、进化上保守的过程,在不利条件被激活,以维持蛋白质的新陈代谢和分解代谢之间的平衡,以及细胞的稳态。LC3-Ⅱ被认为是哺乳动物的自噬体标记,并且LC3-Ⅱ的含量总是与自噬体的数量成正比[21-22]。阿司匹林和乙醇处理都被发现通过下调mTOR信号减少自噬诱发的GES-1的凋亡和组织损伤[7]。在本实验中,乙醇诱导的GES-1细胞中LC3-II蛋白水平下降证明了细胞自噬受损。通过进一步研究发现,乙醇对自噬的抑制作用是由PI3K/AKT/mTOR途径激活介导的,在乙醇处理后,GES-1细胞中PI3K/AKT/mTOR通路磷酸化增加,通路被激活,自噬受到抑制。小麦肽处理改善了乙醇对自噬抑制作用,抑制PI3K/AKT/mTOR通路激活,并显著增加了LC3-II蛋白表达量。这些结果表明,小麦肽可能通过调节细胞自噬作用,减轻乙醇对胃黏膜的损伤,但目前的研究还不够完善,小麦肽调节自噬的作用和机制还需要进一步研究。
本实验研究了小麦肽对乙醇诱导胃黏膜损伤的影响。实验结果表明,小麦肽有效改善乙醇诱导的小鼠体重减轻,减少胃黏膜组织损伤,通过体内和体外实验发现小麦肽可以通过提高抗氧化能力,降低乙醇引起的组织内氧化应激和脂质过氧化水平升高。此外,小麦肽预处理抑制了乙醇导致的组织内中性粒细胞聚集和促炎因子表达。通过体外实验发现,小麦肽通过抑制PI3K/AKT/mTOR通路,驱动自噬过程。目前,本实验对小麦肽通过激活自噬调节乙醇性胃损伤研究还不够全面,需要进一步研究小麦肽对PI3K/AKT/mTOR信号通路调节作用对自噬的影响,全面了解小麦肽对自噬调控机制和胃组织保护作用,这对开发小麦肽作为一种天然膳食补充剂辅助治疗酒精性胃炎具有重要意义。
[1] AIHARA T,NAKAMURA E,AMAGASE K,et al.Pharmacological control of gastric acid secretion for the treatment of acid-related peptic disease:Past,present,and future[J].Pharmacology &Therapeutics,2003,98(1):109-127.
[2] BEHRMAN S W.Management of complicated peptic ulcer disease[J].Archives of Surgery,2005,140(2):201-208.
[3] RIEZZO G,CHILOIRO M,MONTANARO S.Protective effect of amtolmetin guacyl versus placebo diclofenac and misoprostol in healthy volunteers evaluated as gastric electrical activity in alcohol-induced stomach damage[J].Digestive Diseases and Sciences,2001,46(8):1797-1804.
[4] DE ARA JO E R D,GUERRA G C B,ARA
JO E R D,GUERRA G C B,ARA JO D F S,et al.Gastroprotective and antioxidant activity of Kalanchoe brasiliensis and Kalanchoe pinnata leaf juices against indomethacin and ethanol-induced gastric lesions in rats[J].International Journal of Molecular Sciences,2018,19(5):1265.
JO D F S,et al.Gastroprotective and antioxidant activity of Kalanchoe brasiliensis and Kalanchoe pinnata leaf juices against indomethacin and ethanol-induced gastric lesions in rats[J].International Journal of Molecular Sciences,2018,19(5):1265.
[5] PAN J S,HE S Z,XU H Z,et al.Oxidative stress disturbs energy metabolism of mitochondria in ethanol-induced gastric mucosa injury[J].World Journal of Gastroenterology,2008,14(38):5857-5867.
[6] ZHOU D,YANG Q,TIAN T,et al.Gastroprotective effect of gallic acid against ethanol-induced gastric ulcer in rats:Involvement of the Nrf2/HO-1 signaling and anti-apoptosis role[J].Biomedicine &Pharmacotherapy=Biomedecine &Pharmacotherapie,2020,126:110075.
[7] CHANG W L,BAI J,TIAN S B,et al.Autophagy protects gastric mucosal epithelial cells from ethanol-induced oxidative damage via mTOR signaling pathway[J].Experimental Biology and Medicine,2017,242(10):1025-1033.
[8] KAN J T,HOOD M,BURNS C,et al.A novel combination of wheat peptides and fucoidan attenuates ethanol-induced gastric mucosal damage through anti-oxidant,anti-inflammatory,and pro-survival mechanisms[J].Nutrients,2017,9(9):978.
[9] HERN NDEZ-MU
NDEZ-MU OZ R,D
OZ R,D AZ-MU
AZ-MU OZ M,L
OZ M,L PEZ V,et al.Balance between oxidative damage and proliferative potential in an experimental rat model of CCI[J].Hepatology,1997,26(5):1100-1110.
PEZ V,et al.Balance between oxidative damage and proliferative potential in an experimental rat model of CCI[J].Hepatology,1997,26(5):1100-1110.
[10] HERN NDEZ-MU
NDEZ-MU OZ R,MONTIEL-RU
OZ R,MONTIEL-RU Z C,V
Z C,V ZQUEZ-MART
ZQUEZ-MART NEZ O.Gastric mucosal cell proliferation in ethanol-induced chronic mucosal injury is related to oxidative stress and lipid peroxidation in rats[J].Laboratory Investigation,2000,80(8):1161-1169.
NEZ O.Gastric mucosal cell proliferation in ethanol-induced chronic mucosal injury is related to oxidative stress and lipid peroxidation in rats[J].Laboratory Investigation,2000,80(8):1161-1169.
[11] YANG Y,YIN B,LV L,et al.Gastroprotective effect of aucubin against ethanol-induced gastric mucosal injury in mice[J].Life Sciences,2017,189:44-51.
[12] YIN H,PAN X C,SONG Z X,et al.Protective effect of wheat peptides against indomethacin-induced oxidative stress in IEC-6 cells[J].Nutrients,2014,6(2):564-574.
[13] VILLALOBOS-GARC A D,HERN
A D,HERN NDEZ-MU
NDEZ-MU OZ R.Catalase increases ethanol oxidation through the purine catabolism in rat liver[J].Biochemical Pharmacology,2017,137:107-112.
OZ R.Catalase increases ethanol oxidation through the purine catabolism in rat liver[J].Biochemical Pharmacology,2017,137:107-112.
[14] RAO R,BAKER R D,BAKER S S.Inhibition of oxidant-induced barrier disruption and protein tyrosine phosphorylation in Caco-2 cell monolayers by epidermal growth factor[J].Biochemical Pharmacology,1999,57(6):685-695.
[15] BHATTACHARYYA A,CHATTOPADHYAY R,MITRA S,et al.Oxidative stress:An essential factor in the pathogenesis of gastrointestinal mucosal diseases[J].Physiological Reviews,2014,94(2):329-354.
[16] GUMA M,STEPNIAK D,SHAKED H,et al.Constitutive intestinal NF-κB does not trigger destructive inflammation unless accompanied by MAPK activation[J].Journal of Experimental Medicine,2011,208(9):1889-1900.
[17] AL ASMARI A,AL SHAHRANI H,AL MASRI N,et al.Vanillin abrogates ethanol induced gastric injury in rats via modulation of gastric secretion,oxidative stress and inflammation[J].Toxicology Reports,2016,3:105-113.
[18] YANG C Y,SONG Y L,WANG H.Suppression of RAGE and TLR9 by ketamine contributes to attenuation of lipopolysaccharide-induced acute lung injury[J].Journal of Investigative Surgery,2017,30(3):177-186.
[19] KOBAYASHI T,OHTA Y,YOSHINO J,et al.Teprenone promotes the healing of acetic acid-induced chronic gastric ulcers in rats by inhibiting neutrophil infiltration and lipid peroxidation in ulcerated gastric tissues[J].Pharmacological Research,2001,43(1):23-30.
[20] YU L L,LI R J,LIU W,et al.Protective effects of wheat peptides against ethanol-induced gastric mucosal lesions in rats:Vasodilation and anti-inflammation[J].Nutrients,2020,12(8):2355.
[21] PUGSLEY H R.Assessing autophagic flux by measuring LC3,p62,and LAMP1 co-localization using multispectral imaging flow cytometry[J].Journal of Visualized Experiments:JoCE,2017(125):55637.
[22] RAMKUMAR A,MURTHY D,RAJA D A,et al.Classical autophagy proteins LC3B and ATG4B facilitate melanosome movement on cytoskeletal tracks[J].Autophagy,2017,13(8):1331-1347.