白酒是世界六大蒸馏酒之一,是我国特有的传统发酵食品,具有悠久的历史[1]。与世界上其他蒸馏酒以醇香为主不同,我国白酒以酯香为主,酯类香气物质是构成酒体风味的重要成分[2]。其中,短链脂肪酸酯(如乙酸乙酯、乳酸乙酯、丁酸乙酯、己酸乙酯)占白酒中酯类物质含量90%以上[3]。白酒中短链脂肪酸酯主要是由4条途径共同作用的结果,一是原料带入,如小麦中含有少量的乙酸乙酯[4-5];二是发酵、蒸馏或贮存过程中酸醇自身酯化反应合成[6];三是微生物代谢合成,如醇酰基转移酶的乙酸酯合成代谢途径[7-9];四是基于酯化酶的酶促反应途径[10],如窖泥菌群在厌氧条件下代谢合成的己酸和丁酸与酒醅中酵母菌群合成的乙醇在酯化酶的作用下生成已酸乙酯和丁酸乙酯。由此可见,酶促反应途径是浓香型白酒主体香气成分己酸乙酯的主要来源。优质的浓香型白酒通常需要延长酿造周期来增加底物(已酸、丁酸、乙醇)和酯化酶的反应时间,从而获得更多的短链脂肪酸酯类物质[11]。而在酿造过程中引入酯化酶,不仅能够提升白酒品质,还可提高原料利用率、缩短发酵周期、增加企业的利润和市场竞争力。
酿造用酯化酶主要是指可以催化有机酸和醇类物质合成酯类的酶,同时也具有羧酯键水解催化活性[12]。在白酒酿造微生态体系中的酵母、霉菌和细菌都含有脂肪酶等酯化酶基因,具有一定的酯化能力[13]。然而,白酒偏酸性的酿造微环境限制了细菌中中性或碱性酯化酶的应用,酵母和霉菌的酯化酶在白酒酿造过程中发挥了重要的作用(如南极假丝酵母、红曲霉、黑曲霉和烟曲霉等)[14]。尽管前期的研究表明,利用红曲霉等霉菌制备的酯化酶粗制剂可以有效提高酿造体系中短链脂肪酸酯的含量[15],但并未阐明是哪一种酯化酶参与其中。随着组学技术的发展,新型酯化催化元件的挖掘和催化性能表征已成为研究热点。北京工商大学孙宝国院士团队利用多组学联用技术从红曲霉YJX-8中筛选获得能有效在水相中催化合成脂肪酸乙酯的脂肪酶LIP05,并对其催化机制进行了解析[16-17]。天津科技大学王正祥教授团队对黑曲霉中35个脂肪酶基因进行了表征,获得了一个具有丁酸酯合成偏好的新型脂肪酶[18]。除了脂肪酶之外,角质酶也被发现在酸性条件下具有很好的酯化能力。江南大学吴敬教授团队从嗜热放线菌(Thermobifida fusca)中克隆获得具有高效短链酯合成能力的角质酶基因[19]。江正强教授团队从太瑞斯梭孢壳霉(Thielavia terrestris)中筛选获得一个具有较高合成丁酸酯活性的角质酶,而且该蛋白具有良好的耐酸性能,在pH 2.5的条件下,仍能保留80%以上的酶活性[20]。此外,嗜热霉菌Malbranchea cinnamomea中的角质酶McCut可以高效合成丁酸丁酯[21]。角质酶在黑曲霉、红曲霉等酿造用霉菌中普遍存在,由此推断其可能在风味酯的合成反应中扮演着极为重要的角色。
目前关于角质酶的研究多集中在非水相体系中,而白酒酿造体系属于水相体系[22]。往往通过非水相体系筛选获得的高效酯化酶制剂在水相条件下催化性能很差,不能满足生产应用的需求。因此,需要特异性的筛选在水相条件下具有较好酯化能力的角质酶元件。此外,酿造用酯化酶的研究多以脂肪酶为主,而酿造体系中霉菌角质酶在短链脂肪酸酯生成中的作用却鲜有报道。根据白酒酿造体系特点,本文从白酒发酵体系中主要霉菌出发,利用大肠杆菌异源表达9个具有潜在酯合成能力的角质酶基因,并在水相条件下探究它们合成短链脂肪酸酯的催化能力和特性,为厘清白酒酿造体系酯化反应机制提供了全新的视角,同时也为选育适用于白酒体系的具有高效酯化生香能力的菌株提供了新的策略。
1 材料与方法
1.1 菌株与质粒
大肠杆菌(Escherichia coli) DH5α和BL21(DE3)及质粒pET22(b)和pET32(a)均为本实验室保存。
1.2 主要试剂
限制性内切酶、LA DNA 聚合酶,大连宝生物工程有限公司;同源重组酶、质粒小量提取试剂盒、DNA产物纯化回收试剂盒,南京诺唯赞生物科技有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)、卡那霉素、氨苄霉素、BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;Ni柱,GE公司;10 kDa超滤管,Millipore公司;丁酸、戊酸、己酸、庚酸、辛酸,Aladdin;其他生化试剂均为国产分析纯,天津市江天化工技术有限公司。
1.3 重组菌株的构建与表达
根据NCBI数据库中角质酶基因序列,去掉信号肽,并根据大肠杆菌表达系统进行密码子优化。合成后的片段用PCR技术连接至质粒pET22(b)或pET32(a)上,将重组质粒转化至E.coli DH5α中,提取质粒,测序验证正确后,转化至宿主菌BL21(DE3),并进行诱导表达。将重组菌株在含抗生素(100 mg/mL)的液体LB培养基中37 ℃培养至OD600值为0.6~0.8,加入IPTG至终浓度0.1 mmol/L,在16 ℃、180 r/min条件下诱导20 h,4 ℃离心收集菌体,用适量的100 mmol/L Tris-HCl(pH 8.0)缓冲液重悬菌体,随后将装有菌悬液的离心管置于冰水混合物中,利用超声波破碎仪破碎细胞[23-24],将离心收集的上清液经过Ni柱洗脱后,用超滤管进行脱盐、浓缩,所得纯酶液用于后续实验。蛋白浓度用BCA蛋白浓度测定试剂盒测定。
1.4 角质酶活力的测定
在酶促反应条件下,1 min内生成1 μmol丁酸乙酯或己酸乙酯所需的酶量定义为1个酶活力单位(U)。根据产物与外标峰面积之比计算产物的含量。
1.5 角质酶水相催化生成酯类
水相反应体系包含100 μL酶液,10 mmol/L有机酸(丁酸、戊酸、己酸、庚酸、辛酸)以及终浓度为1 mol/L的乙醇,加入到柠檬酸缓冲液中(50 mmol/L,pH 4.0)至终体积为1 mL,以不加酶液的反应体系为对照组。将上述混合反应液在30 ℃以150 r/min的转速反应24 h。此后向反应混合物中加入1 mL正己烷,剧烈涡旋30 s,10 000 r/min离心2 min,将上层即正己烷层过滤后进行气相色谱分析。
1.6 气相色谱的检测
气相色谱检测条件:色谱柱Agilent HP-INNOWAX(30 m×320 μm×0.25 μm),载气为高纯N2(>99.999%);柱流速0.8 mL/min;检测器温度150 ℃;进样口温度200 ℃;程序升温:起始温度50 ℃,保持8 min,以5 ℃/min升至150 ℃,保持15 min;进样体积为1 μL;分流进样,分流比为10∶1。
1.7 角质酶酶学特性分析
按照1.5节的方法,对角质酶进行酶学特性分析,以最高酶活力定义为100%计算相对酶活力。
(1)温度对角质酶酶活力的影响:水相反应体系在20~50 ℃反应24 h后检测生成丁酸乙酯和己酸乙酯的含量,计算相对酶活力,每隔10 ℃为检测点。
(2)pH对角质酶酶活力的影响:将纯酶液添加到不同pH(2~5)的50 mmol/L的柠檬酸钠缓冲液中反应24 h后检测生成丁酸乙酯和己酸乙酯的含量,计算相对酶活力。
1.8 角质酶水相催化合成酯的条件优化
按照1.5节反应体系测定酯含量,计算相对酶活力。
1.8.1 最佳反应时间的确定
测定角质酶在水相中催化合成丁酸乙酯和己酸乙酯的含量,反应时间分别为6、12、18、24、30 h。
1.8.2 最佳酸醇比的确定
测定角质酶在水相中催化合成丁酸乙酯和己酸乙酯的含量,乙醇的量保持不变,仅改变丁酸或己酸的含量。丁酸和乙醇的摩尔比分别为0.5∶100、1∶100、1.5∶100、2∶100、2.5∶100和3∶100,己酸和乙醇的摩尔比分别为0.5∶100、1∶100、2∶100、3∶100、4∶100、5∶100、6∶100、7∶100和8∶100。
2 结果与分析
2.1 霉菌角质酶的挖掘
紫红曲霉、黄曲霉和烟曲霉是白酒酿造体系中常见的霉菌,根据JGI霉菌数据库(https://mycocosm.jgi.doe.gov),通过基因注释检索,获得9个编码角质酶的基因(表1),并将其作为后续的研究对象。
表1 角质酶的基本信息
Table 1 The basic information of cutinase genes

序号元件基因名来源核苷酸序列长度/bp去信号肽的核苷酸序列长度/bp1MPCUT-1MAP00_003891红曲霉7627052MPCUT-2MPDQ_005612红曲霉7176453AFLACUT-1AFLA_072700黄曲霉6425944AFLACUT-2AFLA_023390黄曲霉7657085AFLACUT-3AFLA_044870黄曲霉9159156AFUACUT-1AFUA_4G14120烟曲霉6455977AFUACUT-2AFUA_2G09380烟曲霉6365948AFUACUT-3AFUA_2G14420烟曲霉1 1281 0779AFUACUT-4AFUA_4G03210烟曲霉654579
2.2 角质酶重组菌株的构建及诱导表达
以密码子优化后的带有目的基因的重组质粒为模板扩增上述9个角质酶基因(图1),按照1.3节的方法构建质粒pET22(b)-cutinase,依次转入E.coli.BL21(DE3)中表达蛋白,结果表明只有MPCUT-1能成功表达,蛋白分子质量为26.73 kDa,如图2-a所示。为了获得可溶性重组蛋白,其余8个角质酶基因插入到载体pET32(a)中,构建质粒pET32(a)-cutinase。依次转入E.coli.BL21(DE3)中,并进行诱导表达,如图2-b和图2-c所示,除AFLACUT-3和AFUACUT-3之外,6个角质酶均获得可溶性表达,重组蛋白条带大小与其理论分子质量相符。这些结果表明pET32(a)更适合用于表达霉菌角质酶蛋白。
M-Maker;泳道1~9分别为AFUACUT-4、AFUACUT-3、AFUACUT-2、AFUACUT-1、AFLACUT-3、AFLACUT-2、AFLACUT-1、MPCUT-2、MPCUT-1
图1 PCR扩增角质酶全长基因
Fig.1 PCR amplification of the fungal cutinases gene
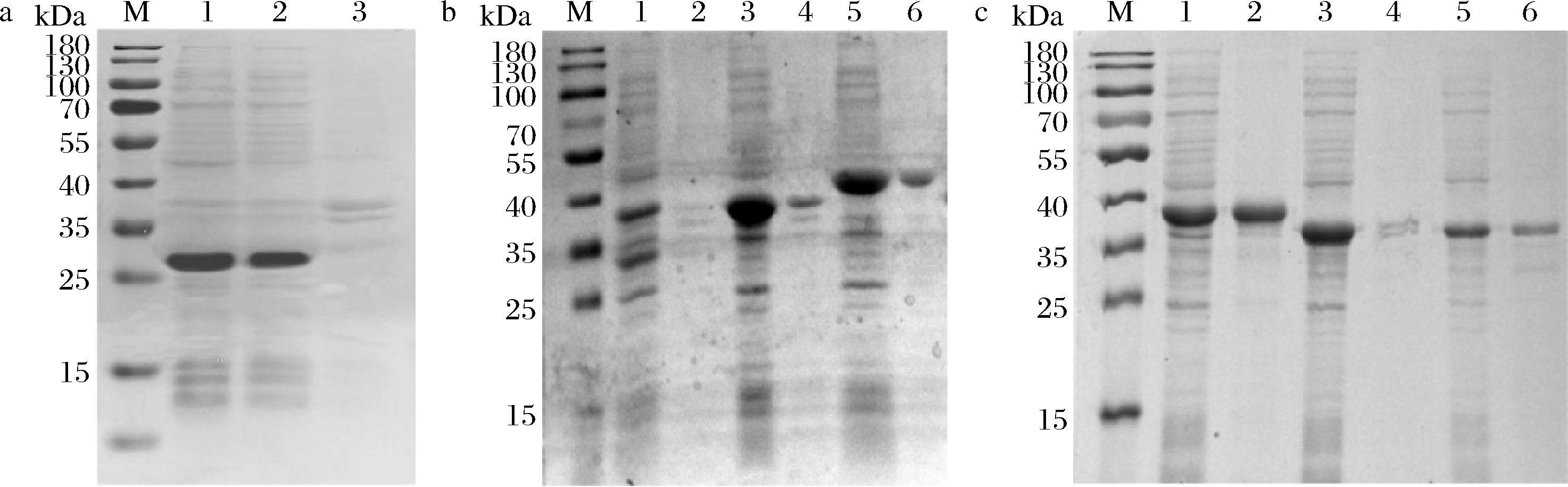
图2 角质酶在大肠杆菌中的表达
Fig.2 The expression of fungal cutinases in E.coli
2.3 角质酶的分离纯化
7个重组菌株经过IPTG诱导后超声波破碎,在4 ℃、12 000 r/min条件下离心,将所获得的含有重组蛋白的上清液过Ni柱,并用不同咪唑浓度洗脱,洗脱液进行SDS-PAGE检测,进而确定最适洗脱浓度。结果如图3所示,MPCUT-1和AFUACUT-1的最适咪唑洗脱浓度为500 mmol/L,MPCUT-2、AFLACUT-1、AFLACUT-2和AFUACUT-2的最适咪唑洗脱浓度为200 mmol/L,而AFUACUT-4的最适咪唑洗脱浓度为100 mmol/L。后续实验使用最适的咪唑浓度纯化目的蛋白,然后利用超滤管进行脱盐、浓缩得到纯酶液。
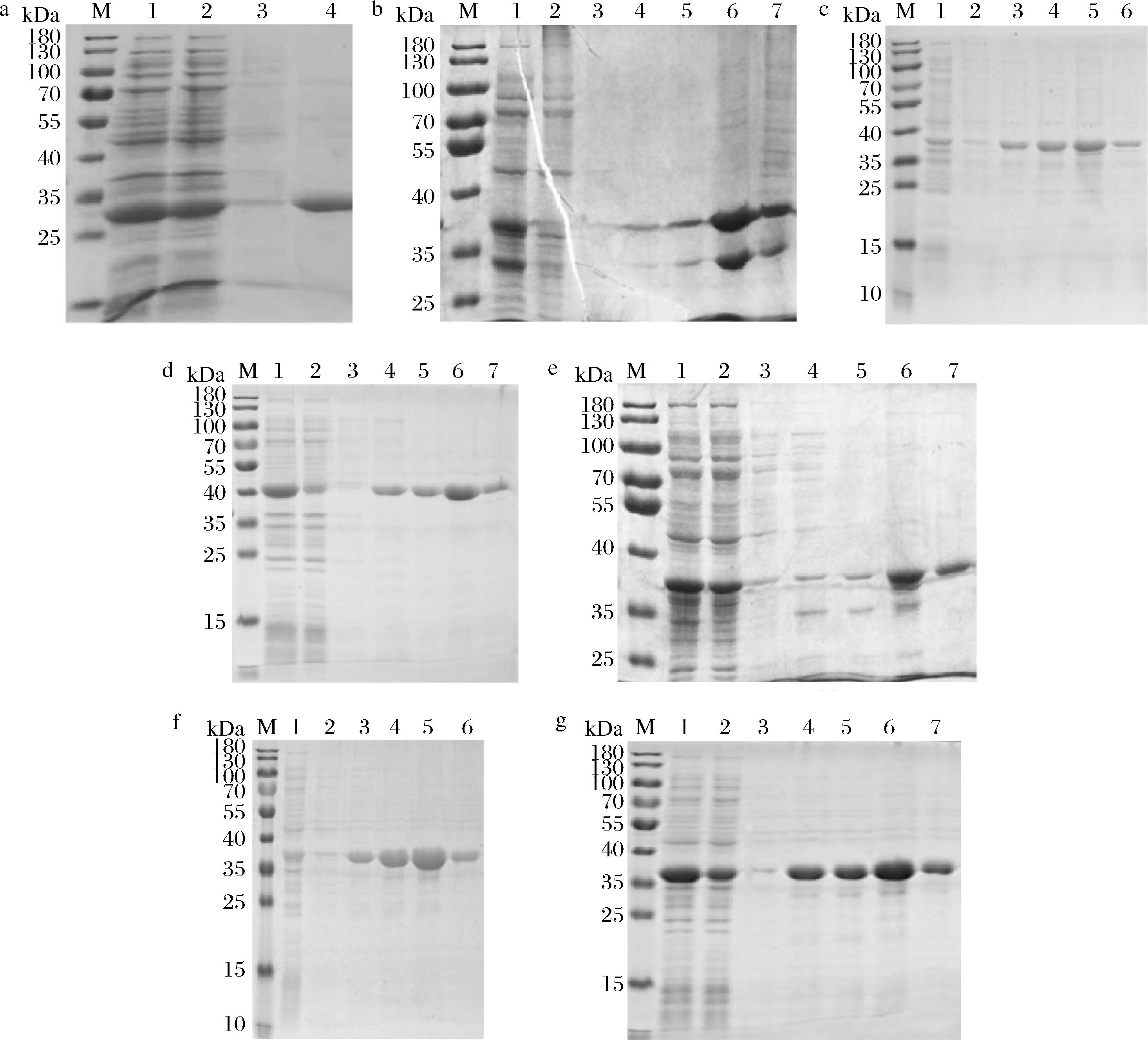
M-Maker;a-MPCUT-1(泳道1~4:破碎后上清液、穿出样品、20 mmol/L咪唑洗脱液、500 mmol/L咪唑洗脱液);b-MPCUT-2(泳道1~7:破碎后上清液、穿出样品、20、60、100、200、500 mmol/L咪唑洗脱液);c-AFLACUT-1(泳道1~6:穿出样品、20、60、100、200、500 mmol/L咪唑洗脱液);d-AFLACUT-2(泳道1~7:破碎后上清液、穿出样品、20、60、100、200、500 mmol/L咪唑洗脱液);e-AFUACUT-1(泳道1~7:破碎后上清液、穿出样品、20、60、100、200、500 mmol/L咪唑洗脱液);f-AFUACUT-2(泳道1~6:穿出样品、20、60、100、200、500 mmol/L咪唑洗脱液); g-AFUACUT-4(泳道1~7:破碎后上清液、穿出样品、20、60、100、200、500 mmol/L咪唑洗脱液)
图3 不同浓度的咪唑洗脱纯化角质酶
Fig.3 Purification of fungal cutinases with different concentrations of imidazole
2.4 霉菌角质酶在水相中合成风味酯的研究
为了考察霉菌角质酶在水相合成短链脂肪酸酯的能力,按1.5节所述方法,在反应体系中只加丁酸、戊酸、己酸、庚酸或辛酸中的一种短链脂肪酸,反应24 h后,结果如图4所示。由于酸和醇存在自发的化学反应,因此,以不加酶液为对照,与对照相比,角质酶MPCUT-1、AFLACUT-1、AFLACUT-2、AFUACUT-1、AFUACUT-2和AFUACUT-4在酸性水相条件下都具有较好的催化合成短链脂肪酸酯的能力,而且催化长链酸与乙醇合成酯的能力都要明显高于短链酸(辛酸>庚酸>己酸>戊酸>丁酸),而角质酶MPCUT-2仅可以微量催化合成辛酸乙酯。由此可见,不同霉菌角质酶在水相条件下催化合成短链脂肪酸酯的能力具有显著差异。
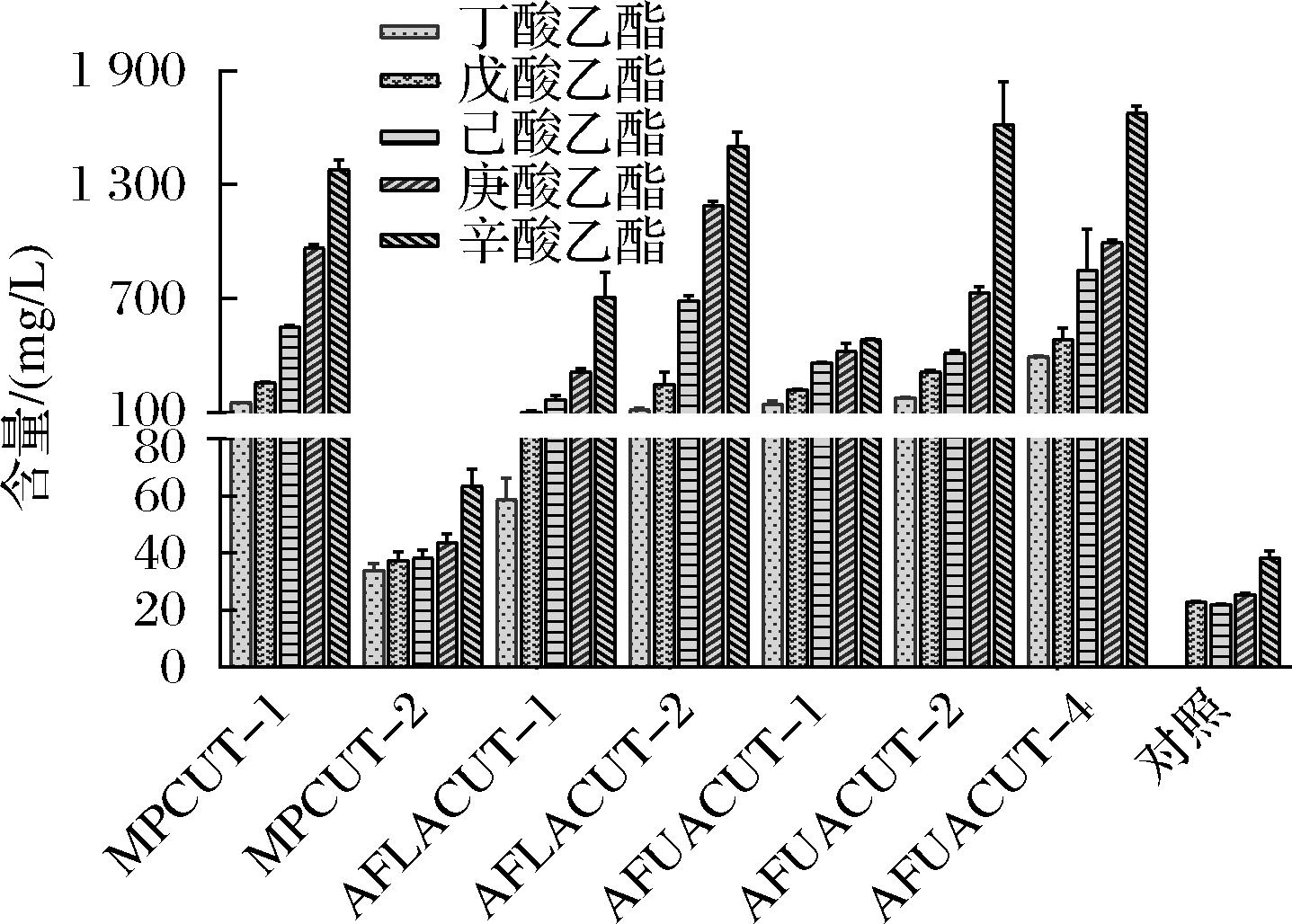
图4 不同霉菌角质酶在水相中催化风味酯能力的比较
Fig.4 Synthesis of esters catalyzed by different fungal cutinases in aqueous phase
在实际白酒发酵体系中,酿造微环境中含有多种短链脂肪酸(如丁酸、己酸等),因此研究考察了霉菌角质酶在混酸条件下对底物的偏好性。在反应体系中同时加入丁酸、戊酸、己酸、庚酸、辛酸后,在30 ℃条件下反应24 h,结果如图5所示。
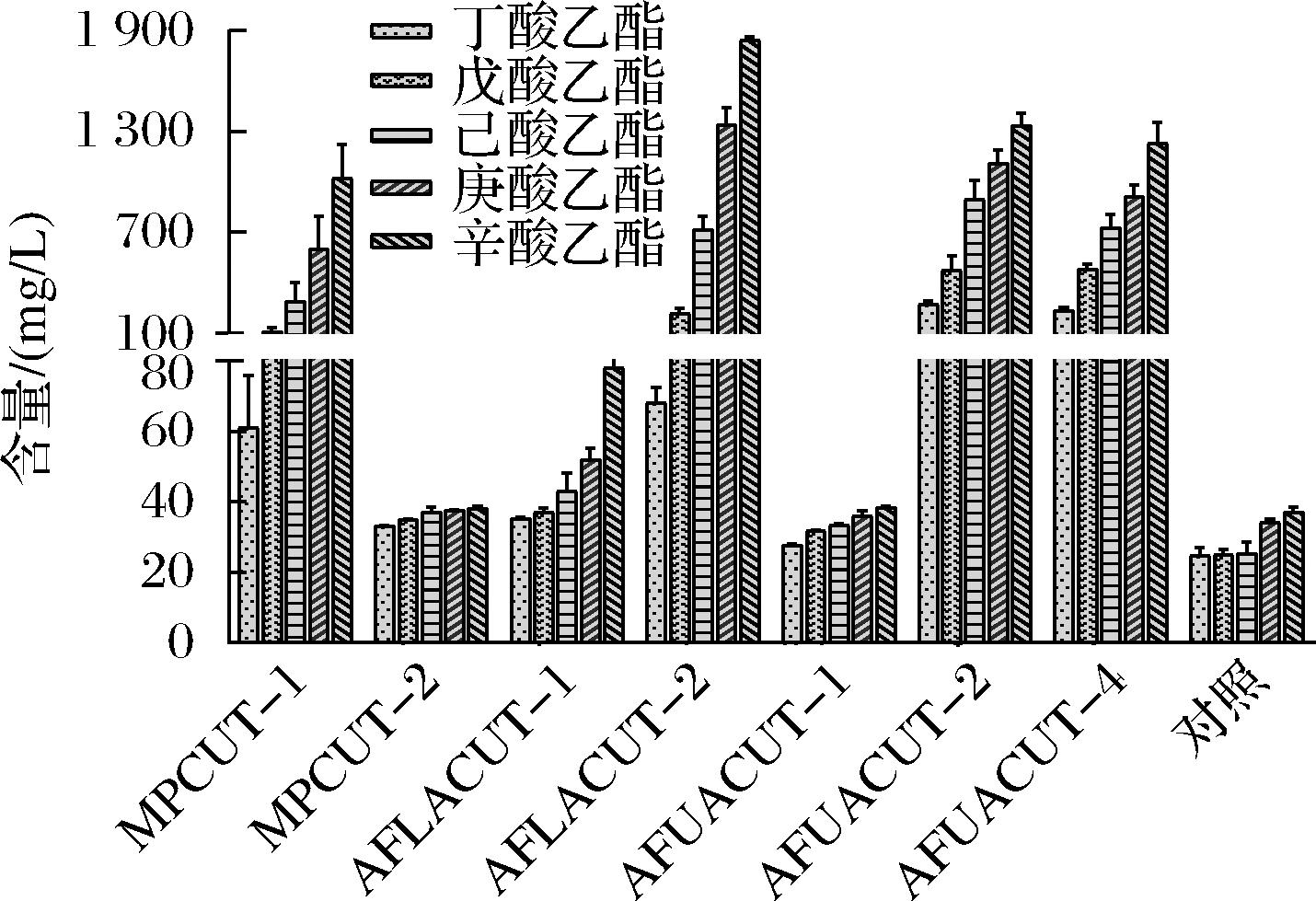
图5 不同霉菌角质酶水相混酸条件下催化合成风味酯能力的比较
Fig.5 Comparison of catalytic synthesis of flavor esters by different fungal cutinase under aqueous mixed acid conditions
角质酶MPCUT-2、AFLCUT-1和AFUACUT-1在混酸条件下催化合成短链脂肪酸酯的能力较弱,其酯化能力显著低于单酸条件,这种现象在AFUACUT-1上表现最为明显,这意味着这些霉菌角质酶耐酸性能较差,其催化性能易受pH波动影响,不适用于实际生产应用。除此之外,其他霉菌角质酶在混酸条件下都表现出较好的合成短链脂肪酸酯的能力,且随着碳链的增长,风味酯的含量增高,如AFLACUT-2可在混酸条件下24 h合成68.15 mg/L丁酸乙酯、214.05 mg/L戊酸乙酯、715.3 mg/L己酸乙酯、1 342.65 mg/L庚酸乙酯和1 842.96 mg/L辛酸乙酯,这意味着角质酶水相条件下催化合成短链脂肪酸酯的偏好性与短链脂肪酸的疏水性密切相关。此外,不同霉菌角质酶在混酸条件下催化合成各种短链脂肪酸酯的比例不同,如AFUACUT-2和AFUACUT-4在混酸条件下对不同短链脂肪酸的催化能力较为均一,而AFLACUT-2在混酸条件下对不同短链脂肪酸的催化能力差异较大,这暗示着其在混酸条件下对底物具有明显的偏好性,有利于定向调控风味酯的合成。综上所述,选择角质酶AFLACUT-2作为后续的研究对象。
2.5 角质酶AFLACUT-2酶学特性分析
按照1.7节的方法,测定角质酶AFLACUT-2的最适反应温度和最适pH。由图6-a可知,AFLACUT-2的酶活力随着温度的升高而升高,当温度达到30 ℃时,酶活力达到最高,之后随着温度的升高酶活力降低。值得注意的是,当温度达到40 ℃时,以丁酸为底物,角质酶AFLACUT-2酶活显著降低,相对酶活力仅为30 ℃时酶活力的35.1%,但以已酸为底物时,相对酶活力为88.9%,仅下降了11.1%。由此推断,可以通过调节酯化反应温度来实现特定短链脂肪酸酯的合成,进而实现风味酯的定向调控,对提升基酒品质具有重要的应用价值。由图6-b可知,在pH 2~4,随着pH的升高,角质酶AFLACUT-2的酶活力升高,pH 4时,酶活力最高,之后随着pH的升高酶活力降低,在pH 3~5,酶活力保持在60%以上,说明角质酶AFLACUT-2具有较好的耐酸性能,完全满足在白酒发酵体系中应用的要求。
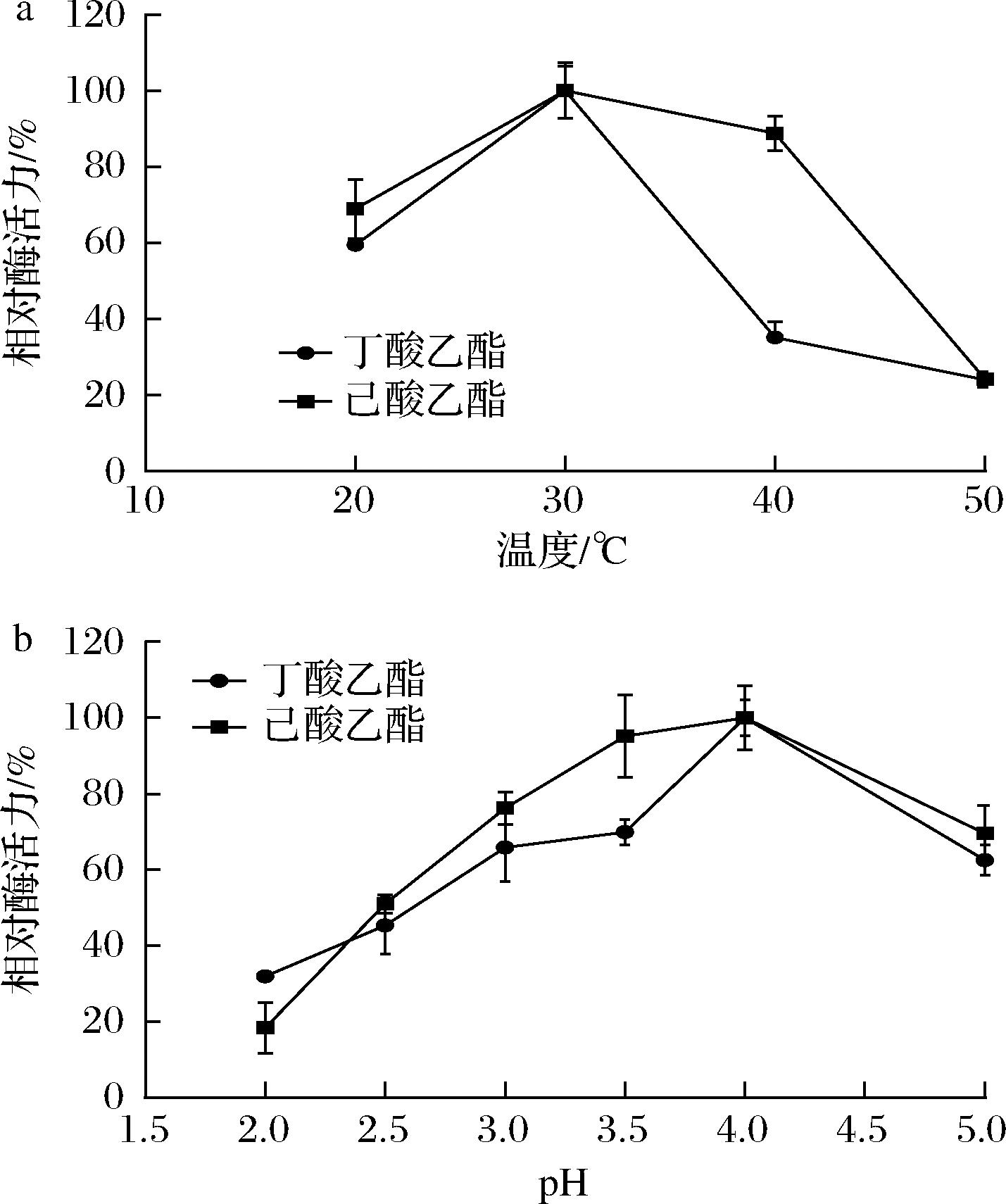
a-最适温度;b-最适pH
图6 AFLACUT-2的最适温度和最适pH
Fig.6 The optimum temperature and optimum pH of AFLACUT-2
2.6 角质酶AFLACUT-2催化合成酯条件的优化
为进一步优化反应体系,通过测定角质酶AFLACUT-2在水相中催化丁酸和乙醇生成丁酸乙酯的含量,确定反应的最佳时间和最佳酸醇比。以24 h时的酶活力定为100%,其他条件下的酶活力为相对酶活力。图7-a表明角质酶AFLACUT-2催化合成丁酸乙酯的最佳反应时间为24 h;以酸醇摩尔比为1∶100时的酶活力为100%,图7-b表明随着酸浓度的升高,相对酶活力升高,当酸与醇的比例为2∶100时,相对酶活力达到最高,之后随着酸浓度的升高,酶活力降低。因此,过多的丁酸可能会使反应体系的pH降低,导致酶的构象发生变化,从而影响角质酶AFLACUT-2的催化活性。
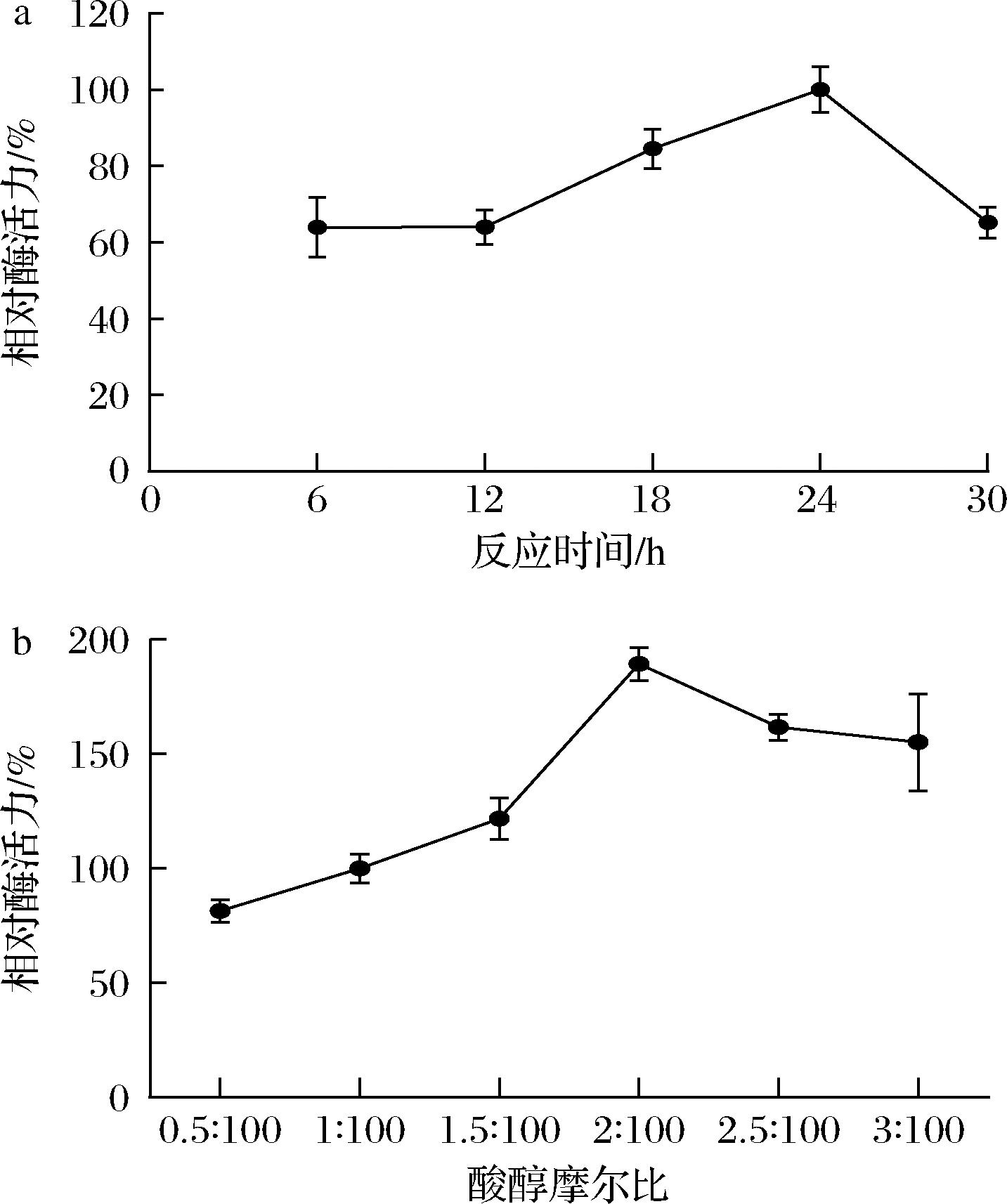
a-最佳反应时间;b-最佳酸醇摩尔比
图7 反应时间和酸醇摩尔比对AFLACUT-2在水相中催化生成丁酸乙酯的影响
Fig.7 Effect of reaction time and molar ratio of acid to alcohol on the catalytic formation of ethyl butyrate by AFLACUT-2 in aqueous phase
通过测定角质酶AFLACUT-2在水相中催化己酸和乙醇生成己酸乙酯的含量,确定反应的最佳时间和最佳酸醇比。以24 h时的酶活力为100%,其他条件下的酶活力为相对酶活力,从图8-a可知角质酶AFLACUT-2催化合成己酸乙酯的最佳反应时间为18 h,相对酶活力达到151.23%,这意味着通过控制酯化反应时间可以调控混酸条件下风味酯合成的比例。以酸醇摩尔比为1∶100时的酶活力为100%,从图8-b中可知随着酸浓度的升高,相对酶活力升高,当酸醇摩尔比为5∶100时,相对酶活力最高,说明增加己酸的浓度有利于角质酶AFLACUT-2催化合成己酸,该酶对己酸的耐受性优于丁酸。
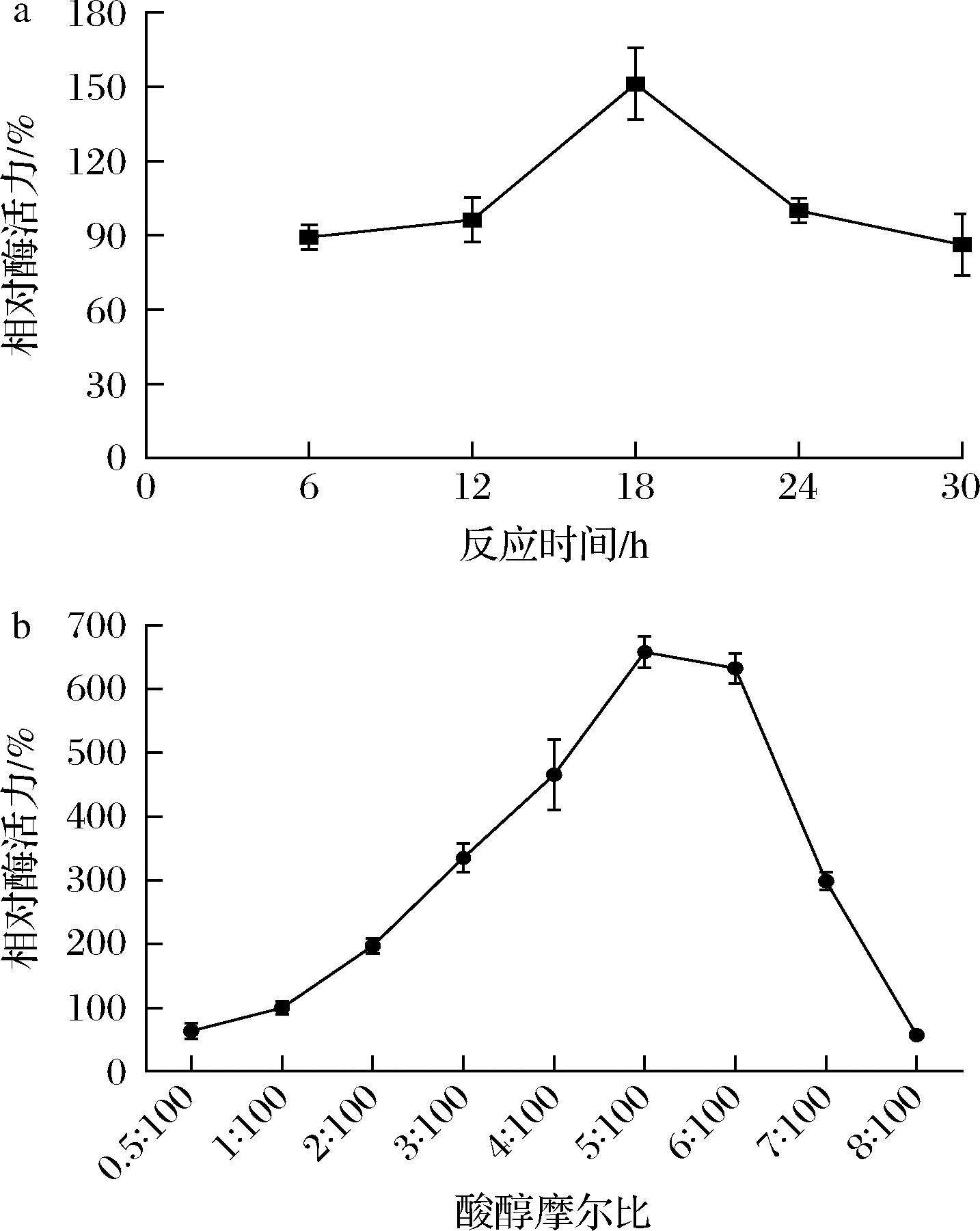
a-反应最佳时间;b-最佳酸醇摩尔比
图8 最佳反应时间和酸醇摩尔比对AFLACUT-2在水相中催化生成己酸乙酯的影响
Fig.8 Effect of reaction time and molar ratio of acid to alcohol on the catalytic formation of ethyl caproate by AFLACUT-2 in aqueous phase
3 结论
短链脂肪酸酯是白酒中重要的风味物质,其含量和比例与白酒品质密切相关。科学阐明白酒酿造体系中短链脂肪酸酯合成机制,深度挖掘高效催化元件,对解析白酒风味合成奥秘和品质提升具有重要意义。基于此,本文以白酒酿造过程中常见霉菌中的角质酶为研究对象,利用E. coli表达体系成功实现7个霉菌角质酶的可溶性表达,进而对这些角质酶在混酸和单酸条件下催化合成短链脂肪酸酯的能力进行表征。结果发现霉菌角质酶在水相中催化合成短链脂肪酸酯的活力与短链脂肪酸酯的疏水性成正相关。单酸和混酸条件下催化活力分析表明AFLACUT-2更适合用于白酒酯化生香过程。进一步酶学性质分析结果表明,AFLACUT-2的最适pH值为4,最适反应温度为30 ℃,与白酒酒醅微环境pH和温度相一致。此外,反应体系优化实验证实通过调控反应温度、反应时间和酸醇比可以实现短链脂肪酸酯合成的定向调控。这些结果不仅丰富了对白酒短链脂肪酸酯合成机制的理解,还为基于酶促反应的白酒酯化生香提供了新的策略和思路。
[1] 肖冬光, 赵树欣, 陈叶福, 等.白酒生产技术[M].2版.北京:化学工业出版社, 2011.
XIAO D G, ZHAO S X, CHEN Y F.Baijiu Production Technology[M].2nd.Beijing:Chemical Industry Press, 2011.
[2] WANG L L, FAN S S, YAN Y, et al.Characterization of potent odorants causing a pickle-like off-odor in Moutai-aroma type Baijiu by comparative aroma extract dilution analysis, quantitative measurements, aroma addition, and omission studies[J].Journal of Agricultural and Food Chemistry, 2020, 68(6):1666-1677.
[3] 陶新功, 孙国昌, 朱瑞康, 等.从四大酯类含量分析糟烧白酒[J].中国酿造, 2013, 32(9):120-122.
TAO X G, SUN G C, ZHU R K, et al.Characterization of arak liquor with the contents of four kinds of esters analysis[J].China Brewing, 2013, 32(9):120-122.
[4] 庄名扬. 中国白酒香味物质形成机理及酿酒工艺的调控[J].四川食品与发酵, 2007, 43(2):1-6.
ZHUANG M Y.The production mechanism of the fragrance in the Chinese spirit &the operation of the spirit brewing[J].Sichuan Food and Fermentation, 2007, 43(2):1-6.
[5] 王晓程, 徐友强, 李秀婷, 等.中国传统发酵食品来源典型小分子脂肪酸酯合成微生物及酶的研究进展[J].中国食品学报, 2021, 21(4):345-355.
WANG X C, XU Y Q, LI X T, et al.Research progress in microorganisms and enzymes for synthesis of typical small molecule fatty acid esters from traditional Chinese fermented foods[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(4):345-355.
[6] ZHU L, WANG X L, SONG X B, et al.Evolution of the key odorants and aroma profiles in traditional Laowuzeng Baijiu during its one-year ageing[J].Food Chemistry, 2020, 310:125898.
[7] KRUIS A J, LEVISSON M, MARS A E, et al.Ethyl acetate production by the elusive alcohol acetyltransferase from yeast[J].Metabolic Engineering, 2017, 41:92-101.
[8] 李锋, 陈叶福, 郭建, 等.过表达EHT1基因对酿酒酵母己酸乙酯生产能力的影响[J].现代食品科技, 2014, 30(3):93-98;176.
LI F, CHEN Y F, GUO J, et al.Effects of overexpressed EHT1 on ester production of Saccharomyces cerevisiae[J].Modern Food Science and Technology, 2014, 30(3):93-98;176.
[9] VERSTREPEN K J, VAN LAERE S D M, VANDERHAEGEN B M P, et al.Expression levels of the yeast alcohol acetyltransferase genes ATF1, Lg-ATF1, and ATF2 control the formation of a broad range of volatile esters[J].Applied and Environmental Microbiology, 2003, 69(9):5228-5237.
[10] 曾婷婷, 张志刚.白酒酿造中酯化酶的研究现状[J].酿酒, 2010, 37(6):12-14.
ZENG T T, ZHANG Z G.Present research situation of the esterifying enzyme in the production of liquor[J].Liquor Making, 2010, 37(6):12-14.
[11] 刘正, 秦培军, 卢延想, 等.酱香型白酒酿造过程中微生物多样性及代谢过程研究进展[J].中国酿造, 2022, 41(6):6-11.
LIU Z, QIN P J, LU Y X, et al.Research progress of microbial diversity and metabolic process during the fermentation of sauce-flavor Baijiu[J].China Brewing, 2022, 41(6):6-11.
[12] XU Y Q, LIU X, ZHAO J R, et al.An efficient phthalate ester-degrading Bacillus subtilis:Degradation kinetics, metabolic pathway, and catalytic mechanism of the key enzyme[J].Environmental Pollution, 2021, 273:116461.
[13] KRUIS A J, BOHNENKAMP A C, PATINIOS C, et al.Microbial production of short and medium chain esters:Enzymes, pathways, and applications[J].Biotechnology Advances, 2019, 37(7):107407.
[14] 范光森, 吴秋华, 刘朋肖, 等.脂肪酶在白酒酯类化合物合成中的作用研究进展[J].中国食品学报, 2021, 21(1):351-360.
FAN G S, WU Q H, LIU P X, et al.Research progress on the role of lipase in the synthesis of esters in Baijiu[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(1):351-360.
[15] 杨磊, 穆敏敏, 文成兵, 等.浓香型白酒提质增香技术研究进展[J].酿酒, 2022, 49(1):17-21.
YANG L, MU M M, WEN C B, et al.Research progress on improving quality and flavor of Luzhou-flavor Baijiu[J].Liquor Making, 2022, 49(1):17-21.
[16] XU Y Q, WANG X C, LIU X, et al.Discovery and development of a novel short-chain fatty acid ester synthetic biocatalyst under aqueous phase from Monascus purpureus isolated from Baijiu[J].Food Chemistry, 2021, 338:128025.
[17] ZHAO J R, XU Y Q, LU H Y, et al.Molecular mechanism of LIP05 derived from Monascus purpureus YJX-8 for synthesizing fatty acid ethyl esters under aqueous phase[J].Frontiers in Microbiology, 2023, 13:1107104.
[18] CONG S Z, TIAN K M, ZHANG X, et al.Synthesis of flavor esters by a novel lipase from Aspergillus niger in a soybean-solvent system[J].3 Biotech, 2019, 9(6):244.
[19] SU L Q, HONG R Y, GUO X J, et al.Short-chain aliphatic ester synthesis using Thermobifida fusca cutinase[J].Food Chemistry, 2016, 206:131-136.
[20] XU H B, YAN Q J, DUAN X J, et al.Characterization of an acidic cold-adapted cutinase from Thielavia terrestris and its application in flavor ester synthesis[J].Food Chemistry, 2015, 188:439-445.
[21] DUAN X J, LIU Y, YOU X, et al.High-level expression and characterization of a novel cutinase from Malbranchea cinnamomea suitable for butyl butyrate production[J].Biotechnology for Biofuels, 2017, 10:223.
[22] XU Y Q, HUANG H Q, LU H Y, et al.Characterization of an Aspergillus niger for efficient fatty acid ethyl ester synthesis in aqueous phase and the molecular mechanism[J].Frontiers in Microbiology, 2022, 12:820380.
[23] 王雅琪, 凡林林, 李文瑶, 等.黑曲霉脂肪酶Lip A的异源表达与酶学性质分析[J].食品与发酵工业, 2023, 49(5):25-31.
WANG Y Q, FAN L L, LI W Y, et al.Heterologous expression and enzymatic characterization of Aspergillus niger lipase Lip A[J].Food and Fermentation Industries, 2023, 49(5):25-31.
[24] 刘小敏, 谢翔云, 林良才, 等.黑曲霉脂肪酶tabI酶学性质及乳酸乙酯合成能力的研究[J].食品与发酵工业, 2022, 48(10):9-15.
LIU X M, XIE X Y, LIN L C, et al.Enzymatic properties of Aspergillus niger lipase tabI and its synthesis ability of ethyl lactate[J].Food and Fermentation Industries, 2022, 48(10):9-15.