环糊精(cyclodextrin,CD)是由淀粉通过环糊精转葡萄糖基酶催化水解产生的一种环状寡聚糖[1],一般由6、7、8个D-吡喃葡萄糖单元组成,分别为α-CD、β-CD和γ-CD[2],其结构如图1所示。CD具有“外亲水、内疏水”的独特分子洞腔,可与疏水性客体分子形成包合物,达到提高客体溶解度和稳定性、掩盖不良气味、降低刺激性与不良反应的目的[1],并且已有研究表明多种CD协同使用会获得更好的包合效果[3]。
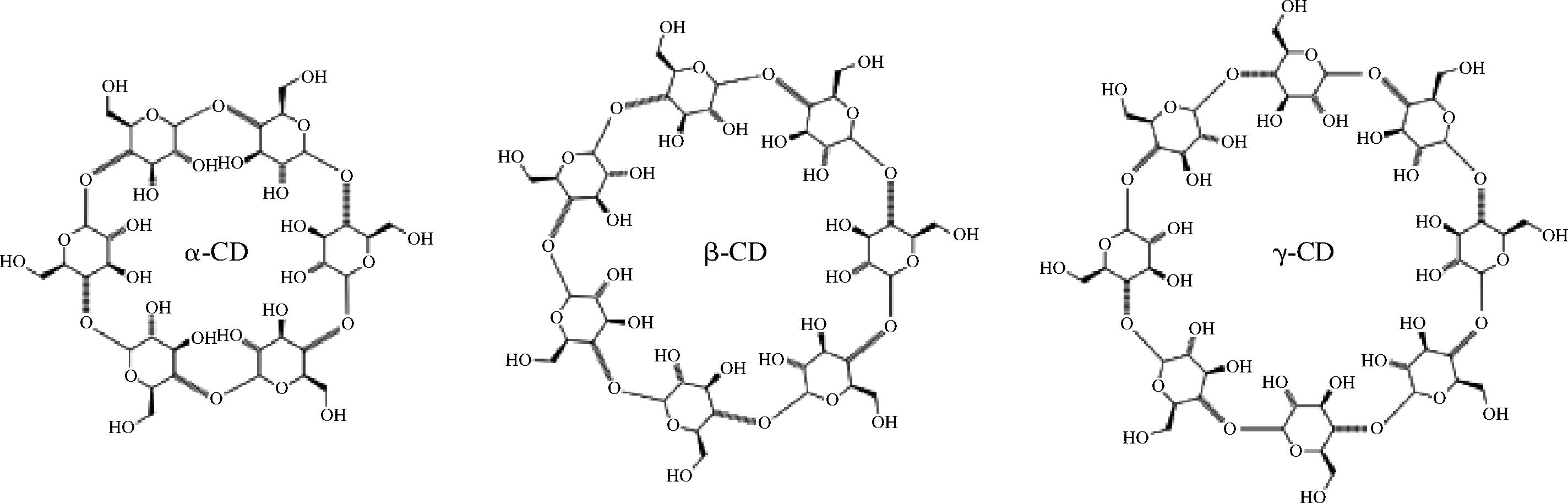
图1 α-环糊精、β-环糊精和γ-环糊精的结构示意图
Fig.1 Schematic diagram of α-, β- and γ-cyclodextrin structures
三丁酸甘油酯(tributyrin,TB)是一种具有多种生理功效的短链脂肪酸酯[4],其结构如图2所示。TB作为丁酸的前体物质,不仅减弱丁酸理化性质方面的缺陷,还具备多种生理功效[6],如维持肠道菌群稳态与减少幼龄动物断奶应激[7]、调节免疫功能与机体代谢[8]、改善生长性能[9]等。但TB水溶性差、有苦味和异味、易在消化道前段被降解,这些缺点限制了其在各个行业尤其是食品行业中的应用[10]。因此,改进TB的使用性能,对其应用价值的提高和使用范围的扩大具有重要意义。
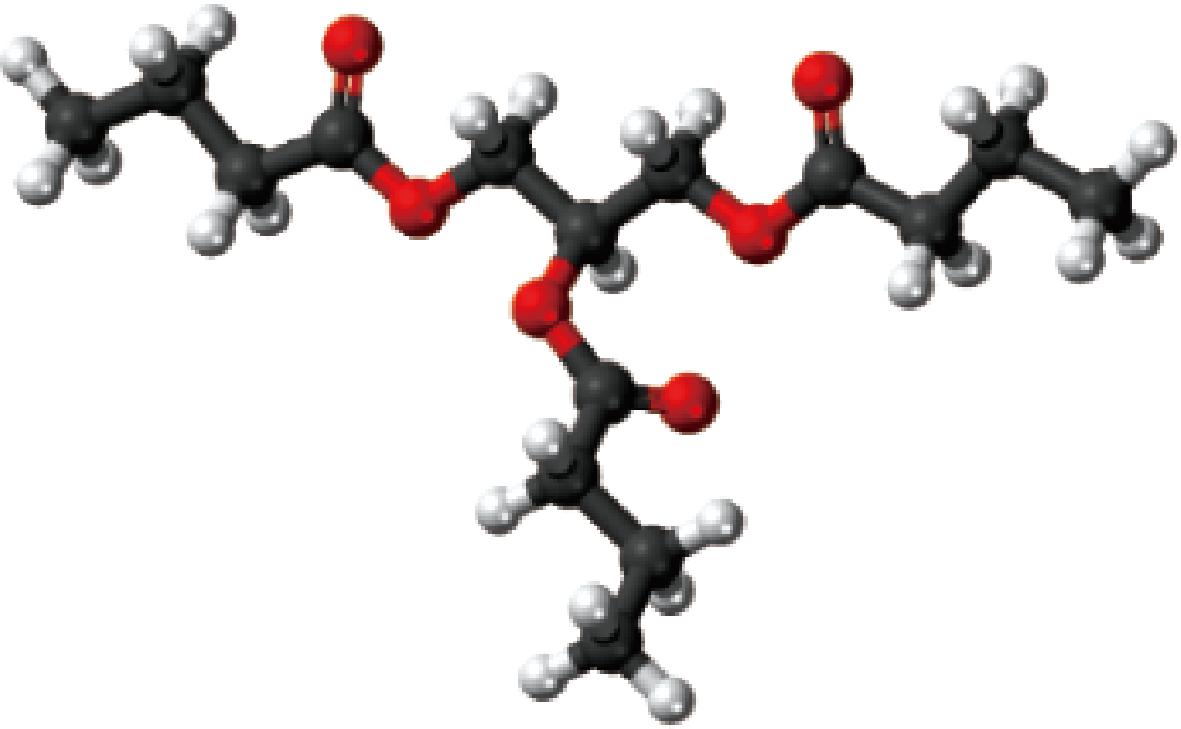
图2 三丁酸甘油酯的结构示意图[5]
Fig.2 Schematic diagram of tributyrin
先前研究报道γ-CD/TB包合物可提高TB的利用率,但通过喷雾干燥制备样品时,包合物中TB的保留率较低[11],因而猜测γ-CD的空腔尺寸并非与TB具备最佳匹配效应。本课题组前期发明了酶法生产CD过程包合TB的新方法,在酶法生产CD的过程中直接添加TB作为络合剂,促进3种CD生成,同时制备得到降低TB异味、有效提高其生物利用度的包合物[9, 12-13]。以上研究并未对CD包合TB的机制进行深入研究,因而本文将系统探究3种CD(α-CD、β-CD和γ-CD)包合TB的分子机制,分析复配CD包合的协同效应,以期为CD的应用打下坚实基础,并为其他功能因子的包合提供理论参考和技术支撑。
1 材料与方法
1.1 实验材料
α-CD、β-CD、γ-CD,上海阿拉丁生化科技股份有限公司;氘代二甲基亚砜(dimethyl sulfoxide-d6,DMSO-d6),美国Cambridge Isotope Laboratories股份有限公司;TB(纯度98%),广东溢多利生物科技股份有限公司;无水乙醇,上海麦克林生化科技股份有限公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
1.2 实验设备
Centrifuge 5424型台式高速离心机,德国Eppendorf公司;RW20 Digital数显型顶置式搅拌器,德国IKA公司;TW8型恒温水浴槽,德国JULABO有限公司;VO-53型真空干燥机,上海泰坦科技股份有限公司;UV1900紫外可见光分光光度计,翱艺仪器(上海)有限公司;Avance III-400 MHz型核磁共振波谱仪,德国Bruker AXS公司;MicroCal VP-ITC等温滴定量热仪,马尔文帕纳科公司。
1.3 实验方法
1.3.1 CD/TB包合物的制备
采用共沉淀法[14]制备,将CD(α-CD、β-CD、γ-CD、复配CD)完全溶于去离子水中,然后将溶解在无水乙醇中的TB缓慢加入CD溶液,50 ℃保温搅拌3 h,冷藏24 h,过滤得到CD/TB包合物,用无水乙醇洗涤2次以除去包合物表面未被包合的TB,真空干燥烘干水分至恒重,获得CD/TB包合物样品。(其中复配CD物质的量比例为:α-CD∶β-CD=3∶7,β-CD∶γ-CD=7∶3,α-CD∶β-CD∶γ-CD=2∶7∶1,所得包合物分别命名为:α-、β-CD/TB,β-、γ-CD/TB,α-、β-、γ-CD/TB)。
1.3.2 1H核磁共振(1H nuclear magnetic resonance,1H NMR)测定
参照李泽西[10]的方法并适当修改,使用核磁共振波谱仪测定样品化学位移量。CD单体、TB单体以及包合物溶解于DMSO-d6有机溶剂,实验温度设置303 K。包合前后CD与TB质子化学位移计算如公式(1)所示:
Δδ=δ(包合物)-δ(单体)
(1)
1.3.3 相溶解度测定
参照李丹等[15]的方法并适当修改。将过量TB(以无水乙醇为溶剂配制2 mol/LTB溶液)分别加入浓度为0、4、8、12、16、20 mmol/LCD溶液中,水浴搅拌24 h,离心取上清液,采用紫外分光光度法测定清液中TB浓度;作TB的含量和CD浓度的关系图,即为相溶解度曲线,并对数据进行线性拟合;根据公式(2)计算CD与TB的包合稳定常数Ks。
(2)
1.3.4 等温滴定微量热测定
参照张翔宇等[16]的方法并适当修改。将浓度分别为2 mmol/LTB溶液与20 mmol/LCD溶液进行脱气处理。向样品池中添加TB溶液,进样针吸取CD溶液后,对样品进行热力学分析,空白溶剂为对照组。实验温度25 ℃;滴定次数27滴;滴定间隔时间240 s;搅拌速率351 r/min。用Microcal Anslysis Launcher软件对滴定过程中的热变化进行记录和处理。
1.3.5 Autodock分子模拟对接
在Automated Topology Builder and Repository网页中搜索α-CD、β-CD、γ-CD和TB的结构,通过ChemSpider下载分子结构,根据先前报道方法对分子结构进行优化并用AutoDock 4.2.6组件进行分子模拟对接[9],输出结果采用Open Babel软件转换文件格式,最终使用软件Discovery Studio进行观察。
1.3.6 数据处理
通过Excel 2019和Origin 2021对数据进行处理及作图;采用SPSS 20统计软件分析实验数据的差异显著性(P<0.05),计算平行实验结果数据的平均值±标准偏差,通过单因素方差分析(AVOVA)中的Duncan程序实现。
2 结果与分析
2.1 核磁共振构象解析
1H NMR是对包合物体系最准确的表征技术[17],已经被广泛用于主客体化合物的结构确认与构象分析[18]。图3为TB与CD包合的1H NMR谱图。
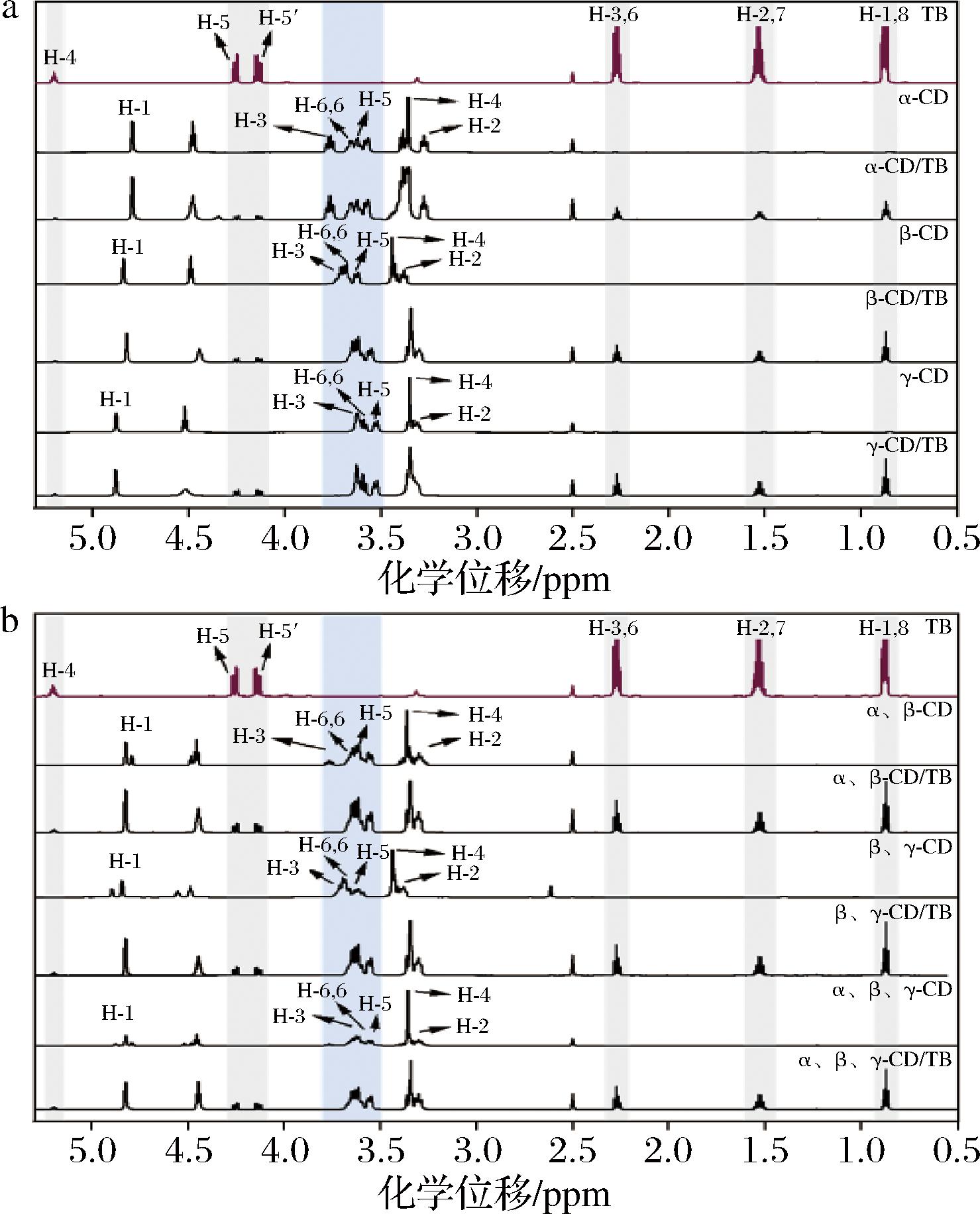
a-三丁酸甘油酯、单一环糊精和包合物的1H NMR谱图;b-三丁酸甘油酯、复配环糊精和包合物的1H NMR谱图
图3 三丁酸甘油酯、环糊精和包合物的1H NMR谱图
Fig.3 1H NMR spectra of tributyrin, cyclodextrins and their inclusion complex
由表1可知,CD空腔内的质子H3、H5、H6发生了不同程度的位移变化,这是由于α-、β-和γ-CD与TB发生相互作用后,TB分子会进入CD的疏水空腔,其环电流效应会使空腔内部质子周围的电子云密度增大,从而导致质子化学位移发生偏移,证实了α-、β-和γ-CD都可包合TB形成包合物[19]。此外,有研究表明质子位移的变化幅度可展现客体分子进入空腔的取向以及主客体的包合模式[20],图4显示了CD单体与TB单体的原子标记,由图4-a可以看出,质子H6位于CD外部的窄口端,并且比较表1中H3、H5、H6的位移变化程度可得知,H3的变化值大于H5,表明TB倾向于从CD宽口端进入疏水空腔,H6的化学位移是由于客体分子深插入空腔造成。此外,相同质子β-CD位移变化值最大,说明尽管TB能与3种CD都发生包合,但β-CD包合TB的能力最强,可能与β-CD空腔尺寸同TB最适配有关[19]。
表1 环糊精单体及与三丁酸甘油酯包合物的1H化学位移(δ)
Table 1 1H-chemical shifts (δ) of cyclodextrins in the absence and presence of tributyrin

质子位移H1H3H6H5H4H2α-CDδ0 4.796 3.778 3.653 3.624 3.356 3.273α-CD/TBδ14.7953.7643.6553.623.3523.274Δδ-0.001-0.0140.002-0.004-0.0040.001β-CDδ04.8263.6913.6113.5593.3423.298β-CD/TBδ14.8283.6683.6153.5663.3403.299Δδ0.002-0.0230.0040.007-0.0020.001γ-CDδ04.8843.6373.5863.5273.353.330γ-CD/TBδ14.8853.6253.5933.5373.3473.327Δδ0.001-0.0120.0070.01-0.003-0.003
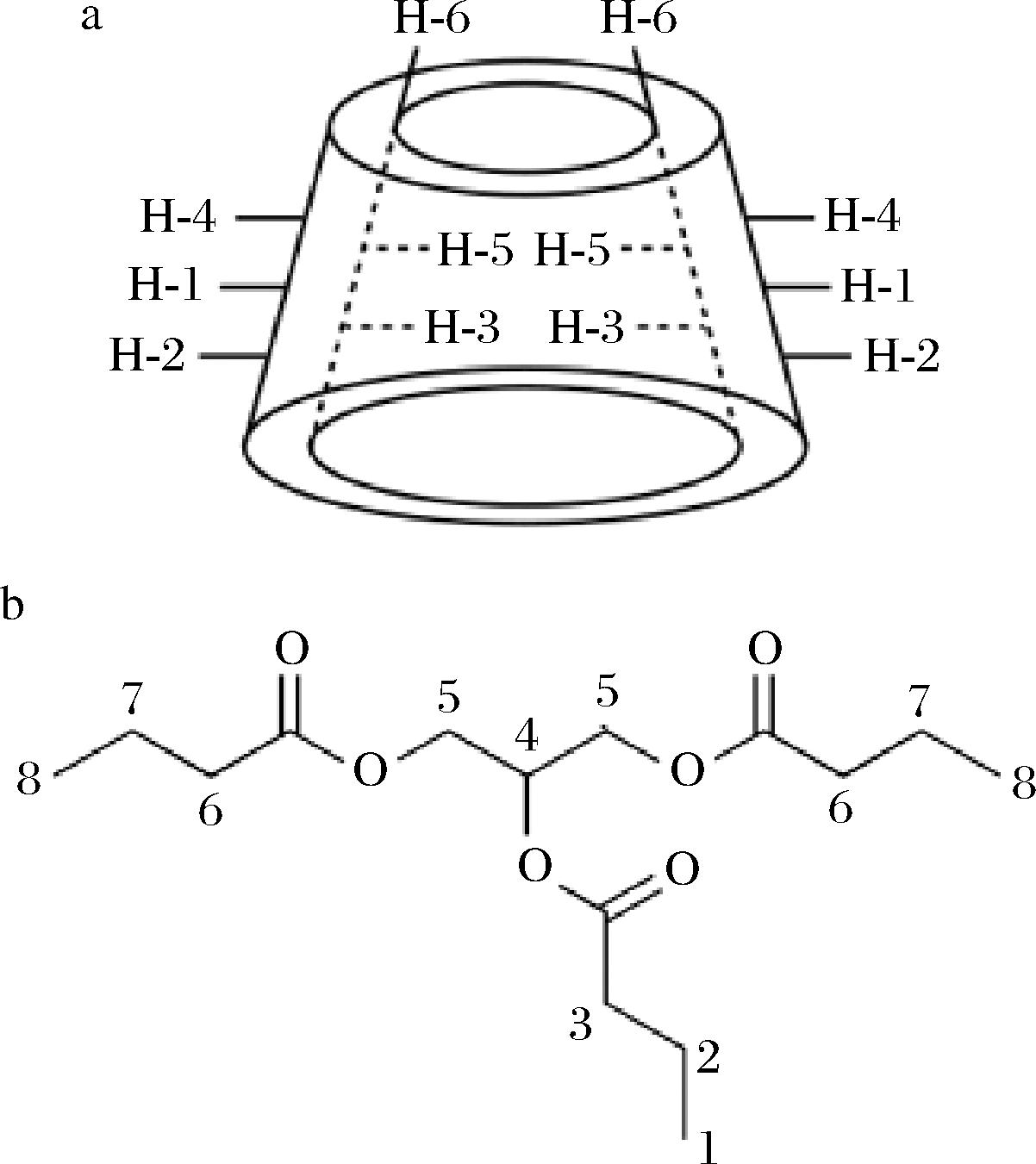
a-环糊精;b-三丁酸甘油酯
图4 环糊精与三丁酸甘油酯的原子标记[9]
Fig.4 Proton labeling of cyclodextrin and tributyrin
表2列出了TB质子的化学位移变化情况。TB外缘链状结构上的氢原子(H2, 7和H1, 8)发生较为明显的偏移,表明TB由乙基部分进入CD空腔的构象占优势。相同质子β-CD的化学位移改变值最大,同表1结果一致。
表2 三丁酸甘油酯单体及与环糊精包合物的1H化学位移(δ)
Table 2 1H-chemical shifts (δ) of tributyrin in the absence and presence of cyclodextrins
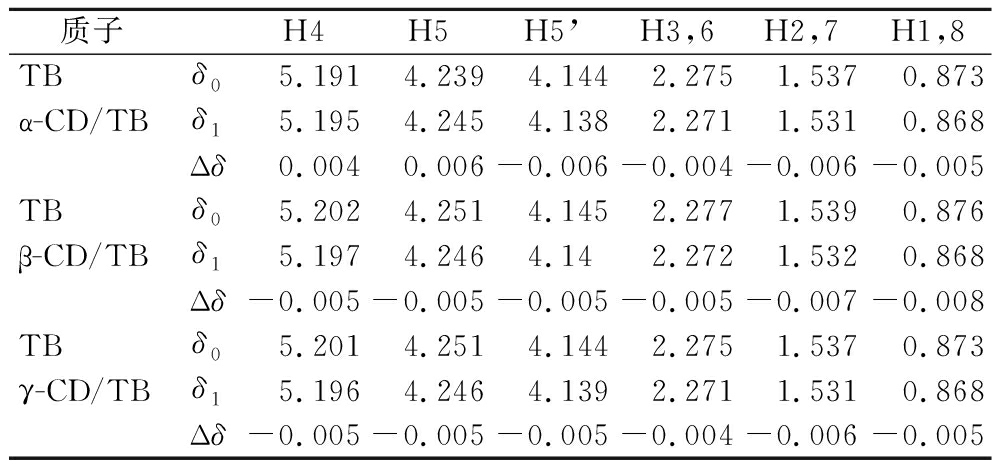
质子H4H5H5’H3,6H2,7H1,8TBδ0 5.191 4.239 4.144 2.275 1.537 0.873α-CD/TBδ15.1954.2454.1382.2711.5310.868Δδ0.0040.006-0.006-0.004-0.006-0.005TBδ05.2024.2514.1452.2771.5390.876β-CD/TBδ15.1974.2464.142.2721.5320.868Δδ-0.005-0.005-0.005-0.005-0.007-0.008TBδ05.2014.2514.1442.2751.5370.873γ-CD/TBδ15.1964.2464.1392.2711.5310.868Δδ-0.005-0.005-0.005-0.004-0.006-0.005
由表3可知,当2种或3种CD同时包合TB时,CD空腔内部质子及外侧部分质子都发生较明显的化学位移,这可能是由于TB分子全部或部分插入CD空腔内引起内部质子位移,TB分子与CD外侧质子相互作用引起外侧质子位移;进而推测复配CD能以多种方式与TB分子结合。观察表2、表4中所示数据,以复配CD为壁材时,包合物中TB分子的化学位移最大为0.013 ppm,以单一CD为壁材时,TB的化学位移最大为0.008 ppm,复配CD-TB包合物中TB分子的化学位移变化明显大于单一CD,所以猜测复配CD存在更适于包合TB的结构,包合TB的能力更强。
表3 环糊精单体及与三丁酸甘油酯包合物的1H化学位移(Δδ)
Table 3 1H-chemical shifts (Δδ) of cyclodextrins in the absence and presence of tributyrin
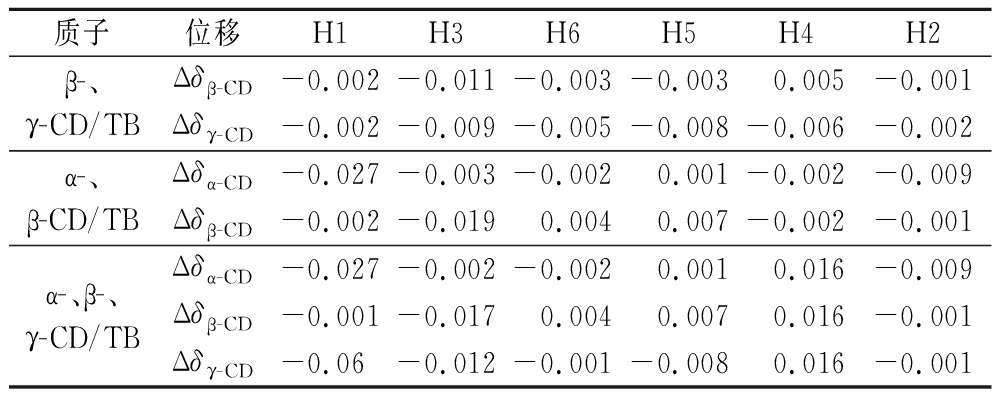
质子位移H1H3H6H5H4H2β-、γ-CD/TBΔδβ-CD-0.002-0.011-0.003-0.003 0.005-0.001Δδγ-CD-0.002-0.009-0.005-0.008-0.006-0.002α-、β-CD/TBΔδα-CD-0.027-0.003-0.002 0.001-0.002-0.009Δδβ-CD-0.002-0.0190.0040.007-0.002-0.001α-、β-、γ-CD/TBΔδα-CD-0.027-0.002-0.002 0.001 0.016-0.009Δδβ-CD-0.001-0.0170.0040.0070.016-0.001Δδγ-CD-0.06-0.012-0.001-0.0080.016-0.001
表4 三丁酸甘油酯单体及与环糊精包合物的1H化学位移(δ)
Table 4 1H-chemical shifts (δ) of tributyrin in the absence and presence of cyclodextrins
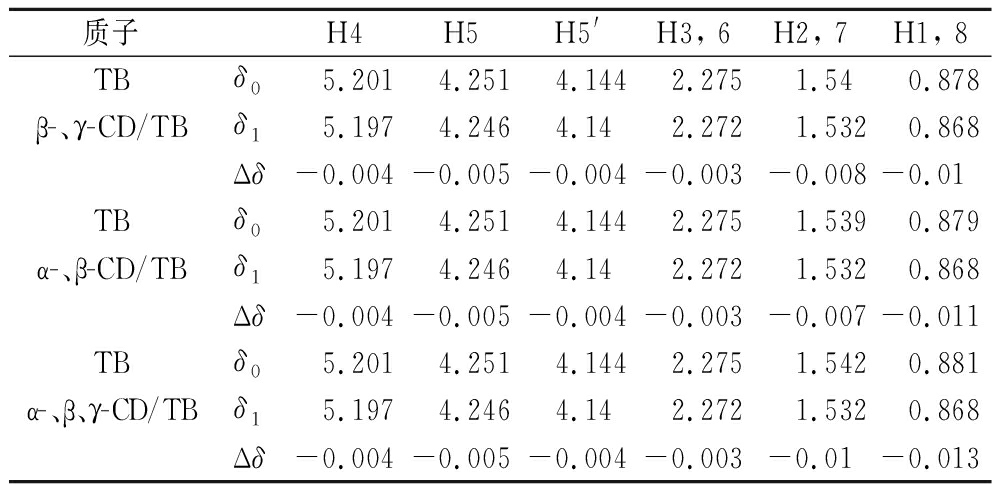
质子H4H5H5'H3, 6H2, 7H1, 8TBδ0 5.201 4.251 4.144 2.275 1.54 0.878β-、γ-CD/TBδ15.1974.2464.142.2721.5320.868Δδ-0.004-0.005-0.004-0.003-0.008-0.01TBδ05.2014.2514.1442.2751.5390.879α-、β-CD/TBδ15.1974.2464.142.2721.5320.868Δδ-0.004-0.005-0.004-0.003-0.007-0.011TBδ05.2014.2514.1442.2751.5420.881α-、β、γ-CD/TBδ15.1974.2464.142.2721.5320.868Δδ-0.004-0.005-0.004-0.003-0.01-0.013
2.2 相溶解度分析
目前,相溶解度法广泛用于研究CD对难溶性客体溶解度的影响[21]。本文通过相溶解度研究了CD对TB的增溶效应,结果如图5所示。TB的溶解性随着CD浓度的增加而成比例增加,这是由于CD可与TB形成包合物[22];分析相溶解度曲线可知,所有线性回归方程的相关系数(R2)均大于0.95(表5),说明CD与TB的相溶解度曲线为AL型[23],表明CD与TB以1∶1物质的量比进行包合[24]。
表5 在不同温度条件下3种环糊精与三丁酸甘油酯的包合稳定常数
Table 5 Inclusion stability constants of the tributyrin and three typical cyclodextrins under different temperature
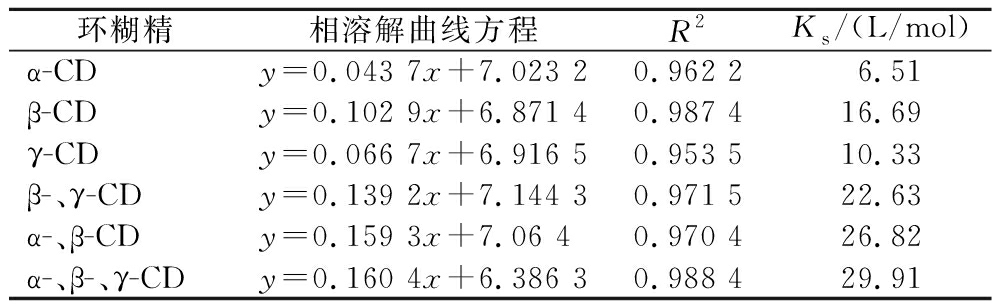
环糊精相溶解曲线方程R2Ks/(L/mol)α-CDy=0.043 7x+7.023 20.962 26.51β-CDy=0.102 9x+6.871 40.987 416.69γ-CDy=0.066 7x+6.916 50.953 510.33β-、γ-CDy=0.139 2x+7.144 30.971 522.63α-、β-CDy=0.159 3x+7.06 40.970 426.82α-、β-、γ-CDy=0.160 4x+6.386 30.988 429.91
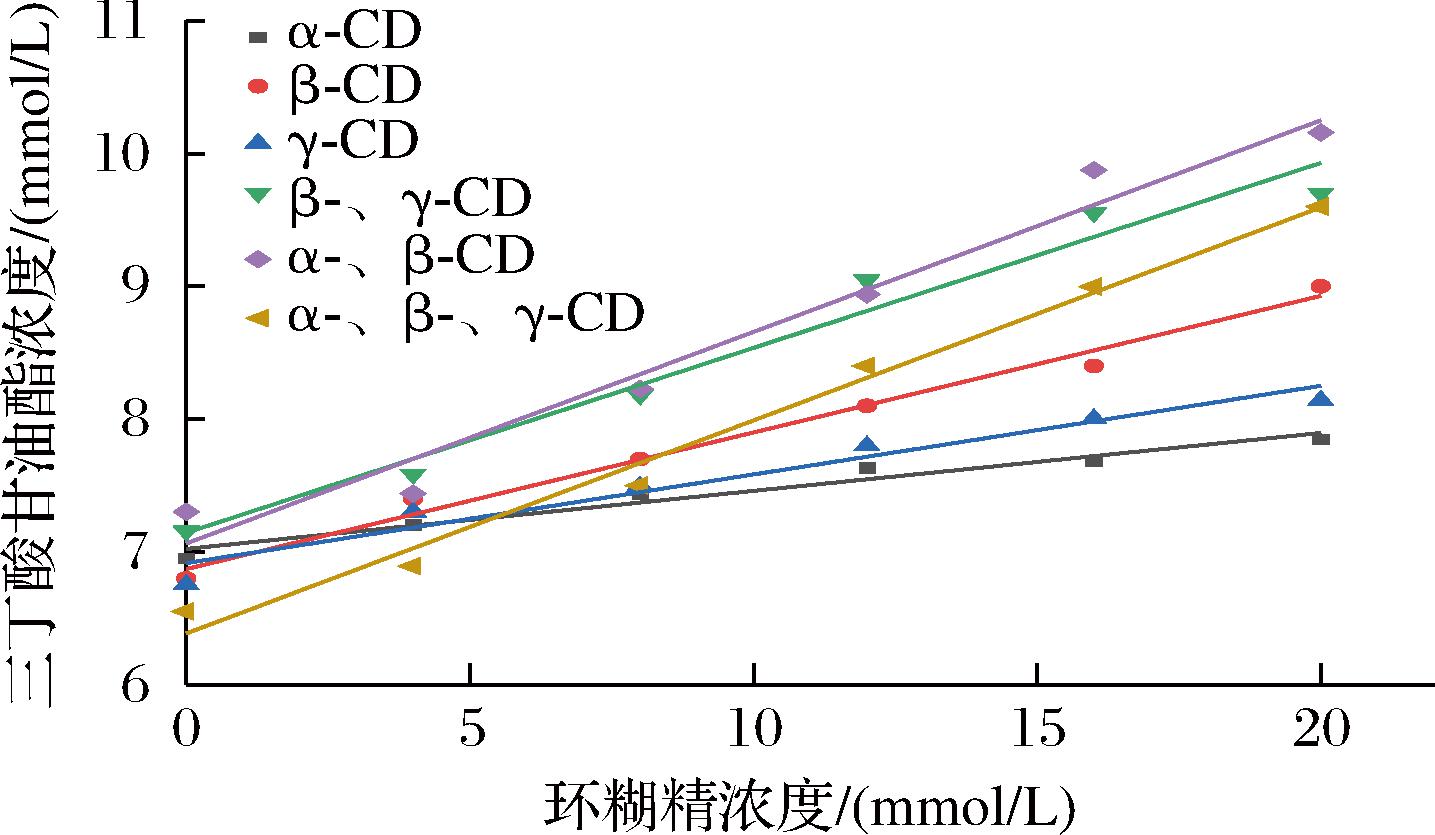
图5 环糊精与三丁酸甘油酯的相溶解度曲线
Fig.5 Phase solubility of cyclodextrin and tributyrin
此外,相溶解度法是计算CD和客体物质包合稳定常数Ks的一种常用技术[25],Ks值越大,包合物稳定性越好[26]。为评估不同CD与TB包合物的稳定性,计算了包合稳定常数,结果如表5所示。不同主体包合稳定常数的顺序为:α-、β-、γ-CD>α-、β-CD>β-、γ-CD>β-CD>γ-CD>α-CD,表明以单一CD作为壁材时,β-CD与TB的Ks值最大,猜测原因可能是TB可能与β-CD空腔的匹配度较高,形成的包合物更稳定;而γ-CD的空腔尺寸相对较大,TB分子能够更自由的进出其空腔,导致γ-CD/TB包合物不稳定;相比之下,α-CD的空腔尺寸较小,降低了其有效包合TB的概率,因此α-CD/TB包合物的稳定性最低;复配CD(α-CD∶β-CD∶γ-CD=2∶7∶1)与TB的Ks值相对于β-CD提高了79.21%,表明多种CD同时存在对TB的协同包合效果明显优于单一CD,复配CD包合TB的能力更强,此结果证实了上文猜测;此外,α-、β-CD及β-、γ-CD与TB的Ks值相对于β-CD分别提高了60.70%、35.60%,可以进一步说明β-CD与α-CD的协同效果较好。
2.3 包合过程热力学分析
等温滴定微量热是近年发展的一项热分析技术,该技术灵敏度高、测量准确,且可做到实时、定量、在线和动态描述反应过程[27]。为进一步研究CD与TB的热力学相互作用,测定了二者的等温滴定量热曲线,实验结果如图6所示。观察拟合结果可知,除α-CD外,其他CD与TB的拟合结果较好,可判断数据有效可靠;推测因α-CD空腔过小有效包合TB的概率较低,加之空白溶剂的影响过大,所以α-CD包合TB过程中的等温滴定量热曲线无法用One Sites拟合方式拟合。
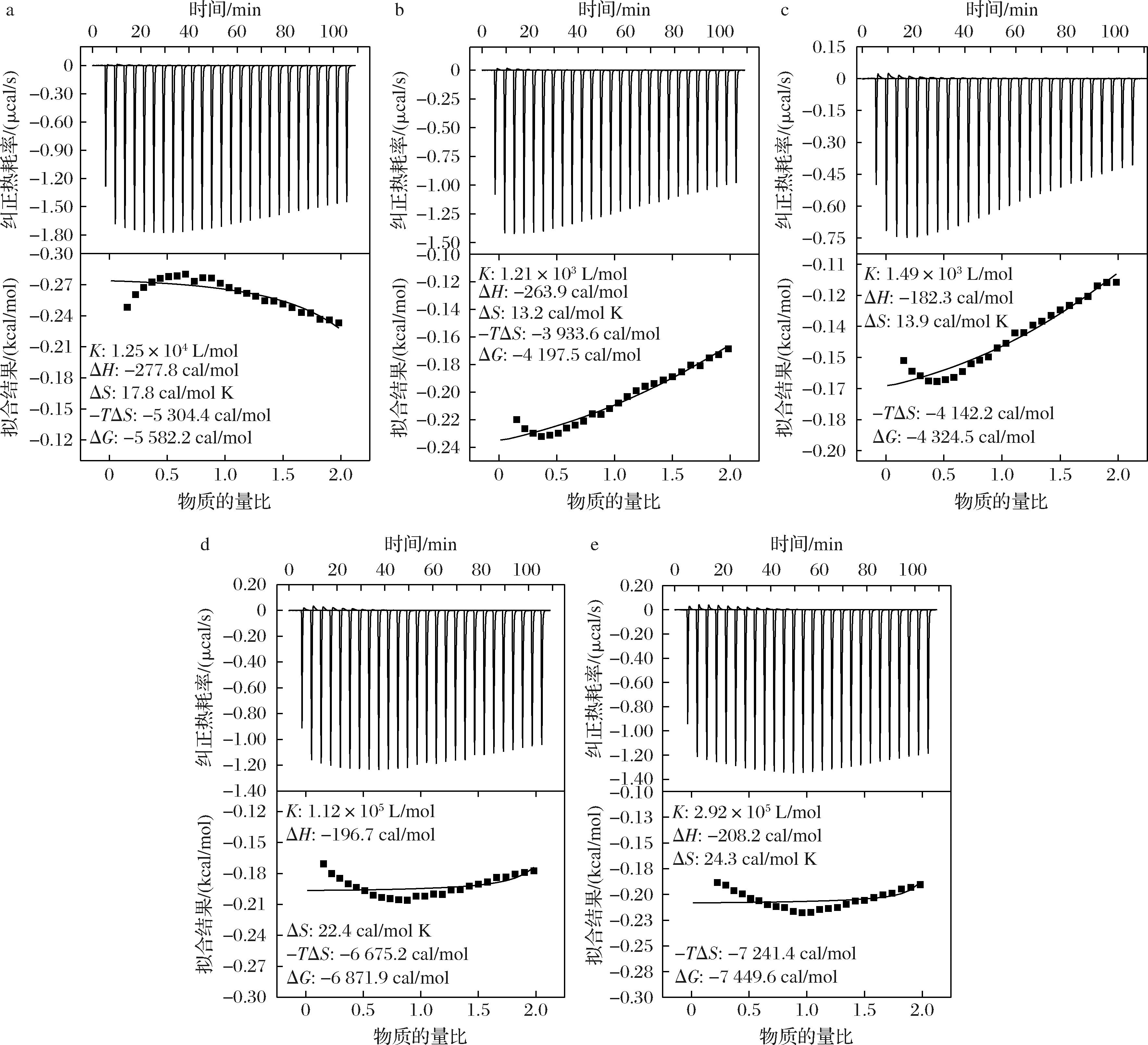
a-β-CD;b-γ-CD;c-β-、γ-CD;d-α-、β-CD;e-α-、β-、γ-CD
图6 环糊精滴定三丁酸甘油酯的等温滴定量热曲线
Fig.6 Cyclodextrin titration tributyrin isothermal drops of quantitative thermal curve
在包合物形成过程中,主客体之间没有化学键变化,热力学上主要由焓或熵驱动,是一种物理过程。观察图6中列出的热力学参数值可以看出,-TΔS、ΔH、ΔG均小于0,表示CD包合TB是一个可自发进行的微放热过程;且∣-TΔS∣>∣ΔH∣,说明焓熵协同驱动促进CD包合TB,熵驱动在包合过程中占主导地位[28];进而,ΔH<0,ΔS>0,表明促进包合过程发生的主要因素有疏水作用力、氢键、离子键和范德华力[29],其中疏水作用力起主要作用,CD/TB包合物形成过程中的热力学参数是上述作用力相互竞争平衡的结果。通常情况下,ΔS>0可能是由于两部分疏水作用力促成的,第一部分是TB分子周围的疏水作用力,包括被包合在CD空腔内部的TB分子及包合体系内少量游离的TB分子;第二部分疏水作用力来自CD/TB包合物形成过程中高能量水分子的释放,包括CD疏水空腔内部的水分子、CD外侧亲水表面的水分子及TB分子疏水结构周围的水分子,此部分疏水作用力较强,能够提高包合过程中的熵驱动[30]。
此外,由图6可知,以单一CD滴定TB时,β-CD与TB的包合稳定常数大于γ-CD,表明β-CD的疏水空腔更适于包合TB,二者之间的疏水相互作用较强,β-CD/TB包合物更稳定。比较复配CD与TB的包合稳定常数可知,3种CD同时存在时与TB的包合稳定常数最大,说明3种CD协同作用可达到更好的包合效果,并且β-CD与α-CD的协同作用比β-CD与γ-CD的协同作用更好,此结果与相溶解度结果一致。β-CD包合TB过程中的熵变为17.8 cal/mol K,与之相比,α-、β-CD及α-、β-、γ-CD包合TB过程中的熵值分别提高了25.84%、36.52%,表明α-CD和γ-CD以一定比例与β-CD同时存在时可增大熵驱动,推测原因为多种环糊精同时存在可以提供更多与TB分子尺寸相匹配的疏水空腔,使较多量的TB进入空腔形成包合物,增加了TB被有效包合的可能性;包合过程中会有较多高能量水分子从CD空腔内部及外侧亲水表面释放,增强了CD与TB之间的疏水相互作用,从而达到更稳定的包合效果。
2.4 分子模拟对接研究
为进一步阐明CD与TB的包合机制,本研究使用分子对接软件AutoDock 4.2.6对CD和TB的包合物进行了分子对接研究,证实了包合物结构的合理性。由ChemSpider获得的3种CD和TB的三维构象如图7所示,α-CD、β-CD和γ-CD为空腔依次增大的环状结构,而TB为3个分支的链状结构。
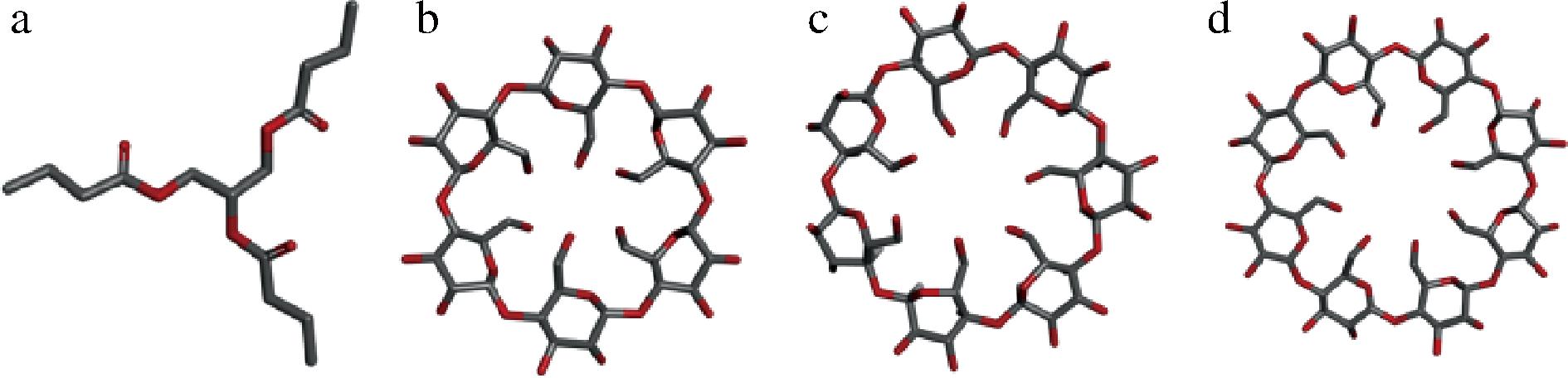
a-三丁酸甘油酯;b-α-环糊精;c-β-环糊精;d-γ-环糊精
图7 三丁酸甘油酯、α-环糊精、β-环糊精、γ-环糊精的三维结构图
Fig.7 3D structures of tributyrin,α-CD, β-CD, and γ-CD
据文献报道,α-、β-和γ-CD的疏水空腔的平均直径分别为5.7 Å、7.8 Å和9.5 Å[31],TB与3种CD在理论上均能发生包合。图8显示了TB和3种CD的最大可能包合构象,TB被包合进CD空腔的基团及其形态不同:α-CD的疏水空腔较小,TB的链状结构只能被部分包合,大部分结构暴露于CD空腔外侧,包合构象极不稳定;TB在β-CD的空腔中可适当卷曲,被较完全包合,增加了β-CD包合TB的紧密程度与稳定性;而γ-CD由于其疏水空腔过大,疏水作用力不足导致TB分子与腔体内侧还存在较大间隙,TB分子能够较自由的进出其空腔,导致包合构象极不稳定,从而增加了形成包合物的难度。
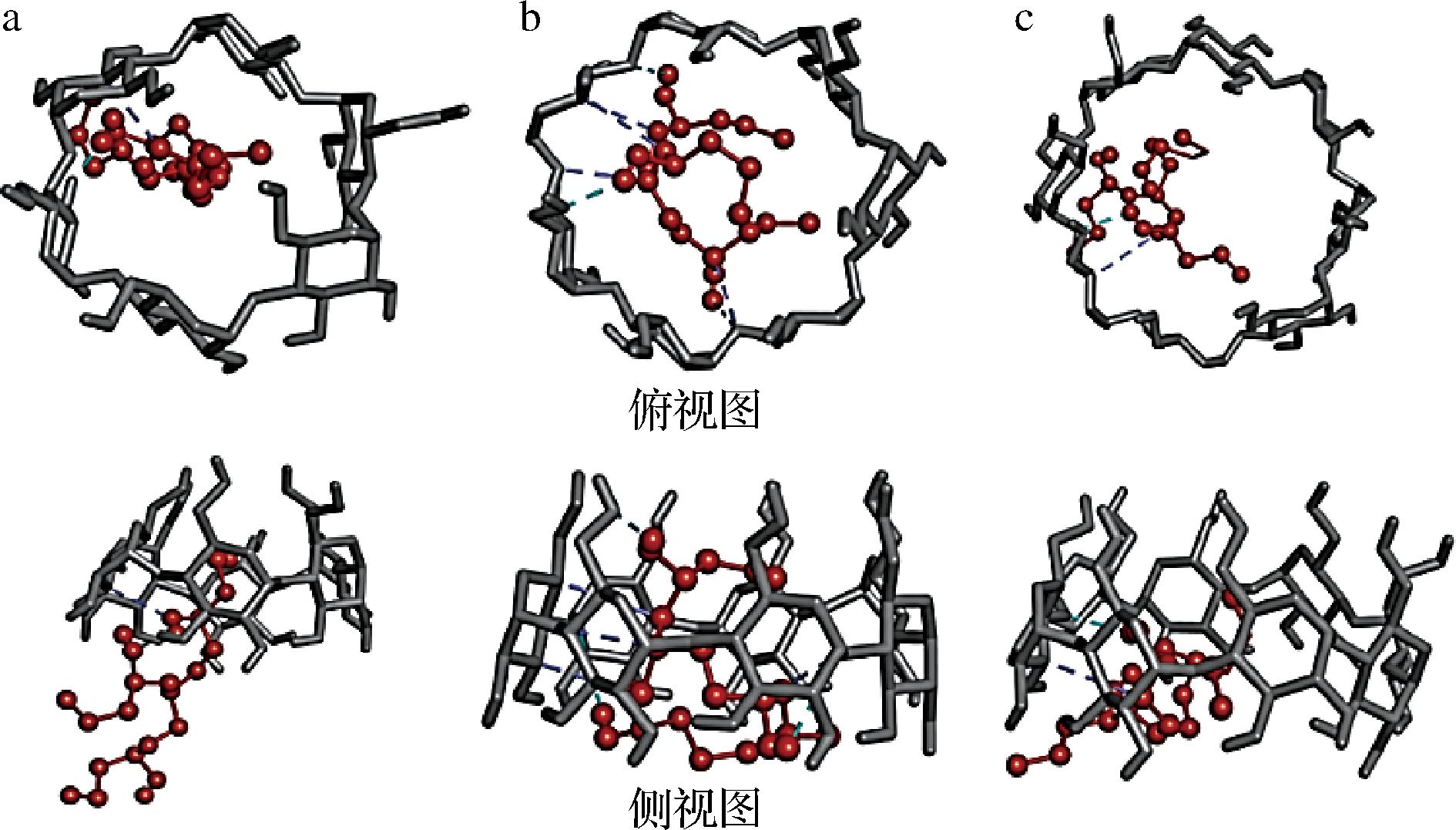
a-α-环糊精;b-β-环糊精;c-γ-环糊精
图8 三丁酸甘油酯与α-环糊精、β-环糊精、γ-环糊精的分子对接最优构象
Fig.8 Optimal molecular docking conformation of tributyrin with α-CD, β-CD, and γ-CD
由表6可知,TB与3种不同类型CD的refRMS值的顺序为:β-CD<α-CD<γ-CD,其中β-CD与TB包合结果的refRMS值最小,表明其对接构象的有效性最大;从结合能方面看,β-CD与TB的结合能最高,远大于α-CD和γ-CD,说明β-CD与TB的包合结构最为紧密。
表6 分子对接结果相关参数
Table 6 Related parameters of molecular docking results
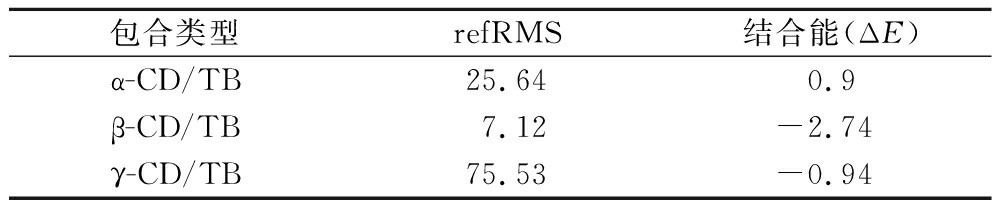
包合类型refRMS结合能(ΔE)α-CD/TB25.640.9β-CD/TB7.12-2.74γ-CD/TB75.53-0.94
通过进一步分析分子模拟对接结果,得到3种CD包合TB的多种包合构象,如图9所示。
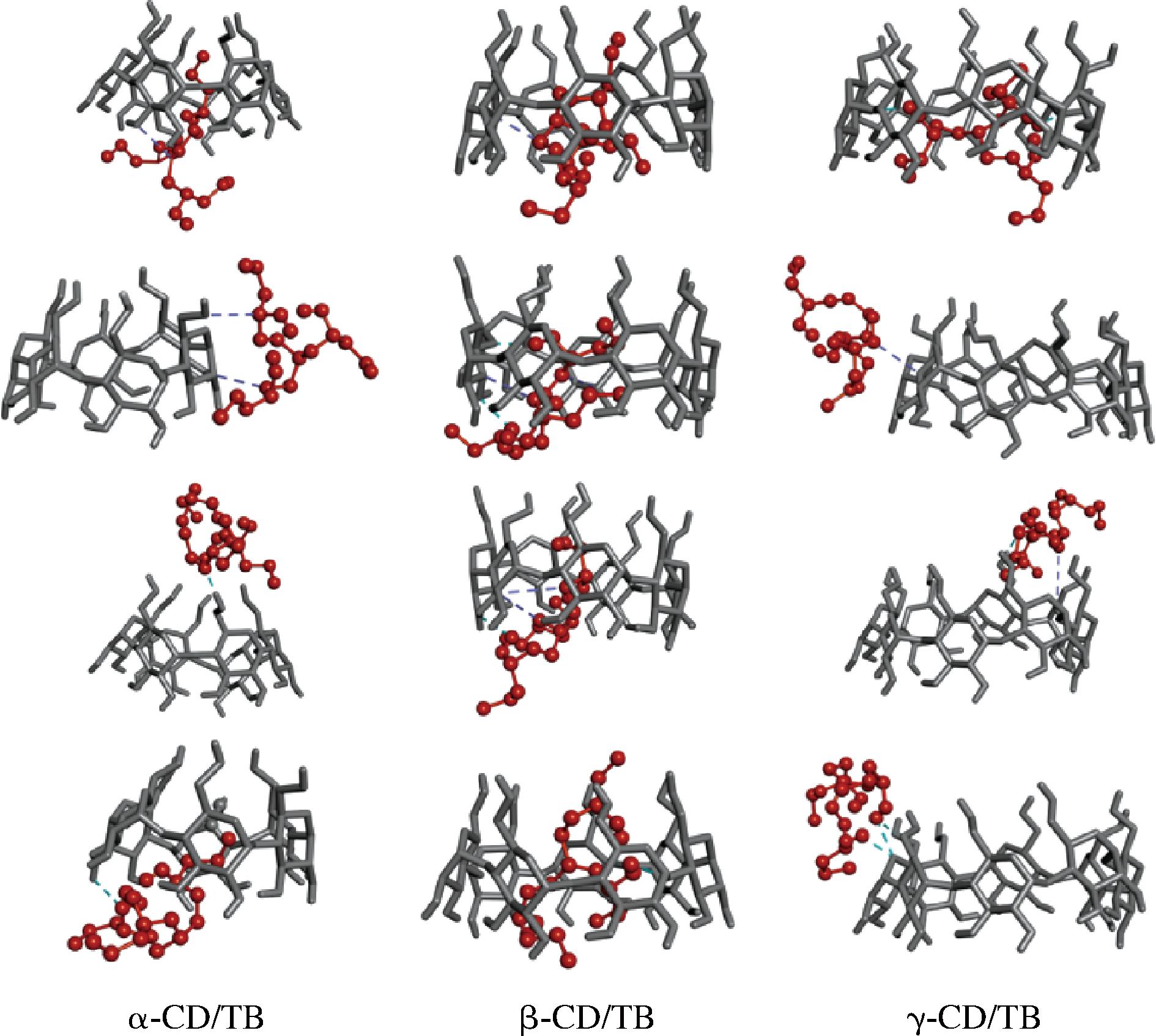
图9 三丁酸甘油酯与α-环糊精、β-环糊精、γ-环糊精的分子对接可能构象
Fig.9 Possible molecular docking conformation of tributyrin with α-CD, β-CD, and γ-CD
β-CD的空腔最适于包合TB,没有出现TB分子脱离β-CD空腔的情况,但也会出现仅包合侧链的对接结果;而α-CD和γ-CD包合TB时,会出现仅包合侧链或TB分子未被包合进空腔内的结果,此时CD与TB的包合构象便不稳定。
联系相溶解度和等温滴定微量热的实验结果可知,2种或3种CD复配与TB时的包合稳定常数明显大于单一CD,说明多种CD协同作用包合TB可能会形成更稳定的包合构象。结合以上实验结果的分析,最终推测出如图10所示复配CD包合TB的包合构象,多种CD协同包合TB能够形成稳定的包合物。
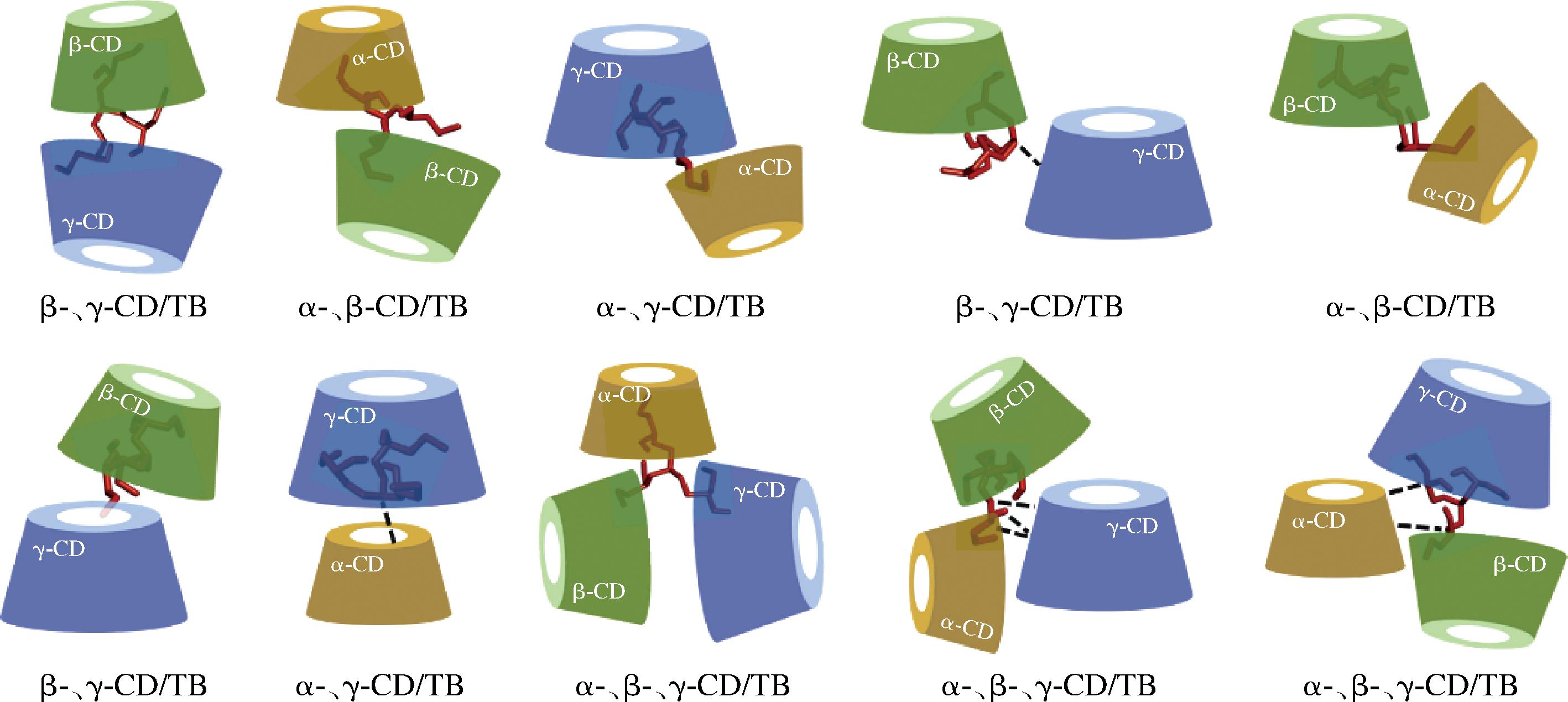
图10 三丁酸甘油酯与环糊精包合模型图
Fig.10 Simulated inclusion complex conformation of tributyrin with cyclodextrins
3 结论
本研究首先通过核磁共振光谱鉴定出α-CD、β-CD、γ-CD均可能与TB形成包合物,其中β-CD最适于包合TB;根据相溶解度实验确定CD与TB的包合比为1∶1,复配CD与TB的包合效果优于单一CD;进而通过等温滴定微量热实验可知CD包合TB是可自发进行的微放热过程,焓熵协同驱动促进包合过程发生,熵驱动在包合过程中占主导地位,疏水作用力为主要作用,并且α-CD和γ-CD以一定比例与β-CD同时存在时可以提供更多与TB分子尺寸相匹配的疏水空腔,增强了CD与TB之间的疏水相互作用,从而达到更稳定的包合效果;最后,通过深入解析单一CD包合TB的分子构象,推测出复配CD协同包合TB的分子模型。本文研究分析了3种常见CD包合TB的分子机制及不同CD包合TB的协同效应,为改善TB的应用效果打下坚实的理论基础,也有助于完善CD的包合理论与技术,最终促进相关产业的快速发展。
[1] TIAN B R, XIAO D, HEI T T, et al.The application and prospects of cyclodextrin inclusion complexes and polymers in the food industry:A review[J].Polymer International, 2020, 69(7):597-603.
[2] YILDIZ Z I, KILIC M E, DURGUN E, et al.Molecular encapsulation of cinnamaldehyde within cyclodextrin inclusion complex electrospun nanofibers:Fast-dissolution, enhanced water solubility, high temperature stability, and antibacterial activity of cinnamaldehyde[J].Journal of Agricultural and Food Chemistry, 2019, 67(40):11066-11076.
[3] KFOURY M, LANDY D, FOURMENTIN S.Characterization of cyclodextrin/volatile inclusion complexes:A review[J].Molecules, 2018, 23(5):1204.
[4] WATKINS S M, CARTER L C, MAK J, et al.Butyric acid and tributyrin induce apoptosis in human hepatic tumour cells[J].The Journal of Dairy Research, 1999, 66(4):559-567.
[5] REN Q C, XUAN J J, WANG L K, et al.Effects of tributyrin supplementation on in vitro culture fermentation and methanogenesis and in vivo dietary nitrogen, calcium and phosphorus losses in small tail ewes[J].Animal Feed Science and Technology, 2018, 243:64-71.
[6] MIRAGOLI F, PATRONE V, PRANDINI A, et al.Implications of tributyrin on gut microbiota shifts related to performances of weaning piglets[J].Microorganisms, 2021, 9(3):584.
[7] 薛永强, 马永喜, 赵虎, 等.三丁酸甘油酯的生理调控机制及在动物生产中的应用[J].动物营养学报, 2020, 32(12):5547-5555.
XUE Y Q, MA Y X, ZHAO H, et al.Physiological regulation mechanism of tributyrin and its application in animal production[J].Chinese Journal of Animal Nutrition, 2020, 32(12):5547-5555.
[8] 郑欣, 徐树德, 艾庆辉, 等.三丁酸甘油酯对动物生长和肠道屏障功能的影响及其作用机制[J].动物营养学报, 2018, 30(5):1668-1675.
ZHENG X, XU S D, AI Q H, et al.Effects of tributyrin on growth and intestinal barrier function of animals and its mechanism[J].Chinese Journal of Animal Nutrition, 2018, 30(5):1668-1675.
[9] LI Z X, FENG Y, LI Z F, et al.Inclusion of tributyrin during enzymatic synthesis of cyclodextrins by β-cyclodextrin glycosyltransferase from Bacillus circulans[J].Food Hydrocolloids, 2020, 99:105336.
[10] 李泽西. 环糊精-三丁酸甘油酯包合体系的酶法构建、表征及其包合机理研究[D].无锡:江南大学, 2020.
LI Z X.Enzymatic preparation, characterization and inclusion mechanism of cyclodextrin-tributyrin inclusion complex[D].Wuxi:Jiangnan University, 2020.
[11] DONOVAN J D, LEE S Y, LEE Y.R-index measure of microencapsulated tributyrin in gamma-cyclodextrin influenced by drying method[J].Journal of Food Science, 2016, 81(9):S2252-S2257.
[12] LI C M, LI Z X, LIU T H, et al.Encapsulating tributyrin during enzymatic cyclodextrin synthesis improves the solubility and bioavailability of tributyrin[J].Food Hydrocolloids, 2021, 113:106512.
[13] FENG Y, GU J Y, ZHU T, et al.Enzymatic cyclodextrin synthesis-tributyrin inclusion complex:Properties, structural characterization and release behaviors in vitro[J].LWT, 2022, 165:113726.
[14] LIU R, QIN X L, LIU X, et al.Host-guest interactions between oleic acid and β-cyclodextrin:A combined experimental and theoretical study[J].Food Chemistry, 2022, 387:132910.
[15] 李丹, 万会达, 吴海燕, 等.甜菊双糖苷/γ-环糊精包合物的制备[J].食品与发酵工业, 2017, 43(3):169-174.
LI D, WAN H D, WU H Y, et al.Research on steviolbioside inclusion complex preparation by γ-cyclodextrin[J].Food and Fermentation Industries, 2017, 43(3):169-174.
[16] 张翔宇, 王瑷琳, 刘祉妤, 等.鱼皮明胶-海藻酸钠相互作用及其规律[J].食品与发酵工业, 2022, 48(7):160-165.
ZHANG X Y, WANG A L, LIU Z Y, et al.Interaction and rule between sodium alginate and fish skin gelatin[J].Food and Fermentation Industries, 2022, 48(7):160-165.
[17] 姜兴粲. 沙拉沙星β-环糊精包合物的制备与评价[D].北京:中国农业科学院, 2020.
JIANG X C.Preparation and evaluation of sarafloxacin β-cyclodextrin inclusion complex[D].Beijing:Chinese Academy of Agricultural Sciences, 2020.
[18] JAHED V, ZARRABI A, BORDBAR A K, et al.NMR (1H, ROESY) spectroscopic and molecular modelling investigations of supramolecular complex of β-cyclodextrin and curcumin[J].Food Chemistry, 2014, 165:241-246.
[19] 刘彤晖. 一步法制备环糊精-植物精油包合物及其抑菌特性研究[D].无锡:江南大学, 2021.
LIU T H.One step preparation and antibacterial properties of cyclodextrin-essential oil inclusion complex[D].Wuxi:Jiangnan University, 2021.
[20] 姜慧明. β-环糊精对典型芳香化合物的分子组装和识别研究[D].大连:大连理工大学, 2011.
JIANG H M.Molecular assembly and recognition investigation of β-cyclodextrin to characteristic aromatic compounds[D].Dalian:Dalian University of Technology, 2011.
[21] LOBATTO V L, ARGÜELLO G A, CAIRA M R, et al.Trifluralin and two of its photodegradation products:Crystal structures and phase solubility/UV studies with cyclodextrins[J].Journal of Physical Organic Chemistry, 2019, 32(11):e4006.
[22] NICOL T W J, MATUBAYASI N, SHIMIZU S.Origin of non-linearity in phase solubility:Solubilisation by cyclodextrin beyond stoichiometric complexation[J].Physical Chemistry Chemical Physics:PCCP, 2016, 18(22):15 205-15 217.
[23] BAYRAKC M, ERTUL
M, ERTUL  , YILMAZ M.Phase solubility studies of poorly soluble drug molecules by using O-phosphorylated calixarenes as drug-solubilizing agents[J].Journal of Chemical &Engineering Data, 2012, 57(1):233-239.
, YILMAZ M.Phase solubility studies of poorly soluble drug molecules by using O-phosphorylated calixarenes as drug-solubilizing agents[J].Journal of Chemical &Engineering Data, 2012, 57(1):233-239.
[24] 姚培培, 樊金玲, 李德锋, 等.光甘草定/环糊精固体包合物的制备和性质[J].食品科学, 2022, 43(16):9-18.
YAO P P, FAN J L, LI D F, et al.Preparation and characterization of glabridin/cyclodextrin solid inclusion complex[J].Food Science, 2022, 43(16):9-18.
[25] XIAO Z B, ZHANG Y Q, NIU Y W, et al.Cyclodextrins as carriers for volatile aroma compounds:A review[J].Carbohydrate Polymers, 2021, 269:118292.
[26] LIU B G, LI W, ZHAO J, et al.Physicochemical characterisation of the supramolecular structure of luteolin/cyclodextrin inclusion complex[J].Food Chemistry, 2013, 141(2):900-906.
[27] 刘荻, 曾勤, 马卓.等温滴定微量热法在中药研究中的应用[J].食品与药品, 2017, 19(1):67-70.
LIU D, ZENG Q, MA Z.Application of isothermal titration calorimetry in traditional Chinese medicine research[J].Food and Drug, 2017, 19(1):67-70.
[28] 文先红. 环糊精与几种药物非共价作用的研究[D].杭州:浙江大学, 2004.
WEN X H.Study on non-covalent interaction between cyclodextrin and several drugs[D].Hangzhou:Zhejiang University, 2004.
[29] ZHENG Y, DONG L N, LIU M, et al.Effect of pH on the complexation of kaempferol-4′-glucoside with three β-cyclodextrin derivatives:Isothermal titration calorimetry and spectroscopy study[J].Journal of Agricultural and Food Chemistry, 2014, 62(1):244-250.
[30] NEAC U A.Physicochemical investigation of the complexation between γ-cyclodextrin and doxorubicin in solution and in solid state[J].Thermochimica Acta, 2018, 661:51-58.
U A.Physicochemical investigation of the complexation between γ-cyclodextrin and doxorubicin in solution and in solid state[J].Thermochimica Acta, 2018, 661:51-58.
[31] ASTRAY G, GONZALEZ-BARREIRO C, MEJUTO J C, et al.A review on the use of cyclodextrins in foods[J].Food Hydrocolloids, 2009, 23(7):1631-1640.