双峰驼是荒漠地区重要的特种经济动物,对荒漠植物利用率高且具备忍耐极端环境的适应力及免疫系统,为偏远地区牧民提供奶、肉、皮及毛等畜产品。骆驼乳具有丰富的优质蛋白及人体必需氨基酸[1],营养价值高且具有低致敏性,适宜各类人群食用,被誉为“沙漠白金”。
双峰驼产奶量低于单峰驼,但乳中蛋白质含量显著高于单峰驼,富含乳铁蛋白、免疫球蛋白、过氧化物酶、溶菌酶等保护性蛋白。驼乳在乳类中营养和药用价值极高,但其开发利用仍处于初级阶段。驼乳中的乳清蛋白营养价值较高,易于消化吸收,对新生仔驼的生长发育至关重要。其中,α-乳白蛋白是色氨酸和半胱氨酸的主要供体,参与免疫调节,并具有极高的抗氧化活性[2]。α-乳白蛋白更易被肠道酶类(糜蛋白酶和胰蛋白酶等)酶解。驼乳中缺少β-乳球蛋白,可作为牛乳的替代品供给过敏患者食用。乳铁蛋白是乳中重要的非血红素铁结合糖蛋白,具有广泛生物学功能,尤其在新生仔畜免疫系统的发育与完善过程中发挥着重要作用[3-4]。免疫球蛋白(immunoglobulin G, IgG)是母体输送给仔畜为其提供被动免疫保护[5]。溶菌酶则与乳铁蛋白间具有协同作用,发挥较强的抗菌活性。α-乳白蛋白、乳铁蛋白、IgG和溶菌酶4种功能蛋白的特殊生物学特性及热敏性与驼乳的开发利用及生产加工息息相关。此外,与牛乳相比,驼乳中长链不饱和脂肪酸丰富,如共轭亚油酸,这些脂肪酸对机体具有潜在的生理保护作用,使得驼乳脂肪酸组成及含量成为国内外研究者重点研究内容之一。此外,驼乳因其脂肪酸组成符合人类健康饮食模式,近些年作为功能食品而受到国内外研究者广泛关注[6]。
目前,国内外研究者对双峰驼常乳期的驼乳成分变化报道较少。国内仅有关于双峰驼在不同饲养条件下乳成分的比较[7]、泌乳前期与中期的氨基酸含量变化[8]及脂肪酸种类及含量变化[9-10]的研究,尚未开展集约化养殖条件下的驼乳功能性蛋白的研究。国外研究者仅对单峰驼泌乳期内乳成分(蛋白质、脂肪、固体非脂肪、灰分、乳糖和水分等理化指标)变化规律[11-14]、矿物质含量变化规律[15]、泌乳曲线类型[16]及挤奶机挤奶时的泌乳特性[17]进行过报道。
本研究对双峰驼泌乳期330 d内的驼乳进行采集,基于课题组前期对多种奶畜乳清蛋白的检测方法,使用超高效液相色谱法检测驼乳中α-乳白蛋白、乳铁蛋白含量,基于酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA)对驼乳中IgG含量进行检测,基于比浊法,使用溶菌酶试剂盒对驼乳中溶菌酶的含量进行测定,使用气相色谱法对乳中脂肪酸含量进行测定。探究集约化养殖条件下驼乳中4 种功能性蛋白(α-乳白蛋白、乳铁蛋白、IgG与溶菌酶)以及脂肪酸含量在泌乳期内变化情况,为深入研究新疆双峰驼泌乳生理学及驼乳功能性乳制品的开发提供理论依据。
1 材料与方法
1.1 乳样的采集及处理
驼乳,新疆阿勒泰地区吉木乃县万驼园养殖区(海拔539.6 m,经纬度E 87°12′09″, N 47°40′34″)饲养的准噶尔双峰驼。选取同一饲养环境下,年龄(相差≤1岁)、胎次且产驼羔时间相近(相差天数≤5 d)的20峰泌乳双峰驼进行追踪。采用舍饲与放牧相结合饲养管理方式,自由采食饮水,每日分别于5∶00与16∶00(京时)进行挤乳操作,并于每日8∶00与19∶00进行补饲,饲料配比为玉米∶豆粕∶苜蓿=2∶1∶2(质量比),每日8∶00补饲后进行放牧,下午挤奶前赶回至圈舍。采样时,驼乳样品置于4 ℃冷藏,迅速运回实验室进行检测。初乳期为1~7 d,期间每日1次进行采集检测;常乳期为30~330 d,每30 d采集并检测1次。
1.2 实验材料
Camel IgG ELISA试剂盒,上海江莱实业股份有限公司;AO50-1-1溶菌酶试剂盒,南京建成生物工程研究所;甲醇、乙腈、正庚烷、15%三氟化硼甲醇及37种脂肪酸混标(色谱纯),美国sigma公司;磷酸、BaCl2、Na2HPO4、NaOH、Na2SO4、NaCl、冰乙酸及三氟乙酸(分析纯),天津富宇精细化工有限公司;焦性没食子酸(分析纯),中国食品药品检定研究院;体积分数为95%乙醇(化学纯),上海源叶生物科技有限公司;沸程30~60 ℃石油醚(分析纯),天津市北联精细化学品开发有限公司。
1.3 仪器与设备
H-class超高效液相色谱仪,Waters公司;GC-2014气象色谱仪,美国岛津公司;7890B/5977A气相色谱质谱联用仪,美国安捷伦科技有限公司;SHB-Ⅲ循环水式多用真空泵,上海科恒实业发展有限公司;GEAKTA蛋白层析仪,美国通用公司;MULTISKAN Sky全波长扫描酶标仪,赛默飞世尔科技有限公司;Power Pac Basic电泳仪,上海伯乐生命医学产品有限公司。
1.4 实验方法
1.4.1 驼乳蛋白标准品的制备
将驼乳样品置于4 ℃恒温离心机,4 000 r/min离心15 min,去上层脂肪,记录pH值。使用稀释后的冰乙酸调节pH值到4.6,40 ℃水浴30 min加速酪蛋白沉淀,在4 ℃冰箱静置2 h后,4 ℃ 4 000 r/min离心20 min,将脱脂乳中的酪蛋白沉淀除去,使用饱和NaHCO3溶液将驼乳清液调回至原始pH值。
1.4.1.1 驼乳α-乳白蛋白标准品制备
将上一步处理后的驼乳清组分按照(NH4)2SO4分级沉淀表对乳清进行0%~20%、20%~30%、30%~40%、40%~50%、50%~60%、60%~70%、70%~80%、80%~90%、90%~100%的组分分级沉淀。α-乳白蛋白存在于90%~100%的组分中,收集90%~100%组分,加入少量超纯水使沉淀重新溶解并至于透析袋中,在4 ℃条件下,置于蒸馏水中透析脱盐,1 次/h更换蒸馏水。使用饱和BaCl2来检测透析液中是否残留(NH4)2SO4,当透析液中无白色沉淀时,透析结束。经50 kDa超滤管透析好的驼乳组分于4 ℃ 2 500 r/min离心10 min,收集超滤管下层的液体。将超滤后的驼乳组分置于培养皿中,密封并在-80 ℃冷冻24 h以上。将冷冻后的样品置于冷冻干燥机中,-58 ℃冷冻干燥48 h,获得90%~100%组分的冻干蛋白样品。将冻干蛋白进行溶解,使用SDS-PAGE检测。
1.4.1.2 驼乳乳铁蛋白标准品制备
取分离得到的驼乳清组分,使用AKTA蛋白纯化仪进行乳铁蛋白的纯化,选用HiTrapTM Heparin H柱进行分离纯化。进样量1.0 mL,流速2 mL/min;AKTA流动相分别为上样缓冲液A相:0.2 mol/L Na2HPO4溶液;洗脱缓冲液B相:1 mol/L NaCl+0.05 mol/L Na2HPO4溶液构成。收集纯化富集后的乳铁蛋白于透析袋中,置于蒸馏水中透析脱盐,1次/h更换蒸馏水,透析时长为24 h。透析后的乳铁蛋白溶液分置于培养皿中,-80 ℃冷冻过夜。随后将样品置于冷冻干燥机中,-58 ℃冷冻干燥48 h,获得冻干后的驼乳铁蛋白样品,将冻干蛋白溶解使用SDS-PAGE检测。
1.4.2 驼乳功能蛋白含量的测定前处理
将冷冻于-80 ℃冰箱驼乳置于40 ℃水中解冻,涡旋5 min,准确量取10 mL乳样,加入10 mL超纯水,4 ℃ 8 000 r/min离心15 min,去除上层乳脂。使用稀释后的冰乙酸调节乳清pH值至4.6,4 ℃水浴30 min,加速酪蛋白沉淀。随后经4 ℃ 8 000 r/min离心15~20 min,除去乳清中剩余的酪蛋白(一式两份)。将其中一份乳清,使用超纯水定容至50 mL,经0.22 μm水系微孔滤膜过滤后上机分析乳白蛋白含量。同时,将另一份乳清液,使用饱和NaHCO3溶液将乳清调回至原来的pH值,以防止蛋白质在酸性溶液中变性失活,使用AKTA对乳清中的乳铁蛋白进行纯化,收集纯化好的样液,使用0.22 μm水系微孔滤膜过滤后上机分析乳铁蛋白含量。对于驼乳中IgG与溶菌酶含量测定前处理,是将冷冻于-80 ℃冰箱驼乳取出置于4 ℃水中缓慢解冻,涡旋混匀后备用,使用前将驼乳水浴至室温。
1.4.3 色谱条件
1.4.3.1 驼乳α-乳白蛋白色谱条件
使用ACQUITY UPLC Protein BEH C4柱(300 Å,1.7 μm,21 mm×100 mm,1/pkg)色谱柱;流速0.2 mL/min。流动相:A液为0.1%(体积分数)三氟乙酸水,B液为0.1%(体积分数)三氟乙酸乙腈;检测波长214 nm;进样量5 μL;样品温度25 ℃;柱温30 ℃;流动相A的梯度变化为:0~2.08 min(75%~68%),2.08~8.34 min(68%~48%),8.34~10.42 min(48%~75%);流动相B的梯度变化为0~2.08 min(25%~32%),2.08~8.34 min(32%~52%),8.34~10.42 min(52%~25%)。
1.4.3.2 驼乳乳铁蛋白色谱条件
使用ACQUITY UPLC Protein BEH C4柱(300 Å,1.7 μm,21 mm×100 mm,1/pkg)色谱柱;流速0.2 mL/min。流动相:A液为0.1%三氟乙酸水,B液为乙腈;检测波长为280 nm;进样量4 μL;样品温度25 ℃;柱温30 ℃;流动相A的梯度变化为:0~2.08 min(70%~45%),2.08~4.17 min(45%~40%),4.17~5.00 min(40%~70%),5.00~6.67 min(70%);流动相B的梯度变化为0~2.08 min(30%~55%),2.08~4.17 min(55%~60%),4.17~5.00 min(60%~30%),5.00~6.67 min(30%)。
1.4.4 驼乳脂肪酸标准溶液与试样的配制
配制质量浓度为20 g/L NaOH-甲醇溶液,振荡混匀。取20 mg脂肪酸甲酯混标至10 mL容量瓶中,用正庚烷(色谱纯)定容,配制2 mg/mL的混合脂肪酸甲酯标准溶液,置于-80 ℃冰箱密封保存备用。吸取10 mL解冻后的驼乳,加入100 mg焦性没食子酸,依次加入3颗沸石、2 mL的体积分数为95%乙醇,4 mL超纯水及5 mL氨水,置于75 ℃水浴20 min,振荡频率4 min/次。待混匀水解,冷却至室温后加入10 mL体积分数为95%乙醇,混匀后转移至分液漏斗中,使用25 mL石油醚冲洗烧杯,并将冲洗液并入分液漏斗中,充分混匀,静置15 min,收集醚层置于烧瓶中,重复上述步骤3次。设置旋转蒸发仪水温为40 ℃,将石油醚旋蒸至干,烧瓶壁上的半不透明残留物为脂肪的提取物。加入8 mL质量浓度为20 g/L NaOH-甲醇溶液,连接回流冷凝器,设置水浴锅温度为80 ℃,使之充分反应直至油滴消失。加入7 mL的15%三氟化硼甲醇溶液,反应3 min,再加入1 mL超纯水冲洗冷凝管,取出烧瓶,迅速冷却至室温[18]。加入15 mL正庚烷,振荡5 min后转移至25 mL试管中,加入2 mL饱和NaCl溶液,静置15 min。吸取上层澄清透明的正庚烷提取液10 mL,加入8 g Na2SO4,振荡2 min,静置15 min,吸取上层溶液,经0.22 μm有机滤膜过滤至进样瓶中。
1.4.5 气相色谱条件
选择HP-FFAP (50.0 m,0.32 mm ID×0.50 μm)色谱柱,检测器:氢火焰离子检测器(FID);进样器温度270 ℃;检测器温度280 ℃;进样量10 μL;载气N2;分流比1∶0;流速0.2 mL/min;总程序时间95.33 min;升温程序如下:100~180 ℃,速率12 ℃/min,保留时间6.00 min;180~200 ℃,速率3 ℃/min,保留时间20 min;200~230 ℃,速率5 ℃/min,保留时间50 min;230 ℃,速率5 ℃/min,保留时间95.33 min。
1.4.6 气相色谱-质谱条件
使用GC-MS对标准品进行检测与验证,条件为:电子轰击(EI)电离源;色谱柱:DB-5MS柱(30 m×0.25 mm×0.25 μm)。色谱条件:进样口温度280 ℃;进样量1.0 μL,不分流进样;程序升温:60 ℃(5 min)以2 ℃/min升至280 ℃(10 min),20 ℃/min升温至300 ℃(53 min);载气He,流速1.0 mL/min。质谱条件:电离方式,电子轰击源,电离能量70 eV。离子源温度230 ℃,四级杆温度150 ℃,接口温度280 ℃。扫描方式全扫描,扫描范围20~500 amu,扫描时间0.45 s,溶剂延迟3 min[19]。
1.4.7 数据处理
对驼乳样品重复检测3次。所测数据均采用均值±标准差来表示。采用SPSS 25.0对数据进行统计分析,并使用R语言作图分析,以P<0.05作为统计学显著性差异标准。
2 结果与分析
2.1 驼乳α-乳白蛋白和乳铁蛋白标准品电泳
驼源性α-乳白蛋白分子质量约为14 kDa,乳铁蛋白分子质量约为80 kDa。如SDS-PAGE结果所示(图1),制备的α-乳白蛋白与乳铁蛋白14 kDa和80 kDa预期位置处具有明显的条带,且纯度较高,可作为后续研究的蛋白标准品。
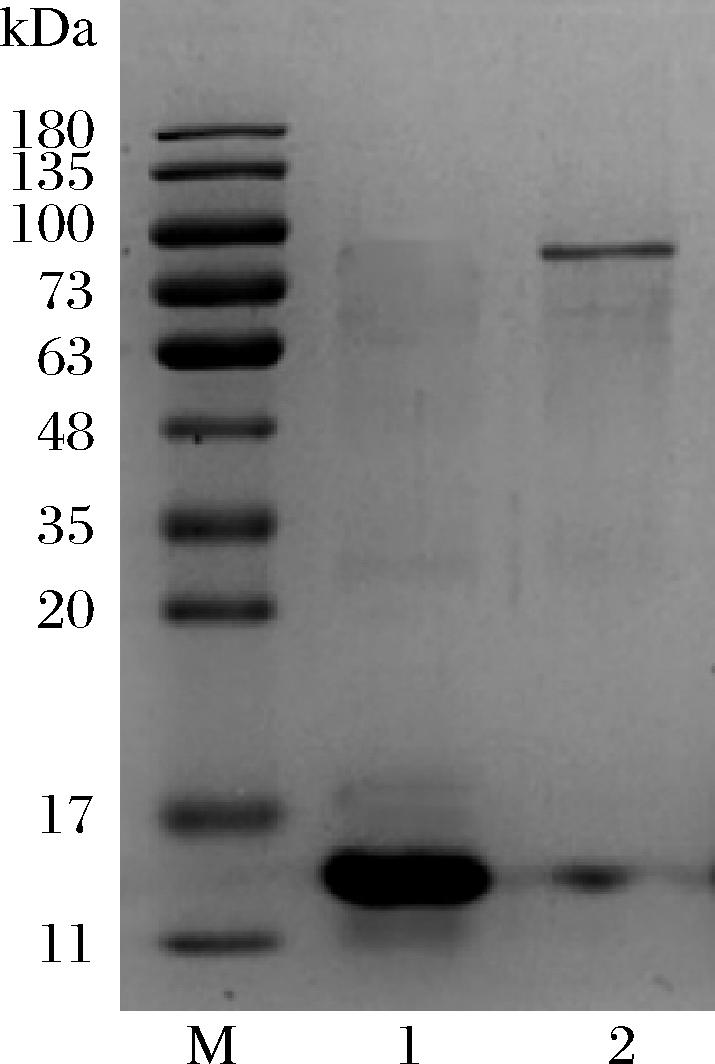
图1 骆驼乳α-乳白蛋白与乳铁蛋白SDS-PAGE
Fig.1 SDS-PAGE analysis of α-lactalbumin and lactoferrin from camel milk
注:M-Marker;1-α-乳白蛋白;2-乳铁蛋白。
2.2 驼乳α-乳白蛋白、乳铁蛋白和IgG功能蛋白的标准曲线
驼源α-乳白蛋白对照品色谱图如图2-a所示,出峰时间为6.373 min;驼源乳铁蛋白对照品色谱图如图2-b所示,出峰时间为3.763 min。色谱峰峰型均呈对称性且无明显拖尾。分别配制质量浓度200、400、600、800、1 000 mg/L的α-乳白蛋白,上机检测,绘制α-乳白蛋白的标准曲线,如图2-c所示,计算出对应的回归方程:y=15 868x+888 315(R2=0.998 9,线性范围200~1 000 mg/L)。分别配制质量浓度25、50、100、200、1 000 mg/L的乳铁蛋白溶液,上机检测,绘制乳铁蛋白的标准曲线。如图2-d所示,得到对应回归方程:y=190.86x-2 122.2(R2=0.998 3,线性范围25~1 000 mg/L)。在450 nm波长下,检测质量浓度15、25、75、125、250、500 μg/L的IgG的OD值,绘制IgG的标准曲线,如图2-e所示,回归方程为y=0.002 5x+0.083 4(R2=0.999 9,线性范围25~500 mg/L)。
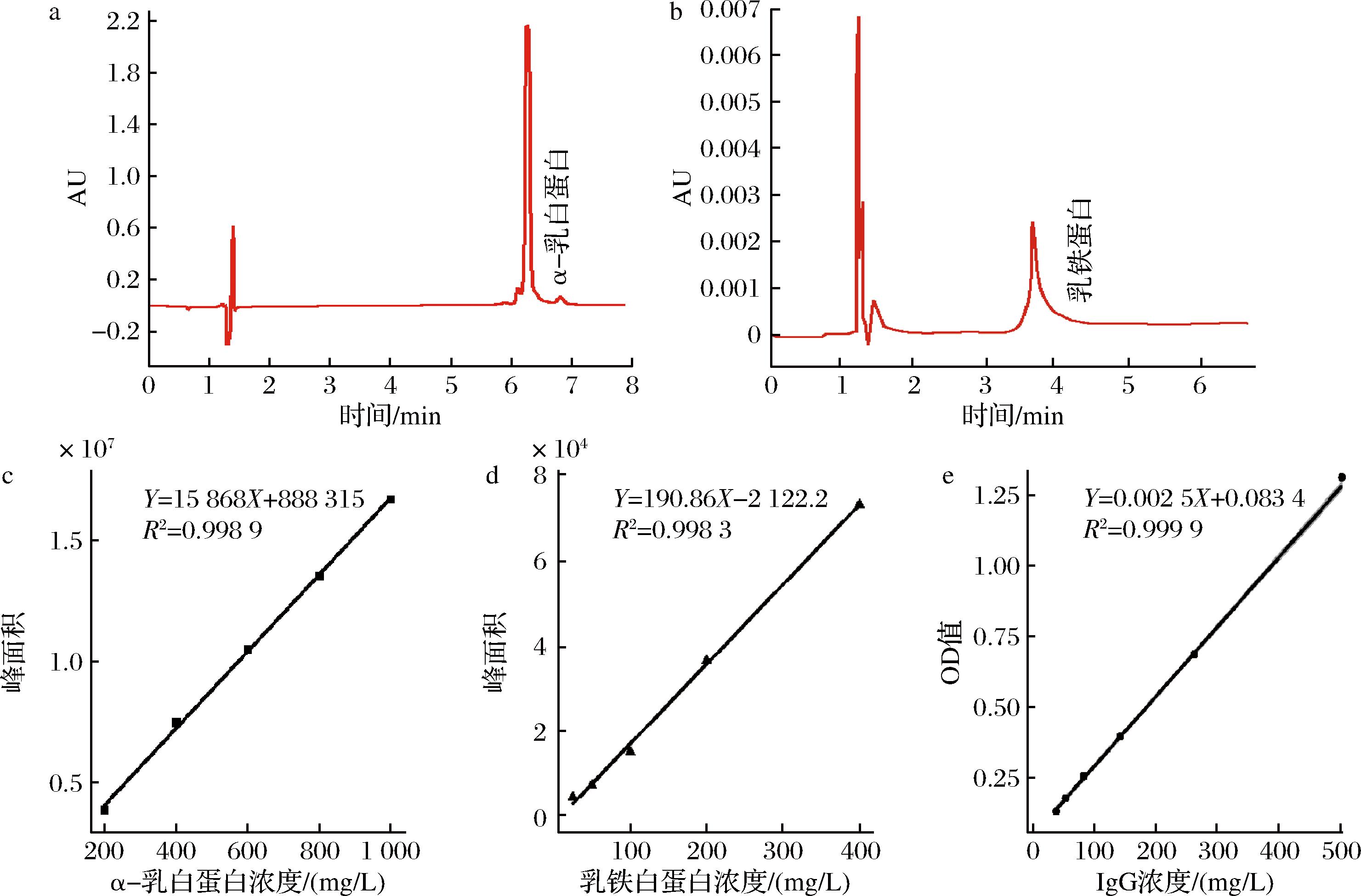
a-α-乳白蛋白对照品色谱图;b-乳铁蛋白对照品色谱图;c-α-乳白蛋白标准曲线;d-乳铁蛋白标准曲线;e-IgG标准曲线
图2 功能蛋白色谱图及标准曲线
Fig.2 Functional protein chromatogram and standard curve
2.3 驼乳脂肪酸甲酯标准品的气相色谱图
使用气相色谱分离出脂肪酸甲酯混和标准品中的34 种脂肪酸甲酯,如色谱图(图3)所示,以运行时间为横坐标,以信号值为纵坐标,运行总时间为95.33 min。结果表明,各脂肪酸甲酯出峰较好、峰纯度高、无杂峰,可进行后续试验。
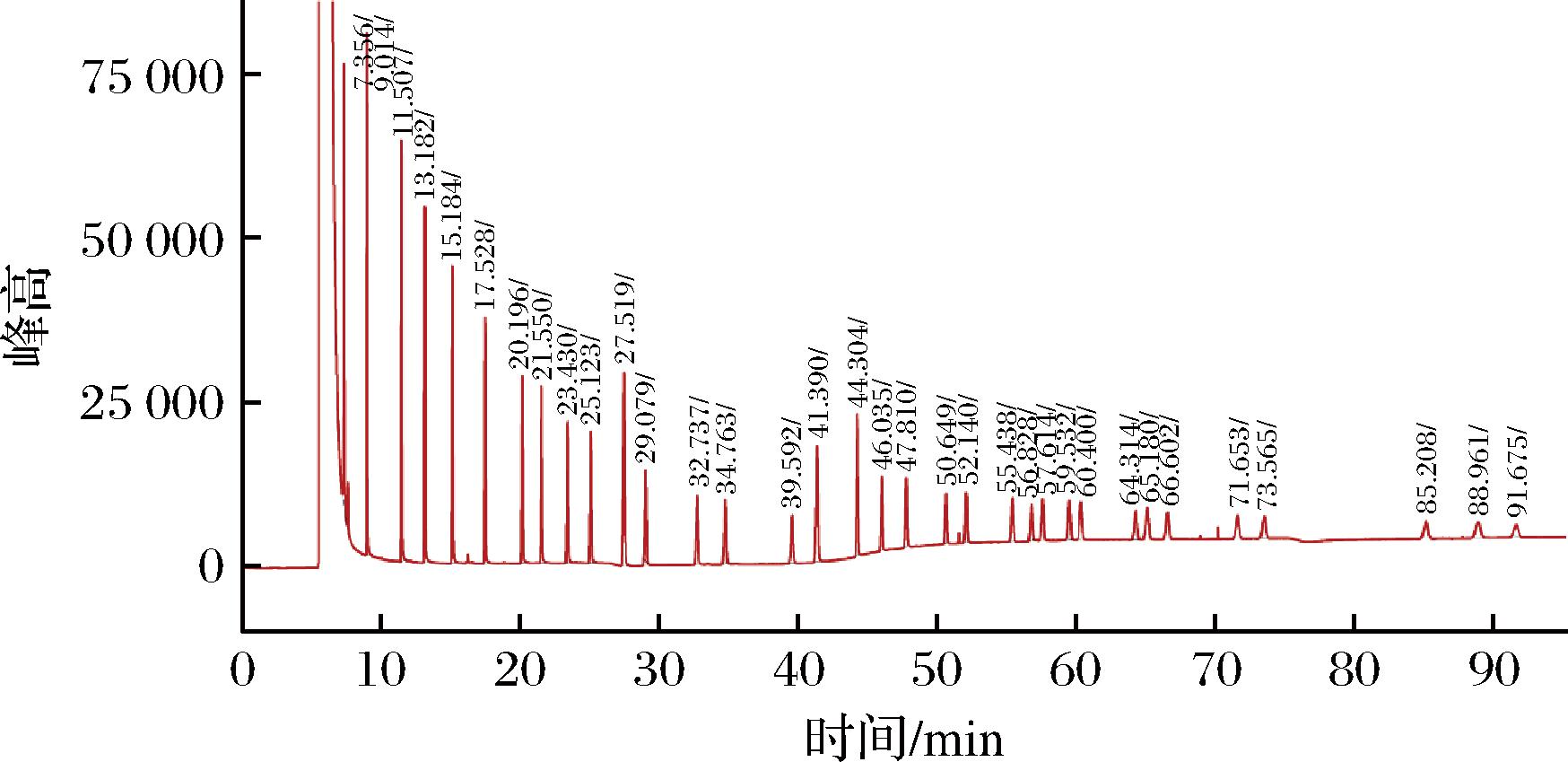
图3 混合脂肪酸甲酯标准溶液的气相色谱图
Fig.3 Gas chromatogram of a standard solution of mixed fatty acid methyl ester
2.4 双峰驼泌乳期内乳α-乳白蛋白、乳铁蛋白、IgG和溶菌酶变化分析
泌乳期内动态追踪20峰泌乳驼,驼初乳中α-乳白蛋白、乳铁蛋白、IgG、溶菌酶4 种功能蛋白含量分别为(6.76±1.80) g/L、(0.91±0.62) g/L、(3.05±0.88) mg/mL及(0.49±0.37) μg/mL均极显著高于常乳期(2.79±0.72) g/L、(0.6±0.54) g/L、(1.24±0.36) mg/mL及(0.24±0.23) μg/mL(P<0.01),并且常乳期中前期功能蛋白变化趋势小,中后期功能蛋白含量变化幅度明显,总体呈现波动递减(图4-b),推测其变化与仔驼生长过程中不同时间点的身体机能免疫需求密切相关。其中,α-乳白蛋白的含量处于1.14~10.97 g/L区间;泌乳第1天,驼乳中α-乳白蛋白含量最高为(10.97±0.24) g/L,随着泌乳天数的增加,α-乳白蛋白整体呈现下降趋势,与MERIN等[20]对单峰驼的报道结果相符。在泌乳的第330天含量最低为(1.14±0.14) g/L;其中处于90~240 d时,驼乳中α-乳白蛋白相对稳定,含量在3.36 g/L,随后逐渐降低。α-乳白蛋白约为乳铁蛋白的6.7倍,驼乳中乳铁蛋白的含量在0.20~2.26 g/L,当母驼泌乳第2天,驼乳中乳铁蛋白含量最高为(2.26±0.04) g/L,随着泌乳天数的增加,乳铁蛋白呈先下降后上升的趋势,总体而言,初乳期的驼乳中的乳铁蛋白的含量显著高于常乳期。整个泌乳期内免疫球蛋白IgG的含量为0.53~4.66 mg/mL。初乳期IgG的含量很高,泌乳第1天时最高为(4.46±0.20) mg/mL,随后逐渐降低,是由于泌乳过程中催乳素含量的增加使得乳腺上皮细胞上IgG1特异性受体失活,下调了免疫球蛋白IgG的转移所致[21];在30~90 d波动较大,可能是由于分娩后母驼的正常消化和代谢功能逐渐恢复;在270~330 d大幅波动,可能是由于泌乳末期双峰驼泌乳功能逐渐衰退。溶菌酶的含量处于0.08~1.16 μg/mL,泌乳第1天溶菌酶含量最高为(1.16±0.01) μg/mL,随着泌乳天数的增加溶菌酶整体呈现下降趋势,150 d后趋于稳定。初乳期以及泌乳前期的溶菌酶含量显著高于泌乳中后期。综上结果表明,初乳期α-乳白蛋白、乳铁蛋白、IgG及溶菌酶含量均高于常乳期,并伴随常乳期泌乳天数的增加,4种功能性蛋白质的含量逐渐下降并趋于稳定,这与大多数哺乳动物变化趋势一致[21-22],由于新生幼犊免疫及消化系统发育不全,免疫功能不足以抵抗外界侵扰,初乳中免疫功能蛋白含量高,能增强仔驼免疫力并促进生长。
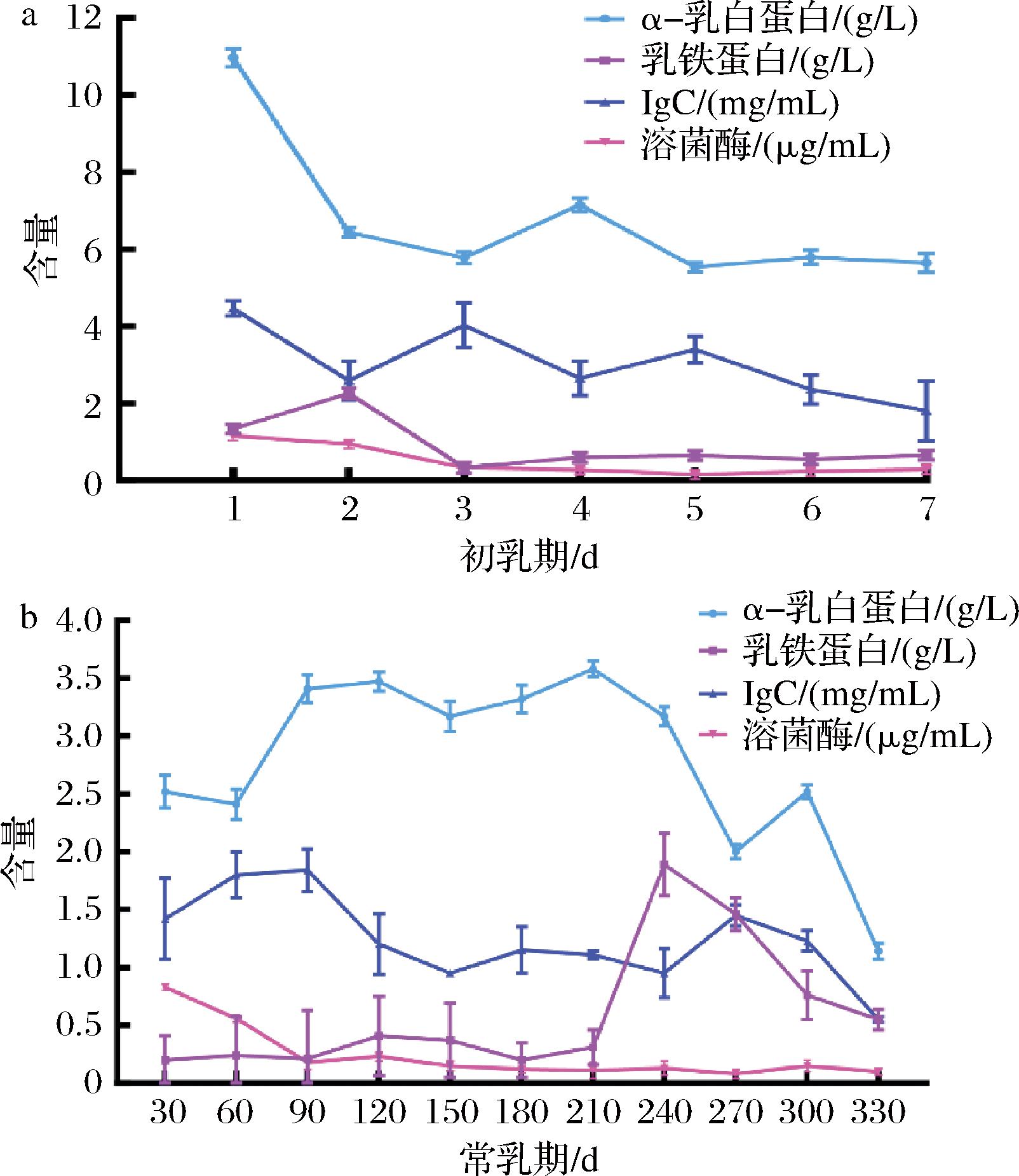
a-初乳期;b-常乳期
图4 泌乳期内驼乳中α-乳白蛋白、乳铁蛋白、IgG和溶菌酶变化
Fig.4 α-Lactalbumin, lactoferrin, IgG, and lysozyme content composition of Bactrian camel milk at different lactation periods
2.5 双峰驼泌乳期内乳α-乳白蛋白、乳铁蛋白、IgG和溶菌酶相关性分析
对泌乳期内驼乳中α-乳白蛋白、乳铁蛋白、IgG及溶菌酶4种功能蛋白进行相关性分析(图5)。结果表明,这些功能蛋白之间具有显著相关性(P<0.05)。其中α-乳白蛋白与IgG具有强正相关(P<0.05,相关系数0.85);溶菌酶与α-乳白蛋白(P<0.05,相关系数0.59)、溶菌酶与和IgG(P<0.05,相关系数0.54)均呈中等强度正相关;乳铁蛋白分别与溶菌酶(P<0.05,相关系数0.33)、α-乳白蛋白(P<0.05,相关系数0.30)和IgG(P<0.05,相关系数0.17)间具有弱正相关。结果表明这4种功能蛋白间具有一定的协同作用,为幼驼生长发育提供一种非特异性的防御机制。
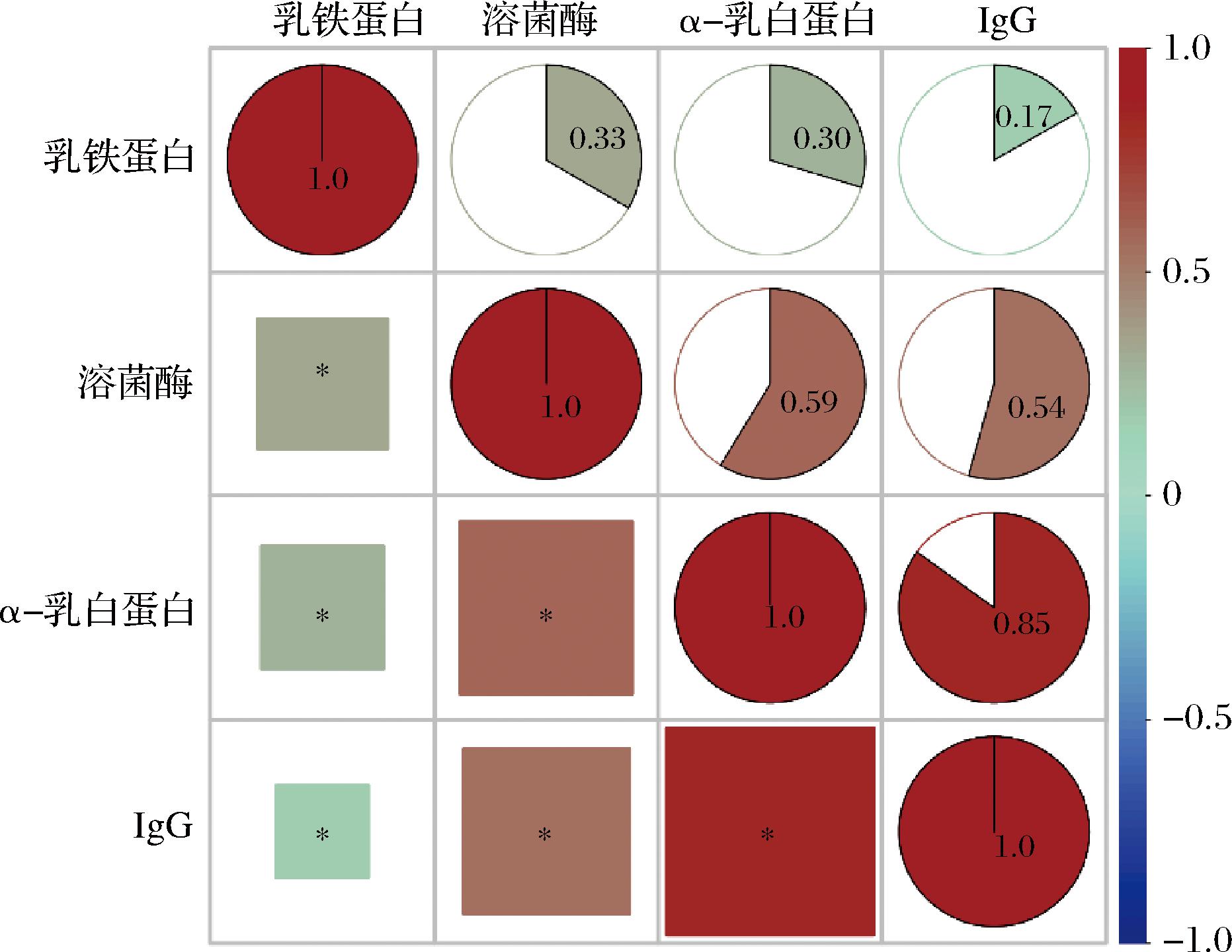
图5 泌乳期内驼乳中α-乳白蛋白、乳铁蛋白、IgG和溶菌酶相关性分析
Fig.5 Correlation analysis between α-lactalbumin, lactoferrin, IgG and lysozyme content composition of Bactrian camel milk at lactation periods
2.6 双峰驼泌乳期内乳脂肪酸质量分数变化分析
使用气相色谱对双峰驼初乳期和常乳期的驼乳中脂肪酸含量进行检测,共检测出32种常规脂肪酸。对不同泌乳阶段脂肪酸质量分数变化进行展示分析(图6),驼乳中脂肪酸含量变化主要集中在初乳期4~7 d与常乳期90~150 d期间,母驼妊娠后开始泌乳哺育幼驼,初乳期4~7 d机体逐渐恢复,初乳期过后脂肪酸含量变化不大,乳腺泌乳逐渐恢复及身体脂肪和激素动员的变化,以满足维持和哺乳需求;而在常乳期90~150 d期间,伴随着季节及饲草转换,母驼产奶量达到高峰期,机体随之改变,因而造成脂肪酸含量一定程度变化,整体看泌乳期间脂肪酸含量变化不大。与伊丽等[23]报道的驼乳脂肪酸质量分数伴随季节而变化结果不同,原因在于其采集样本驼处于自然放牧状态,不同季节采食植物种类不同造成营养差异对奶中脂肪酸组成与含量具有重要影响[24]。分别以饱和脂肪酸(saturated fatty acid,SFA)、不饱和脂肪酸(unsaturated fatty acid,UFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)、多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)、短链脂肪酸(short chain fatty acid,SCFA)、中链脂肪酸(medium chain fatty acid,MCFA)及长链脂肪酸(longchain fatty acid,LCFA)为类别进行分析(图7)。SFA占总脂肪酸含量的56.06%~83.84%,质量分数最高;在UFA中,MUFA含量相对较高。本次试验未检测出SCFA,MCFA质量分数最高,占总脂肪酸含量的95.3%~99.3%。这是由于妊娠后母驼处于能量负平衡状态,机体将储备的营养物质用于乳汁合成,增加体脂分解,释放以长链脂肪酸为主的脂肪酸用于乳腺或肝脏代谢[25]。UFA占总脂肪酸含量的25.1%~44.1%;LCFA、PUFA与MCFA在初乳期和常乳期均含量均较为稳定;SFA与UFA在初乳期3~7 d内较为变化明显,在泌乳高峰期90~150 d波动较为明显,但变化不显著(P>0.05),其余时期变化不大。初乳期UFA含量较高,对人体健康更为有益。此外,选取的样本驼为半集约化人工养殖,养殖条件及饲草纤维素的质量水平基本一致,因此使乳脂肪酸质量分数保持在一定水平,变化幅度小。先前研究表明,骆驼乳脂肪酸的组成受环境、饲养条件和饲料成分等多种因素的影响[23, 26],以上结果进一步验证了准噶尔双峰骆驼乳脂肪酸的组成受饲养条件及饲草组成的影响。
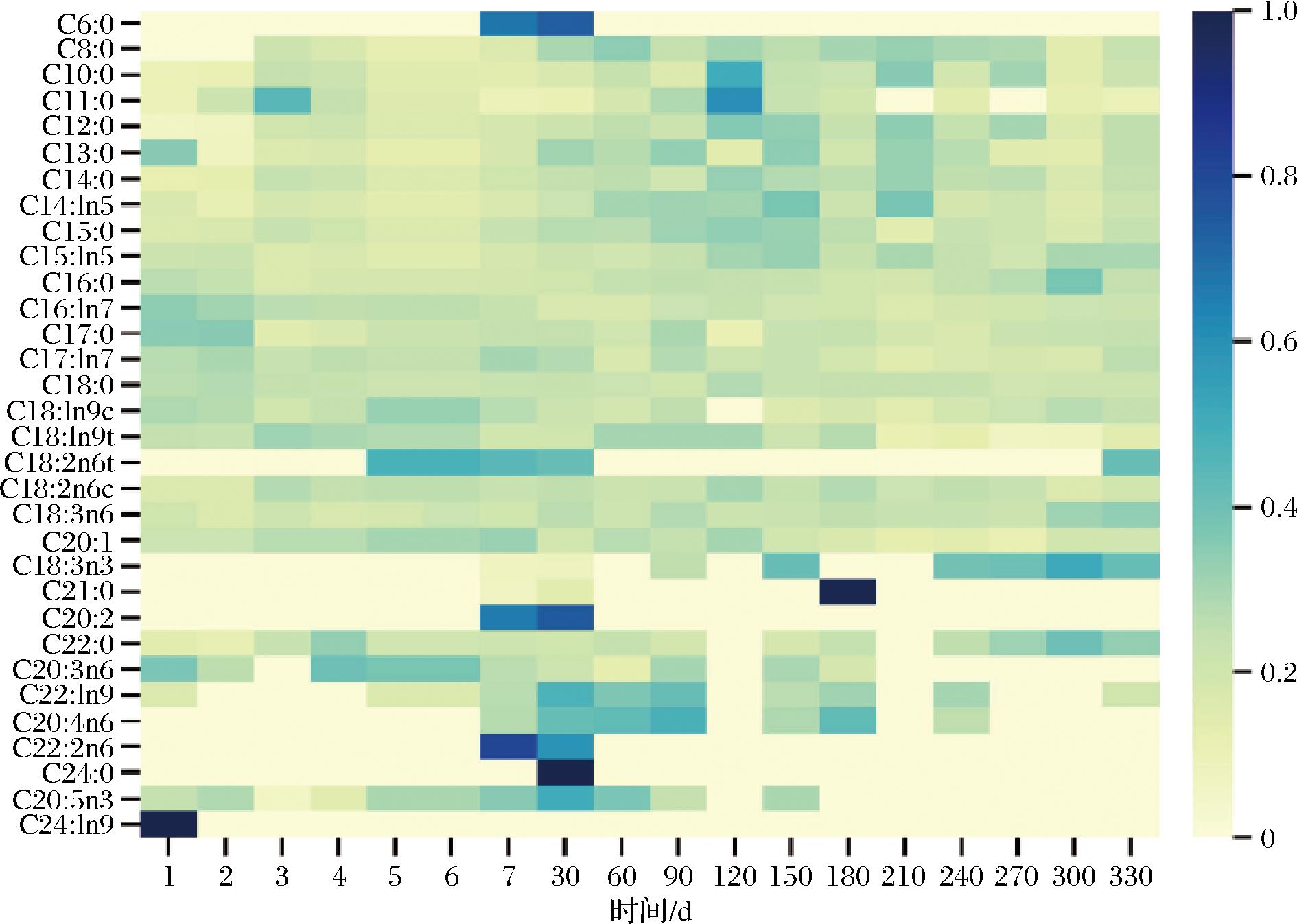
图6 泌乳期内脂肪酸含量的变化
Fig.6 Heat maps of fatty acid content during lactation

a-初乳期;b-常乳期
图7 泌乳期内不同类别脂肪酸变化
Fig.7 Dynamic changes of different fatty acids during lactation
此外,驼乳中最主要的饱和脂肪酸是C14∶0、C16∶0 和C18∶0,其中C18∶0对人体健康有中性的影响,而C14∶0和C16∶0则对人体有害,与人体低密度脂蛋白浓度相关,而低密度脂蛋白是造成动脉粥样硬化的因素之一。驼乳中的中链脂肪酸水平也更高,MCFA比LCFA更容易消化和代谢。作为特殊的反刍动物,双峰驼通过发酵纤维素产生SCFA,而驼乳中的浓度低于其他物种,是由于SCFA在进入乳中之前进行快速代谢,与母驼激素水平变化相关。初乳期LCFA含量较高,随着泌乳天数的增加含量降低,可能与母驼在分娩前胰岛素敏感较低,分娩后对胰岛素敏感性逐渐恢复[27]有关。初乳期高含量MUFA对幼崽髓鞘的形成与大脑发育起关键作用[28-29]。母驼分娩后产生代偿性高胰岛素血症,高水平胰岛素促进了肝脏脂肪合成,与MUFA的合成相关,因此初乳期MUFA含量也较高[30-31]。双峰驼的MUFA质量分数稍高于其他哺乳动物可能是由于双峰驼后肠发酵较为缓慢或脂肪酸去饱和酶活性较强所致[32]。此外,也有研究指出乳中的MUFA和UFA的变化也与母体能量状态有关[33]。PUFA随着母驼哺乳期的延长含量略有降低,与牧草中含量及动物吸收能力相关。
2.7 双峰驼泌乳期内乳脂肪酸含量相关性分析
乳制品可为人体提供所需15%~25%的脂肪酸及25%~35%的饱和脂肪酸。不饱和脂防酸具有降低胆固醇的作用,所以其质量分数越高越好。因此,脂防酸的比例是评估乳的营养价值的重要指标之一。哺乳期驼乳的脂肪酸组成和含量主要受饲草营养水平、乳腺的从头合成及瘤胃微生物组活性等诸多因素决定。与牛乳相比,驼乳脂肪酸的分布和含量更为合理[34]。对泌乳期驼乳中的32种脂肪酸进行相关性分析(图8)。多数脂肪酸间具有显著负相关(P<0.05),其中SFA与MUFA的负相关性极强,少数脂肪酸间具有显著正相关,尤其MCFA和LCF之间具有显著正相关,这与泌乳期前90 d的阿拉善双峰驼23种脂肪酸相关性结果相符[9]。在显著相关的脂肪酸分析结果中,已酸甲酯C6∶0与二十碳二烯酸乙酯C20∶2,二十二碳二烯酸C22∶2n6与二十碳二烯酸乙酯C20∶2和已酸甲酯C6∶0,十二碳酸乙酯C12∶0与乙酸癸酯C10∶0,肉豆蔻酸C14∶0与乙酸癸酯C10∶0和十二碳酸乙酯C12∶0,肉豆寇油酸C14∶1n5与肉豆蔻酸C14∶0和十二碳酸乙酯C12∶0,正辛酸甲酯C8∶0与肉豆蔻酸C14∶0和肉豆寇油酸C14∶1n5,花生四烯酸甲酯C20∶4n6与顺芥子酸甲酯C22∶1n9间具有较强正相关性(P<0.05,相关系数≥0.8)。乙酸癸酯C10∶0与顺-9-十八碳一烯酸甲酯C18∶1n9c,十二碳酸乙酯C12∶0与顺-9-十八碳一烯酸甲酯C18∶1n9c和棕榈油酸C16∶1n7,肉豆蔻酸C14∶0与顺-9-十八碳一烯酸甲酯C18∶1n9c和棕榈油酸C16∶1n7,正辛酸甲酯C8∶0与顺-9-十八碳一烯酸甲酯C18∶1n9c间具有较强负相关(P<0.05,相关系数≤-0.8)。驼乳中不同的脂肪酸组成及含量维持在一定比例,能够保持机体健康状态[32]。
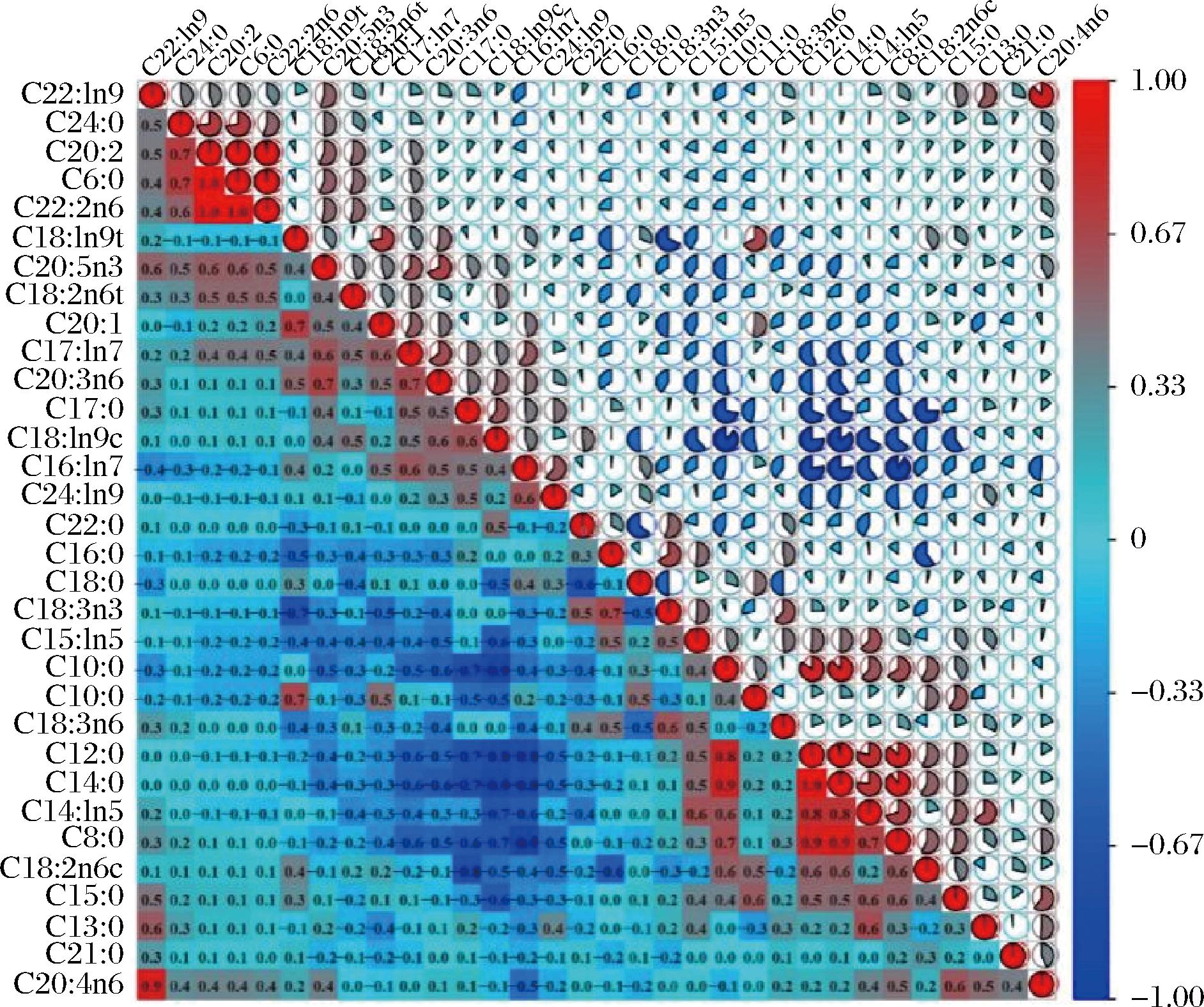
图8 泌乳期内脂肪酸含量间相关性分析
Fig.8 Correlation analysis between fatty acid content of Bactrian camel milk at lactation periods
3 结论与讨论
本研究建立了驼乳中4 种功能蛋白及脂肪酸超高效液相色谱检测方法,对准噶尔双峰驼在泌乳期330 d的驼乳α-乳白蛋白、乳铁蛋白、IgG及溶菌酶及脂肪酸含量进行检测以探究其变化规律。在驼乳中检测出32 种脂肪酸,种类多于先前的研究报道,但主要组成基本一致[9, 35-36]。与其他乳用家畜一致,泌乳驼初乳期的α-乳白蛋白、乳铁蛋白、IgG及溶菌酶的含量显著高于常乳期,归因于新生仔畜免疫系统与消化系统发育尚不完善,合成免疫物质的能力不足难以抵抗外界侵扰,初乳中的免疫蛋白在新生幼犊免疫系统的保护和成熟过程中发挥着重要作用[22, 37]。伴随常乳期泌乳天数的增加,4 种功能性蛋白质的含量逐渐下降。总体而言,初乳期及常乳期驼乳中功能蛋白与脂肪酸的组成及含量具有一定差异。对4 种功能蛋白进行相关性分析,发现它们间具有一定的协同作用,是幼驼生长发育的重要防御机制。此外,准噶尔双峰驼乳动脉粥样硬化指数低于牛乳,乳中不饱和脂肪酸与饱和脂肪酸比例合理,营养成分与人乳相似且具有低致敏性,营养均衡更有利于人类健康[23]。因此,加强对骆驼乳及其乳制品营养资源的开发利用,尤其是在医疗保健价值方面。本研究为新疆双峰驼的泌乳生理学及功能性驼乳制品的开发提供科学参考。
[1] FARAZ A.Composition of camel milk:A blessing for health[J].Ann Public Health Epidemiol, 2020, 1:1-4.
[2] UVERSKY V N, EL-FAKHARANY E M, ABU-SERIE M M, et al.Divergent anticancer activity of free and formulated camel milk α-lactalbumin[J].Cancer Investigation, 2017, 35(9):610-623.
[3] 李梦雨, 伊丽, 吉日木图.驼乳源乳铁蛋白嵌合肽对口腔致龋菌抗菌作用的初步探究[J].食品与发酵工业, 2023, 49(2):54-62.
LI M Y, YI L, JI R.Mechanism by LFA-LFC chimeric peptide on oral cariogenic bacteria[J].Food and Fermentation Industries, 2023, 49(2):54-62.
[4] 徐班萌, 梁新红, 李波, 等.乳铁蛋白、EGCG和低甲酯果胶三元凝聚体稳定的高内相Pickering乳液构建[J].食品科学, 2023, 44(10):82-89.
XU B M, LIANG X H, LI B, et al.High internal phase Pickering emulsions stabilised with the ternary aggregates of lactoferrin, EGCG and low methoxylated pectin[J].Food Science, 2023, 44(10):82-89.
[5] 张和平, 郭军.乳中特异性免疫球蛋白(IgG乳抗体)的开发及应用[J].乳业科学与技术, 2004, 27(3):106-110.
ZHANG H P, GUO J.Development and application of IgG in bovine milk[J].Journal of Dairy Science and Technology, 2004, 27(3):106-110.
[6] CHAMEKH L, CALVO M, KHORCHANI T, et al.Impact of management system and lactation stage on fatty acid composition of camel milk[J].Journal of Food Composition and Analysis, 2020, 87:103418-103426.
[7] 古丽巴哈尔·卡吾力, 高晓黎, 常占瑛, 等.马乳与驼乳、驴乳、牛乳基本理化性质及组成比较[J].食品科技, 2017, 42(7):123-127.
GULIBAHAR K, GAO X L, CHANG Z Y, et al.Comparative the basic properties and composition of mare’s milk and camel milk, donkey milk, milk[J].Food Science and Technology, 2017, 42(7):123-127.
[8] 杨惠茹, 郭军, 古斯愣图, 等.六种家畜乳氨基酸特征聚类分析[J].食品与发酵工业, 2022, 48(6):233-240.
YANG H R, GUO J, GUSILENGTU, et al.Cluster analysis on amino acid properties of six livestock milk[J].Food and Fermentation Industries, 2022, 48(6):233-240.
[9] XIAO Y C, YI L, MING L, et al.Changes in milk components, amino acids, and fatty acids of Bactrian camels in different lactation periods[J].International Dairy Journal, 2022, 131:105363.
[10] 马宇轩, 郄梦洁, 赵姗姗, 等.不同牧场及饲养方式下阿拉善双峰驼乳脂肪酸特征及产地溯源研究[J].核农学报, 2022, 36(10):1964-1974.
MA Y X, QIE M J, ZHAO S S, et al.Fatty acid characteristics and origin traceability of Alxa Bactrian camel milk in different pastures and feeding methods[J].Journal of Nuclear Agricultural Sciences, 2022, 36(10):1964-1974.
[11] ALI W, AKYOL E, CEYHAN A, et al.Milk production and composition in camel and its beneficial uses:A review[J].Turkish Journal of Agriculture—Food Science and Technology, 2019, 7(12):2142-2147.
[12] ATIGUI M, KHORCHANI M.Effects of oestrus on milk yield and composition in Tunisian Maghrebi camels (Camelus dromedarius)[J].Emirates Journal of Food and Agriculture, 2013, 25(4):291-295.
[13] ABDALLA E B, ANIS ASHMAWY A E H, FAROUK M H, et al.Milk production potential in Maghrebi she-camels[J].Small Ruminant Research, 2015, 123(1):129-135.
[14] NAGY P, F BRI Z N, VARGA L, et al.Effect of genetic and nongenetic factors on chemical composition of individual milk samples from dromedary camels (Camelus dromedarius) under intensive management[J].Journal of Dairy Science, 2017, 100(11):8680-8693.
BRI Z N, VARGA L, et al.Effect of genetic and nongenetic factors on chemical composition of individual milk samples from dromedary camels (Camelus dromedarius) under intensive management[J].Journal of Dairy Science, 2017, 100(11):8680-8693.
[15] MOHAMED E, ATTI K A, MUSTAFA A, et al.Milk composition of the udder quarters of she-camel (Camelus dromedaries) raised under intensive farming system[J].Agricultural and Food Sciences, 2017.
[16] MUSAAD A, FAYE B, ABU NIKHELA A.Lactation curves of dairy camels in an intensive system[J].Tropical Animal Health and Production, 2013, 45(4):1039-1046.
[17] ATIGUI M, HAMMADI M, BARMAT A, et al.First description of milk flow traits in Tunisian dairy dromedary camels under an intensive farming system[J].The Journal of Dairy Research, 2014, 81(2):173-182.
[18] 池源, 刘玉玲, 孙辉, 等.基于气相色谱法构建葡萄籽油脂肪酸指纹图谱[J].食品安全质量检测学报, 2018, 9(9):2020-2025.
CHI Y, LIU Y L, SUN H, et al.Establishment of fatty acid fingerprint of grape seed oil based on gas chromatography[J].Journal of Food Safety &Quality, 2018, 9(9):2020-2025.
[19] 张宇, 王立娜, 张宏达, 等.母乳、牛乳及山羊乳脂肪酸组成的差异分析[J].食品工业科技, 2019, 40(4):21-26.
ZHANG Y, WANG L N, ZHANG H D, et al.Difference analysis of fatty acid composition of breast milk, bovine milk and goat milk[J].Science and Technology of Food Industry, 2019, 40(4):21-26.
[20] MERIN U, BERNSTEIN S, BLOCH-DAMTI A, et al.A comparative study of milk serum proteins in camel (Camelus dromedarius) and bovine colostrum[J].Livestock Production Science, 2001, 67(3):297-301.
[21] MÖßLER M, RYCHLI K, REICHMANN V M, et al.Immunoglobulin G concentrations in alpaca colostrum during the first four days after parturition[J].Animals:an Open Access Journal from MDPI, 2022, 12(2):167.
[22] ERKILIÇ E E, ERDO AN H M.Relationship among some colostral immune parameters and hepcidin in neonatal calves[J].Journal of Advances in VetBio Science and Techniques, 2019, 4(2):51-58.
AN H M.Relationship among some colostral immune parameters and hepcidin in neonatal calves[J].Journal of Advances in VetBio Science and Techniques, 2019, 4(2):51-58.
[23] 伊丽, 特木伦, 郑志强, 等.准格尔双峰驼驼乳脂肪酸组成的季节变化[J].中国乳品工业, 2014, 42(3):18-21.
YI L, TEMUULEEN, ZHENG Z Q, et al.Study on seasonal variation of fatty acid composition of Bactrain Camel’s milk in Zhunger[J].China Dairy Industry, 2014, 42(3):18-21.
[24] 陈美庆, 张养东, 郑楠, 等.牛奶中脂肪酸的合成机理及影响因素研究进展[J].动物营养学报, 2021, 33(8):4244-4254.
CHEN M Q, ZHANG Y D, ZHENG N, et al.Advance in synthesis mechanism and influencing factors of milk fatty acids[J].Chinese Journal of Animal Nutrition, 2021, 33(8):4244-4254.
[25] ROCHE J R, FRIGGENS N C, KAY J K, et al.Invited review: Body condition score and its association with dairy cow productivity, health, and welfare[J].Journal of Dairy Science, 2009, 92(12):5769-5801.
[26] 杨晋辉, 周凌云, 张军民, 等.乳脂肪酸及其影响因素的研究进展[J].中国畜牧兽医, 2011, 38(11):23-27.
YANG J H, ZHOU L Y, ZHANG J M, et al.Milk fatty acids and its influencing factors[J].China Animal Husbandry &Veterinary Medicine, 2011, 38(11):23-27.
[27] KUIPERS R S, LUXWOLDA M F, JANNEKE DIJCK-BROUWER D A, et al.Differences in preterm and term milk fatty acid compositions may be caused by the different hormonal milieu of early parturition[J].Prostaglandins, Leukotrienes and Essential Fatty Acids, 2011, 85(6):369-379.
[28] 周锦, 荣爽, 王瑛瑶, 等.我国不同泌乳期母乳的脂肪酸构成特征研究[J].食品工业科技, 2020, 41(19):251-259;265.
ZHOU J, RONG S, WANG Y Y, et al.Fatty acid composition of breast milk during different lactation stages in China[J].Science and Technology of Food Industry, 2020, 41(19):251-259;265.
[29] DELPLANQUE B, GIBSON R, KOLETZKO B, et al.Lipid quality in infant nutrition:Current knowledge and future opportunities[J].Journal of Pediatric Gastroenterology and Nutrition, 2015, 61(1):8-17.
[30] MASSOURAS T, TRIANTAPHYLLOPOULOS K A, THEODOSSIOU I.Chemical composition, protein fraction and fatty acid profile of donkey milk during lactation[J].International Dairy Journal, 2017, 75:83-90.
[31] 李磊, 王昆, 何静, 等.驼、牛、羊乳中脂肪酸含量的比较分析[J].食品科学, 2019, 40(6):223-227.
LI L, WANG K, HE J, et al.A comparative analysis of fatty acid profiles of camel, bovine and caprine milk[J].Food Science, 2019, 40(6):223-227.
[32] SWELUM A A, EL-SAADONY M T, ABDO M, et al.Nutritional, antimicrobial and medicinal properties of Camel’s milk:A review[J].Saudi Journal of Biological Sciences, 2021, 28(5):3126-3136.
[33] SAMKOV E,
E, 
 TEK J, BRZ
TEK J, BRZ KOV
KOV M, et al.Associations among farm, breed, lactation stage and parity, gene polymorphisms and the fatty acid profile of milk from Holstein, Simmental and their crosses[J].Animals:an Open Access Journal from MDPI, 2021, 11(11):3284-3298.
M, et al.Associations among farm, breed, lactation stage and parity, gene polymorphisms and the fatty acid profile of milk from Holstein, Simmental and their crosses[J].Animals:an Open Access Journal from MDPI, 2021, 11(11):3284-3298.
[34] BAKRY I A, YANG L, FARAG M A, et al.A comprehensive review of the composition, nutritional value, and functional properties of camel milk fat[J].Foods, 2021, 10(9):2158-2184.
[35] KONUSPAYEVA G, LEMARIE É, FAYE B, et al.Fatty acid and cholesterol composition of camel’s (Camelus bactrianus, Camelus dromedarius and hybrids) milk in Kazakhstan[J].Dairy Science &Technology, 2008, 88(3):327-340.
[36] 刘雨佳, 叶乐, 鲍志英, 等.双峰驼乳营养成分测定与特征分析[J].食品与发酵工业, 2023, 49(2):251-256.
LIU Y J, YE L, BAO Z Y, et al.Determination and analysis of characteristics of nutritional composition in Bactrian camel milk[J].Food and Fermentation Industries, 2023, 49(2):251-256.
[37] S NCHEZ-MAC
NCHEZ-MAC AS D, MORENO-INDIAS I, CASTRO N, et al.From goat colostrum to milk:Physical, chemical, and immune evolution from partum to 90 days postpartum[J].Journal of Dairy Science, 2014, 97(1):10-16.
AS D, MORENO-INDIAS I, CASTRO N, et al.From goat colostrum to milk:Physical, chemical, and immune evolution from partum to 90 days postpartum[J].Journal of Dairy Science, 2014, 97(1):10-16.