羊乳具有易消化、低致敏的特点,常被加工为配方奶粉。近年来,随着羊乳相关研究的深入,我国羊乳产业也迅速发展[1-2]。酪蛋白是羊乳中主要的蛋白组分,含量占总蛋白的70%,包含β-、αs1-、αs2-和κ-酪蛋白,比例依次为55%、6%、19%和20%[3]。αs-和β-酪蛋白是高度磷酸化的蛋白,可结合大量的Ca2+,使得山羊乳的钙含量约高达134 mg/mL[4]。因此,酪蛋白除了能提供人体所需要的氨基酸,还可以协助提供Ca2+。相比易于消化的乳清蛋白,食用酪蛋白能为婴儿提供一定的饱腹感。
乳中的酪蛋白主要以胶束的形式存在,还有少部分在乳清中以游离的形式存在。在胶束结构中,αs-和β-酪蛋白主要位于胶束内部,通过与胶体磷酸钙相连接,形成胶束的骨架,而κ-酪蛋白位于胶束的表面,呈现柔韧的“毛发”,阻碍胶束之间的聚集。维持胶束结构的主要作用力是酪蛋白之间的疏水作用、以及酪蛋白磷酸丝氨酸与胶体磷酸钙之间的离子相互作用[5]。酪蛋白和Ca2+在胶束与乳清中的分布处于动态平衡,受温度和离子环境等因素影响,进而影响酪蛋白胶束的加工和应用特性[6]。
将牛乳冷却并存储在4 ℃,一部分胶体磷酸钙会从酪蛋白胶束中解离;另外,由于低温下酪蛋白之间疏水作用力的降低,一部分β-酪蛋白会从胶束中解离,剩余的β-酪蛋白与αs-酪蛋白通过磷酸丝氨酸残基与胶体磷酸钙紧密结合,维持胶束的骨架[7]。低温下酪蛋白胶束的部分解离是可逆的,当温度恢复至室温,解离的组分可再次与胶束结合[8]。利用低温下β-酪蛋白的解离特性,李珺珂等[9]在4 ℃使用30 nm孔径的陶瓷膜对脱脂牛乳进行微滤处理,制备了富含β-酪蛋白和乳清蛋白的乳蛋白配料。目前,少有研究关注低温诱导解离对酪蛋白胶束结构的影响,尤其未见羊乳酪蛋白胶束在低温解离后结构变化的相关报道。
本研究以脱脂山羊乳为原料,采用液相色谱-质谱联用、多角度静态/动态光散射、冷冻透射电镜、小角X射线散射等手段,研究4 ℃下胶束态酪蛋白和胶束钙的解离、游离酪蛋白的磷酸化水平及解离后酪蛋白胶束的结构变化。本研究有助于进一步揭示羊乳酪蛋白胶束的结构特征,并为羊乳酪蛋白的分离提供理论参考。
1 材料与方法
1.1 材料与试剂
山羊乳,杭州牧羊谷;PELLICON XL超滤膜包BIOMAX 10KDA,西格玛奥德里奇(上海)贸易有限公司;300SB C8色谱柱(250 mm×4.6 mm,5 μm),美国安捷伦公司。
二硫苏糖醇、三氟乙酸,美国Sigma公司;乙腈、甲醇,赛默飞世尔科技(中国)有限公司;丙烯酰胺、甲叉丙烯酰胺、三羟甲基氨基甲烷、十二烷基硫酸钠、四甲基乙二胺、过硫酸铵、尿素、β-巯基乙醇、1,3-二[三(羟甲基)甲氨基]丙烷,上海生物工程股份有限公司;溴酚蓝、NaOH、HCl、HNO3、高氯酸、乙醇、冰乙酸、三氯乙酸,国药集团化学试剂有限公司。
1.2 仪器与设备
Optima L-100XP超速离心机,美国Beckman Coulter公司;Millipore LabscaleTFF超滤系统,德国Millipore公司;LYNX4000离心机、Talos F200C冷冻透射电镜,美国Thermo Fisher公司;Protean Ⅱ xi Cell电泳仪、GelDox XR凝胶成像仪,美国Bio-rad公司;Waters Alliance e2695 Separations Module高效液相色谱分析仪、MALDI SYNAPT MS超高效液相色谱串联四极杆飞行时间质谱联用仪,美国Waters公司;AA-240原子吸收分光光度计,美国VARIAN公司;BI-200SM广角动静态激光散射仪、Dimension FastScan原子力显微镜,美国Buluke公司;F-2700荧光分光光度计,日本日立公司;SAXSpoint2.0小角X射线散射仪,奥地利Anton Paar公司。
1.3 实验方法
1.3.1 4 ℃下胶束态酪蛋白的逐次诱导解离及分离
样品的制备流程如图1所示,新鲜羊乳经离心脱脂后,在25 ℃、100 000×g离心1 h;取沉淀(即胶束)于羊乳在25 ℃的超滤液中剪切复溶,在4 ℃平衡24 h,然后在4 ℃、100 000×g离心1 h;取沉淀于羊乳在4 ℃的超滤液中进行剪切复溶,在4 ℃平衡24 h,然后在4 ℃、100 000×g离心1 h;重复上述4 ℃复溶、平衡和离心的操作步骤2次;收集上清液、复溶液和沉淀用于后续分析。
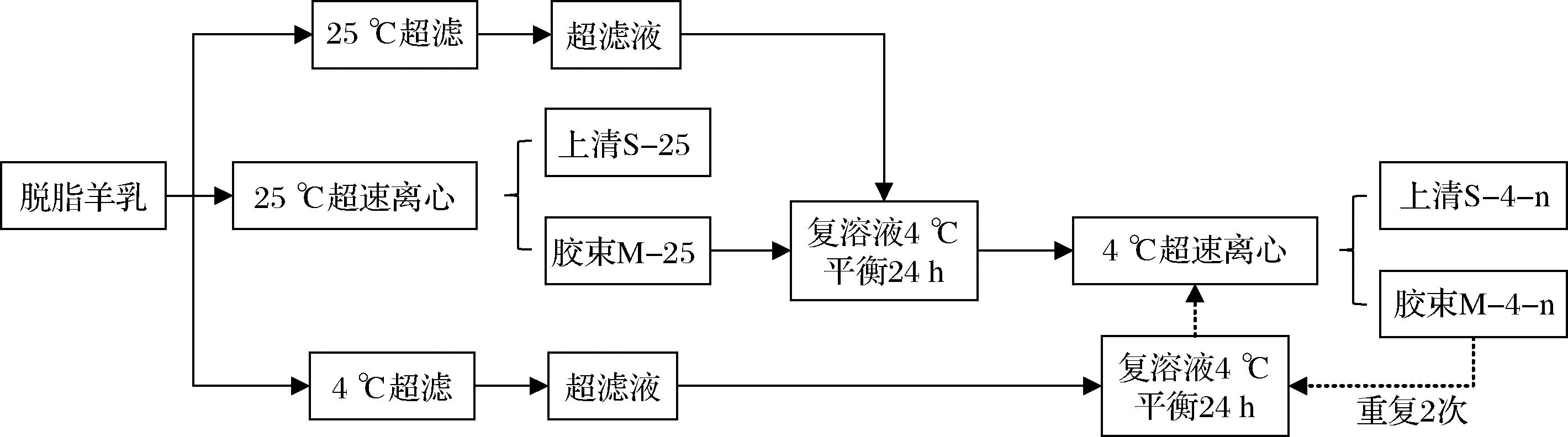
图1 4 ℃下胶束态酪蛋白的逐次诱导解离及分离流程图
Fig.1 Flow chart for the sequential dissociation and separation of micellar casein at 4 ℃
注:n值为1、2、3,分别对应4 ℃下胶束态酪蛋白解离及分离的次数。
1.3.2 SDS-PAGE分析
取山羊脱脂乳和1.3.1节中制备的上清液样品,分别与样品缓冲液按1∶1(体积比)混合,样品缓冲液含0.125 mol/L三羟甲基氨基甲烷溶液,40 g/L十二烷基硫酸钠和20%(体积分数)甘油,并加入5%(体积分数)β-巯基乙醇和0.5 g/L的溴酚蓝,沸水浴5 min,待其冷却后,取10 μL进行电泳上样。电泳的分离胶和浓缩胶质量分数分别是4%和12%,每块胶板的运行电流分别为15 mA和30 mA,胶板的染色和脱色参考LAEMMLI[10]的方法。
1.3.3 反相高效液相色谱分析
参考YUAN等[11]的方法,取山羊脱脂乳和1.3.1节中制备的上清液样品,分别与pH 7缓冲液按1∶1(体积比)混合,缓冲液含0.1 mol/L 1,3-二[三(羟甲基)甲氨基]丙烷, 8 mol/L尿素,20 mmol/L二硫苏糖醇和13 g/L二水合柠檬酸三钠,混合均匀后过0.45 μm的有机膜。选用C8色谱柱,柱温40 ℃,流速0.8 mL/min,流动相A和流动相B为乙腈、水、三氟乙酸的混合,体积比分别为50∶950∶1和800∶200∶1,检测波长220 nm,色谱积分采用Empower软件。
1.3.4 电感耦合等离子体质谱分析(inductively coupled plasma mass spectrometry,ICP-MS)
参考YANG等[12]的方法,取山羊脱脂乳、及1.3.1节中制备的上清液和复溶液样品各1 mL,置于消解管中,加入10 mL的HNO3溶液和2 mL的高氯酸,进行微波消解,消解结束后将消解液定容至50 mL, 然后用ICP-MS测量。脱脂乳或复溶液中的钙减去对应上清液中的钙,即为胶束钙含量。
1.3.5 尿素电泳(Urea-PAGE)分析
参考BANSAL等[13]的方法,取山羊脱脂乳及1.3.1节中制备的上清液,采用1 mol/L HCl溶液调节pH值至4.3,然后在5 000×g下离心30 min。离心的沉淀用1.3.3节中的缓冲液溶解,然后与pH 7.6样品缓冲液按1∶1(体积比)混合,样品缓冲液含0.06 mol/L三羟甲基氨基甲烷溶液,8 mol/L尿素溶液,加入体积分数5% β-巯基乙醇和0.5 g/L溴酚蓝。浓缩胶为40 g/L丙烯酰胺,分离胶为100 g/L丙烯酰胺,运行电压分别为280 V和300 V,上样量30 μL。
1.3.6 液相色谱-质谱联用分析(liquid chromatography-mass spectrometry,LC-MS)
为检测解离β-酪蛋白的磷酸基团数,参考MIRANDA等[14]的方法,将1.3.5节中酸沉后的溶解液过0.45 μm有机膜, 采用LC-MS进行分析。采用BEH C4色谱柱(100 mm×2.1 mm),流动相A和B分别是0.1%(体积分数)的甲酸和纯乙腈。采用阳离子模式, 扫描范围为500~300 m/z, 扫描时间1 s,间隔0.02 s,锥孔电压40 V,碰撞能量6 eV。
1.3.7 多角度静态/动态光散射分析
参考YANG等[12]的方法,光散射测量在25 ℃进行。取1.3.1节中制备的复溶液样品,用水稀释成4个浓度,之后进行静态光测量, 检测角度范围为30°~120°, 间隔10°, 折光指数增量0.189 mg/mL, 静态光的数据使用ALV-Static Fit软件进行Berry拟合, 由曲线中浓度和角度外推至0的斜率和截距获得胶束的均方回转半径(Rg)和重均分子质量(Mw)。动态光测量在90°进行, 颗粒折射率为1.57,获得流体力学半径(Rh)。Rg是从分子的核心到分子中每个质量元素的质量加权平均距离,Rh等于与被观察粒子以相同速度扩散的等效硬球的半径。
1.3.8 胶束水合率测定
参考YANG等[12]的方法,取1.3.1节中制备的沉淀,置于105 ℃干燥7 h, 记录烘干前后样品的质量,两者质量之差除以烘干后样品的质量即为胶束水合率。
1.3.9 内源荧光光谱分析
参考WU等[15]的方法,取1.3.1节中制备的复溶液样品,采用常温超滤液稀释10倍后置于石英池中进行荧光光谱分析,温度控制25 ℃,激发发射狭缝控制在5 nm,激发波长280 nm,发射波长290~450 nm,扫描速度60 nm/min。
1.3.10 冷冻透射电镜(cryo-transmission electron microscopy,Cryo-TEM)分析
参考ZHANG等[16]的方法,用镊子将已亲水化的铜网置入冷冻制样机FEI Vitrobot装置中,取1.3.1节中制备的复溶液3 μL,置于铜网上,用滤纸吸走多余样品溶液后,将铜网迅速投入至液态乙烷中进行速冻,然后在Talos F200C透射电镜下进行观察。
1.3.11 原子力显微镜(atomic force microscope,AFM)分析
参考FREITAS等[17]的方法,取1.3.1节中制备的复溶液,滴加到干净的云母片上,待其干燥后,在接触模式下观察胶束的表面形貌,扫描面积为3 μm×3 μm。
1.3.12 小角X射线散射(small angle X-ray scattering,SAXS)分析
参考MOITZI等[18]的方法,取1.3.1节中制备的复溶液冻干成粉末,将复溶液或其冻干粉置于带有矩形孔(20 mm×4 mm×2 mm)的样品台中,两侧以胶带密封,之后进行SAXS分析,设置样品与检测器的距离600 mm,在真空条件进行1 h的散射分析,采用SAXS analysis 4.00.046软件将获得的二维数据转化为一维数据。
1.4 数据分析
采用SPSS 20.0软件对数据进行统计分析,采用Duncan检验,P<0.05表示差异显著。
2 结果与分析
2.1 25 ℃和4 ℃下游离酪蛋白的含量
在乳中,酪蛋白和钙在乳清与胶束之间的分布处于动态平衡,且受温度的影响。山羊脱脂乳于25 ℃超速离心,将游离和胶束部分分开;取胶束部分复溶于脱脂乳在25 ℃的超滤液,使胶束所处的离子环境保持不变,于4 ℃平衡后超速离心,将游离和胶束部分分开;取胶束部分复溶于脱脂乳在4 ℃的超滤液,使胶束所处的离子环境保持不变,于4 ℃平衡后超速离心,将游离和胶束部分分开;重复上述4 ℃复溶、平衡和离心的操作步骤2次,以实现4 ℃胶束态酪蛋白最大程度的解离。
脱脂乳在25 ℃和4 ℃下游离酪蛋白的组成如图2-a所示。25 ℃游离蛋白组分主要包括β-酪蛋白、κ-酪蛋白以及乳清蛋白,β-酪蛋白的条带强度略高于κ-酪蛋白,乳清蛋白的条带强度与脱脂乳相比无显著差异,表明常温超速离心实现了乳清蛋白与胶束相酪蛋白的分离。在第1次沉淀复溶、4 ℃平衡后超离心的上清液中,β-酪蛋白是主要的游离蛋白,β-酪蛋白的条带强度显著高于其余蛋白的条带, 也高于常温下游离的β-酪蛋白条带, 同时还存在少量的κ-酪蛋白和乳清蛋白, 但相对于25 ℃超离心上清液中的κ-酪蛋白和乳清蛋白,条带强度显著降低。第2次沉淀复溶、4 ℃平衡后超离心的上清液中, β-酪蛋白仍是游离酪蛋白中的主要组分,相比于第1次超离心的上清液,各游离蛋白组分的条带强度均显著降低。第3次沉淀复溶、4 ℃平衡后超离心的上清液中, 几乎没有蛋白再解离出。
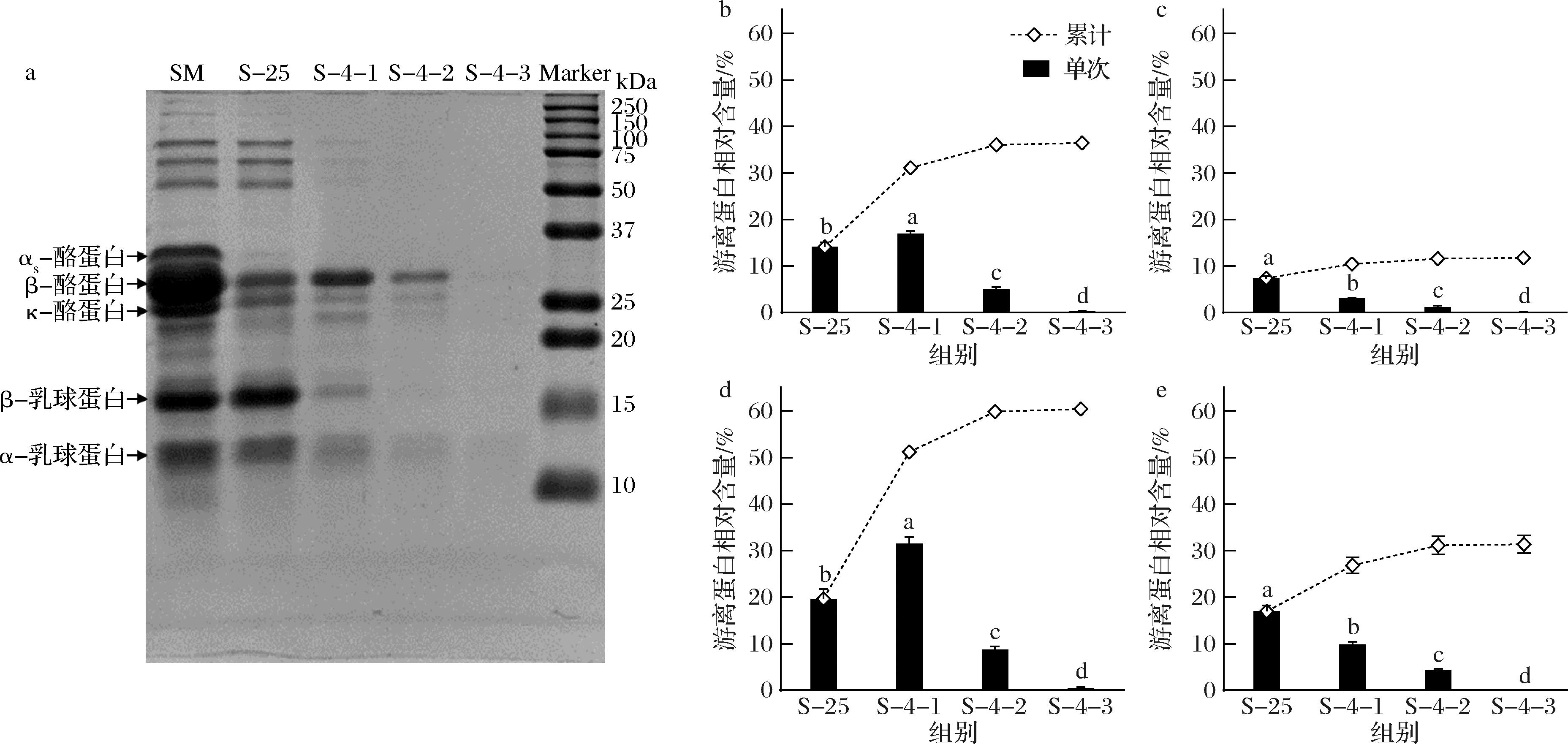
a-游离酪蛋白的组成;b-总酪蛋白;c-αs-酪蛋白;d-β-酪蛋白;e-κ-酪蛋白
图2 25 ℃和4 ℃下游离蛋白的SDS-PAGE图与含量
Fig.2 SDS-PAGE patterns and contents of free caseins at 25 and 4 ℃
注:SM-脱脂乳;不同小写字母表示显著性差异(P<0.05)(下同)。
25 ℃和4 ℃下游离酪蛋白的相对含量如图2-b~图2-d所示。与25 ℃下乳中的游离酪蛋白相比,第1次沉淀复溶液处于4 ℃下游离的αs和κ-酪蛋白含量更低,而游离的总酪蛋白和β-酪蛋白的含量更高。随着沉淀(即胶束)复溶次数的增加,4 ℃下游离的总酪蛋白、αs、β、κ-酪蛋白含量均显著地逐渐降低,游离的总酪蛋含量从17.0%降低至0.4%,其中αs-酪蛋白含量从3.1%降低至0.2%,β-酪蛋白含量从31.5%降低至0.5%,κ-酪蛋白含量从9.9%降低至0.2%。山羊胶束态酪蛋白最多能解离出36.5%的总酪蛋白,其中αs-酪蛋白解离11.8%,β-酪蛋白解离60.4%,κ-酪蛋白解离31.4%。邵言蹊等[19]将山羊乳直接置于4 ℃平衡120 min,发现10.1%的αs-酪蛋白、36.5%的β-酪蛋白、25.5%的κ-酪蛋白从胶束中解离,也表明β-酪蛋白具有最大的解离率。山羊酪蛋白胶束中各蛋白解离的难易程度依次为β-酪蛋白>κ-酪蛋白>αs-酪蛋白。由于低温导致的疏水作用力的减弱,β-酪蛋白大部分从胶束中解离,而αS-酪蛋白的磷酸基团更多,有更高的钙结合能力,能与胶束中的磷酸钙维持更强的离子相互作用力,与胶束结合地更加紧密,因此更难从胶束中解离出[5]。
2次低温解离基本实现了胶束中β-酪蛋白最大程度的解离,胶束达到该温度下的稳定状态。因此,本研究选用胶束M-25的复溶液和胶束M-4-2的复溶液,以研究胶束态酪蛋白解离前后的结构变化。
2.2 25 ℃和4 ℃下游离钙的含量
25 ℃和4 ℃下游离钙含量如图3所示。山羊脱脂乳25 ℃游离钙的含量为38.7 mg/100 mL,占总钙含量的28%,而第1次复溶的沉淀在4 ℃下游离钙的含量为51.0 mg/100 mL,高于25 ℃下游离钙的含量,反映了低温下钙的解离。LAW[20]也报道了脱脂牛乳4 ℃和20 ℃下游离钙含量,20 ℃牛乳的游离钙含量为44.8 mg/100 mL,占总钙含量的33%,4 ℃牛乳的游离钙含量为52.0 mg/100 mL。胶束的存在使得牛羊乳能够携带较多的钙,满足婴儿对钙的需求,多数钙以无定形纳米簇的胶体磷酸钙形式分布在胶束基质中。低温会导致钙的饱和溶解度的增加,使钙在胶束和上清液中的分配发生改变,更多的胶束钙转变成游离钙的形式。邵言蹊等[19]比较了不同平衡温度对山羊乳中胶束钙解离的影响,随着平衡温度从25 ℃降低至4 ℃,胶束钙的占比呈现出线性降低的趋势,因此推测温度进一步降低,胶束钙占比将进一步降低,鉴于4 ℃是乳品加工和贮藏中常用的低温温度以及工业上进一步降低温度所带来的高成本,本研究采用了4 ℃作为代表性的低温温度。LIU等[21]将牛乳从40 ℃冷却到10 ℃,发现pH对温度的响应在短时间内即可完成,表明矿物盐在胶束和乳清中的分布快速达到了平衡。另一项研究将牛乳从4 ℃加热至90 ℃,同样发现可溶性钙在不同温度下的分布可快速(<2 min)达到平衡[22]。在胶束结构中,一部分β-酪蛋白参与胶束骨架结构形成,通过其所带的磷酸基团与胶体磷酸钙相互结合,胶体磷酸钙的增溶会导致部分参与骨架结构形成的β-酪蛋白从胶束中解离出[20]。随着沉淀复溶次数的增加,游离钙含量逐渐降低至40.2 mg/100 mL。
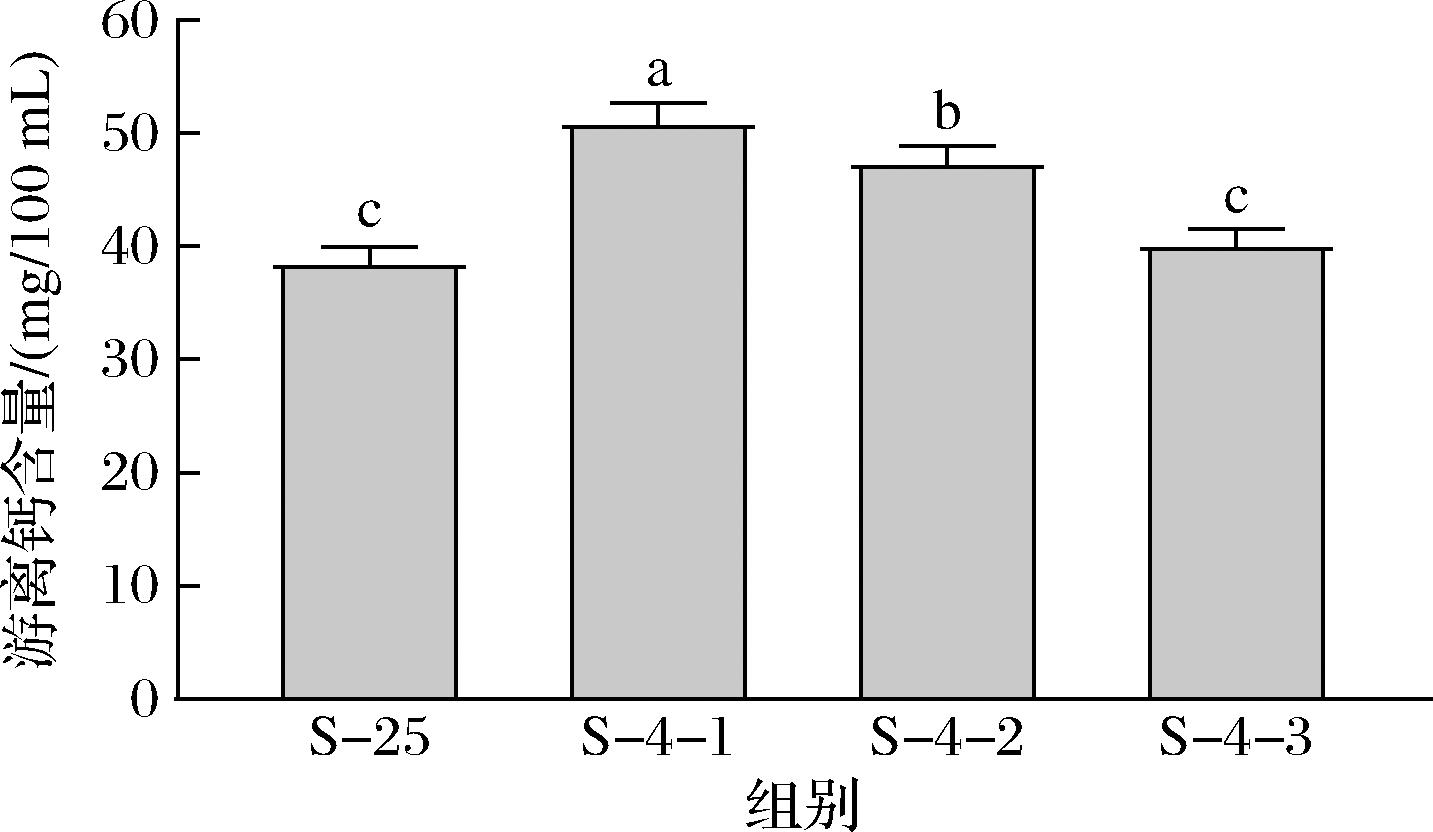
图3 25 ℃和4 ℃下游离钙的含量
Fig.3 Contents of free calcium at 25 and 4 ℃
2.3 25 ℃和4 ℃下游离酪蛋白的磷酸化水平
脱脂乳, 25 ℃和4 ℃下游离酪蛋白的Urea-PAGE如图4-a所示。尿素的添加使得蛋白分子变性,蛋白在聚丙烯酰胺凝胶中的迁移速率受电荷量和分子质量的影响。酪蛋白所携带的磷酸基团越多,其电泳迁移率越大,αs-酪蛋白比β-酪蛋白有更高的电泳迁移率[23]。相比于脱脂乳,25 ℃和4 ℃游离β-酪蛋白对应的条带整体电泳迁移率更低,且4 ℃游离β-酪蛋白对应的条带整体电泳迁移率高于25 ℃下游离的β-酪蛋白,4 ℃下游离β-酪蛋白对应的主要条带与脱脂乳一致,为高电泳迁移率的条带。
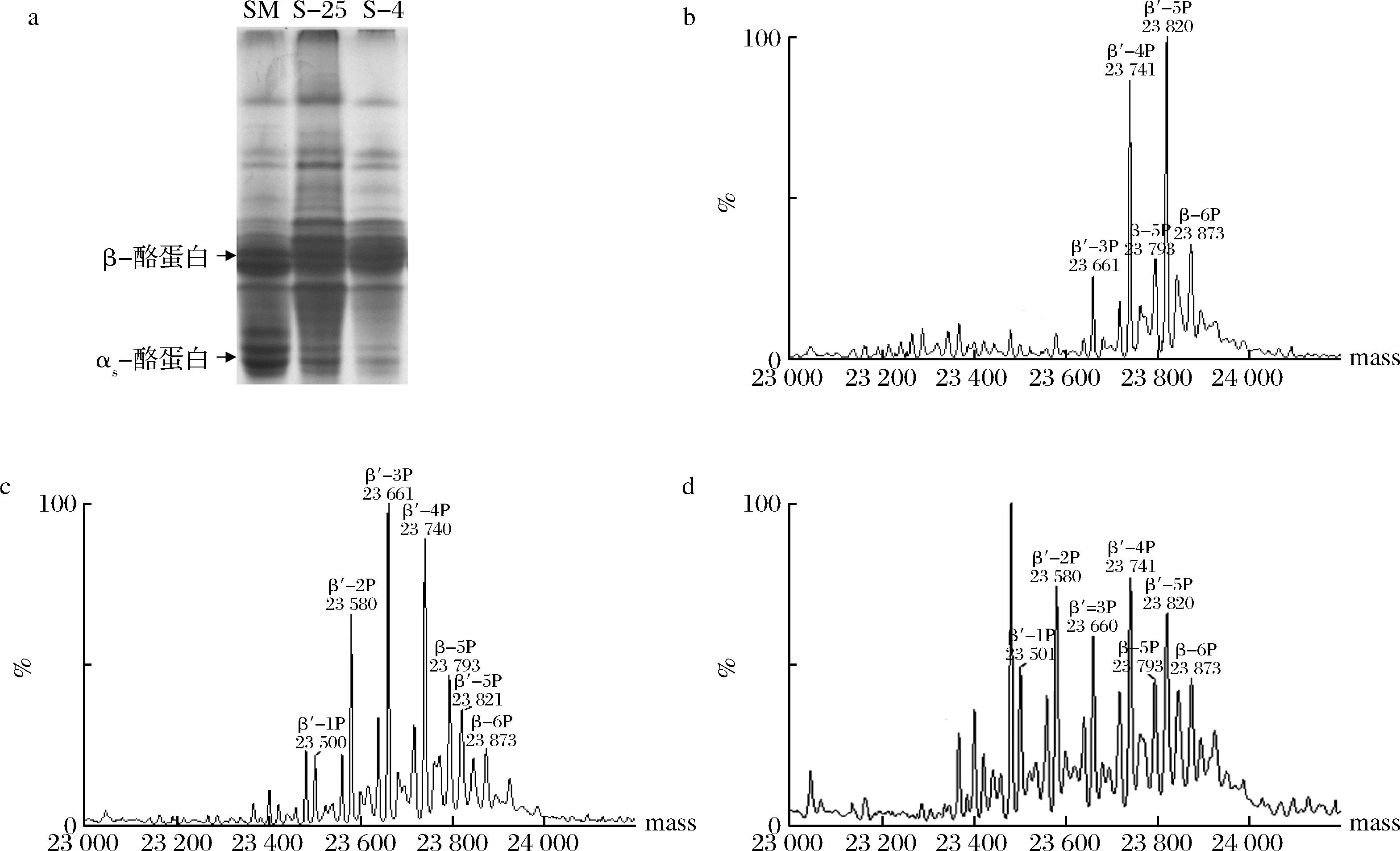
a-Urea-PAGE;b、c、d-脱脂乳,25 ℃和4 ℃下游离酪蛋白的去卷积质谱图
图4 25 ℃和4 ℃下游离酪蛋白的Urea-PAGE图与去卷积质谱图
Fig.4 Urea-PAGE patterns and deconvoluted mass spectrums of free caseins at 25 and 4 ℃
通过LC-MS可以进一步鉴定游离β-酪蛋白的磷酸基团个数(图4-b~图4-d)。β-酪蛋白每减少一个磷酸基团,即减少一个HPO3-,质量数会减少80 Da, 通过比对Uniprot数据库,可以鉴定出β-酪蛋白的磷酸基团数。在山羊脱脂乳中,β-酪蛋白的分子质量为23 793、23 873 Da,分别对应含有5P和6P的β-酪蛋白,另外,还存在变异体β-酪蛋白,分子质量为23 661、23 741、23 820 Da,分别对应含有3P、4P和5P的变异体β-酪蛋白。在25 ℃上清液中,新鉴定到含有1P和2P的变异体β-酪蛋白,对应的分子质量为23 500、23 580 Da,β-酪蛋白的磷酸化形式以2P、3P和4P的变异体β-酪蛋白为主。4 ℃上清液中鉴定到的β-酪蛋白及变异体的分子质量与25 ℃一致,但磷酸化形式以2P和4P的变异体β-酪蛋白为主。
Urea-Page及LC-MS的结果表明,常温下低磷酸化程度的β-酪蛋白,主要是含有2P、3P和4P的变异体β-酪蛋白,更难维持在胶束内部,而主要是以游离的单体存在。磷酸化程度较低的β-酪蛋白可能与胶体磷酸钙形成较少的钙桥,因而与胶束的相互作用力较弱,更易移动至乳清相中。低温下,胶体磷酸钙的解离,导致了更多的高磷酸化程度的、携带5P和6P的β-酪蛋白从胶束中解离出。
2.4 4 ℃诱导解离对酪蛋白胶束钙含量的影响
4 ℃诱导解离对胶束钙相对含量、胶束中钙与酪蛋白摩尔比的影响如图5所示。4 ℃下胶体磷酸钙的增溶导致了酪蛋白胶束钙含量的减小,胶束钙相对含量从72.0%减少至50.2%,胶束中钙与酪蛋白摩尔比从21.8减少至19.4。邵言蹊等[19]将山羊乳直接置于4 ℃下平衡120 min,发现胶束钙相对含量从71.1%降低至63.2%,本研究结果基本相符。钙在胶束的形成、结构完整性维持方面具有重要作用,能通过离子相互作用将酪蛋白分子相连接,同时中和酪蛋白分子上磷酸丝氨酸基团的负电荷,使酪蛋白能在疏水相互作用下相互连接[24]。低温导致了胶束钙含量的减小,从而打破胶束内部作用力的平衡。
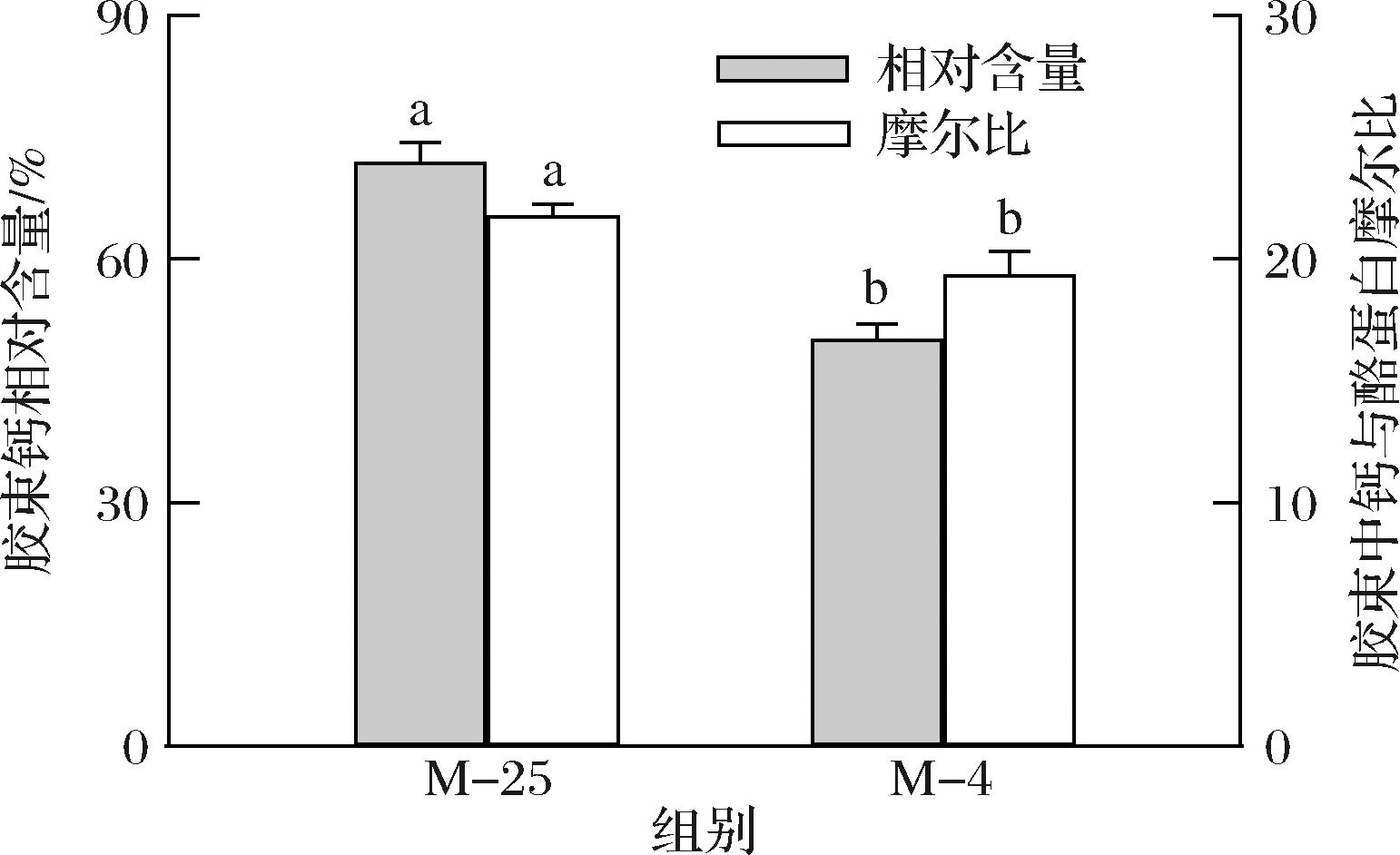
图5 25 ℃下及4 ℃诱导解离后酪蛋白胶束的钙含量
Fig.5 Calcium contents of casein micelles at 25 ℃ and after the dissociation at 4 ℃
注:同种柱子上不同小写字母表示显著性差异(P<0.05)(下同)。
2.5 4 ℃诱导解离对酪蛋胶束粒径的影响
4 ℃诱导解离前后胶束的粒径和摩尔质量如图6所示,低温诱导解离导致了山羊酪蛋白胶束的均方回转半径从145.5 nm减小到133.5 nm,流体力学半径从105.7 nm减小到85.8 nm,Mw从10.8×108 g/mol减小到6.6×108 g/mol。在高分子在溶液中的构象研究方面,形状因子Rg/Rh常用于判断高分子链的构象,酪蛋白胶束属于线性柔性的高斯线团[25]。胶束形状因子值的改变侧面反映了胶束的蓬松状态。4 ℃诱导解离导致了山羊酪蛋白胶束形状因子的增加,表明胶束在低温解离之后变得更加蓬松。YANG等[12]研究了4 ℃诱导解离对人乳酪蛋白胶束结构的影响,在均方回转半径、重均分子质量和Rg/Rh上与羊乳酪蛋白胶束表现相同,都是呈下降趋势,而流体力学半径呈现增加趋势,这可能是由于人乳胶束与羊乳胶束组成和酪蛋白磷酸化程度不同,导致胶束内部离子相互作用、组分分布不同所导致的。
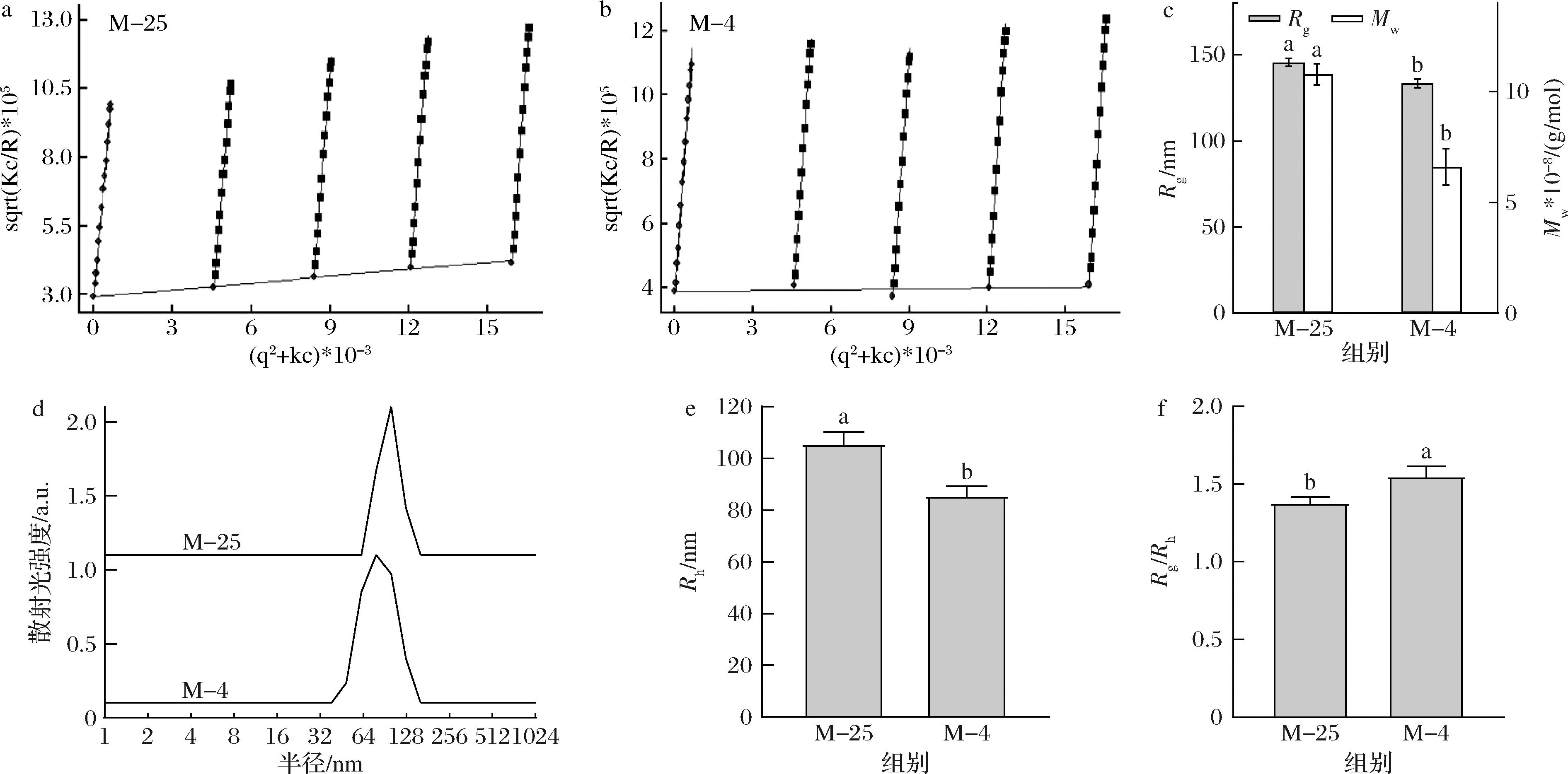
a、b-25、4 ℃诱导解离后酪蛋白胶束的Berry拟合曲线;c-方回转半径和重均分子量;d-流体力学半径;e-平均流体力学半径;f-形状因子
图6 25 ℃下及4 ℃诱导解离后酪蛋白胶束的粒径,Berry拟合曲线,均方回转半径和重均分子质量,流体力学半径分布,平均流体力学半径,形状因子
Fig.6 Particle size of casein micelles at 25 ℃ and after the dissociation at 4 ℃ Berry plots, mean-square radius of gyration and weight-average molecular weight, hydrodynamic radius distribution, average hydrodynamic radius, shape factor
2.6 4 ℃诱导解离对酪蛋胶束水合状态的影响
酪蛋白胶束是高度水合、海绵状的胶体颗粒,只有15%的水与蛋白质结合,其余的水被物理截留在胶束中[26]。4 ℃诱导解离导致了山羊酪蛋白胶束的水合率从2.0 g/g干胶束增加到2.9 g/g干胶束(图7-a)。图7-b显示了4 ℃解离前后胶束内源荧光光谱的改变。低温诱导解离导致了胶束内源荧光强度的增加,而最大发射波长未发生变化。水合率和内源荧光强度的增加都反映了胶束在低温诱导解离后发生溶胀,结构变得更加蓬松,与光散射测得的形状因子一致,因此,物理空间上可以束缚更多的水。杨同香等[27]研究了离子强度对水牛乳酪蛋白胶束内源荧光强度的影响,当离子强度从0.01 mol/L增加到0.05 mol/L时,同样观察到胶束内源荧光强度增加,而荧光的最大发射波长未变化,表明胶束内部结构发生了溶胀。
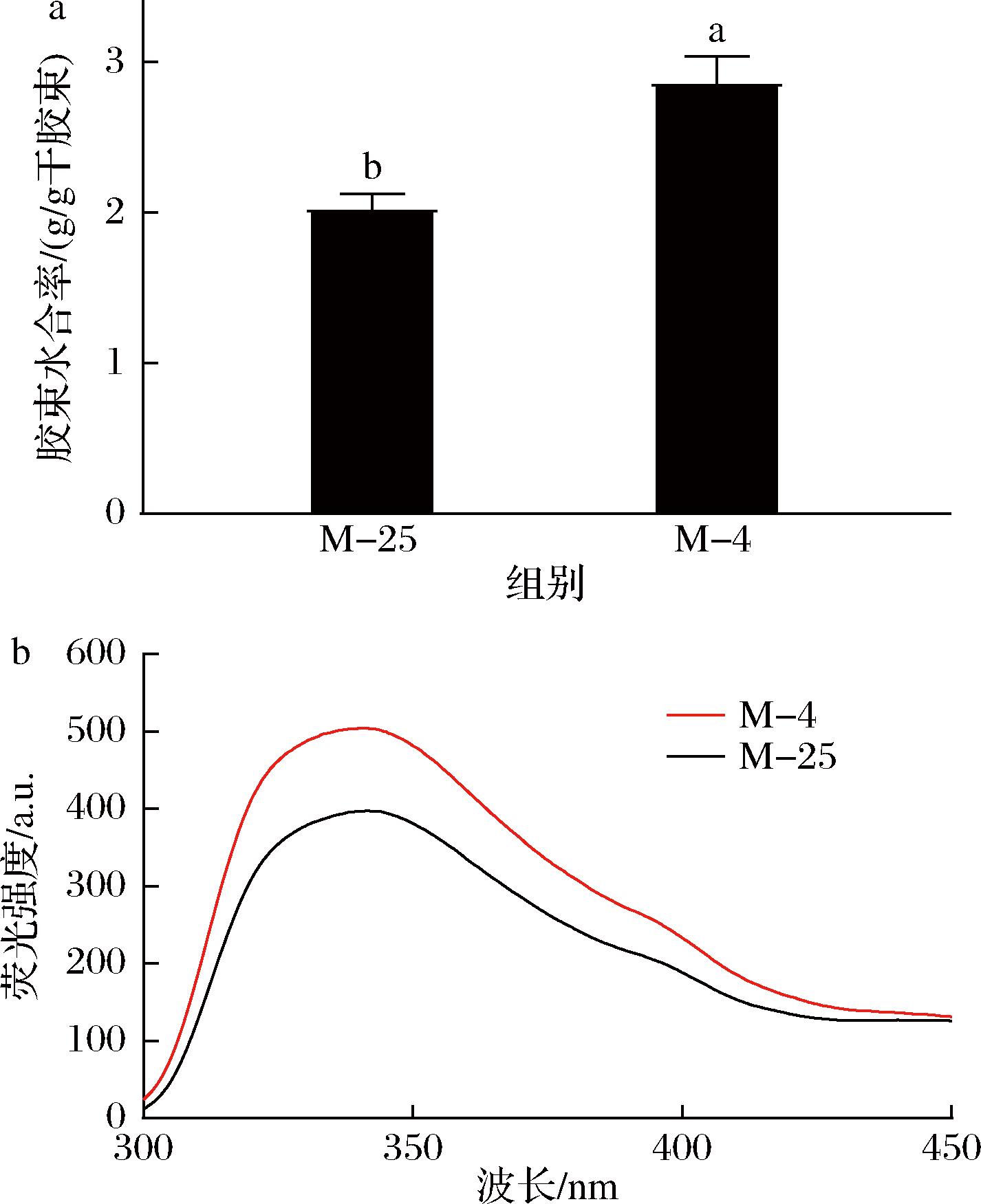
a-水合率;b-荧光光谱
图7 25 ℃下及4 ℃诱导解离后酪蛋白胶束的水合率与荧光光谱
Fig.7 Hydration rate and fluorescence spectra of casein micelles at 25 ℃ and after the dissociation at 4 ℃
2.7 4 ℃诱导解离对酪蛋胶束微观形貌和内部结构的影响
4 ℃诱导解离前后胶束的微观形貌如图8所示,冷冻透射电镜和原子力显微镜的图像表明胶束在4 ℃诱导解离前后均是完整的光滑球形,同时观察到酪蛋白胶束在解离之后尺寸变小,与光散射的数据一致,另外还能在冷冻透射电镜的图像上,观察到胶束的电子密度减弱,进一步表明胶束在低温诱导解离后呈现更加蓬松的状态。

a-Cryo-TEM图;b-AFM图
图8 25 ℃下及4 ℃诱导解离后酪蛋白胶束Cryo-TEM图与AFM图
Fig.8 Cryo-TEM and AFM micrographs of casein micelles at 25 ℃ and after the dissociation at 4 ℃
4 ℃诱导解离前后羊乳胶束的复溶液和粉体SAXS曲线如图9所示。复溶液SAXS曲线在0.035 Å-1 和0.07 Å-1附近观察到2个微弱的肩峰,将曲线分为3个特征区域。小于0.01 Å-1的低Q区,对应于酪蛋白胶束的界面散射;中Q区0.03 Å-1附近的肩峰对应于胶束内部胶体磷酸钙之间的距离;高Q区0.07 Å-1左右的肩峰,对应于胶束内部的酪蛋白局部非均一性分布[11]。4 ℃诱导解离后山羊胶束低Q区的散射无显著变化,这与电镜观测到的胶束低温解离前后均呈现为球形的结果相一致;4 ℃诱导解离导致了中Q区的肩峰变小,这与低温解离后胶束钙含量减少的结果相一致;4 ℃诱导解离还导致了高Q区的肩峰变小,表面低温诱导解离后胶束内部组分的分布发生了重排,酪蛋白空间分布的局部非均一性降低。粉体SAXS曲线中Q区0.035 Å-1的肩峰更加明显,这是因为相比液体基质,气体基质使得散射对比度增加,还因为单位体积的粉体中有效的散射粒子数更多。相比复溶液,粉体SAXS曲线中Q区的肩峰出峰位置向右发生了偏移,这是因为干燥导致了基质的收缩,使得胶体磷酸钙之间的距离缩短。同样4 ℃诱导解离导致了粉体SAXS曲线中Q区的肩峰变小。
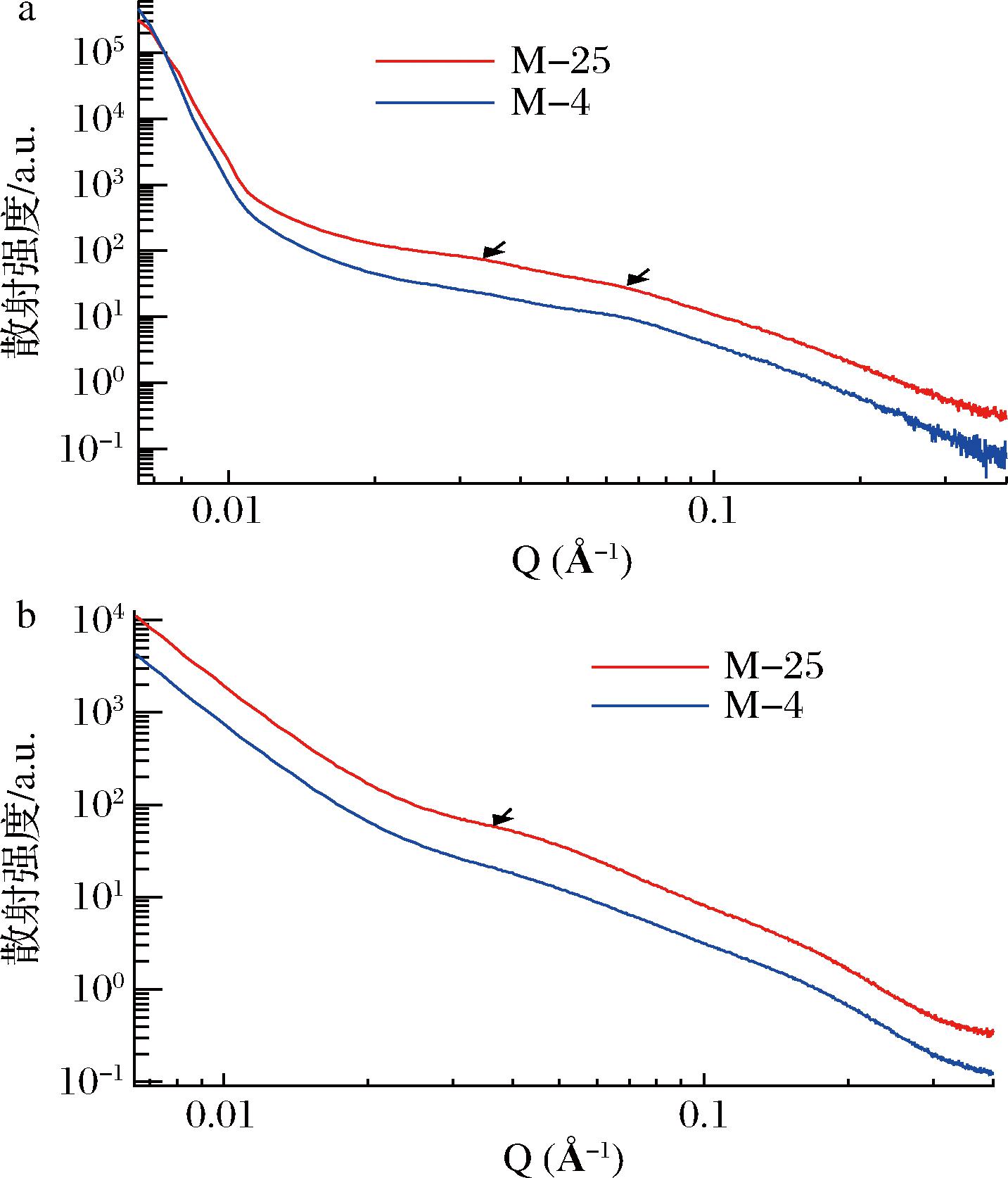
a-复溶液;b-粉体
图9 25 ℃下及4 ℃诱导解离后酪蛋白胶束的SAXS曲线
Fig.9 SAXS profiles of casein micelles at 25 ℃ and after the dissociation at 4 ℃
3 结论
低温下酪蛋白之间疏水作用的减弱以及乳清中钙溶解度的增加,使得山羊乳酪蛋白胶束中酪蛋白(主要为β-酪蛋白)和钙发生部分解离,超速离心和超滤液复溶2次后,胶束态酪蛋白的解离达到平衡,总酪蛋白的解离率达36.5%,其中αs-酪蛋白解离11.8%,β-酪蛋白解离60.4%,κ-酪蛋解离31.4%。由于磷酸化程度较低的β-酪蛋白与胶束钙的相互作用力较弱,常温下游离的β-酪蛋白以低磷酸化程度的变异体β-酪蛋白为主;低温下由于胶束钙的解离、钙离子桥连作用的破坏,导致更多的高磷酸化程度的β-酪蛋白从胶束中解离。低温诱导解离后胶束尺寸变小,但胶束仍然保持初始的完整球状外貌。低温诱导解离后胶束钙含量减小,导致胶束内部酪蛋白分布的不均匀性减小,胶束变得更加松散,能束缚更多的水,并且在TEM下观测到内部的电子密度降低。本研究结果有助于推进对羊乳酪蛋白胶束结构特征的认识,为羊乳酪蛋白配料的分离提供理论参考。
[1] 郭银萍, 张书文, 赵晓璇, 等.液态羊乳的加工研究进展[J].食品安全质量检测学报, 2022, 13(6):1703-1710.
GUO Y P, ZHANG S W, ZHAO X X, et al.Research progress of liquid goat milk processing[J].Journal of Food Safety &Quality, 2022, 13(6):1703-1710.
[2] 高颖智, 王力纬.羊乳产业的前世、今生和未来[J].中国乳业, 2020(2):42-46.
GAO Y Z, WANG L W.The past, present and future of goat milk industry[J].China Dairy, 2020(2):42-46.
[3] ROY D, YE A Q, MOUGHAN P J, et al.Composition, structure, and digestive dynamics of milk from different species-a review[J].Frontiers in Nutrition, 2020, 7:577759.
[4] KUMAR S, KUMAR B, KUMAR R, et al.Nutritional features of goat milk:A review[J].Indian Journal of Dairy Science, 2012, 65(4):266-273.
[5] LUCEY J A, HORNE D S.Perspectives on casein interactions[J].International Dairy Journal, 2018, 85:56-65.
[6] BROYARD C, GAUCHERON F.Modifications of structures and functions of caseins:A scientific and technological challenge[J].Dairy Science &Technology, 2015, 95(6):831-862.
[7] LAW A J R, LEAVER J.Effects of acidification and storage of milk on dissociation of bovine casein micelles[J].Journal of Agricultural and Food Chemistry, 1998, 46(12):5008-5016.
[8] DAVIES D T, LAW A J R.Variation in the protein composition of bovine casein micelles and serum casein in relation to micellar size and milk temperature[J].Journal of Dairy Research, 1983, 50(1):67-75.
[9] 李珺珂, 刘大松, 赖瑞业, 等.低温微滤技术制备富含β-酪蛋白和乳清蛋白的新型功能性乳蛋白配料[J].食品与发酵工业, 2017, 43(6):85-91.
LI J K, LIU D S, LAI R Y, et al.Whey protein and β-casein enriched new functional milk protein by microfiltration at low temperature[J].Food and Fermentation Industries, 2017, 43(6):85-91.
[10] LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature, 1970, 227:680-685.
[11] YUAN J J, LIU D S, PENG X Y, et al.The heat stability of caprine and bovine micellar casein dispersions[J].International Dairy Journal, 2022, 131:105373.
[12] YANG T T, LIU D S, ZHOU P.Temperature-dependent dissociation of human micellar β-casein:Implications of its phosphorylation degrees and casein micelle structures[J].Food Chemistry, 2022, 376:131935.
[13] BANSAL N, FOX P F, MCSWEENEY P L H.Aggregation of rennet-altered casein micelles at low temperatures[J].Journal of Agricultural and Food Chemistry, 2007, 55(8):3120-3126.
[14] MIRANDA G, MAHÉ M F, LEROUX C, et al.Proteomic tools to characterize the protein fraction of Equidae milk[J].Proteomics, 2004, 4(8):2496-2509.
[15] WU K Y, YANG T X, LI Q Y.The effects of pH and NaCl concentration on the structure of β-casein from buffalo milk[J].Food Science &Nutrition, 2021, 9(5):2436-2445.
[16] ZHANG Q J, HE C H, ZHANG D M, et al.Research on viscoelastic properties of SLG-LHSB system:Effects of pH and concentration on micelles in the system[J].Journal of Molecular Liquids, 2022, 367:120593.
[17] FREITAS C D T, SILVA M Z R, OLIVEIRA J P B, et al.Study of milk coagulation induced by chymosin using atomic force microscopy[J].Food Bioscience, 2019, 29:81-85.
[18] MOITZI C, PORTNAYA I, GLATTER O, et al.Effect of temperature on self-assembly of bovine beta-casein above and below isoelectric pH.Structural analysis by cryogenic-transmission electron microscopy and small-angle X-ray scattering[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2008, 24(7):3020-3029.
[19] 邵言蹊, 刘大松, 徐姝, 等.低温诱导羊乳中β-酪蛋白从胶束中解离的研究[J].食品与生物技术学报, 2021, 40(8):27-36.
SHAO Y X, LIU D S, XU S, et al.Dissociation of β-casein from casein micelles in skimmed goat milk at low temperature[J].Journal of Food Science and Biotechnology, 2021, 40(8):27-36.
[20] LAW A J R.Effects of heat treatment and acidification on the dissociation of bovine casein micelles[J].Journal of Dairy Research, 1996, 63(1):35-48.
[21] LIU D Z, WEEKS M G, DUNSTAN D E, et al.Temperature-dependent dynamics of bovine casein micelles in the range 10-40 ℃[J].Food Chemistry, 2013, 141(4):4081-4086.
[22] POULIOT Y, BOULET M, PAQUIN P.Observations on the heat-induced salt balance changes in milk I.Effect of heating time between 4 and 90 ℃[J].Journal of Dairy Research, 1989, 56(2):185-192.
[23] 王园园, 程英华, 刘大松, 等.电泳与质谱技术联用鉴定牛乳酪蛋白分子酶法脱磷酸化修饰[J].食品与发酵工业, 2015, 41(4):1-5.
WANG Y Y, CHENG Y H, LIU D S, et al.Identification of enzymatically dephosphorylated casein by electrophoresis and mass spectrometry[J].Food and Fermentation Industries, 2015, 41(4):1-5.
[24] HORNE D S.Casein interactions:Casting light on the Black boxes, the structure in dairy products[J].International Dairy Journal, 1998, 8(3):171-177.
[25] 刘珂, 高金燕, 袁锦, 等.动静态光散射技术在蛋白质研究中的应用进展[J].高分子通报, 2016(12):16-21.
LIU K, GAO J Y, YUAN J, et al.Progress in application of dynamic and static light scattering on protein[J].Polymer Bulletin, 2016(12):16-21.
[26] HUPPERTZ T, GAZI I, LUYTEN H, et al.Hydration of casein micelles and caseinates:Implications for casein micelle structure[J].International Dairy Journal, 2017, 74:1-11.
[27] 杨同香, 陈俊亮, 吴孔阳, 等.水牛奶酪蛋白胶束结构的荧光光谱研究[J].食品科学, 2014, 35(23):84-87.
YANG T X, CHEN J L, WU K Y, et al.Structure of casein micelles from buffalo milk determined by fluorescence spectroscopy[J].Food Science, 2014, 35(23):84-87.