油凝胶是由液态油和凝胶剂形成的一种热可逆的塑性脂肪,其中的凝胶剂通过自组装方式形成三维网络结构,液态油被包裹在三维网络结构中而失去流动性,使整个体系呈现为具有黏弹性的固态或半固态[1]。本课题组以牡丹籽油为连续相,以植物甾醇和卵磷脂为凝胶剂制备了高含量α-亚麻酸、植物甾醇和卵磷脂的油凝胶(α-亚麻酸、植物甾醇和卵磷脂含量分别为31.325、8.000~12.800、8.000~3.200 g/100 g样品)。该产品可用作功能性膳食补充剂,补充健康成人每日所需的α-亚麻酸[2]、植物甾醇[3]和卵磷脂[4]。但由于油凝胶具有一定的硬度和黏弹性,且呈固态,这就限制了其在亲水基质食品中的应用。此外,由于油凝胶具有较高的熔点,使得其在人体肠消化环境下的生物利用度较低[5]。因此,如何提高富含α-亚麻酸、植物甾醇和卵磷脂的牡丹籽油凝胶的生物利用度,扩大其亲水基食品体系中的应用已成为当前急需解决的问题。
水包油乳液体系一般可用来包埋、保护和投递亲脂性生物活性物质,在食品加工和制药等生产领域受到广泛关注。通常可通过高速剪切、高压均质等技术来制备不同粒径的乳液,其粒径大小为1~105 nm[6]。在乳液体系的构建中,乳化剂起着至关重要的作用。目前,常用的乳化剂有乳清分离蛋白、酪蛋白、大豆分离蛋白等,它们对环境敏感,易在等电点或高离子强度下发生聚集、絮凝和沉淀,导致乳液体系失稳[7-8]。与蛋白质乳化剂相比,辛烯基琥珀酸(octenyl succinic anhydride,OSA)淀粉不仅价格低,而且对环境具有更高耐受力,受体系pH和离子强度的影响较小[9],有利于在各种酸/碱性食品体系中的应用。但值得注意的是,牡丹籽油凝胶乳液体系的构建与普通水包油乳液体系存在着显著的差异。普通乳液的芯材是呈液态的脂类物质,在室温下可通过高速剪切和高压均质形成微小的液滴,乳化剂分子则定向分布于液滴的油水界面,降低其界面张力并形成稳定的界面膜,使得乳状液保持稳定。牡丹籽油凝胶乳液的芯材在室温(25 ℃)或低于室温的情况下呈固态,因此在高速剪切时如果温度过低,会导致油相不能分散形成微小的颗粒;另外,已分散开的油相也会随着乳液体系温度的降低,发生分子自组装,转变成具有特定三维空间结构的固体形态,这是否会影响原来油水界面的表面张力和乳化剂在两相界面间的分布目前尚无相关报道;第三,油凝胶乳液的分散相除了含有牡丹籽油外还含有较高浓度的植物甾醇(C3位含有羟基)和卵磷脂(含有磷酸基团),这有可能会影响常规乳化剂在油滴表面的分布形式并最终影响油水界面的表面张力和乳液体系的稳定性。综上可知,牡丹籽油凝胶乳液与普通水包油乳液在芯材的物理和化学特性上存在着较大的差异,这可能会影响OSA淀粉在油水界面的分布模式,并最终影响乳液的稳定性,然而目前尚无有关这方面的研究报道。
鉴于此,本研究选用OSA淀粉为乳化剂制备牡丹籽油凝胶乳液,考察了pH、盐离子种类及强度、热处理对乳液稳定性的影响,为营养强化型牡丹籽油凝胶乳液的制备及其在不同食品体系中的应用提供技术参考,同时也为后续进一步探讨凝胶乳液中α-亚麻酸、植物甾醇和卵磷脂的生物利用度提供必要基础。
1 材料与方法
1.1 材料与试剂
OSA淀粉(purity gum ultra®),宜瑞安食品配料公司;牡丹籽油,洛阳国花坊牡丹生物科技有限公司;植物甾醇(β-谷甾醇41.8%,豆甾醇31.2%,菜油甾醇23.4%,菜籽甾醇0.2%,总植物甾醇96.6%),西安天宝生物科技有限公司;大豆卵磷脂(纯度≥90%),上海阿拉丁生化科技股份有限公司;KH2PO4、Na2HPO4、NaOH(分析纯),天津德恩化学试剂有限公司;浓盐酸(分析纯),国药集团化学试剂有限公司;NaN3(纯度>99%),Sigma公司。出于防腐目的,所有制备的水相均含有0.02%(质量分数)的NaN3。
1.2 仪器与设备
高压均质机,上海台驰轻工装备有限公司;DHR-2流变仪,沃特世科技(上海)有限公司;Leica-DM2000型光学显微镜,瑞士Leica Microsystems公司;Batersize 2600激光粒度仪、BeNano 180 Zeta纳米粒度及Zeta电位分析仪,丹东百特有限公司;HJ-6A磁力加热搅拌器,常州金坛仪器制造有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义予华仪器有限责任公司;PHS-3E台式 pH计,上海仪电科学仪器股份有限公司;BCD-312 WDPV冰箱,青岛海尔股份有限公司。
1.3 实验方法
1.3.1 植物甾醇-卵磷脂-牡丹籽油凝胶乳液的制备
油相:制备10.0 g油凝胶,其中含16%(质量分数)的凝胶剂。准确称取8.4 g牡丹籽油,加热搅拌至80 ℃,然后将1.6 g不同配比的复合凝胶剂(甾醇与卵磷脂质量比分别为5∶5、6∶4、7∶3和8∶2)分别加入已经预热的牡丹籽油中,继续加热搅拌直至完全溶解(约20 min)。
水相:将2%(质量分数)的OSA淀粉溶于缓冲液中,磁力搅拌至完全溶解,并将其于4 ℃静置12 h,使淀粉粒子充分水合。所用缓冲溶液为1/15 mol/L的缓冲液:V(Na2HPO4)∶V(KH2PO4)=7∶3,pH值为7.17。
凝胶乳液制备:将20%(质量分数)油相与80%(质量分数)的水相均加热至60 ℃,利用手持式高速分散器(3 000 r/min)预均质2 min,然后将其送入两级高压均质机中,在300 bar的压力下再次均质3 min,即可得到色泽均匀的乳液。乳液加入0.02%(质量分数)NaN3作为抑菌剂,然后放置于4 ℃冰箱冷藏待测。
1.3.2 油凝胶乳液的显微镜观察
用漩涡振荡器混合均匀后将乳液滴于载玻片上,盖上盖玻片,采用光学显微镜观察液滴形态(10倍镜),并用显微镜上连接的数字图像处理软件动态获取液滴分布图像。
1.3.3 油凝胶乳液粒径的测定
评价乳化液稳定性的最常用方法是测定乳化液的粒径。采用Bettersize2600激光粒度分布仪测定乳液液滴的粒径。将乳液逐滴加入样品池中,直到混合溶液的遮光度达到10%~20%。测定条件:以水作为分散剂(折射率为1.45),分散剂折射率为1.33,循环转速为1 200 r/min。每个样品测量3次,记录样品的粒径分布及平均粒径值。
1.3.4 油凝胶乳液Zeta电位的测定
Zeta电位是预测乳液稳定性的重要指标[10]。采用Zeta纳米粒度及Zeta电位分析仪于25 ℃测定植物甾醇-卵磷脂-牡丹籽油凝胶乳液的Zeta电位。取适量凝胶乳液,用去离子水稀释后,取大约1 mL样品于样品池中,进行Zeta电位的测定。测定条件:测量温度25 ℃,平衡时间1 min,每个样品测定3次,取平均值。
1.3.5 pH对油凝胶乳液稳定性的影响
将1.3.1节制备好的4种凝胶乳液分装于5 mL的玻璃瓶中,每管大约4 mL,并标号。配制0.1 mol/L的HCl溶液和0.1 mol/L的NaOH溶液,来调节凝胶乳液的pH值。原乳液的pH值为7.17。将乳液样品的pH值分别调至3、4、5、6、7、8、9,并混合均匀,测定样品的粒径和Zeta电位,由此来评估凝胶乳液的稳定性。
1.3.6 盐离子对油凝胶乳液稳定性的影响
使用饱和NaCl、CaCl2、AlCl3溶液将甾醇-卵磷脂-牡丹籽油凝胶乳液稀释10 倍,使得最终浓度为100、200、300、400、500 mmol/L,测定盐离子处理后样品的粒径和Zeta电位,采用平均粒径图、粒径分布图等来评估乳液在不同离子强度下的稳定性。
1.3.7 热处理对油凝胶乳液稳定性的影响
将1.3.1节制备好的4种凝胶乳液分装于10 mL离心管中,每管大约8 mL,进行水浴加热。加热温度分别为40、60、80、100 ℃,加热时间30 min。将热处理后的样品混合均匀,并测定其粒径及Zeta电位。
1.4 数据统计分析
样品均平行测定3次,结果以平均值±标准偏差的形式表示。应用Excel 2016和Origin 2021软件对所有数据进行处理和分析。
2 结果与分析
2.1 植物甾醇-卵磷脂-牡丹籽油凝胶乳液的基本特征
高压均质过程中,均质腔内产生高速剪切、空化和撞击等破坏作用,打破油水界面,OSA淀粉分子中亲水的羧酸基团会伸向水中,疏水的辛烯基长链会嵌入油中,而复杂的多糖长链则会在油水界面上展开,形成一层致密、连续、厚实的界面膜。这层膜结构,不仅可以增加油水界面的强度,还有很强的空间位阻效应,使颗粒间不容易因碰撞而发生聚集[11],从而起到稳定甾醇-卵磷脂-油凝胶乳液的作用。
利用高压均质机制备了4种(甾醇与卵磷脂质量比为5∶5、6∶4、7∶3、8∶2)甾醇-卵磷脂-油凝胶乳液(简称分别为E55、E64、E73、E82),它们的粒径主要分布在0.1~10 μm,呈单峰分布(图1),平均粒径D[4,3]分别为1.079、1.957、2.871、3.601 μm,中位径D50分别为0.832、1.601、2.196、2.303 μm(表1)。植物甾醇与卵磷脂的质量比从5∶5增加到8∶2,相应乳液的粒径跨度由1.776增加到2.915(表1;跨度越小,代表粒度越均匀、尺寸一致性高)。结合光学显微镜观察(图2)可知,E55和E64乳液液滴大小均匀,尺寸一致性高;而E73和E82密集分布着各种尺寸的球形液滴,尺寸一致性较低,这与乳液的粒径测定结果相符。乳液的粒径和分散性是由均质空化作用所产生的高剪切力(能量输入)和乳液流变学特性共同决定[12]。在能量足够打破原有相平衡条件下,油相中凝胶剂的比例对乳液粒径和分散性产生较大的影响。当甾醇与卵磷脂质量比由5∶5增加到8∶2时,即在较大量甾醇与少量的晶体改良剂(卵磷脂)复配的情况下,牡丹籽油凝胶中形成的三维网络结构更加紧密,其熔点、硬度和黏度也随之增加[13-14],因此当不同强度的油凝胶受到同等能量的输入时,结构紧密的油凝胶不易分散成小颗粒,从而产生粒径更大的乳液液滴。
表1 牡丹籽油凝胶乳液的粒径及Zeta电位
Table 1 Particle size and Zeta potential value of peony seed oleogel emulsion
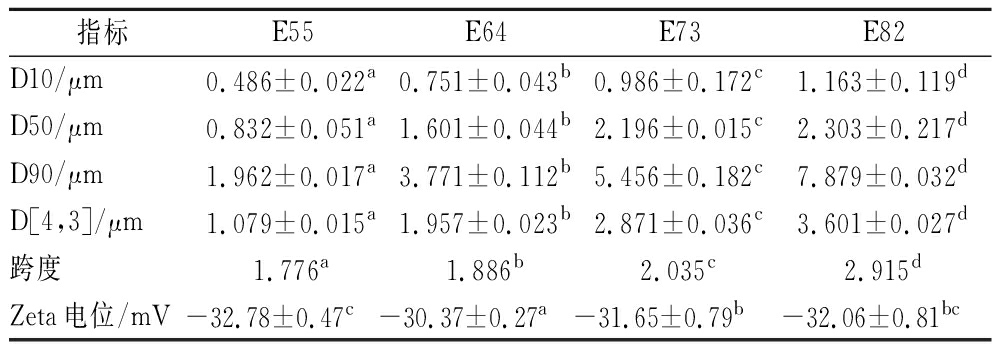
指标E55E64E73E82D10/μm0.486±0.022a0.751±0.043b0.986±0.172c1.163±0.119dD50/μm0.832±0.051a1.601±0.044b2.196±0.015c2.303±0.217dD90/μm1.962±0.017a3.771±0.112b5.456±0.182c7.879±0.032dD[4,3]/μm1.079±0.015a1.957±0.023b2.871±0.036c3.601±0.027d跨度1.776a1.886b2.035c2.915dZeta电位/mV-32.78±0.47c -30.37±0.27a -31.65±0.79b -32.06±0.81bc
注:跨度=(D90-D10)/D50;不同小写字母代表4种油凝胶乳液差异显著(P<0.05)(下同)。

a-E55;b-E64;c-E73;d-E82
图1 牡丹籽油凝胶乳液的粒径分布
Fig.1 Particle size distribution of peony seed oleogel emulsion

a-E55;b-E64;c-E73;d-E82
图2 牡丹籽油凝胶乳液的微观形貌(10×)
Fig.2 Microtopography of peony seed oleogel emulsion (10×)
样品的Zeta电位大小决定液体中粒子是稳定存在还是趋向于絮凝(粘连在一起)。在乳液中,颗粒所带电荷的情况是影响颗粒之间是否会絮凝和/或结合的一个重要因素。如表1所示,本试验制备的4种凝胶乳液均表现出良好的物理稳定性。4种油凝胶乳液具有较高的负电荷且大小相近,这是因为OSA淀粉的酯化改性是在碱性条件下完成,酯化反应为玉米淀粉纳米颗粒的表面连接了疏水性辛烯基琥珀酸酯基团,致使淀粉颗粒带负电[11]。
2.2 pH对甾醇-卵磷脂-牡丹籽油凝胶乳液粒径的影响
食品和饮料的pH值是影响产品口感和保质期的重要指标,如常见的饮料中有酸性的碳酸饮料和乳饮料,也有弱碱性的功能饮料。因此,有必要研究pH值对凝胶乳液稳定性的影响,这对其后续在不同pH食品体系中的应用具有重要的意义。将4种凝胶乳液的pH值分别调至3、4、5、6、7、8、9,对其粒径进行测定,所得粒径分布图及平均粒径如图3和图4所示。
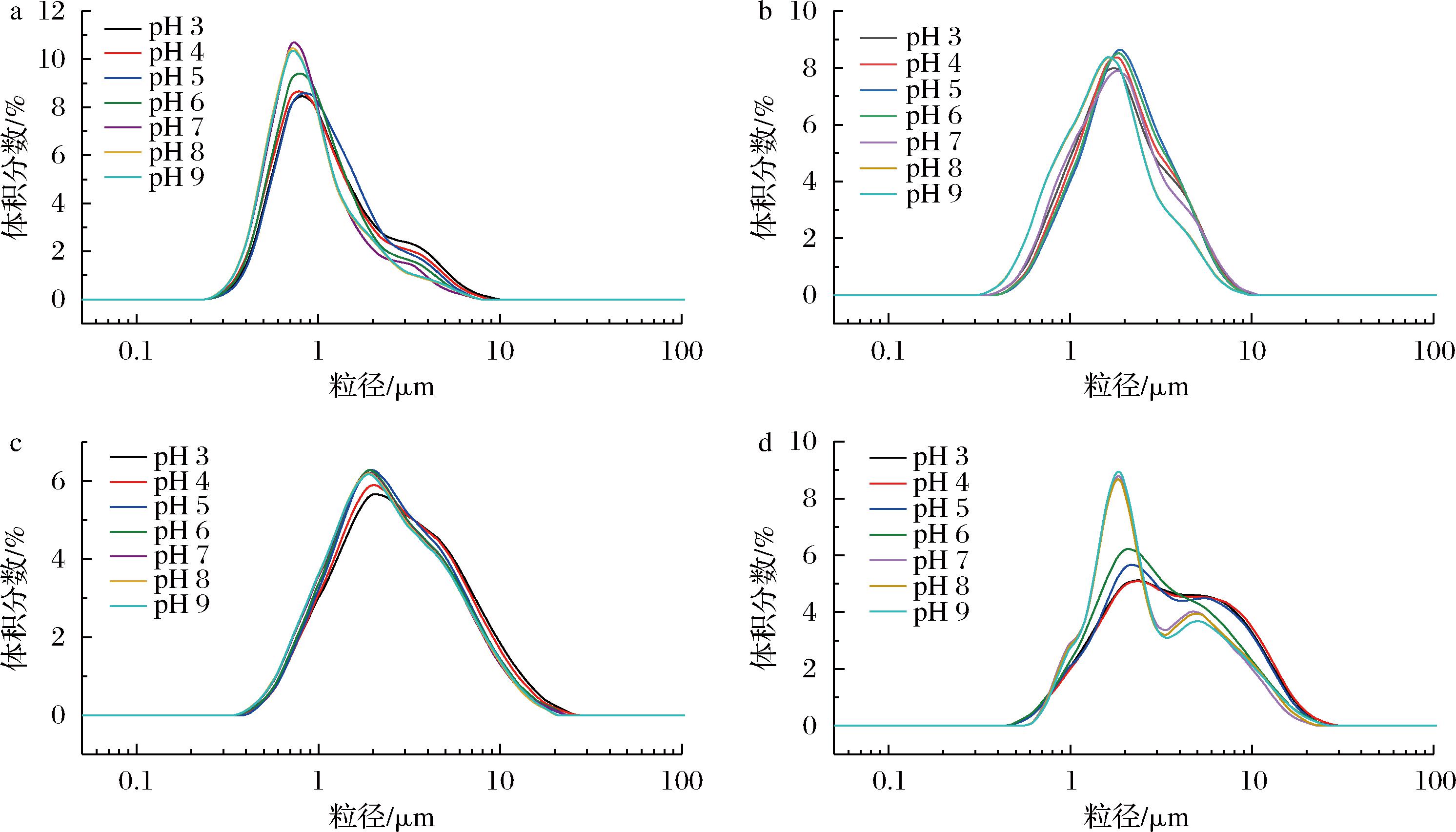
a-E55;b-E64;c-E73;d-E82
图3 pH对牡丹籽油凝胶乳液粒径分布的影响
Fig.3 Effect of pH on particle size distribution of peony seed oleogel emulsion
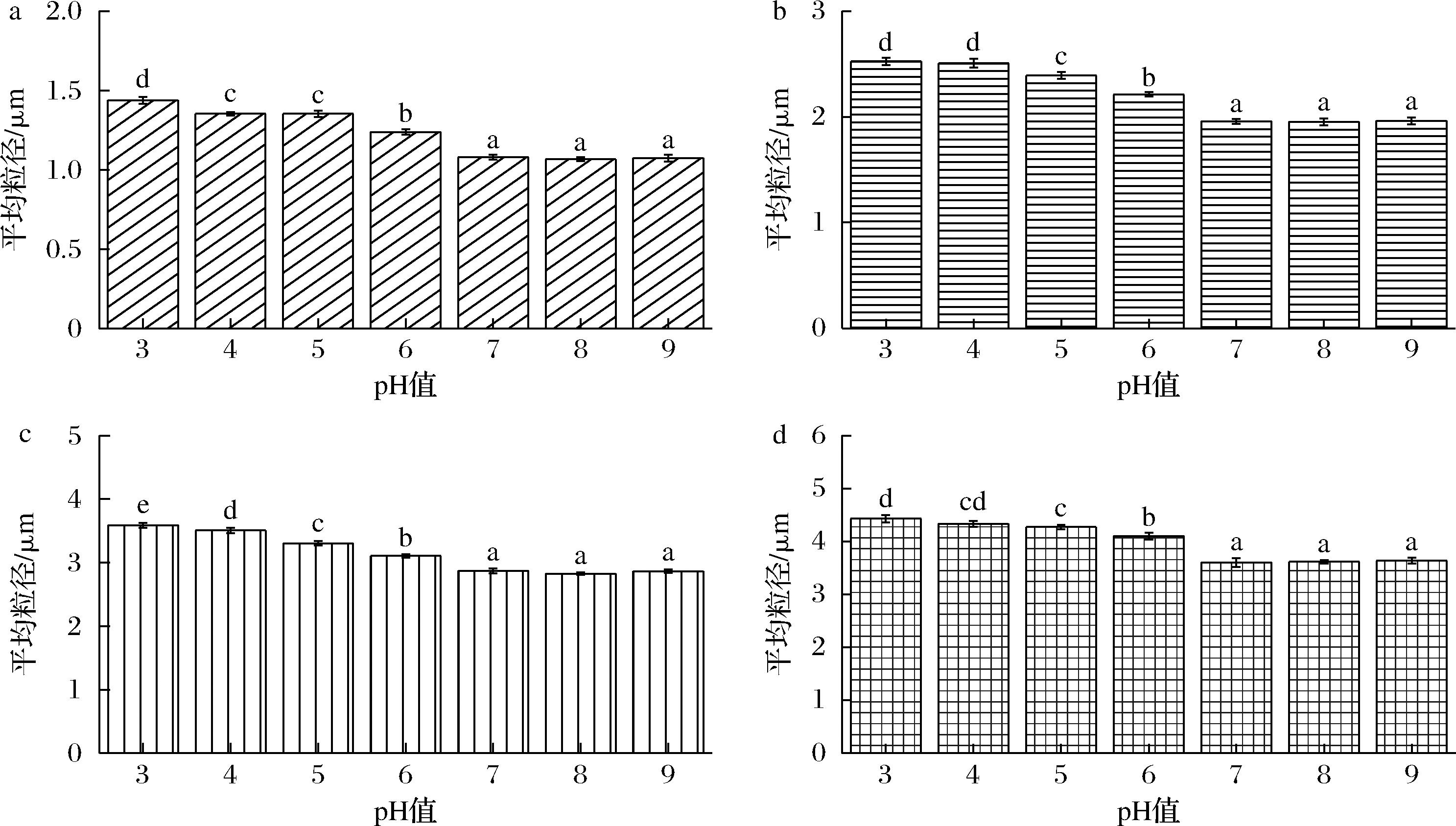
a-E55;b-E64;c-E73;d-E82
图4 pH对牡丹籽油凝胶乳液平均粒径的影响
Fig.4 Effect of pH on the average particle size of peony seed oleogel emulsion
注:不同小写字母代表4种油凝胶乳液差异显著(P<0.05)(下同)。
原始乳液(pH 7.1)经酸(pH 3~6)处理后,粒径分布(图3)发生显著变化,平均粒径(图4)均呈现增大的趋势。在pH 3环境下,4种凝胶乳液的平均粒径是原始乳液平均粒径的1.33、1.29、1.25、1.23倍,平均粒径增长幅度均大于20%。相比而言,E82油凝胶乳液的耐酸性更好。在弱碱环境下,凝胶乳液的粒径分布(图3)及平均粒径(图4)与原始乳液相比均未发生显著变化。淀粉在酸性条件下发生质子化,H+很容易与OSA淀粉分子结构中的R-COO-相互吸附,导致油水界面膜表面电负性减弱,OSA淀粉分子间的静电排斥效应减弱,单个分子占有空间缩小,更多游离的OSA分子被吸附到界面处,进而导致粒径增大。由于OSA改性淀粉在碱性条件(pH 8~9)下分子中的R-COO-基团会不断发生电离,乳液油水界面膜表面的负电荷增多,静电斥力增大,使OSA淀粉分子充分伸展,单个分子在油水界面所占有的空间范围变大,此时界面膜的空间位阻效应阻拦体系中游离态的OSA淀粉分子的进一步吸附[15],因此弱碱环境对牡丹籽油凝胶乳液的粒径没有显著影响。这与杨贵妃等[16]对OSA淀粉乳液pH稳定性的研究结果类似。总之,经不同pH处理的4种凝胶乳液均未发生明显的相分离情况,其中酸性环境会使凝胶乳液分散相颗粒增大,对乳液的稳定性产生一定的不利影响,而弱碱性条件下乳液分散相颗粒无显著变化,乳液稳定性好。
2.3 pH对甾醇-卵磷脂-牡丹籽油凝胶乳液Zeta电位的影响
为了进一步分析pH对牡丹籽油凝胶乳液稳定性的影响,对其Zeta电位进行了测定,结果如表2所示。不同pH条件下,液滴表面的Zeta电位始终为负值,当pH值从7至3依次递减时,4种油凝胶乳液液滴表面的Zeta电位绝对值均有不同程度的减小,其中E82的Zeta电位绝对值从32.06 mV减小到28.31 mV,减小幅度为11.70%,而E55的减小幅度最大,为17.54%;当pH值从7增大到9时,4种凝胶乳液的Zeta电位绝对值均有增大的趋势,其中E55的Zeta电位绝对值由32.78 mV增加到34.51 mV,增长幅度达5.27%,而E82的增长幅度最大,为6.39%。以上结果说明pH对植物甾醇-卵磷脂牡丹籽油凝胶乳液的Zeta电位影响显著,这是由于pH能影响阴离子型乳化剂(OSA淀粉)在水溶液中的解离,改变其在界面膜表面的吸附性能[17],进而影响液滴表面的Zeta电位。酸性条件下,H+与带负电的淀粉分子结合,导致乳化界面膜表面负电荷减少,电位绝对值也随之减小,进而对油凝胶乳液的稳定性产生一定的不利影响。在弱碱条件下(pH 8~9),分子结构中的R-COO-会不断发生电离,乳液液滴表面的负电荷增多,电位绝对值增大[15],使乳液稳定性增强。
表2 pH对牡丹籽油凝胶乳液Zeta电位的影响
Table 2 Effects of pH on Zeta potential of peony seed oleogel emulsion
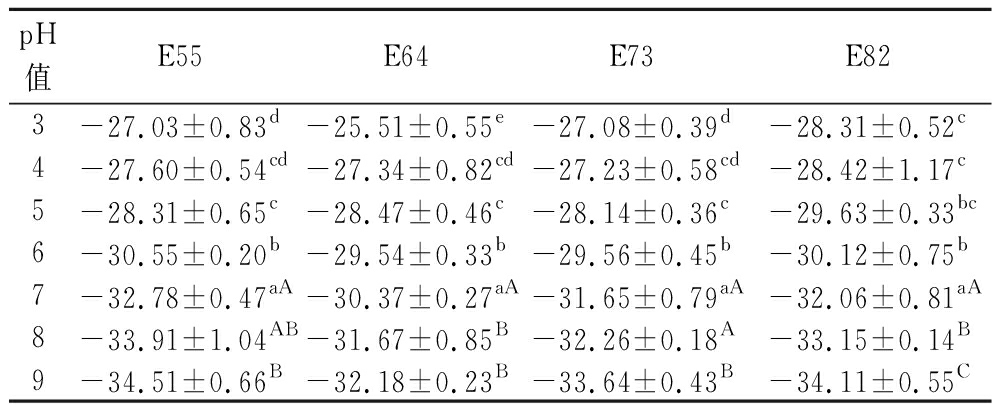
pH值E55E64E73E823-27.03±0.83d-25.51±0.55e-27.08±0.39d-28.31±0.52c4-27.60±0.54cd-27.34±0.82cd-27.23±0.58cd-28.42±1.17c5-28.31±0.65c-28.47±0.46c-28.14±0.36c-29.63±0.33bc6-30.55±0.20b-29.54±0.33b-29.56±0.45b-30.12±0.75b7-32.78±0.47aA-30.37±0.27aA-31.65±0.79aA-32.06±0.81aA8-33.91±1.04AB-31.67±0.85B-32.26±0.18A-33.15±0.14B9-34.51±0.66B-32.18±0.23B-33.64±0.43B-34.11±0.55C
注:同一列中不同小写字母表示pH 3~7平均值差异显著(P<0.05);同一列中不同大写字母表示pH 7~9平均值差异显著(P<0.05)。
2.4 盐离子对植物甾醇-卵磷脂-牡丹籽油凝胶乳液粒径的影响
盐离子是影响乳液稳定性的一个重要因素,本研究考察了常见一价、二价和三价离子(Na+、Ca2+、Al3+)及离子强度(0~500 mmol/L)对凝胶乳液(pH 7.17)稳定性的影响,结果如图5~图8所示。
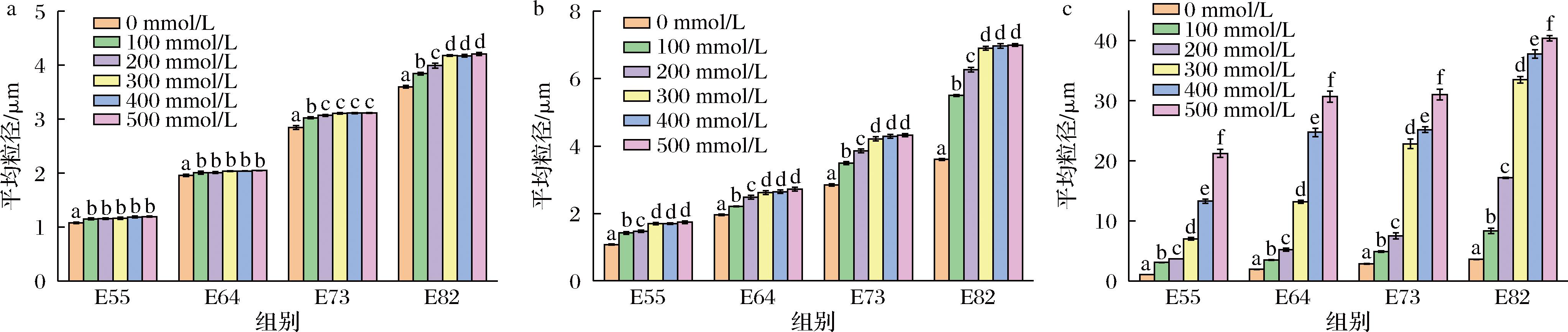
a-NaCl;b-CaCl2;c-AlCl3
图5 不同盐离子及离子强度对牡丹籽油凝胶乳液平均粒径的影响
Fig.5 Effects of different salt ions and ion concentrations on average particle size of peony seed oleogel emulsion
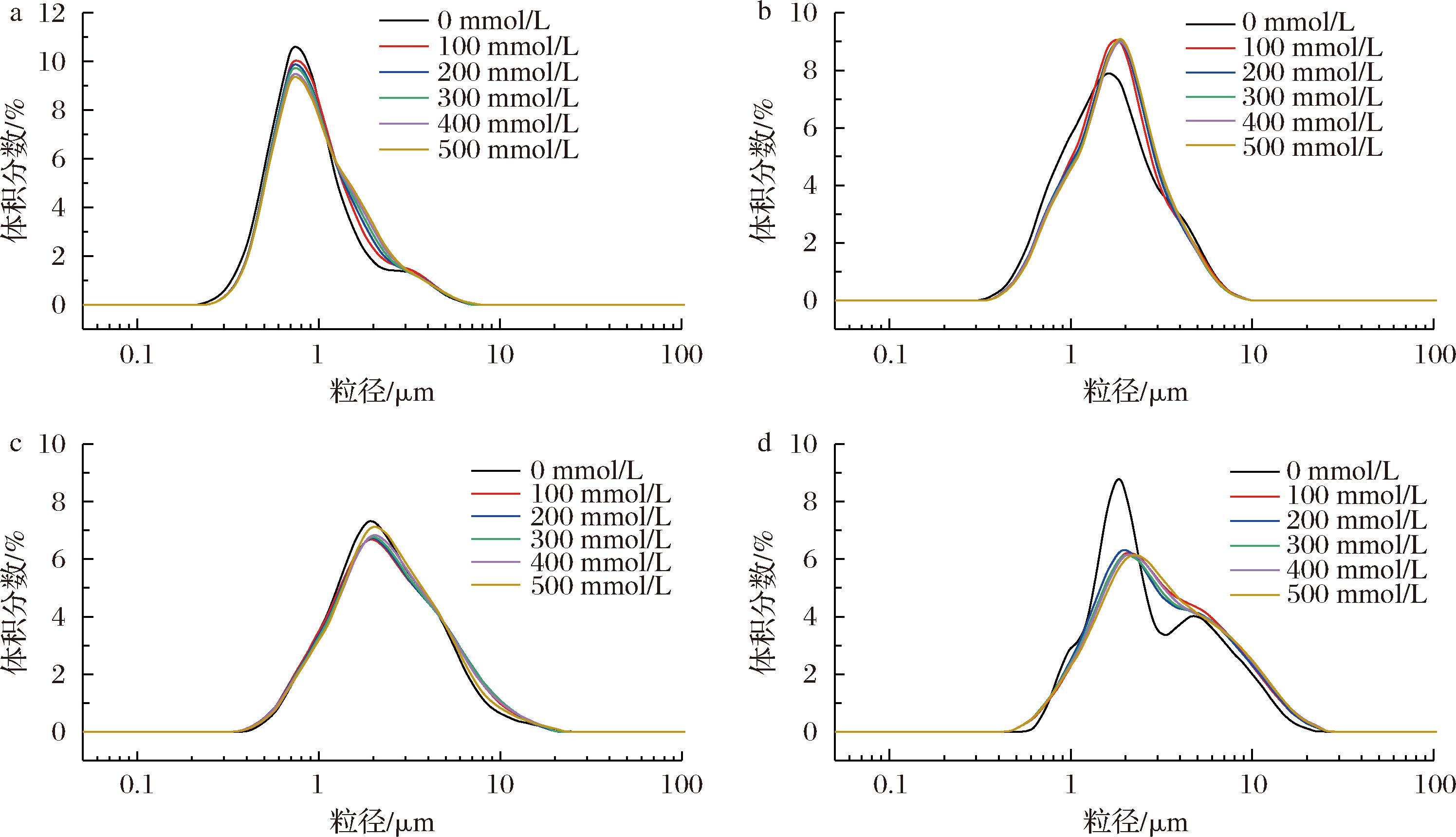
a-E55;b-E64;c-E73;d-E82
图6 NaCl浓度对牡丹籽油凝胶乳液粒径分布的影响
Fig.6 Effect of NaCl concentration on particle size distribution of peony seed oleogel emulsion
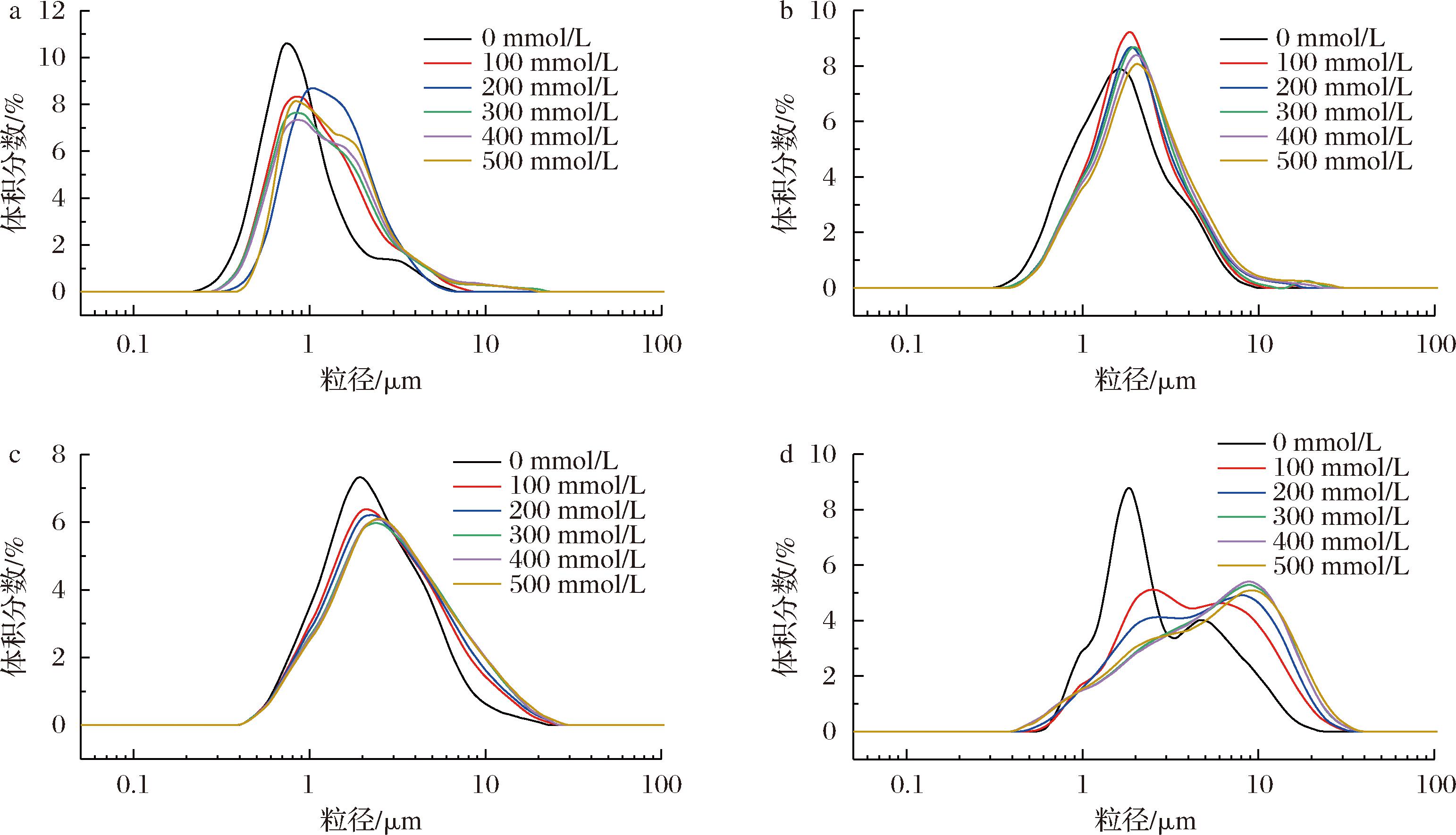
a-E55;b-E64;c-E73;d-E82
图7 CaCl2浓度对牡丹籽油凝胶乳液粒径分布的影响
Fig.7 Effect of CaCl2 concentration on particle size distribution of peony seed oleogel emulsion
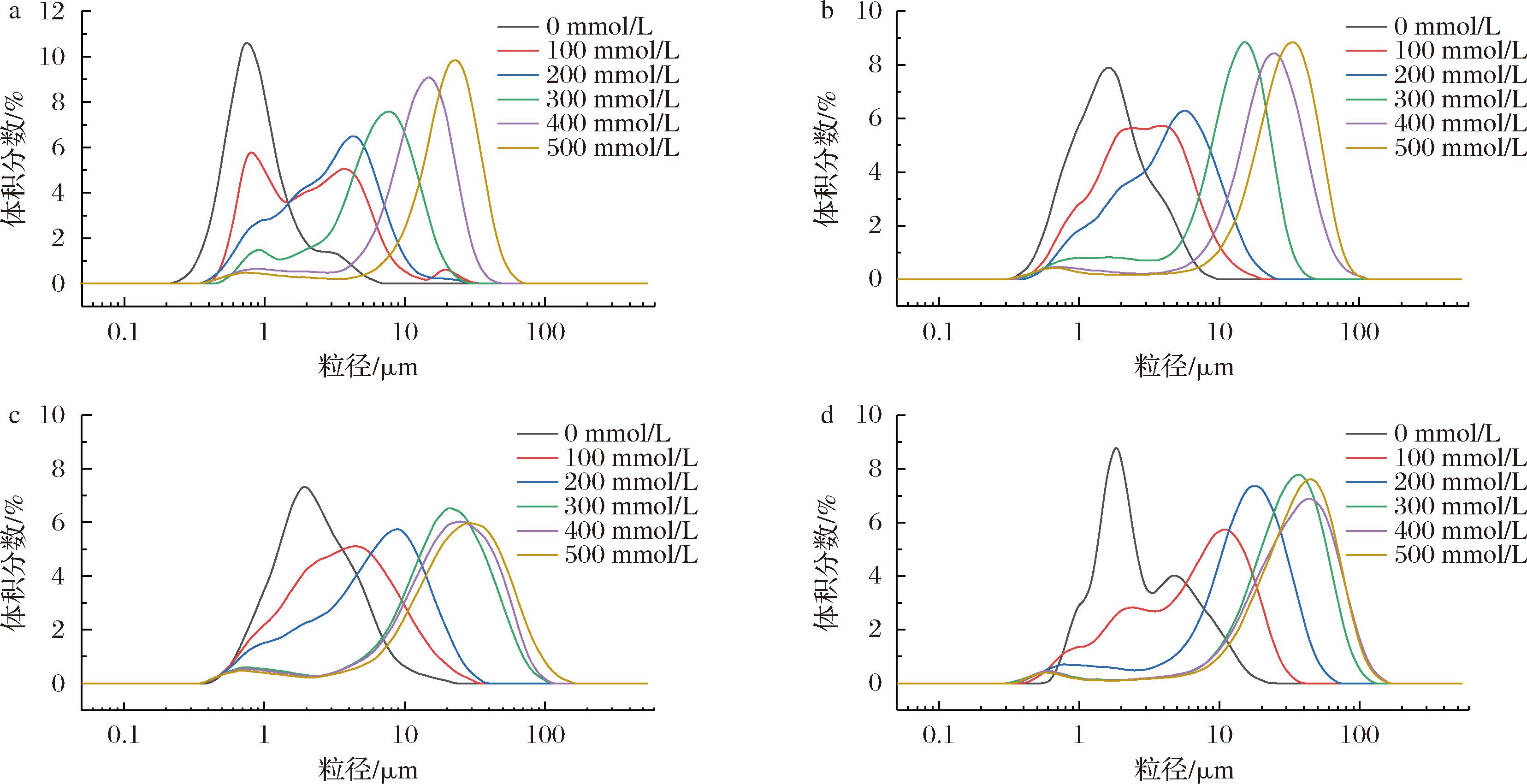
a-E55;b-E64;c-E73;d-E82
图8 AlCl3浓度对牡丹籽油凝胶乳液粒径分布的影响
Fig.8 Effect of AlCl3 concentration on particle size distribution of peony seed oleogel emulsion
图5显示了不同离子强度的NaCl、CaCl2、AlCl3对植物甾醇-卵磷脂-牡丹籽油凝胶乳液(pH 7.17)平均粒径的影响。当Na+浓度由0 mmol/L增大到100 mmol/L 时,凝胶乳液分散相的平均粒径略微增大(图5-a),粒径增长幅度均不超过10%,当Na+浓度由100 mmol/L增大到500 mmol/L时,E55和E64组的平均粒径未发生显著变化,而E73和E82组发生变化,但粒径增幅均在10%以内。经NaCl处理(100~500 mmol/L)的乳液的粒径分布(图6)变化不明显,均呈单峰分布,粒径一致性高。从图5-b可以看出,Ca2+对凝胶乳液的影响程度大于Na+。当Ca2+浓度从0 mmol/L增加到100 mmol/L时,4种凝胶乳液的粒径分别由1.079、1.957、2.871、3.601 μm增长到了1.423、2.211、3.492、5.502 μm,粒径增长幅度均大于20%。当Ca2+浓度进一步增加(100~500 mmol/L)时,4种凝胶乳液的分散相粒径均呈增加趋势,增加幅度分别为22.34%、23.92%、23.71%和27.17%。相较而言,Al3+的添加对凝胶乳液分散相的粒径分布及平均粒径均有极显著影响(图5-c和图8)。随着Al3+浓度的增大,粒径分布(图8)发生明显右移;当Al3+由0 mmol/L增加到500 mmol/L时,E55、E64、E73和E82的平均粒径增长倍数分别为19.68、15.68、10.88和11.20,平均粒径显著增大。
综上,盐离子种类对凝胶乳液粒径的影响强弱顺序为:Al3+>Ca2+>Na+。Na+对凝胶乳液粒径的影响较弱,这可能与Na+对乳液油水界面膜的静电排斥力影响较小有关。Ca2+对乳液粒径有一定影响,这主要是Ca2+的添加减小了阴离子淀粉分子之间的静电排斥力,增加了淀粉分子间发生缔合的可能性,使得分散相表面聚集的淀粉分子增加[18],粒径增加。相较而言,Al3+具有典型的缺电子结构,能和淀粉中的羟基发生强配位效应[19],形成8电子稳定结构,生成络合物,致使凝胶乳液粒径极显著增大,这可能会对乳液稳定性产生不利的影响。
2.5 盐离子对植物甾醇-卵磷脂-牡丹籽油凝胶乳液Zeta电位的影响
Zeta电位的变化反映了颗粒表面带电基团数量和密度的差异[20]。由图9可知,随着3种盐离子(Na+、Ca2+、Al3+)浓度的增加,4种油凝胶乳液的Zeta电位均呈显著的增加趋势。其中,当Na+从0 mmol/L增加到500 mmol/L时,4种油凝胶乳液的Zeta电位绝对值从32.78、30.37、31.64、32.06 mV分别减小到20.79、21.97、22.52、24.85 mV,电位绝对值减小了36.58%、27.67%、28.84%、22.49%。当Ca2+从0 mmol/L增加到500 mmol/L时,4种油凝胶乳液的Zeta电位分别减小到2.55、0.37、0.36、1.03 mV,电位绝对值减小了92.22%、98.78%、98.83%、96.78%。当Al3+从0 mmol/L增加到500 mmol/L时,Zeta电位绝对值减小到26.48、29.92、30.15、28.64。总体而言,盐离子(Na+、Ca2+、Al3+)对油凝胶乳液的Zeta电位均有显著影响,当盐离子浓度在从0 mmol/L增加到500 mmol/L时,4种油凝胶乳液的Zeta电位均在不断增大,但未发生破乳现象。

a-NaCl;b-CaCl2;c-AlCl3
图9 盐离子浓度对牡丹籽油凝胶乳液Zeta电位的影响
Fig.9 Effect of salt ions concentration on Zeta potential of peony seed oil oleogel emulsion
综合2.4节和2.5节可知,盐离子对凝胶乳液稳定性的影响是Zeta电位和分散相粒径变化共同作用的结果。通常而言,分散相粒径的增大会对乳液的稳定性产生不利的影响,而Zeta电位绝对值的增加则会对乳液的稳定性起到有益的作用[21-22]。在本研究中,Al3+对油凝胶乳液Zeta电位和分散相粒径的影响最大,当其添加浓度从0 mmol/L增加到500 mmol/L时,4种凝胶乳液分散相粒子平均粒径从1.079、1.957、2.871、3.601 μm分别增加到21.23、30.68、31.00、40.35 μm,Zeta电位从-32.78、-30.37、-31.64、-32.06 mV分别增加到26.48、29.92、30.15、28.64 mV;此情况下乳液并没有随着分散相粒径的增大而失稳,这与乳液Zeta电位绝对值较高,粒子间的静电斥力较大,阻碍粒子相互靠近和絮凝有关[23]。当Ca2+浓度为500 mmol/L时,4种油凝胶乳液Zeta电位绝对值较小,分别为2.55、0.37、0.36、1.03 mV,此情况下乳液也并未发生明显的破乳现象,这可能与由OSA淀粉形成的乳化界面膜的结构比较稳定有关,其更深层次的机理还有待进一步研究。Na+的添加对油凝胶乳液Zeta电位有显著影响,这是由于Na+与体系中带负电的淀粉分子发生静电吸引,且随着Na+浓度的增加,体系中更多的负电荷被中和,导致乳液的Zeta电位逐渐增大(电位绝对值减小)。
2.6 热处理对植物甾醇-卵磷脂-牡丹籽油凝胶乳液粒径的影响
温度是影响乳液稳定性最为重要的参数。当温度由4 ℃增加到40 ℃时,油凝胶乳液的粒径分布图几乎重叠(图10),平均粒径(表3)无明显变化;当温度达60 ℃时,其粒径分布均发生明显右移,甚至出现多峰现象(如图10-b、图10-d),表明虽然主要粒径分布仍在1~10 μm,但乳液中大粒径颗粒的比例明显增多。与4 ℃相比,经60 ℃处理的油凝胶乳液的平均粒径显著增大(表3),其平均粒径分别是1.987、2.860、3.549、4.302 μm,是原始乳液的1.84、1.46、1.23、1.19倍,但未发生破乳现象;经80 ℃和100 ℃处理的样品均发生明显的破乳现象,油脂漂浮在上层,这主要是由于高温破坏了界面膜的结构,使得油相外泄并聚集,因此该情况下不进行粒径及Zeta电位的测定。
表3 热处理后牡丹籽油凝胶乳液的平均粒径
Table 3 Average particle size of peony seed oil oleogel emulsion after heat treatment
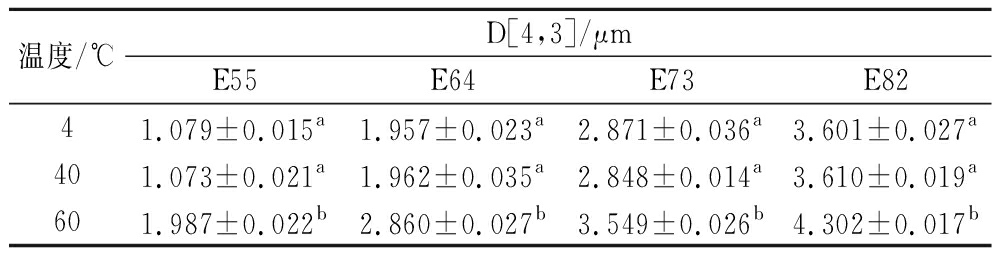
温度/℃D[4,3]/μmE55E64E73E8241.079±0.015a1.957±0.023a2.871±0.036a3.601±0.027a401.073±0.021a1.962±0.035a2.848±0.014a3.610±0.019a601.987±0.022b2.860±0.027b3.549±0.026b4.302±0.017b

a-E55;b-E64;c-E73;d-E82
图10 热处理后牡丹籽油凝胶乳液的粒径分布
Fig.10 Particle size distribution of peony seed oil oleogel emulsionion after heat treatment
与4、40 ℃相比,在较高温度条件(60 ℃)下,粒子不规则运动加剧,OSA淀粉分子乳化性降低[24];同时,由于温度升高,作为连续相的淀粉溶液黏度降低,分散相(牡丹籽油凝胶)聚结的可能增大。综合温度对黏度和粒子不规则运动的双重作用[10],最终所得乳液的粒径显著增大。当甾醇与卵磷脂的质量比由5∶5增加到8∶2时,油凝胶的三维网络结构更加紧密,熔点更高,热稳定性更好,因此凝胶乳液的热稳定性由高到低依次为E82>E73>E64>E55(图10)。
2.7 热处理对植物甾醇-卵磷脂-牡丹籽油凝胶乳液Zeta电位的影响
表4显示了4种凝胶乳液在不同温度(4~60 ℃)下平衡30 min后乳液油滴表面的Zeta电位。结果表明,温度升高,凝胶乳液的Zeta电位绝对值减小,乳液稳定性降低。当温度由4 ℃升高至40 ℃时,4种凝胶乳液的Zeta电位绝对值分别从32.78、30.37、31.65、32.06 mV减小到28.01、27.29、28.66、28.89 mV,绝对值分别减小14.55%、10.14%、9.44%、9.01%。当温度由40 ℃升高至60 ℃时,4种油凝胶乳液的Zeta电位绝对值分别减小20.34%、15.83%、13.15%、10.49%。这是由于随着温度升高,OSA淀粉分子在水溶液中呈舒展状态,其溶解度增大,且淀粉分子从界面逃逸的趋势增加,使得OSA淀粉在油滴表面的吸附量减小,因而随着温度升高,导致油滴表面负电荷减少,Zeta电位增大(电位绝对值减小),稳定性降低。张源等[15]用酯化淀粉乳化剂制备了高效氯氟氰菊酯水包油乳液,其乳液热稳定结果与本文相似。
表4 热处理后牡丹籽油凝胶乳液的Zeta电位 单位:mV
Table 4 Zeta potential of peony seed oil oleogel emulsion after heat treatment

温度/℃E55E64E73E824-32.78±0.47a-30.37±0.27a-31.65±0.79a-32.06±0.81a40-28.01±0.36b-27.29±0.21b-28.66±0.30b-28.99±0.33b60-22.31±0.16c-22.97±0.59c-24.89±0.28c-25.95±0.24c
3 结论
本研究制备了植物甾醇-卵磷脂-牡丹籽油凝胶乳液,并对其稳定性进行了评估。酸处理会导致油凝胶乳液分散相粒径和Zeta电位显著增大(电位绝对值减小),而弱碱(pH 7~9)处理乳液粒径则保持不变,Zeta电位绝对值增加;在pH 3~9乳液均表现出良好的稳定性,但弱碱条件下其稳定性更高。金属离子(Na+、Ca2+、Al3+)及其添加浓度的增加会导致凝胶乳液分散相粒径和Zeta电位增大,其中Al3+的影响最为显著,Ca2+次之,Na+的影响较弱;在本研究中,凝胶乳液在3种金属离子的作用下,均表现出良好的稳定性,未发生明显的破乳现象。油凝胶乳液对温度相对较敏感,在低温区(4~40 ℃)乳液稳定性良好;经60 ℃处理30 min,乳液粒径增大,Zeta电位绝对值减小,但乳液仍表现出良好的稳定性;经过高温(80~100 ℃)处理30 min,油凝胶乳液会发生破乳现象。此外,随着凝胶剂中植物甾醇比例的增加,牡丹籽油凝胶中形成的三维网络结构更加紧密,凝胶乳液的热稳定性最佳。本研究为营养强化型牡丹籽油凝胶乳液的制备及其在不同食品体系中的应用提供技术参考,同时也为后续进一步探讨凝胶乳液中α-亚麻酸、植物甾醇和卵磷脂的生物利用度提供必要基础。
[1] CHAVES K F, BARRERA-ARELLANO D, RIBEIRO A P B.Potential application of lipid organogels for food industry[J].Food Research International, 2018, 105:863-872.
[2] CUNNANE S, DREVON C, HARRIS B, et al.Report of the sub-committee on recommendations for intake of polyunsaturated fatty acids in healthy adults[J].Int Soc Study Fatty Acids Lipids, 2004, 9:2015.
[3] RAS R T, GELEIJNSE J M, TRAUTWEIN E A.LDL-cholesterol-lowering effect of plant sterols and stanols across different dose ranges:A meta-analysis of randomised controlled studies[J].The British Journal of Nutrition, 2014, 112(2):214-219.
[4] CANTY D J, ZEISEL S H.Lecithin and choline in human health and disease[J].Nutrition Reviews, 1994, 52(10):327-339.
[5] DONG L L, LYU M W, GAO X Y, et al.In vitro gastrointestinal digestibility of phytosterol oleogels:Influence of self-assembled microstructures on emulsification efficiency and lipase activity[J].Food &Function, 2020, 11(11):9503-9513.
[6] 陈美妙, 王浩楠, 邱哲瀚, 等.乳液基递送体系对植源活性物健康效应的影响研究进展[J].食品科学, 2022, 43(13):351-360.
CHEN M M, WANG H N, QIU Z H, et al.Progress in research on the enhanced health effects of phytochemicals by emulsion-based delivery systems[J].Food Science, 2022, 43(13):351-360.
[7] 舒心, 郭擎, 高彦祥.以蛋白质为基础物质的姜黄素传递体系研究进展[J].中国食品学报, 2022, 22(5):383-398.
SHU X, GUO Q, GAO Y X.Research progress on protein-based delivery systems for curcumin[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(5):383-398.
[8] 吴婉仪. 不同生物大分子乳化剂的乳化特性比较及构建的纳米乳液特性研究[D].广州:华南农业大学, 2018.
WU W Y.Emulsifying characteristics of different macromolecule emulsifiers and their effects on the preparation and characteristics of nanoemulsions[D].Guangzhou:South China Agricultural University, 2018.
[9] CHANAMAI R, MCCLEMENTS D J.Comparison of gum Arabic, modified starch, and whey protein isolate as emulsifiers:Influence of pH, CaCl2 and temperature[J].Journal of Food Science, 2002, 67(1):120-125.
[10] TSE K Y, REINECCIUS G A.Methods to Predict the Physical Stability of Flavor:Cloud Emulsion[M]//Flavor Technology.Washington, DC:American Chemical Society, 1997:172-182.
[11] TESCH S, GERHARDS C, SCHUBERT H.Stabilization of emulsions by OSA starches[J].Journal of Food Engineering, 2002, 54(2):167-174.
[12] 胡伟, 李湘洲, 穆园园.响应面法优化超声乳化制备油茶籽油纳米乳液及其稳定性研究[J].中国油脂, 2017, 42(9):14-19.
HU W, LI X Z, MU Y Y.Optimization of oil-tea camellia seed oil nanoemulsion prepared using ultrasonic emulsification by response surface methodology and its stability[J].China Oils and Fats, 2017, 42(9):14-19.
[13] HAN L J, LI L, LI B, et al.Structure and physical properties of organogels developed by sitosterol and lecithin with sunflower oil[J].Journal of the American Oil Chemists’ Society, 2014, 91(10):1783-1792.
[14] HAN L J, LI L, ZHAO L, et al.Rheological properties of organogels developed by sitosterol and lecithin[J].Food Research International, 2013, 53(1):42-48.
[15] 张源, 商建, 张小兵, 等.酯化淀粉乳化剂制备的高效氯氟氰菊酯O/W乳液的稳定机制[J].应用化学, 2012, 29(3):332-339.
ZHANG Y, SHANG J, ZHANG X B, et al.Stability mechanism of lambda-cyhalothrin O/W emulsion prepared with esterified starch as emulsifier[J].Chinese Journal of Applied Chemistry, 2012, 29(3):332-339.
[16] 杨贵妃, 杨柳, 钟金锋, 等.超声均质法制备以乳清蛋白-OSA变性淀粉为乳化剂的纳米乳液[J].食品与发酵工业, 2019, 45(12):169-175.
YANG G F, YANG L, ZHONG J F, et al.Ultrasonic homigenization of nanoemulsions stabilized by whey protein-octenyl succinic anhydride modified starch[J].Food and Fermentation Industries, 2019, 45(12):169-175.
[17] 冯建国, 路福绥, 陈甜甜, 等.聚合物分散剂对氟虫脲水悬浮剂分散稳定性的影响[J].高等学校化学学报, 2010, 31(7):1386-1390.
FENG J G, LU F S, CHEN T T, et al.Effect of copolymer dispersant on the dispersion stability of flufenoxuron suspension concentrate[J].Chemical Journal of Chinese Universities, 2010, 31(7):1386-1390.
[18] 林全全. 影响OSA淀粉乳液中β-胡萝卜素生物可给率的要素分析[D].无锡:江南大学, 2018.
LIN Q Q.Affect OSA starch lotion β-factor analysis of carotene bioavailability[D].Wuxi:Jiangnan University, 2018.
[19] JIANG X C, LI H M, LUO Y, et al.Studies of the plasticizing effect of different hydrophilic inorganic salts on starch/poly (vinyl alcohol) films[J].International Journal of Biological Macromolecules, 2016, 82:223-230.
[20] WEI Z H, YANG W, FAN R, et al.Evaluation of structural and functional properties of protein-EGCG complexes and their ability of stabilizing a model β-carotene emulsion[J].Food Hydrocolloids, 2015, 45:337-350.
[21] AOKI T, DECKER E A, MCCLEMENTS D J.Influence of environmental stresses on stability of O/W emulsions containing droplets stabilized by multilayered membranes produced by a layer-by-layer electrostatic deposition technique[J].Food Hydrocolloids, 2005, 19(2):209-220.
[22] MITRI K, SHEGOKAR R, GOHLA S, et al.Lipid nanocarriers for dermal delivery of lutein:Preparation, characterization, stability and performance[J].International Journal of Pharmaceutics, 2011, 414(1-2):267-275.
[23] OFIR E, OREN Y, ADIN A.Electroflocculation:The effect of zeta-potential on particle size[J].Desalination, 2007, 204(1-3):33-38.
[24] 杜鹃, 吴忠红, 吴津蓉.基于OSA变性淀粉为乳化剂对番茄红素纳米运输体系构建影响研究[J].粮食与油脂, 2018, 31(10):24-30.
DU J, WU Z H, WU J R.Research of the emulsifying characteristics of OSA modified starch and its influence on the construction of lycopene nano-transport system[J].Cereals &Oils, 2018, 31(10):24-30.