目前人们对功能性食品的追求不断增大,最受欢迎的产品是那些添加了益生元、富含生物活性化合物的益生菌、维生素和矿物质的产品。在乳制品行业中,许多饮品属于水包油(oil/water,O/W)型乳剂饮料,并利用益生元化合物达到降脂、降糖等目的[1]。人们日常生活中的蔬菜含有菊粉益生元,是一种水溶性植物储存多糖,属于一类非消化碳水化合物果聚糖,对肠胃健康起到有益的作用[2]。一些研究表明,菊粉具有显著的生物学效应,通常被用作益生元[3]、脂肪替代物[4]、蔗糖替代物[5]添加到各类健康食品中,可能具有稳定和增强乳液乳化特性的作用[6]。
乳液是一种热力学不稳定系统,通常出现絮凝、油脂酸败等,影响乳液稳定性以及改变口感[7]。由于菊粉并没有界面活性,形成乳液后稳定性差,通常使用乳化剂将其制作成乳液用于食品工业生产[8]。乳清分离蛋白(whey isolate protein,WPI)是奶酪加工过程中的副产物,常用于乳制品、烘焙、肉类、零食和糖果产品,拥有较好的乳化性质,但制成乳液后的氧化稳定性并无显著提升[9-10]。研究显示:蛋白质-多糖的相互作用可能会改变蛋白质的功能特性,如界面活性、溶解度、发泡或乳化特性,这些相互作用能够使功能性食品乳液的结构和性质发生改变。从这个意义上说,蛋白质-多糖的相互作用对于开发新产品和加工食品是极为重要的[11]。
随着生活质量的提高,人们对健康食品越来越重视,从而有着很多脂肪替代物、益生元产品的出现[12]。DE SOUZA PAGLARINI等[13]通过菊粉的凝胶特性,使乳液形成能够稳定冷藏的脂肪替代凝胶。YANG等[14]研究发现,对菊粉进行疏水改性有利于乳液递送活性物质,增加其在乳液中的稳定性。LI等[15]通过微波处理使连续相暴露更多的疏水基团,吸附在石榴籽油表面,形成稳定的乳液,明显地改善了石榴籽油的氧化稳定性。目前国内大都研究植物蛋白和菊粉复配乳液,李杨等[16]利用蛋白质与多糖的相互作用,改善了豌豆分离蛋白乳液的絮凝以及稳定性。关于菊粉-蛋白乳液凝胶以及对植物蛋白乳液稳定性的研究越来越多,但是关于菊粉对WPI乳液的氧化稳定性还未曾报道。为了研究不同聚合度下不同浓度菊粉对WPI稳定的水包油型乳液的形成、稳定性以及氧化稳定性的影响,通过粒径、激光共聚焦、乳化性质、初级氧化产物值等对其进行稳定能力的表征,本研究将了解乳清分离蛋白-菊粉复合物作为乳剂饮料在食品工业中的应用潜力。
1 材料与方法
1.1 材料与试剂
乳清分离蛋白,美国Hilmar Ingredients公司;短链菊粉(short chain inulin,SCI)、中链菊粉(medium chain inulin,MCI)、橄榄油食品级,上海麦克林生物科技有限公司;尼罗红、异硫氰酸荧光素(fluorescein isothiocyanate,FITC),阿拉丁试剂(上海)有限公司;去离子水、NaOH、HCl,国药集团化学试剂有限公司。
1.2 仪器与设备
STARTER pH计,奥豪斯仪器有限公司;T-18型高速剪切机,德国IKA工业设备基团;高压均质机,ATS Engineering AH-2010;Malvern Nano-ZS动态光散射粒度仪、Msatersizer 3000激光粒度仪,英国马尔文仪器有限公司;F-4600荧光分光光度计,日本日立有限公司;DSA30R界面流变仪,德国吕克士公司。
1.3 试验方法
1.3.1 复合物制备
将WPI溶液、SCI溶液、MCI溶液室温下在磁性搅拌台上搅拌2 h,搅拌完成后将WPI溶液依次与短链菊粉、中链菊粉混合,复合物溶液中WPI最终质量分数为2%,短链菊粉最终质量分数为2%、4%、6%、8%(下同),天然菊粉最终质量分数为2%、4%、6%、8%(下同)。用2 mol/L的NaOH溶液将复合物溶液pH值调整为7.0±0.2,为了使蛋白充分水合,将复合物溶液保存到4 ℃冰箱过夜,待用。
1.3.2 乳液制备
复合物与橄榄油按照9∶1(质量比)混合后,在T-18型高速剪切机,12 000 r/min下均质3次,每次2 min,间隔30 s,制成粗乳液后,通过高压均质机70 MPa均质1次后,形成最终乳液。
1.3.3 复合物Zeta电位测定
使用动态激光散射仪器对连续相不同质量分数菊粉(0%、2%、4%、6%、8%,下同)在室温(25 ℃)环境下测量连续相的电位,每个样品12次测量。
1.3.4 复合物内源荧光光谱测定
根据实验室以往的方法稍作修改,使用F-4600荧光分光光度计,用去离子水(pH 7.0)稀释适当倍数,样品装入石英比色皿中,在280 nm的波长下被激发,然后获得300~500 nm的发射光谱,激发和发射狭缝宽度设置为5 nm。
1.3.5 乳液粒径测定
按照实验室以往的方法,使用Mastersizer 3000型激光粒度仪测定样品的粒径分布和平均粒径,样品性状为球形,样品折射率为1.469,分散剂折射率为1.330,测定第0、7、14、21天的粒径变化。
1.3.6 絮凝指标
根据实验室以往的方法,1%(质量分数)十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液为分散剂,其他同乳液粒径的测定相同,测定乳液的絮凝指标U。计算如公式(1)所示:
(1)
式中:d4,3water,1.3.5节所得乳液粒径;d4,3SDS,样品池中加入SDS所得乳液粒径。
1.3.7 界面蛋白吸附含量
按照实验室以往的方法,吸取新鲜制备的乳液2 mL 放入离心管中,12 000 r/min 离心 20 min,后用注射器小心吸出下层清液并通过0.22 μm的微孔滤膜。下层清液中蛋白质的含量使用Bradford法测量,界面蛋白吸附量(absorption,AP)的计算如公式(2)所示:
(2)
式中:ρ,样品的初始质量浓度,mg/mL;ρL,样品下层清液的质量浓度,mg/mL。
1.3.8 乳化性质分析
根据实验室以往的方法,测定了不同浓度菊粉(0%、2%、4%、6%、8%)乳液的乳化活性指数(emulsifying activity index,EAI)和乳剂稳定性指数(emulsion stability index,ESI),乳液在高压均质后静置0和10 min,取出1 μL的乳液分散在300 μL 1 mg/mL SDS溶液,通过酶标仪测量500 nm处的吸光值,吸光值在0和10 min时分别记为A0和A10。EAI和ESI的计算如公式(3)和公式(4)所示:
(3)
(4)
式中:DF,样品的稀释倍数;ρ,未乳化前WPI的质量浓度,mg/mL;φ,乳液中的油水比(0.1)。
1.3.9 激光共聚焦
采用激光共聚焦(confocal laser scanning microscope,CLMS)(Olympus FluoView FV10i)对乳液微观结构进行观察。按照实验室以往的方法稍作修改,制备了尼罗红(0.1%,质量分数)和FITC(0.1%,质量分数)荧光染色剂,取200 μL乳液与100 μL的FITC以及10 μL尼罗红混合10 s以上,然后将样品放在共聚焦显微镜的载玻片上,轻轻覆盖载玻片,其中尼罗红用于油相染色,FITC用于水相染色。
1.3.10 氧化稳定性分析
实验室以往的方法稍作修改,分别将橄榄油和乳液放置于50 ℃烘箱中进行加速氧化处理,并且每隔3 d测定橄榄油和乳液中的氧化产物含量。
初级氧化产物的测定:取0.3 mL的乳液与 1.5 mL V(异辛烷)∶V(异丙醇)=3∶1充分混合,然后将充分混合的溶液在 10 000 r/min 离心5 min。取 200 μL 离心混合液的上层油相依次加入2.8 mL V(甲醇)∶V(丁醇)=2∶1、15 μL 亚铁溶液(0.132 mol/L BaCl2 溶液和0.144 mol/L FeSO4充分混合)和15 μL 3.94 mol/L的硫氰酸铵溶液。将混合液于室温黑暗中反应20 min,利用酶标仪测量在 510 nm 处的吸光度。标准曲线用过氧化氢异丙苯来建立。
次级氧化产物的测定:硫代巴比妥酸(2-thiobarbituric acid,TBA)溶液的配制:依次加入0.15 g/mL三氯乙酸、0.025 mol/L HCl溶液、3.75 mg/mL硫代巴比妥酸溶液。取 1 mL 乳液与2 mL的TBA溶液充分混合,将充分混合的溶液在沸水浴中加热 15 min,随后置于冰水中冷却至室温,在 4 000 r/min 离心 10 min。利用酶标仪测量532 nm处的吸光度。标准曲线用1,1,3,3-四乙氧基丙烷溶液来建立。
1.4 数据统计分析
以上实验均重复3次,数据以平均值±标准差表示结果。对所得数据采用SPSS软件进行方差分析,取显著性水平P<0.05,并采用Origin 2021制图。
2 结果与讨论
2.1 WPI与菊粉在水中的相互作用
2.1.1 Zeta电位测量
制备了不同聚合度下不同质量分数菊粉(0%、2%、4%、6%、8%,下同),蛋白质含量(2%质量分数)保持不变,对乳液中作为连续相的体系在pH 7.0的环境下进行电位表征。有研究表明,离子间静电斥力的存在使得分子间保持着一定距离,Zeta电位的绝对值超过20 mV能够对乳液提供足够的稳定[17],所以拥有良好的电动势对乳液形成的稳定是至关重要的。表1中表示了不同聚合度下不同质量分数菊粉(0%, 2%, 4%, 6%, 8%)测定的Zeta电位值。所有连续相体系在pH 值为7.0时均显示负电位,低浓度菊粉连续相中电位与对照组连续相并无明显差异,电位的绝对值超过了20 mV,说明了低浓度菊粉对WPI溶液有良好的稳定作用。
表1 WPI-菊粉溶液的Zeta电位
Table 1 Zeta potential of WPI-inulin solution
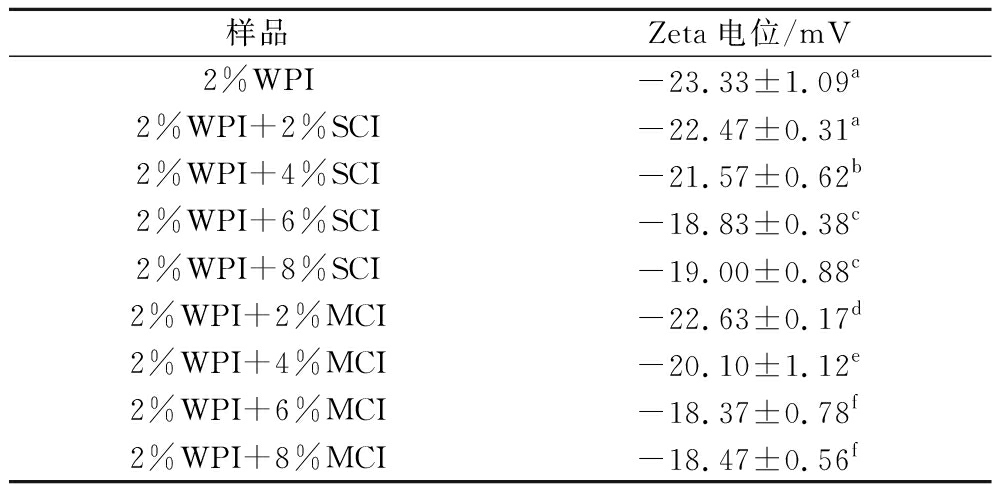
样品Zeta电位/mV2%WPI-23.33±1.09a2%WPI+2%SCI-22.47±0.31a2%WPI+4%SCI-21.57±0.62b2%WPI+6%SCI-18.83±0.38c2%WPI+8%SCI-19.00±0.88c2%WPI+2%MCI-22.63±0.17d2%WPI+4%MCI-20.10±1.12e2%WPI+6%MCI-18.37±0.78f2%WPI+8%MCI-18.47±0.56f
注:不同字母表示无显著性差异(P<0.05)。
高质量分数的菊粉连续相(6%、8%)Zeta电位的绝对值低于20 mV,相较于低质量分数菊粉连续相(2%、4%)的电位-22.47 mV以及-22.63 mV的变动很大,由于菊粉是一种非离子多糖[18],导致连续相电位绝对值降低的可能原因是高浓度的菊粉增加了蛋白质-多糖体系的电荷屏蔽效应,这种变化导致高浓度的菊粉黏弹性增大向凝胶化趋势的转变[19],有研究指出当菊粉的添加量超过10%时会形成凝胶[20],对乳液的形成以及在食品工业上乳液饮料的应用具有一定影响,且菊粉质量分数在6%、8%时,连续相稳定性最差。
2.1.2 复合物内源荧光光谱分析
乳清蛋白分离物中含有大量的荧光物质,如色氨酸等[21],碳水化合物存在的情况下,会使WPI的荧光基团暴露[22]。如图1所示,不同聚合度下不同质量分数(0%, 2%, 4%, 6%, 8%)菊粉-WPI连续相的荧光光谱。所有浓度的菊粉最高吸收峰的波长都出现明显的红移,低浓度菊粉荧光强度增加,使得WPI中色氨酸更多地在水中暴露,由于色氨酸的疏水性,疏水基团的暴露能够增加乳液的稳定性,WPI在330 nm左右观察到较强的荧光峰值,有菊粉的存在下,该峰值的幅度增加,说明了暴露于水相中的色氨酸基团增加。这种现象随着菊粉浓度的下降而增加,可能原因是,菊粉的加入起到了静电屏蔽作用,改变了色氨酸残基周围的疏水性,有研究表明[23],这种改变导致了一些原本位于WPI分子疏水内部的非极性基团暴露在周围的水相中,复合物疏水性的增加,也就代表亲脂性增加,而在没有碳水化合物的情况下,乳清分离蛋白可能是依靠疏水相互吸引,因此疏水基团的暴露少。
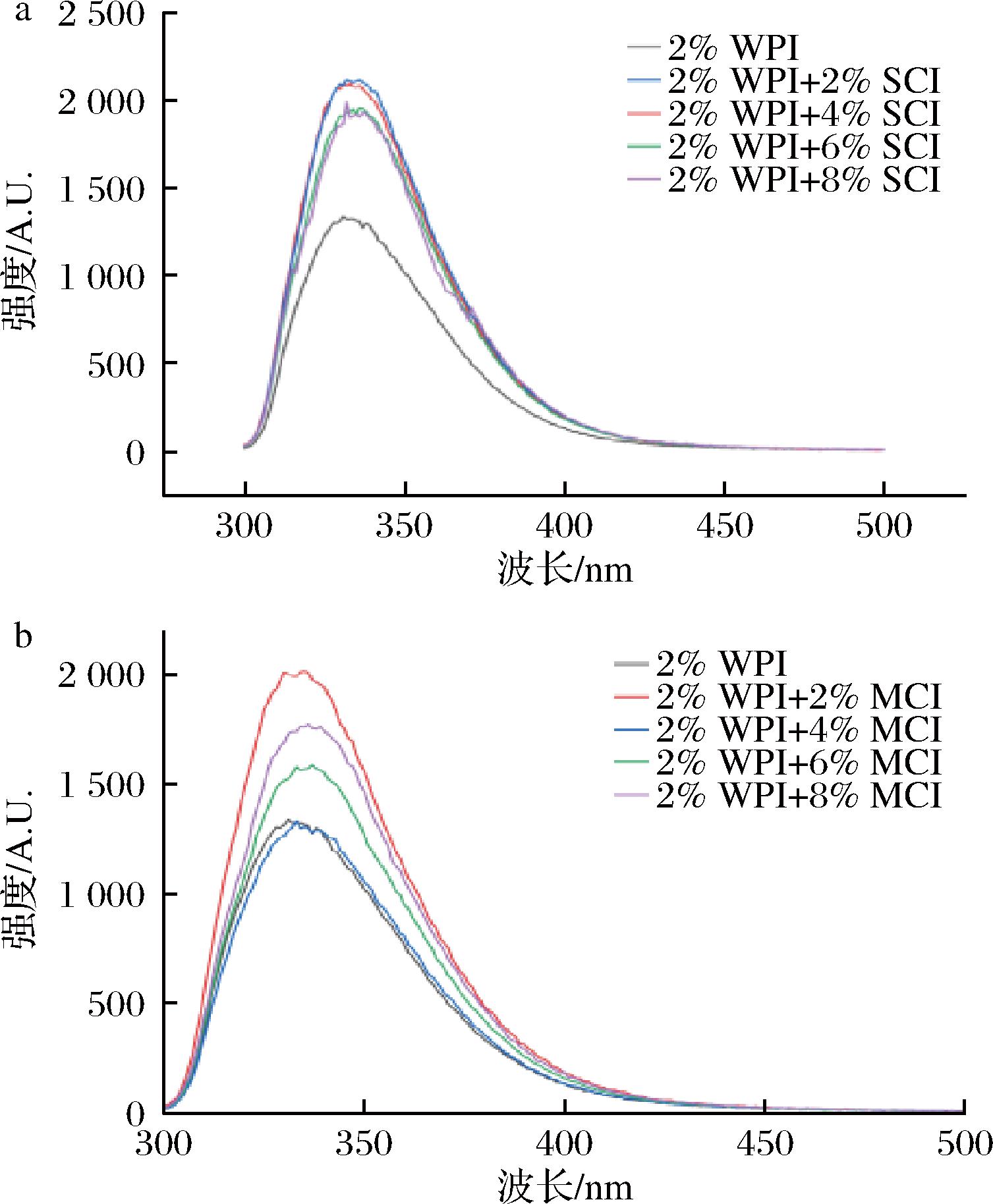
a-SCI复合WPI;b-MCI复合WPI
图1 不同聚合度下不同浓度菊粉连续相的荧光光谱图(P<0.05)
Fig.1 Fluorescence spectra of composite WPI with different concentrations of inulin (P<0.05)
2.2 添加菊粉对粒径以及絮凝指数的影响
为了对乳液中平均粒径进行表征,制备了不同的乳液,油添加的质量分数都是一定的(10%)。图2表示了不同聚合度下不同浓度菊粉对2%WPI乳液的平均粒径大小与絮凝指数。乳液的粒径对乳液稳定性有着很大的关系,通常粒径越小,乳液拥有的稳定性就更好[24]。并且蛋白质-多糖产生的相互作用,比单独使用一种蛋白质所制成的乳液拥有更好的稳定性[25]。图2中所示的所有相同聚合度菊粉乳液随着浓度的增大平均粒径呈现了上升的趋势,当菊粉质量分数为2%时,乳液的平均粒径小于单独使用WPI的平均粒径2.44 μm,短链菊粉乳液和天然菊粉乳液均显示出了最小的平均粒径分别为2.24和2.29 μm,二者无明显差异,说明菊粉质量分数在2%时,乳液拥有更好的稳定性,SCI和MCI乳液(2%、4%)的絮凝指数为0,说明了乳液的稳定性良好。当菊粉质量分数超过4%时,MCI乳液平均粒径为2.84 μm超过WPI乳液且比同浓度的SCI乳液的平均粒径大,可能原因是不同聚合度菊粉之间链长的影响,中链菊粉的聚合度大于短链菊粉,与其他物质复合后,如蛋白质,随着菊粉聚合度的增加,粒径呈上升趋势[26]。在高质量分数菊粉乳液(6%、8%)中平均粒径的大小超过了单独使用WPI的乳液,菊粉质量分数为8%时,短链菊粉和中链菊粉乳液的粒径分别为3.14和3.19 μm,粒径增大的可能原因是样品连续相黏弹性的增加和油滴大小有关[27],这一结果与连续相Zeta电位相一致,图中样品间的絮凝指数并无明显差异。
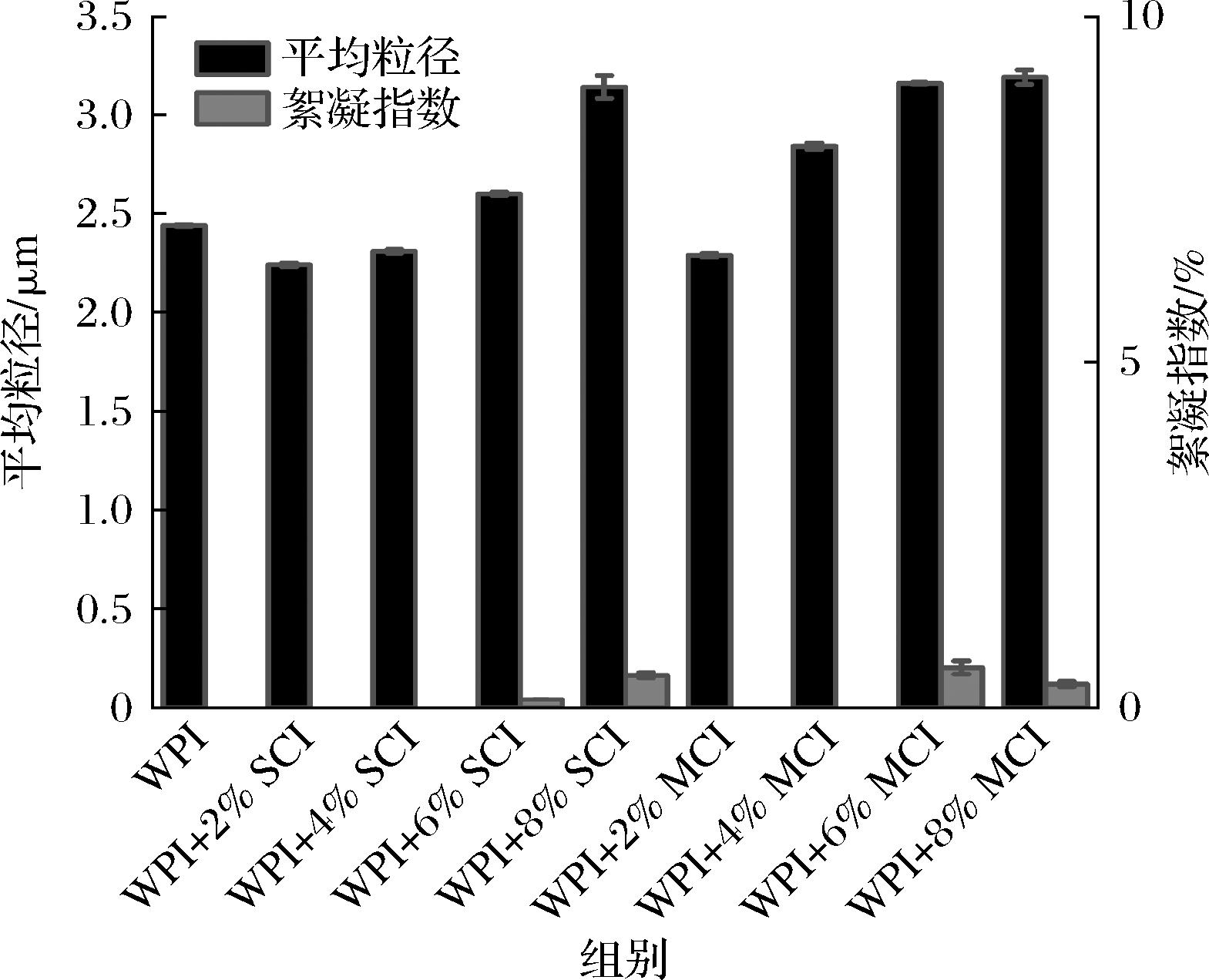
图2 不同浓度的SCI和MCI的WPI乳液平均粒径和絮凝指数(P<0.05)
Fig.2 Average particle size and flocculation index of WPI emulsion with different concentrations of SCI and MCI (P<0.05)
2.3 乳液微观结构
与光学显微镜相比,激光共聚焦检测手段具有乳液内部结构的视觉能力,拥有更多的优势[28]。不同聚合度下不同浓度的菊粉乳液的CLSM图像以及粒径分布如图3所示。绿色、红色和黄色的荧光场分别代表了水相、油相以及蛋白质附着在油滴表面。可以看出所有含不同浓度的菊粉乳液中的蛋白质和菊粉都附着在油滴上,蛋白质-菊粉在油水界面疏水基团的重排形成的黄色环状结构防止乳液的聚集,提高乳液的稳定性[29],并证实了乳液的形成[30]。
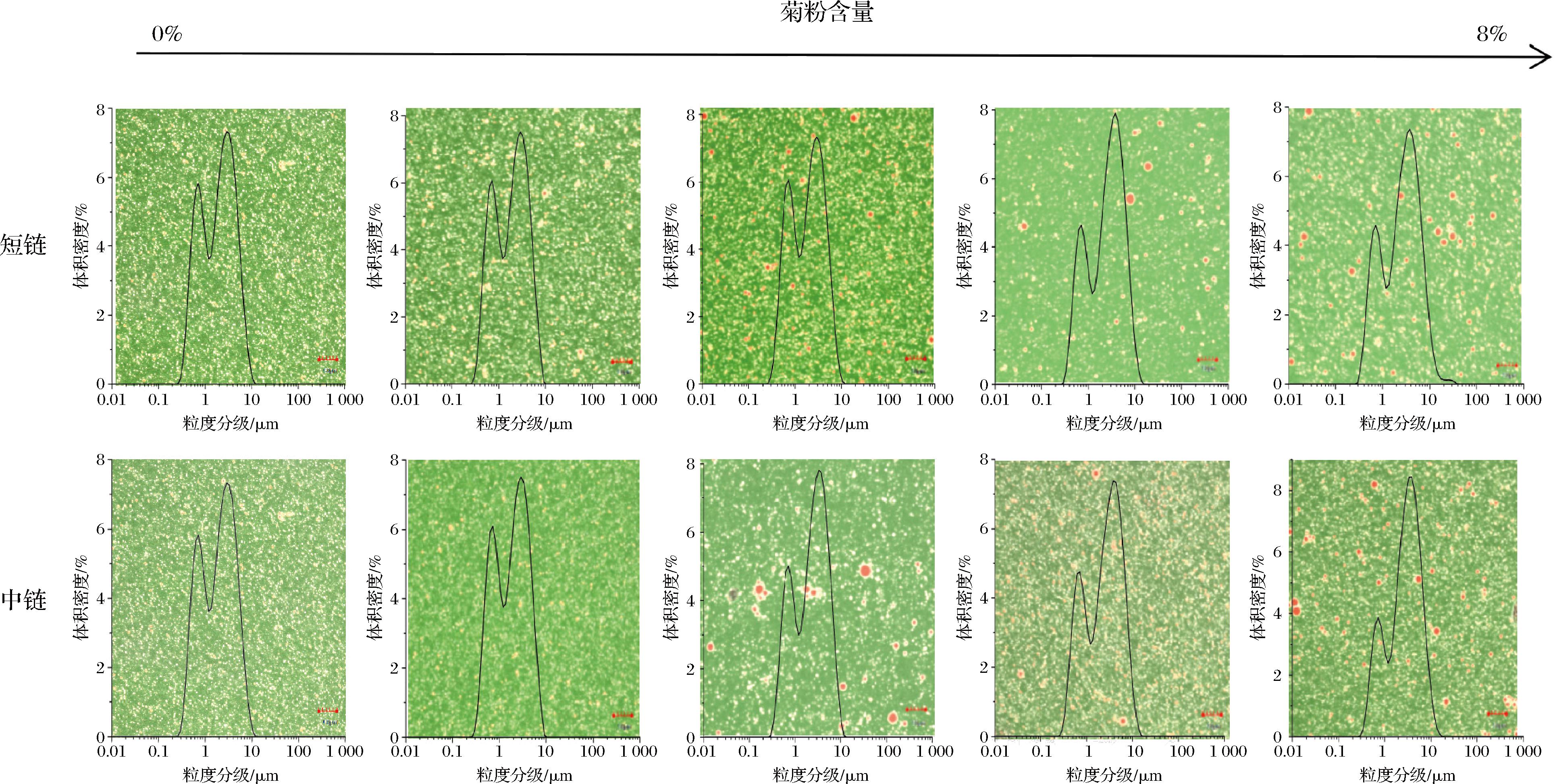
图3 不同浓度SCI和MCI的WPI乳液激光共聚焦显微结构和粒径分布图
Fig.3 Laser confocal microstructure and particle size distribution of WPI emulsion with different concentrations of SCI and MCI
由图3所示,随着菊粉浓度的增加,乳液粒度分级的宽度也随之增加,低质量分数菊粉(2%)粒度分级的宽度小于对照组,且乳液液滴较小、大小分布均匀,并无油滴聚集的情况。反观高质量分数菊粉(6%,8%)的乳液出现较大液滴且密集,可能原因是蛋白质-多糖的电荷屏蔽效应使分子间斥力减小从而使油滴相对聚集,这一微观结构的结果与Zeta电位的分析一致。同时低质量分数菊粉乳液(2%)相较于对照组显示出更小的粒径分布,乳液的液滴分散性良好,短链菊粉质量分数为4%的乳液的粒径分布图同对照组相差无几但略有聚集,此浓度下的中链菊粉乳液不同于短链菊粉乳液,粒径分级与对照组无明显差异,但从激光共聚焦的微观结构结果显示液滴较为密集,分散性较短链菊粉乳液差,这可能是中链菊粉的聚合度以及菊粉分子质量的差异所致,其结果与乳液平均粒径结果一致,高质量分数菊粉乳液(6%、8%)CLMS显示有液滴聚集,并出现了较大油滴的分布,这表明高浓度菊粉乳液稳定性不好。
2.4 乳液界面蛋白吸附量分析
蛋白质-多糖之间的界面相互作用对其特性有着直接的影响,其研究是表征乳液的基础[31]。图4表示了不同聚合度下不同质量分数菊粉(0%、2%、4%、6%、8%)乳液的界面蛋白吸附量,WPI质量分数为2%恒定不变,图中WPI乳液界面蛋白吸附量为70.61%,所有短链菊粉并没有对WPI在界面吸附量上显示出明显的差异,而中链菊粉质量分数从0%增加到2%时,界面蛋白吸附量有着明显的增加,增加量达到6.65%,均高于所有浓度的菊粉乳液,这说明低质量分数(2%)的中链菊粉使WPI能够稳定较大的界面面积,更多的蛋白质吸附在O/W界面上[32]。当中链菊粉质量分数从2%进一步增加到4%、6%,WPI界面蛋白吸附量为68.16%、68.43%其对WPI界面蛋白吸附量轻微下降,中链菊粉质量分数增加到8%时,WPI界面蛋白吸附量下降至64.34%,有研究表明,虽然菊粉对蛋白质的界面性质并无明显的影响,但其对WPI的疏水基团暴露,使WPI能够吸附较大的界面面积[33]。
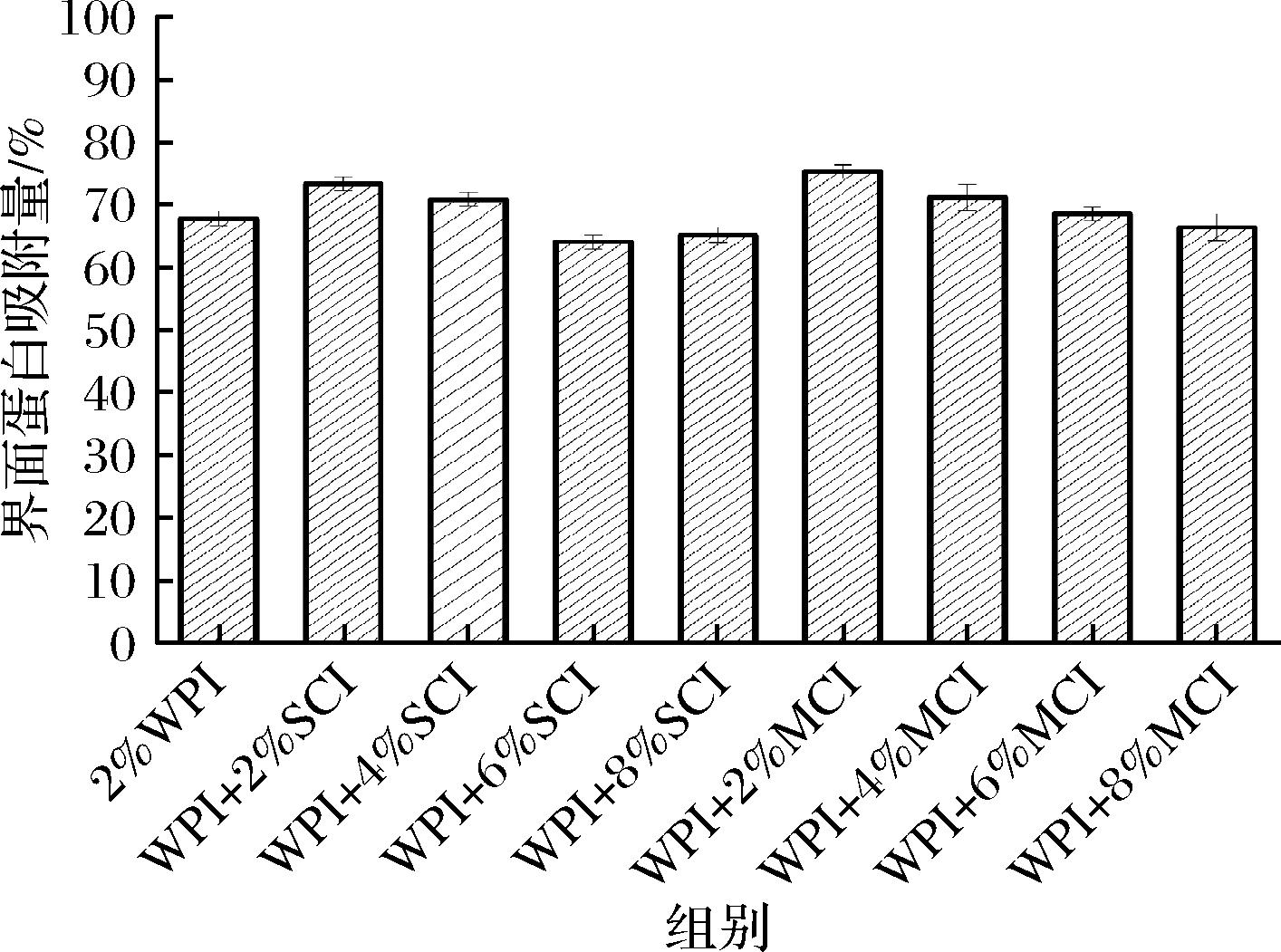
图4 不同浓度短链菊粉和中链菊粉的WPI乳液界面蛋白吸附量图
Fig.4 WPI interfacial protein adsorption capacity of short-chain inulin and medium-chain inulin at different concentrations
2.5 乳化性质分析
EAI和ESI反映了WPI-菊粉在油水界面吸附和乳状液形成过程中油滴扩散和聚集的能力[28]。图5研究了不同聚合度下不同质量分数的菊粉(0%、2%、4%、6%、8%)制成乳液的乳化性质。高压均质机作用下的机械力暴露了更多蛋白表面的疏水基团[34],从荧光光谱分析疏水基团的暴露与菊粉浓度的高低有关,因此高压均质后的低浓度菊粉乳液具有更高的乳化性。从图5中可以看出随着菊粉浓度的增加,乳液的EAI在2%(质量分数)下达到最高值5.734、5.689 m2/g而后下降,结合荧光光谱分析WPI-菊粉使得WPI的疏水基团暴露,使空间结构更舒展,说明在低浓度菊粉的环境下,WPI-菊粉乳液的稳定性增加,油滴分散。高浓度菊粉环境下,WPI-菊粉乳液的EAI为3.703 m2/g,乳化能力明显降低,导致其乳化活性降低的原因是高浓度菊粉的加入使疏水基团暴露减少,其空间结构不如低浓度菊粉乳液舒展,乳化能力及稳定性差,这与激光共聚焦所显示的微观结构一致。短链菊粉和天然菊粉在低质量分数下(2%)对乳液的乳化稳定性影响最为显著,乳液的ESI相比单独使用WPI乳液的ESI 68.71%增加了9.59%以及8.55%,二者的乳化能力最好并无明显差异,短链菊粉和天然菊粉质量分数为8%的乳液,其ESI分别为62.15%和60.34%,乳化能力与乳剂稳定性最差。
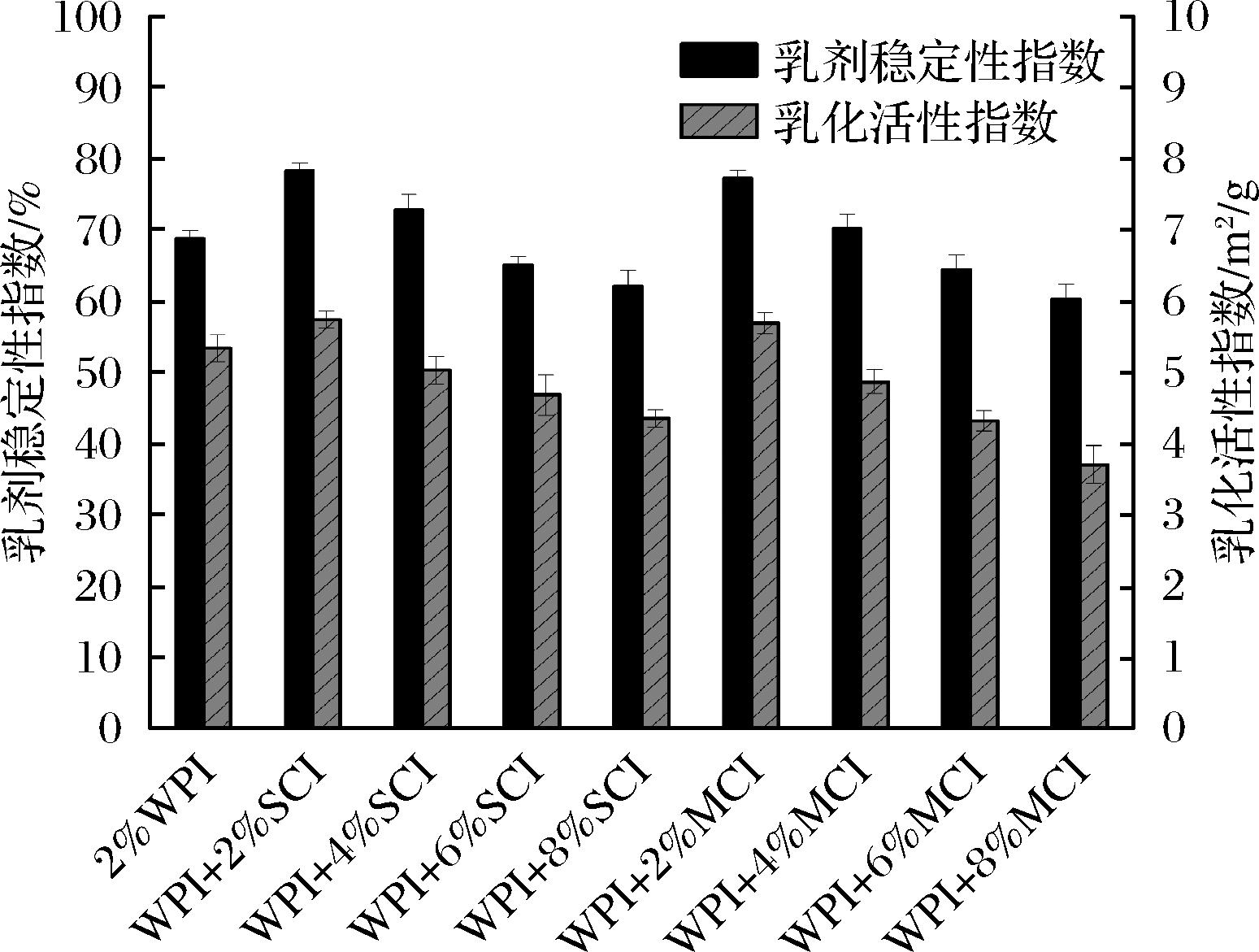
图5 不同浓度短链菊粉与中链菊粉对乳液EAI和ESI的影响
Fig.5 Effects of different concentrations of short chain inulin and medium chain inulin on the EAI and ESI of lotion
2.6 储存过程中粒径的变化
图6显示了颗粒体积(d4,3)和Sauter(d3,2)直径在0、1、3、7、14 d存储时间的变化函数。一般来讲,d3,2作为与乳液不稳定过程相关的液滴尺寸变化的测定手段如液滴的聚集、絮凝等[35],也可以反映出乳液的乳化能力[36]。颗粒体积(d4,3)直径的大小与乳液的稳定性相关,一般较小的粒径具有较好的稳定性[34]。

图6 不同浓度短链菊粉和中链菊粉储藏14 d d4,3 以及d3,2的变化
Fig.6 Changes in d4,3 and d3,2 of short chain inulin and natural inulin stored at different concentrations for 14 days
研究菊粉浓度对储存中粒径变化的影响时,低浓度菊粉乳液总是比单独使用WPI乳液的粒径小,所有短链菊粉乳液均表现出相当的抗聚集稳定性,因为颗粒体积(d4,3)直径在这段时间内保持稳定,可能原因是蛋白-多糖吸附在油滴表面形成黄色环状结构使油滴不容易聚集[29]。高浓度短链菊粉乳液在第14天有一定上升的趋势,蛋白质分子在油滴表面吸附后,油水界面上展开重新排列,所导致的粒径增大[37]。中链菊粉乳液除了低质量分数(2%)在储存时间内相当稳定,其余的浓度梯度虽在前3天保持稳定,7 d后呈现了上升的趋势,可能原因是天然菊粉的线性结构和分子的平均聚合度要高于短链菊粉[38],所以其平均粒径要大于短链菊粉乳。图6-c、图6-d,d3,2低浓度短链菊粉、中链菊粉(2%)在14 d内保持着相同的态势,拥有良好的乳化能力,另一方面,菊粉含量的增加导致d3,2的增加,这表明高浓度菊粉乳液乳化能力的降低。这些结果可能与之前发现的蛋白质疏水基团的暴露的多少有关,这与荧光光谱分析一致。
2.7 氧化稳定性分析
油脂的氧化酸败影响着乳制品的口感和风味,图7表示不同聚合度下不同质量分数菊粉(0%、2%、4%、6%、8%)对初级氧化产物的影响,油脂的氧化程度随加速氧化时间而变深,橄榄油和乳液的氢过氧化物值不断增大。从图7中可以看出,短链菊粉的加入对油脂氧化有抑制作用,不同浓度短链菊粉乳液之间在前12天的氢过氧化物值并没有很大差异。不同浓度的中链菊粉乳液6 d后的初级氧化产物值存在明显差异,图8表示不同聚合度下不同质量分数菊粉(0%、2%、4%、6%、8%)对次级氧化产物的影响,图中橄榄油在50 ℃加速氧化的15 d内,次级氧化产物硫代巴比妥酸(thiobarbituric acid,TBARS)不断升高,加入菊粉的样品均低于橄榄油,短链菊粉乳液之间的TBARS值无明显差异,从图7、图8中可以看出,中链菊粉乳液中菊粉质量分数在2%时氧化稳定性最好,其油脂氧化产物值最低,这是因为低浓度的中链菊粉增大了WPI在油水界面的吸附面积,能够有效地减缓乳液中油脂的氧化[39]。此外,从激光共聚焦的结果来看,蛋白在吸附油滴时形成的环状结构阻隔了介质中的氧化剂[29]。因此,中链菊粉质量分数在2%时,乳液的氧化稳定性最佳。
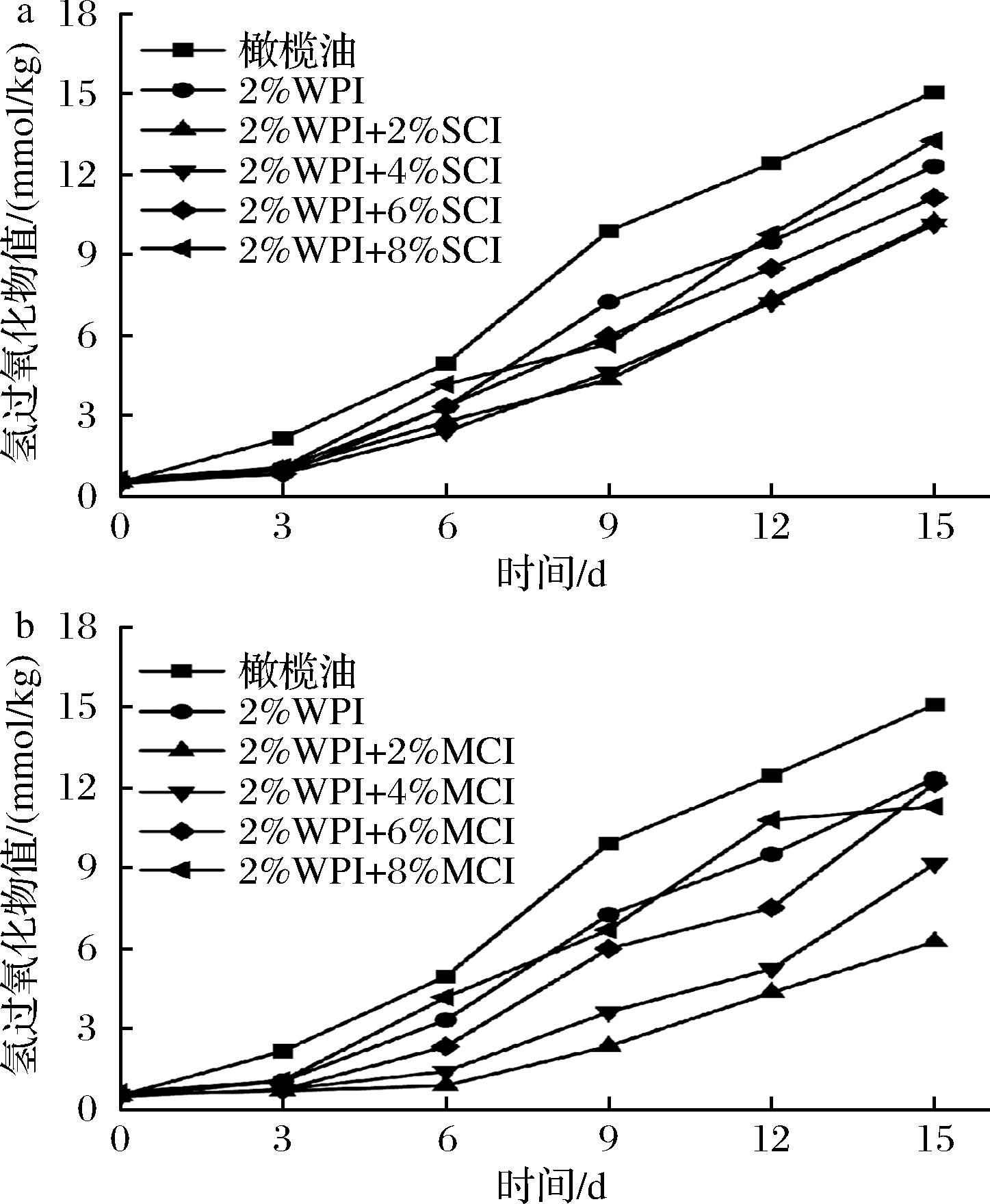
a-不同浓度SCI;b-不同浓度MCI
图7 不同浓度菊粉对初级氧化产物的影响
Fig.7 Effects of different concentrations of inulin on primary oxidation products
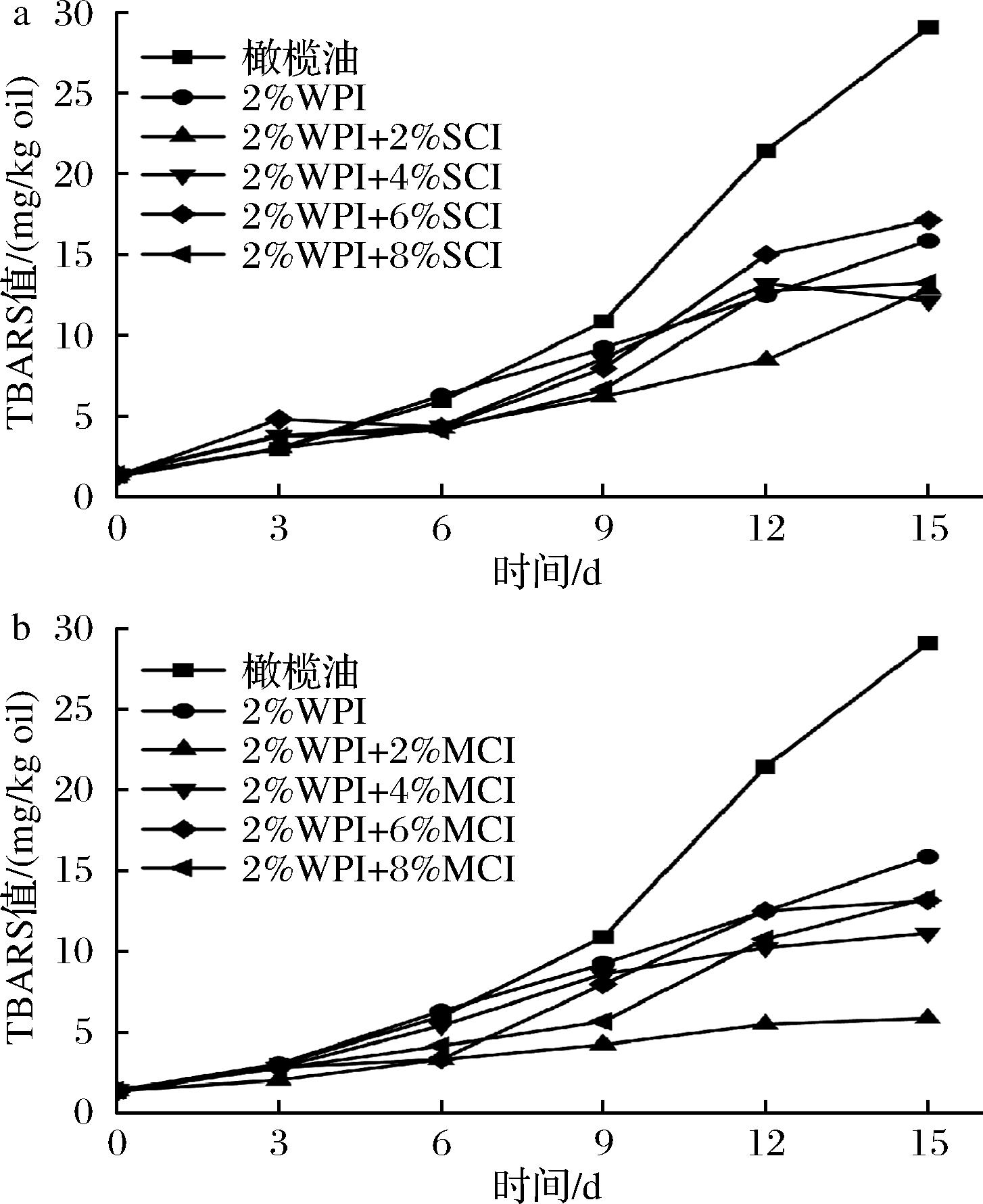
a-不同浓度SCI;b-不同浓度MCI
图8 不同浓度菊粉对次级氧化产物的影响
Fig.8 Effects of different concentrations of inulin on secondary oxidation products
3 结论
乳液中菊粉的存在改变了WPI原有的物理化学性质,WPI-菊粉的相互作用产生的效益影响乳液的稳定性。连续相的Zeta电位随着菊粉浓度的增加,多糖对WPI产生的电荷屏蔽效益增大,Zeta电位的绝对值减小,低质量分数菊粉(2%,质量分数,下同)拥有良好的电动势,对形成乳液后的稳定性起到良好的作用[36]。菊粉质量分数为2%时,乳液的平均粒径最小,在14 d的储存中颗粒体积(d4,3)和Sauter(d3,2)直径均保持在相同的趋势范围内,并没有明显的增大,低浓度短链菊粉和中链菊粉的ESI分别增加了9.59%以及8.55%,其对WPI的乳化能力有明显的提升。在15 d的加速氧化中,2%中链菊粉乳液表现出了更好的氧化稳定性。因此,短链菊粉和中链菊粉在2%时可以提高WPI乳液的乳化性以及稳定性,2%中链菊粉乳液具有更好的氧化稳定性。这些结果支持了商业食品乳液中使用菊粉等益生元成分,突出了其作为稳定剂的作用以及与所使用的乳化剂相互作用的重要性。
[1] GUIMAR ES J T, SILVA E K, COSTA A L R, et al.Manufacturing a prebiotic whey beverage exploring the influence of degree of inulin polymerization[J].Food Hydrocolloids, 2018, 77:787-795.
ES J T, SILVA E K, COSTA A L R, et al.Manufacturing a prebiotic whey beverage exploring the influence of degree of inulin polymerization[J].Food Hydrocolloids, 2018, 77:787-795.
[2] LI Y, MA X H, LIU X.Physicochemical and rheological properties of cross-linked inulin with different degree of polymerization[J].Food Hydrocolloids, 2019, 95:318-325.
[3] KOLIDA S, TUOHY K, GIBSON G R.Prebiotic effects of inulin and oligofructose[J].The British Journal of Nutrition, 2002, 87(Suppl 2):S193-S197.
[4] PACIULLI M, LITTARDI P, CARINI E, et al.Inulin-based emulsion filled gel as fat replacer in shortbread cookies:Effects during storage[J].LWT, 2020, 133:109888.
[5] AIDOO R P, AFOAKWA E O, DEWETTINCK K.Optimization of inulin and polydextrose mixtures as sucrose replacers during sugar-free chocolate manufacture-Rheological, microstructure and physical quality characteristics[J].Journal of Food Engineering, 2014, 126:35-42.
[6] KOKUBUN S, RATCLIFFE I, WILLIAMS P A.The emulsification properties of octenyl- and dodecenyl-succinylated inulins[J].Food Hydrocolloids, 2015, 50:145-149.
[7] MCCLEMENTS D J.Food Emulsions:Principles, Practices, and Techniques, Second Edition[M].Boca Raton:CRC Press, 2004.
[8] XU W, XIONG Y Z, LI Z F, et al.Stability, microstructural and rheological properties of complex prebiotic emulsion stabilized by sodium caseinate with inulin and konjac glucomannan[J].Food Hydrocolloids, 2020, 105:105772.
[9] SMITH T J, FOEGEDING E A, DRAKE M A.Flavor and functional characteristics of whey protein isolates from different whey sources[J].Journal of Food Science, 2016, 81(4):C849-C857.
[10] ZANG Z H, CHOU S R, GENG L J, et al.Interactions of blueberry anthocyanins with whey protein isolate and bovine serum protein:Color stability, antioxidant activity, in vitro simulation, and protein functionality[J].LWT, 2021, 152:112269.
[11] ABU BAKAR SIDDIQUE M, MARESCA P, PATARO G, et al.Influence of pulsed light treatment on the aggregation of whey protein isolate[J].Food Research International, 2017, 99:419-425.
[12] SANDROU D K, ARVANITOYANNIS I S.Low-fat/calorie foods:Current state and perspectives[J].Critical Reviews in Food Science and Nutrition, 2000, 40(5):427-447.
[13] DE SOUZA PAGLARINI C, VIDAL V A, RIBEIRO W, et al.Using inulin-based emulsion gels as fat substitute in salt reduced Bologna sausage[J].Journal of the Science of Food and Agriculture, 2021, 101(2):505-517.
[14] YANG Y Y, YAN S W, YU B, et al.Hydrophobically modified inulin based nanoemulsions for enhanced stability and transdermal delivery of retinyl propionate[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022, 653:129883.
[15] LI S G, WANG K P, HUANG Q, et al.Microwave pretreatment enhanced the properties of ovalbumin-inulin-oil emulsion gels and improved the storage stability of pomegranate seed oil[J].Food Hydrocolloids, 2021, 113:106548.
[16] 李杨, 徐清清, 韩璐, 等.添加菊粉条件下的豌豆分离蛋白乳化特性研究[J].农业机械学报, 2020, 51(7):382-388.
LI Y, XU Q Q, HAN L, et al.Emulsifying properties of pea protein isolate with inulin[J].Transactions of the Chinese Society for Agricultural Machinery, 2020, 51(7):382-388.
[17] HONARY S, ZAHIR F.Effect of Zeta potential on the properties of nano-drug delivery systems: A review (part 2)[J].Tropical Journal of Pharmaceutical Research, 2013, 12(2):265-273.
[18] HA H K, JEON N E, KIM J W, et al.Physicochemical characterization and potential prebiotic effect of whey protein isolate/inulin nano complex[J].Korean Journal for Food Science of Animal Resources, 2016, 36(2):267-274.
[19] GUO M R, WANG H, WANG C N.Interactions between whey protein and inulin in a model system[J].Journal of Food Science and Technology, 2018, 55(10):4051-4058.
[20] CHIAVARO E, VITTADINI E, CORRADINI C.Physicochemical characterization and stability of inulin gels[J].European Food Research and Technology, 2007, 225(1):85-94.
[21] LIU Q, LI Y C, ZHOU Y, et al.Zein-whey protein isolate-carboxymethyl cellulose complex as carrier of apigenin via pH-driven method:Fabrication, characterization, stability, and in vitro release property[J].Food Chemistry, 2022, 387:132926.
[23] JIANG H, HU X F, JIANG W J, et al.Water-in-oil Pickering emulsions stabilized by hydrophobized protein microspheres[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2022, 38(40):12273-12280.
[22] GUO Q, SU J Q, SHU X, et al.Fabrication, structural characterization and functional attributes of polysaccharide-surfactant-protein ternary complexes for delivery of curcumin[J].Food Chemistry, 2021, 337:128019.
[23] JIANG H, HU X F, JIANG W J, et al.Water-in-oil Pickering emulsions stabilized by hydrophobized protein microspheres[J].Langmuir:the ACS Journal of Surfaces and Colloids, 2022, 38(40):12273-12280.
[24] QUEROL N, BARRENECHE C, CABEZA L.Storage stability of bimodal emulsions vs.monomodal emulsions[J].Applied Sciences, 2017, 7(12):1267.
[25] BENICHOU A, ASERIN A, GARTI N.W/O/W double emulsions stabilized with WPI-polysaccharide complexes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2007, 294(1-3):20-32.
[26] GONZ LEZ-TOM
LEZ-TOM S L, BAYARRI S, COLL-MARQUÉS J, et al.Flow behaviour of inulin-enriched dairy desserts:Influence of inulin average chain length[J].International Journal of Food Science &Technology, 2009, 44(6):1214-1222.
S L, BAYARRI S, COLL-MARQUÉS J, et al.Flow behaviour of inulin-enriched dairy desserts:Influence of inulin average chain length[J].International Journal of Food Science &Technology, 2009, 44(6):1214-1222.
[27] KATSAROS G, TSOUKALA M, GIANNOGLOU M, et al.Effect of storage on the rheological and viscoelastic properties of mayonnaise emulsions of different oil droplet size[J].Heliyon, 2020, 6(12):e05788.
[28] SHEN C, CHEN W Q, LI C Z, et al.Pickering emulsion stabilized by gliadin/soybean polysaccharide composite colloidal nanoparticle:Physicochemical properties and its application on washing of fresh-cut cabbage[J].Food Research International, 2022, 161:111886.
[29] HUANG Z Z, YANG X X, LIANG S Y, et al.Polysaccharides improved the viscoelasticity, microstructure, and physical stability of ovalbumin-ferulic acid complex stabilized emulsion[J].International Journal of Biological Macromolecules, 2022, 211:150-158.
[30] CHEN P, YANG B Q, WANG R M, et al.Regulate the interfacial characteristic of emulsions by casein/butyrylated dextrin nanoparticles and chitosan based on ultrasound-assisted homogenization:Fabrication and characterization[J].Food Hydrocolloids, 2022, 133:107983.
[31] CHENG C Y, YUAN C, CUI B, et al.Interfacial behavior of cyclodextrins at the oil-water interface of Pickering emulsion[J].Food Hydrocolloids, 2023, 134:108104.
[32] CHEN M S, LU J H, LIU F, et al.Study on the emulsifying stability and interfacial adsorption of pea proteins[J].Food Hydrocolloids, 2019, 88:247-255.
[33] KOKUBUN S, RATCLIFFE I, WILLIAMS P A.The interfacial, emulsification and encapsulation properties of hydrophobically modified inulin[J].Carbohydrate Polymers, 2018, 194:18-23.
[34] KUHN K R, CUNHA R L.Flaxseed oil-Whey protein isolate emulsions:Effect of high pressure homogenization[J].Journal of Food Engineering, 2012, 111(2):449-457.
[35] WANG L, LI Y J, XIANG D, et al.Stability of lutein in O/W emulsion prepared using xanthan and propylene glycol alginate[J].International Journal of Biological Macromolecules, 2020, 152:371-379.
[36] L PEZ-CASTEJ
PEZ-CASTEJ N M L, BENGOECHEA C, ESPINOSA S, et al.Characterization of prebiotic emulsions stabilized by inulin and β-lactoglobulin[J].Food Hydrocolloids, 2019, 87:382-393.
N M L, BENGOECHEA C, ESPINOSA S, et al.Characterization of prebiotic emulsions stabilized by inulin and β-lactoglobulin[J].Food Hydrocolloids, 2019, 87:382-393.
[37] DICKINSON E.Interfacial structure and stability of food emulsions as affected by protein-polysaccharide interactions[J].Soft Matter, 2008, 4(5):932-942.
[38] VILLEGAS B, COSTELL E.Flow behaviour of inulin-milk beverages.Influence of inulin average chain length and of milk fat content[J].International Dairy Journal, 2007, 17(7):776-781.
[39] HU J N, ZHENG H, CHEN X X, et al.Synergetic effects of whey protein isolate and naringin on physical and oxidative stability of oil-in-water emulsions[J].Food Hydrocolloids, 2020, 101:105517.