姜黄(Curcuma longa L.)是姜科姜黄属植物,姜黄素是从姜黄中提取的疏水性多酚化合物[1]。姜黄素是世界上销售最广泛的天然食品色素。同时,姜黄素在食品工业中常被用作食品香料和膳食补充剂。姜黄素被认为是一种安全物质。研究表明,高剂量口服(6 g/d)对人类和动物无毒性[2]。随着研究的深入,发现姜黄素具有广泛的生理活性功能,包括抗氧化[3]、抗炎[4]、抗菌[5]、抗病毒[6]和抗糖尿病[7]等,姜黄素类化合物的体内代谢途径包括Ⅰ相还原代谢、Ⅱ相结合代谢以及自身氧化和细胞内的催化氧化代谢[8]。姜黄素Ⅰ相还原代谢的产物主要为四氢姜黄素和六氢姜黄素以及少量的阿魏酸,是逐级加氢的过程。在Ⅰ相还原代谢中,肝脏和小肠细胞质内的乙醇脱氢酶参与了反应[9]。由于Ⅰ相代谢产物都具有酚羟基和醇羟基的结构,所以在Ⅱ相代谢中发生了葡萄糖醛酸化和硫酸化的结合反应。姜黄素的最终代谢产物绝大部分是以葡萄糖醛酸化的形式存在的,硫酸化产物相对较少。然而,姜黄素具有低水溶性、低化学稳定性、在胃肠道吸收差以及在胃肠道和肝脏中代谢快的特点,这极大地限制了其应用[10]。近年来,很多研究人员通过构建不同的运载体系包埋并递送姜黄素来提高其溶解度及生物利用度。
脂质体是由两亲性分子定向自组装形成的球形囊泡[11]。作为广泛研究的药物递送载体,脂质体无毒、可生物降解,并能有效地封装各种生物分子[12-14]。目前,常用的脂质体制备方法包括薄膜分散法和乙醇注入法。薄膜分散法存在制备效率不高、脂质体大小不均、有机试剂残留及难以工业化等缺陷[15-16]。乙醇注入法由于脂溶性活性成分在乙醇中的溶解度有限导致负载量较低,且有一定的安全隐患,使其在食品行业中的应用也受到限制。另一种具有高效、安全及稳定的制备方法——高压均质法,可利用物料在均质管道中产生剪切、碰撞和空穴等作用,获得更小粒径及更高稳定性的脂质体[17]。
本研究采用高压均质结合喷雾干燥技术制备基于磷脂包埋的高负载姜黄脂质体粉,对其粒径、电位、微观结构等理化性质及贮藏稳定性进行表征,并以姜黄原料和市售中高吸收姜黄行业标杆品牌物料(简称商业高吸收姜黄)作为对照组比较姜黄素的体外和体内吸收性能。阐明高压均质技术作为高负载姜黄脂质体粉制备新技术的潜力,为其相关产品的开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
姜黄原料(食品级),河南中大恒源生物科技有限公司;磷脂(食品级),北京美业生物科技有限公司;商业高吸收姜黄(为姜黄磷脂复合物产品),市售;姜黄素标品(纯度>98% HPLC)、口腔黏膜蛋白、胃蛋白酶、脂肪酶、胰酶,阿拉丁生化科技股份有限公司;姜黄素葡萄糖醛酸(纯度>95%),湖北杨信医药科技有限公司;乙酸乙酯(色谱纯),广州化学试剂厂;羧甲基纤维素钠(分析纯),阿拉丁生化科技股份有限公司;甲醇(色谱纯)、甲酸(色谱纯),上海安谱实验科技股份有限公司。
SD大鼠15只(5只雌性、10只雄性),体重300~350 g,试验动物来自三峡大学,许可证号:SCXK(鄂)2022-0012。试验设计通过伦理审核,获得湖北工业大学科研伦理与科技安全委员会审批(审批编号:HBUT20220036)。
1.2 仪器与设备
AH-Pilot高压均质机,安拓思纳米技术(苏州)有限公司;Mastersizer3000激光衍射仪、Zetasizer Nano ZSP纳米粒度分析仪,英国Malvern仪器有限公司;ZEISS sigma 300扫描电镜(scanning electron microscope,SEM),德国蔡司;HT7800透射电镜(transmission electron microscope, TEM),日本日立株式会社;U3000-Q-Exactive超高效液相串联质谱,赛默飞;高速冷冻离心机、漩涡振荡混合仪、电子天平、pH计,梅特勒-托利多仪器(上海)有限公司;喷雾干燥塔(MDR-离心式喷雾干燥机),常州通干干燥工程有限公司;BT-1001智能粉体特性测试仪,丹东百特仪器有限公司。
1.3 实验方法
1.3.1 姜黄脂质体粉的制备
将特定比例磷脂与姜黄、水混合,采用高压均质技术制备得到姜黄脂质体液体,再加入壁材利用喷雾干燥塔制备成高负载姜黄脂质体粉(简称姜黄脂质体粉)。
1.3.2 粒径、电位与微观结构
用激光衍射仪测量姜黄脂质体粉的粒径,粒径结果用表面加权平均直径(d3,2) 表示;称取一定量的姜黄脂质体粉样品并加水稀释,平衡约30 min后,利用纳米粒度仪测定其电位;利用SEM观察姜黄脂质体粉的微观结构。将脂质体粉剂按1∶100复水后,并用TEM观察姜黄素脂质体的微观结构。
1.3.3 包封率(encapsulation efficiency,EE)
精密称取混合均匀的姜黄脂质体粉1 g于50 mL离心管中,准确加入4 mL水,涡旋分散5 min,如有样品出现结团无法完全分散,用玻璃棒碾压至无团块。放置1 h,精密吸取0.1 mL溶液至25 mL容量瓶中,作为样品a(总含量)。2 000 r/min离心5 min,精密吸取上层溶液0.1 mL至25 mL容量瓶中,作为样品b(包埋部分)。将样品a和样品b分别加无水乙醇15 mL涡旋分散后,超声3 min,再用无水乙醇定容至刻度,过滤。再分别吸取样品a和样品b滤液各0.5 mL,加无水乙醇稀释至10 mL,采用HPLC进行测定,姜黄脂质体粉的包封率按公式(1)计算:
(1)
式中:a,包埋的姜黄素质量,mg;b,总姜黄素质量,mg。
1.3.4 贮藏稳定性
将姜黄脂质体粉样品置于40 ℃条件下加速贮藏3个月,记录其表观、含量、包封率、休止角、崩溃角、松密度及实密度等性质的变化。其中姜黄素含量测定采用HPLC法,首先要制作姜黄素标准曲线,准确称取10.0 mg的姜黄素标品并置于10 mL棕色容量瓶中,加入甲醇至容量瓶刻度线即得1 mg/mL 姜黄素标准溶液。再将此标准溶液依次稀释成1、2、4、6、8 μg/mL,作为储备液进行HPLC测定(Y=0.147 2X-0.004 5,R2=0.999 9)。其中色谱条件同1.3.3节。姜黄脂质体粉样品经过同样的处理后进行HPLC测定。休止角、崩溃角、松密度及实密度用智能粉体特性测试仪进行测定,包封率用1.3.3节方法进行测定。
1.3.5 模拟体外消化特征
基于先前研究中描述的模拟胃肠道模型[18],确定了姜黄脂质体粉的潜在胃肠道命运,并以姜黄原料和商业高吸收姜黄作为对照。模拟唾液(simulated saliva fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟肠液(simulated intestinal fluid,SIF)的配制参考本课题组先前的研究[17]。所有溶液在实验前预热至37 ℃,并在实验过程中保持在37 ℃。
口腔阶段:黏液蛋白(3.0 mg/mL)在约1 h前溶解在SSF中。将该溶液(7.5 mL)加入到初始样品(7.5 mL)中并将pH值调整为6.8,然后以100 r/min搅拌10 min。
胃阶段:胃蛋白酶(3.2 mg/mL)也提前在SGF中溶解。将该溶液(15 mL)与来自口腔阶段的样品(15 mL)混合并调pH值为2.5,并以100 r/min搅拌2 h以模拟胃部消化条件。
小肠阶段:胆盐和酶提前溶解在磷酸盐缓冲溶液中(5 mmol/L,pH 7.0)。先将胃阶段后的消化物(30 mL)的pH值调整为7.0。然后向样品中加入SIF(1.5 mL)、胆盐溶液(3.5 mL)、脂肪酶溶液(2.5 mL)和胰蛋白酶溶液(2.5 mL)。通过向容器中滴加0.1 mol/L NaOH标准溶液,监测并保持该溶液的pH值在7.0,持续2 h。
消化结束后立刻将消化瓶置于冰水浴中15 min,然后置于搅拌器上取一定质量的原始消化物在4 ℃下离心(15 000×g)30 min并收集中间胶束相。姜黄素含量用紫外可见分光光度计(419 nm)进行测定[19]。
1.3.6 动物实验
1.3.6.1 动物实验分组及生物利用度研究
采用HPLC-MS/MS(orbitrap检测器)方法检测大鼠血浆中姜黄素及其代谢产物的浓度。15只SD 大鼠随机分为3组,每组 5 只(雌雄随机),实验前12 h禁食。姜黄原料均匀分散于0.5%(质量分数)的羧甲基纤维素钠溶液中,商业高吸收姜黄和姜黄脂质体粉分散于超纯水中[20]。所有灌胃样品现配现用,配制时避光。单次喂养以100 mg/kg姜黄素进行生物利用度评价。
1.3.6.2 血浆的采集及检测
对各组大鼠灌胃前(0 h)及灌胃后 0.17 h(约10 min)、0.5、0.75、1、1.5、2、3、4、6、8、11 h各时间点连续采血。每个采血点从老鼠尾部静脉采取全血 0.5 mL,放置于准备好的肝素钠管中,轻轻振摇使血液与抗凝剂充分混匀。血样置冰盒中,避光存放,并于采集后 30 min内采用冷冻离心机离心(3 000 r/min,10 min)。离心后的血清转移至冻存管中,并加入5 μL 50%的色谱级甲酸溶液,放入-80 ℃冰箱保存供后续测试。从血液采集到样品保存至-80 ℃冰箱,所有操作在1~1.5 h完成。所有血清样品在5 d内完成液质检测。具体步骤:取150 μL血浆样品,加入含有色谱级甲酸的乙酸乙酯溶液 450 μL涡旋混匀 5 min,采用冷冻离心机在10 000 r/min 离心10 min,取上清液,定容至500 μL后移入带有内衬管的棕色进样瓶中,进行液质分析。
1.3.6.3 色谱及质谱条件
色谱柱:C18柱,流动相B:0.1%甲酸水,流动相C:0.1%甲酸甲醇,流速0.2 mL/min, 柱温20 ℃。
离子源:ESI;正离子模式;采集模式:targeted-sim-ddms2。以母离子定量:姜黄素(369.133 26),姜黄素葡萄糖醛酸(545.165 35)。以子离子定性:姜黄素(285.111 63,245.080 46),姜黄素葡萄糖醛酸(369.132 69,285.111 63,245.080 46,177.054 38)。
1.4 数据统计与分析
实验数据以均数±标准差表示,采用SPSS Version 18.0软件进行分析。P<0.05表示差异有统计学意义。
2 结果与分析
2.1 理化性质表征
脂质体的粒径是一个重要参数,其大小不仅影响自身的环境稳定性,还对生物活性成分的负载、吸收和释放等有较大影响[21]。如图1所示,当磷脂添加量为2.5%(质量分数)时,脂质体粒径为(5.23±0.14) μm,随着磷脂添加量的增加,姜黄脂质体粉的粒径先减小后趋于平稳。这可能是因为当磷脂含量较低时,膜流动性和稳定性较差,不足以包封体系中大量的姜黄素;随着磷脂添加量的增加,在高压均质过程中形成的膜结构更加紧密稳定,粒径减小;继续添加磷脂对粒径的影响不大,可能主要用于增加双分子层的厚度[22]。
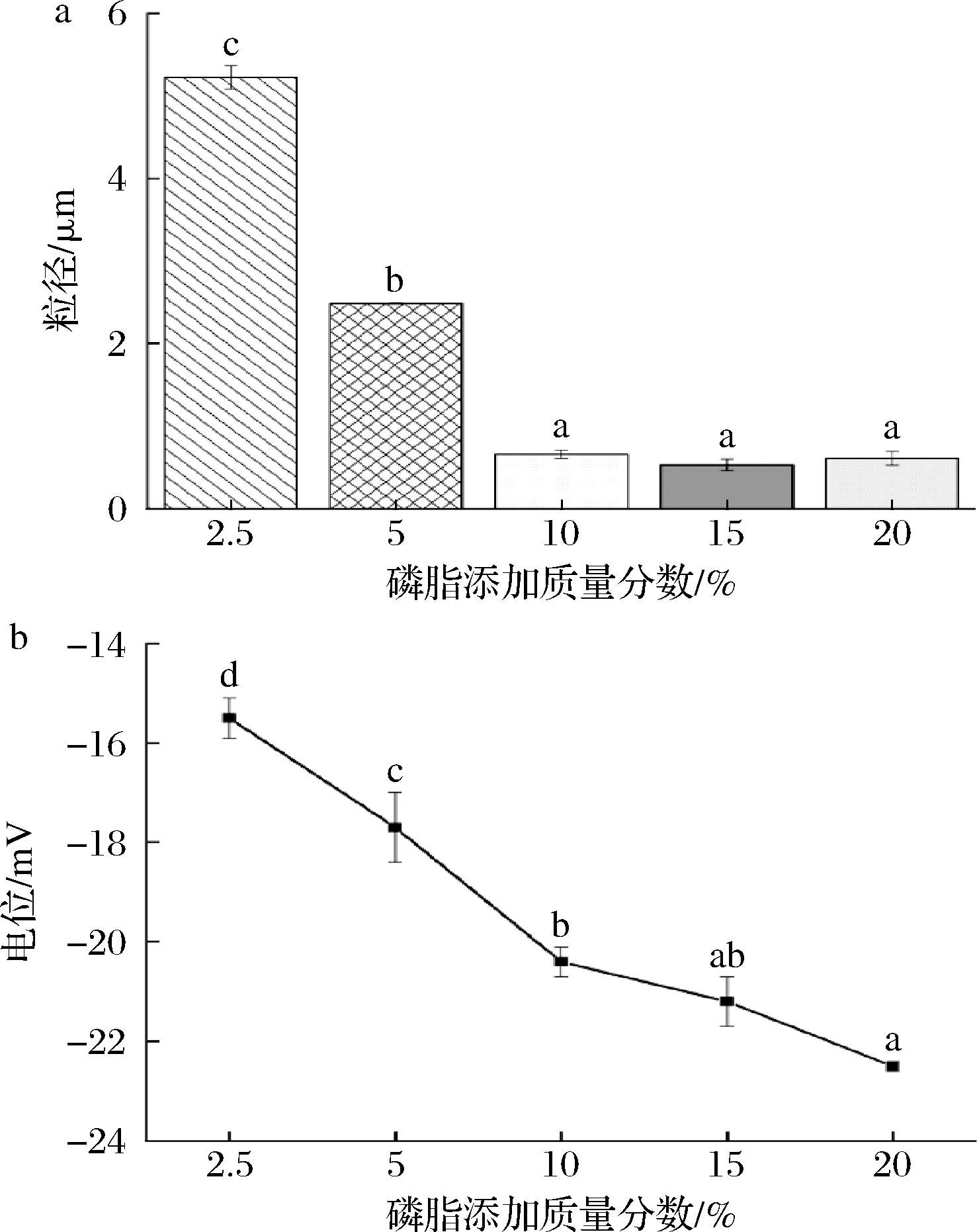
a-粒径;b-电位
图1 不同磷脂添加量姜黄脂质体粉的粒径和电位表征
Fig.1 Characterization of particle size and zeta potential of turmeric liposomes powder with different phospholipid addition levels
注:不同小写字母表示显著性差异(P<0.05)(下同)。
Zeta电位值也是影响脂质体稳定性的重要因素。一般来说,ζ电位的绝对值越高,脂质体体系越稳定[23]。姜黄脂质体粉的电位受磷脂含量影响较大。随着磷脂添加量的增加,姜黄脂质体粉的Zeta电位绝对值逐渐增大,表明脂质体之间静电排斥力逐渐增强,对体系的稳定性具有重要作用。
对不同磷脂含量的姜黄脂质体粉进行微观结构表征(图2),可以观察到微胶囊表面都有一些“褶皱”。这些褶皱的形成是因为料液在喷雾干燥中首先被雾化成小液滴,并在热空气中快速干燥,导致表面形成不同程度的褶皱[24]。随着姜黄脂质体粉中磷脂含量的增加,微胶囊的形状更加规则饱满且表面逐渐平滑。这可能是因为多余的磷脂在喷雾干燥过程中起到了一定的填充作用。

图2 不同磷脂添加量姜黄脂质体粉的微观结构
Fig.2 Microstructure of turmeric liposomes powder with different levels of phospholipid addition
脂质体复溶后的结构也是判断脂质体情况的重要指标,如图3所示,TEM图像显示姜黄素脂质体粉剂复溶后为球形,具有多层结构,在整个图像中均匀分布。这一现象表明,姜黄素脂质体的成功制备且其粉剂具有良好的溶解性。综上,选用10%磷脂添加量的姜黄脂质体粉进行后续研究。
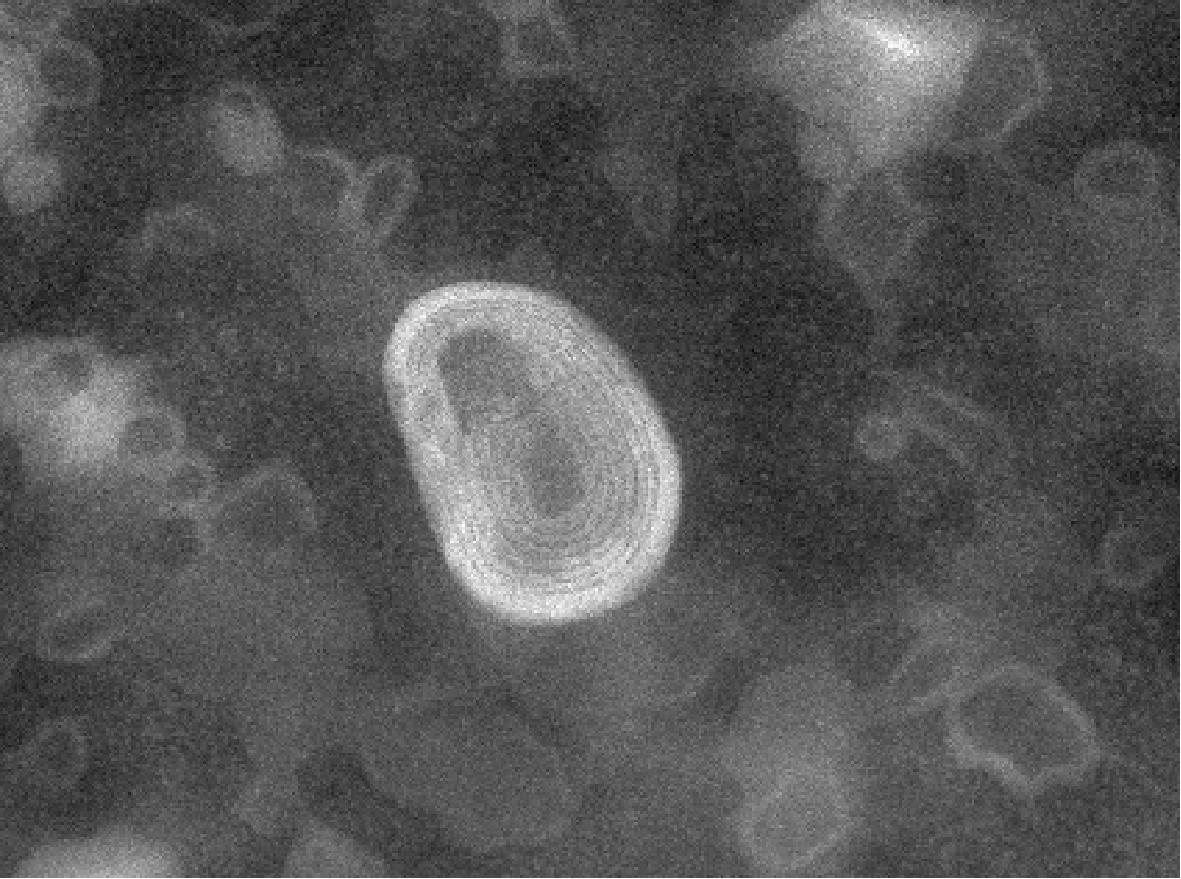
图3 10%磷脂含量姜黄脂质体粉复溶后的微观结构
Fig.3 Microstructure of redissolved turmeric liposomes powder with 10% phospholipid addition
2.2 贮藏稳定性分析
贮藏稳定性分析可为样品有效期的确定提供必要的数据支持。实验过程中考察了姜黄脂质体粉在加速贮藏过程中的外观、含量、包封率、休止角、崩溃角、松密度及实密度等指标的变化情况。如图4所示,40 ℃加速贮藏3个月,姜黄脂质体粉颜色变化不明显,粉体未出现结块现象。姜黄素含量轻微下降,从(60.80±0.15) mg/mL降低至(55.12±0.55) mg/mL,这可能是因为长时间高温使少量姜黄素发生了降解[25]。但经3个月的加速贮藏后,姜黄脂质体粉包封率数值从0月的98.1%降低至3月的91.1%,结果显示有所下降但基本稳定,表现出优秀的姜黄素包封和保留能力。SILVA等[26]所制备的姜黄脂质体粉在储存60 d后仅有80%的保留率。加速3个月休止角、崩溃角、松密度及实密度无明显变化且从这些数值上可以看出姜黄脂质体粉具有良好的粉体学特性(表1)。综上,姜黄脂质体粉具有良好的贮藏稳定性,能为更好的发挥其功效奠定基础。
表1 姜黄脂质体粉含量、包封率、休止角、崩溃角、松密度及实密度随加速贮藏时间的变化
Table 1 Changes in curcumin liposome powder content, encapsulation rate, repose angle, collapse angle, bulk density, and true density over accelerated storage time

加速考察含量/(mg/g)包封率/%休止角/°崩溃角/°松密度实密度初始60.80±0.15c98.11±0.50c37.86±0.07a28.22±0.11a0.52±0.02a0.68±0.05a1月58.60±1.23bc94.52±0.11b37.08±0.12a29.01±0.13a0.53±0.05a0.68±0.03a2月56.35±0.62ab91.56±0.32a37.96±0.04a28.51±0.06a0.52±0.03a0.67±0.01a3月55.12±0.55a91.13±0.26a37.19±0.10a28.88±0.05a0.52±0.04a0.68±0.07a
注:不同小写字母表示显著性差异(P<0.05)。

a-初始;b-40 ℃加速贮藏3个月
图4 10%磷脂含量姜黄脂质体粉初始和40 ℃加速贮藏3个月的表观图
Fig.4 Appearance of turmeric liposomes powder with 10% phospholipid content after accelerated storage at 40 ℃ for 3 months
2.3 模拟体外消化特性
为了考察姜黄脂质体粉中姜黄素的吸收性能,本研究采用模拟体外消化方法,以姜黄原料和商业高吸收姜黄作为对照,测定各样品在消化过程中的外观变化和姜黄素的生物可及性。
在经过每个胃肠道阶段后,各样品的外观有一些差异(图5-a)。姜黄原料自身晶体颗粒较大具有较强疏水性,当其加到水中之后会浮在水面上。与之相反,商业高吸收姜黄和姜黄脂质体粉可以和水均匀混合。当在胃和肠消化结束后,可以发现消化液底部仍有很多未被消化的姜黄原料。相较之下,商业高吸收姜黄和姜黄脂质体粉均匀分散在胃液和小肠液中,表明姜黄原料在未经处理时的吸收性能较差。图5-b的生物可及性结果也证实了这一点,姜黄原料的生物可及性<1%,几乎不能被吸收利用[8]。而商业高吸收姜黄和姜黄脂质体粉显著改善了姜黄素的生物可及性(P<0.05),其中商业高吸收姜黄约为姜黄原料的4倍,姜黄脂质体粉约为姜黄原料的11倍,说明通过高压均质技术制备的脂质体成功将姜黄素包埋。综上,脂质体包埋对姜黄素生物可及性的改善有积极意义。
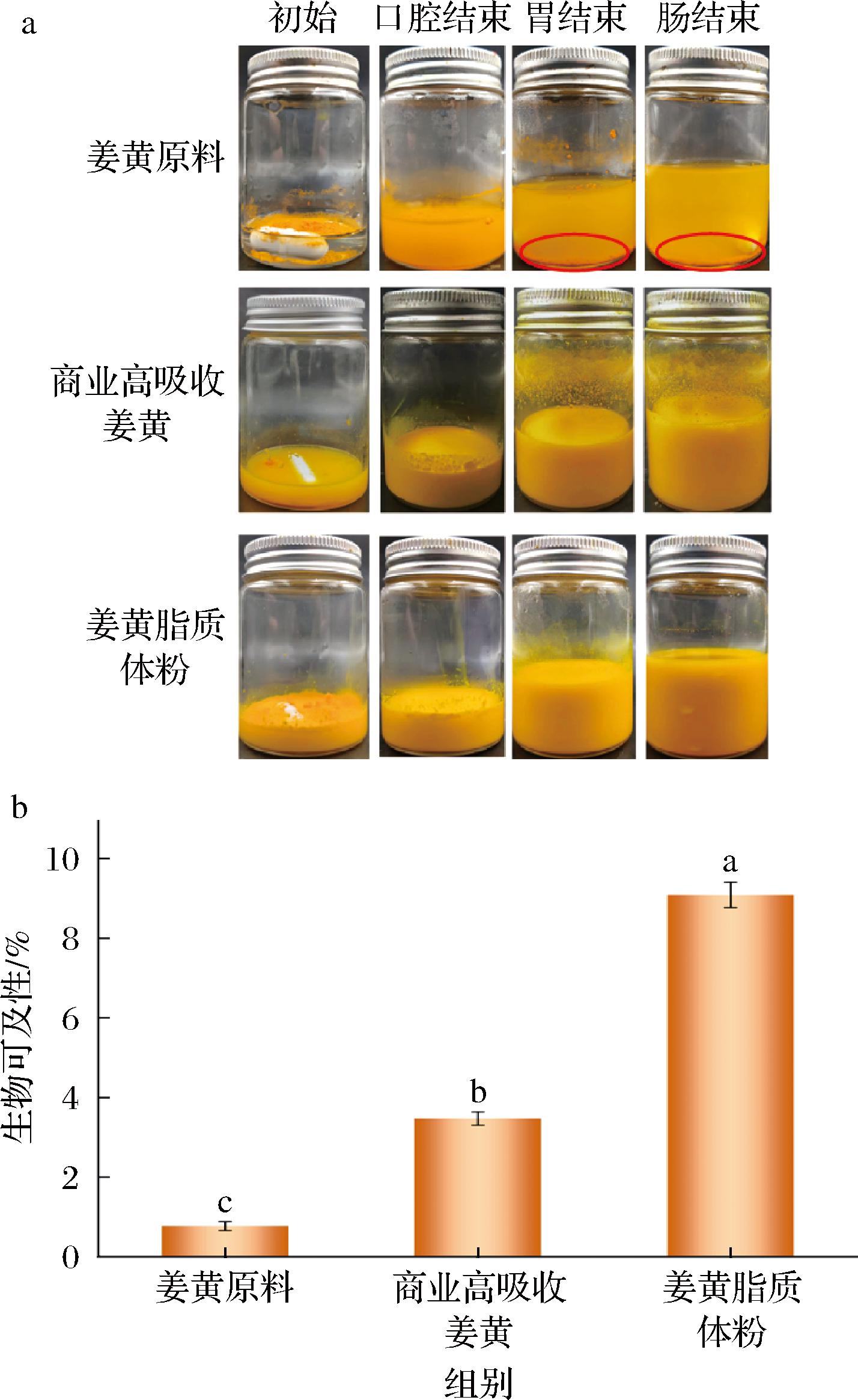
a-模拟体外消化表观图;b-姜黄素生物可及性
图5 模拟体外消化表观图和姜黄素生物可及性
Fig.5 Apparent images of simulated in vitro digestion and bioaccessibility of curcumin
2.4 动物实验
在模拟体外消化的基础上,进一步研究其在大鼠口服灌胃后的吸收性能。大鼠按照100 mg/kg姜黄素计量灌胃姜黄原料,商业高吸收姜黄及姜黄脂质体粉后,如表2所示,血清中总姜黄素(包含姜黄素和姜黄素代谢产物姜黄素葡萄醛酸)曲线下面积(area under curve,AUC)分别为2 095.68,16 968.18和4 105.80 (ng·h/mL),姜黄脂质体粉中总姜黄素AUC是姜黄原料的8.1倍,是商业高吸收姜黄的4.13倍。血清中姜黄素代谢产物(以姜黄素葡萄醛酸计)AUC分别为1 865.97,17 998.18、4 028.7 ng·h/mL,姜黄脂质体粉中姜黄素代谢产物AUC是姜黄原料的9.65倍,是商业高吸收姜黄的4.47倍。如图6-a所示,姜黄原料、姜黄脂质体粉和商业高吸收姜黄均可以进入血液,但从图6-b可以看出姜黄脂质体粉的姜黄素葡萄糖醛酸浓度显著高于姜黄原料和商业高吸收姜黄,可能是高压均质处理使姜黄脂质体粉的粒径更小,更容易被肠道吸收进血液,这也与模拟体外消化结果一致。因此,采用高压均质技术制备的姜黄脂质体粉能够显著地改善姜黄素在大鼠体内的药动力学过程,从而有效地提高了姜黄素的生物利用度,提高其口服吸收性能。
表2 三种样品主要药动力学参数比较
Table 2 Comparison of the main pharmacokinetic parameters among three samples
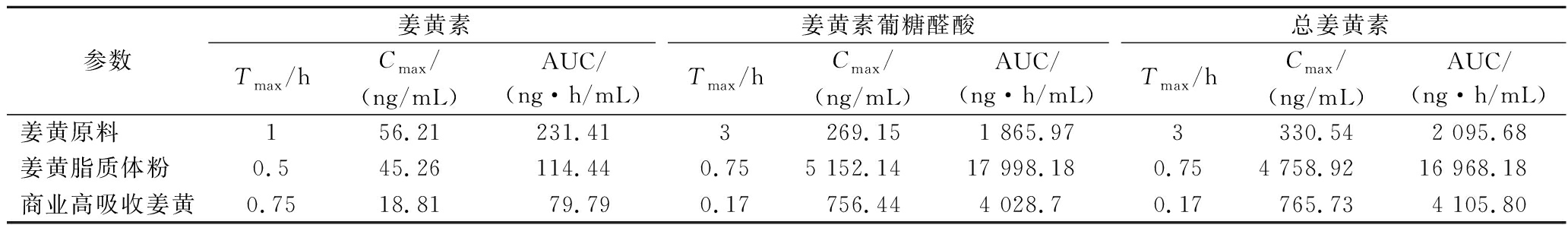
参数姜黄素姜黄素葡糖醛酸总姜黄素Tmax/hCmax/(ng/mL)AUC/(ng·h/mL)Tmax/hCmax/(ng/mL)AUC/(ng·h/mL)Tmax/hCmax/(ng/mL)AUC/(ng·h/mL)姜黄原料156.21231.413269.151 865.973330.542 095.68姜黄脂质体粉0.545.26114.440.755 152.1417 998.180.754 758.9216 968.18商业高吸收姜黄0.7518.8179.790.17756.444 028.70.17765.734 105.80
注:Tmax表示达到最大血药浓度的时间,Cmax表示最大血药浓度。

a-姜黄素;b-姜黄素葡萄醛酸;c-总姜黄素
图6 大鼠灌胃后各样品姜黄素,姜黄素葡萄醛酸和总姜黄素血药浓度-时间曲线图
Fig.6 Blood concentration-time curves of curcumin, curcumin glucuronide, and total curcuminoids in rats after oral administration of different samples
3 结论
本研究采用高压均质技术制备高负载姜黄脂质体粉,探究了磷脂添加量对脂质体粒径、电位、微观结构等理化性质的影响,评价其贮藏稳定性并以姜黄原料和市售中高吸收姜黄行业标杆品牌物料作为对照组研究其体外和体内吸收性能。结果表明姜黄脂质体粉具有良好的储存稳定性,表观、含量、包封率和其他粉体数据无显著变化。模拟体外消化实验结果表明,脂质体包封可显著改善姜黄素的生物可及性,且高于商业高吸收姜黄。动物实验结果表明,姜黄脂质体粉总姜黄素AUC是姜黄原料的8.1倍,是商业高吸收姜黄的4.13倍,姜黄脂质体粉显著提升了姜黄素的口服吸收性能。综上,采用高压均质及喷雾干燥技术制备的姜黄脂质体粉是实现姜黄素高负载及高吸收的有效手段,对姜黄相关产品的开发具有重要意义。需要指出的是,本研究中药代动力学数据由于大鼠个体代谢存在差异等原因而存在一定的数据偏差,我们计划在后续研究中进一步扩大实验动物的样本量以减少个体差异所带来的影响。此外,我们将致力于推进临床试验,通过人体实验进一步确认和完善该研究成果,旨在确保所得结论的精确性和稳定性,以期为人类健康做出更大的贡献。
[1] KUNNUMAKKARA A B, BORDOLOI D, PADMAVATHI G, et al.Curcumin, the golden nutraceutical:Multitargeting for multiple chronic diseases[J].British Journal of Pharmacology, 2017, 174(11):1325-1348.
[2] SOLEIMANI V, SAHEBKAR A, HOSSEINZADEH H.Turmeric (Curcuma longa) and its major constituent (curcumin) as nontoxic and safe substances:Review[J].Phytotherapy Research:PTR, 2018, 32(6):985-995.
[3] RAI M, PANDIT R, GAIKWAD S, et al.Potential applications of curcumin and curcumin nanoparticles:From traditional therapeutics to modern nanomedicine[J].Nanotechnology Reviews, 2015, 4(2):161-172.
[4] WANG Q R, YE C Q, SUN S K, et al.Curcumin attenuates collagen-induced rat arthritis via anti-inflammatory and apoptotic effects[J].International Immunopharmacology, 2019, 72:292-300.
[5] WANG L, MU R J, LI Y Z, et al.Characterization and antibacterial activity evaluation of curcumin loaded konjac glucomannan and zein nanofibril films[J].LWT, 2019, 113:108293.
[6] JIANG T, CHARCOSSET C.Encapsulation of curcumin within oil-in-water emulsions prepared by premix membrane emulsification:Impact of droplet size and carrier oil on the chemical stability of curcumin[J].Food Research International, 2022, 157:111475.
[7] SHAO W J, YU Z W, CHIANG Y T, et al.Curcumin prevents high fat diet induced insulin resistance and obesity via attenuating lipogenesis in liver and inflammatory pathway in adipocytes[J].PLoS One, 2012, 7(1):e28784.
[8] 刘佳, 黄宇虹, 王保和, 等.姜黄素类化合物体内代谢途径及其代谢产物的研究进展[J].现代药物与临床, 2015, 30(12):1553-1557.
LIU J, HUANG Y H, WANG B H, et al.Research progress on the metabolic pathways in vivo and their metabolites of curcuminoids[J].Drugs &Clinic, 2015, 30(12):1553-1557.
[9] HOEHLE S I, PFEIFFER E, S LYOM A M, et al.Metabolism of curcuminoids in tissue slices and subcellular fractions from rat liver[J].Journal of Agricultural and Food Chemistry, 2006, 54(3):756-764.
LYOM A M, et al.Metabolism of curcuminoids in tissue slices and subcellular fractions from rat liver[J].Journal of Agricultural and Food Chemistry, 2006, 54(3):756-764.
[10] HYUN J E, YI H Y, HONG G P, et al.Digestion stability of curcumin-loaded nanostructured lipid carrier[J].LWT, 2022, 162:113474.
[11] ESPOSTO B S, JAUREGI P, TAPIA-BL CIDO D R, et al.Liposomes vs.chitosomes:Encapsulating food bioactives[J].Trends in Food Science &Technology, 2021, 108:40-48.
CIDO D R, et al.Liposomes vs.chitosomes:Encapsulating food bioactives[J].Trends in Food Science &Technology, 2021, 108:40-48.
[12] LIU W L, YE A Q, LIU W, et al.Stability during in vitro digestion of lactoferrin-loaded liposomes prepared from milk fat globule membrane-derived phospholipids[J].Journal of Dairy Science, 2013, 96(4):2061-2070.
[13] LIU H, ZHANG J B, XIONG Y, et al.Improving norbixin dispersibility and stability by liposomal encapsulation using the pH-driven method[J].Journal of the Science of Food and Agriculture, 2022, 102(5):2070-2079.
[14] PENG S F, ZOU L Q, LIU W, et al.Fabrication and characterization of curcumin-loaded liposomes formed from sunflower lecithin:Impact of composition and environmental stress[J].Journal of Agricultural and Food Chemistry, 2018, 66(46):12421-12430.
[15] PETRALITO S, SPERA R, PACELLI S, et al.Design and development of PEG-DMA gel-in-liposomes as a new tool for drug delivery[J].Reactive and Functional Polymers, 2014, 77:30-38.
[16] LAJAVARDI L, CAMELO S, AGNELY F, et al.New formulation of vasoactive intestinal peptide using liposomes in hyaluronic acid gel for uveitis[J].Journal of Controlled Release, 2009, 139(1):22-30.
[17] 黄笛. 高压均质结合酶法改性对蛋清液加工性能的影响[D].雅安:四川农业大学, 2022.
HUANG D.Effect of high pressure homogenization and enzymatic modification on the processing performance of egg white liquid[D].Ya’an:Sichuan Agricultural University, 2022.
[18] GAO H X, CHENG C, FANG S Q, et al.Study on curcumin encapsulated in whole nutritional food model milk:Effect of fat content, and partitioning situation[J].Journal of Functional Foods, 2022, 90:104990.
[19] PENG S F, LI Z L, ZOU L Q, et al.Enhancement of curcumin bioavailability by encapsulation in sophorolipid-coated nanoparticles:An in vitro and in vivo study[J].Journal of Agricultural and Food Chemistry, 2018, 66(6):1488-1497.
[20] XIE X X, TAO Q, ZOU Y N, et al.PLGA nanoparticles improve the oral bioavailability of curcumin in rats:Characterizations and mechanisms[J].Journal of Agricultural and Food Chemistry, 2011, 59(17):9280-9289.
[21] LI Y Y, SUN K Y, CHEN S N, et al.Nano-resveratrol liposome:Physicochemical stability, in vitro release, and cytotoxicity[J].Applied Biochemistry and Biotechnology, 2023, 195(10):5950-5965.
[22] 张转转. 褐藻胶寡糖纳米脂质体的制备及其生物学功能研究[D].杭州:中国计量大学, 2016.
ZHANG Z Z.Preparation and biological function of alginate oligosaccharide nanoliposomes[D].Hangzhou:China University of Metrology, 2016.
[23] SRIHERA N, LI Y, ZHANG T T, et al.Preparation and characterization of astaxanthin-loaded liposomes stabilized by sea cucumber sulfated sterols instead of cholesterol[J].Journal of Oleo Science, 2022, 71(3):401-410.
[24] XIE Y L, ZHOU H M, LIANG X H, et al.Study on the morphology, particle size and thermal properties of vitamin A microencapsulated by starch octenylsucciniate[J].Agricultural Sciences in China, 2010, 9(7):1058-1064.
[25] NEVES M I L, DESOBRY-BANON S, PERRONE I T, et al.Encapsulation of curcumin in milk powders by spray-drying:Physicochemistry, rehydration properties, and stability during storage[J].Powder Technology, 2019, 345:601-607.
[26] SILVA G S, JANGE C G, ROCHA J S S, et al.Characterisation of curcumin-loaded proliposomes produced by coating of micronised sucrose and hydration of phospholipid powders to obtain multilamellar liposomes[J].International Journal of Food Science &Technology, 2017, 52(3):772-780.