随着经济的发展由石油衍生的聚合物制成的塑料包装使地球的白色污染进一步加重。因此急需一类可替代传统合成塑料的包装材料。可食性包装膜应运而生。壳聚糖是一种含氮碱性天然多糖,是甲壳素脱除部分乙酰基的产物,其广泛应用于食品添加剂、生物医用领域和组织工程载体材料等众多领域[1-3],具有天然独特的可降解性和可再生性,是十分具有前景的替代传统合成塑料的环保材料。可食性包装薄膜的主要作用是控制水分损失和减少不良化学反应速率,以提高各种加工食品和新鲜食品的质量和安全性[4-5]。多糖是含量丰富的天然聚合物,近年来被广泛用于制备可食薄膜或涂层材料[6]。壳聚糖具有很高的黏度,类似于天然胶,由于具有活性氨基而具有抗菌特性[7],将壳聚糖基制成薄膜,可将食品与周围环境分离开,减少与外界不良因素的相互作用,避免理想化合物(风味挥发物)的损失,从而提高食品的质量并延长食品的货架期[8]。
诺丽(Morinda citrifolia L.)别称海天巴戟,是茜草科热带植物。在南太平洋、夏威夷及中国的海南、台湾等多个地区均有分布,其根、茎、叶、花、果实均可入药[9]。研究发现诺丽果中富含多糖、多酚、东莨菪素、茜素和芦丁等活性物质,诺丽多糖(noni polysaccharide,NP)能够阻断来自于足水肿的炎症介质和信号分子,具有消炎镇定、抗坏血酸、抗氧化等作用[10]。亚临界水提取是在亚临界条件下水的电离常数和扩散系数增加,但由于水的物理化学性质变化都会在萃取结束时得到恢复,并且在提取过程中不使用任何化学物质,亚临界水提取过程不会导致废液的产生,对环境的危害最小。在亚临界条件下,水的介电常数与有机溶剂相似。因此,只需改变水的温度和压力,就可以用水选择性地提取极性和非极性物质。相比于热水浸提、超声提取等常用的传统提取方法,亚临界水提取提供了比传统提取技术更好的优势,如提取率高、节省时间、设备简单、成本低且环保等优势。有研究发现,不同浓度含蓝莓叶提取物的新型生物可降解诺丽多糖膜,具有作为抗氧化包装材料的潜力[11]。由此可见,诺丽多糖具备良好的成膜性能,而纯的壳聚糖薄膜机械性能不强[12]。将诺丽多糖引入壳聚糖薄膜中制备出不含其他食品添加剂的可食性诺丽多糖复合膜,并对其形态结构、力学性能进行了表征,且将其应用到食品的内包装上,为环境的可持续发展做出贡献。
1 材料与方法
1.1 材料与仪器
诺丽果,海南诺丽谷集团(海南)有限公司;椰子油,海口植之素生物资源研究所有限公司;水杨酸、壳聚糖、NaCl,国药集团化学试剂有限公司;无水乙醇、无水甲醇、过硫酸钾、氯仿、冰乙酸,西陇科学股份有限公司;苯酚、硫酸,广州化学试剂厂;ABTS试剂,美国Sigma公司;DPPH试剂,阿拉丁试剂有限公司。试剂均为分析纯。
Synergy LX型酶标仪,美国BioTek公司;EL204型电子分析天平,梅特勒-托利多仪器上海有限公司;GL-20G型高速冷冻离心机,上海安亭科学仪器厂;SHZ-B型水浴恒温振荡器,上海龙跃仪器设备有限公司;TA.XT Plus型质构仪,英国Stable Micro Systems公司;XD5000型旋转蒸发器,上海贤德实验仪器有限公司;7890B型气相色谱质谱联用仪,美国Agilent公司;XO-5200DTD型超声机,南京先欧仪器制造有限公司。
1.2 诺丽多糖的提取
亚临界水提取是一种环保的可持续提取方法,利用水作为萃取剂,在密闭、高温的压力容器内,通过物料与萃取剂在浸泡过程中的分子扩散过程,达到固体物料中的成分转移到液态的萃取剂中,再通过减压蒸发的过程将萃取剂与目的产物分离,最终得到目的产物的一种新型萃取与分离技术。亚临界水提取采用的是实验室自主开发和创新设计的专利技术仪器进行的,有学者报告了该技术的使用方法[13-14]。
亚临界水提多糖参考文献[15]的方法,从果园采摘的新鲜诺丽果洗净后晾干,切成薄片后放入烘箱60 ℃烘干,使用中草药粉碎机将其粉碎后,过60目筛,并用索氏抽提法提取诺丽果粉中的油脂,去除油脂。称取脱脂后的诺丽果粉加入适量蒸馏水(果粉和水按料液比为1∶30,g∶mL),放入亚临界提取器中,在150 ℃提取30 min。过滤后取上清液,并旋蒸至滤液体积的1/4,放凉后加入4倍体积无水乙醇,放入4 ℃冰箱过夜醇沉后取出离心,取沉淀物冻干即制得诺丽多糖。
1.3 诺丽多糖的结构表征
1.3.1 红外光谱测试
将少量诺丽多糖与KBr混合在热灯下研磨均匀并压制成片,上机,采用傅立叶变换红外光谱仪对NP进行了结构表征。傅立叶变换红外光谱记录的频率范围为4 000~500 cm-1。
1.3.2 X射线衍射测试
将少量诺丽多糖用X射线衍射仪获得衍射图谱。设计参数如下:射线采用CuKct射线X=154 nm,采用Ni片作滤波,扫描范围5°~50°,扫描速度10 °/min。
1.3.3 诺丽多糖的单糖组成成分分析
先取10 mg诺丽多糖,用5 mL 2 mol/L三氟乙酸(trifluoroacetic acid,TFA)在100 ℃下水解2 h,冷却后开盖,取1 mL水解后样品溶液加入1 mL无水甲醇,70 ℃水浴下用N2吹干,如此重复加无水甲醇并用N2吹干2次,以去除TFA。分别取400 μL的混合单糖标准溶液或多糖水解液于5 mL的具塞试管中,加400 μL 0.5 mol/L的1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)-无水甲醇溶液,漩涡混匀,于70 ℃水浴中反应2 h,取出放置冷却至室温,加400 μL 0.3 mol/L HCl溶液中和(pH 6~7);加1 200 μL去离子水,再加入等体积的氯仿,漩涡混匀振荡,静置,弃去氯仿相,如此萃取2次。将水相用0.45 μm微孔滤膜(水系)过滤后待进样分析。
1.4 诺丽多糖复合膜的制备
将壳聚糖溶解于含1%(体积分数)冰乙酸溶液中,制备出20 g/L的壳聚糖溶液。分别取2、3、4、5 mg/mL诺丽多糖与20 g/L的壳聚糖(体积比为1∶1)混合搅匀,45 ℃水浴溶胀2 h加入(占25%,体积分数)的甘油作为增塑剂,磁力搅拌2 h,冷却后超声脱气1 h,将成膜液倒在一次性培养皿上,55 ℃烘干,取出,用2%(质量分数)NaOH溶液浸泡0.5 h,流水冲洗,将膜揭下阴干,后放入干燥器内固定保存2 d,分别命名为2 NPF、3 NPF、4 NPF、5 NPF,并以纯的壳聚糖膜(1 NPF)为对照,测其性能。
1.5 特性研究
1.5.1 物理性质测定
1.5.1.1 膜厚
选取厚度均匀,表面平滑无气泡的复合膜,在膜上随机选取5个点,用千分尺测量其厚度。
1.5.1.2 密度
将膜裁剪成2 cm×2 cm的方形,称质量。膜密度的计算如公式(1)所示:
(1)
式中:ρ,密度,g/cm3;m,膜样品质量,g;s,膜样品面积,cm2;d,膜样品厚度,cm。
1.5.1.3 溶解度
将膜裁剪成10 mm×50 mm小块膜条,置于60 ℃干燥箱中恒温烘干24 h,取出称其质量,记为膜条初始质量[16]。然后将其放入15 mL的大试管中,倒入等量超纯水浸泡24 h取出,用纸擦干膜表面,将其重新放入60 ℃干燥箱中恒温烘干24 h,重复称质量,作为复合膜样品的最后质量记录。膜的溶解度计算如公式(2)所示:
溶解度![]()
(2)
式中:m0,膜样条初始质量,g;m1,膜样条最后质量,g。
1.5.1.4 水蒸气透过率(water vapour permeability, WVP)
采用拟杯子法[17],将CaCl2研磨成粉末,干燥至恒重备用。称5 g NaCl粉末放入透明的玻璃瓶内,控制其距瓶口4~6 mm,选取厚度均匀,表面平滑无气泡的复合膜覆盖密封瓶口并迅速称质量,再将瓶子放入干燥器内,干燥器底部倒入KNO3饱和溶液维持湿度,每隔1 d称质量1次,连续称质量1周后,复合膜水蒸气透过率的计算如公式(3)所示:
(3)
式中:WVP,复合膜的水蒸气透过率,g·m/(m2·s·Pa);Δm,测试前后玻璃瓶质量的增加量,g;d,复合膜的膜厚度,mm;A,复合膜的膜面积,m2,统一为1.6×103 m2;Δt,测量时间,s;Δp,膜两侧的水蒸气压差,Pa,本实验取为3.167×103 Pa。
1.5.1.5 氧气透过率测定
氧气透过率的测定采用压差法,将复合膜裁成10 cm×10 cm的方形放置于气体渗透仪的测试腔内,温度设定23 ℃,相对湿度60%。
1.5.2 红外测试
参考1.3.1节的方法,频率范围为4 000~400 cm-1。
1.5.3 X衍射光谱测试
参考1.3.2节的方法。
1.5.4 扫描电镜测试
将不同的NPF用液氮脆断后固定在样品台上,在真空条件下进行喷金处理,然后将样品置于扫描电子显微镜中观察。
1.5.5 力学性能的测定
复合膜的抗拉强度和断裂延伸率使用质构仪测试[18],选取厚度均匀、无断裂的复合膜,将其裁剪为50 mm×20 mm的长方形膜条,将初始夹距设为45 mm,拉伸速度设为l mm/s,复合膜的抗拉强度和断裂延伸率的计算如公式(4)和公式(5)所示:
(4)
(5)
式中:TS,复合膜的抗拉伸强度,MPa;F,复合膜断裂时所承受的最大压力,N;L,复合膜的厚度,mm;W,复合膜的宽度,mm;EB,膜的断裂延展率,%;L1,初始时两夹距离,mm;L0,膜断裂时两夹具间距离,mm。
1.5.6 光学性能的测定
1.5.6.1 颜色参数
利用色差仪对复合膜的颜色参数进行量化[19]。颜色测量用L*、a*和b*比例尺进行标示,以便容易理解颜色值。色差仪在实验前用专用的白色陶瓷板(L0=94.60,a0=3.6,b0=-2.5)进行标定。在薄膜不同处随机选取5个点进行测量,代入公式(6)~公式(8)计算出膜的各项颜色参数。
以白板为对照的颜色变化:
(6)
复合膜样品的白色指数(white index,WI)的值:
(7)
复合膜样品的黄色指数(yellow index,YI)的值:
(8)
式中:L1、a1、b1分别表示膜的测量值。
1.5.6.2 透明度
选取厚度均匀,表面平滑无气泡的复合膜裁剪成10 mm×30 mm的长方形,将其紧贴与比色皿内壁,不要留有空隙,并以空白比色皿为对照,在600 nm处测定吸光度值。膜不透明度的计算如公式(9)所示:
(9)
式中:O,膜的不透明度,mm-1;A600,在600 nm处的吸光度值;d,膜的厚度,mm。
1.5.7 热稳定性测定
分别取不同比例的诺丽多糖复合膜3~10 mg,上样至热重分析仪。设定参数如下:在N2流环境下,将样品加热温度从室温上升到600 ℃,升温速率10 ℃/min。
1.5.8 抗氧化活性测定
DPPH自由基清除能力的测定参考LI等[20]方法,适当改动。配制浓度为0.2 mmol/mL的DPPH溶液,乙醇定容。取不同比例膜样各0.5 g加入10 mL去离子水中,在室温下搅拌12 h,然后在8 000 r/min下离心15 min,取上清薄膜溶液进行实验。实验加样顺序如表1所示,加样混匀后室温避光反应30 min,以空白参比于517 nm处测吸光度值,以0.05 g/mL抗坏血酸(维生素C)作阳性对照进行测定。
表1 DPPH自由基清除率测定加样顺序
Table 1 DPPH free radical scavenging assay spiking sequence

组别加样顺序D02 mL DPPH+2 mL乙醇D12 mL DPPH+2 mL样品D22 mL乙醇+2 mL样品
DPPH自由基清除率的计算如公式(10)所示:
清除率![]()
(10)
式中:OD0,DPPH和乙醇溶液混合的吸光度值;OD1,DPPH和样品溶液混合的吸光度值;OD2,乙醇和样品溶液混合的吸光度值。
1.5.9 土壤微生物降解性测定
将复合膜裁剪成20 mm×20 mm方形,埋入容量为180 mL含湿润泥土的瓶中,放置深度为瓶内土壤高度的一半。每天在瓶中加10 mL水,以保持土壤湿润,分别在第15天和第30天取出膜样,清理膜表面并干燥至恒重后称质量。土壤微生物降解率的计算如公式(11)所示:
土壤微生物降解率![]()
(11)
式中:m1,放入前NPF干燥至恒重质量,g;m2,取出NPF干燥至恒重质量,g。
1.5.10 椰子油包装的潜在应用
1.5.10.1 NPF的耐油性能
将滤纸在60 ℃烘箱中烘干至恒重,将复合膜覆盖在装有5 mL椰子油的玻璃瓶顶部用绳子固定,倒置于恒重的滤纸上48 h后取下,称重滤纸。吸油率的计算如公式(12)所示:
吸油率![]()
(12)
式中:me,48 h后滤纸的质量,g;mf,烘干滤纸的质量,g。
1.5.10.2 过氧化值的测定
将复合膜覆盖在装有35 mL椰子油的玻璃瓶顶部,在50 ℃下贮存28 d,分别在第1、7、14、21、28天,从每个玻璃瓶中取5 mL样测过氧化值。以无复合膜覆盖的玻璃瓶中的椰子油为对照。过氧化值的测定参照国标GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》中第一法中滴定法。
1.6 数据处理
所有试验均重复3次,结果用平均值±标准偏差表示,使用SPSS软件进行Waller-Duncan检验统计学显著性分析,P<0.05为显著性差异。Origin 2021软件进行制图。
2 结果与分析
2.1 诺丽多糖的结构表征
2.1.1 红外光谱
由图1可知,所制得的诺丽多糖在3 389 cm-1和2 931 cm-1的吸收峰较为清晰,分别归因于—OH基团和C—H键的伸缩振动,在多糖中,羧酸的羰基伸缩振动分别出现在1 710~1 740 cm-1而羧酸基的不对称振动和对称振动分别出现在1 600~1 651 cm-1和1 408~1 450 cm-1,这几个吸收峰被认为是多糖聚合物的特征带[21]。
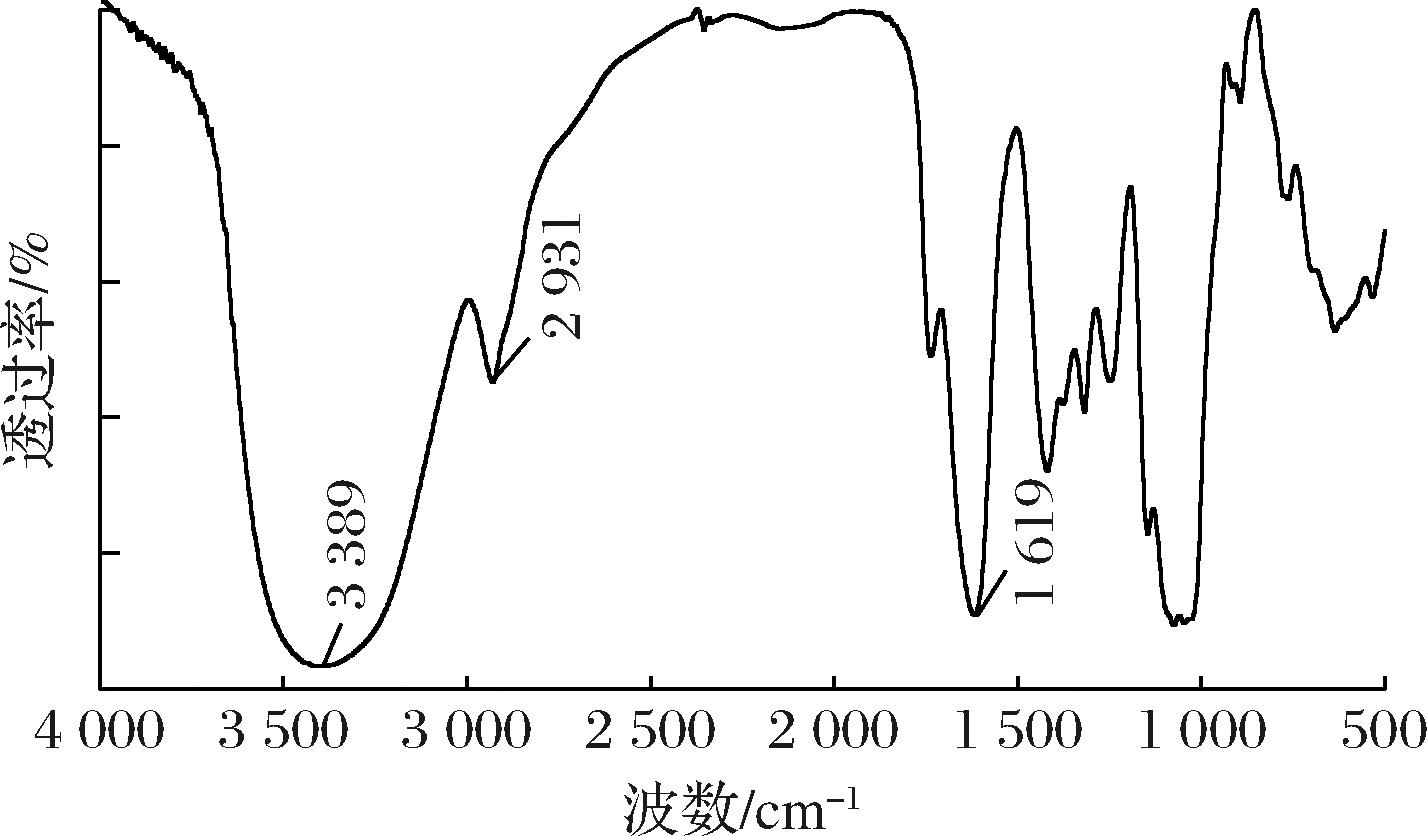
图1 诺丽多糖的红外光谱图
Fig.1 Infrared spectroscopic analysis of noni polysaccharide
2.1.2 X射线衍射
由图2可见,诺丽多糖在2θ=14.9°和20.1°处有衍射峰,诺丽多糖属于高分子聚合物,化学结构复杂且分子多呈无序形态,因此不能形成大量单晶体,大多以多晶体或非晶体的无定形形式存在。诺丽多糖的X-射线衍射图谱分析为复合膜相容性的表征奠定了基础。
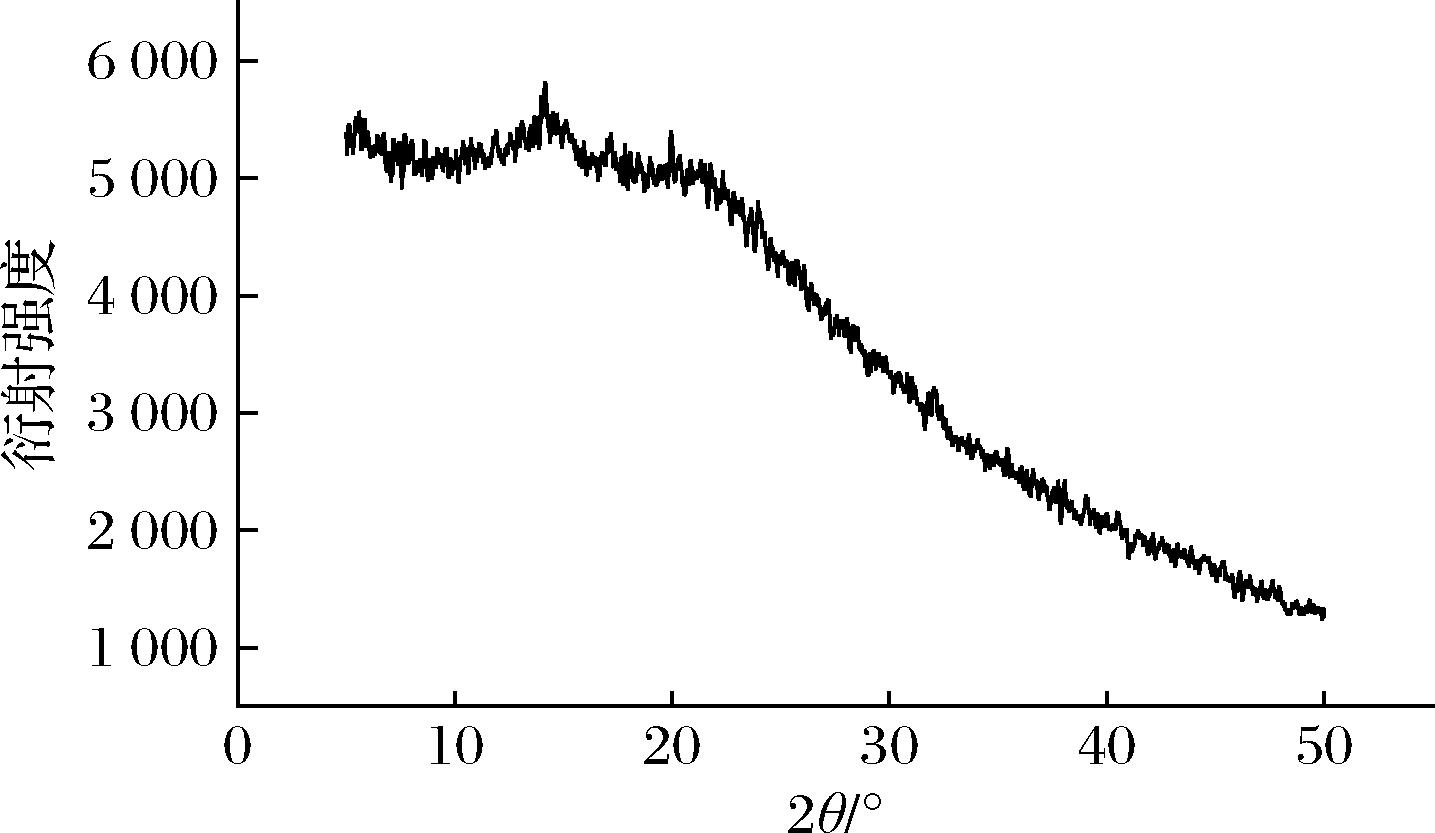
图2 诺丽多糖的X衍射图
Fig.2 X-ray diffraction pattern of noni polysaccharide
2.1.3 液相色谱-离子阱飞行时间质谱法(liquid chromatography-ion trap time-of-flight mass spectrometry LCMS-IT-TOF)分析
多糖中单糖的组成分析是研究多糖结构和性质的基本内容,单糖组成的测定可收集有关生物聚合物的单糖组成信息。通过比较混合标准品与诺丽多糖保留时间确定单糖种类,根据各峰面积比计算单糖的物质的量之比。如表2所示,诺丽多糖是一种由9种单糖组成的酸性多糖。由Fuc、Ara、Rha、Gal、Glc、Xyl、Man、Gal-UA、Glc-UA组成,物质的量比为0.164 1∶2.109 3∶7.975 8∶13.914 5∶17.023 9∶3.158 2∶5.329 7,其中Glc含量最高。
表2 诺丽多糖的单糖组成
Table 2 Monosaccharide composition of noni polysaccharide
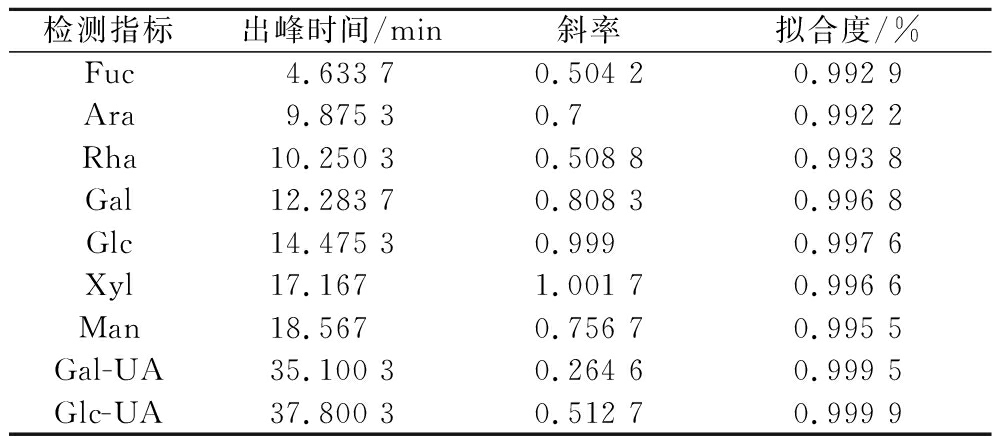
检测指标出峰时间/min斜率拟合度/%Fuc4.633 70.504 20.992 9Ara9.875 30.70.992 2Rha10.250 30.508 80.993 8Gal12.283 70.808 30.996 8Glc14.475 30.9990.997 6Xyl17.1671.001 70.996 6Man18.5670.756 70.995 5Gal-UA35.100 30.264 60.999 5Glc-UA37.800 30.512 70.999 9
2.2 NPF的表征
2.2.1 NPF物理性质的测定分析
2.2.1.1 膜厚和密度
如表3所示,随着诺丽多糖添加量的增多,复合膜的厚度显著增加的同时密度也显著增加(P<0.05)。可能是由于固体含量的增加和诺丽多糖液滴对壳聚糖聚合物链造成破坏,壳聚糖作为膜的基本成分,其添加量也带动了膜厚的增加;并可能导致分子链构象的改变和多糖在膜中的更大分散,从而产生更厚的膜。在壳聚糖薄膜中植物提取物的添加,也导致了膜厚的增加[22]。因此,植物提取物与壳聚糖网络的完整性也会影响膜的最终厚度。
表3 不同NPF的厚度、密度、溶解度、透明度、水蒸气透过率和氧气透过率
Table 3 Thickness, density, solubility, transparency, water vapor transmission rates, and oxygen transmission rate of different NPFs
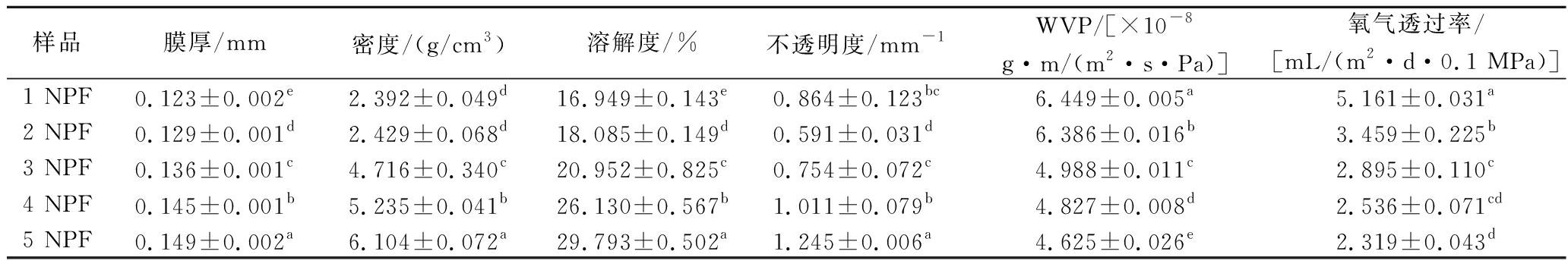
样品膜厚/mm密度/(g/cm3)溶解度/%不透明度/mm-1WVP/[×10-8g·m/(m2·s·Pa)]氧气透过率/[mL/(m2·d·0.1 MPa)]1 NPF0.123±0.002e2.392±0.049d16.949±0.143e0.864±0.123bc6.449±0.005a5.161±0.031a2 NPF0.129±0.001d2.429±0.068d18.085±0.149d0.591±0.031d6.386±0.016b3.459±0.225b3 NPF0.136±0.001c4.716±0.340c20.952±0.825c0.754±0.072c4.988±0.011c2.895±0.110c4 NPF0.145±0.001b5.235±0.041b26.130±0.567b1.011±0.079b4.827±0.008d2.536±0.071cd5 NPF0.149±0.002a6.104±0.072a29.793±0.502a1.245±0.006a4.625±0.026e2.319±0.043d
注:同一列中不同小写字母(a~h)表示差异显著(P<0.05)(下同)。
2.2.1.2 溶解度
复合膜的溶解度对膜的防水性能有很大的影响,如表3所示,随着复合膜中多糖添加比例的加大,复合膜的溶解度也呈增大的趋势(P<0.05),因为诺丽多糖结构具有亲水性,且壳聚糖结构中存在类似羟基的亲水性基团,水分子更容易进入膜内。
2.2.1.3 水蒸气透过率
水蒸气透过率是判断食品复合膜质量的一个重要参数,其通过覆盖包装减少食品在贮存运输途中水分的流失从而延长食品的保质期。如表3所示,5 NPF的WVP值最低,较高浓度的诺丽多糖加入复合膜中使其亲水性达到饱和状态,同时诺丽多糖的加入填补了多糖链中存在的结构空白,从而堵塞了水在膜上的运输通道和途径。膜的WVP也受提取物、温度、湿度和甘油添加量的相互作用和均匀分布的影响。
2.2.1.4 氧气透过率
诺丽多糖添加量对复合膜氧气透过率的影响见表3,诺丽多糖的添加降低了复合膜的氧气透过率,与纯度壳聚糖膜(1 NPF)相比,其他添加了诺丽多糖的复合膜阻氧率更高。其中,5 NPF的氧气透过率最低,为(2.319±0.043) mL/(m2·d·0.1 MPa),可能是因为诺丽多糖的添加增大了膜厚度,且诺丽多糖与壳聚糖具有良好的相容性,复合膜结构致密导致氧气难以通过。
2.2.1.5 透明度
透明度测试可发现不透明度值受到诺丽多糖浓度增加的显著影响(P<0.05),由于不透明度的变化归因于诺丽多糖的添加,多糖含量越高,膜的不透明度值越高,也可能是复合膜在干燥过程中逐渐紧皱,从而降低了透明度,5 NPF的不透明度比1 NPF增加44%。
2.2.2 红外分析
为研究复合膜中不同含量诺丽多糖添加导致复合膜中分子间结构相互作用和化学键的变化,进行了红外光谱分析如图3所示。通常,纯壳聚糖中氨基的变形振动主要发生在1 645 cm-1和1 583 cm-1区域。而由于壳聚糖膜一般先溶于乙酸溶液而后制成,壳聚糖膜的主链由乙酸与壳聚糖中的酰胺基团相连构成,壳聚糖膜的红外光谱会受到甘油的影响[23-24]。壳聚糖和诺丽多糖都属于高分子多糖。在本实验中,复合膜在3 377 cm-1处的吸收峰是氨基和羟基伸缩振动引起的,2 920 cm-1的峰是由于C—H键的振动引起的[25]。1 530 cm-1处为N—H的弯曲振动吸收峰。1 200~1 030 cm-1的吸收峰,是由2个C—O伸缩振动引起的,是吡喃糖环上的一组特征吸收峰,其中1 050 cm-1处是由多糖(1→4)糖苷键的伸缩振动造成的[26]。总体而言,诺丽多糖的加入对复合膜的红外光谱没有过分的影响。
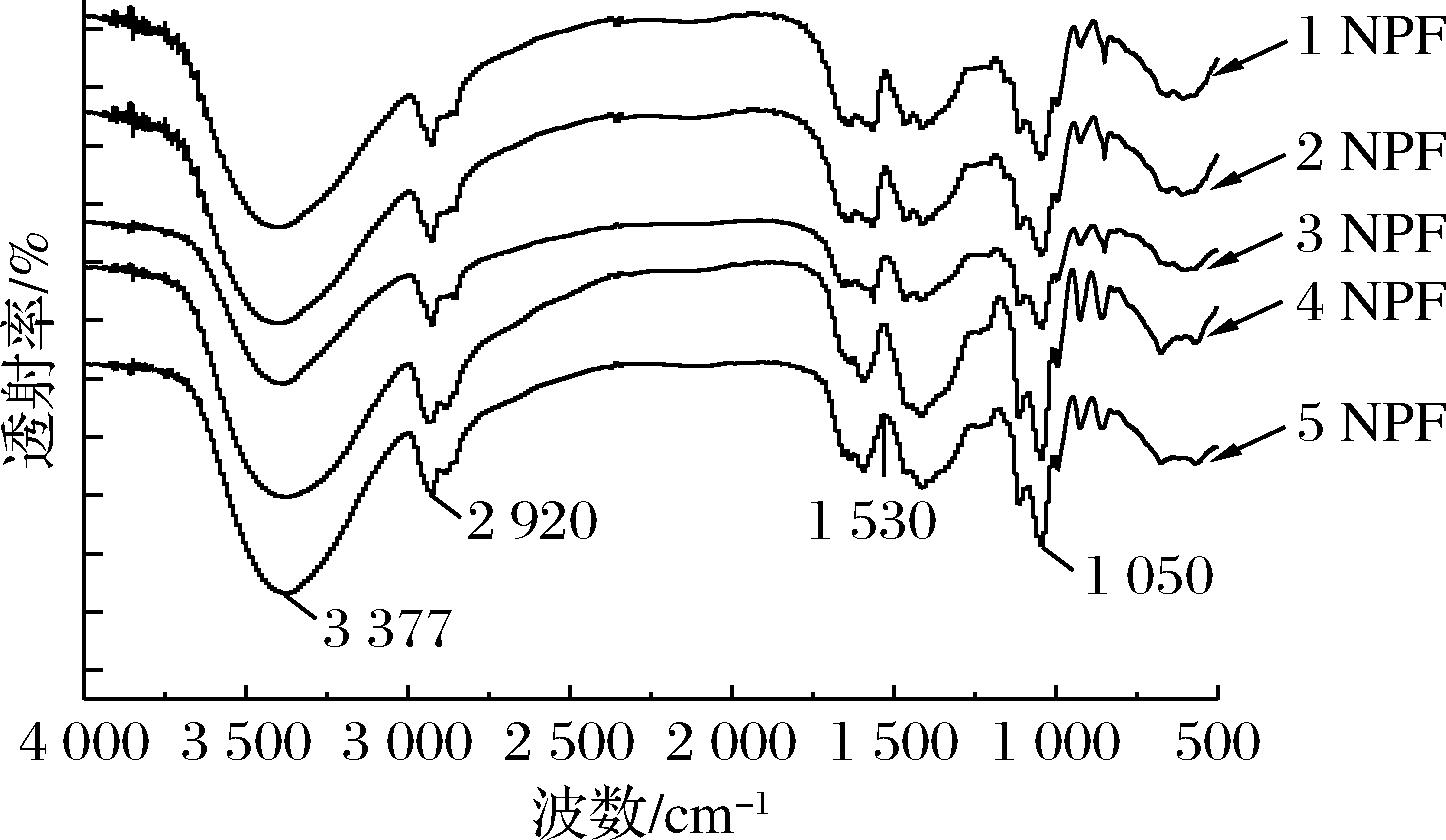
图3 NPF的红外光谱图
Fig.3 Infrared spectra of NPF
2.2.3 X衍射分析
为了研究复合膜的晶体结构,探究不同比例诺丽多糖的加入对复合膜的影响,对其进行了X射线衍射分析。通常情况下,壳聚糖的主要结晶形式有非结晶、水合结晶和无水结晶3种形式。而这3种结晶形式会因壳聚糖构象的变化而变化。在壳聚糖膜中,壳聚糖是一种由多糖不对称单元组成的松散的不稳定的双重螺旋结构,这种结构最易出现非结晶状态,也易与水合结晶,还可以在乙酸的作用下变为无水结晶形式,是不稳定的,这主要是由于壳聚糖本身游离氨基的存在以及酸的自发疏水作用[27]。
复合膜的X射线衍射如图4所示,在2θ=20.35°处有一个主要的衍射峰,随着诺丽多糖的加入,在20.35°处的衍射峰及在14.12°和20.01°处的衍射峰明显减弱直至消失,而复合膜的衍射峰逐渐变宽变强,说明多糖与壳聚糖分子间发生了强烈的相互作用,改变了各自的结晶度,从而使两者具有一定的相容性,提高了复合膜的稳定性。
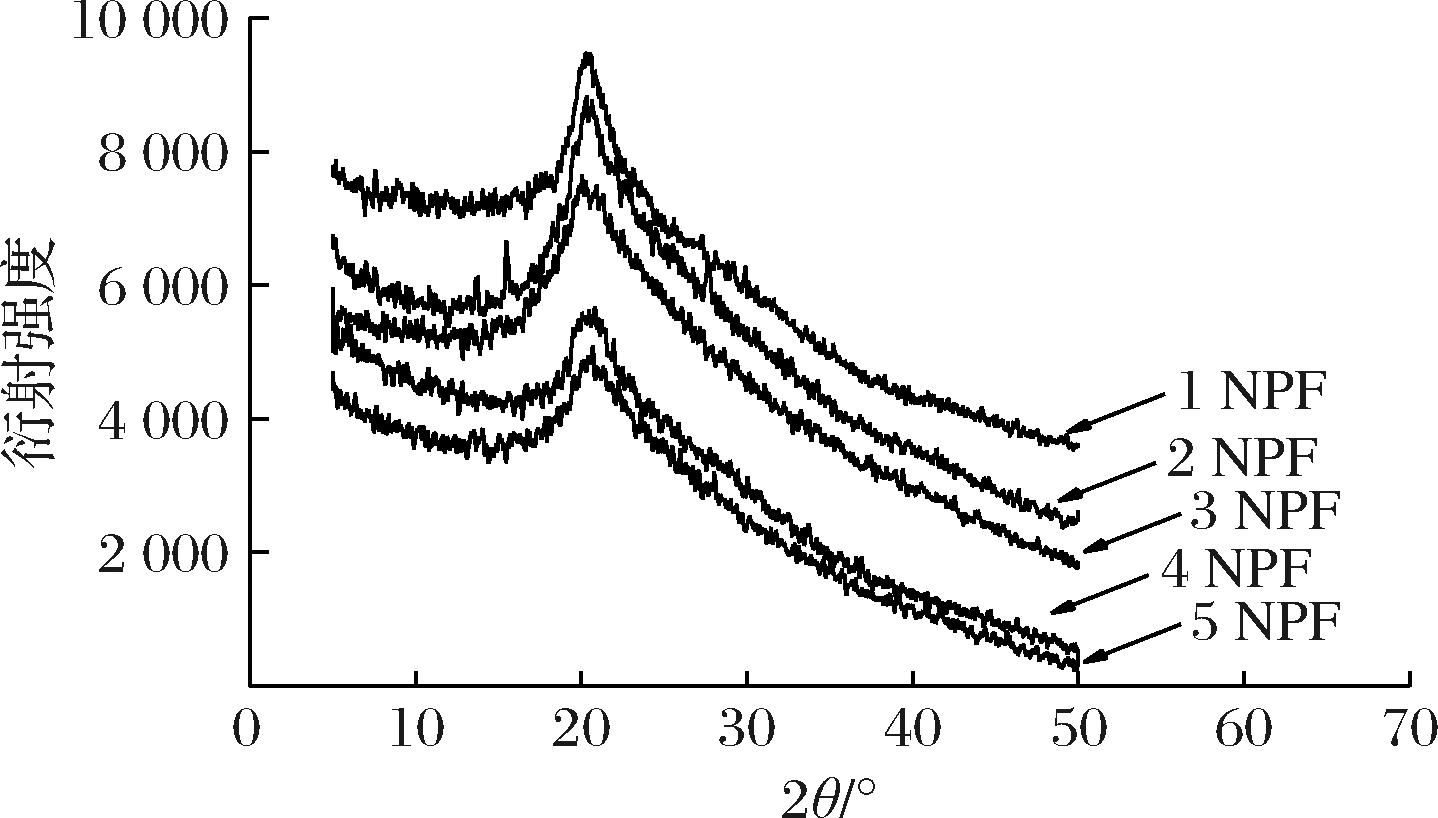
图4 NPF的X-衍射图
Fig.4 X-ray diffraction pattern of NPF
2.2.4 电镜分析
用扫描电镜对复合膜的截面进行观察,结果如图5所示,箭头指向为膜的截面,表面个别可见的白色团状物和白色小点是由于进行电镜扫描前,将膜粘至电镜样品台过程中和使用喷金预处理时引入的颗粒物杂质。壳聚糖和诺丽多糖复合构成的薄膜微观结构的截面紧凑且无大裂隙和小孔,说明诺丽多糖的加入未破坏膜的结构。其他类型的薄膜在添加植物提取物后也表现出形态变化,例如含有枇杷叶提取物的可生物降解食用薄膜[28]。

图5 NPF的扫描电子显微镜图
Fig.5 Scanning electron micrograph of NPF
2.2.5 力学性能的测定分析
在运输或搬运过程中,为了保持膜的完整性,一定的延展性和机械强度是非常必要的。因此膜的机械性能必须显著,使它能承受外界压力,并在包装过程中具有阻隔性。复合膜的机械性能影响见图6,该图表明诺丽多糖复合膜的拉伸强度随着壳聚糖分子质量和诺丽多糖的加入而显著增加,可能是壳聚糖基质分子间氢键和晶体结构增加的结果[29]。与此同时其断裂伸长率呈递减趋势(P<0.05)。
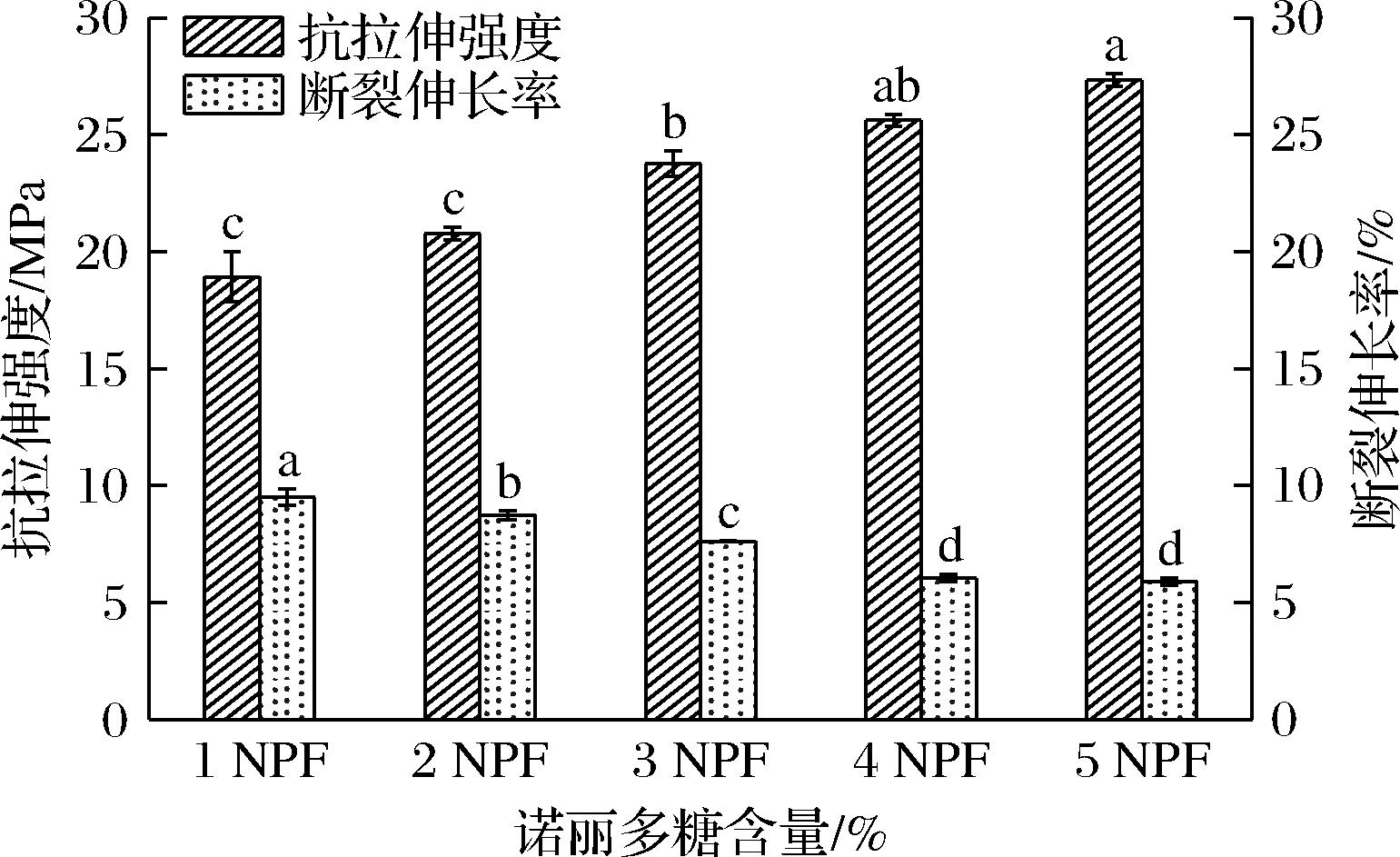
图6 NPF的抗拉升强度和断裂伸长率
Fig.6 Tensile strength and elongation at break of NPF
注:不同小写字母代表差异显著,P<0.05(下同)。
在聚合物基质中加入增塑剂,可降低分子间引力来增加聚合物链的流动性,分子间引力可能会导致拉伸强度下降,但伸长率会增加。且用超声对薄膜溶液进行脱气时,可能会导致聚合物的链断裂,减少了接合量,并促进了链的滑动,薄膜很容易被撕裂[30-31]。又由于超声脱气时间较长,分子经历分子内和分子间的相互作用,特别是氢键,与溶液中水的存在导致塑化效应[32]。本研究和其他报道的数据存在一些差异,可能是由于壳聚糖类型、增塑剂的存在以及膜的制备方法,这些都对膜的性能产生影响并导致机械性能的变化。
2.2.6 光学性能的测定分析
食品包装薄膜的颜色性能是选择合适材料的重要标准。特别是用于食品保鲜包装,较透明的包装通常比深色包装更易令人接受。
膜的颜色值(L*、a*和b*)、总色差(ΔE)和不透明度如表4所示,随着诺丽多糖用量的增加,膜的a*、b*、ΔE值和不透明度显著增加,而L*值显著降低(P<0.05)。多糖的添加量是导致膜颜色变化的主要因素。多糖的加入增加了膜中黄色的强度。因为诺丽果含有天然的黄绿色色素,而诺丽多糖是从诺丽果中得到的天然提取物,其与壳聚糖共混制成的膜也呈现淡黄绿色。
表4 NPF的光学性质
Table 4 Optical properties of NPF
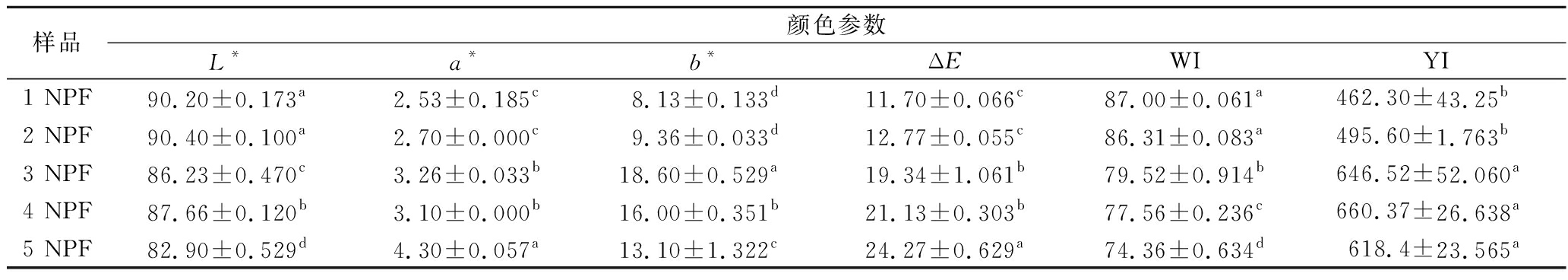
样品颜色参数L*a*b*ΔEWIYI1 NPF90.20±0.173a2.53±0.185c8.13±0.133d11.70±0.066c87.00±0.061a462.30±43.25b2 NPF90.40±0.100a2.70±0.000c9.36±0.033d12.77±0.055c86.31±0.083a495.60±1.763b3 NPF86.23±0.470c3.26±0.033b18.60±0.529a19.34±1.061b79.52±0.914b646.52±52.060a4 NPF87.66±0.120b3.10±0.000b16.00±0.351b21.13±0.303b77.56±0.236c660.37±26.638a5 NPF82.90±0.529d4.30±0.057a13.10±1.322c24.27±0.629a74.36±0.634d618.4±23.565a
2.2.7 热稳定性分析
通过热重分析来评估诺丽多糖复合膜在加热过程的质量损失。如图7所示,第1个失重范围在30~140 ℃,主要是与氢键的分解导致水分损失和乙酸的蒸发有关。第2个失重范围在140~230 ℃,与甘油的分解有关[33]。第3个范围在230~400 ℃,NPF发生了显著的失重,主要是多糖等聚合物的降解引起的,是热降解阶段的主要过程,也是复合膜分解的主要范围。随着温度的升高复合膜发生热降解,失重程度均有下降。但随着诺丽多糖添加量的增加,膜的总质量损失减小,最终残炭量增多,稳定性呈现较好的趋势。NPF与纯的壳聚糖薄膜相比有更好的热稳定性。因此,在壳聚糖膜中添加诺丽多糖能提高复合膜在一定温度范围(230~400 ℃)内的热稳定性。
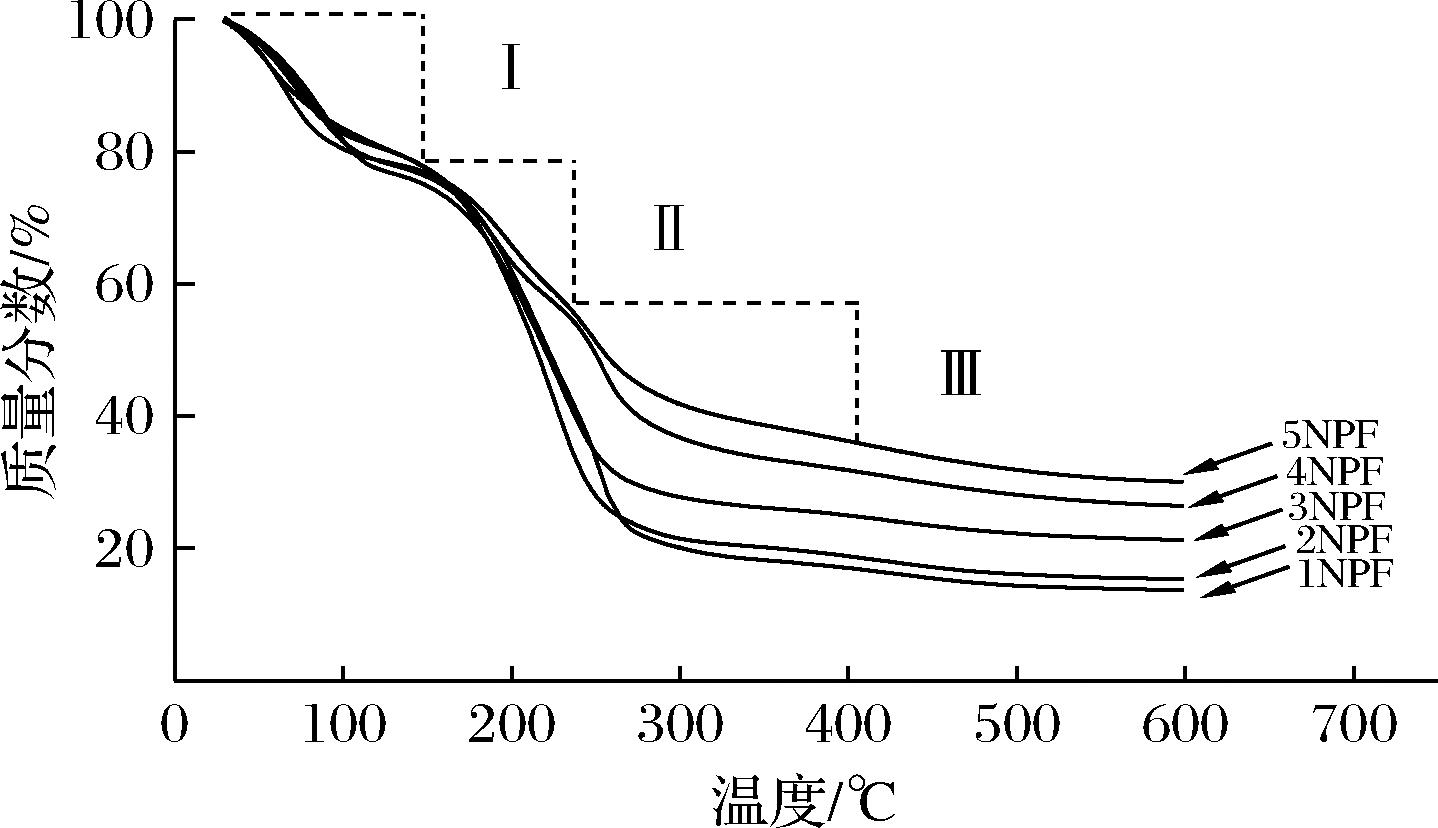
图7 NPF的热重图
Fig.7 Thermogram of NPF
2.2.8 DPPH自由基清除率测定分析
DPPH是一种稳定的自由基。其乙醇溶液呈紫色,在517 nm处有较强的吸收。抗氧化剂可以降低其乙醇溶液在517 nm处的吸光度,并使其褪色[34]。
因此,DPPH被广泛用于评价各种化合物清除自由基的能力,即化合物的抗氧化能力。在本研究设定的范围内,如图8所示,复合膜对DPPH自由基的清除呈剂量依赖性,清除速率随着多糖浓度的增加而进一步增加。可见随着诺丽多糖含量的增加,膜的抗氧化活性有所提高。
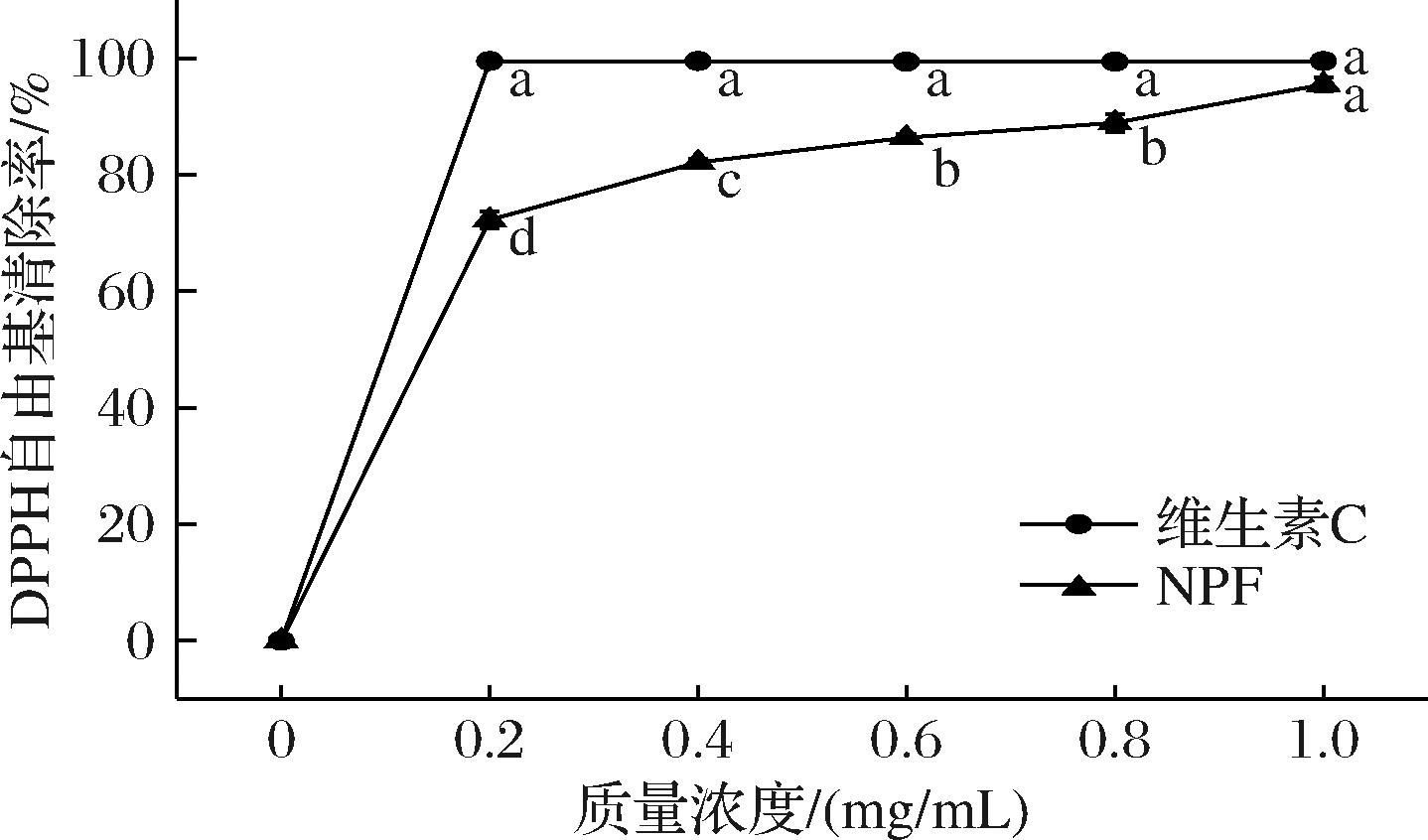
图8 NPF的抗氧化活性评价
Fig.8 Evaluation of the antioxidant activity of NPF
2.2.9 土壤微生物降解评价
经过一个月的土壤埋藏,复合膜的质量逐渐降低,可能是土壤中的微生物菌群对膜进行了分解,膜的结构遭到破坏发生降解,以及随着时间的延长水分流失导致的。如图9所示,5 NPF的土壤微生物降解性最高,可见诺丽多糖的添加可以改善膜的土壤微生物降解度。
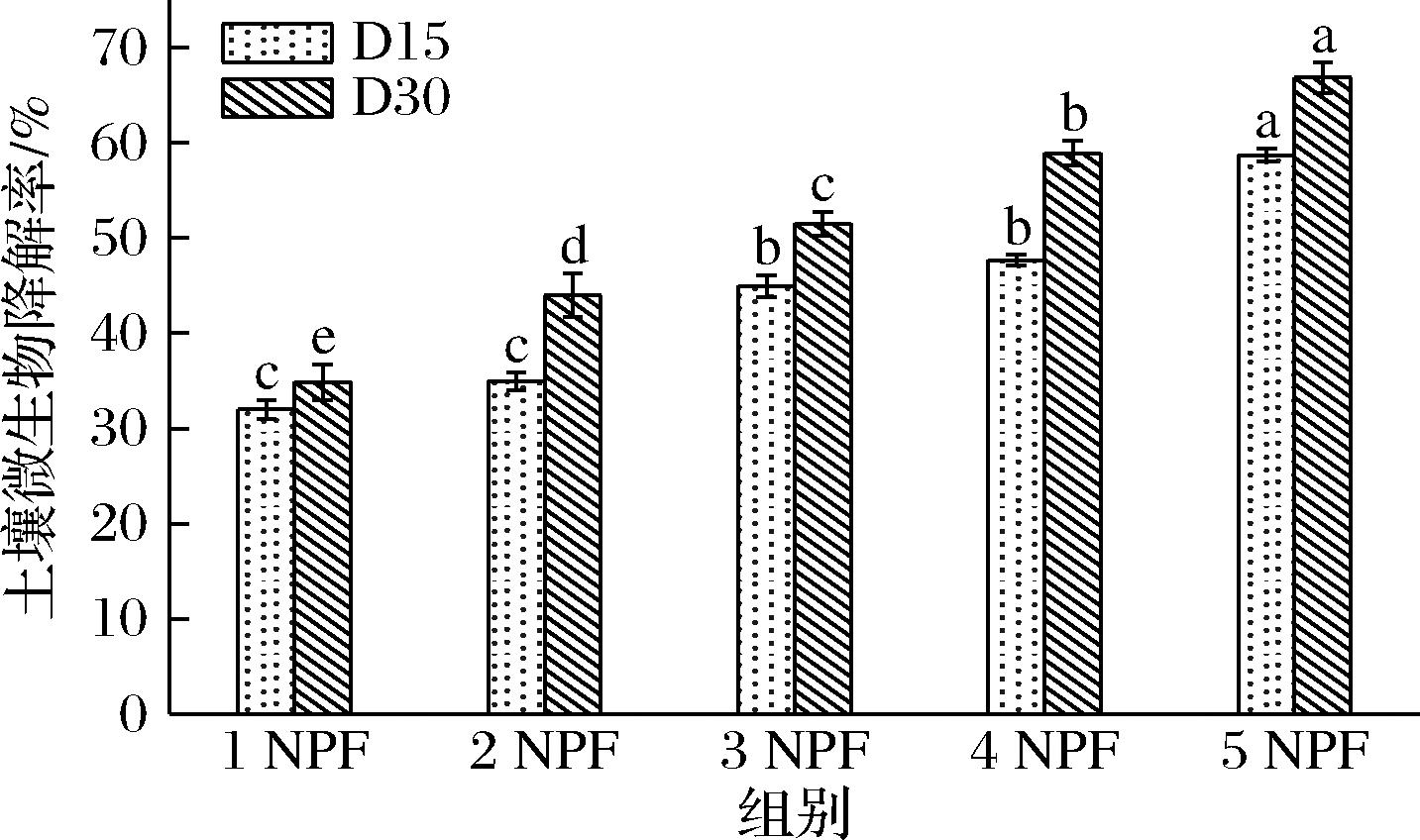
图9 NPF的土壤微生物降解趋势图
Fig.9 Trend of soil microbial degradation of NPF
2.2.10 椰子油包装的潜在应用
2.2.10.1 不同NPF的耐油性能
用吸油率来评价诺丽多糖复合膜作为食品包装材料的耐油性[35]。由表5可知,与纯的壳聚糖对照膜相比,诺丽多糖复合膜具有更低的吸油率。这可能是由于诺丽多糖的结构中存在亲水性羟基,而诺丽多糖的加入导致膜的厚度增加,使得油分子很难通过复合膜。较低的吸油率表现出较高的耐油能力,说明诺丽多糖复合膜具有椰子油包装材料的理想特性。
表5 诺丽多糖复合膜的吸油率和储存在诺丽多糖复合膜中的椰子油的过氧化值
Table 5 The oil absorption of noni polysaccharide composite films and peroxide values of coconut oil stored in Noni polysaccharide composite films
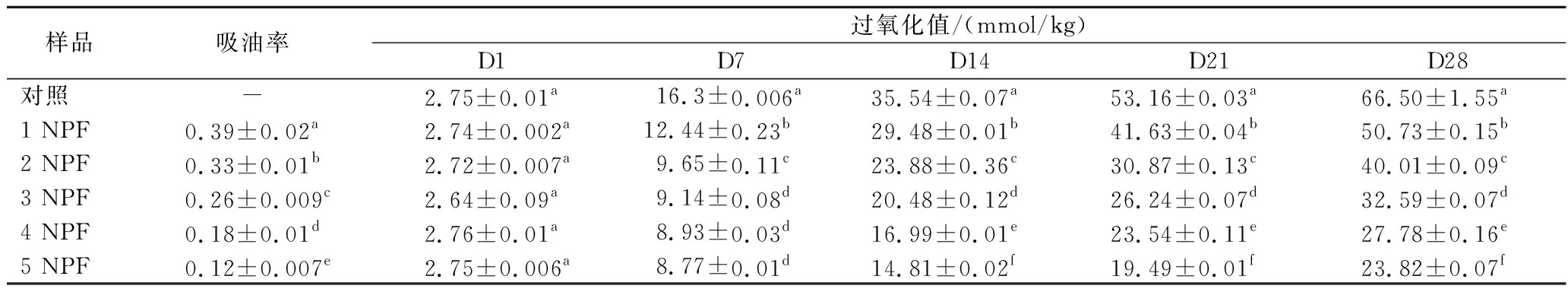
样品吸油率过氧化值/(mmol/kg)D1D7D14D21D28对照-2.75±0.01a16.3±0.006a35.54±0.07a53.16±0.03a66.50±1.55a1 NPF0.39±0.02a2.74±0.002a12.44±0.23b29.48±0.01b41.63±0.04b50.73±0.15b2 NPF0.33±0.01b2.72±0.007a9.65±0.11c23.88±0.36c30.87±0.13c40.01±0.09c3 NPF0.26±0.009c2.64±0.09a9.14±0.08d20.48±0.12d26.24±0.07d32.59±0.07d4 NPF0.18±0.01d2.76±0.01a8.93±0.03d16.99±0.01e23.54±0.11e27.78±0.16e5 NPF0.12±0.007e2.75±0.006a8.77±0.01d14.81±0.02f19.49±0.01f23.82±0.07f
2.2.10.2 过氧化值的测定
过氧化值(peroxide value, POV)是表征油脂氧化过程中产生的初级氧化产物、氢过氧化物的含量[36],储存了28 d的椰子油的POV结果见表5。所有处理均增加了椰子油的POV,但与无覆盖的对照组和纯的壳聚糖膜相比,5 NPF的POV增加速度较慢。贮藏第28天,贮存在无膜覆盖瓶中的椰子油POV最高,为(66.50±1.55) mmol/kg,由5 NPF覆盖的瓶中椰子油POV最低,为(23.82±0.07) mmol/kg。复合膜的致密结构使氧气难以通过,阻氧性较好,从而在减少氧化过程中发挥了重要的作用[37]。此外,复合膜中多糖类化合物的存在也提高了膜的抗氧化能力,且阻油性好,有助于减缓油脂的氧化。
3 结论
本研究以诺丽多糖和壳聚糖共混制备出环保的复合膜。诺丽多糖的加入提高了膜的抗拉升强度和总糖含量,降低了膜的断裂伸长率和水蒸气透过率,改善了膜的性能。按不同比例添加诺丽多糖后,表现出良好的机械性能,所制备的诺丽多糖复合膜表面致密、均匀并且在一定程度上显示出韧性。诺丽多糖的添加引起了复合膜特征吸收峰的迁移和强弱变化,使其衍射峰减弱甚至消失,表明用于制膜的诺丽多糖和壳聚糖之间存在着强烈的相互作用,各组分间有着一定程度的相容性。通过X射线衍射,热重分析表明,诺丽多糖复合膜具有生物聚合物的自然形态和理化性质;且阻氧性好,耐油能力强。本文为植物提取物混合壳聚糖基薄膜的研究提供了一定的理论基础,所制备的复合膜作为良好的环保型食品包装膜具有良好的应用潜力。
[1] JARAMILLO C M, GUTIÉRREZ T J, GOYANES S, et al.Biodegradability and plasticizing effect of yerba mate extract on cassava starch edible films[J].Carbohydrate Polymers, 2016, 151:150-159.
[2] YUAN D, MENG H C, HUANG Q, et al.Preparation and characterization of chitosan-based edible active films incorporated with Sargassum pallidum polysaccharides by ultrasound treatment[J].International Journal of Biological Macromolecules, 2021, 183:473-480.
[3] PEREDA M, AMICA G, MARCOVICH N E.Development and characterization of edible chitosan/olive oil emulsion films[J].Carbohydrate Polymers, 2012, 87(2):1318-1325.
[4] THI NGUYEN T, PHAM B T T, NHIEN LE H, et al.Comparative characterization and release study of edible films of chitosan and natural extracts[J].Food Packaging and Shelf Life, 2022, 32:100830.
[5] LUO S M, CHEN J D, HE J, et al.Preparation of corn starch/rock bean protein edible film loaded with D-limonene particles and their application in glutinous rice cake preservation[J].International Journal of Biological Macromolecules, 2022, 206:313-324.
[6] IMRE B, GARC A L, PUGLIA D, et al.Reactive compatibilization of plant polysaccharides and biobased polymers:Review on current strategies, expectations and reality[J].Carbohydrate Polymers, 2019, 209:20-37.
A L, PUGLIA D, et al.Reactive compatibilization of plant polysaccharides and biobased polymers:Review on current strategies, expectations and reality[J].Carbohydrate Polymers, 2019, 209:20-37.
[7] NGUYEN T T, THI DAO U T, THI BUI Q P, et al.Enhanced antimicrobial activities and physiochemical properties of edible film based on chitosan incorporated with Sonneratia caseolaris (L.) Engl.leaf extract[J].Progress in Organic Coatings, 2020, 140:105487.
[8] RIBEIRO A M, ESTEVINHO B N, ROCHA F.Preparation and incorporation of functional ingredients in edible films and coatings[J].Food and Bioprocess Technology, 2021, 14(2):209-231.
[9] SOUSA S G, ALMEIDA OLIVEIRA L, DE AGUIAR MAGALH ES D, et al.Chemical structure and anti-inflammatory effect of polysaccharide extracted from Morinda citrifolia Linn (Noni)[J].Carbohydrate Polymers, 2018, 197:515-523.
ES D, et al.Chemical structure and anti-inflammatory effect of polysaccharide extracted from Morinda citrifolia Linn (Noni)[J].Carbohydrate Polymers, 2018, 197:515-523.
[10] GETACHEW A T, LEE H J, CHO Y J, et al.Optimization of polysaccharides extraction from Pacific oyster (Crassostrea gigas) using subcritical water:Structural characterization and biological activities[J].International Journal of Biological Macromolecules, 2019, 121:852-861.
[11] HAN H S, BIN SONG K.Noni (Morinda citrifolia) fruit polysaccharide films containing blueberry (Vaccinium corymbosum) leaf extract as an antioxidant packaging material[J].Food Hydrocolloids, 2021, 112:106372.
[12] ZHANG X H, ISMAIL B B, CHENG H, et al.Emerging chitosan-essential oil films and coatings for food preservation:A review of advances and applications[J].Carbohydrate Polymers, 2021, 273:118616.
[13] DU X J, BAI X P, GAO W, et al.Properties of soluble dietary fibre from defatted coconut flour obtained through subcritical water extraction[J].International Journal of Food Science &Technology, 2019, 54(4):1390-1404.
[14] SHI F, JIANG Z B, XU J, et al.Optimized extraction of phenolic antioxidants from red pitaya (Hylocereus polyrhizus) seeds by subcritical water extraction using response surface methodology[J].Journal of Food Measurement and Characterization, 2022, 16(3):2240-2258.
[15] 何坤明. 山茱萸籽多糖亚临界水萃取、分离纯化、结构表征及抗氧化活性分析[D].海口:海南大学, 2021.
HE K M.Subcritical water extraction, purification, structure characterization and antioxidant activity analysis of Cornus officinalis seed polysaccharide[D].Haikou:Hainan University, 2021.
[16] 成子阳. 壳聚糖基可食性包装薄膜的制备与应用研究[D].株洲:湖南工业大学, 2020.
CHENG Z Y.Study on preparation and application of chitosan-based edible packaging film[D].Zhuzhou:Hunan University of Technology, 2020.
[17] PETERSEN D R, LINK R E, KUMARAN M K.Interlaboratory comparison of the ASTM standard test methods for water vapor transmission of materials (E 96-95)[J].Journal of Testing and Evaluation, 1998, 26(2):83.
[18] DU H J, HU Q H, YANG W J, et al.Development, physiochemical characterization and forming mechanism of Flammulina velutipes polysaccharide-based edible films[J].Carbohydrate Polymers, 2016, 152:214-221.
[19] GHOSHAL G, SHIVANI.Thyme essential oil nano-emulsion/Tamarind starch/Whey protein concentrate novel edible films for tomato packaging[J].Food Control, 2022, 138:108990.
[20] LI Y F, TANG Z J, LU J, et al.The fabrication of a degradable film with high antimicrobial and antioxidant activities[J].Industrial Crops and Products, 2019, 140:111692.
[21] CHYLI SKA M, SZYMA
SKA M, SZYMA SKA-CHARGOT M, ZDUNEK A.FT-IR and FT-Raman characterization of non-cellulosic polysaccharides fractions isolated from plant cell wall[J].Carbohydrate Polymers, 2016, 154:48-54.
SKA-CHARGOT M, ZDUNEK A.FT-IR and FT-Raman characterization of non-cellulosic polysaccharides fractions isolated from plant cell wall[J].Carbohydrate Polymers, 2016, 154:48-54.
[22] BREDA C A, MORGADO D L, ASSIS O B G, et al.Processing and characterization of chitosan films with incorporation of ethanolic extract from “pequi” peels[J].Macromolecular Research, 2017, 25(11):1049-1056.
[23] LAWRIE G, KEEN I, DREW B, et al.Interactions between alginate and chitosan biopolymers characterized using FTIR and XPS[J].Biomacromolecules, 2007, 8(8):2533-2541.
[24] CAVA D, CATALA R, GAVARA R, et al.Testing limonene diffusion through food contact polyethylene by FT-IR spectroscopy:Film thickness, permeant concentration and outer medium effects[J].Polymer Testing, 2005, 24(4):483-489.
[25] HEGYESI D, SOV NY T, BERKESI O, et al.Study of the effect of plasticizer on the structure and surface characteristics of ethylcellulose free films with FT-IR spectroscopy[J].Microchemical Journal, 2013, 110:36-39.
NY T, BERKESI O, et al.Study of the effect of plasticizer on the structure and surface characteristics of ethylcellulose free films with FT-IR spectroscopy[J].Microchemical Journal, 2013, 110:36-39.
[26] CUI H Y, CHENG Q, LI C Z, et al.Improving packing performance of lily polysaccharide based edible films via combining with sodium alginate and cold plasma treatment[J].International Journal of Biological Macromolecules, 2022, 206:750-758.
[27] ZHU L, FENG L, LUO H X, et al.Characterization of polyvinyl alcohol-nanocellulose composite film and its release effect on tetracycline hydrochloride[J].Industrial Crops and Products, 2022, 188:115723.
[28] MEDEIROS SILVA V D, COUTINHO MACEDO M C, RODRIGUES C G, et al.Biodegradable edible films of ripe banana peel and starch enriched with extract of Eriobotrya japonica leaves[J].Food Bioscience, 2020, 38:100750.
[29] NOURI A, YARAKI M T, GHORBANPOUR M, et al.Enhanced Antibacterial effect of chitosan film using Montmorillonite/CuO nanocomposite[J].International Journal of Biological Macromolecules, 2018, 109:1219-1231.
[30] THAKHIEW W, DEVAHASTIN S, SOPONRONNARIT S.Effects of drying methods and plasticizer concentration on some physical and mechanical properties of edible chitosan films[J].Journal of Food Engineering, 2010, 99(2):216-224.
[31] RAMBABU K, BHARATH G, BANAT F, et al.Mango leaf extract incorporated chitosan antioxidant film for active food packaging[J].International Journal of Biological Macromolecules, 2019, 126:1234-1243.
[32] GRIGORIADI K, GIANNAKAS A, LADAVOS A K, et al.Interplay between processing and performance in chitosan-based clay nanocomposite films[J].Polymer Bulletin, 2015, 72(5):1145-1161.
[33] SHOJAEE-ALIABADI S, HOSSEINI H, MOHAMMADIFAR M A, et al.Characterization of antioxidant-antimicrobial κ-carrageenan films containing Satureja hortensis essential oil[J].International Journal of Biological Macromolecules, 2013, 52:116-124.
[34] KOC B, AKYUZ L, CAKMAK Y S, et al.Production and characterization of chitosan-fungal extract films[J].Food Bioscience, 2020, 35:100545.
[35] WANG X C, YONG H M, GAO L, et al.Preparation and characterization of antioxidant and pH-sensitive films based on chitosan and black soybean seed coat extract[J].Food Hydrocolloids, 2019, 89:56-66.
[36] LI X L, ZHOU A G, HAN Y.Anti-oxidation and anti-microorganism activities of purification polysaccharide from Lygodium japonicum in vitro[J].Carbohydrate Polymers, 2006, 66(1):34-42.
[37] RIAZ A, LAGNIKA C, LUO H, et al.Chitosan-based biodegradable active food packaging film containing Chinese chive (Allium tuberosum) root extract for food application[J].International Journal of Biological Macromolecules, 2020, 150:595-604.