淀粉具有良好的生物相容性和生物降解性,可作为运输功能分子理想载体使用[1]。但是,天然马铃薯淀粉(native starch, NS)颗粒较差的孔隙结构,限制了对目标物质的吸附和运输方面的潜力[2]。多孔淀粉(porous starch, PS)作为一种通过物理、化学或酶处理获得的具有蜂窝状孔洞的变性淀粉,与NS相比,其表面及内部形成了大量的孔洞,这种结构显著增加了比表面积和总孔隙体积[3]。在医药、食品等行业中,PS可用于对目标物质的转运、控释以及对光、氧化或高温敏感分子的保护。WU等[4]用多孔淀粉微球泡沫对疏水性较高的洛伐他汀进行吸附,与商业胶囊相比,多孔淀粉为载体时可显著提升洛伐他汀的溶解性和生物利用度。
丁香酸(syringic acid, SA)是水果、蔬菜以及谷物中常见的酚酸类化合物,在植物中通过莽草酸途径合成[5],其具有抗氧化、抗菌、抗炎、抗内毒素等生物活性[5],在预防疾病(如糖尿病、心血管疾病、癌症、脑缺血)等方面具有广泛的治疗应用。SA的多种生物医学活性主要取决于芳香环上羟基(—OH)和甲氧基(—OCH3)的存在,取代的数量和位置决定了其作用的广泛范围和效力[6]。目前,SA与多糖的研究主要集中于壳聚糖成膜性方面的改善。YANG等[7]通过把不同浓度的SA加入到壳聚糖薄膜中制备复合膜,发现SA对复合膜的力学性能和抗菌性能均有影响;LIU等[8]把不同结构羟基苯甲酸接枝到壳聚糖上,结果发现没食子酸接枝壳聚糖薄膜具有最高的紫外线和湿气阻隔、机械和抗氧化性能。淀粉和壳聚糖都是可生物降解性、安全性较高的生物质材料。与壳聚糖相比,多孔淀粉具有良好的包埋能力,且其孔隙、孔道和空腔的存在使更多的羟基暴露,增加了与SA分子作用的敏感性,使酯化反应易于发生。因此,综合多孔淀粉良好的包埋能力和酚类物质的生物活性,研究酚类物质对淀粉改性,使淀粉携带酚类功能,制备具有转运、控释和保护活性物质功能的材料,是当前的研究热点。
本研究以溶剂交换法制备出纳米级孔结构PS为反应主体,SA为客体,在有机体系中对PS进行酯化改性,旨在制备高取代度且具备大量孔隙结构的丁香酸多孔淀粉酯(syringic acid porous starch ester, SA@PS),并对其结构性能进行表征,为改性淀粉作为载体材料提供一个可行的选择。
1 材料与方法
1.1 材料与试剂
异丙醇,二甲基亚砜(dimethyl sulfoxide, DMSO),天津市北辰方正试剂厂;马铃薯淀粉、丁香酸、N,N′-羰基二咪唑、DMSO-d6(纯度≥99.9%)、DPPH,上海麦克林生化科技有限公司;所用试剂均为分析纯。
1.2 仪器与设备
B11-2型恒温磁力搅拌水浴锅,上海司乐仪器有限公司;HXLG-10-50B型真空冷冻干燥机,上海沪析实业有限公司;JSM-6701F型冷场发射型扫描电子显微镜(scanning electron microscope, SEM),日本电子光学公司;ASAP 2020型全自动比表面积及孔隙度分析仪,美国麦克公司;NEXUS 670型傅里叶红外光谱仪(Fourier transform infrared spectroscopy, FT-IR),美国Thermo公司;AVance NEO型600 MHz核磁共振波普仪,德国布鲁克科技公司。
1.3 实验方法
1.3.1 马铃薯多孔淀粉的制备
参考CHANG等[9]的方法稍作修改,称取马铃薯淀粉10.0 g并加入100 mL去离子水,放置于磁力搅拌水浴锅中温度设为40 ℃搅拌20 min形成均匀分散的淀粉悬浮液,然后持续升温到90 ℃并搅拌1 h淀粉完全糊化,4 ℃下贮存72 h形成淀粉凝胶,将淀粉凝胶切成立方体小块(0.6~0.8 cm3),浸入无水乙醇(200 mL×6次,每次1 h)置换后冷冻真空干燥,研磨备用。
1.3.2 丁香酸多孔淀粉酯的制备
参考HAN等[10]和WEN等[11]的方法并改进,采用两步法合成丁香酸多孔淀粉酯(合成路线如图1所示)。第一步:将等摩尔的丁香酸和CDI加入至100 mL单口平底烧瓶中,再加入25 mL DMSO,置于恒温磁力搅拌油浴锅中,烧瓶在60 ℃、N2气氛下加热15 h,生成丁香酸咪唑化合物。取1.0 g多孔淀粉加入到丁香酸咪唑化合物中,混合物在75 ℃、N2气氛下磁力搅拌反应7 h后停止。第二步:反应物用异丙醇多次洗涤离心(6 000 r/min,10 min),沉淀物装入透析袋(截留分子质量为8~14 kDa)中用DMSO透析24 h,然后用异丙醇再进行透析48 h后,进行真空冷冻干燥,得到丁香酸多孔淀粉酯(SA@PS)。
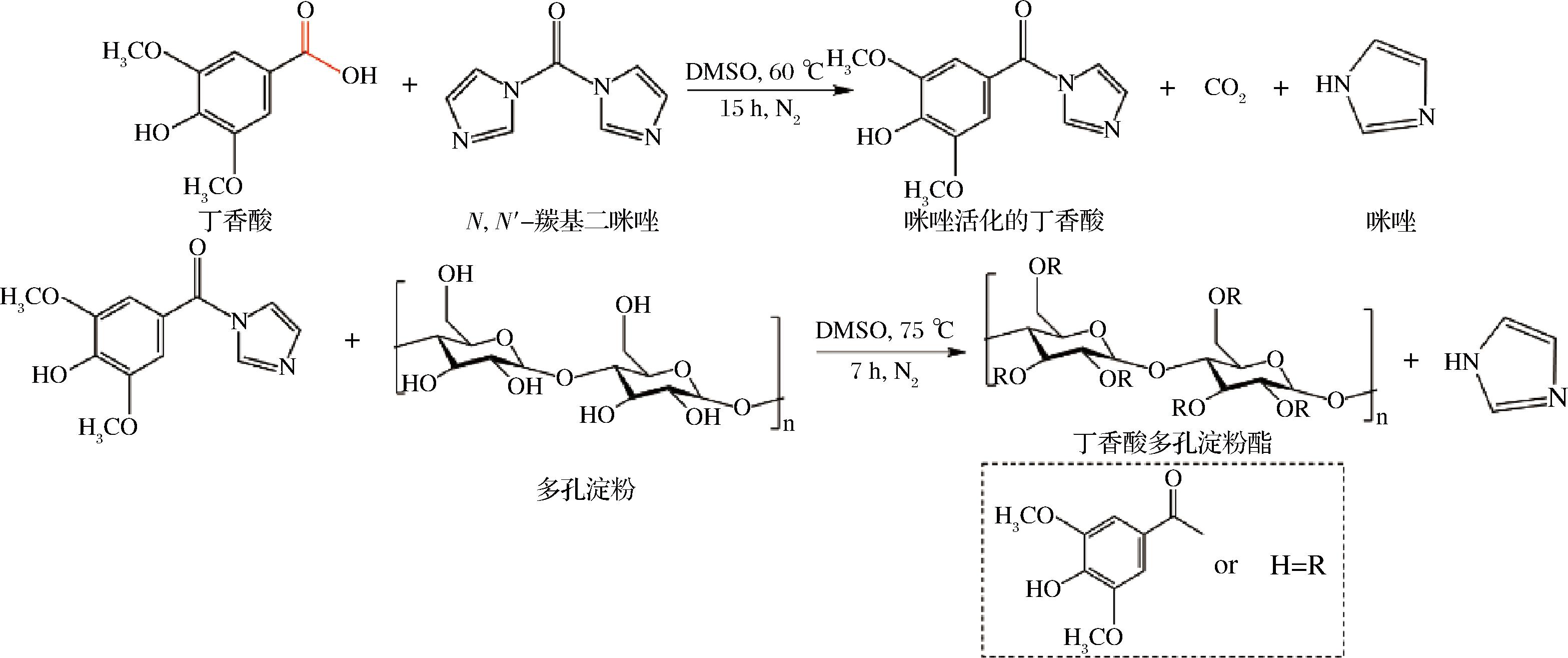
图1 丁香酸多孔淀粉酯的合成路线图
Fig.1 The synthetic route of preparing SA@PS
1.3.3 N2-吸附/脱附等温线测定
低温N2吸附法是测定多孔材料孔隙度最常用的方法之一,采用非定域密度泛函理论,从多孔淀粉的吸附数据中得到孔径的尺寸分布曲线。依据Brunauer-Emmett-Teller(BET)多层吸附理论计算样品的比表面积。
1.3.4 取代度的测定
丁香酸多孔淀粉酯的取代度(degree of substitution, DS)参考KAPUSNIAK等[12]的方法稍作修改。在1H NMR谱图中,4.58~5.50 ppm的峰对应于淀粉脱水葡萄糖单元(anhydro glucose unit, AGU)的4个质子的信号,而SA@PS结构中的甲氧基(—OCH3)质子信号峰在3.83 ppm左右处[13]。因此,取代度由3.83处甲氧基的3个质子峰面积与4.58~5.50淀粉脱水葡萄糖单元中1号位氢和2、3、6号位羟基的质子峰面积和之比计算而来。计算如公式(1)所示:
(1)
式中:Isignal、3分别是样品在3.83处的峰面积、质子数;IAGU、4分别是淀粉在4.58~5.50的4个质子的峰面积之和、质子数。
1.3.5 SEM表观形态观察
利用SEM观察不同倍数下样品的表观形态特征。将样品座置于离子溅射仪中镀金60 s后,加速电压为5 kV时观察。
1.3.6 FT-IR测定
FT-IR测定采用KBr压片法。将样品与KBr按1∶50(mg∶mg)的比例混合均匀,反复碾磨至无颗粒感后压片,在4 000~500 cm-1进行扫描测定。
1.3.7 液态核磁分析
在使用600 MHz核磁共振氢谱仪(1H NMR)测定之前,称取一定量样品于核磁管中,加入DMSO-d6,在75 ℃下超声波处理30 s使淀粉样品充分溶解并去除溶解氧对实验的影响,使用TXISz探针(8 μs 90°脉冲,重复时间15.07 s,包括采集时间3.07 s和松弛延迟12 s),测量温度25 ℃。所有化学位移以百万分之几(ppm)为单位报告,使用通常用作核磁共振测量内部标准的四甲基硅烷信号作为参考。
1.3.8 X-射线衍射测定
使用多晶粉末X射线衍射仪(X-ray diffraction, XRD)来测定样品的晶体结构,扫描范围为10°~40°。
1.3.9 DPPH自由基清除活性测定
将PS和不同取代度的SA@PS均匀分散在4 mL的DPPH乙醇溶液中(0.2 mmol/L),并制备一系列质量浓度梯度(0.5、1、1.5、2、2.5 mg/mL)。将制备好的样品涡漩振荡3 min后,在室温条件下,黑暗环境中反应30 min进行测定,以无水乙醇为空白对照,混合物的吸光度在517 nm处测定[14]。样品的DPPH自由基清除活性的计算如公式(2)所示:
DPPH自由基清除率![]()
(2)
式中:A1,样品吸光值;A2,乙醇溶液代替DPPH溶液所测吸光值;A0,空白样品吸光值。
1.4 数据分析与处理
利用Origin 2018和SPSS 25软件进行处理和分析数据。
2 结果与分析
2.1 SEM形态结构分析
如图2所示,NS颗粒在形状和大小上表现出很大的差异,淀粉颗粒形状呈球形或椭圆形,颗粒表面光滑,观察不到孔隙或裂缝(图2-a);经溶剂交换法制备得到的PS表面粗糙、不规则、呈蜂窝状(图2-b)。马铃薯淀粉经高温糊化、冷冻之后,大量的水分子变成冰晶被固定在淀粉凝胶中,经乙醇置换、干燥挥发后,从而形成表面孔隙及内部的孔结构,这提供了大的比表面积和总孔隙体积,同时也增加了与化学基团或酶反应的可能性[15]。多孔淀粉经过酯化改性后,颗粒形状不规则,相互堆积。低DS的SA@PS-1(图2-c)孔大小不一,分布不均匀,与图2-c、图2-d相比,高取代度淀粉酯(图2-e)的孔呈蜂窝絮状结构,这是由于淀粉表面及颗粒内部发生了酯化反应,从而影响其外观形态。

a-NS(500×);b-PS(5 000×);c-FA@PS-1(5 000×);d-FA@PS-2(5 000×);e-FA@PS-3(5 000×)
图2 马铃薯淀粉、多孔淀粉和丁香酸多孔淀粉酯的SEM图
Fig.2 SEM images of native starch、porous starch and SA@PS
2.2 多孔淀粉的BET分析
为表征制备材料的孔径,采用Barret、Joyner和Halenda(BJH)理论计算了孔隙分布,根据国际纯粹与应用化学联合会将孔隙分为三大类:微孔(<2 nm)、介孔(2~50 nm)、大孔(>50 nm)。如图3-a所示,PS的平均孔径为18.03 nm,表明所制备的PS可归属于介孔材料范畴。参照王宇霞等[16]NS的比表面积仅为0.02 m2/g,经溶剂交换法制备的PS的表面积达到了14.69 m2/g(图3-b)。但是,多孔淀粉经过酯化之后,SA@PS-3(图3-d)比表面积为7.64 m2/g,这表明酯化过程中破坏了原来的孔结构,且平均孔径(图3-c)由原来的18.03 nm减小为13.88 nm。
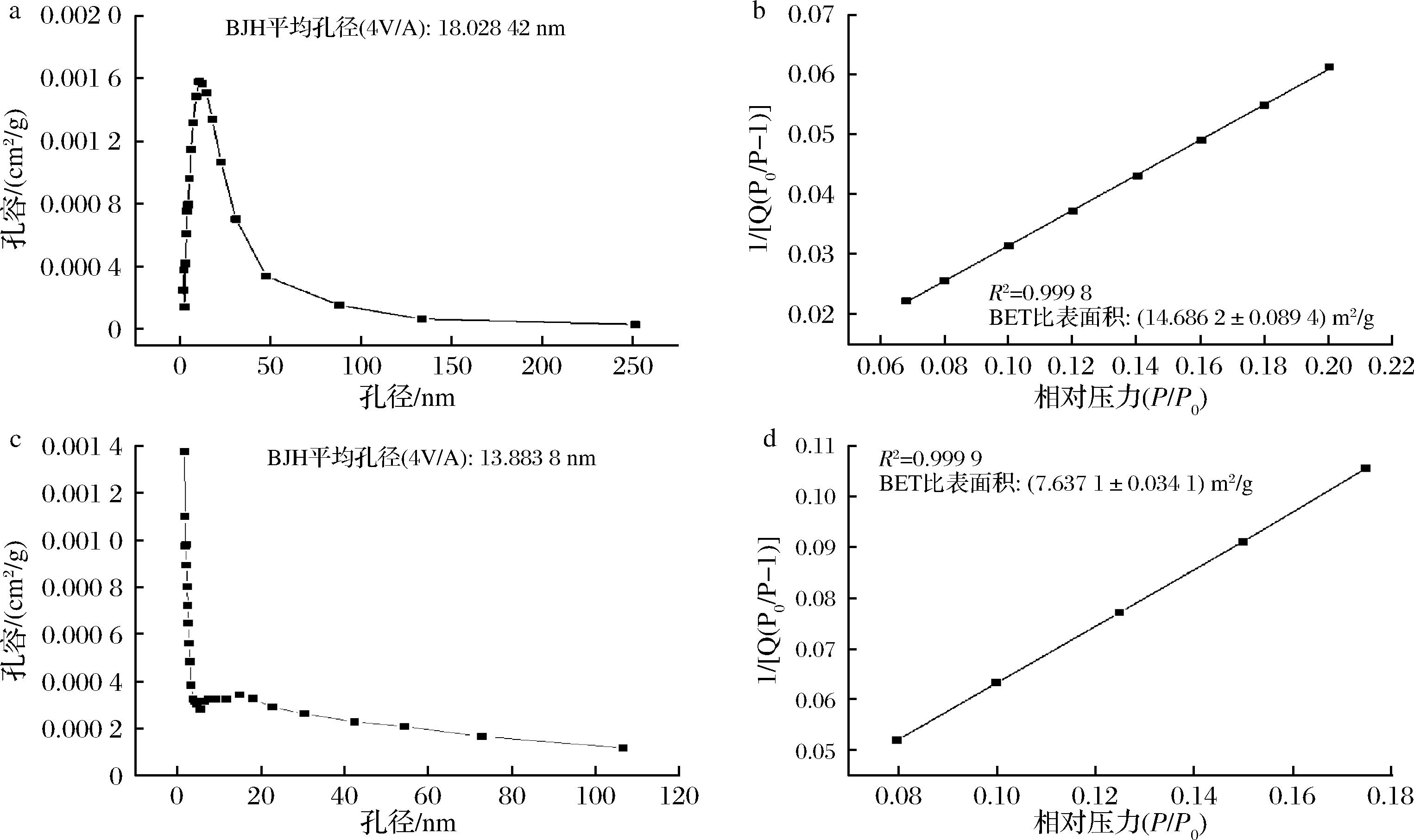
a-孔径大小;b-多孔淀粉BET;c-SA@PS-3孔径;d-SA@PS-3比表面积
图3 多孔淀粉和多孔淀粉酯的孔径分布及BET表面积图
Fig.3 Pore diameter distribution and BET surface area plots of PS and SA@PS-3
2.3 丁香酸多孔淀粉酯取代度分析
DS是指淀粉聚合物的每个AUG被反应试剂取代的羟基数[17]。实验中设定不同反应底物比例(表1),用1H NMR谱图对取代度进行定量分析。如表1所示,SA@PS的取代度随着SA/PS摩尔比例的增大而增加,这可归因于丁香酸浓度增加,另一方面PS的孔结构以及内部的空腔暴露出更多的活性位点与丁香酸发生化学反应,使丁香酸分子靠近主体PS的可能性增大,进而提升了反应效率。这与LU等[18]在混合离子液体中脂肪酶催化合成棕榈酸淀粉酯的结果相似。
表1 丁香酸多孔淀粉酯的取代度
Table 1 Degree of substitution of SA-PS

样品名称丁香酸/mol脱水葡萄糖单元/molDSSA@PS-10.003 10.003 10.06±0.026cSA@PS-20.006 20.003 10.12±0.038bSA@PS-30.009 30.003 10.25±0.054a
注:不同小写字母表示差异显著。
2.4 1H NMR液态核磁分析
图4显示了溶解在d6-DMSO中PS(图4-a),SA(图4-b),以及SA@PS-3(图4-c)的核磁共振氢谱图。质子在3.64 ppm的1H化学位移归属于H-3,3.57 ppm归属于H-5,3.31 ppm归属于H-2,3.15 ppm归属于H-4,H-1和OH-2、3、6位的化学位移被指定为4.58~5.50 ppm的峰[19];而2.5 ppm和3.3 ppm分别对应的是溶剂d6-DMSO和水的质子峰[20](图4-a)。相比PS,SA@PS-3的1H NMR谱有额外的信号,包括7.36~7.54 ppm(苯环上的亚甲基质子)的多重信号,3.83 ppm的强峰[13](—OCH3,图4-c)。这些附加信号的存在证实了PS和SA已成功合成。此外,指定给—COOH的峰为12.62 ppm的SA(图4-b)在SA@PS-3不存在,表明未反应的SA从目标产物中完全脱除。
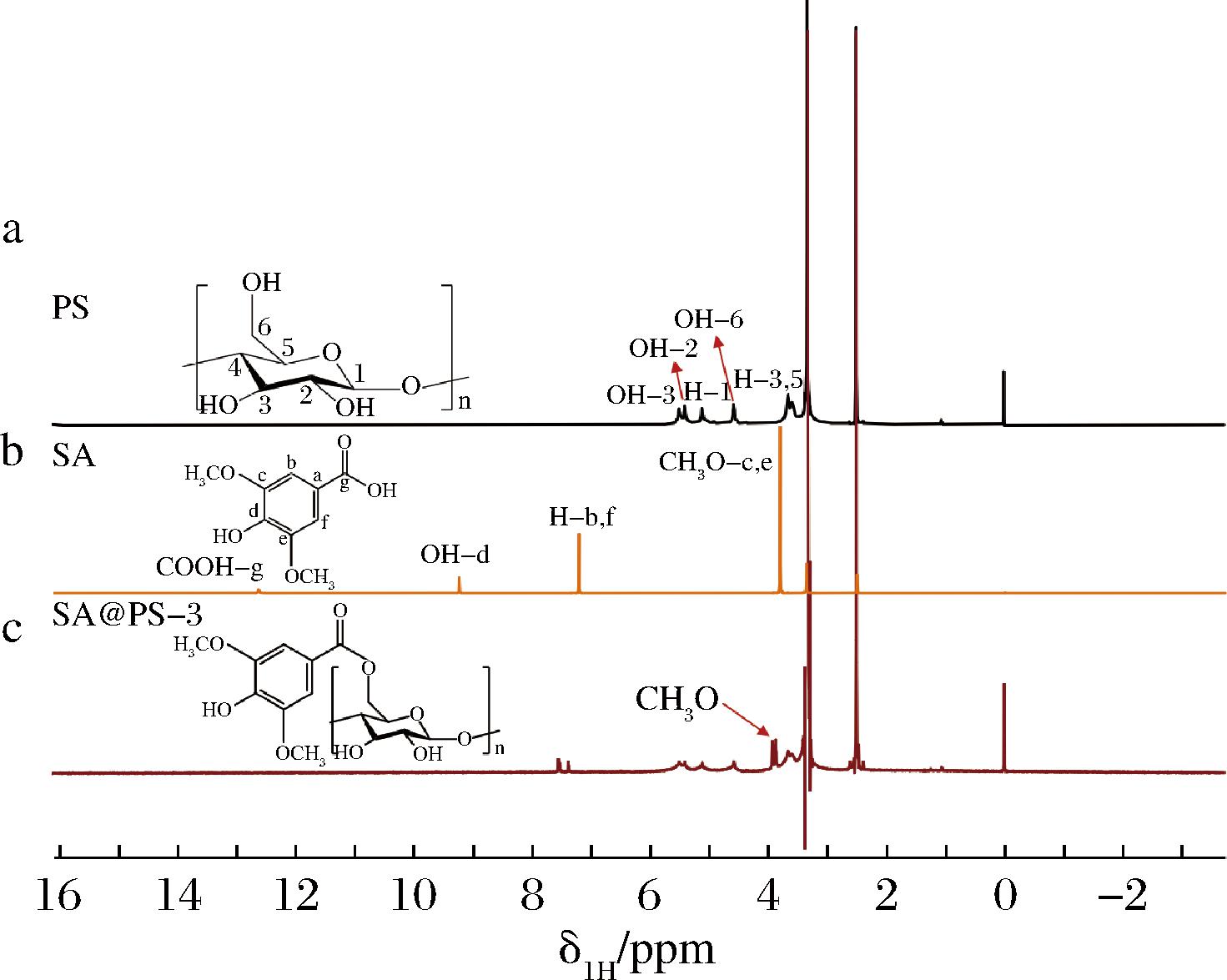
a-PS;b-SA;c-SA@PS-3
图4 多孔淀粉、丁香酸及丁香酸多孔淀粉酯的核磁共振氢谱图
Fig.4 1H NMR images of PS、SA and SA@PS-3
2.5 红外光谱分析
为了进一步证实多孔淀粉和丁香酸之间形成酯键,对PS、SA和SA@PS进行了红外谱图的分析(图5),该光谱可提供有关分子键性质、结构和微环境变化的详细信息。如图5所示,PS在3 417 cm-1和2 927 cm-1处的吸附峰,分别归属于淀粉葡萄糖单元中—OH和CH2—的伸缩振动;而在1 647 cm-1处吸收峰与淀粉分子中的结合水有关;另外,在1 019 cm-1附近的几处波段都是与C—O的骨架振动和不对称伸缩振动引起的[17]。SA@PS除了具有AGU结构的特征峰外,在1 742 cm-1处出现了一个明显的新峰[21],这归因于淀粉酯的RCOO基团中(C![]() O)吸收峰伸缩振动,并随着所得产物DS值的增加,酯羰基谱带的峰强度显著增加。另外,除了DS值增加外,由于羟基数目的减少,3 400 cm-1附近的宽峰强度也降低了,可能表明羟基参与了酯化反应。
O)吸收峰伸缩振动,并随着所得产物DS值的增加,酯羰基谱带的峰强度显著增加。另外,除了DS值增加外,由于羟基数目的减少,3 400 cm-1附近的宽峰强度也降低了,可能表明羟基参与了酯化反应。
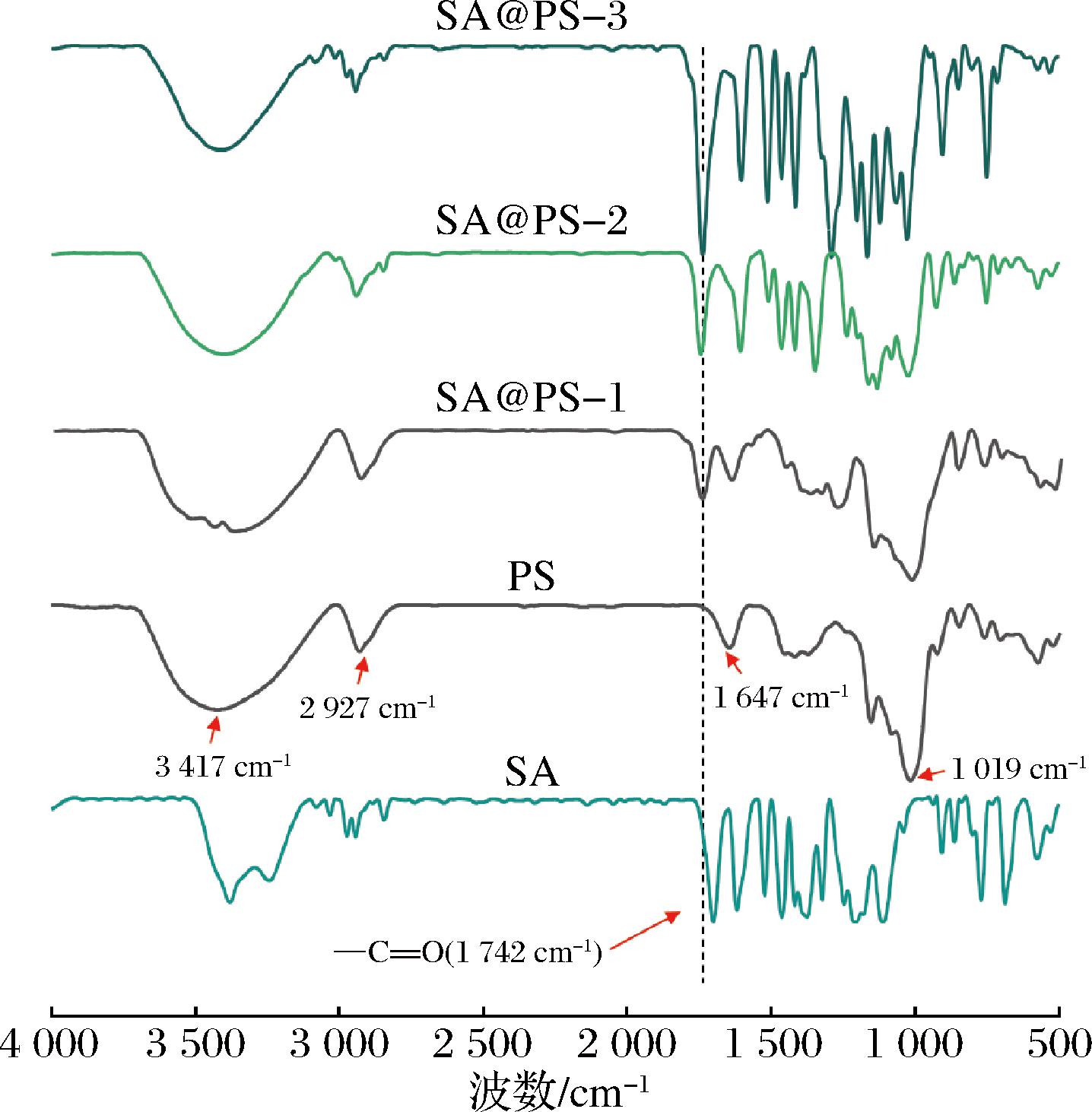
图5 多孔淀粉和不同取代度丁香酸多孔淀粉酯的红外光谱图
Fig.5 FT-IR spectra of PS、SA@PS of different degree of substitution
2.6 X-衍射分析
NS、PS和不同取代度的SA@PS进行XRD分析(图6)。NS的X射线衍射图显示出典型的B型晶体结构特征,分别在15.2°、17.1°、22.5°处有3个较强的特征衍射峰[22]。PS的图谱中观察到无定形分散的宽峰,这可能是PS制备过程NS经高温糊化、淀粉晶核熔化,破坏了分子之间的氢键,使更多的淀粉分子长链发生分离,导致淀粉结构分解程度增加,最终呈现为单一的、非晶态的衍射峰[23]。而SA@PS在12.8°、19.2°、26.6°处有3个新的衍射峰,表明PS经酯化作用形成了新的晶体结构,SA@PS 3个新衍射峰的峰强度随着取代度的增大而增强,这可能是酯化过程中短链直链淀粉发生了回生重新聚集形成了新的晶体结构,确切的形成机理有待深入研究[24]。
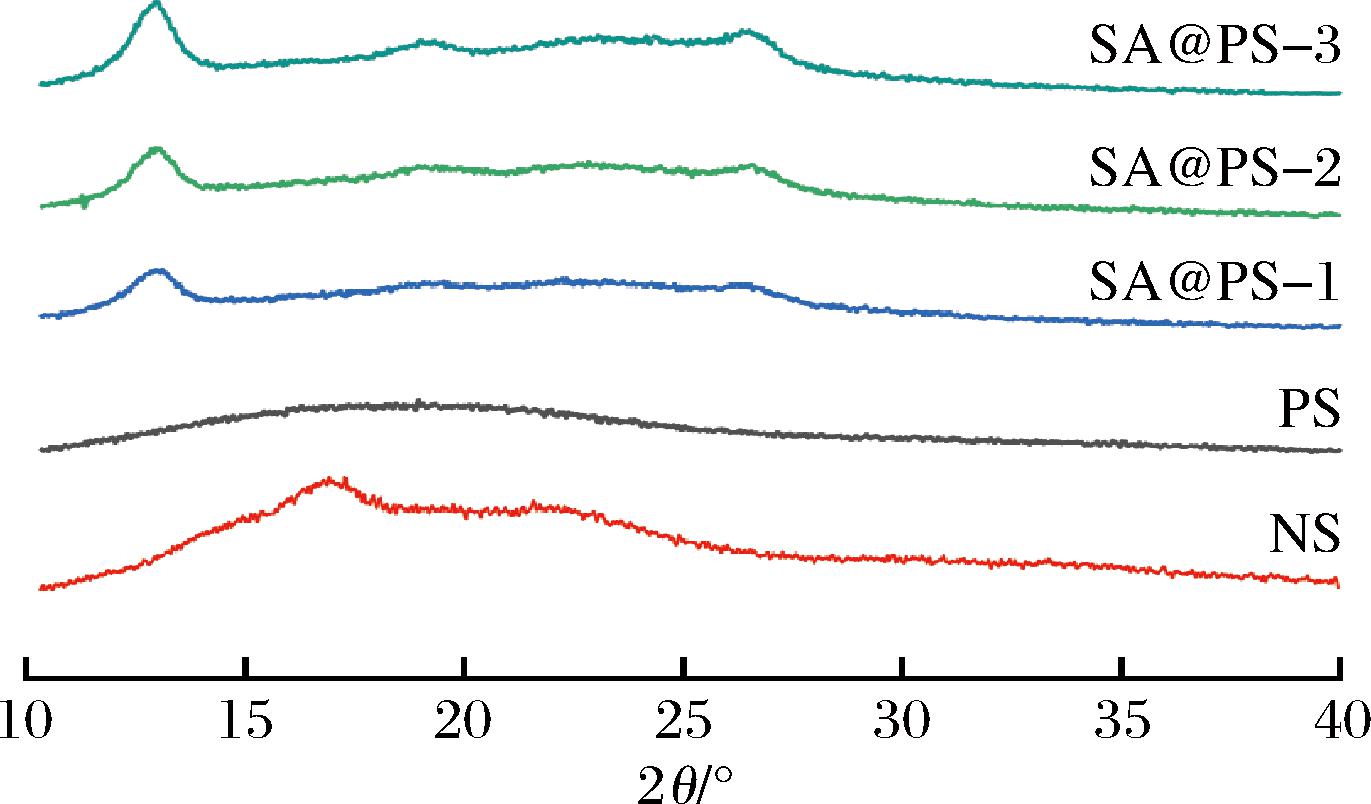
图6 丁香酸、多孔淀粉及不同取代度的丁香酸多孔淀粉酯的X射线衍射图谱
Fig.6 The X-ray diffraction pattern of SA、PS and SA@PS of different degree of substitution
2.7 DPPH自由基清除能力分析
PS和不同取代度的SA@PS对DPPH自由基的清除率如图7所示。在DPPH自由基清除实验中,抗氧化剂能够将稳定的DPPH自由基(紫色)还原为非自由基形式的DPPH-H(黄色)[25]。结果表明PS对DPPH自由基的清除能力非常弱;相同浓度的条件下,SA@PS对DPPH自由基的清除率随着取代度的增加而增加,这可能由于丁香酸通过酯化反应连接到PS骨架中。当SA@PS的质量浓度为2.5 mg/mL,SA@PS-3对DPPH自由基的清除率达到最高17.68%。取代度越大说明有更多的丁香酸分子参与酯化反应,丁香酸的酚羟基能与自由基反应形成稳定的苯氧基,且两侧的甲氧基有效加强了苯氧基的稳定性[26],从而使SA@PS具备了较强的抗氧化性。

图7 多孔淀粉和不同取代度的丁香酸多孔淀粉酯的DPPH自由基清除能力
Fig.7 DPPH free radical scavenging ability of PS and SA@PS of different degree of substitution
3 结论
化学改性是一种广泛应用于改善淀粉性能以满足某些特定应用要求的有力手段。以溶剂交换法对NS进行多孔化改性,完全破坏了淀粉颗粒原有的表观形貌,制备出PS 颗粒形状不规则,表面形成了大量分布不均的孔隙结构,孔隙及内部的空腔暴露出更多的反应位点,使靠近主体分子的可能性增大,提升了反应效率,且随着丁香酸分子浓度的增加,DS也随之增加,表明多孔处理有利于淀粉改性反应的发生。利用CDI介导的反应将丁香酸酯化到马铃薯多孔淀粉上。1H NMR和FT-IR谱图结果表明,丁香酸羧基与淀粉羟基之间通过酯键完成骨架连接;酯化反应后XRD显示,SA@PS的晶体结构由PS无定形状态在酯化过程中发生部分回生,从而形成新的晶体结构。SA@PS因携带了酚类物质,获得了较强的抗氧化活性,取代度和样品浓度与DPPH自由基的清除率呈正相关关系。制备的淀粉酯化物可用于生物活性物质的转运、控释和保护材料,有望在医药、食品等领域应用。
[1] GOPINATH V, SARAVANAN S, AL-MALEKI A R, et al.A review of natural polysaccharides for drug delivery applications:Special focus on cellulose, starch and glycogen[J].Biomedicine &Pharmacotherapy, 2018, 107:96-108.
[2] SUJKA M, JAMROZ J.Characteristics of pores in native and hydrolyzed starch granules[J].Starch-Stärke, 2010, 62(5):229-235.
[3] HJ LATIP D N, SAMSUDIN H, UTRA U, et al.Modification methods toward the production of porous starch:A review[J].Critical Reviews in Food Science and Nutrition, 2021, 61(17):2841-2862.
[4] WU C, WANG Z Y, ZHI Z Z, et al.Development of biodegradable porous starch foam for improving oral delivery of poorly water soluble drugs[J].International Journal of Pharmaceutics, 2011, 403(1-2):162-169.
[5] SRINIVASULU C, RAMGOPAL M, RAMANJANEYULU G, et al.Syringic acid (SA):A review of its occurrence, biosynthesis, pharmacological and industrial importance[J].Biomedicine &Pharmacotherapy, 2018, 108:547-557.
[6] RYCHLICKA M, ROT A, GLISZCZY SKA A.Biological properties, health benefits and enzymatic modifications of dietary methoxylated derivatives of cinnamic acid[J].Foods, 2021, 10(6):1417.
SKA A.Biological properties, health benefits and enzymatic modifications of dietary methoxylated derivatives of cinnamic acid[J].Foods, 2021, 10(6):1417.
[7] YANG K, DANG H, LIU L, et al.Effect of syringic acid incorporation on the physical, mechanical, structural and antibacterial properties of chitosan film for quail eggs preservation[J].International Journal of Biological Macromolecules, 2019, 141:876-884.
[8] LIU J, LIU S, CHEN Y, et al.Physical, mechanical and antioxidant properties of chitosan films grafted with different hydroxybenzoic acids[J].Food Hydrocolloids, 2017, 71:176-186.
[9] CHANG P R, YU J G, MA X F.Preparation of porous starch and its use as a structure-directing agent for production of porous zinc oxide[J].Carbohydrate Polymers, 2011, 83(2):1016-1019.
[10] HAN J F, BORJIHAN G, BAI R K, et al.Synthesis and anti-hyperlipidemic activity of a novel starch piperinic ester[J].Carbohydrate Polymers, 2008, 71(3):441-447.
[11] WEN Y, YE F Y, ZHU J F, et al.Corn starch ferulates with antioxidant properties prepared by N, N′-carbonyldiimidazole-mediated grafting procedure[J].Food Chemistry, 2016, 208:1-9.
[12] KAPUSNIAK J, SIEMION P.Thermal reactions of starch with long-chain unsaturated fatty acids.Part 2.Linoleic acid[J].Journal of Food Engineering, 2007, 78(1):323-332.
[13] MATHEW S, ABRAHAM T E.Physico-chemical characterization of starch ferulates of different degrees of substitution[J].Food Chemistry, 2007, 105(2):579-589.
[14] TAO B B, YE F Y, LI H, et al.Phenolic profile and in vitro antioxidant capacity of insoluble dietary fiber powders from Citrus (Citrus junos Sieb.ex Tanaka) pomace as affected by ultrafine grinding[J].Journal of Agricultural and Food Chemistry, 2014, 62(29):7166-7173.
[15] CHEN Y, DAI G F, GAO Q Y.Preparation and properties of granular cold-water-soluble porous starch[J].International Journal of Biological Macromolecules, 2020, 144:656-662.
[16] 王宇霞, 马云翔, 苟丽娜, 等.羧甲基多孔淀粉表征及其对槲皮素吸附研究[J].食品与发酵工业, 2022, 48(20):105-111.
WANG Y X, MA Y X, GOU L N, et al.The characterization of carboxymethyl porous starch and its adsorption on quercetin[J].Food and Fermentation Industries, 2022, 48(20):105-111.
[17] FANG J M.The preparation and characterisation of a series of chemically modified potato starches[J].Carbohydrate Polymers, 2002, 47(3):245-252.
[18] LU X X, LUO Z G, YU S J, et al.Lipase-catalyzed synthesis of starch palmitate in mixed ionic liquids[J].Journal of Agricultural and Food Chemistry, 2012, 60(36):9273-9279.
[19] PENG Q J, PERLIN A S.Observations on N.M.R.spectra of starches in dimethyl sulfoxide, iodine-complexing, and solvation in water-di-methyl sulfoxide[J].Carbohydrate Research, 1987, 160:57-72.
[20] DONA A, YUEN C W W, PEATE J, et al.A new NMR method for directly monitoring and quantifying the dissolution kinetics of starch in DMSO[J].Carbohydrate Research, 2007, 342(17):2604-2610.
[21] LIU Y Q, LIU J G, KONG J, et al.Citrate esterification of debranched waxy maize starch:Structural, physicochemical and amylolysis properties[J].Food Hydrocolloids, 2020, 104:105704.
[22] LAWAL O S, LECHNER M D, KULICKE W M.Single and multi-step carboxymethylation of water yam (Dioscorea alata) starch:Synthesis and characterization[J].International Journal of Biological Macromolecules, 2008, 42(5):429-435.
[23] WANG Y L, GAO W Y, LI X.Carboxymethyl Chinese yam starch:Synthesis, characterization, and influence of reaction parameters[J].Carbohydrate Research, 2009, 344(13):1764-1769.
[24] 苟丽娜, 马云翔, 王宇霞, 等.高比表面积阿魏酸多孔淀粉酯结构表征及体外消化特性[J].食品与发酵工业, 2021, 47(22):76-83.
GOU L N, MA Y X, WANG Y X, et al.Structural characterization and in vitro digestibility of ferulic acid porous starch ester with high specific surface area[J].Food and Fermentation Industries, 2021, 47(22):76-83.
[25] LIU J, WANG X C, BAI R Y, et al.Synthesis, characterization, and antioxidant activity of caffeic-acid-grafted corn starch[J].Starch-Stärke, 2018, 70(1-2):1700141.
[26] RICE-EVANS C A, MILLER N J, PAGANGA G.Structure-antioxidant activity relationships of flavonoids and phenolic acids[J].Free Radical Biology and Medicine, 1996, 20(7):933-956.