牦牛是高寒缺氧地区的特有畜种,其肉质营养丰富,具有高蛋白、低脂肪等特点。然而,牦牛肉肌纤维较粗,嫩度较差,导致其食用及加工受限[1]。宰后成熟过程肌肉内部发生各种复杂生理生化反应(如糖酵解[2]、肌肉收缩[3]、细胞凋亡[1]、蛋白质降解[4])导致肌肉品质(嫩度[5]、保水性和颜色[6])发生改变,动物胴体逐渐由肌肉转变成肉,有效改善了肌肉品质[7]。
在这个生化过程中,活性氧(reactive oxygen species, ROS)自由基引发的蛋白质氧化所形成的羰基及衍生物与肌肉品质高度相关[8],活性氮(reactive nitrogen species,RNS)自由基同样可以与ROS自由基、蛋白质和其他物质的巯基反应,并参与肌肉品质调节[9]。研究表明,动物屠宰后,缺氧、缺血的环境导致肌肉内部ROS含量增加,从而加速蛋白氧化[7];此外,宰后动物体内的抗氧化能力下降,无法及时清除外界氧化应激因子,肌肉氧化应激水平逐渐升高,最终影响肌肉品质[10]。ROS是细胞代谢过程中由氧直接或间接转变而成的氧自由基(单线态氧、超氧阴离子和羟自由基等)和具有反应氧功能的基团(H2O2、HClO4、氢过氧化物等)[6]。ROS通过影响蛋白质氨基酸残基、肽键,使蛋白质氧化,导致其结构和功能特性改变,最终影响肌肉品质[11]。已有研究表明,蛋白氧化会影响肉类质构特性,例如二硫键和席夫碱的产生会增加肉的硬度[12];氧化也会导致部分疏水性残基的暴露,降低蛋白质水合力,导致肌肉保水性降低[13];同时肌红蛋白的氧化还会造成肌肉肉色改变[6]。除ROS自由基外,在肉类加工和贮藏过程中RNS也可以诱发蛋白氧化[14]。其中,NO是RNS的主要组成物质[15],它通过一氧化氮合酶(nitric oxide synthase,NOS)的激活来应对缺氧/缺血引起的不良反应,通过与蛋白质、铁离子、ROS自由基和其他物质的巯基反应,调节许多生化过程(如碳代谢、肌肉收缩和细胞凋亡)[9]。值得注意的是,蛋白质亚硝化,即NO与蛋白质半胱氨酸的巯基的共价键形成S-亚硝硫醇(S-nitrosothiols,SNO),已被证明参与了肌肉到肉类的转化过程[16]。据报道,使用NO供体和NOS抑制剂调节屠宰前和屠宰后肌肉细胞中NO水平,可影响牛肉、鸡肉、猪肉和羊肉等动物的嫩度、颜色和保水性等品质属性[5, 17]。尽管在低氧损伤过程中ROS和NO介导的肌肉品质调控机制已知,但支持氧化应激两个下游事件之间的串扰与肌肉品质调控之间的关系的研究仍较有限,即关于蛋白质氧化(由羰基引起;CO自由基)和蛋白质亚硝基化(由NO/过氧亚硝酸根引起;ONOO自由基)在调控牦牛肉品质特性的相互作用的研究尚未见报道。
本实验通过使用ROS促进剂(H2O2)和ROS抑制剂[N-乙酰半胱氨酸(N-acetylcysteine,NAC)]与NO供体[S-亚硝基-L-谷胱甘肽(S-nitroso-L-glutathione, GSNO)]和NO抑制剂[N-硝基-L-精氨酸甲酯盐酸盐(N-nitro-L-arginine methyl ester hydrochloride, L-NAME)]分组组合对宰后牦牛肉进行处理,模拟牦牛宰后自然成熟过程,评估蛋白质氧化和亚硝化之间的串扰影响牦牛肉食用品质的可能机制,为牦牛肉品质提高提供理论依据。
1 材料与方法
1.1 材料与试剂
本试验选用甘肃省天祝藏族自治州3~4岁[体重约(300±50) kg]、健康无病的公牦牛6头。在商业屠宰厂屠宰后,于30 min内取背最长肌(第12胸椎至第5腰椎),剔除表面筋膜、脂肪,切成100 g大小的肉块。随机分为6份。W:对照组1(切割后立即用液氮速冻);A:对照组2[0.9%(质量分数,下同)NaCl];B:ROS促进组+RNS促进组(0.9% NaCl、20 mmol/L H2O2);C:ROS促进组+RNS抑制组(20 mmol/L H2O2、0.1 mol/L L-NAME、0.9% NaCl);D:ROS抑制组+RNS促进组[20 mmol/L NAC、200 μmol/L GSNO,0.9% NaCl]; E:ROS抑制组+RNS抑制组(20 mmol/L NAC、0.1 mol/L L-NAME、0.9% NaCl],注射比例为1∶1(g∶mL),4 ℃成熟12、24、72、120、168 h后取样,测定相关品质指标,剩余肉样用铝箔纸包裹,-80 ℃保存待用。
GSNO、L-NAME,上海源叶生物科技有限公司;H2O2、NAC,北京索莱宝科技有限公司;K2HPO4、KH2PO4、NaCl均为分析纯,天津市光复科技发展有限公司。
1.2 仪器与设备
TGL-16PC台式高速冷冻离心机,湖南湘仪集团;PHS-3 C型pH计,上海虹益仪器仪表有限公司;SP-756P紫外-可见分光光度计,上海美谱达仪器有限公司;C-LM4数显式肌肉嫩度仪,东北农业大学工程学院;TA.XT Express质构仪,英国Stable Micro Systems公司;JEM-1400FLASH透射电子显微镜,日本日立公司。
1.3 试验方法
1.3.1 食用品质的测定
1)pH值:参考陈炼红等[7]的方法并稍作修改。采用pH计测定。
2)肉色:参照刘佳东[18]的方法,利用色差仪测定。在每个处理组肉样中随机选取3个不同位置,测定亮度(L*)值、红度(a*)值、黄度(b*)值。结果以3组的平均数计。
3)蒸煮损失:参照张朝阳[19]的方法并稍作修改,将肉切成约6 cm×3 cm×3 cm的肉块(约100 g)。取上述肉样称重,记作m1,置于蒸煮袋中,水浴加热,待肉样中心温度达75 ℃时,持续加热30 min后取出肉样,冷却至室温再次称重,记作m2。按公式(1)计算:
蒸煮损失![]()
(1)
4)剪切力:参照NY/T 1180—2006《肉嫩度的测定 剪切力测定法》,利用嫩度仪进行测定。取蒸煮损失试验中煮熟的肉样,滤纸吸去表面水分后冷却至室温,取样器(直径1.27 cm)沿着肌纤维方向钻取3个肉柱,使用嫩度仪对每个样品进行剪切,肌纤维的长轴与刀片垂直。
5)质构特性:参考HERRERO等[20]的方法,采用物性测试仪进行分析。测试条件为测前速度4.0 mm/s,测试速度6.0 mm/s,测后速度6.0 mm/s,目标模式strain,压缩比例40%,停留时间5.0 s,触发力5 g,探头类型:P/50探头。将肉样切成 1 cm×1 cm×1 cm,选择硬度、弹性、胶着性、黏聚性、咀嚼性和回复性为分析指标。进行6次平行测定,结果用平均值表示。
1.3.2 肌肉微观结构的测定
1)肌原纤维小片化指数(myofibril fragmentation index,MFI):参照王琳琳[1]的方法进行测定。
2)微观结构:参照HOU等[5]的方法,将肉样沿肌纤维方向切成0.5 mm×0.5 mm× 0.5 mm的小块,用体积分数为3%的戊二醛溶液固定7 d(每隔1 d更换1次固定液),再用体积分数为2%锇酸固定,之后依次用体积分数为50%、70%、80%、90%和100%乙醇脱水,然后用1∶1(g∶mL)丙酮树脂包埋,4~5 h后将样品转移至纯包埋液中,室温可过夜。然后修整包埋块,超薄切片,之后在透射电子显微镜下观察肌纤维,放大倍数为12 000倍。
1.4 数据分析
利用Excel 2019对数据进行平均值和标准差分析,采用SPSS 21.0进行Duncan’s多重检验(P<0.05),数据用平均值±标准差表示,并运用Origin 2021进行相关性和主成分分析及作图。
2 结果与分析
2.1 pH值
如图1所示,各处理组pH值均呈先降低后增大的趋势,且均在成熟的第72 h达到极限值,这可能是因为宰后0 h动物体内的高度缺氧导致糖原进行无氧糖酵解产生乳酸及ATP分解产生磷酸而导致肌肉pH的下降[7],而随着成熟的进行,当肉样pH值达到极限值时,肌质网释放Ca2+,激活钙蛋白酶,分解肌间蛋白质,这一过程中产生的碱性物质使肉的pH值增大[18]。此外,同一成熟时间(除0 h),不同处理组之间pH值差异显著(P<0.05)。在成熟的第12~168 h时,各处理组的pH值大小依次为:ROS抑制组+RNS促进组>ROS抑制组+RNS抑制组>对照组2>ROS促进组+RNS促进组>ROS促进组+RNS抑制组。即抑制ROS的同时激活或抑制RNS能够增加牦牛肉的pH值,而激活ROS的同时促进或抑制RNS可降低pH值,说明与对照组相比,抑制ROS的同时激活或抑制RNS均有利于pH值的增大;而在激活ROS的同时促进或抑制RNS,pH值显著降低;同时结果也显示高/低RNS条件下激活ROS,pH值降低;高/低氧条件下,激活RNS可使pH值显著增大。以上结果表明,减少NO或增加ROS的产生能够降低样品最终pH值,张朝阳[19]和WANG等[21]研究也发现,抑制NO的生成可显著降低牛肉pH值(P<0.05),这与本试验结果相一致。
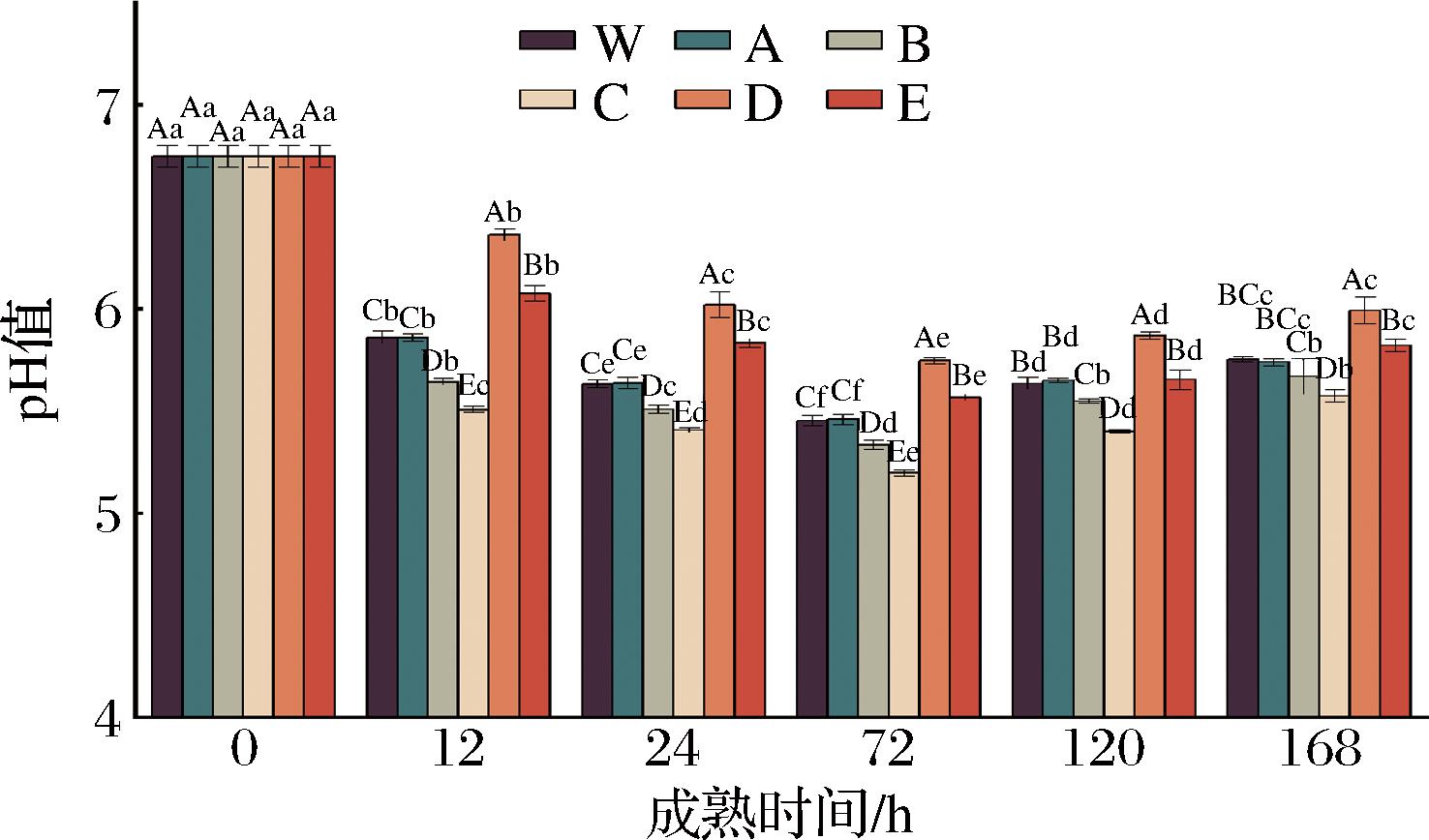
图1 宰后RNS与ROS串扰对牦牛肉pH值的影响
Fig.1 Effect of the crosstalk between RNS and ROS on the pH of yak meat during postmortem
注:不同大写字母代表不同处理组在同一成熟时间点差异显著性(P<0.05),不同小写字母代表同一处理组不同成熟时间差异显著性(P<0.05)(下同)。
2.2 肉色
由图2-a可知,各处理组牦牛肉的L*值基本呈先升高后降低的趋势,这可能是由于宰后成熟期间,肌肉内的水分大量流出,并聚集在肉表面,增强光反射能力,使L*值增加[18],而成熟后期,肌肉中的肌红蛋白被氧化为高铁肌红蛋白,导致脱氧肌红蛋白数量减少,进而导致亮度值维持一个较低的水平[6]。此外,同一成熟时间不同处理组之间牦牛肉L*值也存在显著差异(P<0.05),在成熟的第12~168 h,ROS促进组+RNS抑制组的L*值显著低于对照组2(P<0.05),表明与对照组相比,在促进ROS的同时抑制RNS可使牦牛肉L*值降低;此外,ROS促进组+RNS促进组的L*值显著高于ROS促进组+RNS抑制组,该结果表明,高氧条件下抑制RNS可使L*值显著降低(P<0.05),这可能是因为抑制NO或促进ROS的生成导致氧化肌红蛋白含量减少[6]。此外,整个成熟期间,各处理组L*值变化不一致,推测可能与ROS、RNS的串扰作用和肌肉pH值有关[6,18]。
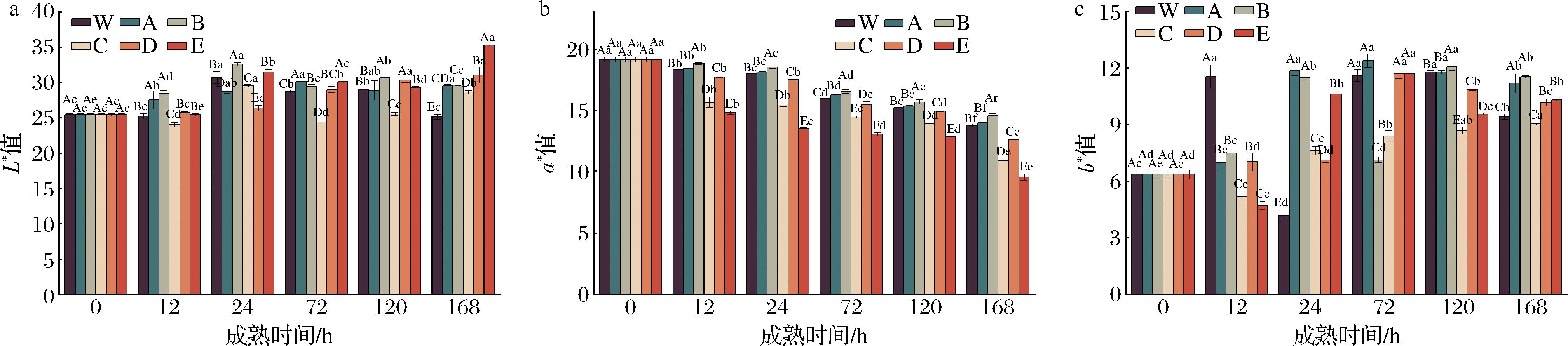
a-L*;b-a*;c-b*
图2 宰后RNS与ROS串扰对牦牛肉L*、a*和b*的影响
Fig.2 Effect of crosstalk of RNS and ROS on L*, a*, and b* values of yak meat during postmortem
由图2-b可知,各处理组牦牛肉的a*值均显著下降(P<0.05),这可能是因为宰后成熟期间肌红蛋白逐渐被氧化为高铁肌红蛋白,积累的高铁肌红蛋白使a*值显著下降[22]。同一成熟时间不同处理组间牦牛肉a*值也存在显著差异(P<0.05),在成熟的第12~168 h,各处理组a*值大小依次为:ROS促进组+RNS促进组>对照组2>ROS抑制组+RNS促进组>ROS促进组+RNS抑制组>ROS抑制组+RNS抑制组,结果表明与对照组相比,同时激活ROS和RNS,a*值显著增加,而在激活或抑制ROS的同时抑制RNS,a*值显著降低;此外,结果也表明,高/低氧条件下,激活RNS可使a*值显著再增加,这可能是由于宰后氧化程度越高,则易生成鲜红色的氧合肌红蛋白,肉的色泽越好;反之,肉的色泽越差[18]。
由图2-c可知,在成熟的第12~168 h,不同处理组牦牛肉的b*值整体呈升高的趋势,且b*值在成熟期间各处理组未呈现出一定的规律。
综上,与对照组相比,在促进ROS的同时抑制RNS可使牦牛肉L*值、a*值显著降低,而同时激活ROS和RNS,a*值显著增加;此外,高氧/低氧条件下激活RNS, a*值显著增加,高氧条件下抑制RNS可显著降低L*值。
2.3 蒸煮损失
由图3可知,随成熟时间的延长,各处理组牦牛肉的蒸煮损失基本上呈先增加后降低的趋势,且在成熟的第72 h时,蒸煮损失达到最大值。这可能是因为宰后初期,肌肉迅速进入缺氧状态,导致肌肉内部糖原进行无氧糖酵解产生大量乳酸而降低pH值,pH下降至接近于蛋白质等电点时,蛋白质之间相互作用产生沉淀,从而减弱对水分的结合力,造成肌肉水分流失,使保水性降低,蒸煮损失增加[23];而随着成熟时间的延长,肌肉中肌原纤维及骨架蛋白被逐渐分解,吸收K+、释放Ca2+导致离子净电荷增加,渗透压增加,结合水的能力增加,蒸煮损失逐渐降低[24]。此外,同一成熟时间(除0 h),不同处理组之间蒸煮损失也存在显著差异,其中,在成熟的第24~120 h时,ROS促进组+RNS促进组的蒸煮损失显著高于ROS促进组+RNS抑制组和对照组2(空白)(P<0.05);同时,对照组蒸煮损失也显著高于ROS抑制组+RNS促进组和ROS抑制组+RNS抑制组(P<0.05),说明促进ROS可加重肌肉的蒸煮损失,原因可能是ROS诱导的蛋白氧化引起蛋白质的降解与变性,导致其对水分结合能力降低,肌肉蒸煮损失逐渐增加[7]。以上结果表明,与对照组相比,激活ROS的同时激活/抑制RNS,蒸煮损失显著增加,而抑制ROS的同时激活或抑制RNS,蒸煮损失显著降低;此外,结果还表明高氧/低氧条件下,激活RNS可显著提高肌肉的蒸煮损失(P<0.05),推测可能是由宰后ROS与RNS串扰对牦牛肉的蛋白质降解程度、蛋白质氧化、蛋白质亚硝基化和pH值不同所致[25-26]。
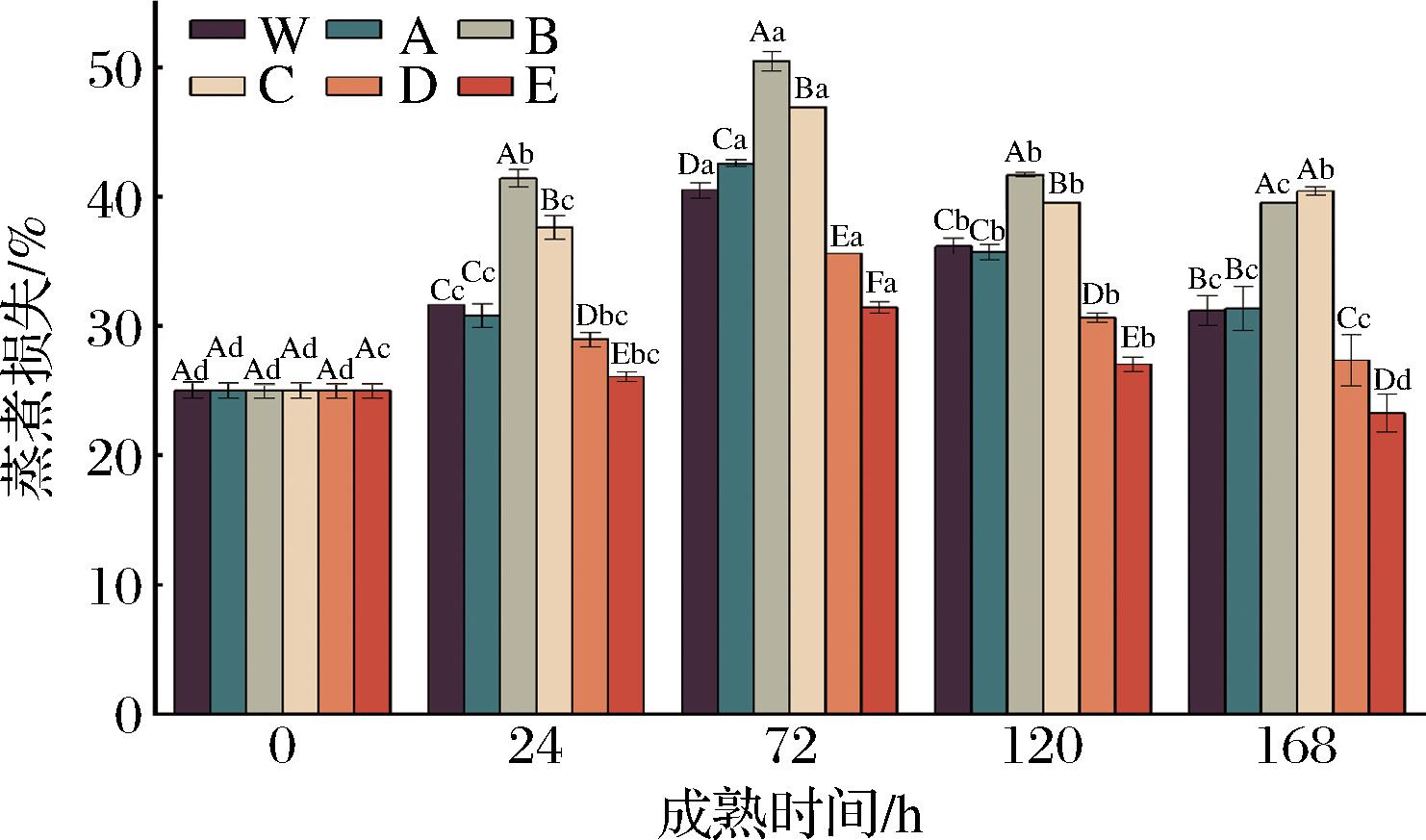
图3 宰后RNS与ROS串扰对牦牛肉蒸煮损失的影响
Fig.3 Effect of crosstalk between RNS and ROS on steaming losses of yak meat during postmortem
2.4 剪切力
由图4可知,各处理组剪切力基本上呈先上升后下降的趋势,且在成熟的第72 h达到最大值。这可能是因为在宰后成熟早期,由于肌节的收缩而导致肌肉进入僵直状态,剪切力增大;而随着成熟的进行,当达到最大僵直后,在肌肉中一些内源酶和肌浆Ca2+等激活因子的作用下,将肌肉结构破坏,使肉的嫩度增加,剪切力值降低[27]。此外,牦牛肉宰后成熟过程中,同一成熟时间,不同处理组之间剪切力也存在显著差异(除0 h),在成熟的第24 h,剪切力由大到小依次为:ROS抑制组+RNS促进组>对照组>ROS促进组+RNS促进组>ROS促进组+RNS抑制组>ROS抑制组+RNS抑制组,表明宰后成熟第24 h时,增加ROS或抑制RNS的产生能够使肌肉剪切力减小,嫩度降低,这与王琳琳[1]的研究结果一致。随着成熟的进行,在72~168 h,ROS促进组+RNS促进组剪切力显著高于ROS促进组+RNS抑制组(P<0.05),而显著低于ROS抑制组+RNS抑制组。张朝阳[19]研究也发现,与对照组相比,NO供体处理提高了成熟第7天的剪切力值,NO抑制剂处理降低了牛肉成熟第4天和第7天的剪切力值,这与本试验结果相一致,即当宰后肌肉细胞中的NO含量增加时,会增加牛肉的剪切力,即降低牛肉的嫩度。以上结果表明,在成熟的第72~168 h,与对照组相比,激活ROS的同时激活/抑制RNS,剪切力值显著降低,而抑制ROS的同时激活或抑制RNS,剪切力值显著增大;此外,结果还发现,高氧条件下抑制RNS可降低剪切力值,而低氧条件下抑制RNS可使剪切力值增大。引起上述结果变化的原因,一方面这可能由于H2O2处理后ROS含量增加,积累的ROS诱导细胞凋亡级联反应的发生,从而对肌原纤维蛋白进行降解,破坏了肌纤维的结构,导致剪切力值减小[1];另一方面可能是因为NO及其介导的蛋白质亚硝基化通过抑制钙蛋白酶的自溶,降低钙蛋白酶的水解活性,从而抑制肌原纤维蛋白和细胞骨架蛋白降解,使肌肉嫩度降低,剪切力增大[19]。
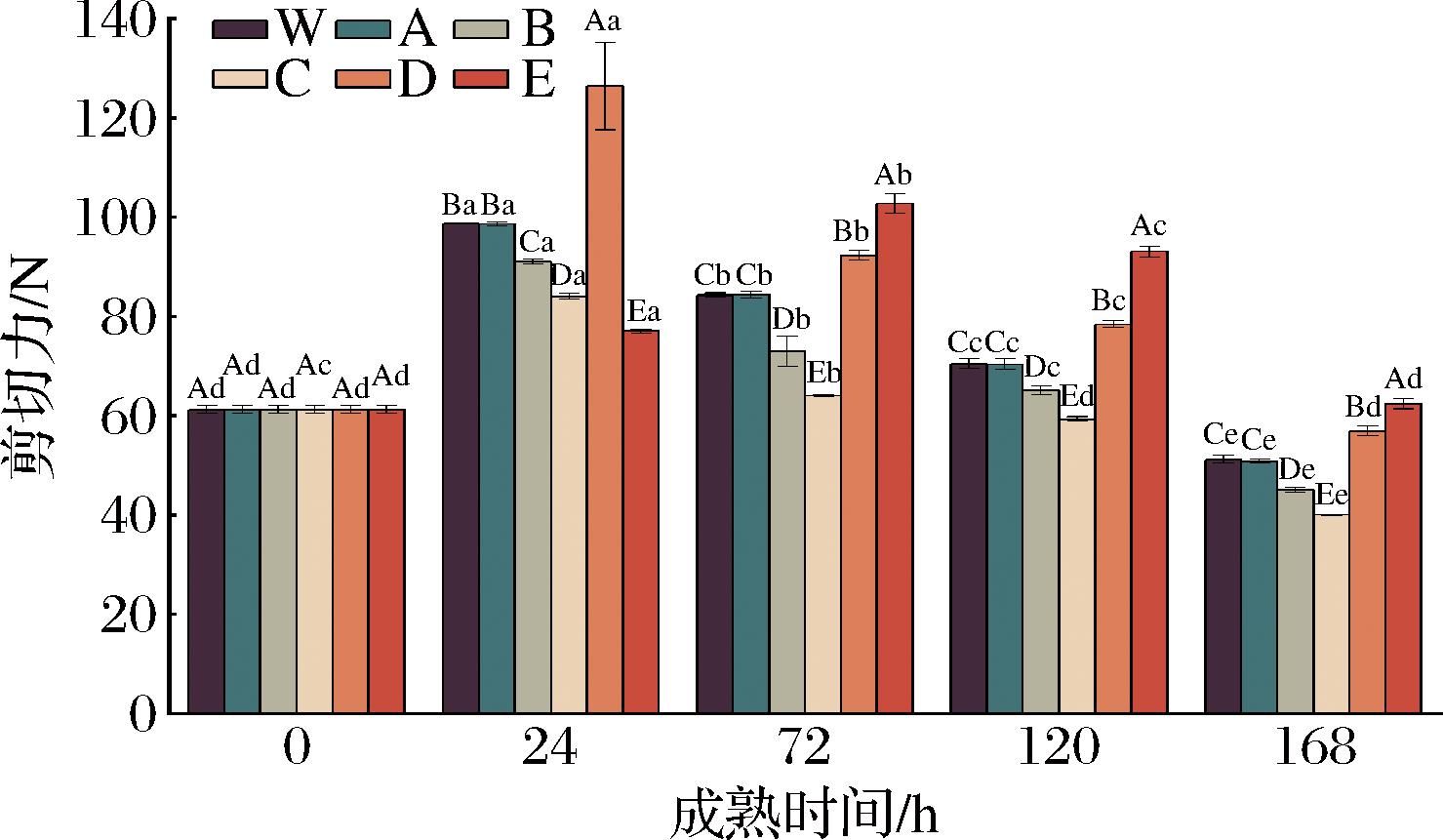
图4 宰后RNS与ROS串扰对牦牛肉剪切力的影响
Fig.4 Effect of crosstalk between RNS and ROS on shear force of yak meat during postmortem
2.5 质构特性
由图5-a可知,随着成熟时间的延长,各处理组牦牛肉硬度均呈先增加后降低的趋势。同一成熟时间(除0 h外)不同处理间牦牛肉的硬度也存在显著差异,且在成熟的第24~72 h,硬度大小依次为ROS抑制组+RNS促进组>ROS抑制组+RNS抑制组>对照组>ROS促进组+RNS促进组>ROS促进组+RNS抑制组,说明在激活ROS的同时促进或抑制RNS可使肌肉硬度降低,利于肌肉嫩化,这与剪切力的变化规律相一致,推测可能是由于在成熟间RNS引起的蛋白亚硝基化对蛋白氧化有负向调控作用[28]。结果表明增加RNS肌肉嫩度变差,而增加ROS可改善肌肉嫩度。
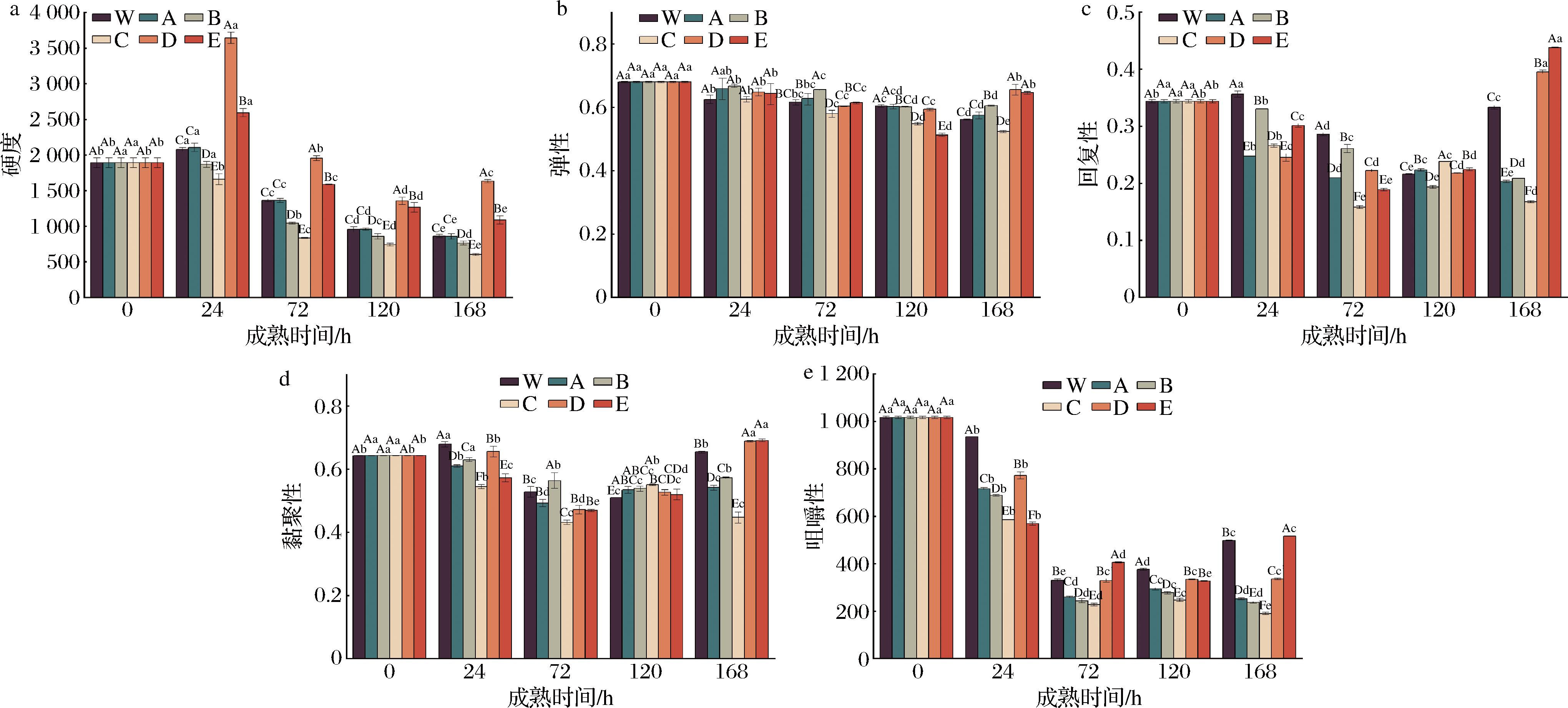
a-硬度;b-弹性;c-回复性;d-黏聚性;e-咀嚼性
图5 宰后RNS与ROS串扰对牦牛肉硬度、弹性、回复性、黏聚性、咀嚼性的影响
Fig.5 Effect of crosstalk between RNS and ROS on hardness, elasticity, recovery, cohesiveness, and chewiness of yak meat during postmortem
由图5-b~图5-d可知,牦牛肉宰后成熟过程中,各处理组弹性和回复性均呈下降趋势(P<0.05);且成熟24~168 h,各处理组牦牛肉黏聚性均呈先下降后上升的趋势。此外,同一成熟时间,不同处理组之间肌肉弹性、回复性及黏聚性也存在一定的变化。
咀嚼性与硬度、黏聚性和弹性的大小有关[28]。由图5-e可知,在成熟的第0~120 h,对照组、ROS促进组+RNS促进组/ROS抑制组、ROS抑制组+RNS促进组的咀嚼性呈先下降后上升的趋势。此外,同一成熟时间不同处理间牦牛肉的咀嚼性也存在显著差异,且在成熟的第24 h,咀嚼性大小依次为ROS抑制组+RNS促进组>对照组2>ROS促进组+RNS促进组>ROS促进组+RNS抑制组>ROS抑制组+RNS抑制组,这与剪切力的结果相一致,表明宰后成熟第24 h时,增加ROS或抑制RNS的产生能够使肌肉咀嚼性减小,嫩度降低;而在成熟的第72~168 h,咀嚼性大小依次为:ROS抑制组+RNS抑制组>对照组2>ROS促进组+RNS促进组>ROS促进组+RNS抑制组(P<0.05)。综上,结果表明增加ROS的同时激活或抑制RNS可降低肌肉咀嚼性,改善肌肉嫩度。
综上所述,与对照组相比,激活ROS的同时激活/抑制RNS,硬度和咀嚼性显著降低,而抑制ROS的同时促进或抑制RNS,硬度和咀嚼性显著增大;此外,结果也表明,高氧条件下抑制RNS,牦牛肉的硬度和咀嚼性显著降低,可有效改善肌肉嫩度。
2.6 肌原纤维蛋白微观结构
2.6.1 MFI
MFI与肉的嫩度显著相关,是反映肌原纤维内部结构完整性破坏程度的指标。由图6-a可知,成熟时间和不同处理对牦牛肉MFI具有显著影响(P<0.05)。随成熟时间的延长,各处理组MFI均显著增大(P<0.05),这可能是由于在整个成熟过程中牦牛肉骨架蛋白发生一定程度的降解[1]。此外,同一成熟时间(除0 h外),各处理组MFI由大到小依次为:ROS促进组+RNS抑制组>ROS促进组+RNS促进组>对照组1=对照组2>ROS抑制组+RNS促进组>ROS抑制组+RNS抑制组,说明H2O2处理显著增大了MFI,这可能由于H2O2处理后ROS含量增加,积累的ROS诱导细胞凋亡级联反应的发生,从而对肌原纤维蛋白进行降解,破坏了肌纤维的结构,导致MFI升高[1]。另外,该结果表明,与对照组相比,激活ROS的同时激活或抑制RNS使MFI显著增大,而抑制ROS的同时激活或抑制RNS使MFI显著降低;此外,结果还表明高氧条件下抑制RNS或低氧条件下激活RNS,MFI显著增大,利于肉的嫩化,这与张朝阳[19]的结果一致。此外,我们的结果也表明,同时激活ROS和RNS有利于宰后肌肉的嫩化,这可能与ROS和ROS分子结合生成更高氧化活性的过氧亚硝酸盐有关[29]。
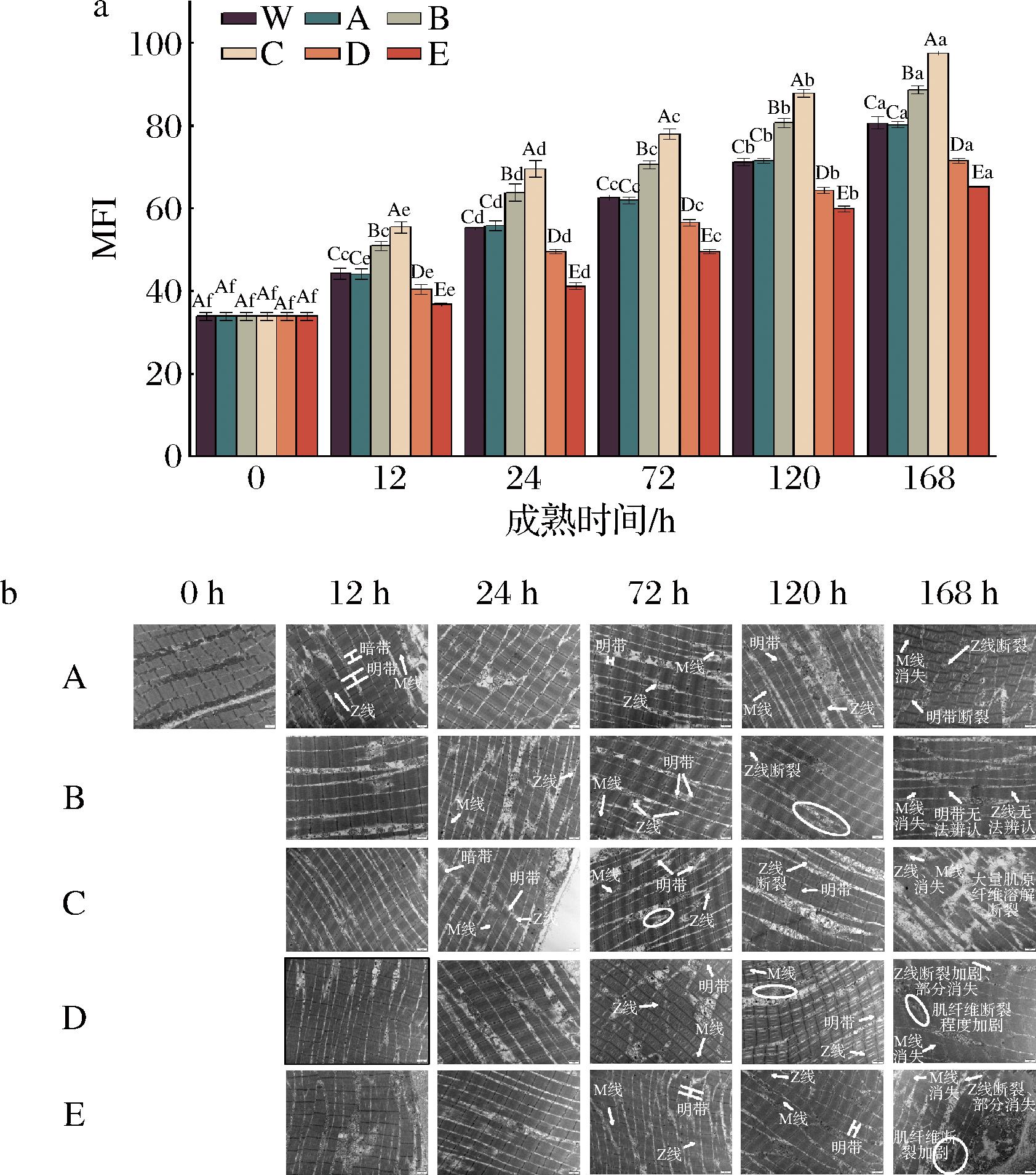
a-肌原纤维小片化指数;b-肌原纤维微观结构(×12 000)
图6 宰后RNS与ROS串扰对牦牛肉肌原纤维小片化指数和肌原纤维微观结构的影响
Fig.6 Effect of crosstalk between RNS and ROS on myogenic fiber miniaturization index and myogenic fiber protein histology of yak meat during postmortem
2.6.2 肌纤维微观结构的变化
不同处理组的牦牛肉样品的微观结构变化如图6-b所示。宰后0~12 h,牦牛肉肌纤维排列整齐有序,暗带(A带)、明带(I带)、Z线和M线均清晰可见;随着成熟的进行,肌原纤维的微观结构恶化,肌原纤维的正常排列被破坏。宰后24 h,ROS抑制组+RNS促进组/RNS抑制组的Z线和M线相对完整,I带和A带清晰可见;然而ROS促进组+RNS促进组/RNS抑制组的M线和Z线较对照组变得模糊。成熟72 h时,各处理组的Z 线扭曲、肌纤维出现明显的收缩带,其中,ROS促进组+RNS抑制组的某些区域的肌原纤维I带和Z线断裂程度明显加重,肌原纤维结构较对照组更差。成熟120 h时,ROS促进组+RNS促进组/RNS抑制组的Z线断裂,M线已无法辨认,A带和I带不易被发现,肌节间有缝隙。宰后的第168 h牦牛肉肌原纤维结构完全消失,Z 线断裂、崩解,M 线消失,且各处理组中均出现大量可见的肌原纤维碎片,且ROS促进组+RNS抑制组的肌原纤维结构的损伤程度明显重于对照组。这些结果表明,与对照组相比,激活ROS的同时促进或抑制RNS加速了肌纤维结构遭的破坏,而抑制ROS的同时激活或抑制RNS可减缓牛肉肌纤维的断裂程度,这可能是因为GSNO和L-NAME调控的NO通过影响氧化应激、肌原纤维的降解、细胞凋亡而在肌肉嫩化过程中发挥重要做用[16, 21]。另外,NO可能是通过调控ROS并参与细胞凋亡途径参与改善肉类嫩度[17,21]。此外,肌原纤维的弱化有助于提高肉类的嫩度[17]。因此,肌原纤维结构的变化部分原因可能是在牦牛肉成熟过程中由RNS引起的亚硝基化通过抑制蛋白氧化、降低肌原纤维的降解程度改善牛肉嫩度。
2.7 相关性和主成分分析
如图7-a所示,pH值与L*值、b*值、蒸煮损失和MFI呈显著负相关,相关性系数分别为-0.48、-0.56、-0.77和-0.77;蒸煮损失与L*值和b*值显著正相关,而与a*值呈负相关;剪切力与硬度呈正相关,与MFI呈负相关,相关系数分别为0.63和-0.30;硬度与弹性、回复性、黏聚性和咀嚼性呈正相关。
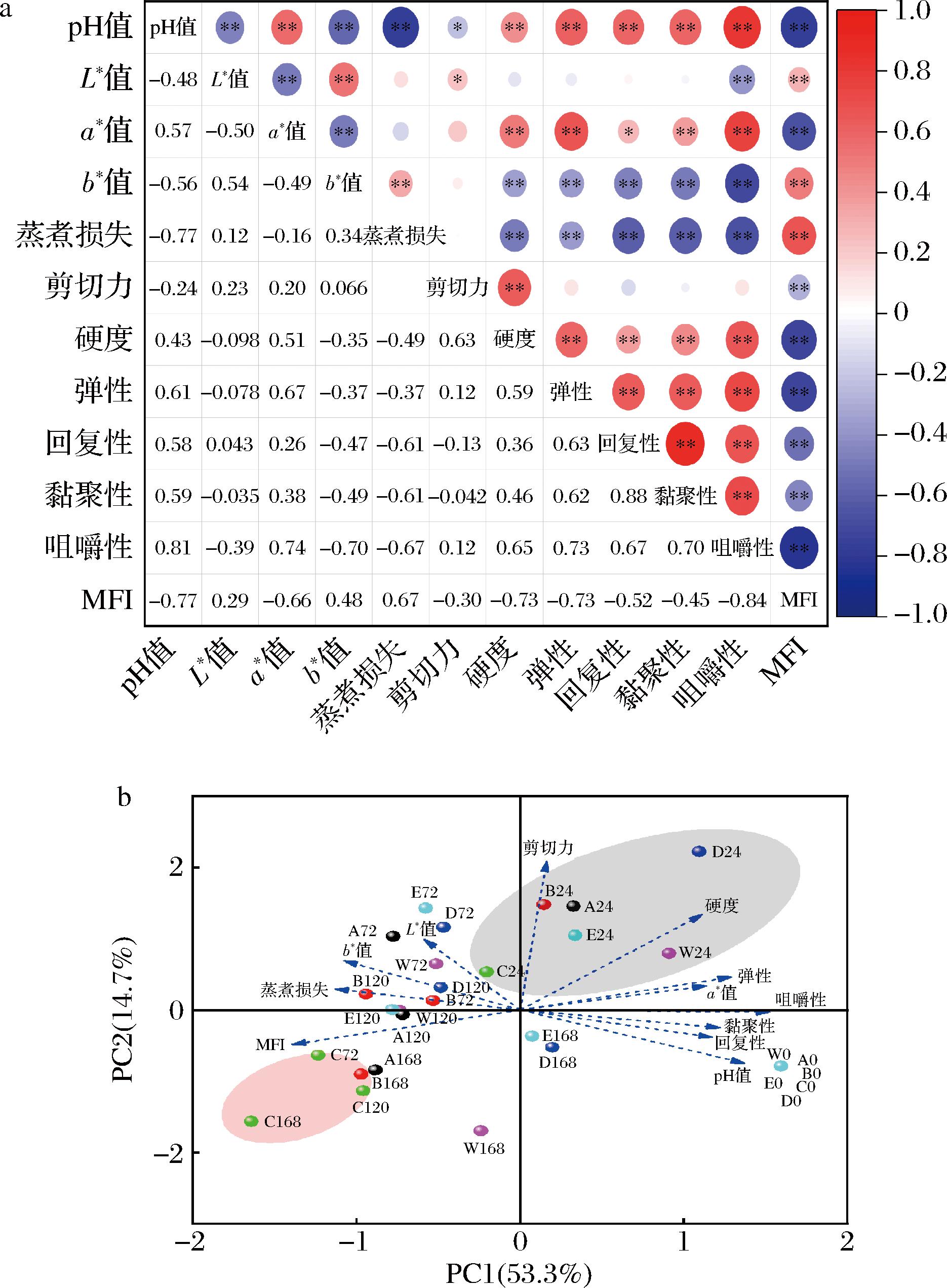
a-相关性;b-主成分分析
图7 宰后RNS与ROS串扰下牦牛肉食用品质间的相关性和主成分分析
Fig.7 Correlation and principal component analysis between the crosstalk of RNS and ROS on the edible quality of yak meat during postmortem
图7-b采用主成分分析方法对宰后成熟过程中RNS与ROS串扰作用下牦牛肉pH值、肉色、蒸煮损失、质构特性、MFI进行了区分,并研究他们在宰后成熟过程中的关系。前两个主成分(PC1和PC2)共解释了68%的变异,第一主成分解释了53.3%的方差贡献率,它可明确区分成熟0~24 h与72~120 h,且pH、剪切力、硬度、a*值、咀嚼性、黏聚性、回复性和弹性与成熟0~24 h呈正相关,而与L*值、b*值、蒸煮损失和MFI呈负相关。第二主成分PC2解释了14.7%的方差贡献率,它可作为成熟时间的区分因子,明确区分ROS促进组+RNS抑制组在成熟的第24 h和72~168 h,以及除ROS促进组+RNS抑制组外的其他组在成熟的第24~72 h与168 h时,时间对牦牛肉品质的影响。说明在成熟的24~72 h时,其他处理组中蒸煮损失、b*值、L*值的变化明显增加,而剪切力、硬度、弹性、a*值、黏聚性、回复性和pH值明显降低;而在成熟的72~168 h,MFI、回复性、黏聚性、pH值剪切力、硬度和弹性变化明显,且易受ROS促进组+RNS抑制组的影响,该结果与图1~图5、图6-a结果相一致。
3 结论
H2O2诱导ROS的增加可显著降低牦牛肌肉的剪切力、硬度和咀嚼性,增加肉样蒸煮损失和MFI,改善肌肉嫩度;宰后牦牛肉因促进ROS而引发蛋白氧化所形成的高氧条件中,抑制RNS也可降低牦牛肉的最终pH、L*值、a*值、蒸煮损失、硬度、咀嚼性和剪切力,而增加MFI,对肉的成熟嫩化具有一定的积极作用;此外,因抑制ROS诱发蛋白氧化的发生所形成的低氧条件中,GSNO引起的RNS诱导的蛋白质亚硝化,可增加牦牛肉pH值、a*值、蒸煮损失和MFI,而使剪切力降低,也可有效改善肉类嫩度。综上,宰后成熟过程中,抑制ROS诱导的蛋白氧化发生的同时激活或抑制蛋白质亚硝基化可阻碍肌肉的嫩化,而ROS诱导蛋白氧化发生的同时激活或抑制蛋白质亚硝基化程度可有效改善牦牛肉的嫩度。
[1] 王琳琳. Cyt-c释放和介导宰后牦牛肉线粒体凋亡途径激活机制及对嫩度影响的研究[D].兰州:甘肃农业大学, 2018.
WANG L L.Study on the effect of cytochrome c release and its mediation mechanism of mitochondrial apoptosis activation on yak meat tenderness during postmortem aging[D].Lanzhou:Gansu Agricultural University, 2018.
[2] WARNER R D, WHEELER T L, HA M, et al.Meat tenderness:Advances in biology, biochemistry, molecular mechanisms and new technologies[J].Meat Science, 2022, 185:108657.
[3] STAMLER J S, MEISSNER G.Physiology of nitric oxide in skeletal muscle[J].Physiological Reviews, 2001, 81(1):209-237.
[4] ZHANG C Y, LIU R, WANG A R, et al.Regulation of calpain-1 activity and protein proteolysis by protein nitrosylation in postmortem beef[J].Meat Science, 2018, 141:44-49.
[5] HOU Q, ZHANG C Y, ZHANG W G, et al.Role of protein S-nitrosylation in regulating beef tenderness[J].Food Chemistry, 2020, 306:125616.
[6] 刘维. 基于线粒体蛋白质组学研究牛肉贮藏变色机制[D].泰安:山东农业大学, 2017.
LIU W.Study on the mechanism of beef discoloration during storage based on mitochondrial protein omics[D].Tai’an:Shandong Agricultural University, 2017.
[7] 陈炼红, 王琳琳, 张岩, 等.氧化应激对宰后獭兔肉肌肉品质、脂质及蛋白质氧化的影响[J].食品与发酵工业, 2023, 49(1):207-213.
CHEN L H, WANG L L, ZHANG Y, et al.Effects of oxidative stress on meat quality, lipid oxidation, and protein oxidation of rex rabbit meat during post-mortem ageing[J].Food and Fermentation Industries, 2023, 49(1):207-213.
[8] 刘昊天, 殷小钰, 汪海棠, 等.基于蛋白氧化行为的肉及肉制品品质提升及劣变机制研究进展[J].食品科学, 2020, 41(21):230-237.
LIU H T, YIN X Y, WANG H T, et al.Quality improvement and deterioration of meat and meat products based on the protein oxidation:A review of recent research[J].Food Science, 2020, 41(21):230-237.
[9] ZHANG L L, LIU R, CHENG Y P, et al.Effects of protein S-nitrosylation on the glycogen metabolism in postmortem pork[J].Food Chemistry, 2019, 272:613-618.
[10] FU Q Q, LIU R, WANG H O, et al.Effects of oxidation in vitro on structures and functions of myofibrillar protein from beef muscles[J].Journal of Agricultural and Food Chemistry, 2019, 67(20):5866-5873.
[11] 傅卉. ROS介导的内源酶调控低温熟化虾夷扇贝品质机理研究[D].大连:大连工业大学, 2017.
FU H.Research on regulated Patinopecten yessoensis quality mechanism of ROS induced endogenous enzyme during low-temperature cooking[D].Dalian:Dalian University of Technology, 2017.
[12] SOLADOYE O P, JU REZ M L, AALHUS J L, et al.Protein oxidation in processed meat:Mechanisms and potential implications on human health[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2):106-122.
REZ M L, AALHUS J L, et al.Protein oxidation in processed meat:Mechanisms and potential implications on human health[J].Comprehensive Reviews in Food Science and Food Safety, 2015, 14(2):106-122.
[13] DELLES R M, XIONG Y L.The effect of protein oxidation on hydration and water-binding in pork packaged in an oxygen-enriched atmosphere[J].Meat Science, 2014, 97(2):181-188.
[14] 周竹. 反复苯丙胺刺激对大鼠脑部突触蛋白氧化修饰的影响[D].苏州:苏州大学, 2015.
ZHOU Z.Effect of repeated amphetamine stimulation on oxidative modification of synaptic proteins in rat brain[D].Suzhou:Soochow University, 2015.
[15] 王丹妮. 姜黄素及双去甲氧基姜黄素对溃疡性结肠炎的肠粘膜保护作用及机制研究[D].长春:吉林大学, 2020.
WANG D N.Protective effect and mechanism of curcumin and demethoxycurcumin on intestinal mucosa of ulcerative colitis[D].Changchun:Jilin University, 2020.
[16] LIU R, YANG L, YANG T Y, et al.Effect of nitric oxide treatment on pork meat quality, microstructure, and total bacterial count during postmortem aging[J].Meat Science, 2022, 190:108806.
[17] LIU R, ZHANG C Y, XING L J, et al.A bioinformatics study on characteristics, metabolic pathways, and cellular functions of the identified S-nitrosylated proteins in postmortem pork muscle[J].Food Chemistry, 2019, 274:407-414.
[18] 刘佳东. 宰后牦牛肉成熟机理及肉用品质变化研究[D].兰州:甘肃农业大学, 2011.
LIU J D.Research on Yak meat maturation mechanism and meat quality after slaughter[D].Lanzhou:Gansu Agricultural University, 2011.
[19] 张朝阳. 蛋白质亚硝基化对牛肉成熟过程中品质的影响研究[D].南京:南京农业大学, 2018.
ZHANG C Y.Effect of protein nitrosation on the quality of beef during ripening[D].Nanjing:Nanjing Agricultural University, 2018.
[20] HERRERO A M, DE LA HOZ L, ORD
 EZ J A, et al.Tensile properties of cooked meat sausages and their correlation with texture profile analysis (TPA) parameters and physico-chemical characteristics[J].Meat Science, 2008, 80(3):690-696.
EZ J A, et al.Tensile properties of cooked meat sausages and their correlation with texture profile analysis (TPA) parameters and physico-chemical characteristics[J].Meat Science, 2008, 80(3):690-696.
[21] WANG L L, DU R S, LI J, et al.The potential mediation of nitric oxide in the activation of mitochondrion-dependent apoptosis and yak meat tenderness during postmortem aging[J].Food Bioscience, 2021, 42:101131.
[22] DAI Y, LU Y, WU W, et al.Changes in oxidation, color and texture deteriorations during refrigerated storage of ohmically and water bath-cooked pork meat[J].Innovative Food Science &Emerging Technologies, 2014, 26:341-346.
[23] LIU R, ZHAO S M, XIONG S B, et al.Role of secondary structures in the gelation of porcine myosin at different pH values[J].Meat Science, 2008, 80(3):632-639.
[24] NAVEENA B M, MUTHUKUMAR M, KULKARNI V V, et al.Effect of aging on the physicochemical, textural, microbial and proteome changes in emu (Dromaius novaehollandiae) meat under different packaging conditions[J].Journal of Food Processing and Preservation, 2015, 39(6):2497-2506.
[25] CHEN L, ZHOU G H, ZHANG W G.Effects of high oxygen packaging on tenderness and water holding capacity of pork through protein oxidation[J].Food and Bioprocess Technology, 2015, 8(11):2287-2297.
[26] HUFF-LONERGAN E, LONERGAN S M.Mechanisms of water-holding capacity of meat:The role of postmortem biochemical and structural changes[J].Meat Science, 2005, 71(1):194-204.
[27] 杨巧能, 梁琪, 文鹏程, 等.宰后成熟时间对不同年龄牦牛肉用品质的影响[J].食品科学, 2015, 36(18):237-241.
YANG Q N, LIANG Q, WEN P C, et al.Influence of postmortem aging time on meat quality of yaks at different ages[J].Food Science, 2015, 36(18):237-241.
[28] RUIZ DE HUIDOBRO F, MIGUEL E, ONEGA E, et al.Changes in meat quality characteristics of bovine meat during the first 6 days post mortem[J].Meat Science, 2003, 65(4):1439-1446.
[29] TIEN M, BERLETT B S, LEVINE R L, et al.Peroxynitrite-mediated modification of proteins at physiological carbon dioxide concentration:pH dependence of carbonyl formation, tyrosine nitration, and methionine oxidation[J].Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(14):7809-7814.