魔芋(amorphophallus konjac)是天南星科魔芋属多年生宿茎草本植物,在我国有着广泛的种植,具有较高的经济价值和保健价值,魔芋块茎中含有丰富的葡甘聚糖。魔芋葡甘聚糖(konjac glucomannan,KGM)是由D-葡萄糖与D-甘露糖残基通过β-1,4糖苷键聚合而成的一种亲水性多糖,是魔芋的主要功能性成分,具有良好的吸水性、增稠性、成膜性、凝胶性等[1],进入人体后可以促进食物的消化和吸收,调节人体的新陈代谢。研究表明KGM具有减肥、降血压、降血脂、抗肿瘤等功效[2],目前已在食品、医学、生物学等方面具有广泛的应用。全球商品化的魔芋品种有花魔芋(A.rivieri)、白魔芋(A.albus)和珠芽魔芋(A.bulbifer)。白魔芋为我国特有的优质商品化品种,分布于金沙江干热河谷等地带[3],因KGM含量高、加工制品色泽亮白等优势而享有盛誉,具有较大的开发利用潜力。
魔芋的成熟具有季节性,新鲜魔芋除加工成魔芋豆腐外,还通常被加工成魔芋精粉[3]。干燥是魔芋精粉生产中的一个必要环节,近年来,热风干燥、真空冷冻干燥、微波干燥、红外干燥等干燥技术应用于魔芋干燥[4-6]。魔芋中含有大量多酚氧化酶等热敏性物质,在适当热和氧的条件下会发生严重的酶促褐变,使魔芋精粉的色泽等品质受到影响[7],同时在干燥过程中魔芋精粉中的KGM等物质会发生降解,因此不同的干燥方式可能会对样品的品质产生影响,选择合适的干燥条件极为重要。
自然干燥是魔芋干燥中较常见的干燥方式,操作简单、设备成本低,但其干燥效率较低、成品品质较差[8];毕振举等[5]、卫永华等[9]发现真空冷冻干燥可以最大程度保持魔芋精粉的品质,但其设备成本较高,干燥效率较低;热风干燥是常用的传统干燥方式,对温度控制要求较高,近年来热风分段干燥方式因其干燥效率高、成品品质好等优点引起了研究者的关注。DA SILVA等[10]在对甜瓜种子的干燥研究中发现与连续干燥相比,分段干燥可以提高保存的蛋白质和脂质的品质;效碧亮等[11]发现热风分段干燥可以缩短苹果片干燥时间并提高产品品质;ZHU等[12]发现采用前期高温、后期低温的热风分段干燥方式,可以显著提高烟草的干燥效率且减少烟草在干燥过程中受到的损害。而目前关于热风分段干燥应用于魔芋干燥的研究未见报道。
基于此,本研究以新鲜白魔芋为原料,探讨自然干燥、真空冷冻干燥、热风干燥(低温干燥、高温干燥、分段干燥)5种不同的干燥条件对白魔芋精粉色泽、KGM含量、乙酰基含量、流变学性质等的影响,并通过分子质量、傅里叶变换红外光谱(Fourier transform infrared,FTIR)、X射线衍射(X-ray diffraction, XRD)以及扫描电子显微镜(scanning electron microscope, SEM)等进行结构表征,旨在提高白魔芋的应用,为优化魔芋干燥工艺提供理论依据与数据支撑。
1 材料与方法
1.1 材料与试剂
原料:白魔芋,重庆石柱魔芋试验示范实践基地。
试剂:乙醇、盐酸、NaOH,成都市科隆化学品有限公司;葡萄糖(分析纯),重庆市钛新化工有限公司;DNS试剂,北京雷根生物技术有限公司。
1.2 仪器与设备
DHG-9070A电热鼓风干燥箱,上海一恒科学仪器有限公司;SCIENTZ-10 ND型真空冷冻干燥机,宁波新芝生物科技股份有限公司;FW100高速万能粉碎机,北京科伟永兴仪器有限公司;FA1004A电子分析天平,上海精天电子仪器有限公司;HZ-ZK8型数显恒温水浴锅,巩义市予华仪器有限责任公司;WR-18精密手持测色仪,深圳市威福光电科技有限公司;SF-756P紫外可见分光光度计,上海光谱仪器有限公司;HR-1型TA旋转流变仪,美国TA公司;LC-20A多角度激光光散射仪-凝胶渗透色谱联用仪,日本岛津有限公司;Spectrum 100傅里叶红外光谱仪,美国Perkin Elmer公司;X’Pert3 Powder型X射线衍射仪,荷兰帕纳特有限公司;BX43生物显微镜,日本OLYMPUS公司;Phenom Pro型扫描电镜,荷兰Phenom World公司。
1.3 实验方法
1.3.1 样品干燥
新鲜白魔芋洗净削皮,切成均匀的5 cm×5 cm×0.5 cm大小的片状,随机分成6组,每组10个重复样品,1组用于新鲜样品测试,其他5组用于干燥,各组干燥条件参数如下。
1.3.1.1 自然干燥
将新鲜魔芋片平铺在不锈钢晾晒网上,置于实验室通风干燥处自然干燥,每隔0.5 h翻一次面,干燥至魔芋片含水量为10%左右。
1.3.1.2 真空冷冻干燥
将新鲜魔芋片于-40 ℃冰箱预冻24 h,预冻好的样品平铺在不锈钢盘,放入预热好的真空冷冻干燥机,设置真空度为50 Pa,冷阱温度为-40 ℃,干燥至魔芋片含水量为10%左右。
1.3.1.3 热风干燥
将新鲜魔芋片平铺在不锈钢铺晒网上,设定风速2 m/s,分别进行低温干燥(60 ℃)、高温干燥(100 ℃)、分段干燥(100 ℃干燥至样品含水量为50%后转移至60 ℃干燥),干燥至魔芋片含水量为10%左右。
取不同干燥条件的魔芋片在恒温干燥箱里于105 ℃干燥4 h[13],测定干燥样品的终含水量,重复3次测定,结果如表1所示,各样品均符合GB/T 18104—2000《魔芋精粉》中的规定(魔芋精粉水分含量≤13%),可以进行后续测试。
表1 不同干燥条件下样品的水分含量 单位:%
Table 1 moisture content of samples under different drying methods
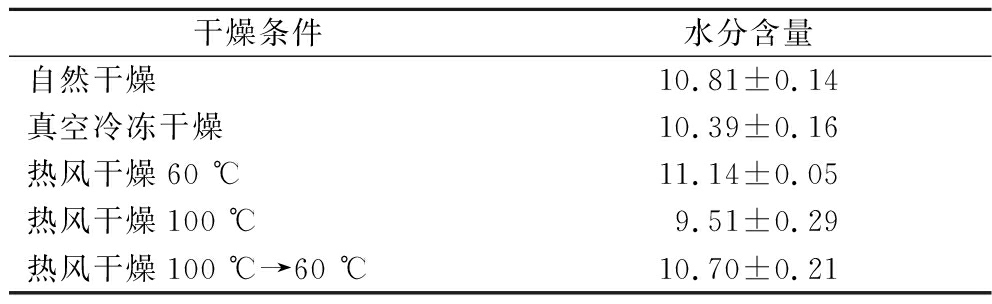
干燥条件水分含量自然干燥10.81±0.14真空冷冻干燥10.39±0.16热风干燥60 ℃11.14±0.05热风干燥100 ℃9.51±0.29热风干燥100 ℃→60 ℃10.70±0.21
1.3.2 指标检测
将不同干燥条件的魔芋片粉碎过筛,选择40目~120目的样品,为待测魔芋精粉。
1.3.2.1 色泽测定
将不同干燥条件得到的魔芋精粉分装在底部直径为3 cm的圆底塑料盒,样品高度为0.5 cm,用色度仪测量样品的色泽,记录各样品的L*值、a*值、b*值[5]。
1.3.2.2 KGM含量测定
准确称量一定量不同干燥条件制得的魔芋精粉,用乙醇沉淀法提取样品中的魔芋葡甘聚糖[6],按GB/T 18104—2000《魔芋精粉》附录A进行KGM含量的测定。
1.3.2.3 乙酰基含量测定
准确称取2.000 0 g不同干燥条件的魔芋精粉于100 mL锥形瓶中,加入40 mL体积分数75%乙醇,在40 ℃的恒温振荡器内以150 r/min振摇30 min,样品充分溶胀后加入5 mL 0.5 mol/L NaOH溶液,在40 ℃继续振摇皂化24 h,用0.1 mol/L HCl溶液中和滴定过量的碱,以酚酞为指示剂,样品的乙酰基含量按公式(1)计算[14]:
乙酰基含量![]()
(1)
式中:V1,空白对照组消耗的HCl体积,mL;V2,样品组消耗的HCl体积,mL;N,HCl的摩尔浓度,mol/L;M,摩尔指数,43 g/mol;m,样品质量,g。
1.3.2.4 分子质量测定
通过多角度激光光散射仪-凝胶渗透色谱联用仪测量样品的分子质量,0.80 mg/mL样品溶液通过0.22 μm的水系滤膜后用于测试,色谱柱为OHpak SB-804HQ柱,进样量20 μL,流动相为0.9% NaCl溶液,流速1.0 mL/min,柱温35 ℃,示差检测器RI[15]。
1.3.2.5 FT-IR测定
将适量不同干燥条件的魔芋精粉放入傅里叶红外光谱测定仪圆盘压片测量,扫描光谱范围4 000~600 cm-1,分辨率0.4 cm-1,扫描次数64[16],记录样品的红外光谱。
1.3.2.6 XRD测定
将适量不同干燥条件的魔芋精粉放入载玻片上压片后放入X射线衍射仪测试,扫描范围5°~60°(2θ),扫描速度5 °/min[17],记录样品的衍射光谱。
1.3.2.7 光学显微镜观察
使用光学显微镜对各样品的大小分布及形态结构进行观察,将适量的样品粉末固定在载玻片上,用显微镜观察,选择有代表性的区域进行拍摄,拍摄倍数为100×。
1.3.2.8 SEM分析
使用SEM对各样品的微观结构进行观察,将适量的魔芋精粉固定在样品铜台上,在真空度1.0×10-3 Pa,溅射电压1.2 kV条件下镀金5 min,镀金后的样品送入电镜观察,选择有代表性的区域进行拍摄,拍摄倍数为500×[6]。
1.3.2.9 流变学性质测定
将质量分数1.0%的魔芋精粉加入60 ℃的去离子水中,200 r/min搅拌60 min至KGM完全溶胀,自然冷却至室温(约25 ℃)后放至4 ℃的冰箱冷藏24 h,待测。
稳态剪切流变:测试模具为40 mm的平行板,测试间隙1.0 mm,测试温度25 ℃,测试前平衡时间120 s,选择流动扫描模式,剪切速率范围0.1~100 s-1,对数取点[18],测定各样品表观黏度和剪切应力随剪切速率变化的情况。
频率扫描:测试模具为40 mm的平行板,测试间隙1.0 mm,测试温度25 ℃,测试前平衡时间120 s,形变量γ 2%,在振荡模式下进行频率扫描,扫描范围0.1~10 Hz[19],测定样品的储能模量(G′)、损耗模量(G″)和损耗正切值(tanδ)随频率的变化。
1.3.3 数据处理
所有实验进行3次平行,实验结果表示为平均值±标准差的形式,采用SPSS 23.0进行数据处理与分析,采用Origin 2021进行图形绘制。
2 结果与分析
2.1 不同干燥条件对魔芋精粉色泽的影响
魔芋精粉的色泽是评判其品质的重要指标之一,GB/T 18104—2000《魔芋精粉》中明确指出,特级魔芋粉颜色亮白,允许存在极少量其他颜色的颗粒,随着品质的逐渐降低,魔芋粉中非白色颗粒增多[15]。不同干燥条件对魔芋精粉色泽的影响如图1所示,采用Lab法表示结果,其中L*值代表白度,L*值越大白度越大,a*值为红绿值,a+表示偏红,其值越大表示越红,b*值为黄蓝值,b+表示偏黄,其值越大代表越黄。可以看出真空冷冻干燥样品的白度值最大,为88.44,显著高于其他样品(P<0.05),其次为热风分段干燥的样品,白度值为82.05,热风高温干燥的样品a*值和b*值都显著高于其他样品(P<0.05),色泽偏向焦黄。产生以上现象的原因是在真空冷冻的条件下酶的生物反应难以进行,抑制了酶促褐变的发生[5],所得样品与未干燥的新鲜魔芋色泽接近;高温可以使多酚氧化酶失活,在一定程度上抑制酶促褐变,但持续的高温会使样品呈现出烤焦的黄色[4],因此采用先高温灭酶后降低干燥温度的分段干燥方式既可以抑制酶促反应又能避免过度烘烤出现的焦黄色。

a-L*值;b-a*值;c-b*值;d-样品照片
图1 不同干燥条件对魔芋精粉色泽的影响
Fig.1 Effect of different drying methods on the color of konjac flour
2.2 不同干燥条件对魔芋精粉KGM含量的影响
KGM含量是评价魔芋精粉品质好坏的重要指标,GB/T 18104—2000《魔芋精粉》中明确指出,魔芋精粉的KGM含量需≥50%,其中特级魔芋粉的KGM含量≥80%。不同干燥条件对魔芋精粉KGM含量的影响如图2所示,可以看出真空冷冻干燥的样品KGM含量为81.82%,显著高于其他样品(P<0.05),满足特级魔芋粉的KGM含量要求,这是因为真空冷冻干燥的环境抑制了大部分微生物和酶的生物反应的进行,KGM无法被氧化,糖类物质损失较少[5],提高了KGM的留存率。热风高温、分段干燥所得样品KGM含量仅次于真空冷冻干燥,分别为63.20%、64.63%,自然干燥的样品KGM含量最低,为51.33%,与毕振举等[5]在对不同干燥条件下富硒魔芋的KGM含量研究中发现规律一致,产生以上现象的原因是高温条件降低了KGM的氧化程度,缩短了干燥时间[20],能在一定程度上提高KGM的含量。
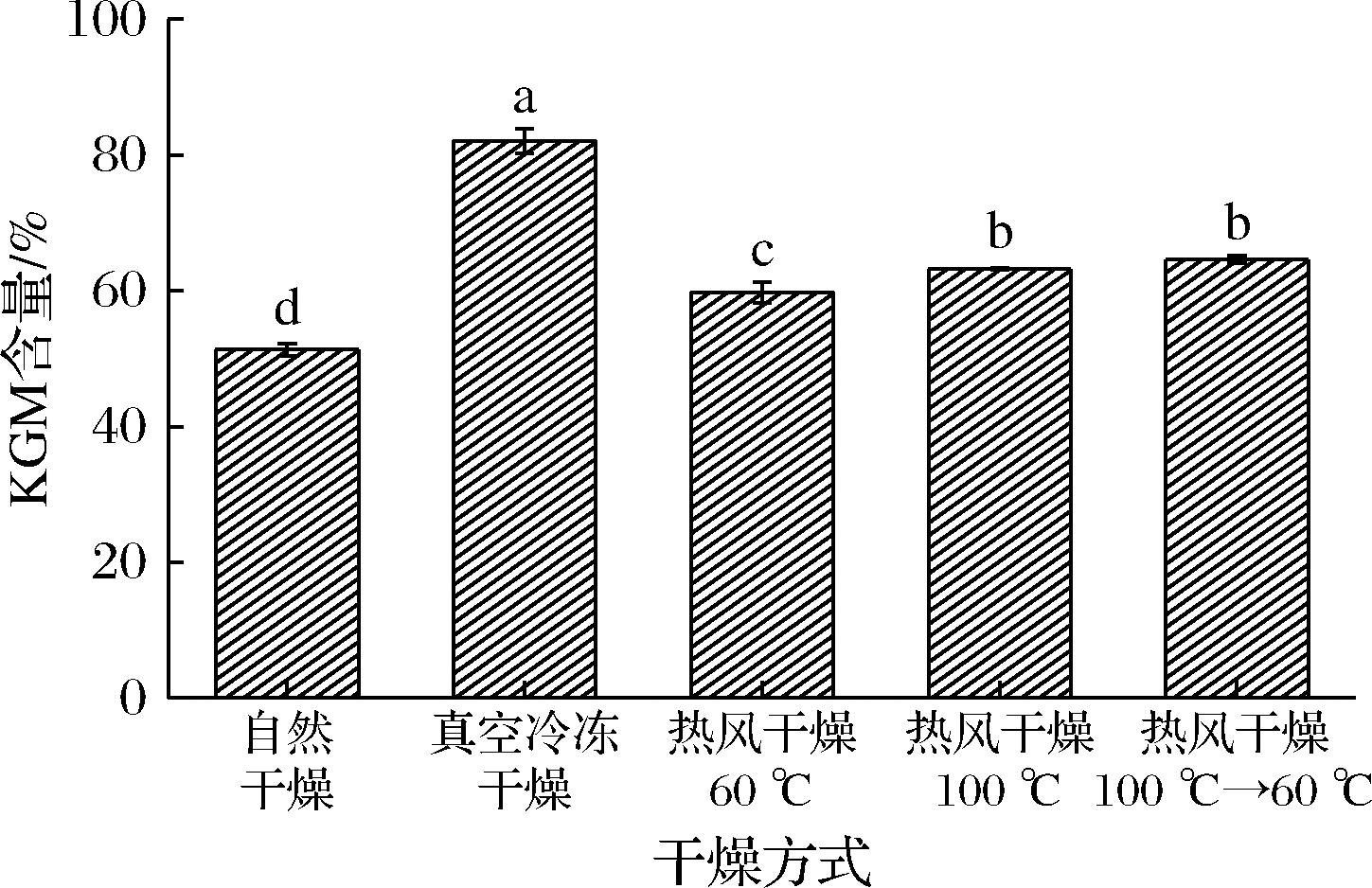
图2 不同干燥条件对魔芋精粉KGM含量的影响
Fig.2 Effect of different drying methods on KGM content of konjac flour
2.3 不同干燥条件对魔芋精粉乙酰基含量的影响
乙酰基是分布在KGM糖残基支链上的结构,与魔芋精粉的溶胀行为和凝胶特性息息相关,其存在会使KGM分子间的空间位阻较大,阻碍分子间网络结构的形成[21],因而低的乙酰基含量有助于KGM形成良好的凝胶特性。不同干燥条件对魔芋精粉乙酰基含量的影响如图3所示,可以看出真空冷冻干燥的样品乙酰基含量最低,为22.68%,这是因为在真空冷冻干燥的条件下,KGM内的水分直接从细胞内部升华,对KGM结构的破坏更加彻底[9],促进了乙酰基从KGM支链的脱离;自然干燥条件下乙酰基含量最高,为27.20%,在热风干燥条件下,乙酰基的含量排序为低温干燥>高温干燥>分段干燥,产生以上现象的原因可能是因为高温的热处理促进了分子间的热运动,增加乙酰基的脱除率[14]。
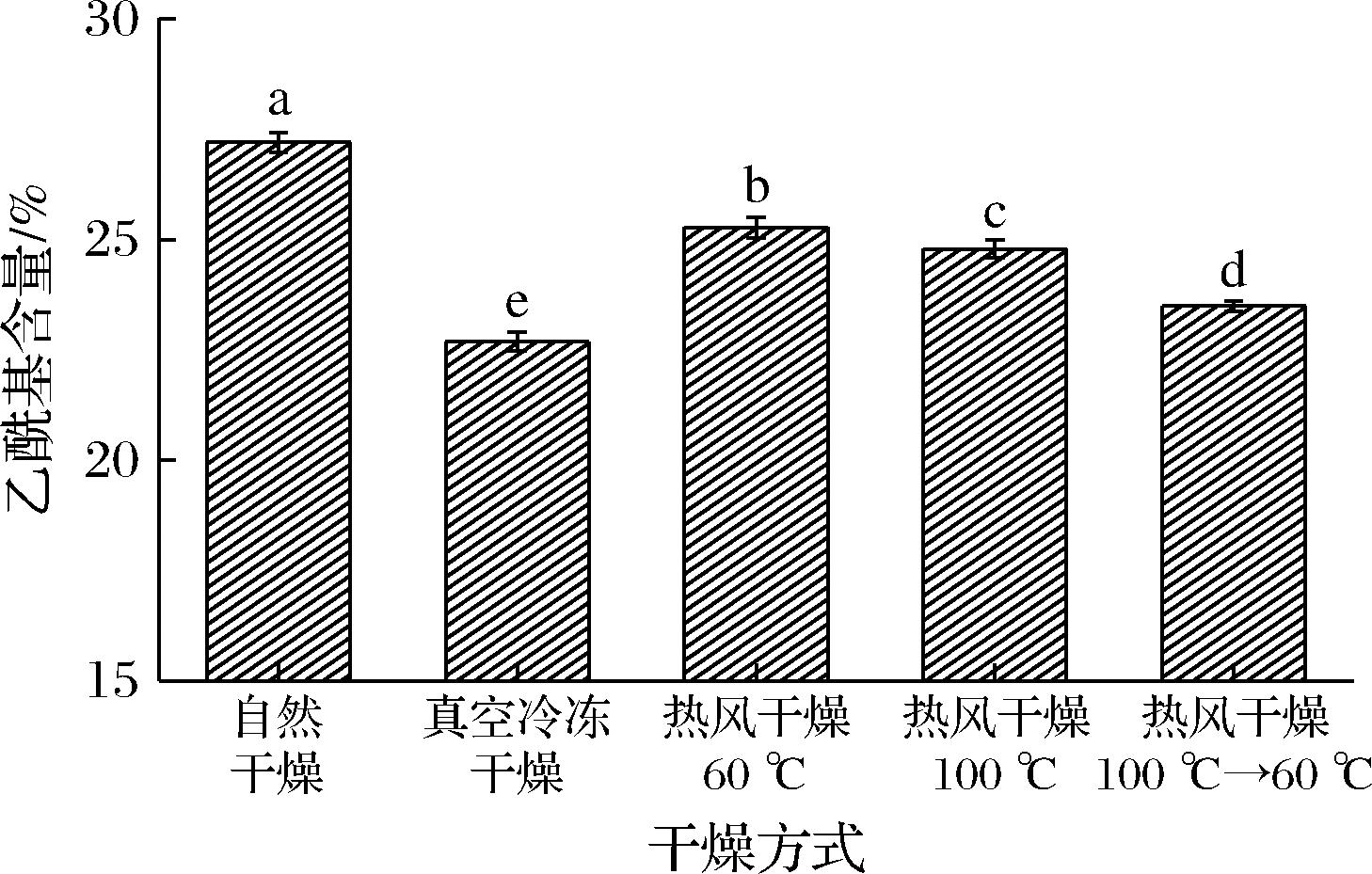
图3 不同干燥条件对魔芋精粉乙酰基含量的影响
Fig.3 Effect of different drying methods on acetyl content of konjac flour
2.4 不同干燥条件对魔芋精粉分子质量的影响
多糖的分子质量是表征其功能特性和生理活性的一个极为重要的指标,由于来源和提取方式不同,KGM的分子质量一般在200~2 000 kDa之间[22],重均分子质量(Mw)为在单位重量上平均得到的分子质量,D为重均分子质量(MW)与数均分子质量(Mn)的比值,其值越接近于1,说明样品中分子质量分布越集中[6]。从表2可以看出所有样品的D值都接近于1,即KGM分子质量分布较均匀集中。不同干燥条件所得的KGM分子质量有所差异,说明KGM的结构变化情况不同。自然干燥和热风低温的样品分子质量较小,这是因为在室温、热风低温干燥条件下,长时间的水分及合适的温度条件促进了KGM的湿热降解[23],真空冷冻干燥也会使多糖发生降解,但其降解的程度低于室温和热风低温的湿热降解;热风高温干燥与分段干燥的样品分子质量>1 000 kDa,显著高于其他样品的分子质量,说明此时KGM降解率相对较低,这是因为高温可以使水分快速丧失,减少了湿热降解的发生,同时持续的高温处理会促进分子的热运动,所以采用先高温使水分快速散失后低温干燥的方式获取的魔芋精粉KGM分子质量最高。
表2 不同干燥条件对魔芋精粉分子质量的影响
Table 2 Effect of different drying methods on molecular weight of konjac flour
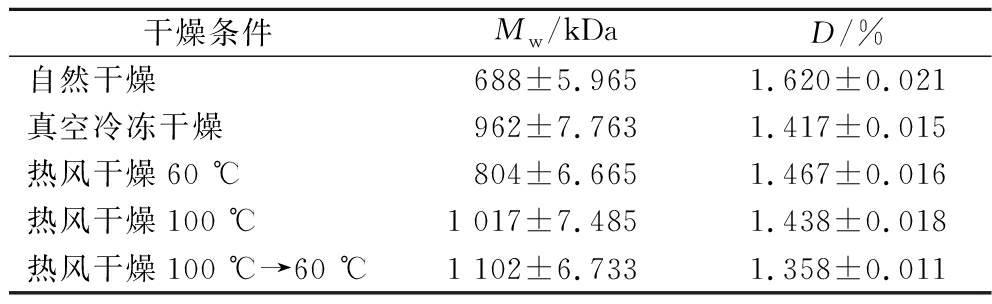
干燥条件Mw/kDaD/%自然干燥688±5.9651.620±0.021真空冷冻干燥962±7.7631.417±0.015热风干燥60 ℃804±6.6651.467±0.016热风干燥100 ℃1 017±7.4851.438±0.018热风干燥100 ℃→60 ℃1 102±6.7331.358±0.011
2.5 FT-IR结果分析
通过红外光谱特征吸收峰的形状、位置和数目可以分析不同样品的分子结构变化,不同干燥条件得到的魔芋精粉红外扫描图谱如图4所示,所有样品的吸收峰形状大致相同,与唐兰兰等[6]观察到的魔芋精粉红外光谱图类似。以自然干燥样品为例,3 283 cm-1附近出现的宽峰为葡甘聚糖的羟基伸缩振动峰,2 927 cm-1附近为—CH2的C—H伸缩振动峰,1 732 cm-1是乙酰基羰基C![]() O伸缩振动的吸收带,反映了乙酰基的存在[16],1 636 cm-1附近出现的峰为分子内氢键的吸收峰,1 399 cm-1为C—H弯曲振动,1 014 cm-1左右吸收峰是β-D-吡喃糖C—H的变角振动峰,表明分子中含有β-D-吡喃糖环,863 cm-1处的特征吸收峰表明该多糖为β-构型,807 cm-1附近的吸收峰为β-甘露糖苷键的特征吸收峰[24]。与自然干燥样品相比,其他样品的β-甘露糖苷键吸收峰透射率降低,乙酰基特征吸收峰透射率增高,即β-甘露糖苷键数量增多,乙酰基含量减少,且变化的程度为真空冷冻干燥>热风分段干燥>热风高温干燥>热风低温干燥,与2.2节、2.3节中干燥条件对KGM、乙酰含量的影响研究结果一致。
O伸缩振动的吸收带,反映了乙酰基的存在[16],1 636 cm-1附近出现的峰为分子内氢键的吸收峰,1 399 cm-1为C—H弯曲振动,1 014 cm-1左右吸收峰是β-D-吡喃糖C—H的变角振动峰,表明分子中含有β-D-吡喃糖环,863 cm-1处的特征吸收峰表明该多糖为β-构型,807 cm-1附近的吸收峰为β-甘露糖苷键的特征吸收峰[24]。与自然干燥样品相比,其他样品的β-甘露糖苷键吸收峰透射率降低,乙酰基特征吸收峰透射率增高,即β-甘露糖苷键数量增多,乙酰基含量减少,且变化的程度为真空冷冻干燥>热风分段干燥>热风高温干燥>热风低温干燥,与2.2节、2.3节中干燥条件对KGM、乙酰含量的影响研究结果一致。
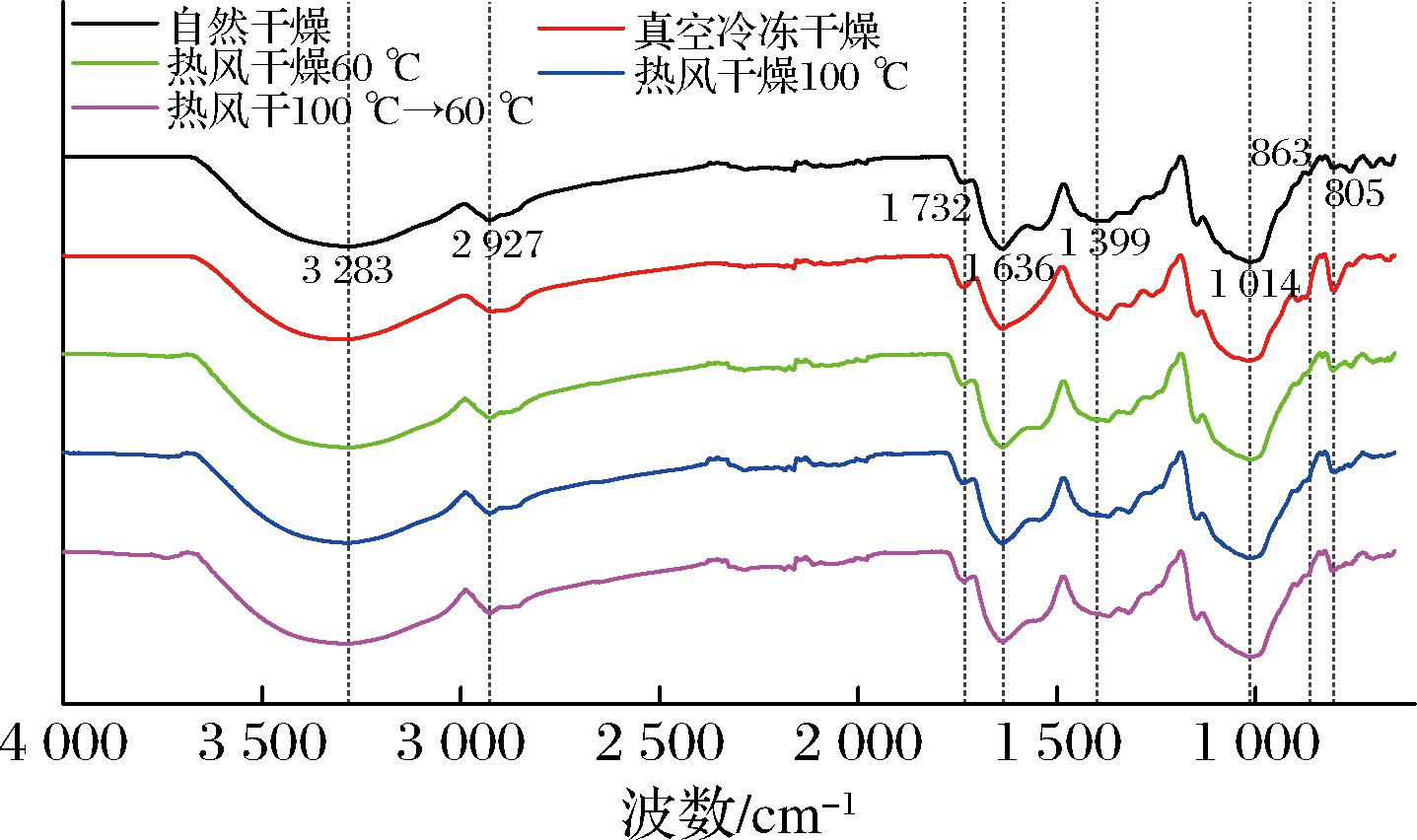
图4 不同干燥条件的魔芋精粉红外光谱图
Fig.4 Infrared spectrum of konjac powder with different drying methods
2.6 XRD结果分析
XRD经常用于表征样品的晶体/非晶结构、晶格参数等结构特征,具有制样简单、对样品无破坏性等优点[17],不同条件干燥的魔芋精粉XRD图如图5所示,在2θ=20°左右观察到了一个宽的弥散峰,说明KGM呈现无定形状态,与LI等[24]报道的结果一致,这是因为天然KGM中含有大量的无定形区域,少量的结晶区隐藏在无定形区域内,整体上呈现出一种无定形状态。可以看出热风高温与分段干燥的样品弥散峰明显变窄且分段干燥的样品更窄,说明与其他干燥条件相比,热风高温和分段干燥的样品结晶度增加,分子结构更加有序[17]。同时观察到自然干燥和热风干燥的样品在2θ=15°时观察到了一个小的结晶峰,而真空冷冻干燥的样品未出现,猜测可能是由于在真空冷冻干燥时水分从分子内部升华,对细胞破坏程度大,而自然和热风干燥水分是从表面汽化,水分散失的形式不同而对结构造成了差异。
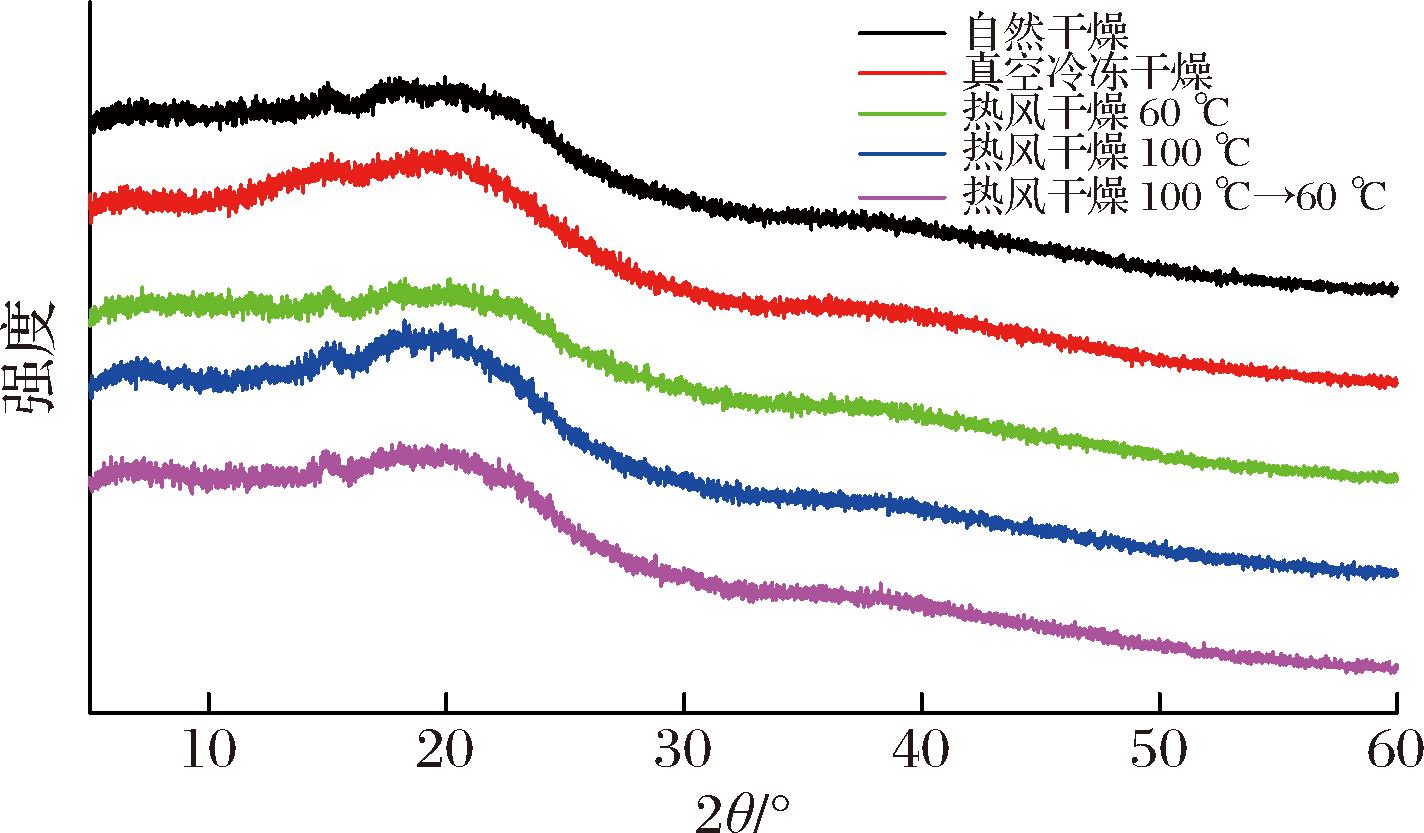
图5 不同干燥条件的魔芋精粉XRD图
Fig.5 XRD pattern of konjac powder with different drying methods
2.7 不同干燥条件的魔芋精粉光学显微镜观测图
通过光学显微镜可以看出粉末样品的大小形貌和分布状态,各样品的光学显微镜观测图如图6所示,可以看出粉碎后的魔芋精粉组织结构完整,颗粒大致呈扁平的椭圆状,与杨晓仪等[25]观察到的魔芋精粉形貌类似。不同条件干燥的魔芋精粉形貌与分布状态有所差异,真空冷冻干燥(图6-b)和热风干燥(图6-c~图6-e)得到的样品颗粒分布均匀,而自然干燥(图6-a)得到的样品分布的均匀性差,有较多的小颗粒分子,可能为未去除的淀粉颗粒,产生以上现象的原因可能是热风干燥是在密闭环境中的风力条件下,以及真空冷冻干燥得到的脆性样品有助于淀粉颗粒和魔芋精粉的分离,而自然干燥条件下淀粉颗粒易被魔芋精粉包裹,通过筛分难以去除。
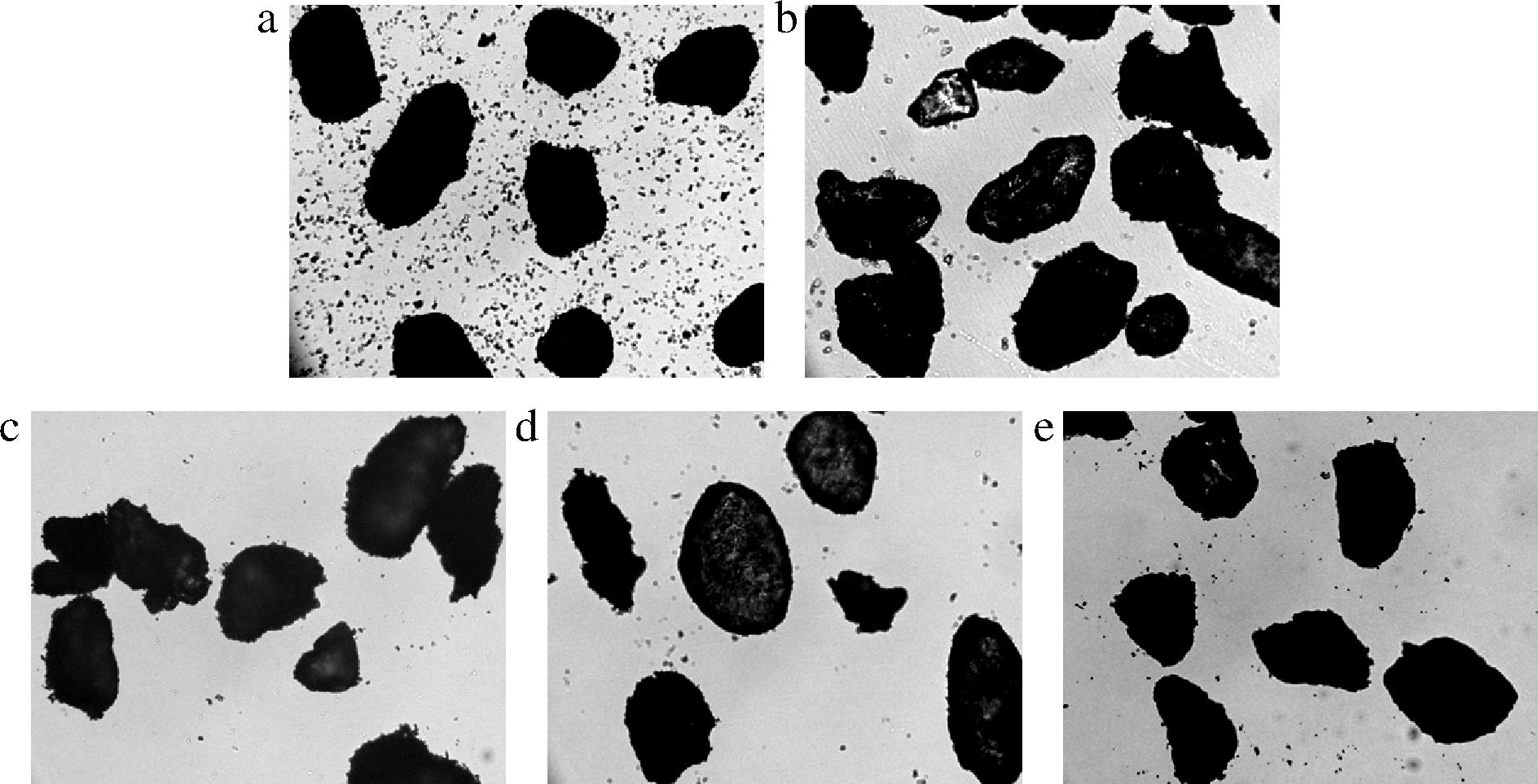
a-自然干燥;b-真空冷冻干燥;c-热风干燥60 ℃;d-热风干燥100 ℃;e-热风干燥100 ℃→60 ℃
图6 不同干燥条件的魔芋精粉光学显微镜观测图
Fig.6 Optical microscope observation of konjac powder with different drying methods
2.8 不同干燥条件的魔芋精粉SEM观测图
SEM可以直观地观察到魔芋精粉的表观形态,由图7可以看出KGM分子为规则的椭圆状,不同干燥条件下的魔芋精粉表面形态有所差异。真空冷冻干燥(图7-b)的样品表面破损最严重且表面观察到孔状结构,是因为真空冷冻干燥时,细胞内部的水分发生升华,气体冲出细胞,从而形成微孔[9],同时干燥的样品为脆性,在粉碎时较易受到破坏。自然干燥(图7-a)和热风的低温干燥(图7-c)粉末样品表面呈粗糙状,而高温(图7-d)和分段干燥(图7-e)的样品表面光滑有序且分段干燥样品光滑有序度更高,这是因为自然干燥与热风干燥时,水分主要在魔芋精粉颗粒表面汽化,同时在魔芋的烘干过程中,KGM分子发生湿热降解,在室温、低温条件下湿热降解程度高,分子被破坏程度增加,而在高温条件下虽然湿热降解程度降低,但是持续的高温烘烤会加剧分子间的热运动[14],也会造成分子结构的破坏,因此先高温灭酶使水分快速挥发后再降低干燥温度的分段干燥模式得到的魔芋精粉表面较为光滑有序,受损程度较低。
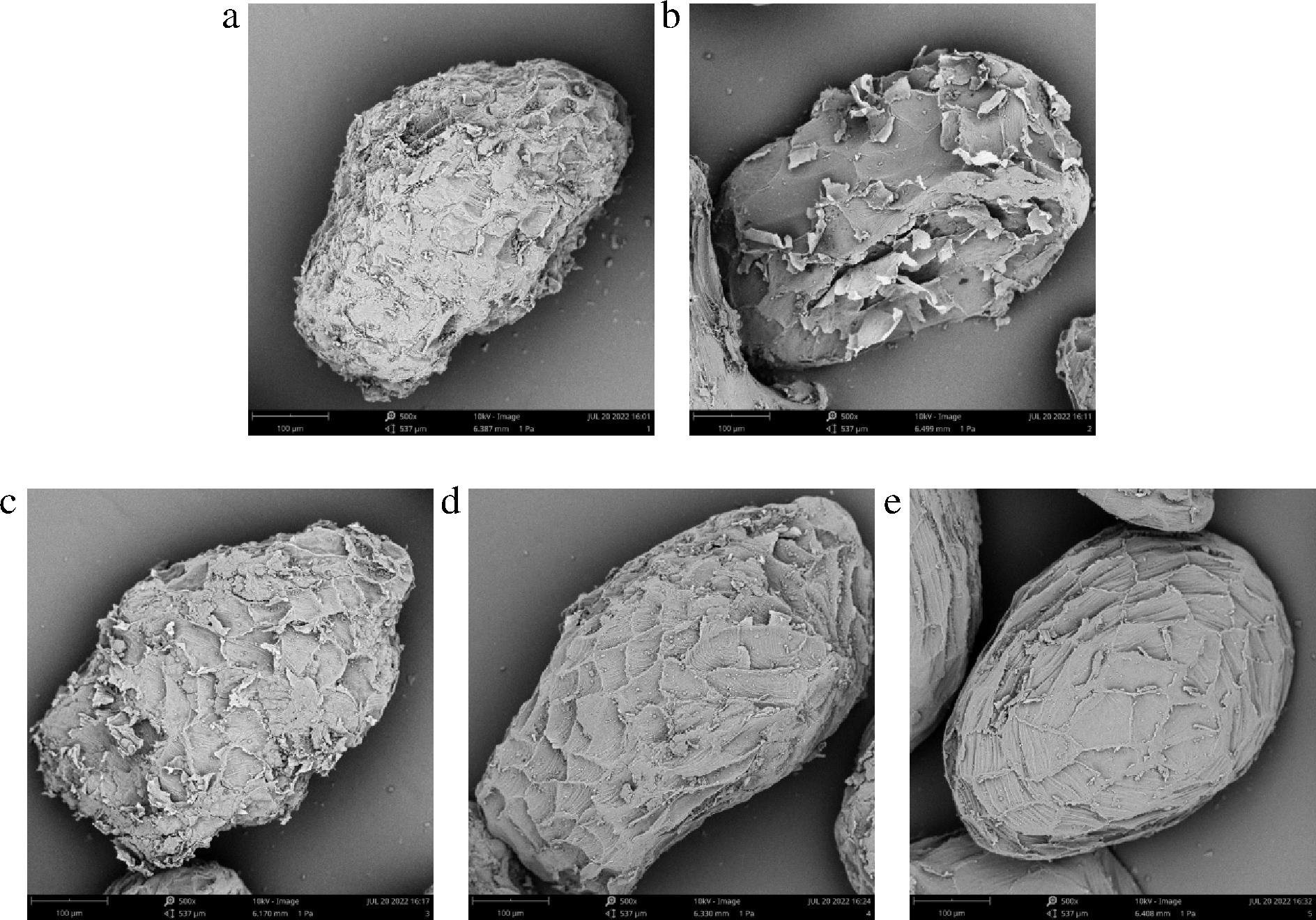
a-自然干燥;b-真空冷冻干燥;c-热风干燥60 ℃;d-热风干燥100 ℃;e-热风干燥100 ℃→60 ℃
图7 不同干燥条件的魔芋精粉SEM观测图(500×)
Fig.7 SEM observation of konjac powder with different drying methods(500×)
2.9 不同干燥条件对魔芋精粉流变性质的影响
2.9.1 稳态剪切流变
稳态流变特性可以反映样品的表观黏度,从图8可知,随着剪切速率的增大,样品的黏度逐渐减小,说明KGM水溶胶属于典型的假塑性流体,呈现出剪切稀化的特性,这主要是由于随着剪切速率的增加,体系中高分子链结构被破坏,以及剪切过程中分子链在流动方向上的定向取向而导致的[18]。不同条件干燥的魔芋精粉制得的KGM水溶胶黏度有所差异,主要与干燥过程中魔芋精粉的分子结构变化有关。一般来说,魔芋精粉水溶胶黏度与KGM的分子质量呈正相关[6],KGM分子质量越高,其黏度越高;但由于真空冷冻干燥的魔芋精粉中KGM含量显著高于其他样品(P<0.05),且魔芋精粉表面和内部有大量的孔隙,颗粒吸水速度快,KGM溶胀速度快[9],所以真空冷冻干燥样品的水溶胶黏度显著高于其他样品。对自然干燥和热风干燥的样品来说,干燥过程中KGM的降解率及分子质量的差异导致了4组样品黏度大小的变化,其规律与2.4节中不同干燥条件对魔芋精粉分子质量影响的规律相一致。
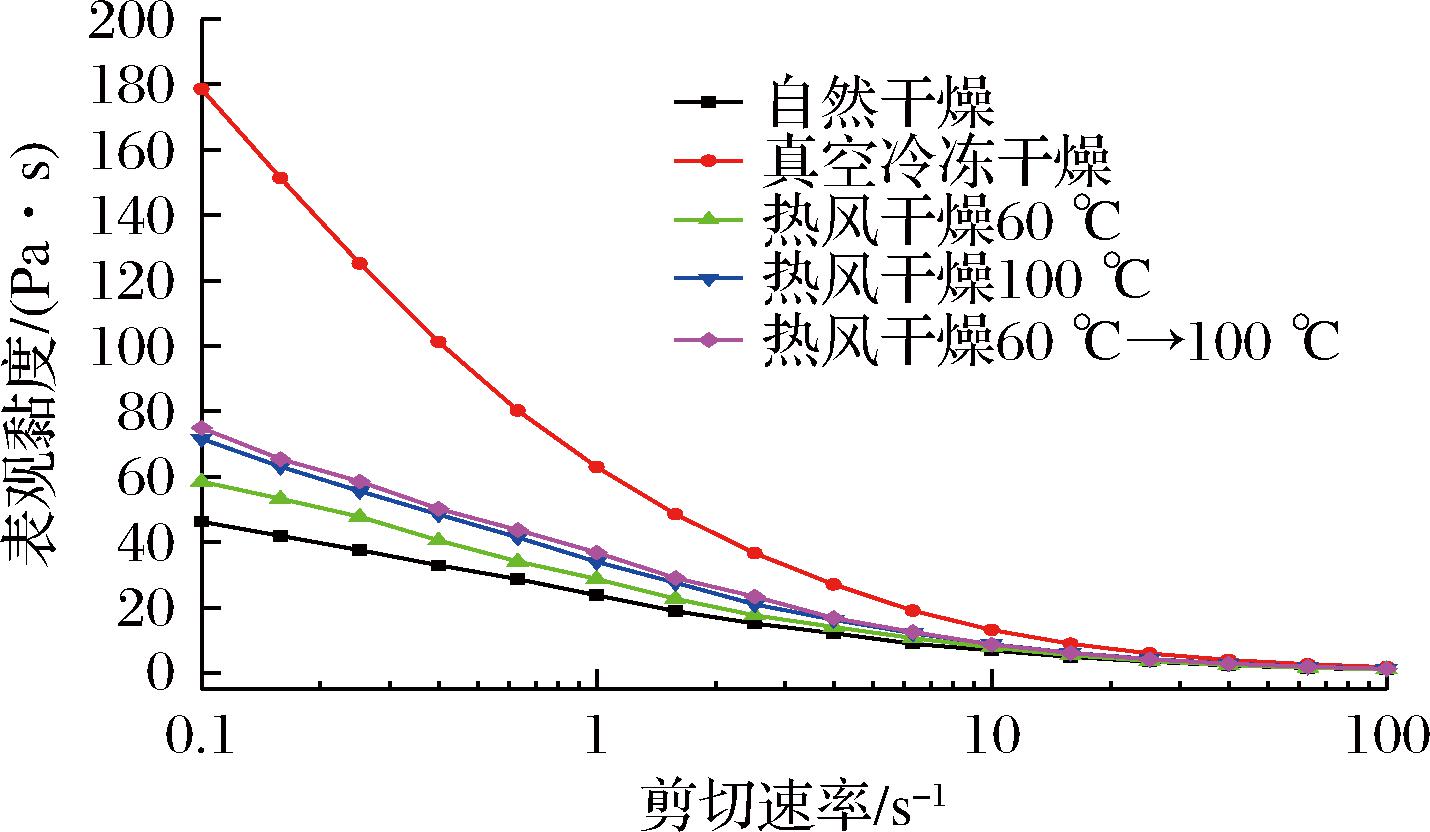
图8 不同干燥条件对魔芋精粉表观黏度的影响
Fig.8 Effect of different drying methods on apparent viscosity of konjac flour
2.9.2 频率扫描
频率扫描可以反映样品的动态黏弹性,对不同条件干燥的魔芋精粉制备的水溶胶进行频率扫描,结果如图9所示。G′为储能模量,代表储存在复合体系中的能量,反映体系弹性大小,G″为损耗模量,代表体系由于不可逆黏性形变损耗的能量大小,反映体系黏性大小[19],tanδ是G″与G′的比值,为损耗正切值,其值越大表示体系的内摩擦力越大,tanδ<1表示样品弹性占主导地位,tanδ>1表示黏性占主导地位。在测定频率范围内,不同干燥条件的KGM水溶胶的G′(图9-a)和G″(图9-b)都随着振荡频率的增大逐渐上升,相同频率下,真空冷冻干燥的G′和G″值最高,即其分子结构的动态黏弹性最好,其次分别为热风分段干燥、热风高温干燥、热风低温干燥、自然干燥,原因解释同2.9.1节。在低频率时,所有样品的tanδ>1(图9-c),说明KGM水溶胶中黏性占主导地位,分子链间存在较大的刚性,而随着振荡频率的增大,所有样品的tanδ<1(图9-c),可能是因为过度的振荡破坏分子结构[18]。
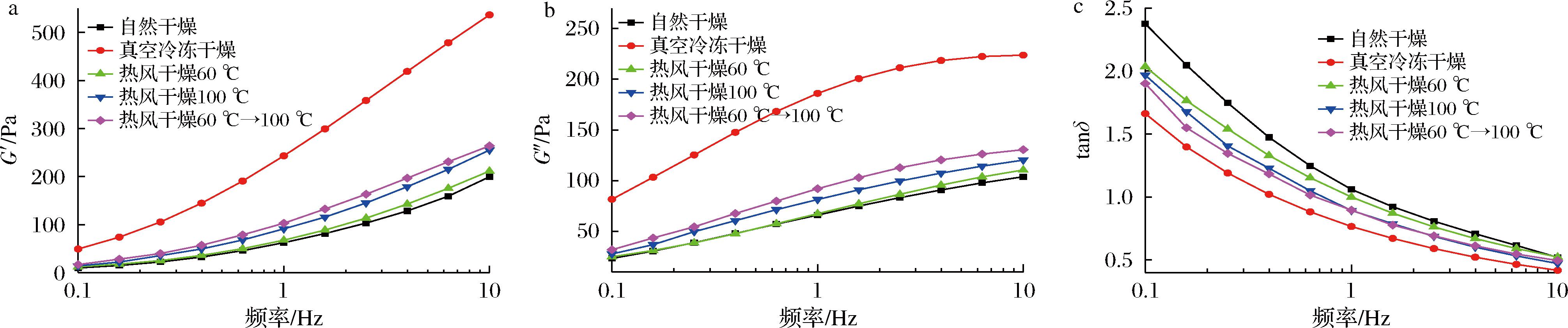
a-G′储能模量;b-G″损耗能量;c-tanδ损耗正切值
图9 不同干燥条件对魔芋精粉动态黏弹的影响
Fig.9 Effect of different drying conditions on dynamic viscoelasticity of konjac flour
3 结论
干燥是魔芋精粉生产中的一个必要环节,不同的干燥条件会对样品品质产生影响,选择恰当的干燥条件极为重要。研究结果表明自然干燥虽然操作简单,但干燥效率低,得到的样品品质较差;真空冷冻干燥虽然能得到较高品质的样品,但对设备要求比较高,干燥效率低;综合考虑,使用100 ℃→60 ℃的热风分段干燥方式为最佳方法,可以获得品质较好的魔芋精粉,且设备操作简单,干燥效率高。该方法有望应用于白魔芋及其他魔芋精粉的生产中,未来可着眼于分段干燥方式的工艺优化。
[1] YANG B, CHEN Y S, LI Z Q, et al.Konjac glucomannan/polyvinyl alcohol nanofibers with enhanced skin healing properties by improving fibrinogen adsorption[J].Materials Science &Engineering.C, Materials for Biological Applications, 2020, 110:110718.
[2] ZHUANG X B, WANG L J, JIANG X P, et al.Insight into the mechanism of myofibrillar protein gel influenced by konjac glucomannan:Moisture stability and phase separation behavior[J].Food Chemistry, 2021, 339:127941.
[3] 宋倩, 王敏, 邓利玲, 等.魔芋不可逆凝胶的流变学性质[J].食品科学, 2015, 36(11):86-90.
SONG Q, WANG M, DENG L L, et al.Rheological properties of irreversible konjac gel[J].Food Science, 2015, 36(11):86-90.
[4] 杨大伟, 申丹, 钟果林.微波和热风联合干燥魔芋片的最佳工艺方法研究[J].包装与食品机械, 2020, 38(3):18-21;50.
YANG D W, SHEN D, ZHONG G L.Study on the optimal process parameters of drying konjac chips by microwave combined with hot air[J].Packaging and Food Machinery, 2020, 38(3):18-21;50.
[5] 毕振举, 谷云盈, 闫丽, 等.不同干燥条件下富硒魔芋颜色、葡甘聚糖及硒含量的研究[J].西北林学院学报, 2020, 35(3):207-211;223.
BI Z J, GU Y Y, YAN L, et al.Effects of different drying methods on the color, glucomannan and selenium contents of selenium-enriched konjac Tuber[J].Journal of Northwest Forestry University, 2020, 35(3):207-211;223.
[6] 唐兰兰, 张世奇, 卫子颜, 等.红外烘烤对魔芋葡甘露聚糖表观黏度以及微观结构的影响[J].食品科学, 2021, 42(17):98-105.
TANG L L, ZHANG S Q, WEI Z Y, et al.Effect of infrared baking on apparent viscosity and microstructure of konjac glucomannan[J].Food Science, 2021, 42(17):98-105.
[7] 叶维, 李保国.魔芋热泵干燥特性及数学模型的研究[J].食品与发酵科技, 2015, 51(5):32-36;79.
YE W, LI B G.Drying characteristics and mathematical modeling for heat pump drying of konjacs[J].Food and Fermentation Technology, 2015, 51(5):32-36;79.
[8] SURYANA A L, ROSIANA N M, OLIVIA Z.Effect of drying method on the chemical properties of local soy flour[J].IOP Conference Series:Earth and Environmental Science, 2022, 980(1):012030.
[9] 卫永华, 张东, 相辉, 等.干燥方法对湿法魔芋精粉理化性质的影响[J].食品工业科技, 2015, 36(15):248-251;264.
WEI Y H, ZHANG D, XIANG H, et al.Effect of drying methods on physicochemical properties of wet-processing konjac powder[J].Science and Technology of Food Industry, 2015, 36(15):248-251;264.
[10] DA SILVA R C, DA SILVA W P, GOMES J P, et al.A new empirical model for predicting intermittent and continuous drying of “neve” melon (Cucumis melo sp.) seeds[J].Agriculture, 2022, 12(3):328.
[11] 效碧亮, 效碧彩, 刘晓风.苹果片双段控湿干燥特性及干燥品质工艺研究[J].食品与发酵工业, 2023, 49(5):237-246.
XIAO B L, XIAO B C, LIU X F.Drying characteristics, quality, and process optimization of apple slices during two-stage relative humidity-controlled drying[J].Food and Fermentation Industries, 2023, 49(5):237-246.
[12] ZHU W K, WANG L, DUAN K, et al.Experimental and numerical investigation of the heat and mass transfer for cut tobacco during two-stage convective drying[J].Drying Technology, 2015, 33(8):907-914.
[13] MOHAMMADI-MOGHADDAM T, FIROOZZARE A, HELALIAN S.The effect of different spices on the moisture content, texture characterizations and consumer preferences of roasted sunflower seeds[J].Food Chemistry:X, 2021, 12:100130.
[14] LI J, YE T, WU X F, et al.Preparation and characterization of heterogeneous deacetylated konjac glucomannan[J].Food Hydrocolloids, 2014, 40:9-15.
[15] 黄晴. 两种魔芋精粉的基础应用特性研究[D].武汉:华中农业大学, 2016.
HUANG Q.Study on basical applicational properties of refined konjac flour from two species[D].Wuhan:Huazhong Agricultural University, 2016.
[16] OUYANG D M, DENG J, ZHOU K, et al.The effect of deacetylation degree of konjac glucomannan on microbial metabolites and gut microbiota in vitro fermentation[J].Journal of Functional Foods, 2020, 66:103796.
[17] ROSTAMABADI H, FALSAFI S R, JAFARI S M.Starch-based nanocarriers as cutting-edge natural cargos for nutraceutical delivery[J].Trends in Food Science &Technology, 2019, 88:397-415.
[18] JIANG Y Y, REDDY C K, HUANG K H, et al.Hydrocolloidal properties of flaxseed gum/konjac glucomannan compound gel[J].International Journal of Biological Macromolecules, 2019, 133:1156-1163.
[19] WANG Y C, CHANG Y G, XUE Y, et al.Rheology and microstructure of heat-induced fluid gels from Antarctic krill (Euphausia superba) protein:Effect of pH[J].Food Hydrocolloids, 2016, 52:510-519.
[20] 梅婷. 魔芋葡甘聚糖湿热降解特性研究[D].武汉:华中农业大学, 2012.
MEI T.Study on thermal and acidic or alcali depolymerization of konjac glucomannan[D].Wuhan:Huazhong Agricultural University, 2012.
[21] LUO X G, HE P, LIN X Y.The mechanism of sodium hydroxide solution promoting the gelation of Konjac glucomannan (KGM)[J].Food Hydrocolloids, 2013, 30(1):92-99.
[22] DENG J, ZHONG J, LONG J, et al.Hypoglycemic effects and mechanism of different molecular weights of konjac glucomannans in type 2 diabetic rats[J].International Journal of Biological Macromolecules, 2020, 165(Pt B):2231-2243.
[23] 张钟元, 聂梅梅, 肖亚冬, 等.真空微波干燥过程中南瓜果胶性质变化与质构的关系[J].现代食品科技, 2021, 37(1):134-141.
ZHANG Z Y, NIE M M, XIAO Y D, et al.Relationship between pectin properties and texture of pumpkin during vacuum microwave drying[J].Modern Food Science and Technology, 2021, 37(1):134-141.
[24] LI B, LI J, XIA J, et al.Effect of gamma irradiation on the condensed state structure and mechanical properties of konjac glucomannan/chitosan blend films[J].Carbohydrate Polymers, 2011, 83(1):44-51.
[25] 杨晓仪, 孙远明, 杨幼慧, 等.机械力对魔芋葡甘聚糖影响研究[J].农产品加工, 2022(4):70-72.
YANG X Y, SUN Y M, YANG Y H, et al.Research progress on effect of mechanical force on konjac glucomannan[J].Farm Products Processing, 2022(4):70-72.