非酿酒酵母(non-Saccharomyces yeasts),指的是除酿酒酵母属(Saccharomyces)之外的酵母。在我国的酿酒和发酵工业中,“酿酒酵母”往往会被特指为Saccharomyces cerevisiae,然而在国外酒类相关发酵的研究中,“酿酒酵母”泛指属于Saccharomyces属的酵母。因此,非酿酒酵母不仅涵盖了Saccharomyces属之内除Saccharomyces cerevisiae外的其他酵母菌种,也包括了所有Saccharomyces属之外的酵母,如有孢汉逊酵母属(Hanseniaspora),毕赤酵母属(Pichia),德巴利酵母属(Debaryomyces)等[1-3]。它们普遍发酵能力弱,酒精耐受度低,还可能产生H2S、乙醛等影响酒产品风味的物质,在发现之初被科学家列为不良菌株[4]。近年来,有研究发现,部分非酿酒酵母不仅没有损害酒的品质,还能通过在酿造过程中产生生物酶,利用发酵原料合成酯类、高级醇类等香气化合物,增加风味复杂性,从而改善产品的最终风味[5]。葡萄酒是由非酿酒酵母与酿酒酵母混合发酵的典型酒种之一,其最终产品的风味品质受到非酿酒酵母的重要影响。季也蒙有孢汉逊酵母(Hanseniaspora guilliermondii)是葡萄酒发酵中最为丰富的非酿酒酵母,能显著提高酒中乙酸酯及乙酯类物质的含量[6-7];异常威克汉姆酵母(Wickerhamomyces anomalus)是酒中产生乙酸乙酯的主要非酿酒酵母菌株,能产生大量具有水果风味的酯和醇[8];德尔布有孢圆酵母(Torulaspora delbrueckii)在酿造过程中能大幅度降低酒中的乙醇含量,同时增加酯类物质的含量[9];耐热拉钱斯氏酵母(Lachancea thermotolerans)具有较好的产酸能力,可产生超过16 g/L的乳酸,从而显著改变酒的pH值[10];美极梅奇酵母属(Metschnikowia spp.)能促进葡萄酒中高级醇和酯类物质的形成,还会降低挥发酚的含量,显著影响酒的最终感官风味品质[11]。
除与酿酒酵母混合发酵改善酿造酒风味之外,部分非酿酒酵母还表现出单菌种发酵的潜力,但其发酵产品的效率、风味复杂性和酿造可控性都明显低于同酿酒酵母的混合发酵[12]。非酿酒酵母-酿酒酵母混合发酵在保障发酵效率的同时,还能促进形成积极的风味,如花香、果香和坚果香[13-14],帮助调节酿造酒中生物胺(biogenic amines,BAs)、高级醇等成分的含量[11],提高最终产品的微生物稳定性[15]。因此,目前非酿酒酵母主要是与酿酒酵母以混合发酵的形式应用于酒类酿造。在葡萄酒、白酒、黄酒等酿造酒的传统发酵过程中,往往存在着复杂的微生物区系。非酿酒酵母与其他微生物间的不同相互作用,如形成有利于双方共同生长的协同作用,或是两者相互抑制的营养竞争、或是产生嗜杀因子影响其他微生物生长等,都会对产品的最终风味造成巨大影响。因此,了解酿酒酵母与其他微生物间的相互作用,才能更好的将非酿酒酵母应用于酒类的混合发酵生产中,酿造出高品质的发酵酒。
非酿酒酵母在酒类酿造中的应用提高了产品风味多样性的可能,利用非酿酒酵母进行混合发酵可为酒类新产品的研发提供支持,还能有效避免酒类市场产品风味的同质化现象。传统酿造酒的发酵环境较复杂,微生物间的相互作用形式多样,因此,本文从酿造酒的生产出发,综述非酿酒酵母与发酵环境中其他微生物间的相互作用及其在酿造过程中的功能特性,并指出后续研究中可能存在的问题,为研究非酿酒酵母提高酒类感官风味的作用机制及开发多元化酿造酒的非酿酒酵母新菌株提供可参考的方向。
1 非酿酒酵母在酒类酿造过程中的微生物相互作用
在酒的酿造过程中,除酿酒酵母外,还有非酿酒酵母、乳酸菌、真菌等微生物的参与,它们之间都存在相互作用。目前,对酿酒酵母和乳酸菌间的相互作用已有了较多的研究,而非酿酒酵母与酿造酒中其他微生物的相互作用报道相对有限。乳酸菌作为影响酿造酒最终品质最重要的细菌,其与非酿酒酵母间的相互作用也逐渐被重视。但目前非酿酒酵母与酿酒酵母间的相互作用被认为是影响发酵酒品质最主要的因素,尽管二者间的相互作用机制尚不清晰,目前研究认为,影响非酿酒酵母-酿酒酵母间相互作用的主要因素有以下几种:1)营养物质利用竞争;2)胞间接触作用;3)代谢物的影响;4)合作及协同共生作用;5)群体感应等(图1)。
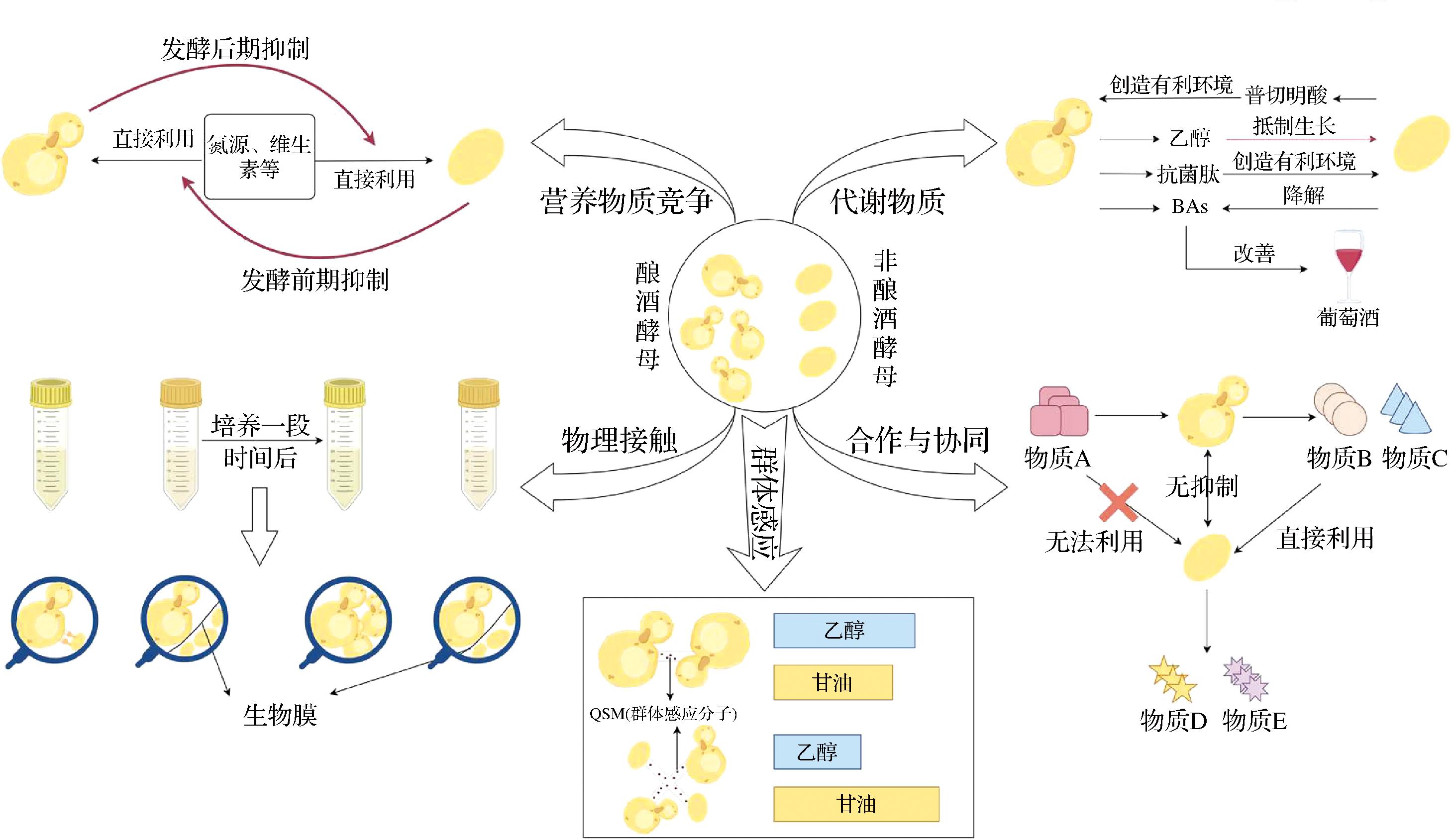
图1 酿酒酵母与非酿酒酵母相互作用的主要因素
Fig.1 The main factors of interaction between Saccharomyces cerevisiae and non-Saccharomyces yeast
1.1 非酿酒酵母与酿酒酵母间的相互作用
非酿酒酵母发酵能力弱,酒精耐受度低,接种顺序和方式的差异显著影响着非酿酒酵母与酿酒酵母的相互作用强度及最终酒产品的品质。目前,人们广泛采用的接种方式有同时接种与顺序接种两种策略[16]。同时接种是指非酿酒酵母和酿酒酵母混合后接种并进行发酵,顺序接种则是指非酿酒酵母接种一段时间后,再接种酿酒酵母。
由于顺序接种的发酵初期没有酿酒酵母的竞争作用,非酿酒酵母有较长的时间发挥作用,使得最终酒产品普遍具有更佳的品质[17]。李甜等[16]利用非酿酒酵母进行同时接种发酵时发现,非酿酒酵母主要在发酵初期发挥作用,发酵的第 6~7天开始出现死亡现象。WANG等[11]发现在季也蒙有孢汉逊酵母与酿酒酵母的同时接种发酵中,酿酒酵母的全基因组转录水平响应始终受到抑制,处于低发酵活性。这可能是导致同时接种发酵效果普遍弱于顺序接种发酵的主要原因。CHEN等[18]使用异常威克汉姆酵母同酿酒酵母分别进行同时接种和顺序接种发酵米酒,从发酵产品的分析结果来看,同时接种发酵的产品具有较低的挥发性酸度、较多的风味物质种类和发酵香气含量。但是,顺序接种发酵比同时接种发酵更有利于改善米酒的风味和品质,顺序接种发酵减少了硫醇,增加了高级醇、酯类、苯乙醇和萜烯类等发酵化合物。且顺序接种发酵对醇和谷物风味成分的气味活性调节效果更好,对米酒整体风味的协调性更好。因此,在现有研究中,人们往往优先选择顺序接种方式研究非酿酒酵母与酿酒酵母的相互作用。
1.1.1 营养物质竞争对非酿酒酵母-酿酒酵母相互作用的影响
营养物质的可利用性,尤其是氮源和维生素,决定了酒酿造过程中微生物种群动态、发酵动态以及副产物的形成[19]。同时,酵母菌的生长过程对营养物质有较高需求,碳源、氮源、水、无机盐等缺一不可,其含量也会影响酵母菌的生长状态,严重缺乏时会导致其死亡[20]。在非酿酒酵母和酿酒酵母的混合发酵中,营养物质的竞争是最早发生的相互作用。在顺序接种发酵中,优先接种的非酿酒酵母会消耗一定的营养物质,影响后续接种的酿酒酵母对营养物质的获取和利用,从而导致整个发酵过程变得缓慢[12]。酒精发酵的全过程中,非酿酒酵母同酿酒酵母的竞争中往往处于弱势地位,这可能与酿酒酵母更适应发酵的环境有关,如不同的渗透压、酒精浓度、氮源限制等,所以酿酒酵母的祖先能战胜其他酵母而被人们发现并应用于发酵。
在非酿酒酵母[德尔布有孢圆酵母或葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)]与酿酒酵母的混合发酵中,酿酒酵母的应激反应、细胞复制相关基因[21]和糖途径相关基因[22]有一定的过表达,说明非酿酒酵母与酿酒酵母对底物(碳源)的利用存在一定程度的竞争。相较于酿酒酵母,非酿酒酵母可以利用等量的碳源产生更少的乙醇、更多的甘油和琥珀酸,这种能力并不会因为共培养的物种数量增加而受到抑制[23],因此大部分非酿酒酵母具备降低酒产品乙醇水平的潜力。尽管酵母菌所需营养种类较多,但大多营养物质的吸收都受到氮源吸收效率的影响。非酿酒酵母(如耐热拉钱斯氏酵母和德尔布有孢圆酵母)在生长、发酵曲线和氮同化偏好方面与酿酒酵母具有高度相似性,使得非酿酒酵母和酿酒酵母在混合发酵过程中极易发生氮源竞争[24]。因此,氮源成为非酿酒酵母和酿酒酵母相互作用体系中竞争的主要营养物质之一。CONTRERAS-RUIZ等[25]将不同来源的60株酿酒酵母分别与库德里阿兹威酵母(Saccharomyces kudriavzevii)菌株同时接种进行微发酵,分析其对碳源和氮源的吸收情况。结果表明,竞争最激烈的酿酒酵母-库德里阿兹威酵母组合中,酿酒酵母对氮源的吸收显著加快,糖发酵速率减慢,与之前所研究的竞争中酿酒酵母糖途径相关基因的过表达[22]有一定差异。这可能是因为,面对多种营养物质的竞争时,酿酒酵母会优先摄取与生长和繁殖相关的成分——氮源,所以从快速扩张转向高效但较慢的扩张模式。
除碳源和氮源外,其他物质的吸收也或多或少地影响非酿酒酵母和酿酒酵母的共培养。O2的可用性强烈影响着非酿酒酵母的生存能力。不饱和脂肪酸和甾醇参与酵母菌的细胞膜合成,而它们的合成都需要O2的参与。耐热拉钱斯氏酵母对溶解氧的消耗量非常迅速,当它与酿酒酵母进行顺序接种发酵时,易造成发酵环境的较低溶解氧含量,会直接导致后续酿酒酵母的低生物量现象[26]。若将此类高耗氧菌株应用于预发酵阶段,则可以有效预防氧化,充当生物保护剂。WINDHOLTZ等[27]筛选了一株具备高耗氧能力的美极梅奇酵母,其在预发酵阶段成功抑制了醋酸菌(与葡萄酒腐败有关)的种群水平,且该抑制作用不低于常使用的SO2保护剂。维生素和矿物质的充足性对酿酒酵母-非酿酒酵母的相互作用也会产生一定影响。硫胺素(维生素B1)参与了酵母菌生长中的多个代谢过程,通过补充外源硫胺素,才能确保最高的发酵效率。葡萄汁有孢汉逊酵母和柠檬形克勒克酵母(Kloeckera apiculata)可抢夺葡萄浆中的硫胺素,造成酿酒酵母的营养流失[28]。锌元素也是影响酵母菌发酵性能的重要物质[29]。德尔布有孢圆酵母同酿酒酵母顺序接种培养时,由于明显的营养竞争作用往往会出现发酵过程中止或者减缓现象,ROCA-MESA等[30]通过联合添加硫胺素、锌和氨基酸,允许酿酒酵母在不接触的情况下连续接种完成发酵。目前的研究表明,仅限制硫胺素不会造成酿酒酵母的发酵缓慢[28],其是否与氮源素的吸收有关还需进一步研究。
氮源作为酵母菌生长最重要的物质之一,影响着非酿酒酵母与酿酒酵母的共同培养结果。因此,筛选和培育能够促进酿酒酵母氮源吸收,或氮源需求量低的非酿酒酵母,能有效降低二者间的负相互作用,甚至促进酿酒酵母的氮同化与种群扩张。
1.1.2 非酿酒酵母与酿酒酵母的合作与协同对酿造的影响
混合发酵中,两种或多种酵母菌在同一体系中生长平衡,且未出现相互抑制的现象,称为协同共生作用,这也是混合发酵工艺中的理想状态。在保证自身正常生长的情况下,非酿酒酵母可将部分物质转化为酿酒酵母能直接代谢的小分子,从而促进酿酒酵母的吸收与生长;非酿酒酵母还可降低发酵环境酸度,分解BAs,为酿酒酵母创造更有利的生存空间。
在德尔布有孢圆酵母和酿酒酵母同时接种发酵的长相思葡萄酒中,两者能够达到相同的种群数量,约为1×108 CFU/mL,与各自单独培养时数量相同,说明两者间不存在相互抑制作用,并且混合发酵所得酒产品中的C6化合物,萜烯醇和2-苯乙醇的含量显著提高,改善了酒的风味特征[17]。4-甲基-4-硫基戊烷-2-酮(4-methyl-4-sulfanylpentan-2-one,4MSP)和3-硫基己烷-1-醇(3-sulfanylhexan-1-ol,3SH)及其乙酸盐3-硫基己基乙酸酯(3-sulfanylhexyl acetate,3SHA)是长相思葡萄酒中最重要的芳香化合物。在酒精发酵过程中,德尔布有孢圆酵母同化了谷硫酰化前体(Glut-3SH)和释放半胱氨酸化偶联物前体(Cys-3SH),两种前体形式均可被酿酒酵母代谢转化为3SH。相比于酿酒酵母/德尔布有孢圆酵母纯发酵,协同发酵所得葡萄酒中的3SH和3SHA的总体水平显著升高,说明两者间具有良好的协同相互作用[31]。此外,李华敏等[32]也证明了德尔布有孢圆酵母和酿酒酵母在混合发酵过程中不存在相互抑制的关系,且德尔布有孢圆酵母能够快速适应酒体环境,迅速增殖。使用该混合发酵组合发酵生产樱桃酒,增强了产品的花香、果香和发酵香气,进一步提高了香气强度。耐热拉钱斯氏酵母和粟酒裂殖酵母(Schizosaccharomyces pombe)组合发酵生产葡萄酒时,苹果酸可被耐热拉钱斯氏酵母完全消耗,在不增加乙酸含量的情况下产生了较高含量的甘油和丙酮酸。这替代了传统发酵中的苹果酸-乳酸发酵(malolactic fermentation,MLF),增强了微生物稳定性,且产生了更低水平的BAs[33]。LUO等[34]基于代谢物和转录组学特征进一步揭示了酿酒酵母和粟酒裂殖酵母的相互作用。在两者的混合发酵中,参与糖酵解途径的相关基因下调,调节乙醇生产和编码脂肪酸合成酶的基因上调,使得发酵速度减缓,乙酸乙酯、辛酸乙酯、庚酸乙酯、1-庚醇和苯乙醇等芳香化合物含量上升,丰富了产品的风味物质。
混合发酵是提高酒产品品质的有效途径,但在现有研究中,大多数非酿酒酵母与酿酒酵母存在较大的环境(温度、乙醇、酸碱度)耐受性差距,很难实现共存。非酿酒酵母-酿酒酵母的协同共生作用研究有待更加深入,开发可以共生发酵的非酿酒酵母-酿酒酵母组合,扩大共生数量,才能够获得风味更加多样化,品质更高的产品。因此,未来还需进一步探索菌株共生的作用机制,以便设计更加合理的发酵环境。
1.1.3 代谢物质对非酿酒酵母-酿酒酵母相互作用的影响
酒精发酵过程中,酵母菌除将葡萄糖等底物转化为乙醇外,还会代谢产生醛、酯、酚等芳香化合物及BAs、抗菌肽(antimicrobial peptides,AMPs)等不利于其他微生物生长的成分。非酿酒酵母-酿酒酵母相互作用过程中各自产生的代谢底物都有可能影响另一方的生长和代谢。
乙醇是酒精发酵过程中的主产物,能抑制酵母菌的生长与活力,抑制强度也会随着乙醇浓度的升高而增强。大多数非酿酒酵母对SO2和乙醇的抗性较低,在葡萄酒酿造工业中往往受到酿酒酵母接种的抑制[35]。酿酒酵母发酵产生乙醇,当浓度积累到一定程度时,易使非酿酒酵母细胞组织和通透性改变,细胞质膜流动性下降,营养吸收进程减缓或延迟,导致其生长发育受到抑制[19]。酿酒酵母在酒精发酵过程中还会分泌AMPs,它们对多种酵母[如布鲁塞尔酒香酵母(Brettanomyces bruxellensis)]和细菌[如酒酒球菌(Oenococcus oeni)]具有活性。葡萄酒发酵过程中,酿酒酵母将AMPs排入培养基中,在指数生长期(24~48 h)结束时诱导非酿酒酵母死亡。而对部分免疫AMPs的非酿酒酵母来说,AMPs也能为其创造更好的生存空间。
非酿酒酵母能产生某些物质为酿酒酵母创造更适宜的发酵环境。美极梅奇酵母能产生铁螯合剂普切明酸——一种具有抗真菌活性的不溶性红色素,能与微生物竞争铁元素,从而抑制相关微生物的生长[36]。普切明酸对热带假丝酵母(Candida tropicalis)、白假丝酵母(Candida albicans)、酒香酵母属(Brettanomyces)、德克酵母属(Dekkera)、有孢汉逊酵母属、毕赤酵母属(Pichia)和部分真菌[灰葡萄孢(Botrytis cinerea)、青霉属(Penicillium)、链格孢属(Alternaria)、丛梗孢属(Monilia)]都表现出有效的抑制活性,但是酿酒酵母不受其影响[37-38]。
BAs是一类低分子质量的含氮化合物,人过量摄入会导致头痛、呼吸窘迫、高血压、呕吐和各种过敏症状[39]。在葡萄酒的酒精发酵、MLF和陈酿过程中,都会形成一定量的BAs[8]。通过非酿酒酵母直接或间接降低BAs的含量是目前的研究热点。汉逊德巴利酵母(Debaryomyces hansenii) H525虽然对乙醇的耐受性较低,无法直接应用于与酿酒酵母的混合发酵,但是其具有较好的胺氧化酶活性,对生长和休眠细胞的BAs代谢具有广泛的影响,值得进一步研究[40]。使用粟酒裂殖酵母与耐热拉钱斯氏酵母可以有效替代传统酿造中的MLF过程(粟酒裂殖酵母代谢苹果酸,耐热拉钱斯氏酵母产生乳酸)[15],从而有效降低酒产品中的BAs含量。
由于技术和经济等原因,大多数酵母菌参与的酒精发酵都无法在无菌环境下进行,存在较大的污染风险。AMPs的研究可以在创造良好发酵环境中发挥重要作用。BAs作为一类含氮化合物,抑制其形成过程是最直接有效的方式,但目前没有研究报道相关技术被应用于工业生产中,可能存在降解效率低等问题。可以尝试在酒产品的陈酿过程中,利用微生物进行降解以达到控制其含量的效果。
1.1.4 胞间接触对非酿酒酵母-酿酒酵母相互作用的影响
在固定的空间中,不同的微生物间会不可避免地发生物理接触,随着种群密度的增加,这种接触可能会带来一定的负面作用。在酿酒酵母与非酿酒酵母的同时接种发酵中,非酿酒酵母在早期呈现指数型死亡的现象,主导地位逐渐由酿酒酵母替代,主要原因是非酿酒酵母较低的乙醇耐受性[41]。但NISSEN等[42]证明,耐热拉钱斯氏酵母、德尔布有孢圆酵母在混合发酵早期的死亡,主要是由于其与酿酒酵母在高细胞密度下的细胞接触作用导致的。LUYT等[43]将耐热拉钱斯氏酵母与酿酒酵母进行混合发酵(物理接触)同膜分离(无细胞接触)的混合发酵对比,发现物理接触大大降低了耐热拉钱斯氏酵母的活力,并提前了细胞的死亡时间,说明细胞接触对非酿酒酵母与酿酒酵母的相互作用产生了负面影响。转录分析结果显示,在混合发酵中,酿酒酵母通过上调PAU基因(能提供对杀伤性毒素的保护)来加强竞争力,耐热拉钱斯氏酵母则显著上调了葡萄糖和几丁质生物发生、组装和维持的基因以增强和稳定细胞壁,降低外界刺激[44]。
细胞间的直接接触会对非酿酒酵母产生直接的抑制作用,同时,酿酒酵母也可能产生有毒化合物影响非酿酒酵母的生长。因此,在将来的研究过程中,尝试使用膜生物反应器、透析管等工具可有效避免细胞间的直接接触及有毒化合物的影响,以稳定二者间的相互作用,提升酿造酒的发酵品质。
1.1.5 群体感应对非酿酒酵母-酿酒酵母相互作用的影响
群体感应是广泛存在于微生物间的交流方式,不同于人类所使用的“语言”,微生物通过分泌群体感应分子(quorum sensing molecules,QSM)来进行交流和协调群体行为。交流过程至少包括4个要素:传递信号的酵母、信号、接受信号的酵母及其作出的生理反应[45]。现有研究中,已发现的真菌QSM有色醇、苯乙醇、法尼醇、酪醇和法尼酸5种物质[46]。王琮杰[47]使用产2-苯乙醇的非酿酒酵母与酿酒酵母进行顺序发酵,在确保两者存在群体感应的前提下,发现2-苯乙醇的合成具有细胞依赖性,合成速率变化曲线呈钟形。非酿酒酵母可以诱导酿酒酵母2-苯乙醇相关基因的表达上调,且终产物中甘油含量上升,乙醇含量显著下调。除了“交流”调节产物产量外,还有研究发现“交流”能够提升非酿酒酵母的环境耐受性。在酪醇的作用下,酿酒酵母、异常威克汉姆酵母、热带假丝酵母和光滑念珠菌(Candida glabrata)都对重金属有了更强的耐受性,提高了发酵产物的品质[48]。若能增强非酿酒酵母对高浓度乙醇和低温等发酵条件的耐受性,可以有效延长非酿酒酵母的停留时间以提高贡献。
非酿酒酵母领域中关于QSM的研究还很有限,考虑到酿酒酵母与非酿酒酵母在生长、发酵曲线和氮同化偏好等方面具有的高度相似性,可以参考现有关于酿酒酵母QSM的研究。现有研究已经证明可以通过添加外源QSM(2-苯乙醇、色醇和酪醇)提高酒中乙醇含量,实现了操控天然生物控制系统来控制酿酒酵母的产物及产量[49]。若能通过添加外源QSM来加强非酿酒酵母与酿酒酵母混合发酵时的“交流”,可以增强发酵过程的稳定性和可控性,提高醇酯水平。
1.2 非酿酒酵母与乳酸菌间的相互作用
葡萄酒发酵中,乳酸菌引发的MLF过程是葡萄酒酿造的次级发酵,对于酿造优质红葡萄酒来说尤其重要。MLF过程不仅可以降低葡萄酒的酸涩感和粗糙感,使之柔和、圆润,还能提高葡萄酒的感官质量和生物稳定性。但是,乳酸菌能将L-苹果酸酶解羧化为L-乳酸和CO2[50],使得发酵环境pH值增加,乙醇浓度上升,不利于大部分微生物的生长[51],包括非酿酒酵母。同时,酵母菌能影响SO2、乙醇、酚类化合物和低营养物质含量的变化并产生一定浓度的BAs,对乳酸菌的生长和MLF过程产生负面影响,最终影响葡萄酒的品质。
德尔布有孢圆酵母和美极梅奇酵母等非酿酒酵母在葡萄酒中释放甘露糖蛋白,可以被一些乳酸菌利用水解,提高培养基的营养成分,对酒酒球菌和MLF过程产生积极影响[52]。德尔布有孢圆酵母和美极梅奇酵母的参与还能降低酒精发酵末端SO2和中碳链脂肪酸浓度,提供了比酿酒酵母纯发酵更有利的MLF条件[53]。DU PLESSIS等[54]使用葡萄汁有孢汉逊酵母、酿酒酵母和酒酒球菌同时发酵葡萄酒,促进了酒酒球菌的生长并缩短了葡萄酒的MLF周期,葡萄汁有孢汉逊酵母和酒酒球菌采用顺序接种还可增加葡萄酒的香气丰度。焦媛媛[55]使用库德里阿兹威毕赤酵母(Pichia kudriavzevii)和副干酪乳杆菌(Lactobacillus paracasei)发酵出具有优良口感和风味的低醇梨酒,并发现两者具有潜在的共生关系。相比于酵母菌,乳酸菌通常具有更复杂的营养需求。乳酸菌与非酿酒酵母的混合接种易刺激非酿酒酵母的营养物质吸收和代谢,这可能导致乳酸菌的营养缺乏[56]。
目前关于非酿酒酵母-乳酸菌相互作用的研究大多基于葡萄酒的发酵过程,无法排除酿酒酵母对两者的共同影响。但总体来看,使用筛选过的非酿酒酵母能够有效改善乳酸菌的生长环境及其引导的MLF过程。
2 非酿酒酵母在酒类酿造过程中的功能特性
用于酒精发酵的酵母菌一般来源于发酵底物的自然环境,如葡萄酒发酵的微生物主要来源于葡萄果皮表面及果园。自然发酵除酿酒酵母外,还有多种非酿酒酵母的参与,相较于纯种发酵的葡萄酒具有更复杂的风味和营养物质。非酿酒酵母具有某些酿酒酵母所不具备的酶学特征,可以促进大分子物质的分解及转化,还有望改善葡萄酒的工艺过程及发酵品质,如提升发酵速率,降低乙醇含量,提高醛、酯、酚等风味成分的水平。
2.1 降低产品的乙醇含量
由于地理环境差异,部分产区的葡萄成熟度较高,易造成发酵过程中乙醇含量快速积累并维持在较高水平,不利于酵母菌的生存与后续发酵[57]。近年来,市场对低乙醇含量产品的需求量持续上升,研发低酒度新产品十分必要。延迟成熟,降低浆果产量,减少花青素、可溶性固体和挥发性化合物含量等措施都能降低乙醇含量,但也会对葡萄酒有不同程度的负面影响[58-59]。使用微生物措施,则可以将负面影响降至最小,还能利用其来提高产品的香气复杂性[60]。非酿酒酵母的低乙醇生成能力,使得其在开发低酒度产品中具有十分显著的优势。
耐热拉钱斯氏酵母、葡萄汁有孢汉逊酵母在与酿酒酵母的混合发酵中,各菌株的糖消耗量均低于酿酒酵母纯发酵的平均消耗量,能产生较低的最终乙醇水平,体积分数约为0.2%~0.5%[15,61]。使用德尔布有孢圆酵母与酿酒酵母顺序接种发酵,终产物的乙醇体积分数减少了0.48%~0.77%,并伴随着乳酸和乙酸浓度的上升。当德尔布有孢圆酵母接种量为酿酒酵母的10倍(107个/mL)时,乙醇含量降幅最大[62]。泽普林假丝酵母(Candida zemplinina)和克鲁维毕赤酵母(Pichia kluyveri)可以利用麦汁发酵生产低乙醇啤酒,发酵成品都具有较好的感官特性[63-64]。
通常地,乙醇含量的下降往往会伴随甘油和乙酸含量的增加。非酿酒酵母可以利用底物产生高浓度的不同于乙醇的代谢物,如甘油或丙酮酸,从而减少合成乙醇的原料。葡萄汁有孢汉逊酵母、耐热拉钱斯氏酵母、美极梅奇酵母、拜耳接合酵母(Zygosaccharomyces bailii)等可以进行纯培养实现乙醇含量的下降,但实践表明,这会出现发酵停滞的问题[62]。因此,非酿酒酵母与酿酒酵母的混合发酵是目前最有效的降低乙醇的方式,能够确保发酵工艺的正常进行和产品的稳定性。
2.2 产酶能力
相比于酿酒酵母,非酿酒酵母能分泌多种有益于葡萄酒香气形成的水解酶,如蛋白酶、果胶酶、β-葡萄糖苷酶(β-D-glucosidase,BGLs)、β-木糖苷酶[65]、脂肪水解酶和纤维素酶等。因此,添加非酿酒酵母可以提高酒产品的芳香复杂性、甘油含量和颜色稳定性,并降低乙醇含量。
BGLs是一种纤维素水解酶,存在于葡萄等植物材料中,也能由一些微生物产生,它能水解结合于末端的糖苷键,与β-木糖苷酶参与萜烯的释放,从而提高葡萄酒的芳香复杂性[66]。酵母菌和乳酸菌是酿酒过程中BGLs的主要来源[67]。现代酿酒工艺常采用非酿酒酵母产生的BGLs,它是水解葡萄香气前体物质增强葡萄酒风味的关键成分。HAN等[68]以9个地区44个葡萄园的葡萄为样本,通过BGLs活性筛选出一株光滑念珠菌D18。结果显示,该菌株能显著增加葡萄酒中花香和果香的典型性和复杂性,具备在葡萄酒发酵中应用的潜力。另外,作为酵母细胞的胞外酶,不同菌株BGLs的产量及活性也会存在较大差异性。常见的不同非酿酒酵母产BGLs的酶活力见表1。TESTA等[71]筛选了共计196株季也蒙有孢汉逊酵母和葡萄汁有孢汉逊酵母,发现季也蒙有孢汉逊酵母的BGLs、蛋白酶、酯酶等活性普遍优于葡萄汁有孢汉逊酵母。也有学者发现同种菌种的不同菌株之间也会存在明显的差异,在其所筛选的汉逊德巴利酵母中,汉逊德巴利酵母4025具有较强的BGLs活性,而汉逊德巴利酵母533、6010、618、1和1M的BGLs活性则较低[73]。
表1 不同非酿酒酵母产β-葡萄糖苷酶的活力
Table 1 Enzyme activity of β-D-glucosidase produced by different non-Saccharomyces yeast

菌株名称β-葡萄糖苷酶活性参考文献酿酒酵母+[69-70]季也蒙有孢汉逊酵母++/+++[70-71]异常威克汉姆酵母++/++++[70]德尔布有孢圆酵母+[69]克鲁维毕赤酵母+[69-70,72]粟酒裂殖酵母++[69]东方伊萨酵母(Issatchenkia oriental-is)+[70]葡萄汁有孢汉逊酵母++[70-71]拜耳接合酵母++[72]
注:相对β-葡萄糖苷酶活性:极弱活性(+);弱活性(++);适中活性(+++);强活性(++++)。
果胶酶广泛分布于高等植物和微生物中,可用于降解底物葡萄中的果胶,还能提高果汁产量,澄清和过滤葡萄酒,从葡萄皮中释放颜色和风味化合物,对葡萄酒香气产生积极贡献[74]。龙舌兰酒菌群含有多种类型的非酿酒酵母,是龙舌兰果聚糖水解的新果聚糖酶和用于低聚果糖合成新酶的潜在来源。研究人员从其中分离出了新型的果糖酶和果糖基转移酶,它们将被应用在果聚糖水解和益生元的工业生产中[75]。在接种非酿酒酵母[阿德利隐球菌(Cryptococcus adeliensis)、东方伊萨酵母和克鲁维毕赤酵母]的红葡萄酒中添加果胶后,可滴定酸度、乙酸、pH和D-半乳糖醛酸发生显著的变化[76]。
关于非酿酒酵母产生的BGLs、木聚糖酶、果胶酶、纤维素酶等的研究和工艺应用较少,且大部分研究集中于BGLs。研究证明,非酿酒酵母所产酶具有很大的应用潜力,参考酿酒酵母产酶的研究,探索新型胞外酶和稳定的产酶非酿酒酵母是筛菌工作的重点。关于酶的研究,改善萜烯、硫醇、去甲异戊二烯和其前体等物质的释放,能否有效解决产品中蛋白质、果胶引起的浑浊问题是研究重点。
2.3 产生风味物质
啤酒和葡萄酒等产品因其独特且丰富的香气深受消费者的喜爱,但仅靠现有产品是无法满足市场需求的。非酿酒酵母对香气的贡献引起了广大研究者的关注,如德尔布有孢圆酵母能提供草莓、猕猴桃和黑莓香气,光滑念珠菌能提供琼瑶浆典型性香气,覆膜孢酵母属(Saccharomycopsis crataegensis)和葡萄汁有孢汉逊酵母能提供甜香和花香等[77]。
酿造过程中,除酿酒酵母外,存在一大部分产脂的非酿酒酵母,它们利用乙醇、糖、醛等代谢物生产酯类物质,是酒产品中的主要呈香物质。扣囊复膜孢酵母(Saccharomycopsis fibuligera)是目前研究较多的产酯酵母。SU等[78]将扣囊复膜孢酵母和酿酒酵母进行生物强化接种后用于小曲酒的发酵,与传统发酵相比,成品的醇酯含量分别提高了42.5%和11.8%,醛酮和杂环化合物的含量分别下降了73.7%和77.1%。葡萄牙棒孢酵母(Clavispora lusitaniae)也是一种在酿造工业中广泛应用的产酯酵母,经过其强化的大曲,在发酵后期能产出更高含量的乙酸乙酯[79]。耐热拉钱斯氏酵母能提高混合发酵时有益的芳香族分子浓度,包括乙酯、萜类化合物[80-81]以及甘油[82]。
同时,大多数非酿酒酵母可以产生更多的有机酸和多酚类物质,部分非酿酒酵母还具备调节和平衡能力[83]。酸度是影响果酒纯正和清爽的重要参数,多酚类物质能影响酒产品的颜色和风味,并具有多种保健功能。LI等[84]就利用鲁氏接合酵母(Zygosaccharomyces rouxii)、拜耳接合酵母和异常威克汉姆酵母发酵出具有极低pH值和更高含量多酚的猕猴桃酒。LIU等[85]使用不同的酿酒酵母与德尔布有孢圆酵母共培养发酵猕猴桃酒,检测到柠檬酸、L-苹果酸和琥珀酸等有机酸含量升高。耐热拉钱斯氏酵母和经过筛选的粟酒裂殖酵母菌株组合,能够从苹果酸的角度稳定葡萄酒,而不需要进行MLF[33],实现pH的稳定。拜耳接合酵母与酿酒酵母的顺序接种发酵也通过降低苹果酸含量产生积极作用,同时显著提高了低乙醇猕猴桃酒中的总黄酮、总酚、部分单酚含量及抗氧化活性[86]。
风味是酒类产品最重要的指标之一,其丰度甚至决定着产品的优劣。上述研究证实了非酿酒酵母增加酒中脂、酸、酚类等风味成分的可能性,为未来的风味研究提供一定的参考。但是酒的风味通常还受多种因素的影响,如菌株的接种方式会影响风味物质的产生顺序及含量,接种数量有利于增加风味的丰度,但可能影响菌株的生长情况。风味的评估也缺乏一套统一的评价方法,无法在不同研究间进行直接的对比评价。
3 结论和展望
非酿酒酵母曾被人们视为腐败菌而被排除在酒精发酵的全过程。现有研究充分证明,非酿酒酵母可以同酿酒酵母良好共存,并利于其生长和生产更优质的产品。非酿酒酵母与微生物相互作用的研究,有助于控制发酵环境,如控制pH、SO2、AMPs等,确保目的菌株的正常生长。在同酿酒酵母的混合发酵中,如何确保非酿酒酵母的持久性以实现贡献最大化,如何确保不同时期不同菌株的主导地位及稳定发酵效率是保证非酿酒酵母用于酒类混合发酵的重点之一。使用特定装置(如微胶囊、生物膜等)固定和保护非酿酒酵母以增强竞争力,有望达到弱化微生物间负相互作用的效果。优质的非酿酒酵母-酿酒酵母组合要求能够降低终产品的乙醇水平,产生多种胞外酶降解大分子,还能产生(相较于酿酒酵母纯发酵)新的醇、酯、醛等芳香化合物。除不断筛选和培育外,尝试应用多种已知的非酿酒酵母与酿酒酵母进行混合发酵,实现品质的叠加效果也是方法之一。另外,葡萄酒、黄酒等产品在发酵完成后会进行陈酿操作,部分非酿酒酵母具备降解醛、酯的能力,可以探索其在酿造酒陈酿过程中的应用。
[1] 田晓菊. 酵母属在食品工业中的应用[J].中国酿造, 2015, 34(4):13-16.
TIAN X J.Application of Saccharomyces in food industry[J].China Brewing, 2015, 34(4):13-16.
[2] SAGANELIDZE K, BOKUCHAVA L, ZEDELASHVILI I, et al.Can a β-glucan-containing orthomolecular agent (Saccharomyces sp.) containing metabolic cofactors attenuate cytokine activation and alleviate hypoxia in COVID-19 patients?[J].International Journal of Clinical Pharmacology and Therapeutics, 2023, 61(10):471-474.
[3] JOLLY N P, VARELA C, PRETORIUS I S.Not your ordinary yeast:Non-Saccharomyces yeasts in wine production uncovered[J].FEMS Yeast Research, 2014, 14(2):215-237.
[4] 王笑语,陈晶瑜,马长伟.非酿酒酵母在多元化啤酒酿造中应用的研究进展[J/OL].食品与发酵工业,2024.DOI:10.13995/j.cnki.11-1802/ts.035951.
WANG X Y, CHEN J Y, MA C W.Application of non-Saccharomyces in diversified beer brewing:A review[J/OL].Food and Fermentation Industry,2024.DOI:10.13995/j.cnki.11-1802/ts.035951.
[5] JIANG X H, LU Y Y, LIU S Q.Effects of different yeasts on physicochemical and oenological properties of red dragon fruit wine fermented with Saccharomyces cerevisiae, Torulaspora delbrueckii and Lachancea thermotolerans[J].Microorganisms, 2020, 8(3):315.
[6] LAGE P, BARBOSA C, MATEUS B, et al.H.guilliermondii impacts growth kinetics and metabolic activity of S.cerevisiae:The role of initial nitrogen concentration[J].International Journal of Food Microbiology, 2014, 172:62-69.
[7] SEIXAS I, BARBOSA C, MENDES-FAIA A, et al.Genome sequence of the non-conventional wine yeast Hanseniaspora guilliermondii UTAD222 unveils relevant traits of this species and of the Hanseniaspora genus in the context of wine fermentation[J].DNA Research, 2019, 26(1):67-83.
[8] 陈丽花, 任丽霞, 李东娜, 等.甜酒曲中优质酵母菌的分离鉴定及其产香特性分析[J].食品科学, 2021, 42(6):142-149.
CHEN L H, REN L X, LI D N, et al.Fermentation characteristics for flavor compounds production by quality yeast strains isolated from rice wine starters[J].Food Science, 2021, 42(6):142-149.
[9] LIU S X, LAAKSONEN O, YANG B R.Volatile composition of bilberry wines fermented with non-Saccharomyces and Saccharomyces yeasts in pure, sequential and simultaneous inoculations[J].Food Microbiology, 2019, 80:25-39.
[10] BANILAS G, SGOUROS G, NISIOTOU A.Development of microsatellite markers for Lachancea thermotolerans typing and population structure of wine-associated isolates[J].Microbiological Research, 2016, 193:1-10.
[11] WANG B S, TAN F L, CHU R C, et al.The effect of non-Saccharomyces yeasts on biogenic amines in wine[J].Trends in Food Science &Technology, 2021, 116:1029-1040.
[12] PRIOR K J, BAUER F F, DIVOL B.The utilisation of nitrogenous compounds by commercial non-Saccharomyces yeasts associated with wine[J].Food Microbiology, 2019, 79:75-84.
[13] ROSSOUW D, BAUER F F.Exploring the phenotypic space of non-Saccharomyces wine yeast biodiversity[J].Food Microbiology, 2016, 55:32-46.
[14] ESCRIBANO-VIANA R, GONZ LEZ-ARENZANA L, PORTU J, et al.Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non-Saccharomyces/Saccharomyces yeasts[J].Food Research International, 2018, 112:17-24.
LEZ-ARENZANA L, PORTU J, et al.Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non-Saccharomyces/Saccharomyces yeasts[J].Food Research International, 2018, 112:17-24.
[15] BENITO S.Combined use of Lachancea thermotolerans and Schizosaccharomyces pombe in winemaking:A review[J].Microorganisms, 2020, 8(5):655.
[16] 李甜, 雷雨, 李东, 等.不同非酿酒酵母与酿酒酵母顺序发酵对茵红李果酒风味的影响[J].食品科学,2023,44(24):179-187.
LI T, LEI Y, LI D, et al.Impact of sequential fermentation with different non-Saccharomyces and Saccharomyces cerevisiae on the aroma of Yinhong plum wine[J].Food Science,2023,44(24):179-187.
[17] CIANI M, CAPECE A, COMITINI F, et al.Yeast interactions in inoculated wine fermentation[J].Frontiers in Microbiology, 2016, 7:555.
[18] CHEN L H, LI D N, REN L X, et al.Effects of simultaneous and sequential cofermentation of Wickerhamomyces anomalus and Saccharomyces cerevisiae on physicochemical and flavor properties of rice wine[J].Food Science &Nutrition, 2021, 9(1):71-86.
[19] BARBOSA C, MENDES-FAIA A, LAGE P, et al.Genomic expression program of Saccharomyces cerevisiae along a mixed-culture wine fermentation with Hanseniaspora guilliermondii[J].Microbial Cell Factories, 2015, 14:124.
[20] 赵剑雷. 发酵蓝莓酒中不同酵母菌间相互作用机制初步研究[D].贵阳:贵州大学, 2022.
ZHAO J L.Preliminary study on the interaction mechanism between different yeasts in fermented blueberry wine[D].Guiyang:Guizhou University, 2022.
[21] TRONCHONI J, CURIEL J A, MORALES P, et al.Early transcriptional response to biotic stress in mixed starter fermentations involving Saccharomyces cerevisiae and Torulaspora delbrueckii[J].International Journal of Food Microbiology, 2017, 241:60-68.
[22] ALONSO-DEL-REAL J, PÉREZ-TORRADO R, QUEROL A, et al.Dominance of wine Saccharomyces cerevisiae strains over S.kudriavzevii in industrial fermentation competitions is related to an acceleration of nutrient uptake and utilization[J].Environmental Microbiology, 2019, 21(5):1627-1644.
[23] CARBON H N, APLIN J J, JIANG G Z, et al.Fate of carbon in synthetic media fermentations containing Metschnikowia pulcherrima or Meyerozyma guilliermondii in the presence and absence of Saccharomyces cerevisiae[J].Food Microbiology, 2023, 114:104308.
[24] ROCA-MESA H, SENDRA S, MAS A, et al.Nitrogen preferences during alcoholic fermentation of different non-Saccharomyces yeasts of oenological interest[J].Microorganisms, 2020, 8(2):157.
[25] CONTRERAS-RUIZ A, ALONSO-DEL-REAL J, BARRIO E, et al.Saccharomyces cerevisiae wine strains show a wide range of competitive abilities and differential nutrient uptake behavior in co-culture with S.kudriavzevii[J].Food Microbiology, 2023, 114:104276.
[26] ENGLEZOS V, CRAVERO F, TORCHIO F, et al.Oxygen availability and strain combination modulate yeast growth dynamics in mixed culture fermentations of grape must with Starmerella bacillaris and Saccharomyces cerevisiae[J].Food Microbiology, 2018, 69:179-188.
[27] WINDHOLTZ S, NIOI C, COULON J, et al.Bioprotection by non-Saccharomyces yeasts in oenology:Evaluation of O2 consumption and impact on acetic acid bacteria[J].International Journal of Food Microbiology, 2023, 405:110338.
[28] 尚大鹏. 葡萄酒酿造中非酿酒酵母的应用分析[J].农业与技术, 2015, 35(24):222.
SHANG D P.Application analysis of non-Saccharomyces cerevisiae in wine brewing[J].Agriculture and Technology, 2015, 35(24):222.
[29] WALKER G, DE NICOLA R, HALL N.Zinc accumulation and utilization by wine yeasts[J].International Journal of Wine Research, 2009:85-94.
[30] ROCA-MESA H, DELGADO-YUSTE E, MAS A, et al.Importance of micronutrients and organic nitrogen in fermentations with Torulaspora delbrueckii and Saccharomyces cerevisiae[J].International Journal of Food Microbiology, 2022, 381:109915.
[31] RENAULT P, COULON J, MOINE V, et al.Enhanced 3-sulfanylhexan-1-ol production in sequential mixed fermentation with Torulaspora delbrueckii/Saccharomyces cerevisiae reveals a situation of synergistic interaction between two industrial strains[J].Frontiers in Microbiology, 2016, 7:293.
[32] 李华敏, 孙舒扬, 黄萍萍, 等.戴尔有孢圆酵母WA19与酿酒酵母F33混合发酵在樱桃酒酿造中的应用[J].食品科学, 2018, 39(24):123-130.
LI H M, SUN S Y, HUANG P P, et al.Mixed-culture cherry wine fermentation with Torulaspora delbrueckii WA19 and Saccharomyces cerevisiae F33[J].Food Science, 2018, 39(24):123-130.
[33] BENITO  , CALDER
, CALDER N F, PALOMERO F, et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules, 2015, 20(6):9510-9523.
N F, PALOMERO F, et al.Combine use of selected Schizosaccharomyces pombe and Lachancea thermotolerans yeast strains as an alternative to the traditional malolactic fermentation in red wine production[J].Molecules, 2015, 20(6):9510-9523.
[34] LUO X Q, LI Y M, ZHONG K, et al.Discovering the effect of co-fermentation involving Saccharomyces cerevisiae and Schizosaccharomyces pombe on the sensory quality improvement of mandarin wine based on metabolites and transcriptomic profiles[J].Journal of the Science of Food and Agriculture, 2023, 103(15):7932-7940.
[35] BENITO S.The impact of Torulaspora delbrueckii yeast in winemaking[J].Applied Microbiology and Biotechnology, 2018, 102(7):3081-3094.
[36] PAWLIKOWSKA E, KOLESI SKA B, NOWACKA M, et al.A new approach to producing high yields of pulcherrimin from Metschnikowia yeasts[J].Fermentation, 2020, 6(4):114.
SKA B, NOWACKA M, et al.A new approach to producing high yields of pulcherrimin from Metschnikowia yeasts[J].Fermentation, 2020, 6(4):114.
[37] ORO L, CIANI M, COMITINI F.Antimicrobial activity of Metschnikowia pulcherrima on wine yeasts[J].Journal of Applied Microbiology, 2014, 116(5):1209-1217.
[38] K NTOR A, HUTKOV
NTOR A, HUTKOV J, PETROV
J, PETROV J, et al.Antimicrobial activity of pulcherrimin pigment produced by Metschnikowia pulcherrima against various yeast species[J].Journal of Microbiology, Biotechnology and Food Sciences, 2015, 5(3):282-285.
J, et al.Antimicrobial activity of pulcherrimin pigment produced by Metschnikowia pulcherrima against various yeast species[J].Journal of Microbiology, Biotechnology and Food Sciences, 2015, 5(3):282-285.
[39] RICCI A, ALLENDE A, et al.Update of the list of QPS-recommended biological agents intentionally added to food or feed as notified to EFSA 5:suitability of taxonomic units notified to EFSA until September 2016[J].EFSA Journal, 2017, 15(3):4663.
[40] B UMLISBERGER M, MOELLECKEN U, KÖNIG H, et al.The potential of the yeast Debaryomyces hansenii H525 to degrade biogenic amines in food[J].Microorganisms, 2015, 3(4):839-850.
UMLISBERGER M, MOELLECKEN U, KÖNIG H, et al.The potential of the yeast Debaryomyces hansenii H525 to degrade biogenic amines in food[J].Microorganisms, 2015, 3(4):839-850.
[41] COCOLIN L, BISSON L F, MILLS D A.Direct profiling of the yeast dynamics in wine fermentations[J].FEMS Microbiology Letters, 2000, 189(1):81-87.
[42] NISSEN P, ARNEBORG N.Characterization of early deaths of non-Saccharomyces yeasts in mixed cultures with Saccharomyces cerevisiae[J].Archives of Microbiology, 2003, 180(4):257-263.
[43] LUYT N A, BEAUFORT S, DIVOL B, et al.Phenotypic characterization of cell-to-cell interactions between two yeast species during alcoholic fermentation[J].World Journal of Microbiology and Biotechnology, 2021, 37(11):186.
[44] SHEKHAWAT K, PATTERTON H, BAUER F F, et al.RNA-seq based transcriptional analysis of Saccharomyces cerevisiae and Lachancea thermotolerans in mixed-culture fermentations under anaerobic conditions[J].BMC Genomics, 2019, 20(1):145.
[45] MENCHER A, MORALES P, TRONCHONI J, et al.Mechanisms involved in interspecific communication between wine yeasts[J].Foods, 2021, 10(8):1734.
[46] NATH B J, PARASAR D P, SARMA H K.Linking the diversity of yeasts inherent in starter cultures to quorum sensing mechanism in ethnic fermented alcoholic beverages of Northeast India[J].Frontiers in Sustainable Food Systems, 2021, 5:678045.
[47] 王琮杰. 群体感应信号分子2-苯乙醇在非酿酒酵母及顺序发酵中的初步研究[D].秦皇岛:河北科技师范学院, 2023.
WANG Z J.Preliminary study on quorum sensing signaling molecule 2-phenylethanol in non-Saccharomyces cerevisiae and sequential fermentation[D].Qinhuangdao:Hebei Normal University of Science and Technology, 2023.
[48] NATH B J, DAS K K, TALUKDAR R, et al.Tyrosols retrieved from traditionally brewed yeasts assist in tolerance against heavy metals and promote the growth of cells[J].FEMS Microbiology Letters, 2022, 368(21-24):fnab152.
[49] HUANG X F, REARDON K F.Quorum-sensing molecules increase ethanol yield from Saccharomyces cerevisiae[J].FEMS Yeast Research, 2021, 21(8):foab056.
[50] BARTOWSKY E J.Oenococcus oeni and malolactic fermentation-moving into the molecular arena[J].Australian Journal of Grape and Wine Research, 2005, 11(2):174-187.
[51] SUMBY K M, BARTLE L, GRBIN P R, et al.Measures to improve wine malolactic fermentation[J].Applied Microbiology and Biotechnology, 2019, 103(5):2033-2051.
[52] FERRANDO N, ARAQUE I, ORT S A, et al.Evaluating the effect of using non-Saccharomyces on Oenococcus oeni and wine malolactic fermentation[J].Food Research International, 2020, 138(Pt B):109779.
S A, et al.Evaluating the effect of using non-Saccharomyces on Oenococcus oeni and wine malolactic fermentation[J].Food Research International, 2020, 138(Pt B):109779.
[53] BALMASEDA A, ROZ S N, LEAL M
S N, LEAL M  , et al.Impact of changes in wine composition produced by non-Saccharomyces on malolactic fermentation[J].International Journal of Food Microbiology, 2021, 337:108954.
, et al.Impact of changes in wine composition produced by non-Saccharomyces on malolactic fermentation[J].International Journal of Food Microbiology, 2021, 337:108954.
[54] DU PLESSIS H, DU TOIT M, NIEUWOUDT H, et al.Modulation of wine flavor using Hanseniaspora uvarum in combination with different Saccharomyces cerevisiae, lactic acid bacteria strains and malolactic fermentation strategies[J].Fermentation, 2019, 5(3):64.
[55] 焦媛媛. 酵母菌—乳酸菌共发酵低醇梨酒的研制[D].天津:天津科技大学, 2018.
JIAO Y Y.Preparation of yeast-lactic acid bacteria co-fermented low alcohol pear wine[D].Tianjin:Tianjin University of Science &Technology, 2018.
[56] CURIEL J A, MORALES P, GONZALEZ R, et al.Different non-Saccharomyces yeast species stimulate nutrient consumption in S.cerevisiae mixed cultures[J].Frontiers in Microbiology, 2017, 8:2121.
[57] CONTRERAS A, HIDALGO C, SCHMIDT S, et al.The application of non-Saccharomyces yeast in fermentations with limited aeration as a strategy for the production of wine with reduced alcohol content[J].International Journal of Food Microbiology, 2015, 205:7-15.
[58] DE TODA F M, SANCHA J C, BALDA P.Reducing the sugar and pH of the grape (Vitis vinifera L.cvs.‘grenache’ and ‘tempranillo’) through a single shoot trimming[J].South African Journal of Enology and Viticulture, 2016, 34(2):246-251.
[59] LONGO R, BLACKMAN J W, TORLEY P J, et al.Changes in volatile composition and sensory attributes of wines during alcohol content reduction[J].Journal of the Science of Food and Agriculture, 2017, 97(1):8-16.
[60] VARELA C, BARKER A, TRAN T, et al.Sensory profile and volatile aroma composition of reduced alcohol Merlot wines fermented with Metschnikowia pulcherrima and Saccharomyces uvarum[J].International Journal of Food Microbiology, 2017, 252:1-9.
[61] MESTRE M V, MATURANO Y P, GALLARDO C, et al.Impact on sensory and aromatic profile of low ethanol malbec wines fermented by sequential culture of Hanseniaspora uvarum and Saccharomyces cerevisiae native yeasts[J].Fermentation, 2019, 5(3):65.
[62] ZHU X L, TORIJA M J, MAS A, et al.Effect of a multistarter yeast inoculum on ethanol reduction and population dynamics in wine fermentation[J].Foods, 2021, 10(3):623.
[63] CAPECE A, DE FUSCO D, PIETRAFESA R, et al.Performance of wild non-conventional yeasts in fermentation of wort based on different malt extracts to select novel starters for low-alcohol beers[J].Applied Sciences, 2021, 11(2):801.
[64] SIM ES J, COELHO E, MAGALH
ES J, COELHO E, MAGALH ES P, et al.Exploiting non-conventional yeasts for low-alcohol beer production[J].Microorganisms, 2023, 11(2):316.
ES P, et al.Exploiting non-conventional yeasts for low-alcohol beer production[J].Microorganisms, 2023, 11(2):316.
[65] HONG M N, LI J, CHEN Y W.Characterization of tolerance and multi-enzyme activities in non-Saccharomyces yeasts isolated from Vidal Blanc icewine fermentation[J].Journal of Food Biochemistry, 2019, 43(11):e13027.
[66] L PEZ M C, MATEO J J, MAICAS S.Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates[J].Journal of Food Science, 2015, 80(8):C1696-C1704.
PEZ M C, MATEO J J, MAICAS S.Screening of β-glucosidase and β-xylosidase activities in four non-Saccharomyces yeast isolates[J].Journal of Food Science, 2015, 80(8):C1696-C1704.
[67] BLASCO L, VEIGA-CRESPO P, POZA M, et al.Hydrolases as markers of wine aging[J].World Journal of Microbiology and Biotechnology, 2006, 22(11):1229-1233.
[68] HAN X Y, QING X, YANG S Y, et al.Study on the diversity of non-Saccharomyces yeasts in Chinese wine regions and their potential in improving wine aroma by β-glucosidase activity analyses[J].Food Chemistry, 2021, 360:129886.
[69] 李静. 非酿酒酵母发酵薏米酒醪的特性研究[J].中国食品添加剂, 2022, 33(6):45-52.
LI J.Study on the characterization of non-Saccharomyces cerevisiae fermented coix seed wine mash[J].China Food Additives, 2022, 33(6):45-52.
[70] ZHANG P Z, ZHANG R G, SIRISENA S, et al.Beta-glucosidase activity of wine yeasts and its impacts on wine volatiles and phenolics:A mini-review[J].Food Microbiology, 2021, 100:103859.
[71] TESTA B, LOMBARDI S J, IORIZZO M, et al.Use of strain Hanseniaspora guilliermondii BF1 for winemaking process of white grapes Vitis vinifera cv Fiano[J].European Food Research and Technology, 2020, 246(3):549-561.
[72] CORDERO OTERO R R, UBEDA IRANZO J F, BRIONES-PEREZ A I, et al.Characterization of the β-glucosidase activity produced by enological strains of Non-Saccharomyces yeasts[J].Journal of Food Science, 2003, 68(8):2564-2569.
[73] ARÉVALO VILLENA M,  BEDA IRANZO J F, CORDERO OTERO R R, et al.Optimization of a rapid method for studying the cellular location of β-glucosidase activity in wine yeasts[J].Journal of Applied Microbiology, 2005, 99(3):558-564.
BEDA IRANZO J F, CORDERO OTERO R R, et al.Optimization of a rapid method for studying the cellular location of β-glucosidase activity in wine yeasts[J].Journal of Applied Microbiology, 2005, 99(3):558-564.
[74] BELDA I, CONCHILLO L B, RUIZ J, et al.Selection and use of pectinolytic yeasts for improving clarification and phenolic extraction in winemaking[J].International Journal of Food Microbiology, 2016, 223:1-8.
[75] ARRIZON J, MOREL S, GSCHAEDLER A, et al.Fructanase and fructosyltransferase activity of non-Saccharomyces yeasts isolated from fermenting musts of Mezcal[J].Bioresource Technology, 2012, 110:560-565.
[76] PAUP V D, BARTON T L, EDWARDS C G, et al.Improving the chemical and sensory characteristics of red and white wines with pectinase-producing non-Saccharomyces yeasts[J].Journal of Food Science, 2022, 87(12):5402-5417.
[77] 王春晓, 俞俊竹, 周文亚, 等.非酿酒酵母属酵母的葡萄酒发酵应用研究进展[J].中国农业科学, 2023, 56(3):529-548.
WANG C X, YU J Z, ZHOU W Y, et al.Research progress on the application of non-Saccharomyces during wine fermentation[J].Scientia Agricultura Sinica, 2023, 56(3):529-548.
[78] SU C, ZHANG K Z, CAO X Z, et al.Effects of Saccharomycopsis fibuligera and Saccharomyces cerevisiae inoculation on small fermentation starters in Sichuan-style Xiaoqu liquor[J].Food Research International, 2020, 137:109425.
[79] LI W W, FAN G S, FU Z L, et al.Effects of fortification of Daqu with various yeasts on microbial community structure and flavor metabolism[J].Food Research International, 2020, 129:108837.
[80] BENITO S, HOFMANN T, LAIER M, et al.Effect on quality and composition of Riesling wines fermented by sequential inoculation with non-Saccharomyces and Saccharomyces cerevisiae[J].European Food Research and Technology, 2015, 241(5):707-717.
[81] BALIKCI E K, TANGULER H, JOLLY N P, et al.Influence of Lachancea thermotolerans on cv.Emir wine fermentation[J].Yeast, 2016, 33(7):313-321.
[82] KAPSOPOULOU K, MOURTZINI A, ANTHOULAS M, et al.Biological acidification during grape must fermentation using mixed cultures of Kluyveromyces thermotolerans and Saccharomyces cerevisiae[J].World Journal of Microbiology and Biotechnology, 2007, 23(5):735-739.
[83] GE Q, GUO C F, YAN Y, et al.Contribution of non-Saccharomyces yeasts to aroma-active compound production, phenolic composition and sensory profile in Chinese Vidal icewine[J].Food Bioscience, 2022, 46:101152.
[84] LI S Q, BI P F, SUN N, et al.Characterization of different non-Saccharomyces yeasts via mono-fermentation to produce polyphenol-enriched and fragrant kiwi wine[J].Food Microbiology, 2022, 103:103867.
[85] LIU J, LIU M, YE P, et al.Characterization of major properties and aroma profile of kiwi wine co-cultured by Saccharomyces yeast (S.cerevisiae, S.bayanus, S.uvarum) and T.delbrueckii[J].European Food Research and Technology, 2020, 246(4):807-820.
[86] LI S Q, CHEN X W, GAO Z Y, et al.Enhancing antioxidant activity and fragrant profile of low-ethanol kiwi wine via sequential culture of indigenous Zygosaccharomyces rouxii and Saccharomyces cerevisiae[J].Food Bioscience, 2023, 51:102210.