睡眠不足是现代社会普遍存在的一个突出问题。睡眠不足导致白天过度困倦的发生率在9%~24%。睡眠不足被定义为在过去4周内每晚6 h睡眠或更少。睡眠剥夺可能会影响学习能力和形成新记忆的能力,特别是对海马体依赖性记忆任务的巩固敏感[1]。越来越多的证据表明,睡眠剥夺可能导致神经炎症、氧化应激、突触可塑性、神经递质、基因表达和蛋白质合成的变化,从而引发认知记忆衰退[2]。
天然产物,例如来自海洋生物的生物活性材料和多糖,被认为是神经保护剂的宝贵来源[3]。壳聚糖低聚糖(chitooligosaccharide, COS)是一种来自壳聚糖的低聚糖,其聚合度(degree of polymerization, DP)<20,Mw<3 900。由于其相对分子质量低、水溶性良好、黏度低、易吸收的特性和其他生物活性,成为了有价值的功能成分。最近研究表明,COS在体外和体内均具有良好的血脑屏障(blood-brain barrier, BBB)渗透能力[4]。文献证据显示,一些相对分子质量<500的疏水性化合物和极性分子可以通过特定的运输工具穿过BBB进入内皮细胞。因此,COS在体外和体内的良好的神经保护作用,引起了研究人员的兴趣。WANG等[5]证明,COS通过减少α-突触核蛋白的过度表达,减轻神经炎症,激活PI3K/Akt(phosphotylinosital 3 kinase/protein kinase B)途径,对帕金森小鼠的神经行为障碍有良好的作用。DAI等[6]证明,COS可以通过抑制β淀粉样蛋白1-42纤维的形成和分解预先形成的纤维,成为预防和治疗阿尔兹海默症的新型治疗剂。ZHANG等[7]证明,COS可以通过调节核因子E2相关因子2/抗氧化反应元件信号通路保护神经元SH-SY5Y细胞免受氧化损伤和凋亡。WU等[8]证明,COS对新生大鼠缺氧缺血性脑损伤具有较好的神经保护作用,可改善早期神经反射行为,减少氧化应激损伤,减轻炎症反应。
目前,对壳寡糖的生物活性的研究大多是用混合物进行的。然而,不同MW、DP、脱乙酰化程度(degree of deacetylation, DD)和浓度的COS被证明具有各种治疗效果。LI等[9]通过使用DP为2~6的COS测试抗氧化活性,发现低DP的COS显示出更好的羟自由基清除效果,并具有更好的还原能力。前期采用不同DP(2~5)的COS预防干预给药后,对帕金森病均有显著性的预防缓解作用,其中壳三糖(chitotriose,COS3)和壳五糖(chitopentaose,COS5)对多巴胺能神经元的保护作用优于壳二糖和壳四糖[10]。
本研究采用改良多平台水环境法(modified multiple platform method, MMPM)建立小鼠睡眠剥夺模型,通过新物体识别测定小鼠的学习记忆能力,并探究COS3和COS5对睡眠剥夺造成的学习记忆下降的改善作用及其潜在机制。
1 材料与方法
1.1 实验动物、材料与试剂
60只SPF级7周龄C57BL/6J雄性小鼠,由北京斯贝福生物技术有限公司提供,实验动物许可证号为SCXK(京)2019-0010。
COS3、COS5,实验室自制[10];RIPA(radio immunoprecipitation assay)裂解液、苯甲磺酰氟(phenylmethanesulfonyl fluoride, PMSF)、二喹啉甲酸(bicinchoninic acid, BCA)试剂盒、5×上样缓冲液、电泳胶配制液、脱脂奶粉、一抗稀释液、磷酸酶抑制剂、β-actin抗体、羊抗鼠免疫球蛋白G(H+L)抗体、羊抗兔免疫球蛋白G(H+L)抗体、苏木精伊红(hematoxylin and eosin, HE)染色试剂盒、超氧化物歧化酶(superoxide dismutase, SOD)、总抗氧化能力(total antioxidant capacity, T-AOC)试剂盒,碧云天生物技术有限公司;丙二醛(malondialdehyde, MDA)试剂盒,南京建成生物工程研究所;PI3K、p-PI3K(phospho-phosphotylinosital 3 kinase)、Akt、p-Akt(phospho-protein kinase B)抗体,Affinity Biosciences公司;聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜,美国Merck &Millipore公司;增强型化学发光(enhanced chemiluminescence,ECL)显影液,天能生物公司;其他试剂均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
新物体识别系统,江南大学动物实验中心;Axio Vert A1 型倒置荧光显微镜,德国蔡司公司;ASP 200S型组织脱水机、1150H型石蜡包埋机、RM2245型手动轮转切片机,德国莱卡公司;SCIENTZ-48型高通量组织研磨器,宁波新芝生物科技股份有限公司;4K15型冷冻离心机,德国Sigma公司;Tanon-1000型凝胶成像仪,上海天能科技有限公司;DYY-8C 型电泳仪,北京市六一仪器厂;UV-1800型紫外-可见分光光度计,日本岛津公司;FC全自动酶标仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 动物分组和睡眠剥夺模型建立
将60只C57BL/6J小鼠随机分为4 组,每组15只,分别为空白组、模型组、COS3组、COS5组。实验动物饲养于江南大学动物实验中心,按照SPF小鼠饲养标准,给予小鼠以12 h为周期的光照循环,保持饲养温度为(22±2) ℃,空气湿度为40%~70%。每笼5只小鼠,并在适应环境7 d后,使用耳标钳,对每只小鼠进行标记。每7 d更换灭菌垫料,每天称量小鼠体重。所有动物实验操作都通过江南大学实验管理与动物福利委员会的审核,伦理审核的编号为JN.No20220615c0600901[201]。
采用MMPM法建立睡眠剥夺模型。实验箱均为20 cm×30 cm×40 cm的透明箱,其中模型组的箱子底部安置20个小平台,直径3 cm,高5 cm,每个平台间隔4 cm;空白组的箱底安置15个大平台,直径12 cm,高5 cm。把模型组、COS3组和COS5组的小鼠放到小平台上,小鼠进入睡眠后,由于肌张力降低而接触水或掉到水中,突然惊醒,利用啮齿类动物畏水的生活习性,促使小鼠站立在水平台上;把空白组小鼠放到大平台上,小鼠可以正常睡眠。在箱内装入清水,使水面低于平台约1 cm,箱顶盖上笼盖,放置水瓶和饲料,小鼠可在平台间活动,每天及时更换箱内的水。小鼠每天在箱内活动20 h后,放回小鼠饲养笼内休息4 h。在睡眠剥夺过程(PD8~PD28,共21 d)中,观察记录各组小鼠的精神状态,每天称量小鼠的体重,连续称量3周,称重后根据体重进行灌胃。正式实验开始前将小鼠置于睡眠剥夺箱适应5 d,每日1次,每次2 h。
1.3.2 COS干预给药
通过灌胃法对小鼠进行给药,给药情况如下:根据国家关于COS作为“食品新原料”的规定[11],COS的每人每日推荐量为≤0.5 g,换算成每只小鼠每日剂量为65 mg/kg(以体重计)。用生理盐水将COS3和COS5配制成质量浓度为6.5 mg/mL的溶液,给药体积为0.1 mL/10 g体重,给药周期为PD8~PD28,共给药21 d。每天对COS3组和COS5组分别进行灌胃,空白组和模型组灌胃相同剂量生理盐水。
1.3.3 新物体识别实验
新物体识别实验分为学习阶段和测试阶段,2个阶段间隔24 h。1)学习阶段:将2个完全相同的物体放在靠近箱体一侧壁的两端,将小鼠从积木对面墙面的中心点背对积木放下,让小鼠在箱体内自由探索10 min,记录学习阶段小鼠探索2个完全相同物体A1、A2的时间;2)测试阶段:间隔24 h后,将其中的一个物体换成新的物体B,让小鼠在箱体内自由探索10 min,记录测试阶段小鼠探索新物体和旧物体的时间以及辨别指数(discrimination index, DI)。DI的计算如公式(1)所示:
(1)
式中:t1,新物体探索时间;t2,旧物体探索时间。
1.3.4 小鼠脑组织取材
各组小鼠腹腔注射质量分数为5%的戊巴比妥钠溶液(10 mL/kg体重),麻醉后脱臼处死,在冰盒上取出全脑,分离出左右海马体,-80 ℃保存,用于后续蛋白免疫印迹测定。同时每组随机选择3只小鼠,腹腔注射质量分数为5%的戊巴比妥钠溶液(10 mL/kg体重),麻醉后用磷酸盐缓冲液(0.01 mol/L、pH 7.4)进行心脏灌注,灌注结束后脱臼处死小鼠,于冰上分离全脑,置于质量分数为4%的多聚甲醛溶液中,用于后续HE染色实验。
1.3.5 HE染色
取1.3.4节固定于多聚甲醛溶液中的小鼠全脑,经过脱水、浸蜡包埋、切片、展片、烘片、水化、复水、HE染色、复水、封片处理后,采用倒置荧光显微镜观察小鼠海马区神经细胞的组织形态。
1.3.6 海马氧化还原状态的测定
取1.3.4节冻存在-80 ℃的海马组织,参考试剂盒说明书测定海马中SOD、MDA、T-AOC水平,结果以蛋白质含量计。
1.3.7 蛋白质免疫印迹测定海马蛋白表达
取1.3.4节冻存在-80 ℃的海马组织,向每10 mg海马样本中加入100 μL的RIPA裂解液,匀浆后在冰上裂解30 min,离心后测定上清液的蛋白含量,根据溶液体积加入上样缓冲液,煮沸使蛋白变性。SDS-PAGE凝胶,每孔上样20~40 μg,待溴酚蓝跑到底,停止电泳,将目标条带切下,在250 mA恒定电流作用下进行转膜。转膜结束后,用TBST(Tris buffered saline with Tween-20)洗涤膜3次,每次5 min。然后用质量分数为5%的脱脂乳封闭2 h,封闭结束后,用TBST洗涤膜3次。采用一抗稀释液稀释一抗:PI3K(体积比1∶1 000)、Akt(体积比1∶1 000)、p-PI3K(体积比1∶500)、p-Akt(体积比1∶500),将膜在4 ℃下与一抗孵育过夜。用TBST洗涤膜5次,每次5 min。然后与相应的二抗(体积比1∶1 000)常温孵育2 h,用TBST洗涤膜5次,每次5 min。采用ECL工作液进行显影拍照,并用ImageJ进行光密度分析计算,进行显著性分析。
1.3.8 数据分析与绘图
采用SPSS 19.0进行单因素(ANOVA)检验和方差齐性检验,事后检验采用Duncan法,P<0.05表示有显著差异。数据用平均值±标准偏差表示,采用GraphPad Prism 9.0进行图表绘制。
2 结果与分析
2.1 COS3和COS5对睡眠剥夺小鼠体重及精神状态的影响
体重减轻、精神状态下降是睡眠剥夺小鼠造模成功的典型性状之一。如图1所示,在睡眠剥夺初期(0~6 d),空白组小鼠体重呈现轻微下降的趋势,而在睡眠剥夺后期,空白组小鼠体重逐渐增长至初始体重。模型组小鼠从睡眠剥夺开始体重显著降低,与空白组相比,模型组小鼠第21天的体重显著降低9.16%(P<0.01)。而COS3和COS5均能够在一定程度上缓解睡眠剥夺小鼠的体重下降,其中COS3组小鼠的体重显著增加3.52%(P<0.01)。结果表明,COS3和COS5均能够改善睡眠剥夺小鼠的体重下降,效果为COS3>COS5。同时,模型组小鼠在睡眠剥夺初期出现互相攻击增多、烦躁不安的表现,随着造模时间的增加,小鼠出现精神萎靡、行为呆板、落水明显增加、对外界反应迟钝等症状。与模型组相比,COS3组和COS5组小鼠落水明显减少,精神状态得到显著改善。
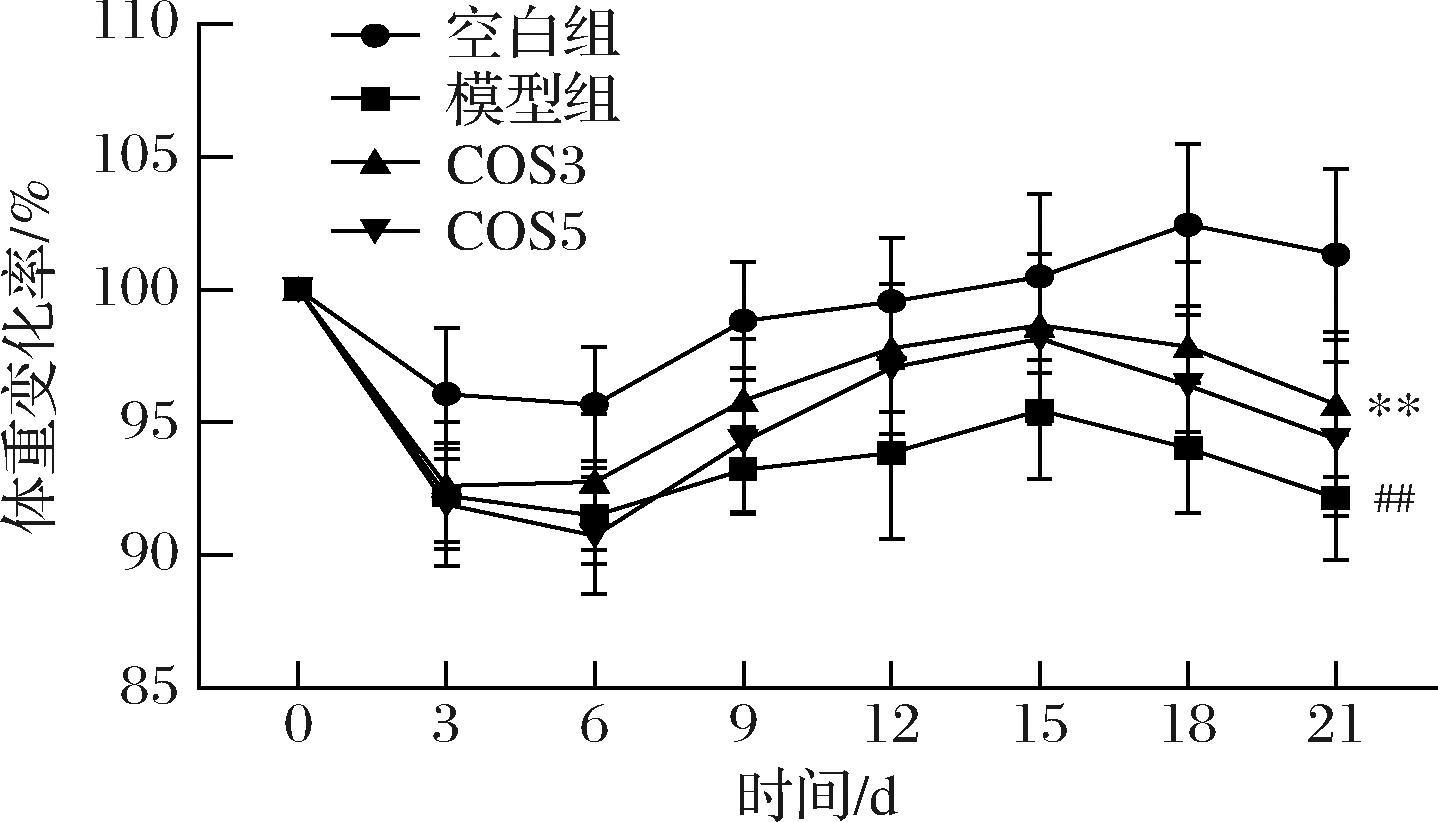
图1 COS3和COS5对睡眠剥夺小鼠体重变化率的影响
Fig.1 Effects of COS3 and COS5 on body weight change rate of sleep-deprived mice
注:#与空白组比较差异显著(P<0.05);##与空白组比较差异极显著(P<0.01);*与模型组比较差异显著(P<0.05);**与模型组比较差异极显著(P<0.01)(下同)。
睡眠剥夺对小鼠体重的影响是多方面的,除了内分泌系统的紊乱,也会导致焦虑、消极等情绪变化。实验初期的体重下降可以部分归因于小鼠对睡眠剥夺中水环境的不适应。短时间(0~6 d)的睡眠剥夺带来的焦虑行为导致了小鼠活动量增加,体重呈下降趋势,而在长时间(9~21 d)的睡眠剥夺后,小鼠的焦虑行为向消极行为转变,能量消耗减小,因此也带来体重的回升[12]。LI等[13]发现,患肠应激综合征(irritable bowel syndrome, IBS)会出现明显的抑郁症相关焦虑行为,而COS可以通过穿透BBB改善IBS引发的小鼠抑郁样行为,这也与本实验的结果一致。
2.2 COS3和COS5对睡眠剥夺小鼠学习记忆能力的影响
对新物体的偏好降低程度是判断睡眠剥夺小鼠学习记忆障碍的重要指标之一。由表1可知,在学习阶段中,各组小鼠对2个物体A1、A2的探索时间均无显著差异。由图2可知,在测试阶段中,与空白组相比,模型组的DI值基本为0(P<0.01),说明模型组小鼠经过学习后未对旧物体形成深刻记忆,睡眠剥夺明显造成了工作记忆能力的缺陷,这与许多研究结果一致[14]。与模型组相比,COS3组和COS5组的DI显著增加(P<0.01),其中,COS3的DI比COS5高11.49%。
表1 学习阶段小鼠对物体A1、A2的探索时间 单位:s
Table 1 Exploration time of object A1 and A2 in mice during learning phase

物体空白组模型组COS3组COS5组A116.49±0.6117.12±3.3118.26±5.4919.99±3.44A217.29±3.0419.98±3.2120.96±3.2718.67±1.14
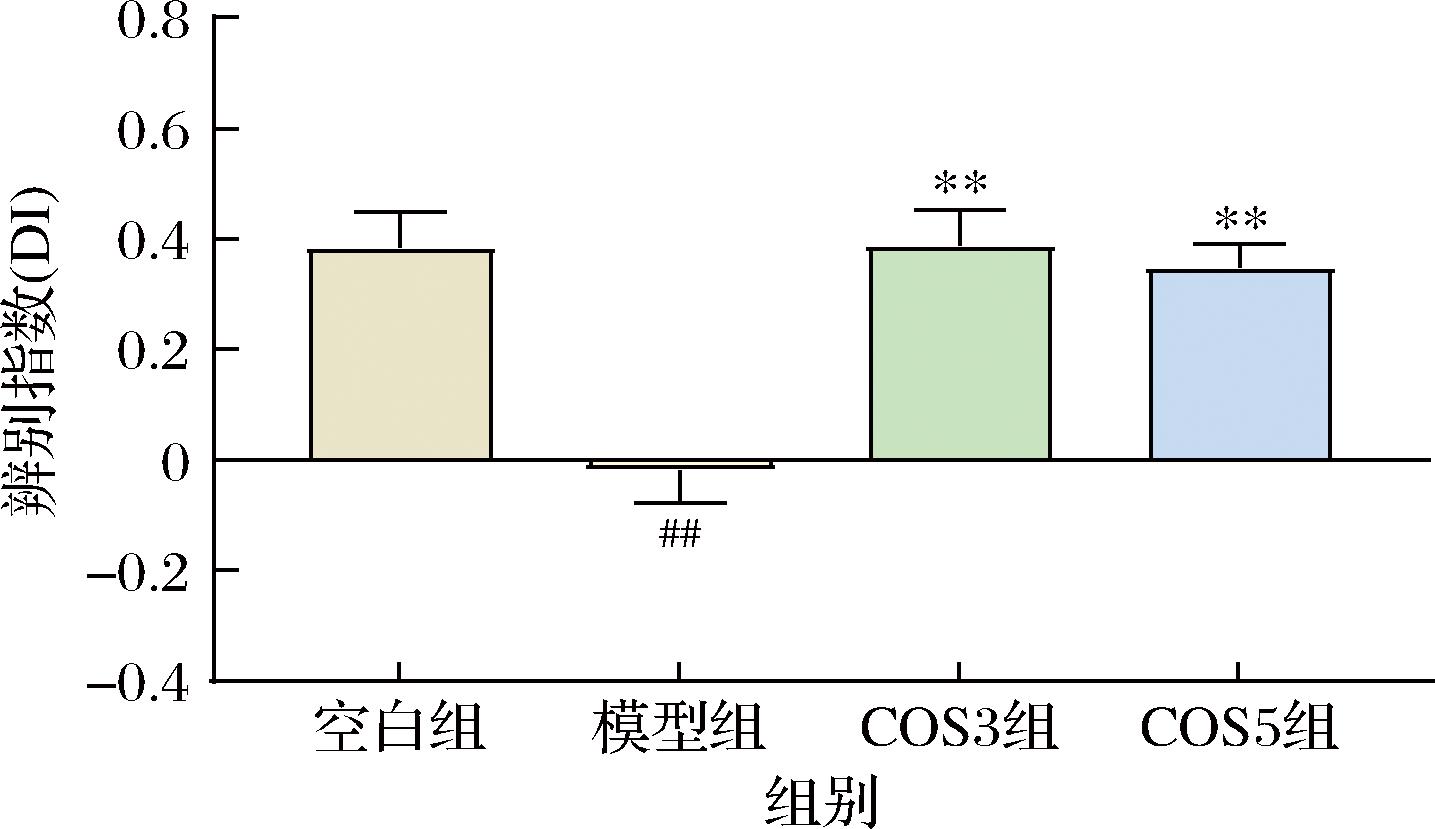
图2 测试阶段COS3和COS5对睡眠剥夺小鼠辨别指数的影响
Fig.2 Effects of COS3 and COS5 on discrimination index in sleep-deprived mice during testing phase
新物体识别测试是一种高度验证海马相关认知功能的方法。利用小鼠对新颖物体的偏好特性,经过学习后,在自然条件下对新旧物体进行探索。在LIU等[15]的报道中,小鼠由于患肝性脑病导致认知障碍、学习和记忆迟缓等缺陷,在口服COS后得到显著缓解,100 mg/kg COS干预可以显著提高肝性脑病小鼠在探索新物体上花费的时间以及DI,与本研究结果一致。结果表明,COS3和COS5干预能够显著改善睡眠剥夺导致的小鼠学习记忆能力下降,效果为COS3>COS5。
2.3 COS3和COS5对睡眠剥夺小鼠脑组织病理学的影响
学习记忆能力受大脑中多个部位的影响,而其中联系最密切的是海马体。有研究表明,无论是完全性睡眠剥夺还是部分睡眠剥夺,都会不同程度地造成海马区神经元细胞的损伤[16]。由图3可知,与空白组相比,模型组脑神经细胞出现明显固缩变形,细胞间隙变大,且排列不规则,有一部分神经细胞出现坏死,说明睡眠剥夺导致小鼠脑组织形态损伤明显。与模型组相比,COS3组和COS5组小鼠脑组织形态明显恢复,神经细胞排列紧密,层次清楚,细胞整体结构完整、细胞核清晰。病理学结果表明COS3和COS5对缓解睡眠剥夺小鼠的脑神经细胞损伤有一定作用。JIANG等[17]研究发现,壳寡糖具有促进周围神经再生的作用,在5种COS单体中,COS3对于促进背根神经节外植体的神经元生长具有最好的效果。
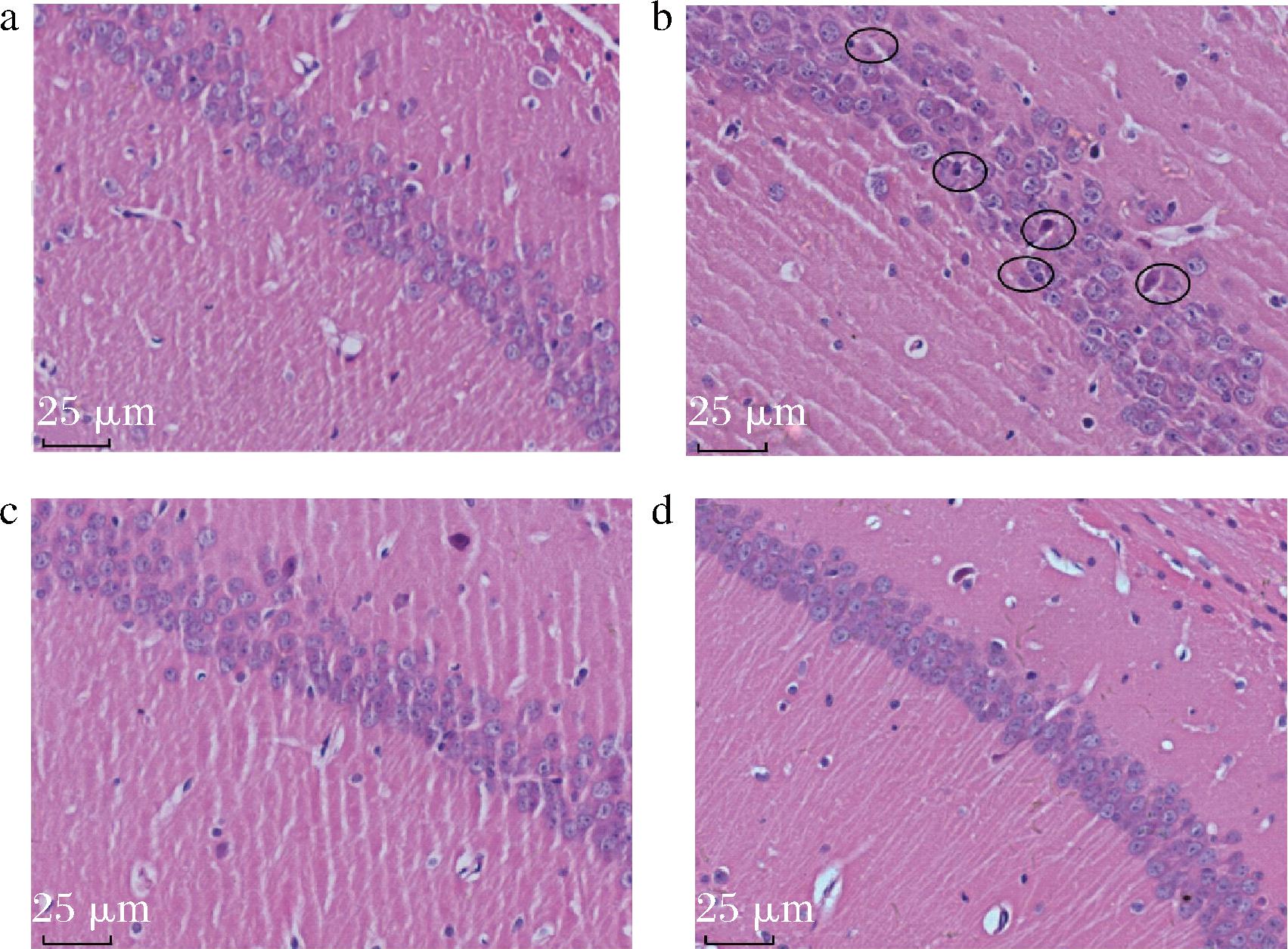
a-空白组;b-模型组;c-COS3组;d-COS5组
图3 COS3和COS5对睡眠剥夺小鼠脑组织形态的影响(400×)
Fig.3 Effects of COS3 and COS5 on brain tissue morphology in sleep-deprived mice(400×)
2.4 COS3和COS5对睡眠剥夺小鼠海马氧化应激损伤的影响
睡眠缺失会诱导氧化应激,中枢神经系统特别容易受到氧化应激的影响,导致MDA水平上升,SOD和T-AOC水平下降[18]。海马是最容易受到氧化应激损伤的脑区之一。由图4-a和图4-b可知,与空白组相比,模型组海马SOD和T-AOC水平分别显著降低30.96%和56.09%(P<0.01)。经过COS3和COS5干预后,与模型组相比,COS3组和COS5组的SOD水平分别显著上升27.23%、20.97%(P<0.01);COS3组和COS5组的T-AOC水平分别显著上升92.91%、81.49%(P<0.01)。效果为COS3>COS5。由图4-c可知,与空白组相比,模型组海马MDA水平显著升高67.08%(P<0.01)。经过COS3和COS5干预后,与模型组相比,COS3组和COS5组的MDA水平分别显著下降24.67%、23.81%(P<0.01)。效果为COS3>COS5。
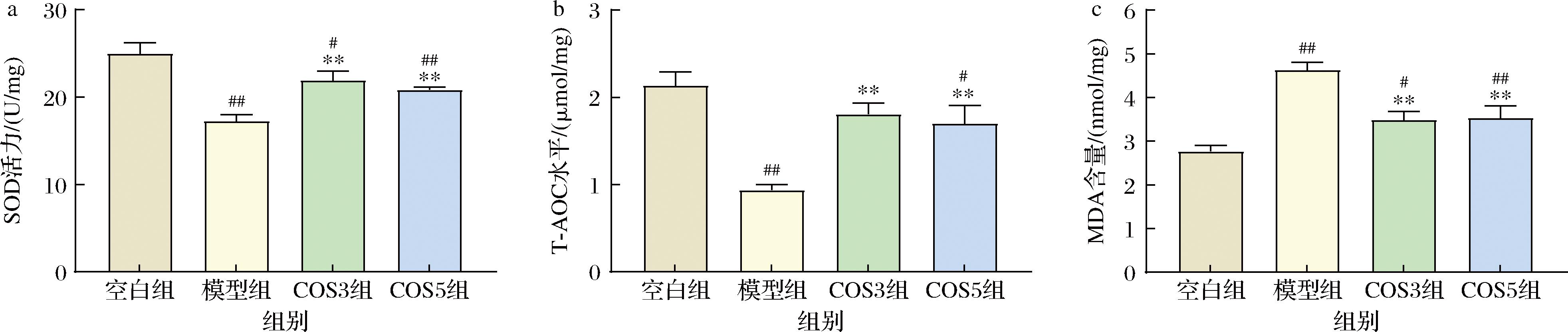
a-SOD水平;b-T-AOC水平;c-MDA水平
图4 COS3和COS5对睡眠剥夺小鼠海马氧化损伤的影响
Fig.4 Effects of COS3 and COS5 on hippocampal oxidative damage in sleep-deprived mice
神经细胞的氧化应激是导致认知障碍的重要途径。MDA是脂质过氧化的产物,是氧化应激最敏感的指标之一,小鼠海马MDA含量变化可以间接反映出细胞氧化损伤程度[19]。SOD是机体内重要的抗氧化剂,异常的SOD活动与神经紊乱有关。而T-AOC是指抗氧化酶和抗氧化物等构成的总抗氧化水平。陈逸伦[20]发现每日45 mg/kg体重COS干预能显著缓解酒精诱导的抗氧化酶活力的下降,提高新生SD大鼠的清除自由基和抗氧化的能力,改善酒精性神经损伤。K SADERE等[21]研究发现每日200 mg/kg体重COS可以抑制镉诱导的海马组织中MDA含量增加,缓解脑组织中由于超氧自由基的过量产生介导的脂质过氧化,并通过提高海马中抗氧化剂SOD活性,保护Wistar大鼠脑组织神经细胞。李克成[22]研究发现,低聚合度的壳寡糖具有更强的羟自由基清除活性和还原能力,在所有壳寡糖样品中,COS3的羟自由基清除活性最高,与本实验研究结果一致。本实验结果从氧化应激角度印证了COS3和COS5具有较好的神经保护作用,效果为COS3>COS5。
SADERE等[21]研究发现每日200 mg/kg体重COS可以抑制镉诱导的海马组织中MDA含量增加,缓解脑组织中由于超氧自由基的过量产生介导的脂质过氧化,并通过提高海马中抗氧化剂SOD活性,保护Wistar大鼠脑组织神经细胞。李克成[22]研究发现,低聚合度的壳寡糖具有更强的羟自由基清除活性和还原能力,在所有壳寡糖样品中,COS3的羟自由基清除活性最高,与本实验研究结果一致。本实验结果从氧化应激角度印证了COS3和COS5具有较好的神经保护作用,效果为COS3>COS5。
2.5 COS3和COS5对睡眠剥夺小鼠PI3K/Akt相对表达水平的影响
PI3K/Akt通路是胞内信号传导途径,与细胞代谢、增殖、存活和生长密切相关[23]。睡眠剥夺可降低海马体Akt、PI3K的磷酸化水平[24]。由图5可知,各组小鼠的PI3K和Akt蛋白水平没有显著差异。与空白组相比,模型组海马p-PI3K/PI3K和p-Akt/Akt表达水平分别显著下降60.24%、46.31%(P<0.01),说明睡眠剥夺抑制了小鼠海马PI3K/Akt信号通路。经过COS3和COS5干预后,与模型组相比,COS3组和COS5组p-PI3K/PI3K表达水平显著提升52.20%和50.94%(P<0.01);COS3组和COS5组p-Akt/Akt表达水平显著提升98.15%和88.08%(P<0.01),说明COS3和COS5干预可能通过上调PI3K和Akt的磷酸化蛋白水平,激活PI3K/Akt信号通路,效果为COS3>COS5。

a-p-PI3K的相对表达量;b-p-Akt的相对表达量
图5 COS3和COS5对睡眠剥夺小鼠海马PI3K、p-PI3K、Akt、p-Akt表达的影响
Fig.5 Effects of COS3 and COS5 on expression of PI3K, p-PI3K, Akt, and p-Akt in hippocampus of sleep-deprived mice
磷脂酰肌醇3-激酶(PI3K)能够激活蛋白激酶B(Akt),并积极参与自噬的调节。Akt是丝氨酸/苏氨酸激酶,是PI3K信号转导途径中的一个主要下游目标。它是促进细胞生存、抑制细胞凋亡和维持正常功能的关键信号分子。睡眠剥夺会导致PI3K/Akt信号通路活性降低,引发神经细胞凋亡和记忆认知障碍。激活PI3K/Akt信号通路能够预防睡眠剥夺诱导的神经细胞凋亡和丢失,发挥神经保护作用,该过程由一系列下游底物的丝氨酸或苏氨酸磷酸化介导。LI等[23]发现丹参酮IIA对大鼠急性睡眠剥夺所致认知障碍具有神经保护作用,其作用机制可能是激活海马区CNR1/PI3K/AKT通路,增加p-PI3K和p-Akt的表达,改善海马神经元细胞损伤,抑制海马细胞细胞凋亡。CAO等[24]发现莫达非尼增强了PI3K和Akt的磷酸化,通过激活PI3K/Akt信号通路减轻海马神经元的过度自噬。另外,Akt的激活与其磷酸化位点Thr308和Ser473密切相关,Akt的激活主要依赖于Ser473的磷酸化[25]。本研究结果表明,磷酸化位点为Ser473的p-Akt在睡眠剥夺小鼠海马中的表达量显著降低,而COS3和COS5干预逆转了这种降低;然而,Akt的蛋白水平无显著变化,说明Akt是通过其磷酸化途径发挥作用的。越来越多的研究表明,COS能够通过刺激PI3K/Akt信号通路保护不同来源的神经元,例如皮层神经细胞、海马神经细胞和小脑颗粒神经细胞。XU等[26]发现COS可能通过调节PI3K/Akt信号通路对培养的皮层神经元发挥神经保护作用,并且COS的抗细胞凋亡作用可以被PI3K的化学抑制所阻断。贾鹏[27]发现COS可减缓H2O2诱导的细胞,这种保护作用依赖于胞内PI3K/Akt信号转导通路活性的增强。因此,本研究结果表明,COS3和COS5可能通过上调p-PI3K和p-Akt的表达,激活PI3K/Akt信号通路来抑制睡眠剥夺诱导的小鼠海马神经细胞凋亡。YANG等[28]研究发现COS能够通过PI3K/Akt信号通路激活RAW 264.7细胞,其中α-COS比β-COS更具活性。在帕金森模型中,COS3表现出更好的多巴胺能神经元保护作用[10]。这些研究结果与本研究结果一致,COS3和COS5可能通过上调p-PI3K和p-Akt水平,激活PI3K/Akt信号通路,效果为COS3>COS5。
3 结论
本研究结果表明,COS3和COS5干预对睡眠剥夺小鼠的学习记忆能力均有一定程度的改善作用,在新物体识别实验中能显著改善睡眠剥夺小鼠的学习记忆能力,其发挥作用的机制可能是通过降低小鼠海马氧化应激损伤,激活PI3K/Akt信号通路,从而抑制海马区神经细胞凋亡,发挥对睡眠剥夺小鼠海马神经细胞保护的效果。从本文所检测的指标来分析,与COS5组相比,相同剂量的COS3干预对睡眠剥夺小鼠体重减轻、DI降低、氧化应激和PI3K、Akt的磷酸化水平下降具有更好的抑制作用,这可能是由于COS3的聚合度低于COS5的缘故,具体的原因需要深入探究。COS3和COS5对睡眠剥夺造成的学习记忆下降的改善作用及其潜在机制还有待于进一步研究,后续研究可以围绕神经炎症、突触可塑性等其他方面开展。
[1] CHATTU V K, MANZAR M D, KUMARY S, et al.The global problem of insufficient sleep and its serious public health implications[J].Healthcare, 2018, 7(1):7010001.
[2] XUE R, WAN Y H, SUN X Q, et al.Nicotinic mitigation of neuroinflammation and oxidative stress after chronic sleep deprivation[J].Frontiers in Immunology, 2019, 10:2546.
[3] PANGESTUTI R, KIM S K.Marine-derived bioactive materials for neuroprotection[J].Food Science and Biotechnology, 2013, 22(5):1-12.
[4] ZHU L M, LI R L, JIAO S M, et al.Blood-brain barrier permeable chitosan oligosaccharides interfere with β-amyloid aggregation and alleviate β-amyloid protein mediated neurotoxicity and neuroinflammation in a dose- and degree of polymerization-dependent manner[J].Marine Drugs, 2020, 18(10):488.
[5] WANG B, WANG L, QU Y F, et al.Chitosan oligosaccharides exert neuroprotective effects via modulating the PI3K/Akt/Bcl-2 pathway in a Parkinsonian model[J].Food &Function, 2022, 13(10):5838-5853.
[6] DAI X L, HOU W Q, SUN Y X, et al.Chitosan oligosaccharides inhibit/disaggregate fibrils and attenuate amyloid β-mediated neurotoxicity[J].International Journal of Molecular Sciences, 2015, 16(5):10526-10536.
[7] ZHANG X X, LIANG S, GAO X H, et al.Protective effect of chitosan oligosaccharide against hydrogen peroxide-mediated oxidative damage and cell apoptosis via activating Nrf2/ARE signaling pathway[J].Neurotoxicity Research, 2021, 39(6):1708-1720.
[8] WU W, WEI W, LU M, et al.Neuroprotective effect of chitosan oligosaccharide on hypoxic-ischemic brain damage in neonatal rats[J].Neurochemical Research, 2017, 42(11):3186-3198.
[9] LI K C, XING R E, LIU S, et al.Separation of chito-oligomers with several degrees of polymerization and study of their antioxidant activity[J].Carbohydrate Polymers, 2012, 88(3):896-903.
[10] 汪玲. 单一聚合度壳寡糖的分离及其对帕金森模型小鼠的神经保护作用研究[D].无锡:江南大学, 2022.
WANG L.Separation of chitosan oligosaccharide monomers with single degree of polymerization and the study of their neuroprotection in parkinsonian mice model[D].Wuxi:Jiangnan University, 2022.
[11] 国家卫生计生委. 关于批准壳寡糖等6种新食品原料的公告(2014年第6号)[J].中国食品添加剂, 2014(4):177-179.
National Health and Family Planning Commission.Announcement on the approval of six new food ingredients, including chitosan (No.6 of 2014)[J].China Food Additives, 2014(4):177-179.
[12] MARTINS P J F, D’ALMEIDA V, NOBREGA J N, et al.A reassessment of the hyperphagia/weight-loss paradox during sleep deprivation[J].Sleep, 2006, 29(9):1233-1238.
[13] LI X, LIU Q Q, YU J Y, et al.Costunolide ameliorates intestinal dysfunction and depressive behaviour in mice with stress-induced irritable bowel syndrome via colonic mast cell activation and central 5-hydroxytryptamine metabolism[J].Food &Function, 2021, 12(9):4142-4151.
[14] XU Z Q, GAO C Y, FANG C Q, et al.The mechanism and characterization of learning and memory impairment in sleep-deprived mice[J].Cell Biochemistry and Biophysics, 2010, 58(3):137-140.
[15] LIU P, LI H, XU H Y, et al.Chitooligosaccharides attenuated hepatic encephalopathy in mice through stabilizing gut-liver-brain disturbance[J].Molecular Nutrition &Food Research, 2023, 67(1):e2200158.
[16] GUAN Z W, PENG X W, FANG J D.Sleep deprivation impairs spatial memory and decreases extracellular signal-regulated kinase phosphorylation in the hippocampus[J].Brain Research, 2004, 1018(1):38-47.
[17] JIANG M R, GUO Z M, WANG C P, et al.Neural activity analysis of pure chito-oligomer components separated from a mixture of chitooligosaccharides[J].Neuroscience Letters, 2014, 581:32-36.
[18] SALEHPOUR F, FARAJDOKHT F, ERFANI M, et al.Transcranial near-infrared photobiomodulation attenuates memory impairment and hippocampal oxidative stress in sleep-deprived mice[J].Brain Research, 2018, 1682:36-43.
[19] TSIKAS D.Assessment of lipid peroxidation by measuring malondialdehyde (MDA) and relatives in biological samples:Analytical and biological challenges[J].Analytical Biochemistry, 2017, 524:13-30.
[20] 陈逸伦. 壳寡糖对新生大鼠酒精性神经损伤的缓解作用研究[D].无锡:江南大学, 2021.
CHEN Y L.Effect of chitooligosaccharide on ethanol-induced nerve injury in neonatal rats[D].Wuxi:Jiangnan University, 2021.
[21] K SADERE
SADERE ![]() KARAMAN M, AYD
KARAMAN M, AYD N M F, et al.The protective effects of chitosan oligosaccharide (COS) on cadmium-induced neurotoxicity in Wistar rats[J].Archives of Environmental &Occupational Health, 2022, 77(9):755-763.
N M F, et al.The protective effects of chitosan oligosaccharide (COS) on cadmium-induced neurotoxicity in Wistar rats[J].Archives of Environmental &Occupational Health, 2022, 77(9):755-763.
[22] 李克成. 单一聚合度和特定N-乙酰化壳寡糖的分离及抗氧化活性研究[D].北京:中国科学院大学, 2013.
LI K C.Study on separation and antioxidant activity of chitosan oligosaccharide with single polymerization degree and specific N-acetylation[D].Beijing:University of Chinese Academy of Sciences, 2013.
[23] LI Z H, CHENG L, WEN C, et al.Activation of CNR1/PI3K/AKT pathway by tanshinone IIA protects hippocampal neurons and ameliorates sleep deprivation-induced cognitive dysfunction in rats[J].Frontiers in Pharmacology, 2022, 13:823732.
[24] CAO Y, LI Q L, LIU L L, et al.Modafinil protects hippocampal neurons by suppressing excessive autophagy and apoptosis in mice with sleep deprivation[J].British Journal of Pharmacology, 2019, 176(9):1282-1297.
[25] WEI Y Z, ZHOU J Y, YU H Y, et al.AKT phosphorylation sites of Ser473 and Thr308 regulate AKT degradation[J].Bioscience, Biotechnology, and Biochemistry, 2019, 83(3):429-435.
[26] XU Y Y, ZHANG Q, YU S, et al.The protective effects of chitooligosaccharides against glucose deprivation-induced cell apoptosis in cultured cortical neurons through activation of PI3K/Akt and MEK/ERK1/2 pathways[J].Brain Research, 2011, 1375:49-58.
[27] 贾鹏. 壳寡糖减缓大鼠髓核细胞退变的实验研究[D].武汉:武汉大学, 2017.
JIA P.Chitosan oligosaccharides protect nucleus pulposus cells from degeneration in A rat experimental model[D].Wuhan:Wuhan University, 2017.
[28] YANG Y, XING R E, LIU S, et al.Immunostimulatory effects of chitooligosaccharides on RAW 264.7 mouse macrophages via regulation of the MAPK and PI3K/akt signaling pathways[J].Marine Drugs, 2019, 17(1):36.