黄酮类化合物是水果、食用或药用植物中广泛存在的一类重要的天然产物。该类化合物的结构是由苯环A和B通过3个不饱和碳原子相连(简称C6-C3-C6)构成,主要包括黄酮、黄酮醇、黄烷酮、异黄酮、查耳酮和花色素6个主要亚类。黄酮类化合物具有广泛的生物学活性,如抗氧化、抗炎、抗肿瘤等[1]。长期摄入富含黄酮类化合物的食物有助于健康状况的改善;美国的一项针对49 493名女性和27 842名男性进行的为期16年的调查报告显示,长期的摄入黄酮类化合物可显著降低主观认知能力下降的风险[2]。该类化合物在生物学和食品科学等领域具有重要的应用价值;研究表明,将木瓜黄酮添加至鸭肉中有利于延缓鸭肉蛋白氧化,发挥对肉制品的保鲜作用[3];范芳玉等[4]研究发现富含黄酮的刺梨果渣能够有效抑制红酸汤中菌落总数增长,从而延长其货架期;另有研究总结发现,将富含类黄酮的山楂添加至畜禽饲料中,可提高畜禽的生产性能和免疫能力等[5]。然而,由于其自身分子结构的原因,导致超过95%的黄酮类化合物在体内的生物利用度很低,只有极少部分能直接被吸收利用,大部分主要经肠道微生物的代谢转化后吸收或排出体外[6]。
人体肠道中栖居着数量庞大、种类繁多的微生物,这些微生物共同构成了宿主微生态系统的核心部分——肠道菌群。肠道菌群不仅在维护肠道屏障中扮演着重要的角色,同时它参与肠道与不同器官之间的对话,并在机体健康中发挥重要的调控作用。值得注意的是,不同肠道微生物能够产催化不同反应(如水解、氧化还原、脱羧、去甲基和环裂解反应)的微生物酶。因此,肠道菌群在膳食物质的吸收、代谢及转化方面同样发挥着无法取代的作用[7]。
已有研究表明,黄酮类化合物(如黄腐酚等)需要在体内肠道菌群的作用下发挥生物学功能[8]。流行病学研究和临床实验亦表明,黄酮类化合物的体内代谢产物在其生物学活性的发挥中具有主导作用[9]。因此,肠道菌群不仅能够代谢难以吸收的黄酮类化合物,而且在黄酮类化合物的生物学活性中扮演着至关重要的角色。目前,黄酮类化合物在体内代谢的重要性受到越来越多的关注,而剖析黄酮类化合物在体内的代谢规律及代谢转化后的生物学活性变化是阐释其促进健康作用机制的重要前提。因此,本文将解析黄酮类化合物在肠道菌群作用下的代谢反应,总结肠道微生物代谢黄酮类化合物后的生物学活性变化,为明确黄酮类化合物在体内发挥药效的物质基础提供一定的理论依据,为开发具有促进健康功效的小分子药物奠定基础。
1 肠道菌群对黄酮类化合物的代谢反应
肠道微生物酶代谢不同黄酮类化合物发生的反应一般包括去糖基化反应、去甲基化反应、脱羟基反应、还原反应以及环裂变反应等。以下将分别总结归纳黄酮类化合物在肠道菌群作用下的主要代谢反应类型,以期寻找黄酮类化合物在肠道中的代谢规律。
1.1 肠道菌群的去糖基化反应
肠道中不同的微生物群能产生不同的糖苷水解酶,如Enterococcus、Lactococcus和Escherichia中的一些微生物可产生葡萄糖苷酶,Bacteroides和Lactobacillus等中的一些微生物可产α-鼠李糖苷酶,一些Lactobacillus、Bifidobacterium、Escherichia等是β-半乳糖苷酶的微生物来源。大多黄酮类化合物在自然界中以苷类形式存在,主要包括两种形式:第一种为黄酮苷元与糖以O-糖苷键连接的黄酮类化合物,另一种方式为黄酮苷元与糖以C-糖苷键连接形成的黄酮C-糖苷。黄酮苷类化合物在肠道中发生的第一步代谢反应通常为,在糖苷水解酶和多糖裂解酶的作用下,黄酮苷中糖基与非糖基或糖基与糖基之间的糖苷键被水解为糖半缩醛或半缩酮及相应的游离糖苷配基。目前,大多关于肠道菌群对黄酮类化合物的去糖基化反应研究均集中于黄酮O-糖苷的代谢,比如:Bifidobacterium infantis INIA P728水解木犀草苷中的O-糖苷键转化为木犀草素[10];芦丁可在Bacteroides JY-6分泌的α-L-鼠李糖苷酶作用下转化为槲皮素3-O-葡萄糖苷;肠道中Escherichia coli K12产生的β-葡萄糖醛酸苷酶可水解黄芩苷的O-糖苷键生成黄芩素[11]。然而,C-糖苷键与O-糖苷键相比具有更高的稳定性,导致黄酮C-糖苷具有一定的糖苷水解酶耐受能力。一些肠道细菌如Enterococcaceae、Lachnospiraceae、Streptococcaceae的微生物可催化黄酮C-糖苷水解为相应的苷元[12];NAKAMURA等[13]研究发现肠道中一株与Dorea longicatena LCR19和Marseille-P2116具有98%同源性的菌株PUE,该菌株表达的微生物酶(DgpA、DgpB-DgpC复合物)可作用于葛根素中的C-糖苷键并生成黄豆苷元;另有研究人员从健康人群粪便中筛选得到能够催化黄酮8-C-糖苷如荭草苷和牡荆素发生去糖基化反应的肠道菌株Enterococcus avium W974-1[14]。然而,肠道中微生物繁多,能够催化黄酮C-糖苷发生去糖基化反应的肠道菌仍有待深入的挖掘。此外,不同黄酮类化合物由于结构和取代基的差异,受化合物空间位阻的影响,肠道菌群对该类化合物的降解效率也不同,因此,不同黄酮类化合物在肠道中的降解程度和体内的生物利用度受化合物结构、宿主肠道内环境、宿主肠道微生物组成和丰度等多方面因素影响。
黄酮苷类经肠道菌群代谢发生去糖基化反应后的化合物通常表现出更高的生物学活性,如黄芩素比同等剂量的黄芩苷表现出更高的黄嘌呤氧化酶抑制活性和抗病毒能力[15]。黄酮苷类化合物经去糖基化反应后生物学活性的升高可能与糖苷键的断裂和羟基的生成有关。研究发现,C-3、C-5和C-7位羟基是黄酮类化合物发挥抗氧化活性的重要基团,该3个羟基被糖基取代将削弱化合物的抗氧化活性[16]。
1.2 甲基化和去甲基化反应
肠道中的一些微生物群可以表达转移酶,并通过亲核取代反应移动反应底物中的官能团。黄酮类化合物的多位点(如C-2、C-3、C-4、C-5、C-6、C-7和C-8)均可发生甲基化修饰;比如:芦丁在肠道菌群分泌的甲基转移酶作用下生成甲基芦丁、甲基异槲皮素和甲基槲皮素硫酸盐[17]。此外,黄酮类化合物在肠道菌群产脱甲基酶的作用下发生去甲基化反应,如异黄腐酚在肠道中Eubacterium limosum的作用下转化为8-异戊烯基柚皮素[18],三甲基芹菜素在肠道中Blautia sp. MRG-PMF1产甲基转移酶的催化下转化为芹菜素[19]。
甲基转移酶是催化黄酮类化合物生成甲基化衍生物的一类重要酶。研究发现,一些黄酮类化合物经甲基化修饰后的生物利用度和亲脂性均有所提高,促进其与细胞膜结合从而更好的发挥生物学活性[20];一些甲氧基黄酮(如黄芩黄酮I和韧黄芩素I)与黄芩素相比具有更强的抗肝癌和肺癌细胞活性[21]。此外,O-甲基化修饰可以保护黄酮类化合物免受肝脏代谢的影响,从而提高其代谢稳定性。因此,黄酮类化合物在肠道中的甲基化修饰对于其体内生物学活性的发挥具有重要的影响。微生物转化法是获得甲基化黄酮的一种有效方式,目前研究较多的是在E.coli中过表达编码类黄酮O-甲基转移酶的基因[22],而从肠道中筛选具有编码甲基化转移酶能力的肠道菌仍需深入的探索,同时,采用基因编辑技术赋予不同肠道微生物菌株产甲基转移酶的能力是提高黄酮类化合物体内生物利用度及生物学活性的一个有效途径。
1.3 还原反应
肠道菌能表达不同的氧化还原酶,天然产物在这些酶的帮助下完成电子或氢原子的转移。还原反应是黄酮类化合物在体内代谢转化过程中的一个重要反应,且其反应产物表现为生物利用度提高和药理活性增加等特点。最新研究发现了一株可以代谢黄酮类化合物的肠道菌——Clostridium orbiscindens,该菌中的黄酮还原酶能够催化黄酮和黄酮醇C环结构上的C2和C3位上的双键加氢生成二氢黄酮和二氢黄酮醇[23]。一般黄酮类化合物在肠道微生物酶的作用下发生还原反应的位置为C环的C-2和C-3之间的双键。很多黄酮经去糖基化后的还原反应遵循木犀草素和芹菜素等的代谢规律;这两个化合物在人类粪便中Eubacterium ramulus、C. orbiscindens分泌的烯还原酶的作用下C环C-2和C-3之间的双键被还原成黄烷酮[24]。黄酮醇经去糖基化后发生的还原反应遵循槲皮素等化合物的代谢规律;槲皮素可以在E. ramulus、C. orbiscindens、Bacteroides fragilis、Clostridium perfringens作用下发生降解,还原C环C2和C3之间的双键,氧原子处发生裂解形成对应的互变异构体查耳酮[25]。以大豆苷为代表的异黄酮在发生还原反应时,大豆苷元在Clostridium sp. TM-40作用下被还原为二氢黄豆苷元[26],并在Slackia sp. NATTS等菌的作用下代谢为雌马酚[27];研究发现,大豆苷经代谢后的产物雌马酚具有更强的抗癌及抗氧化作用[28]。然而,黄酮类化合物在肠道中被还原的程度与肠道微生物系统密切关联,以大豆苷元的代谢为例,肠道中Clostridium sp. TM40仅可将大豆苷元还原为二氢大豆苷元,但不能将其还原为雌马酚,其进一步的代谢需借助Slackia sp. NATTS等菌的作用转化为雌马酚;表明虽然不同的肠道微生物菌株均具有催化黄酮发生还原反应的能力,但不同菌株催化还原反应的过程及顺序存在差异性。
1.4 环裂变反应
黄酮类化合物经还原反应后的产物通常不稳定,需在肠道微生物酶的作用下重新进行C环裂解。不同黄酮化合物发生C环裂解后的产物不同,如黄酮醇类发生C环裂解反应后,C环1位氧原子与C-3重新环合为五元环[23];黄酮类如木犀草素在C环1位上发生脱氧开裂,先形成查耳酮后又被还原为双氢查耳酮,随后进一步降解为间苯三酚和苯丙酸衍生物[29]。
黄酮类化合物在肠道中发生环裂解反应的效率还受底物浓度的影响。在肠道微生物酶浓度一定的情况下,黄酮类化合物如儿茶素浓度越高,其发生C环裂解反应的速度越快[30]。鉴于黄酮类化合物在肠道中的代谢速度存在个体差异性,其在不同个体的肠道中发生裂解的程度亦存在一定的差别。
2 黄酮肠道菌代谢物的生物学活性
肠道中不同微生物可降解黄酮类化合物产生小分子酚类化合物,表1总结了不同黄酮类化合物中的代表性黄酮在不同肠道菌作用下降解产生的代谢物。黄酮类化合物在肠道中经肠道菌群代谢后的产物可能表现出完全不同于母药的生物学活性,因此,在提高黄酮类化合物体内生物利用度的同时,有必要全面了解其肠道菌代谢物的生物学活性变化。不同黄酮代谢物表现出不同的生物学活性,如抗氧化、抗炎、抗肿瘤、抗心血管疾病等,以下将分别总结不同黄酮类化合物的肠道菌代谢物的生物学活性,为小分子活性药物的开发提供理论参考。
表1 肠道菌对不同黄酮类化合物的代谢及其代谢产物
Table 1 Metabolism of different flavonoids by gut bacteria and their metabolites
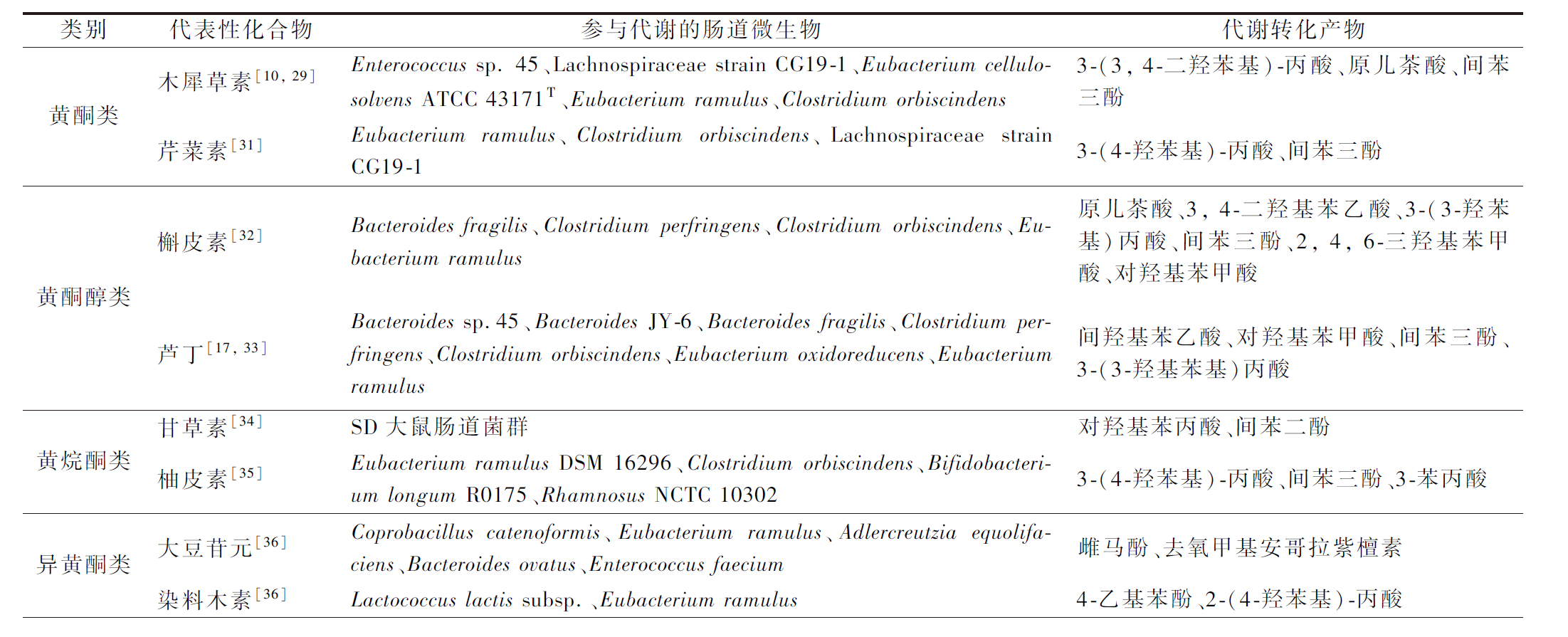
类别代表性化合物参与代谢的肠道微生物代谢转化产物黄酮类木犀草素[10, 29]Enterococcus sp. 45、Lachnospiraceae strain CG19-1、Eubacterium cellulosolvens ATCC 43171T、Eubacterium ramulus、Clostridium or-biscindens3-(3, 4-二羟苯基)-丙酸、原儿茶酸、间苯三酚芹菜素[31]Eubacterium ramulus、Clostridium orbiscindens、Lachnospiraceae strain CG19-13-(4-羟苯基)-丙酸、间苯三酚黄酮醇类槲皮素[32]Bacteroides fragilis、Clostridium perfringens、Clostridium orbiscin-dens、Eubacterium ramulus原儿茶酸、3, 4-二羟基苯乙酸、3-(3-羟苯基)丙酸、间苯三酚、2, 4, 6-三羟基苯甲酸、对羟基苯甲酸芦丁[17, 33]Bacteroides sp.45、Bacteroides JY-6、Bacteroides fragilis、Clostrid-ium perfringens、Clostridium orbiscindens、Eubacterium oxidoredu-cens、Eubacterium ramulus间羟基苯乙酸、对羟基苯甲酸、间苯三酚、3-(3-羟基苯基)丙酸黄烷酮类甘草素[34]SD大鼠肠道菌群对羟基苯丙酸、间苯二酚柚皮素[35]Eubacterium ramulus DSM 16296、Clostridium orbiscindens、Bifidobacterium longum R0175、Rhamnosus NCTC 103023-(4-羟苯基)-丙酸、间苯三酚、3-苯丙酸异黄酮类大豆苷元[36]Coprobacillus catenoformis、Eubacterium ramulus、Adlercreutzia equolifaciens、Bacteroides ovatus、Enterococcus faecium雌马酚、去氧甲基安哥拉紫檀素染料木素[36]Lactococcus lactis subsp.、Eubacterium ramulus4-乙基苯酚、2-(4-羟苯基)-丙酸
续表1

类别代表性化合物参与代谢的肠道微生物代谢转化产物查耳酮类黄腐酚[18]Eubacterium Ramulus、Eubacterium limosum8-异戊烯基柚皮素、α, β-二羟基黄腐酚根皮素[37]Eubacterium ramulus DSM 16296、Clostridium orbiscindens、Fla-vonifractor plantii3-(4-羟苯基)-丙酸、间苯三酚花色素类矢车菊素-3-O-葡萄糖苷[38]Eubacterium ramulus、Clostridium saccharogumia3-羟基苯乙酸、3-(3-羟苯基)丙酸、原儿茶酸、3, 4-二羟基苯乙酸、3-(3, 4-二羟苯基)-丙酸、丁香酸、香草酸、间苯三酚醛
2.1 抗氧化活性
体内外实验研究发现,黄酮类化合物具有良好的抗氧化活性,而肠道菌对黄酮类化合物的代谢作用导致黄酮类化合物的体内外浓度存在一定的差异性,因此黄酮在生物转化过程中产生的一些代谢物可能是其体内发挥抗氧化作用的主要形式[39]。有研究发现柚皮苷经大鼠肠道菌群代谢后表现出更高的自由基清除能力[40]。另有报道称黄酮醇类化合物如槲皮素、芦丁等经体内代谢后抗氧化活性降低,槲皮素的超氧化物歧化酶活性比其肠道菌代谢物的活性要高,它们的酶活性大小分别为槲皮素>3, 4-二羟基苯乙酸>原儿茶酸>3-羟基苯乙酸[41];其抗氧化活性差异可能与化合物结构中的羟基数量和位置有关,3, 4-二羟基苯乙酸、原儿茶酸、3-羟基苯乙酸均为黄酮类化合物的B环裂解产物,而黄酮A环的C-7位羟基可能在抗氧化活性中也发挥关键的作用。
黄酮的肠道菌代谢物主要通过两条途径发挥抗氧化活性:一是清除多余的活性氧自由基;二是通过调控相关基因的表达提高细胞的抗氧化能力。研究发现,花青素和黄酮醇类化合物的肠道菌代谢物3, 4-二羟基苯乙酸可通过多种途径调节细胞氧化压力,如通过调控烟酰胺腺嘌呤二核苷酸磷酸氧化酶4(nicotinamide adenine dinucleotide oxidase 4,NOX-4)NOX-4/沉默信号调控因子(silence signal regulating factor 1,SIRT-1)信号通路降低NRK-52E细胞中的活性氧自由基水平,从而保护肾近端小管细胞免受高糖诱导的细胞氧化应激[42]。另有研究发现,花青素的主要肠道菌代谢物——原儿茶酸可以通过减少乙酰辅酶A的产生或通过脂肪酸移位酶(fatty acid translocase,CD36)/腺苷酸活化蛋白激酶(adenosine monophosphate activated protein kinase,AMPK)依赖途径激活Sirt1和Sirt3以恢复锰依赖性超氧化物歧化酶的活性,从而缓解内皮细胞氧化压力[43]。
2.2 抗炎活性
肿瘤坏死因子-α(TNF-α)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)等是促进炎症反应的细胞因子,黄酮类化合物及其代谢物(如原儿茶酸、间苯三酚等)具有调节胞内促炎性细胞因子水平以缓解炎症的作用。黄酮代谢物原儿茶酸可以改善由高脂饮食诱导的小鼠肝脏炎症,其中,Toll样受体4(toll-like receptor 4,TLR4)、髓样细胞分化因子88(myeloid differentiation factor 88,MyD88)/转录因子-κB(nuclear factor kappa-B,NF-κB)通路是原儿茶酸改善肝细胞炎症的重要通路[44]。另有研究发现,蔓越莓原花青素及其肠道菌代谢物3,4-二羟基苯乙酸可通过调节IL-1β相关的miRNA从而缓解炎症[45]。一种富含花色苷的黑莓提取物主要通过调节肠道菌群,促进肠道菌代谢物犬尿酸的产生减轻肥胖相关的神经系统并发症,犬尿酸能够保护神经、对抗高脂饮食引起的神经炎症[46]。
2.3 代谢性疾病的调节活性
天然黄酮类化合物具有降糖、降脂和改善心血管疾病等功效,而肠道菌代谢黄酮类化合物的代谢物可能在代谢性疾病的调节中同样扮演着重要的作用。已有研究比较了表儿茶素及其肠道菌代谢物包括马尿酸、高香草酸和5-苯基缬草酸对骨骼肌和β细胞的糖代谢调节能力,结果发现,与表儿茶素相比,所检测的肠道菌代谢物能更有效地促进β细胞分泌胰岛素[47]。一些研究也探究了黄酮的其他肠道菌代谢物的降糖作用及机制;其中,3,4-二羟基苯乙酸能显著降低糖尿病小鼠血糖,同时该化合物能通过调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/肌球蛋白轻链激酶(myosin light chain kinase,MLCK)通路缓解糖尿病小鼠肠道屏障功能受损[48]。山奈酚在肠道菌Flavonifractor plautii作用下的代谢物4-羟基苯乙酸通过腺苷酸激活蛋白激酶α(AMPKα)通路改善由高脂饮食诱导的C57BL/6小鼠肝脏脂肪变性和肥胖[49]。
2.4 抗肿瘤活性
黄酮类化合物的生物利用度较低,其体内抗癌活性可能主要归功于肠道菌代谢后的小分子代谢物。甘草素具有抗肿瘤活性的作用,KERANMU等[34]研究发现,甘草素经体内肠道菌代谢后含量降低,而由于其肠道菌代谢物的化学结构与天然抗肿瘤活性成分异奎黄素相似,其代谢物表现出更强、更广谱的抗癌活性潜力。体外细胞学研究发现,黄酮类化合物如花青素和鞣花丹宁等的肠道菌代谢物能够抑制乳腺癌细胞的增殖[50]。槲皮素具有促进癌细胞凋亡、下调周期蛋白表达的作用;该化合物经肠道菌发酵后可增强其抗癌活性,其代谢衍生物3, 4-二羟基苯乙酸能够抑制血红素诱导的结肠癌和结肠上皮细胞的恶性转化[51]。另有研究证实,黄酮的肠道菌代谢物如原儿茶酸、没食子酸、2, 4, 6-三羟基苯甲酸等具有抑制癌细胞增殖的活性,其中2, 4, 6-三羟基苯甲酸可能通过抑制细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)的活性发挥抗癌作用[52]。此外,黄酮的不同肠道菌代谢物可能具有协同抗癌细胞增殖的作用;研究发现,鞣花单宁和儿茶素的肠道微生物代谢物尿素A和5-(3′, 4′, 5′-三羟基苯基)-γ-戊内酯对前列腺癌细胞具有协同抗增殖作用[53]。
众多关于黄酮代谢物的生物学活性研究均为采用体外细胞学实验和体内动物模型进行评价,而日常饮食摄入黄酮产生的活性代谢物浓度与实际发挥生物学功效的代谢物浓度存在一定的差异,已有研究报道的黄酮肠道菌代谢物的生物学活性评价未能全面反映黄酮在体内的实际生物学活性。未来可在明确黄酮在人体肠道代谢过程中组成及含量变化的前提下,进一步探索黄酮肠道菌代谢物的生物学活性变化。
3 总结与思考
近年来,众多研究已证实黄酮类化合物与肠道菌群相互影响在机体健康中的重要作用,其重要性不仅体现在黄酮类化合物对肠道菌群组成的影响,更重要的是,肠道菌群直接决定了黄酮类化合物能否在体内发挥生物学作用。大部分黄酮类化合物在肠道菌的作用下代谢为不同小分子化合物,一些黄酮类化合物经肠道菌代谢后的代谢产物可能表现出较母药生物学活性更高或母药本身没有的生物学活性。因此,深入剖析肠道菌对黄酮类化合物的代谢规律及其代谢产物的生物学活性变化有助于阐明黄酮类化合物的体内药效物质基础。
天然源黄酮类化合物具有结构多样的特点,而目前关于肠道菌对黄酮类化合物代谢相关的研究仍较有限。本文较为系统的综述了肠道菌群对黄酮类化合物的代谢反应,为推演不同黄酮类化合物在肠道菌群作用下的代谢规律提供了一定的理论参考依据。然而,目前关于肠道菌代谢黄酮类化合物的研究仍存在一定的局限性。首先,鉴于肠道中复杂的微生物组成及多样性,黄酮在肠道中也要经过复杂的代谢反应,在接下来的研究中可采用同位素标记法跟踪不同黄酮类化合物在肠道中的代谢过程,从而深入阐明黄酮类化合物在体内的代谢过程及生物学活性变化。其次,黄酮在肠道中的代谢反应主要由肠道微生物酶催化进行,接下来的研究可聚焦于肠道微生物中编码相应酶的功能基因,有望通过重组表达实现赋予不同的微生物相同的生物学功能。此外,不同群体的肠道菌群组成具有明显的差异性,机体对不同黄酮类化合物的吸收及利用能力也存在个体差异性。因此,未来研究仍需关注健康及不同疾病人群对黄酮类化合物的代谢及利用能力,从而为制定个性化饮食和开发新型调节健康功能的合生元产品提供佐证。
[1] BATTINO M, GIAMPIERI F, CIANCIOSI D, et al.The roles of strawberry and honey phytochemicals on human health:A possible clue on the molecular mechanisms involved in the prevention of oxidative stress and inflammation[J].Phytomedicine, 2021, 86:153170.
[2] YEH T S, YUAN C Z, ASCHERIO A, et al.Long-term dietary flavonoid intake and subjective cognitive decline in US men and women[J].Neurology, 2021, 97(10):e1041-e1056.
[3] 龚涛. 宣木瓜类黄酮提取纯化及鸭肉抗氧化保鲜应用实验研究[D].合肥:合肥工业大学, 2017.
GONG T.Study on extraction and purification of flavonoids from Chaenomeles speciosa, application of antioxidation and preservation of duck[D].Hefei:Hefei University of Technology, 2017.
[4] 范芳玉, 杨璇, 刘宇, 等.刺梨果渣天然防腐剂的制备及其在红酸汤中的应用[J].食品安全质量检测学报, 2022, 13(22):7399-7406.
FAN F Y, YANG X, LIU Y, et al.Preparation of natural preservative of the Rosa roxburghii Tratt pomace and its application in red sour soup[J].Journal of Food Safety &Quality, 2022, 13(22):7399-7406.
[5] 王磊, 王辉, 康福忠, 等.山楂的生物活性成分及其在畜禽业中的研究进展[J].饲料研究, 2022, 45(21):146-149.
WANG L, WANG H, KANG F Z, et al.Research progress on bioactive constituents of hawthorn and their application in livestock and poultry industry[J].Feed Research, 2022, 45(21):146-149.
[6] WAN M L Y, CO V A, EL-NEZAMI H.Dietary polyphenol impact on gut health and microbiota[J].Critical Reviews in Food Science and Nutrition, 2021, 61(4):690-711.
[7] MUROTA K, NAKAMURA Y, UEHARA M.Flavonoid metabolism:The interaction of metabolites and gut microbiota[J].Bioscience, Biotechnology, and Biochemistry, 2018, 82(4):600-610.
[8] LOGAN I E, SHULZHENKO N, SHARPTON T J, et al.Xanthohumol requires the intestinal microbiota to improve glucose metabolism in diet-induced obese mice[J].Molecular Nutrition &Food Research, 2021, 65(21):e2100389.
[9]  LVAREZ-CILLEROS D, MART
LVAREZ-CILLEROS D, MART N M
N M  , RAMOS S.Protective effects of (-)-epicatechin and the colonic metabolite 3,4-dihydroxyphenylacetic acid against glucotoxicity-induced insulin signalling blockade and altered glucose uptake and production in renal tubular NRK-52E cells[J].Food and Chemical Toxicology, 2018, 120:119-128.
, RAMOS S.Protective effects of (-)-epicatechin and the colonic metabolite 3,4-dihydroxyphenylacetic acid against glucotoxicity-induced insulin signalling blockade and altered glucose uptake and production in renal tubular NRK-52E cells[J].Food and Chemical Toxicology, 2018, 120:119-128.
[10] PEIROTÉN  ,
,  LVAREZ I, LANDETE J M.Production of flavonoid and lignan aglycones from flaxseed and soy extracts by Bifidobacterium strains[J].International Journal of Food Science &Technology, 2020, 55(5):2 22-2131.
LVAREZ I, LANDETE J M.Production of flavonoid and lignan aglycones from flaxseed and soy extracts by Bifidobacterium strains[J].International Journal of Food Science &Technology, 2020, 55(5):2 22-2131.
[11] 周琪, 窦同意, 丁乐乐, 等.β-葡萄糖醛酸苷酶的重组表达及对黄芩苷的生物转化[J].大连医科大学学报, 2017, 39(2):110-115.
ZHOU Q, DOU T Y, DING L L, et al.Bioconversion of baicalin to baicalein with recombinant β-glucuronidase in Escherichia coli[J].Journal of Dalian Medical University, 2017, 39(2):110-115.
[12] WEI B, WANG Y K, QIU W H, et al.Discovery and mechanism of intestinal bacteria in enzymatic cleavage of C-C glycosidic bonds[J].Applied Microbiology and Biotechnology, 2020, 104(5):1883-1890.
[13] NAKAMURA K, ZHU S, KOMATSU K, et al.Deglycosylation of the isoflavone C-glucoside puerarin by a combination of two recombinant bacterial enzymes and 3-oxo-glucose[J].Applied and Environmental Microbiology, 2020, 86(14):e00607-e00620.
[14] WANG S, LIU S Q, WANG J, et al.A newly isolated human intestinal strain deglycosylating flavonoid C-glycosides[J].Archives of Microbiology, 2022, 204(6):310.
[15] ZANDI K, MUSALL K, OO A, et al.Baicalein and baicalin inhibit SARS-CoV-2 RNA-dependent-RNA polymerase[J].Microorganisms, 2021, 9(5):893.
[16] ISIKA D K, SADIK O A.Selective structural derivatization of flavonoid acetamides significantly impacts their bioavailability and antioxidant properties[J].Molecules, 2022, 27(23):8133.
[17] 伍明江, 吴晓磊, 张德芹, 等.UPLC-Q-TOF/MS鉴定芦丁在大鼠体内的代谢产物[J].中国实验方剂学杂志, 2017, 23(17):91-97.
WU M J, WU X L, ZHANG D Q, et al.Identification of metabolites of rutin in rats by UPLC-Q-TOF/MS[J].Chinese Journal of Experimental Traditional Medical Formulae, 2017, 23(17):91-97.
[18] PARAISO I L, PLAGMANN L S, YANG L P, et al.Reductive metabolism of xanthohumol and 8-prenylnaringenin by the intestinal bacterium Eubacterium ramulus[J].Molecular Nutrition &Food Research, 2019, 63(2):e1800923.
[19] BURAPAN S, KIM M, HAN J.Demethylation of polymethoxyflavones by human gut bacterium, Blautia sp.MRG-PMF1[J].Journal of Agricultural and Food Chemistry, 2017, 65(8):1620-1629.
[20] WEN L R, JIANG Y M, YANG J L, et al.Structure, bioactivity, and synthesis of methylated flavonoids[J].Annals of the New York Academy of Sciences, 2017, 1398(1):120-129.
[21] CUI M Y, LU A R, LI J X, et al.Two types of O-methyltransferase are involved in biosynthesis of anticancer methoxylated 4′-deoxyflavones in Scutellaria baicalensis Georgi[J].Plant Biotechnology Journal, 2022, 20(1):129-142.
[22] 田苗苗, 郭佳婧, 刘娟, 等.大肠杆菌表达类黄酮O-甲基转移酶合成槲皮素甲基化衍生物[J].食品与生物技术学报, 2022, 41(7):111-119.
TIAN M M, GUO J J, LIU J, et al.Synthesis of quercetin methylated derivatives by expression of FOMT in Escherichia coli[J].Journal of Food Science and Biotechnology, 2022, 41(7):111-119.
[23] YANG G H, HONG S, YANG P J, et al.Discovery of an ene-reductase for initiating flavone and flavonol catabolism in gut bacteria[J].Nature Communications, 2021, 12(1):790.
[24] 武锦春. 正常人肠道菌群对酸枣仁总黄酮的体外代谢研究[D].太原:山西大学, 2021.
WU J C.Study on the in vitro metabolism of total flavonoids in Ziziphi Spinosae Semen by normal human intestinal flora[D].Taiyuan:Shanxi University, 2021.
[25] FENG X C, LI Y, BROBBEY OPPONG M, et al.Insights into the intestinal bacterial metabolism of flavonoids and the bioactivities of their microbe-derived ring cleavage metabolites[J].Drug Metabolism Reviews, 2018, 50(3):343-356.
[26] TAMURA M, TSUSHIDA T, SHINOHARA K.Isolation of an isoflavone-metabolizing, Clostridium-like bacterium, strain TM-40, from human faeces[J].Anaerobe, 2007, 13(1):32-35.
[27] 梁文欧, 赵力超, 方祥, 等.大豆异黄酮与肠道微生物相互作用研究进展[J].食品科学, 2019, 40(9):283-289.
LIANG W O, ZHAO L C, FANG X, et al.Progress in the research of the interactions of soy isoflavones with gut microbiota[J].Food Science, 2019, 40(9):283-289.
[28] YAMASHITA S, LIN I, OKA C, et al.Soy isoflavone metabolite equol inhibits cancer cell proliferation in a PAP associated domain containing 5-dependent and an estrogen receptor-independent manner[J].The Journal of Nutritional Biochemistry, 2022, 100:108910.
[29] KALUZHSKIY L, ERSHOV P, YABLOKOV E, et al.Human lanosterol 14-α demethylase (CYP51A1) is a putative target for natural flavonoid luteolin 7,3′-disulfate[J].Molecules, 2021, 26(8):2237.
[30] KUTSCHERA M, ENGST W, BLAUT M, et al.Isolation of catechin-converting human intestinal bacteria[J].Journal of Applied Microbiology, 2011, 111(1):165-175.
[31] VOLLMER M, ESDERS S, FARQUHARSON F M, et al.Mutual interaction of phenolic compounds and microbiota:Metabolism of complex phenolic apigenin-C- and kaempferol-O-derivatives by human fecal samples[J].Journal of Agricultural and Food Chemistry, 2018, 66(2):485-497.
[32] RODRIGUEZ-CASTA O G P, DORRIS M R, LIU X B, et al.Bacteroides thetaiotaomicron starch utilization promotes quercetin degradation and butyrate production by Eubacterium ramulus[J].Frontiers in Microbiology, 2019, 10:1145.
O G P, DORRIS M R, LIU X B, et al.Bacteroides thetaiotaomicron starch utilization promotes quercetin degradation and butyrate production by Eubacterium ramulus[J].Frontiers in Microbiology, 2019, 10:1145.
[33] RIVA A, KOLIM R D, SPITTLER A, et al.Conversion of rutin, a prevalent dietary flavonol, by the human gut microbiota[J].Frontiers in Microbiology, 2020, 11:585428.
R D, SPITTLER A, et al.Conversion of rutin, a prevalent dietary flavonol, by the human gut microbiota[J].Frontiers in Microbiology, 2020, 11:585428.
[34] KERANMU A, PAN L B, FU J, et al.Biotransformation of liquiritigenin into characteristic metabolites by the gut microbiota[J].Molecules, 2022, 27(10):3057.
[35] CHEN T B, WU H, HE Y, et al.Simultaneously quantitative analysis of naringin and its major human gut microbial metabolites naringenin and 3-(4′-hydroxyphenyl) propanoic acid via stable isotope deuterium-labeling coupled with RRLC-MS/MS method[J].Molecules, 2019, 24(23):4287.
[36] LUCA S V, MACOVEI I, BUJOR A, et al.Bioactivity of dietary polyphenols:The role of metabolites[J].Critical Reviews in Food Science and Nutrition, 2020, 60(4):626-659.
[37] QIU T Y, GONG T, ZHANG S, et al.A carbon-carbon hydrolase from human gut probiotics Flavonifractor plautii catalyzes phloretin conversion[J].Food Bioscience, 2022, 50:102178.
[38] CHEN Y, CHEN H, ZHANG W J, et al.Bioaccessibility and biotransformation of anthocyanin monomers following in vitro simulated gastric-intestinal digestion and in vivo metabolism in rats[J].Food &Function, 2019, 10(9):6052-6061.
[39] BRITO SAMPAIO K, LUIZ DE BRITO ALVES J, MANGUEIRA DO NASCIMENTO Y, et al.Nutraceutical formulations combining Limosilactobacillus fermentum, quercetin, and or resveratrol with beneficial impacts on the abundance of intestinal bacterial populations, metabolite production, and antioxidant capacity during colonic fermentation[J].Food Research International, 2022, 161:111800.
[40] ZENG X, ZHENG Y Y, HE Y, et al.Microbial metabolism of naringin and the impact on antioxidant capacity[J].Nutrients, 2022, 14(18):3765.
[41] TANG Y, NAKASHIMA S, SAIKI S, et al.3,4-Dihydroxyphenylacetic acid is a predominant biologically-active catabolite of quercetin glycosides[J].Food Research International, 2016, 89:716-723.
[42]  LVAREZ-CILLEROS D, MART
LVAREZ-CILLEROS D, MART N M
N M  , GOYA L, et al.(-)-Epicatechin and the colonic metabolite 3, 4-dihydroxyphenylacetic acid protect renal proximal tubular cell against high glucose-induced oxidative stress by modulating NOX-4/SIRT-1 signaling[J].Journal of Functional Foods, 2018, 46:19-28.
, GOYA L, et al.(-)-Epicatechin and the colonic metabolite 3, 4-dihydroxyphenylacetic acid protect renal proximal tubular cell against high glucose-induced oxidative stress by modulating NOX-4/SIRT-1 signaling[J].Journal of Functional Foods, 2018, 46:19-28.
[43] HAN L, YANG Q, LI J, et al.Protocatechuic acid-ameliorated endothelial oxidative stress through regulating acetylation level via CD36/AMPK pathway[J].Journal of Agricultural and Food Chemistry, 2019, 67(25):7060-7072.
[44] 李佳. 原儿茶酸改善高脂诱导肝脏炎症及作用机制研究[D].杨凌:西北农林科技大学,2021.
LI J.Effect of protocatechuic acid on liver inflammation induced by high fat and its mechanism[D].Yangling:Northwest A &F University, 2021.
[45] LOFFT Z, TAIBI A, MASSARA P, et al.Cranberry proanthocyanidin and its microbial metabolite 3, 4-dihydroxyphenylacetic acid, but not 3-(4-hydroxyphenyl)-propionic acid, partially reverse pro-inflammatory microRNA responses in human intestinal epithelial cells[J].Molecular Nutrition &Food Research, 2022, 66(8):e2100853.
[46] MARQUES C, FERNANDES I, MEIRELES M, et al.Gut microbiota modulation accounts for the neuroprotective properties of anthocyanins[J].Scientific Reports, 2018, 8(1):11341.
[47] BITNER B F, RAY J D, KENER K B, et al.Common gut microbial metabolites of dietary flavonoids exert potent protective activities in β-cells and skeletal muscle cells[J].The Journal of Nutritional Biochemistry, 2018, 62:95-107.
[48] LIU M, WANG L, HUANG B J, et al.3, 4-Dihydroxyphenylacetic acid ameliorates gut barrier dysfunction via regulation of MAPK-MLCK pathway in type 2 diabetes mice[J].Life Sciences, 2022, 305:120742.
[49] OSBORN L J, SCHULTZ K, MASSEY W, et al.A gut microbial metabolite of dietary polyphenols reverses obesity-driven hepatic steatosis[J].Proceedings of the National Academy of Sciences of the United States of America, 2022, 119(48):e2202934119.
[50] TEIXEIRA L L, COSTA G R, DÖRR F A, et al.Potential antiproliferative activity of polyphenol metabolites against human breast cancer cells and their urine excretion pattern in healthy subjects following acute intake of a polyphenol-rich juice of grumixama (Eugenia brasiliensis Lam.)[J].Food &Function, 2017, 8(6):2266-2274.
[51] CATAL N M, FERREIRA J, CARRASCO-POZO C.The microbiota-derived metabolite of quercetin, 3, 4-dihydroxyphenylacetic acid prevents malignant transformation and mitochondrial dysfunction induced by hemin in colon cancer and normal colon epithelia cell lines[J].Molecules, 2020, 25(18):4138.
N M, FERREIRA J, CARRASCO-POZO C.The microbiota-derived metabolite of quercetin, 3, 4-dihydroxyphenylacetic acid prevents malignant transformation and mitochondrial dysfunction induced by hemin in colon cancer and normal colon epithelia cell lines[J].Molecules, 2020, 25(18):4138.
[52] SANKARANARAYANAN R, VALIVETI C K, KUMAR D R, et al.The flavonoid metabolite 2, 4, 6-trihydroxybenzoic acid is a CDK inhibitor and an anti-proliferative agent:A potential role in cancer prevention[J].Cancers, 2019, 11(3):427.
[53] STANIS AWSKA I J, GRANICA S, PIWOWARSKI J P, et al.The activity of urolithin A and M4 valerolactone, colonic microbiota metabolites of polyphenols, in a prostate cancer in vitro model[J].Planta Medica, 2019, 85(2):118-125.
AWSKA I J, GRANICA S, PIWOWARSKI J P, et al.The activity of urolithin A and M4 valerolactone, colonic microbiota metabolites of polyphenols, in a prostate cancer in vitro model[J].Planta Medica, 2019, 85(2):118-125.