虾青素(astaxanthin)是一种具有酮式结构的类胡萝卜素,β-胡萝卜素与天然虾青素结构大体一致,由一条长的共轭双键碳链和两端α-羟基酮的六元环组成,共轭双键碳链是由4个异戊二烯结构组成。虾青素的抗氧化能力是维生素E的550倍,β-胡萝卜素的10倍。正因为虾青素超强的抗氧化能力,可以去除因阳光或细胞老化产生的氧化自由基,从而保护人体的眼睛和皮肤,降低太阳辐射对人体的伤害,防止心脏的血管老化、预防癌症和老年痴呆等。虾青素在保健品、化妆品等领域有着广泛的应用,这使得虾青素的市场需求与日俱增。
目前,研究的主流方向是以微生物作为生产者,利用代谢工程手段获得高产虾青素的工程菌,常用的微生物有解脂耶氏酵母、大肠杆菌、谷氨酸棒杆菌等。与化学合成法相比,微生物生产具有结构明确、副产物少、对环境无污染,培养时间短,生产成本价格低廉,可以在发酵罐中,以超高的密度进行培养等优势。
本文综述了虾青素的生物功能及其应用、虾青素的来源,并对虾青素合成途径及如何利用合成生物学提高微生物虾青素积累的方法进行了详细介绍,其目的是为虾青素的高效合成研究提供一定的参考。
1 虾青素的生物学功能及其应用
科研人员一直都在研究具有抗氧化成分的物质。从起初的维生素类物质,到第二代拥有抗氧化功效的物质,如β-胡萝卜素、过氧化物歧化酶、辅酶Q10等,再到近年来较为热门的第三代抗氧化物质,如葡萄籽、花青素、蓝莓提取物、番茄红素、绿茶素等。目前最新的抗氧化成分即为虾青素,也是第四代抗氧化成分。虾青素极强的抗氧化能力使其在医药、食品及养殖业等领域有广泛的应用[1]。
1.1 医药中的应用
在人体视网膜中富含不饱和脂肪酸,中枢神经系统中同样也富含不饱和脂肪酸,氧化产生的自由基非常容易使视网膜细胞和中枢神经系统发生过氧化导致机体损伤[2]。有研究表明,虾青素因为具有非溶于水的特殊分子构造很容易穿过细胞膜和血脑屏障[3],通过强力清除氧化自由基,保护中枢神经系统,最终起到保护大脑的作用[4],有效治疗由于氧化自由基引起的中枢神经系统损伤,如缺血再灌注损伤、脊髓损伤、帕金森综合征等[5];通过直接清除掉细胞内的氧化自由基,可以有效增强细胞的再生能力,维持人体机能平衡,并且减少体内衰老细胞的积累,由内而外保护细胞和DNA的健康;清除体内细胞中的氧化自由基,防止损伤视网膜中的视杆细胞和视锥细胞[6]。另外,虾青素治疗视网膜黄斑变性的效果好于使用叶黄素治疗的效果。虾青素可克服因抗血小板药物导致凝血功能的障碍,在美国,已经有公司将虾青素作为药物来研发,其目的是防止脑梗塞后再次梗塞[7]。
1.2 食品中的应用
脂溶性的虾青素呈现出自然的艳丽红色,具有着色力强、安全无害、用量不多、无异味、口感佳的特点,被广泛用于保健品、食用油脂、冰淇淋、糖果及调料的着色等,尤其是含脂类较多的食品[8]。
虾青素不仅充当优质色素,还因其增强免疫、抗衰老等[9-10]作用而充当保健品中的功能成分;因其极强的抗氧化性能,虾青素能保持食品的营养成分不被破坏,从而充当了食品的保鲜、保味及保质成分[11]。在日本,虾青素通常被看作一种功能性食品添加剂,常常用来浸泡水果、海藻和蔬菜,同时虾青素也作为蔬菜的红色染料来使用[12]。
1.3 养殖业中的应用
在水产养殖方面,将虾青素作为激素可以促进鱼卵受精,减少胚胎死亡率,加快个体生长,增加鱼类成熟速度[13]。在鱼饵料中添加产虾青素的红法夫酵母碎片,鲑鱼和鲟鱼食用饵料后,虾青素通常会积累在鱼类的皮肤和鱼肉中,使鱼呈现出红色[14]。这些鱼和不食用虾青素的鱼类相比,呈现出较鲜艳的色泽,营养丰富,口感更出色,在欧美市场很受消费者的喜爱。显然,富含虾青素的鱼的价格也要比普通鱼更昂贵。但由于极大的市场需求,鲟鱼和鲑鱼在欧美国家的养殖业发展仍然很迅速。虾青素在红鲑鱼体内的含量要达到5~20 mg/kg鲜重,含有虾青素浓度为40~150 mg/kg的饵料是红鲑鱼食用饵料的基本标准,这样一来红鲑鱼每年需要的虾青素可达数十万吨,总价值超数亿美元。我国的水产养殖业发展迅速,添加虾青素的饲料生产高档水产品,有着十分广阔的前景[15]。
虾青素不仅可以用在水产养殖中,也可以用在禽业养殖中。研究表明,在鸡的饲料中加入2.95%的红法夫酵母来补充虾青素,蛋黄会因虾青素的增加使其特征吸收峰从571 nm 红移到593 nm,远高于使用10.85%黄玉米为饲料的红移,添加高浓度的黄玉米仅仅从571 nm红移到575 nm[16]。添加了虾青素的饲料能促进家禽的生长,提高家禽的产蛋率,肉禽的皮肤、脚、喙也都呈现出消费者喜爱的金黄色。虾青素的添加能提高各种蛋和肉的商品价值。因此,虾青素的使用能对养殖业经济的发展起到有效的促进作用[17]。
2 虾青素的来源
目前国内和国外制备虾青素的方法有2类:一种是运用化学合成法获得虾青素。化学合成法是利用化工原材料或角黄质、玉米黄质和叶黄素等类胡萝卜素制备虾青素;但是化学合成法副产物多,结构不明确,对环境不友好,其产品主要用做工业原料[18]。另一种方法是从藻类、酵母和水生动物中分离获得天然虾青素,这种来源获取可以克服化学制备法的缺陷,且获取的天然虾青素可以作为食品添加剂使用[19]。
2.1 藻类生产虾青素
随着生物技术发展,微藻的应用范围逐步从饲料向食品及药品发展,从生产简单的生物物质到生产有价值的产品迈进。如雨生红球藻(Haematococcus pluvialis)[20]和杜氏盐藻(Dunaliella salina)[21]可以合成虾青素和虾青素前体β-胡萝卜素,蓝藻(cyanobacteria)[22]通过引入外源虾青素的基因也可以成为虾青素的生产宿主。雨生红球藻是一种单细胞淡水微藻[23],分布在全球许多水生环境中,被认为是最丰富且最有前途的天然虾青素商业生产来源之一[24],成熟期其胞内虾青素含量约占胞内类胡萝卜素总量的90%[25],重量可以达细胞干重的7%[26]。杜氏盐藻是一种生存在海洋中的藻类,能够产生β-胡萝卜素,可通过代谢工程手段改造杜氏盐藻来合成虾青素[21]。蓝藻可以利用太阳能和CO2来合成有机物质,被认为是可再生的微生物细胞工厂,其特点是培养简单、易于基因操作和相对明确的遗传背景,通过代谢工程改造用来生产高价值的虾青素[22]。
2.2 酵母生产虾青素
除了藻类,虾青素也能从酵母中合成。红法夫酵母(Phaffia rhodozyma)[19]是一种耐寒担子菌酵母。虾青素是其主要合成的类胡萝卜素。研究发现,在该菌中,虾青素约占总类胡萝卜素的84%[27],其可利用多种糖类作为碳源进行生长代谢,不需光照,培养时间短,可在发酵罐进行超高密度的培养;且该菌细胞含有17%的脂类物质,虾青素是属于脂溶性的,可以更加均匀地分布于细胞质中,有利于虾青素在细胞内的储存[19];酵母提取虾青素后,其副产物含有丰富的蛋白质、酯类和维生素B等营养物质,可作为富含营养的饲料添加剂使用。
2.3 原核生物生产虾青素
部分原核生物中亦存在虾青素前体物质合成途径,可以合成虾青素前体β-胡萝卜素、番茄红素以及虾青素前体异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)。因为存在这些前体,添加外源虾青素基因可以实现高产虾青素。作为常用的外源基因表达宿主——大肠杆菌,大肠杆菌是应用最多、最成功的一种表达体系,大肠杆菌的遗传背景很清晰,操作技术与培养条件相对简单。将外源的虾青素合成基因引入到大肠杆菌中,使大肠杆菌成功生产出虾青素[28-29]。谷氨酸棒杆菌(Corynebacterium glutamicum)是在20世纪50年代首次被发现的一种天然可以生产谷氨酸的革兰氏阳性菌。近几十年,已成为上百万吨的各种氨基酸的生产菌株,用于饲料和食品工业中。谷氨酸棒杆菌可以合成番茄红素,番茄红素是虾青素的前体物质,重组谷氨酸棒杆菌的末端工程可构建虾青素合成途径。因此,谷氨酸棒杆菌这种无毒的典型工业微生物具有生产虾青素的巨大潜力[30]。
3 虾青素合成途径
上述不同来源菌种依靠其自身产虾青素的能力远远不能满足市场对虾青素的需求。要实现高产,通常需要对微生物进行工程改造,改造的前提是要清晰了解其合成途径。
生物生产虾青素的过程可分成3个阶段[19],第一阶段称为中心碳代谢循环阶段(图1-a),第二阶段称为虾青素前体物质合成阶段,虾青素前体物质异戊烯基焦磷酸和二甲基烯丙基焦磷酸的合成(图1-b),第三阶段为虾青素合成阶段(图1-c)。
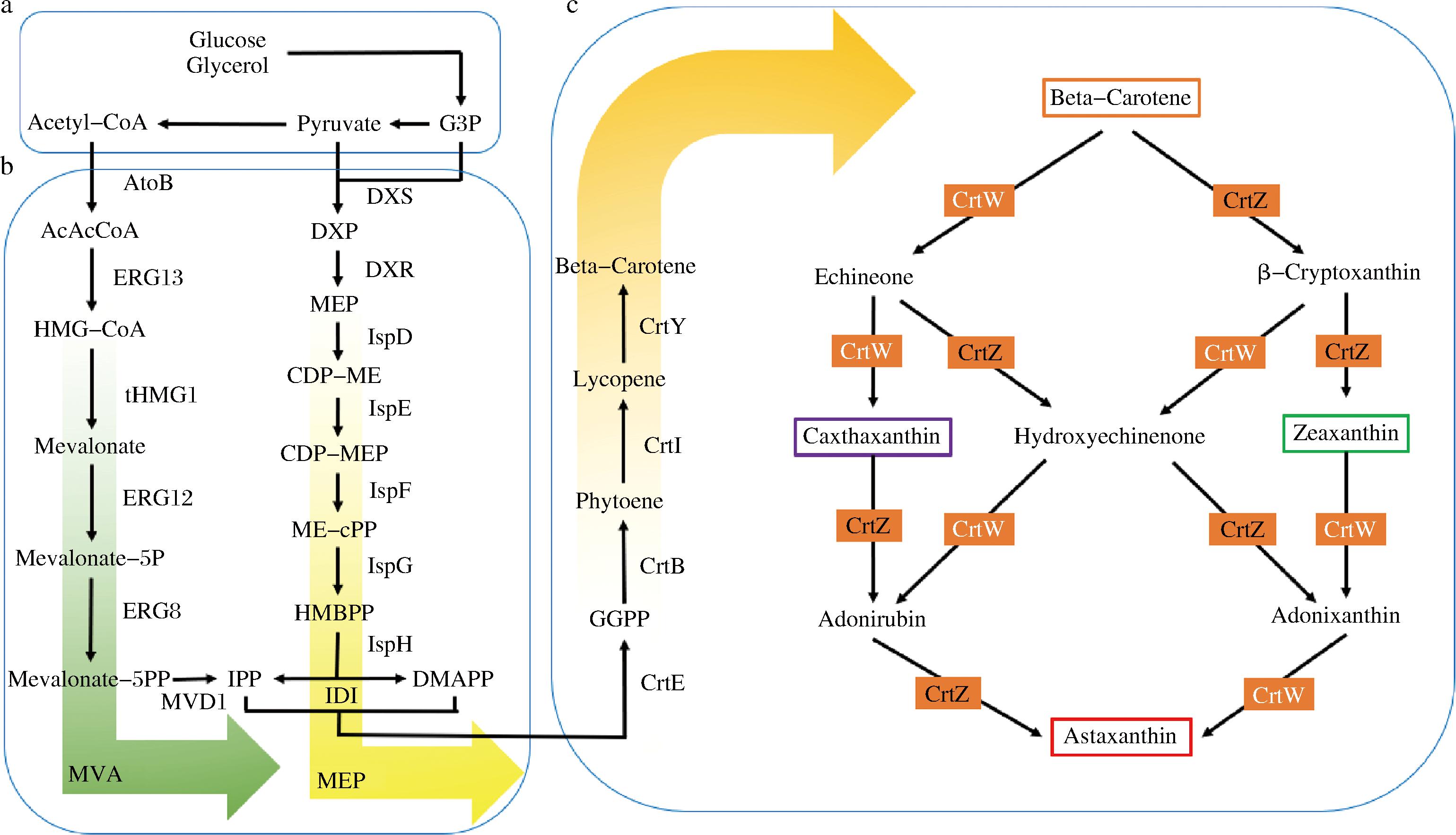
a-中心碳代谢循环阶段。葡萄糖经过糖酵解和磷酸戊糖途径生成甘油三磷酸(G3P)、丙酮酸(pyruvate)和乙酰辅酶A(acyl-CoA);b-虾青素前体物质合成阶段。MVA 途径多存在于真核生物及古生菌。MEP 途径常存在于植物及大多数细菌中;c-虾青素合成阶段。IPP和DMAPP作为类胡萝卜素前体合成虾青素
图1 虾青素生物合成代谢路径图
Fig.1 Astaxanthin bioanabolic pathway
注:AcAcCoA,乙酰乙酰辅酶 A;HMG-CoA,羟甲基戊二酰辅酶A;Mevalonate,甲羟戊酸;Mevalonate-5P,甲羟戊酸-5-磷酸;Mevalonate-5PP,甲羟戊酸二磷酸;DXP,1-脱氧-D-木酮糖5-磷酸盐;CDP-ME,4-二磷酸胞基-2-甲基赤藓糖醇;CDP-MEP,4-二磷酸胞苷基-2-甲基赤藓糖醇2-磷酸酯;ME-cPP,2-甲基赤藓糖醇2,4-环焦磷酸盐;HMBPP,4-羟基-3-甲基丁-2-烯基焦磷酸盐;GGPP,牻牛儿基牻牛儿基焦磷酸;Phytoene,八氢番茄红素; Lycopene,番茄红素;β-Carotene,β-胡萝卜素。
3.1 中心碳代谢循环阶段
第一阶段的中心碳代谢循环是生物通过糖酵解途径和磷酸戊糖途径消耗葡萄糖和果糖等碳源,合成大量的甘油三磷酸(G3P)、丙酮酸(pyruvate)和乙酰辅酶A(acyl-CoA)[31]。作为虾青素合成的碳源, 甘油三磷酸、丙酮酸和乙酰辅酶A将会合成IPP和DMAPP流入下一个合成虾青素的途径中[32]。部分乙酰辅酶A进入三羧酸循环,生成生物生存所必须的能量、糖类、脂类、氨基酸等物质。合成的ATP、NADPH等供能物质流向细胞代谢中,不仅为生物的生存提供了能量,也为虾青素的合成提供了能量[33]。
3.2 虾青素前体物质合成阶段
第二阶段是虾青素的前体异戊烯基焦磷酸和二甲基烯丙基焦磷酸合成。甲羟戊酸途径(mevalonate,MVA)和甲基赤藻糖醇磷酸(mevalonate pathway,MEP)途径是IPP和 DMAPP合成的2种天然的合成途径[33]。MVA途径(图1-b中绿色箭头)主要存在于古生菌、酵母及少部分的革兰氏阳性菌,也是这些生物体内形成 IPP的唯一途径[34];MEP途径则存在于藻类和大部分细菌中,在植物体内也有此途径存在[35]。IPP和DMAPP可由细菌、藻类、酵母及植物中的 MVA途径和 MEP途径产生[36]。
在 MVA途径中,乙酰辅酶A通过图1中的6个蛋白酶:乙酰CoA-酰基转移酶(acetyl-CoA acetyltransferase,AtoB)、3-羟基-3-甲基戊二酰CoA合酶(3-hydroxy-3-methylglutaryl CoA synthase,ERG13)、3-羟基-3-甲基戊二酰辅酶a还原酶(3-hydroxy-3-methylglutaryl CoA reductase,tHMG1)、甲羟戊酸激酶(mevalonate kinase,ERG12)、磷酸甲羟戊酸激酶(phosphomevalonatekinase,ERG8)和甲羟戊酸二磷酸脱羧酶(mevalonate diphosphate decarboxylase,MVD1)合成IPP[20]。通过异戊烯基焦磷酸异构酶异构化反应,IPP生成同分异构体DMAPP。
在MEP途径(图1-b中黄色箭头)中,甘油三磷酸和丙酮酸分子经过缩合及异构化反应形成1-脱氧-D-木酮糖-5-磷酸酯(1-deoxy-d-xylulose-5-phosphate,DXP),由1-脱氧木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose-5-phosphate synthase,DXS)和1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase,DXR)参与催化。MEP再与三磷酸胞苷偶联后经过一系列的磷酸化反应形成 IPP,这些磷酸酶分别是D-核糖醇-5-磷酸胞苷转移酶(D-ribitol-5-phosphate cytidylyltransferase,IspD)、4-(胞苷5′-二磷酸)-2-C-甲基-D-赤藓糖醇激酶[4-(cytidine 5′-diphospho)-2-C-methyl-D-erythritol kinase,IspE]、2-C-甲基-D-赤藓糖醇2,4-环二磷酸合酶(2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase,IspF)、(E)-4-羟基-3-甲基丁-2-烯基二磷酸合酶[(E)-4-hydroxy-3-methylbut-2-enyl-diphosphate synthase (flavodoxin),IspG]、4-羟基-3-甲基丁-2-烯基二磷酸还原酶(4-hydroxy-3-methylbut-2-enyl diphosphate reductase,IspH)。在异戊烯基焦磷酸异构酶(isopentenyl diphosphate isomerase,IDI)的作用下,IPP可与DMAPP互相转化[37]。
3.3 虾青素合成阶段
第三阶段是虾青素的合成[38]。在牻牛儿基牻牛儿基焦磷酸合成酶(geranylgeranyl diphosphate synthase,CrtE)的作用下,IPP或DMAPP被催化成牻牛儿基牻牛儿基焦磷酸。牻牛儿基牻牛儿基焦磷酸在八氢番茄红素合酶(phytoene synthase,CrtB)和八氢番茄红素脱氢酶(phytoene desaturase,CrtI)2种酶的催化下,缩合形成番茄红素。番茄红素在番茄红素β-环化酶(lycopene beta-cyclase,CrtY)催化下合成虾青素的前体 β-胡萝卜素。合成虾青素的最后一步在不同生物体内略有不同,但主要都是通过β-胡萝卜素羟化酶(β-carotene hydroxylase,CrtZ)和β-胡萝卜素酮醇酶(β-carotene ketolase,CrtW)催化β-胡萝卜素来合成虾青素的。
4 虾青素合成细胞工厂的构建及构建策略
构建虾青素合成细胞工厂涉及到多个不同模块之间的组装和适配等问题,是一个复杂的过程。首先,需要根据宿主细胞的特性来选择最合适的催化模块,其次还需要考虑解除代谢中间体的反馈抑制效应,增强NADPH和ATP的合成,以求稳定增加虾青素的前体供应。要尽量减少非必需的副产物或代谢中间体的产生,将碳流引入虾青素的合成途径,最大限度在底盘细胞中增加前体池的供应,扩大从底物到虾青素的代谢通量,才能提高虾青素的最终产量。因此,要做到催化模块和底盘细胞的选择最优化,并从催化特性、底盘适应性、表达水平等多个角度进行组合适配。
4.1 扩大前体池增加虾青素产量
PÉREZ-GARC A等[39]在研究谷氨酸棒杆菌生产虾青素时,设计了一株可以解除糖酵解和PTS基因抑制的底盘菌株,敲除乳酸途径,减少副产物的形成,以此来节约葡萄糖的消耗,以L-赖氨酸和L-哌啶酸的产量为衡量标准,相比较改造前,其L-赖氨酸和L-哌啶酸生产力提高了70%~72%。在此底盘细胞的基础上,采用代谢工程方法建立生产虾青素的谷氨酸棒杆菌工程菌株,导入的异源虾青素合成基因crtY来自成团泛菌,crtW和crtZ来自褐肋菌,最终虾青素产量达到了10 mg/L[40],相较于之前构建的菌株ASTA1虾青素产量提高了18%,减少葡萄糖流向不必要的副产物,可以有效提高终产物虾青素的产量。
A等[39]在研究谷氨酸棒杆菌生产虾青素时,设计了一株可以解除糖酵解和PTS基因抑制的底盘菌株,敲除乳酸途径,减少副产物的形成,以此来节约葡萄糖的消耗,以L-赖氨酸和L-哌啶酸的产量为衡量标准,相比较改造前,其L-赖氨酸和L-哌啶酸生产力提高了70%~72%。在此底盘细胞的基础上,采用代谢工程方法建立生产虾青素的谷氨酸棒杆菌工程菌株,导入的异源虾青素合成基因crtY来自成团泛菌,crtW和crtZ来自褐肋菌,最终虾青素产量达到了10 mg/L[40],相较于之前构建的菌株ASTA1虾青素产量提高了18%,减少葡萄糖流向不必要的副产物,可以有效提高终产物虾青素的产量。
在虾青素前体合成阶段,MEP途径和MVP途径最终都可以合成虾青素的2种前体物质IPP和DMAPP。HEIDER等[30]研究谷氨酸棒杆菌产虾青素的过程中,将谷氨酸棒杆菌中的dxs单独过表达,虾青素前体物质中的番茄红素产量达到0.08 mg/g DCW,相比较没过表达dxs之前,番茄红素产量增加了2倍,而单独过表达idi的菌株同样也可以使番茄红素产量达到0.08 mg/g DCW,增加2倍的番茄红素产量,但是在谷氨酸棒杆菌中同时过表达dxs和idi并没有发现叠加的效果。由于idi负责IPP和DMAPP的相互转化,在大部分生物中都以IPP为前体,在消耗完IPP后,idi活性越高,DMAPP转化为IPP的速度就会越快,因此idi成为了MEP途径中的一个限速酶,过表达idi可以减少2种前体之间的比例发生剧烈变化而影响虾青素的合成。在过表达idi的基础上构建了完整的虾青素通路,虾青素产量为0.1 mg/g DCW,由于产量较低,通过进一步过表达虾青素合成基因crtE、crtB、crtI、crtY、crtW、crtZ,最终使虾青素产量达到了1.2 mg/g DCW,除了打开限速酶的限速,扩大整体的代谢通量可以显著增加虾青素的最终产量。
引入外源的前体供应途径可以增加IPP和DMAPP的产量,可以使虾青素产量提高,以生产β-胡萝卜素为例,MA等[41]在改造解脂耶氏酵母产β-胡萝卜素的研究中引入外源的异戊烯醇利用途径(isopentenol utilization pathway,IUP),表达胆碱激酶(choline kinase,CK)和异戊烯基磷酸激酶(isopentenyl phosphate kinase,IPK),IUP 途径以异戊烯醇的同分异构体异戊二烯醇或戊烯醇为底物,经过两步磷酸化酶反应有效地增加了虾青素前体IPP和DMAPP,最终使解脂耶氏酵母的β-胡萝卜素产量从3.43 g/L增加到4.22 g/L,β-胡萝卜素作为虾青素合成前体,其β-胡萝卜素产量的提高对于虾青素产量的增加具有指导意义。
XIE等[42]在解脂耶氏酵母产β-胡萝卜素的研究中发现番茄红素底物抑制作用,过量的番茄红素抑制了番茄红素环化酶的活性,导致番茄红素被积累,不能快速地转化为β-胡萝卜素,最终影响虾青素的生产。XIE等[42]研究发现双功能番茄红素环化酶/八氢番茄红素合成酶(bifunctional lycopene cyclase/phytoene synthase,CarRP)是一种双功能酶,拥有番茄红素环化酶活性的P区和番茄红素β-环化酶活性的R区,将R区的序列进行随机突变后,筛选出有效去除番茄红素底物抑制的最佳突变位点Y27R,β-胡萝卜素在类胡萝卜素总量的占比从18%提升到了98%,有效地去除了番茄红素底物抑制。他们还从另一种角度出发,在不去除番茄红素底物抑制的情况下,用限制代谢流的方法缓解底物抑制,控制番茄红素前体GGPP生成的量,使番茄红素生成的量低于触发底物抑制水平的量,间接地去除了番茄红素底物抑制,增加了β-胡萝卜素的产量,最终通过发酵培养使其产量达到了39.5 g/L,比初始菌株提高了1 441倍,解除代谢中间体的反馈抑制效应,可以显著提高虾青素前体β-胡萝卜素的产量,对虾青素的生产同样具有指导意义。
4.2 级联酶增加反应速率
图1显示,从β-胡萝卜素到虾青素合成过程中要经历7种中间产物[43],分别是海胆酮(echinenone)、角黄素(canthaxanthin)、金盏花红素(adonirubin)、羟基海胆酮(hydroxyechinenone)、β-隐黄质(β-cryptoxanthin)、玉米黄质(zeaxanthin)、阿多尼红素(adonixanthin)。如此多的中间产物生产线影响了虾青素最终产量。为缩短中间产物与催化酶之间的距离, HENKE等[43]在谷氨酸棒杆菌产虾青素的研究中使用了一种简单的方法将酶连接在一起,即在β-胡萝卜素羟化酶和β-胡萝卜素酮醇酶之间连上一段Linker,拉近了酶与底物的距离,最终使虾青素产量达到了3.1 mg/g DCW,相比改造前产量提高了7倍。
KANG等[44]在大肠杆菌产虾青素的研究中采用Mi3(一种球状蛋白笼)作为支架,将MVP途径中的3个酶AtoB、3-羟基-3-甲基戊二酸单酰辅酶A合酶(3-hydroxy-3-methylglutaryl-CoA-synthase,HmgS)和3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-coenzyme A reductase,HmgR)通过SpyCatcher和SpyTag固定在Mi3表面,使酶与底物的距离拉近。结果显示,异丙基-β-D-硫代半乳糖苷诱导使最终虾青素前体物质番茄红素效价达151.6 mg/L,是原始菌株的8.5倍。SUN等[45]通过模仿模块化聚酮合成酶(modular polyketide synthases,PKSs)在原核生物大肠杆菌中将虾青素合成途径中的酶进行组装,拉近酶与底物的距离,减少中间产物的游离,发酵后虾青素产量为16.9 mg/g DCW,是目前原核生物生产虾青素的最高产量。
真核生物由于存在多种细胞器,使得细胞代谢涉及广泛的串扰和复杂的调节机制,如MA等[46]在解脂耶氏酵母产虾青素的研究中发现,脂溶性的β-胡萝卜素随着脂质合成从内质网转移到脂质体,最后随着游离脂肪酸转移到过氧化物酶体中,这种现象会导致终产物产量低并形成不良副产物。MA等[46]将外源引入解脂耶氏酵母的β-胡萝卜素羟化酶(CrtZ,来自雨生红球藻)和β-胡萝卜素酮醇酶(CrtW,来自副球菌)融合表达,再通过添加膜蛋白定位标签的方式分别同时定位到内质网、脂质体和过氧化物酶体上,有效地解决了由细胞器隔离机制导致的底物和酶距离远的问题,使解脂耶氏酵母在补料分批发酵中虾青素产量为16.7 mg/g DCW,是目前真核生物生产虾青素的最高产量。
5 结论
虾青素具备极强的抗氧化功能,因而在食品营养、医疗保健、饲料等领域拥有非常大的应用价值和发展空间。近年来,虾青素在市场上的需求量不断加大,构建虾青素合成细胞工厂生产虾青素也备受关注。合成生物学技术的迅速发展也为虾青素合成细胞工厂的构建提供了新的契机,为实现大规模的设计、开发、改造与应用虾青素细胞工厂提供了更多可能。微生物合成虾青素分为3个阶段,分别为中心碳代谢循环阶段、虾青素前体物质合成阶段和虾青素合成阶段。构建高产虾青素的菌株,就要从这3个阶段出发,综合设计,通过打开限速酶的限速、扩大及平衡虾青素前体池、采用多酶级联等方法,及通过动态调控的方式来获得更多的细胞工厂和更高的产量。
综上所述,通过多种途径对微生物进行代谢工程改造以提高虾青素产量显示出巨大的潜力,未来还会有更多的微生物会被开发作为虾青素的生产宿主,从而逐步满足市场的需求。
[1] 孙存普, 田文勇.虾青素:红色奇迹 席卷世界[M].北京:中国医药科技出版社, 2016.
SUN C P, TIAN W Y.Astaxanthin:Red Wonders Take the World by Storm[M].Beijing:China Medical Science Press, 2016.
[2] LI J J, GUO C Y, WU J Y.Astaxanthin in liver health and disease:A potential therapeutic agent[J].Drug Design, Development and Therapy, 2020, 14:2275-2285.
[3] WU L W, MO W H, FENG J, et al.Astaxanthin attenuates hepatic damage and mitochondrial dysfunction in non-alcoholic fatty liver disease by up-regulating the FGF21/PGC-1α pathway[J].British Journal of Pharmacology, 2020, 177(16):3760-3777.
[4] ZHANG X S, LU Y, LI W, et al.Astaxanthin ameliorates oxidative stress and neuronal apoptosis via SIRT1/NRF2/Prx2/ASK1/p38 after traumatic brain injury in mice[J].British Journal of Pharmacology, 2021, 178(5):1114-1132.
[5] DONOSO A, GONZ LEZ-DUR
LEZ-DUR N J, MU
N J, MU OZ A A, et al.“Therapeutic uses of natural astaxanthin:An evidence-based review focused on human clinical trials”[J].Pharmacological Research, 2021, 166:105479.
OZ A A, et al.“Therapeutic uses of natural astaxanthin:An evidence-based review focused on human clinical trials”[J].Pharmacological Research, 2021, 166:105479.
[6] GIANNACCARE G, PELLEGRINI M, SENNI C, et al.Clinical applications of astaxanthin in the treatment of ocular diseases:Emerging insights[J].Marine Drugs, 2020, 18(5):239.
[7] LIU F, SMITH A D, SOLANO-AGUILAR G, et al.Mechanistic insights into the attenuation of intestinal inflammation and modulation of the gut microbiome by krill oil using in vitro and in vivo models[J].Microbiome, 2020, 8(1):83.
[8] COOPERSTONE J L, GOETZ H J, RIEDL K M, et al.Relative contribution of α-carotene to postprandial vitamin A concentrations in healthy humans after carrot consumption[J].The American Journal of Clinical Nutrition, 2017, 106(1):59-66.
[9] SZTRETYE M, DIENES B, GÖNCZI M, et al.Astaxanthin:A potential mitochondrial-targeted antioxidant treatment in diseases and with aging[J].Oxidative Medicine and Cellular Longevity, 2019, 2019:3849692.
[10] MULARCZYK M, MICHALAK I, MARYCZ K.Astaxanthin and other nutrients from Haematococcus pluvialis-multifunctional applications[J].Marine Drugs, 2020, 18(9):459.
[11] BRENDLER T, WILLIAMSON E M.Astaxanthin:How much is too much? A safety review[J].Phytotherapy Research:PTR, 2019, 33(12):3090-3111.
[12] ZHOU T, WANG X F, JU Y, et al.Stability application and research of astaxanthin integrated into food[J].IOP Conference Series:Materials Science and Engineering, 2018, 394:022007.
[13] MART NEZ-DELGADO A A, KHANDUAL S, VILLANUEVA-RODR
NEZ-DELGADO A A, KHANDUAL S, VILLANUEVA-RODR GUEZ S J.Chemical stability of astaxanthin integrated into a food matrix:Effects of food processing and methods for preservation[J].Food Chemistry, 2017, 225:23-30.
GUEZ S J.Chemical stability of astaxanthin integrated into a food matrix:Effects of food processing and methods for preservation[J].Food Chemistry, 2017, 225:23-30.
[14] GALASSO C, OREFICE I, TOSCANO A, et al.Food modulation controls astaxanthin accumulation in eggs of the sea urchin Arbacia lixula[J].Marine Drugs, 2018, 16(6):186.
[15] DAVINELLI S, NIELSEN M E, SCAPAGNINI G.Astaxanthin in skin health, repair, and disease:A comprehensive review[J].Nutrients, 2018, 10(4):522.
[16] CHEN L, WANG J L, NI H, et al.Disruption of Phaffia rhodozyma cells and preparation of microencapsulated astaxanthin with high water solubility[J].Food Science and Biotechnology, 2018, 28(1):111-120.
[17] AO X, KIM I H.Effects of astaxanthin produced by Phaffia rhodozyma on growth performance, antioxidant activities, and meat quality in Pekin ducks[J].Poultry Science, 2019, 98(10):4954-4960.
[18] 陈丹, 汪锋, 蒋珊, 等.虾青素化学和生物合成研究进展[J].食品工业科技, 2021, 42(21):445-453.
CHEN D, WANG F, JIANG S, et al.Research progress on chemical and biological synthesis of astaxanthin[J].Science and Technology of Food Industry, 2021, 42(21):445-453.
[19] WAN X, ZHOU X R, MONCALIAN G, et al.Reprogramming microorganisms for the biosynthesis of astaxanthin via metabolic engineering[J].Progress in Lipid Research, 2021, 81:101083.
[20] OSLAN S N H, SHOPARWE N F, YUSOFF A H, et al.A review on Haematococcus pluvialis bioprocess optimization of green and red stage culture conditions for the production of natural astaxanthin[J].Biomolecules, 2021, 11(2):256.
[21] ANILA N, SIMON D P, CHANDRASHEKAR A, et al.Metabolic engineering of Dunaliella salina for production of ketocarotenoids[J].Photosynthesis Research, 2016, 127(3):321-333.
[22] DIAO J J, SONG X Y, ZHANG L, et al.Tailoring cyanobacteria as a new platform for highly efficient synthesis of astaxanthin[J].Metabolic Engineering, 2020, 61:275-287.
[23] AZIZI M, MOTESHAFI H, HASHEMI M.Distinctive nutrient designs using statistical approach coupled with light feeding strategy to improve the Haematococcus pluvialis growth performance and astaxanthin accumulation[J].Bioresource Technology, 2020, 300:122594.
[24] LIM K C, YUSOFF F M, SHARIFF M, et al.Astaxanthin as feed supplement in aquatic animals[J].Reviews in Aquaculture, 2018, 10(3):738-773.
[25] ZHU Y X, ZHANG Z, XU X D, et al.Simultaneous promotion of photosynthesis and astaxanthin accumulation during two stages of Haematococcus pluvialis with ammonium ferric citrate[J].The Science of the Total Environment, 2021, 750:141689.
[26] PULZ O, GROSS W.Valuable products from biotechnology of microalgae[J].Applied Microbiology and Biotechnology, 2004, 65(6):635-648.
[27] STOKLOSA R J, JOHNSTON D B, NGHIEM N P.Utilization of sweet Sorghum juice for the production of astaxanthin as a biorefinery co-product by Phaffia rhodozyma[J].ACS Sustainable Chemistry &Engineering, 2018, 6(3):3124-3134.
[28] LU Q, BU Y F, LIU J Z.Metabolic engineering of Escherichia coli for producing astaxanthin as the predominant carotenoid[J].Marine Drugs, 2017, 15(10):296.
[29] PARK S Y, BINKLEY R M, KIM W J, et al.Metabolic engineering of Escherichia coli for high-level astaxanthin production with high productivity[J].Metabolic Engineering, 2018, 49:105-115.
[30] HEIDER S A E, WOLF N, HOFEMEIER A, et al.Optimization of the IPP precursor supply for the production of lycopene, decaprenoxanthin and astaxanthin by Corynebacterium glutamicum[J].Frontiers in Bioengineering and Biotechnology, 2014, 2:28.
[31] WANG J L, NIYOMPANICH S, TAI Y S, et al.Engineering of a highly efficient Escherichia coli strain for mevalonate fermentation through chromosomal integration[J].Applied and Environmental Microbiology, 2016, 82(24):7176-7184.
[32] ANASTASIOU E, LORENTZ K O, STEIN G J, et al.Prehistoric schistosomiasis parasite found in the Middle East[J].The Lancet.Infectious Diseases, 2014, 14(7):553-554.
[33] TARKOWSK D, STRNAD M.Isoprenoid-derived plant signaling molecules:Biosynthesis and biological importance[J].Planta, 2018, 247(5):1051-1066.
D, STRNAD M.Isoprenoid-derived plant signaling molecules:Biosynthesis and biological importance[J].Planta, 2018, 247(5):1051-1066.
[34] MCNERNEY M P, STYCZYNSKI M P.Precise control of lycopene production to enable a fast-responding, minimal-equipment biosensor[J].Metabolic Engineering, 2017, 43:46-53.
[35] TETALI S D.Terpenes and isoprenoids:A wealth of compounds for global use[J].Planta, 2019, 249(1):1-8.
[36] YU W J, ZHANG L T, ZHAO J, et al.Exogenous sodium fumarate enhances astaxanthin accumulation in Haematococcus pluvialis by enhancing the respiratory metabolic pathway[J].Bioresource Technology, 2021, 341:125788.
[37] RODRIGUES J S, LINDBERG P.Metabolic engineering of Synechocystis sp.PCC 6803 for improved bisabolene production[J].Metabolic Engineering Communications, 2020, 12:e00159.
[38] ZHANG Y, SHI M C, MAO X M, et al.Time-resolved carotenoid profiling and transcriptomic analysis reveal mechanism of carotenogenesis for astaxanthin synthesis in the oleaginous green alga Chromochloris zofingiensis[J].Biotechnology for Biofuels, 2019, 12:287.
[39] PÉREZ-GARC A F, PETERS-WENDISCH P, WENDISCH V F.Engineering Corynebacterium glutamicum for fast production of L-lysine and L-pipecolic acid[J].Applied Microbiology and Biotechnology, 2016, 100(18):8075-8090.
A F, PETERS-WENDISCH P, WENDISCH V F.Engineering Corynebacterium glutamicum for fast production of L-lysine and L-pipecolic acid[J].Applied Microbiology and Biotechnology, 2016, 100(18):8075-8090.
[40] HENKE N A, WIEBE D, PÉREZ-GARC A F, et al.Coproduction of cell-bound and secreted value-added compounds:Simultaneous production of carotenoids and amino acids by Corynebacterium glutamicum[J].Bioresource Technology, 2018, 247:744-752.
A F, et al.Coproduction of cell-bound and secreted value-added compounds:Simultaneous production of carotenoids and amino acids by Corynebacterium glutamicum[J].Bioresource Technology, 2018, 247:744-752.
[41] MA Y S, LIU N, GREISEN P, et al.Removal of lycopene substrate inhibition enables high carotenoid productivity in Yarrowia lipolytica[J].Nature Communications, 2022, 13(1):572.
[42] XIE Y X, CHEN S L, XIONG X C.Metabolic engineering of non-carotenoid-producing yeast Yarrowia lipolytica for the biosynthesis of Zeaxanthin[J].Frontiers in Microbiology, 2021, 12:699235.
[43] HENKE N A, WENDISCH V F.Improved astaxanthin production with Corynebacterium glutamicum by application of a membrane fusion protein[J].Marine Drugs, 2019, 17(11):621.
[44] KANG W, MA X, KAKARLA D, et al.Organizing enzymes on self-assembled protein cages for cascade reactions[J].Angewandte Chemie (International Ed.in English), 2022, 61(52):e202214001.
[45] SUN X X, YUAN Y J, CHEN Q T, et al.Metabolic pathway assembly using docking domains from type I cis-AT polyketide synthases[J].Nature Communications, 2022, 13(1):5541.
[46] MA Y S, LI J B, HUANG S W, et al.Targeting pathway expression to subcellular organelles improves astaxanthin synthesis in Yarrowia lipolytica[J].Metabolic Engineering, 2021, 68:152-161.