柚皮素是一类广泛存在于橙子、柚子和柠檬等水果中的柑橘类黄酮化合物。据文献报道,柚皮素具有多种显著的生理功效,如抗氧化、抗炎、抗菌和抗肿瘤等[1-2]。除此之外,柚皮素在口服进入人体后,能够通过减少氧化应激、调控基因表达、控制酶的合成以及调节酶的活性,保护人体的心血管系统、神经系统、肠胃和肝脏等免受疾病的侵害,其在医药和营养保健领域具有很高的研究价值和广泛的应用前景[2]。
尽管过去许多研究人员已经探索了这种植物成分以评估其有可能的生物活性,但研究证实柚皮素自身疏水性高,溶解度低,在人体内的口服利用度相对较低(仅10%的摄入量是生物可利用的)[3]。这些因素限制了柚皮素在食品和制药领域的功效和应用。为了解决上述问题,研究人员开发了针对柚皮素的多种纳米递送系统,包括聚合物纳米颗粒、脂质体、纳米乳液和纳米混悬液等,这些纳米递送系统在很大程度上提高了柚皮素的溶解度、生物利用度和药物活性等[4]。尤其是脂质纳米递送系统的出现,使得柚皮素具有靶向性,能够有效作用于目标部位[3]。
由此可见,纳米递送系统的开发对于柚皮素的未来研究和发展至关重要。然而当前国内通过纳米递送系统提高柚皮素生物利用度的研究和综述非常有限,因此有必要对其进行系统总结。笔者课题组主要以多酚类化合物的纳米递送系统为研究对象,已开发了包括纳米颗粒、油凝胶、乳液等在内的多种纳米递送系统,提高了多种多酚化合物的生物利用度和稳定性[5-6]。综上,本文探究了当前不同递送系统的递送效果,并对柚皮素纳米递送体系的应用前景进行展望,以期为研究人员提供借鉴。
1 柚皮素概述
1.1 柚皮素的化学结构与理化性质
柚皮素由Power和Tutin于1907年首次发现[2]。柚皮素在各类柑橘类水果(如橘子、柠檬等)中含量最多。柚皮素分子质量为272.256 g/mol,氢供体数和受体数分别为3和5。常温下,纯柚皮素呈固态,熔点为208~251 ℃,可溶于乙醇、二甲基甲酰胺和二甲基亚砜等有机溶剂,但微溶于水,其水溶解度为475 mg/L,油水分配系数log P值为2.42[2,7]。通过紫外光谱法测定柚皮素的解离常数(pKa)为298.2 K。柚皮素的pKa1和pKa2值分别为7.05±0.06和8.84±0.08,具有弱碱性[3]。
1.2 柚皮素的生理功效
柚皮素与人类的生活饮食息息相关,其广泛的生理功效倍受关注,包括抗炎、抗氧化、抗菌和抗癌活性。此外,柚皮素被证实具有多种人体组织器官保护功能,包括心血管保护、神经系统保护、肠胃保护和肝脏保护(图1)。
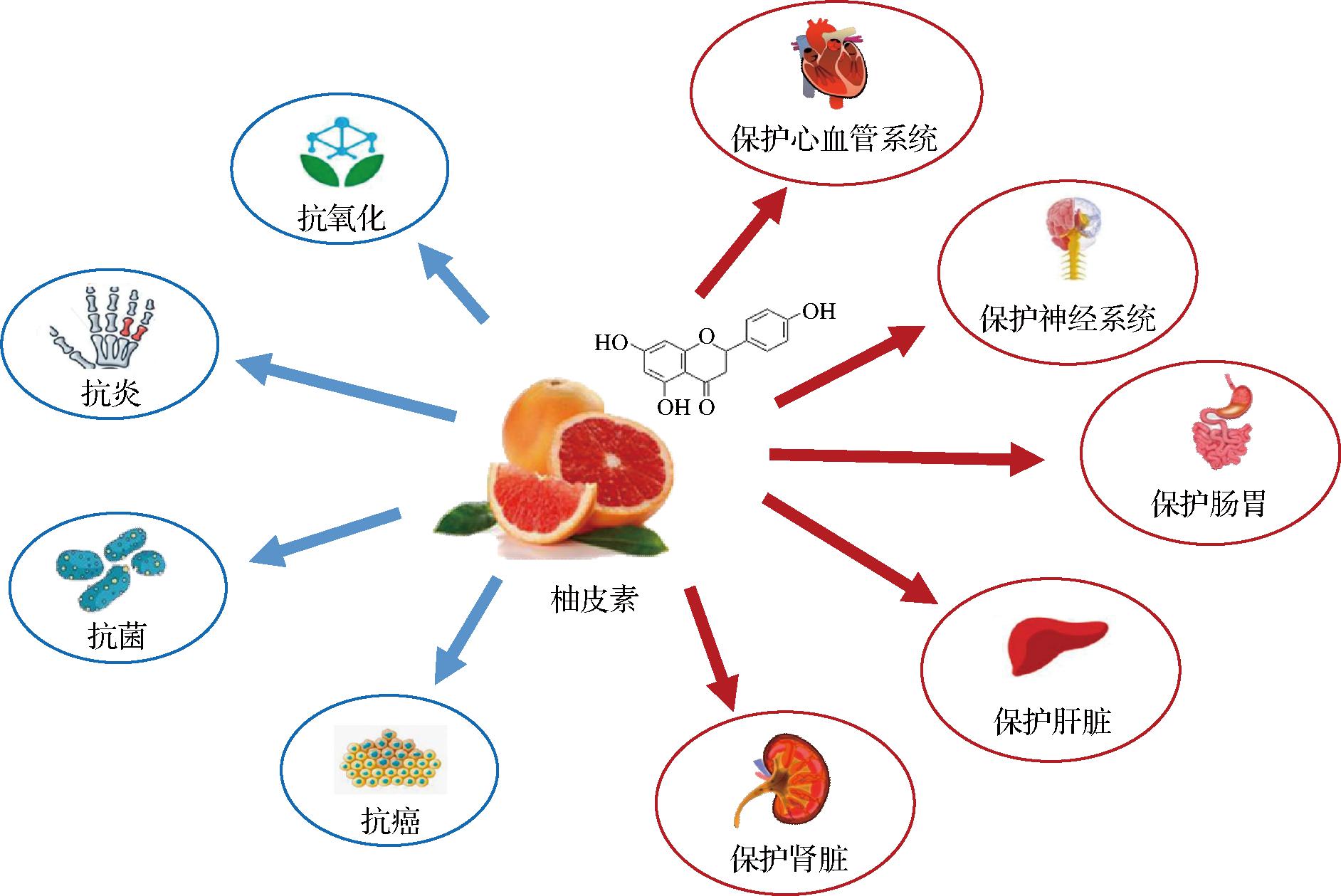
图1 柚皮素的生理功效
Fig.1 Physiological effects of naringenin
1.2.1 柚皮素的抗氧化功效
在炎症级联反应的早期,炎症介质激活巨噬细胞,并导致白细胞在炎症部位的聚集。活化的巨噬细胞和中性粒细胞会产生·O2-、活性氧和活性氮,导致氧化应激[8]。柚皮素的抗氧化作用主要通过清除自由基和活性氧、抑制脂质过氧化损伤、提高超氧化物歧化酶和过氧化氢酶的活性等方式进行[2]。柚皮素能有效地清除自由基和活性氧,这归因于其结构中羟基的供电子性质,包括5-羟基和5, 7-二羟基[8]。柚皮素羟基中的氢原子可以转移到自由基上,然后通过共振稳定自身。此外,柚皮素还可以调节细胞中抗氧化基因的表达,如诱导巨噬细胞激活核转录因子(nuclear factor erythroid-2-related factor 2,Nrf2),激活抗氧化酶(heme oxygenase-1,HO-1),诱导机体的抗氧化应答[3]。
1.2.2 抗炎功效
在炎症发生后,除了氧化应激外,由炎症介质激活的巨噬细胞会产生细胞因子,如白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和其他介质(如NO、前列腺素等)[2]。柚皮素可以抑制促炎细胞因子和介质的产生。例如,KUMAR等[9]发现柚皮素纳米颗粒可以显著下调NF-κB和P38 MAPK(炎症信号通路),抑制环氧合酶-2(cyclooxygenase-2,COX-2)和一氧化氮合酶(inducible nitric oxide synthase,iNOS)的表达,从而抑制促炎细胞因子和NO的产生。
1.2.3 抗菌功效
研究表明,柚皮素可抑制金黄色葡萄球菌、大肠杆菌和变形链球菌在内的多种细菌的体外生长[10]。WANG等[10]发现柚皮素可以通过改变细菌细胞膜流动性,细胞膜中脂肪酸占比,调控脂肪酸合成等方式发挥抑菌功效。柚皮素也会影响细胞膜的通透性和完整性,造成细胞内物质和遗传物质的泄露,进而发挥抗菌作用[3]。此外,柚皮素与氨苄西林、甲氧西林、四环素和万古霉素对金黄色葡萄球菌具有协同抗菌特性,可以显著增强抗生素的抗菌作用,且对耐药细菌的抑制效果显著增强[11]。
1.2.4 抗肿瘤功效
柚皮素具有潜在的癌症化学预防和治疗作用,对多种癌细胞具有治疗效果[12-14]。如图2所示,柚皮素可通过干扰多种转导途径限制癌细胞增殖和转移,包括使致癌物失活、抗增殖作用、细胞周期阻滞、诱导细胞凋亡和抑制持续的血管生成。例如,柚皮素可以下调鸟氨酸脱羧酶(ornithine decarboxylase,ODC),导致多胺DNA和蛋白质合成的减少[12]。柚皮素可以通过调节细胞凋亡相关信号通路,如上调磷酸肌醇3-激酶/AKT信号通路,诱导细胞凋亡[13]。此外,柚皮素可以使线粒体跨膜电位丧失,导致线粒体破裂并将细胞色素C释放到细胞质中,诱导半胱天冬酶3和半胱天冬酶9合成,进而诱导细胞凋亡[14]。另一方面,柚皮素通过降低血管内皮生长因子(vascular endothlial growth factor,VEFG)、碱性成纤维细胞生长因子[如白细胞介素-8(interleukin-8,IL-8)和TGF-α(transforming growth factor-α)等]发挥其血管生成抑制作用,减少癌细胞的转移和侵袭[14]。
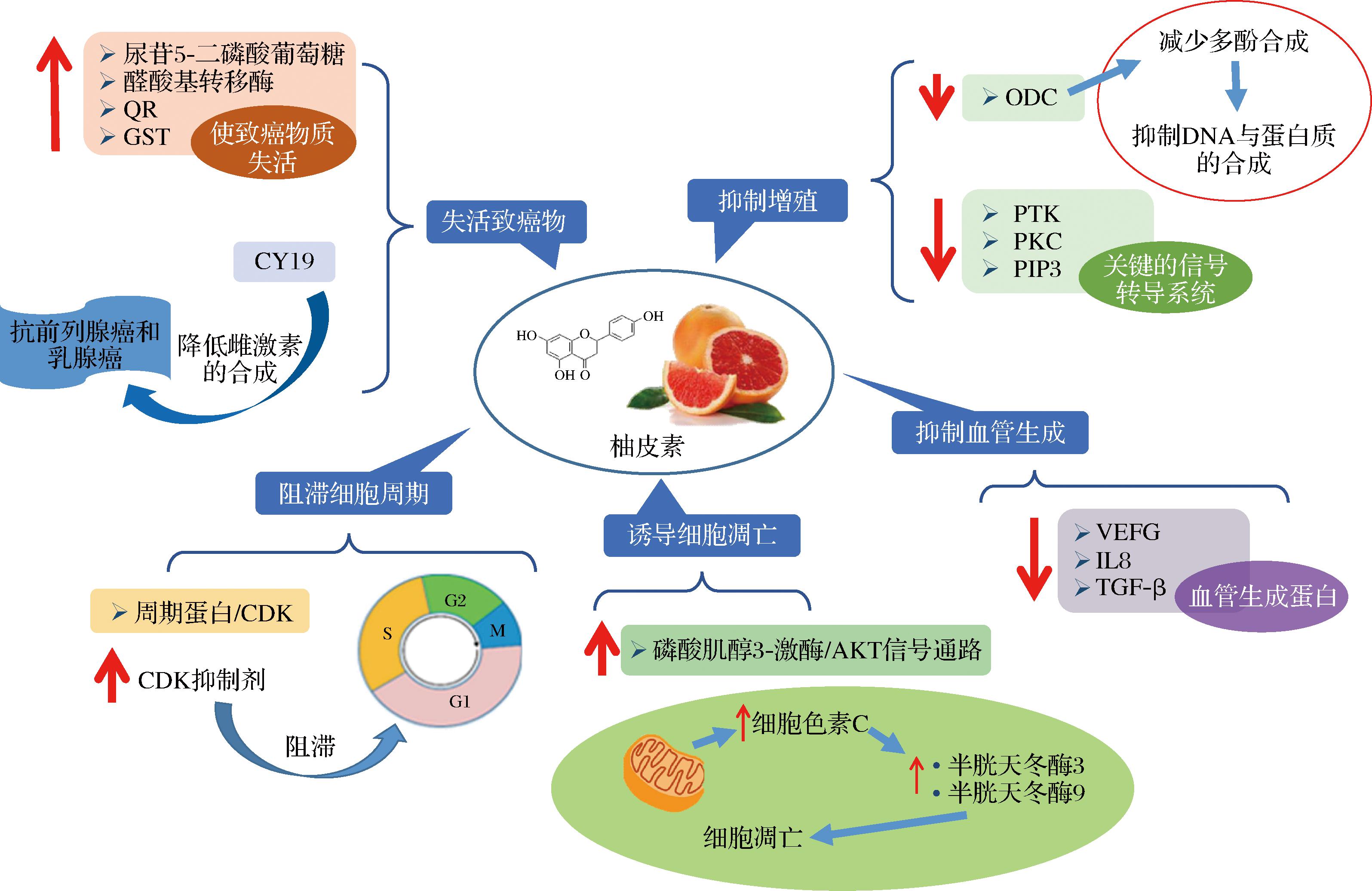
图2 柚皮素的抗癌功效
Fig.2 Anti-cancer properties of naringenin
1.2.5 人体保护功效
柚皮素可通过减少氧化应激、抑制炎症因子释放、调控基因表达、调节生物酶的合成等多种方式,保护人体的心血管系统、神经系统、肠胃和肝脏等组织器官[15-18]。例如,柚皮素通过增强抗氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽-s-转移酶(glutathione S-transferase,GST)和过氧化氢酶(catalase,CAT)的活性,降低自由基和活性氧对心肌细胞造成的氧化应激,保护心血管系统[15]。柚皮素可以通过抑制促凋亡蛋白半胱天冬酶3和半胱天冬酶9的表达,增加抗凋亡蛋白(b-cell lymphoma-2,Bcl-2)的表达,减少氧化应激,抑制神经元细胞凋亡,保护神经系统[16]。当肠胃出现溃疡后,柚皮素可以有效减少组织溃疡、炎症和结肠坏死,也可能通过抑制iNOS等促炎标志物、减少炎症细胞因子、降低黏膜中的蛋白浓度等治疗结肠炎[17]。此外,在肝脏保护中,柚皮素可以显著缓解由高胆固醇膳食引发的肝脏炎症,包括显著减少促炎介质的释放,下调TNF-α、基质金属蛋白酶-2(matrix metallopeptidase-2,MMP-2)和基质金属蛋白酶-9(matrix metallopeptidase-9,MMP-9)的表达,有助于减少巨噬细胞浸润,并通过降解细胞外基质来调节坏死性炎症[18]。
2 柚皮素的吸收、代谢与生物利用
2.1 柚皮素的吸收、代谢
柚皮素在人体内的吸收和代谢过程如图3所示。在口服给药后,柚皮素可被整个胃肠道吸收,但其在小肠的吸收多于胃和结肠[19]。柚皮素可被β-葡萄糖苷酶水解成苷元后被小肠上皮细胞吸收,还可以通过被动的细胞外扩散被人肠上皮细胞吸收[20]。柚皮素经肠道代谢后会形成大量的硫酸盐、葡萄糖醛酸酯等代谢物,其生物利用度显著降低[20]。
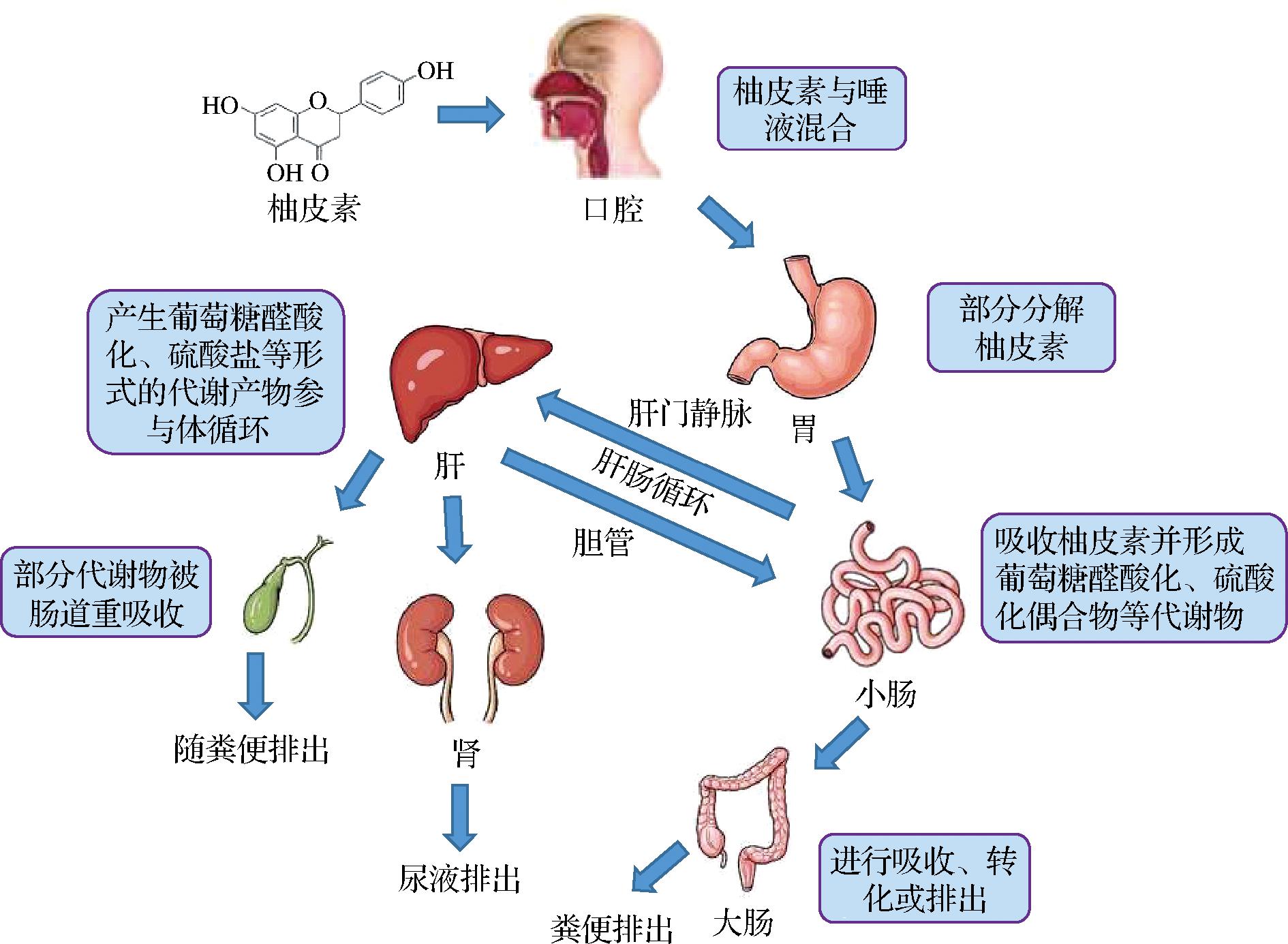
图3 柚皮素在人体的吸收和代谢过程
Fig.3 Absorption and metabolism of naringenin in human body
经胃肠道吸收后,未代谢的柚皮素可与血液中的白蛋白结合,通过血液循环迅速流动到肝脏、肾脏和脾脏等器官。在肝脏和肾脏中,柚皮素可在磺基转移酶和尿苷二磷酸葡萄糖醛酸转移酶的作用下生成葡萄糖醛酸化、硫酸盐等形式的代谢产物[21]。其中,98%的柚皮素葡萄糖醛酸作为柚皮素代谢物存在于血浆中,参与体循环。组织器官中的β-葡萄糖醛酸酶可以参与该代谢物的水解,释放柚皮素进行再循环[22]。此外,肠道微生物可分泌各种的生物酶参与柚皮素的生物转化,通过糖苷化、甲基化、脱氢等反应生成13种微生物代谢物[22],随后将柚皮素代谢物进行吸收、转化或排出。
2.2 柚皮素的生物利用
柚皮素在血液中的代谢速度快,半衰期短。BAI等[20]研究发现人口服柚皮素后,其在血浆中总质量浓度约2.00~2.00×102 ng/mL,并随着肠道代谢,其浓度在约(3.62±3.19) h时增加至最大。柚皮素在血浆中循环的主要形式是通过代谢成柚皮素硫酸盐和柚皮素葡萄糖醛酸酯。实际上,柚皮素的口服生物利用率很低,这主要是由于:1)与大多数类黄酮化合物一样,柚皮素具有疏水性,溶解度低;2)两亲性的柚皮素大分子不易穿过脂质细胞膜;3)胃肠道降解、肝脏代谢使得柚皮素易分解。因此,为了克服柚皮素生物利用度低等缺陷,科研人员开发了多种负载柚皮素的纳米递送载体(例如纳米颗粒、纳米乳液、脂质体和纳米混悬液等)。这些纳米递送载体极大地提高了柚皮素的稳定性、溶解度、生物利用度等,实现了多种疾病的预防和治疗[2]。
3 柚皮素纳米递送系统
近年来,为了提高药物的治疗效果,各种纳米递送系统已被广泛应用于给药研究,以提高药物生物利用度、溶解度、载药量、药物保留时间、促进靶向给药并减小药物的副作用等。纳米递送系统中药物载体通常由多种化合物构成,包括人工聚合物和天然聚合物(如脂质、蛋白质等),药物则被溶解、封装或附着在药物载体上[3]。根据体系构成的不同,柚皮素纳米递送系统可分为聚合物纳米颗粒递送系统、脂质纳米递送系统、乳液基纳米递送系统以及纳米悬浮液递送系统(图4)。
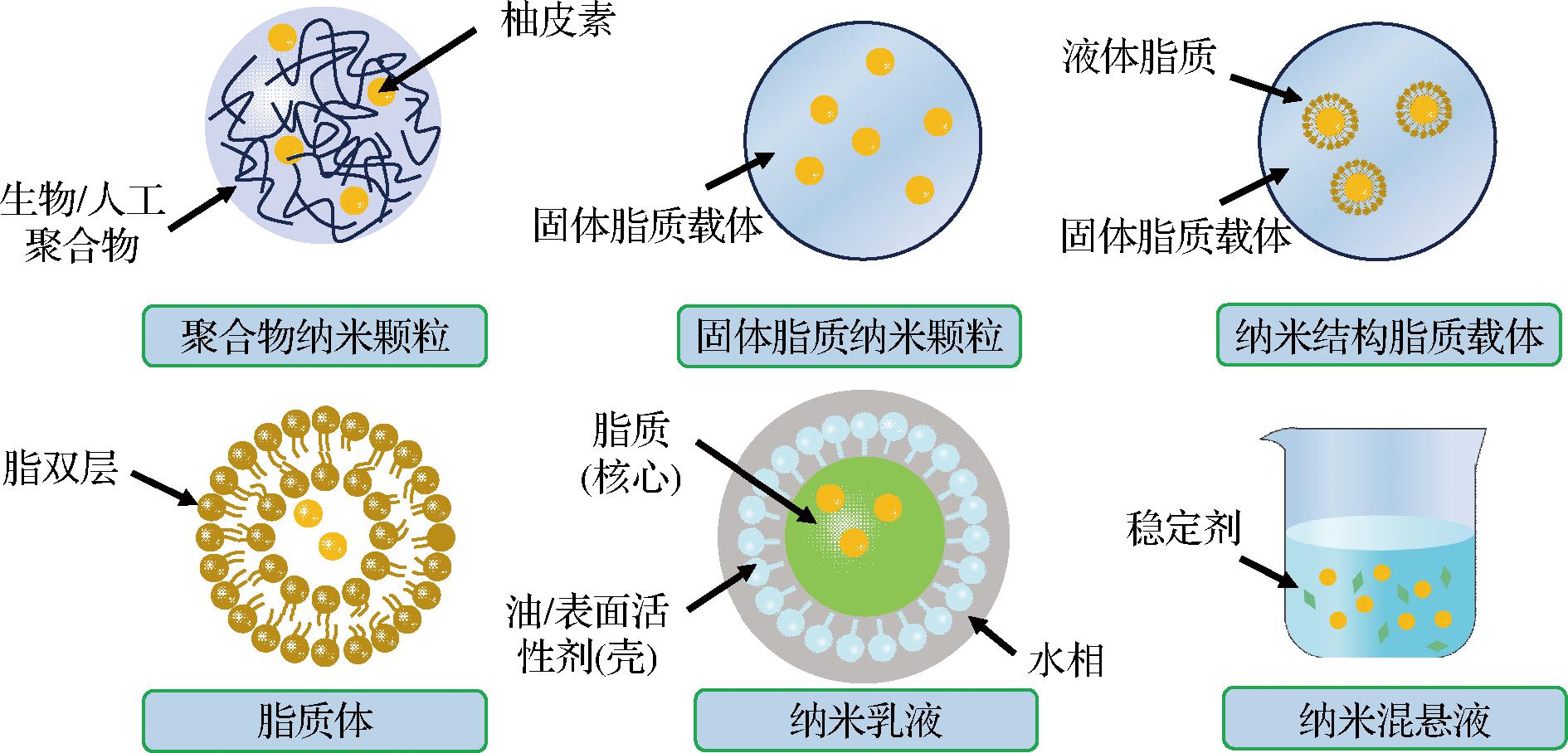
图4 柚皮素纳米递送系统示意图
Fig.4 Schematic diagram of naringenin nano-delivery system
3.1 聚合物纳米颗粒
自20世纪80年代以来,各种聚合物纳米颗粒(尺寸为100~1 000 nm,包括聚合物纳米凝胶、纳米胶囊及纳米胶束等)已被应用于药物传递系统,将不同的药物转运到目标器官[23]。与传统的治疗方法相比,聚合物纳米颗粒在给药应用中提高了药物的生物相容性、生物利用度、安全性、药物的渗透性和稳定性,并保护药物不被水解酶水解,提高了治疗效果。在这种递送系统中,聚合物纳米载体往往要求是具有生物相容性和可生物降解的聚合物,这样可以有效降低载体的毒性。依据聚合物纳米颗粒组成的不同,聚合物纳米颗粒可分为人工聚合物纳米颗粒与天然聚合物纳米颗粒。
3.1.1 人工聚合物纳米颗粒
多种具有生物相容性、可降解性及低毒性的人工聚合物(包括聚乙烯醇、聚乙烯吡咯烷酮和聚乙二醇化聚乳酸酯等)被证实可用于柚皮素纳米颗粒的构建[24-26]。SMRUTHI等[24]利用聚乳酸和聚乙烯醇对柚皮素进行封装,发现这种纳米颗粒在模拟胃肠道条件下具有更好的封装效率和持续释放柚皮素的特点,柚皮素的生物利用度提高了4.7倍。值得注意的是,通常人工聚合物的一些性质(如亲疏水性、靶向性等)会影响聚合物纳米颗粒的结构与性质。两亲性聚合物分子(如聚乙二醇化聚乳酸酯、甲氧基聚乙二醇-聚己内酯)可以在水介质中自发形成核壳结构,它们的疏水核心可以作为柚皮素的储层,将疏水的柚皮素包裹在聚合物胶束中,进而提高柚皮素在水介质中的溶解度/分散性[25]。而亲水性聚合物(如右旋糖酐和聚乙烯吡咯烷酮等)则可以通过涂层的形式包裹柚皮素,形成纳米颗粒[26]。这些亲水性聚合物通过与柚皮素形成分子络合物进而缓解柚皮素结晶,提高柚皮素的溶解度和生物利用度。此外,聚己内酯被认为具有很好的靶向性,能够保护正常非靶向组织免受毒性。因此,聚己内酯-柚皮素纳米颗粒具有优异的主动靶向作用,能增强癌细胞对柚皮素的摄取并提高柚皮素对癌细胞的毒性作用[27]。
3.1.2 天然聚合物纳米颗粒
与人工聚合物相比,具有各种生物活性的天然聚合物能更有效地提高柚皮素生物利用度、安全性和生物相容性,在保持治疗效果的同时降低毒性,增强渗透性和吸收,并且可以有效调节药物的保留时间[28]。应用于柚皮素纳米颗粒构建的天然聚合物的类型非常广泛[包括蛋白质(丝素蛋白、β-酪蛋白、乳球蛋白)[28-30]和多糖(壳聚糖、海藻酸钠、纤维素)[31-33]等]。天然聚合物纳米颗粒的构建方式多样,主要包括:1)交联法:即利用物理或化学交联剂实现天然聚合物与柚皮素的交联;2)自上而下法:即将天然聚合物与柚皮素在剪切、撞击等力的作用下产生纳米颗粒的方法(如涡旋混合、研磨等);3)自下而上法:即通过环境诱导(如温度、pH值、离子强度、溶剂极性等)使生物聚合物与柚皮素组装形成纳米颗粒(如溶解-吸附法、反溶剂重结晶法等[29])。研究表明,纳米颗粒递送系统构建时所选择的原料、制备方法不同,会对纳米颗粒的形成、递送体系的理化性质、功能特性等产生影响(表1)。
表1 天然聚合物纳米颗粒在柚皮素递送系统中的应用
Table 1 Application of natural polymer nanoparticles in naringenin delivery system

原料制备方法应用效果参考文献丝素蛋白溶解-吸附法柚皮素的释放量显著提升,具有抗氧化和抗肿瘤活性[28]β-酪蛋白生物交联剂(京尼平)交联合成柚皮素的释放时间增加,控释性能增强[29]β-乳糖球蛋白高温涡旋混合β-乳糖球蛋白抑制了柚皮素的结晶,并提升了其溶解度(3倍)和生物利用度[30]壳聚糖离子凝胶法(三聚磷酸钠作为化学交联剂)柚皮素的封装效率约为80%,模拟胃液中柚皮素释放量约为15%,其自由基的清除活性显著升高[31]壳聚糖、海藻酸钠Na2SO4和CaCl2为交联剂,双交联合成柚皮素的包裹率>90%,具有pH响应及药物缓释的特征[32]反溶剂重结晶法柚皮素纳米化和分散性提升,柚皮素溶出度增加(120 min达到93.4%),柚皮素的抗氧化活性显著提高[33]
3.2 脂质纳米递送系统
在过去的20年里,脂质纳米递送系统一直被认为是解决疏水性药物溶解度局限性的有效方法。脂质作为两亲性或疏水分子,常被用作活性成分递送的载体。由于其生物降解性、生物相容性、毒性低、可增加药物的溶解度和靶向递送的特点而在药物递送系统中很受欢迎。在针对柚皮素的脂质纳米递送系统中,固体脂质纳米颗粒(solid lipid nanoparticles,SLNs)、纳米结构脂质载体(nanostructured lipid carriers,NLCs)和脂质体形式的纳米递送系统被广泛使用。
3.2.1 SLNs
SLNs最早于1991年由MÜLLER等[34]首次合成,是新一代亚微粒给药系统。SLNs是以天然或合成的固体脂质(如硬脂酸、三酰甘油等)为载体,将药物包裹于类脂核中而制成的脂质纳米颗粒。SLNs具有亚微米尺寸(<1 000 nm)。与聚合物、脂质体和乳剂相比,SLNs具有低毒性、无需使用有机溶剂、药物控释、成本低等优点。
近些年,SLNs作为柚皮素纳米递送系统被广泛研究。YANG等[35]以甘油单油酸酯(glyceryl monooleate,GMO)为脂质来源和聚乙二醇琥珀酸酯(tocopheryl polyethylene glycol succinate,TPGS)为稳定剂,采用乳化均质化法制备了(naringenin-solid lipid nanoparticles,NRG-SLNs)。研究发现,柚皮素和脂质聚合物是相溶的,脂质纳米颗粒呈光滑的纳米球状,柚皮素可持续释放长达90 h,NRG-SLNs能有效减少肝损伤和纤维化,并且SLNs显著提高了柚皮素的生物利用度和肝脏的靶向递送。JI等[36]采用乳化和低温凝固技术将柚皮素包裹在SLNs中。NRG-SLNs结构为均匀的球形颗粒,具有高载药量,对人肺癌上皮细胞没有毒性,给药后NRG-SLNs的生物利用度显著增强。WANG等[37]利用微乳化法制备负载柚皮素和紫杉醇的双药物SLNs载体系统,用于治疗多形性胶质母细胞瘤(glioblastoma,GBM),结果表明SLNs显著提高了药物的释放率和吸收率,并改进了药物对GBM的靶向性。
3.2.2 NLCs
NLCs是在SLNs基础上发展的第二代脂质基纳米颗粒。NLCs由在固体脂质中加入液体脂质作为混合类脂基质,以此制备的脂质基纳米颗粒。NLCs的特点在于:药物在脂质基质中的溶解度高、载药量高、药物释放可控,并且,由于其紧凑的结构,药物的爆发释放量也较低。HU等[38]采用乳状液蒸发加低温凝固法制备了柚皮素负载纳米结构脂质载体(naringenin-nanostructured lipid carriers,NRG-NLCs),发现NRG-NLCs具有较高载药能力[载药量为(22.5±1.7)%],并使柚皮素释放率提高了3.5倍,促进了柚皮素的上皮转运和肠道吸收,提高了柚皮素的口服生物利用度。
3.2.3 脂质体
脂质体是由磷脂双分子层膜形成的球形脂质囊泡。这些脂类通常是天然磷脂,如大豆磷脂酰胆碱(soy phosphatidylcholines, SPC),合成磷脂和二棕榈酰磷脂酰胆碱(dipalmitoylphosphatidylcholine,DPPC)。脂质体可以将亲脂性和亲水分子包裹在其中,避免它们的降解,并将药物成分释放到指定的目标上。研究表明,脂质体可以有效改善和增强柚皮素的药物效果[如提高药物的溶解度和生物利用度、改变药物的形态(颗粒大小、Zeta电位、包封效率和药物释放谱)、促进药物靶向],进而提高治疗效果[39]。研究表明,柚皮素脂质体具有更好的物理稳定性和较高的Zeta电位值,与游离的柚皮素相比,柚皮素脂质体具有更高的溶解度和口服利用度,在不同组织中的药物浓度更高,特别是在肝脏中[40]。TSAI等[41]制备了负载柚皮素的弹性脂质体,用于局部皮肤抗氧化,研究表明,与水溶液相比,以弹性脂质体为载体时,柚皮素在皮肤中的沉积量显著增加了7.3~11.8倍,并且能有效缓解多聚甲醛引起的皮肤刺激,表明弹性脂质体适用于柚皮素的局部皮肤靶点。
3.3 乳液基递送载体
3.3.1 纳米乳液
纳米乳液是由水中油分散体组成(液滴尺寸100~600 nm),是利用有机相和水相混合时发生的自乳化机制形成的。纳米乳液是热力学不稳定和动力学稳定的体系,自身易发生沉降、絮凝和聚结。因此,纳米乳液中常加入乳化剂(通常是表面活性剂和助表面活性剂),后者可吸附在油水界面,导致界面张力降低,有利于更小的液滴的形成,并防止液滴的聚集。纳米乳液中的颗粒具有核壳结构(图4),即两亲性材料构成的壳包裹着亲脂性材料构成的核心。亲脂性材料可能包括多种不同的非极性分子,如三酰基甘油、二酰基甘油、单酰基聚醛醇和生物活性成分[42]。两亲性壳可能包含各种表面活性分子(如表面活性剂、磷脂、蛋白质和多硫化合物等[42])。研究表明,纳米乳液可用作柚皮素等疏水性药物的递送体系,并显著改善药物的生物活性和吸收利用情况[42-43](表2)。
表2 乳液基递送载体在柚皮素递送中的应用
Table 2 Application of emulsion based delivery carrier in naringenin delivery
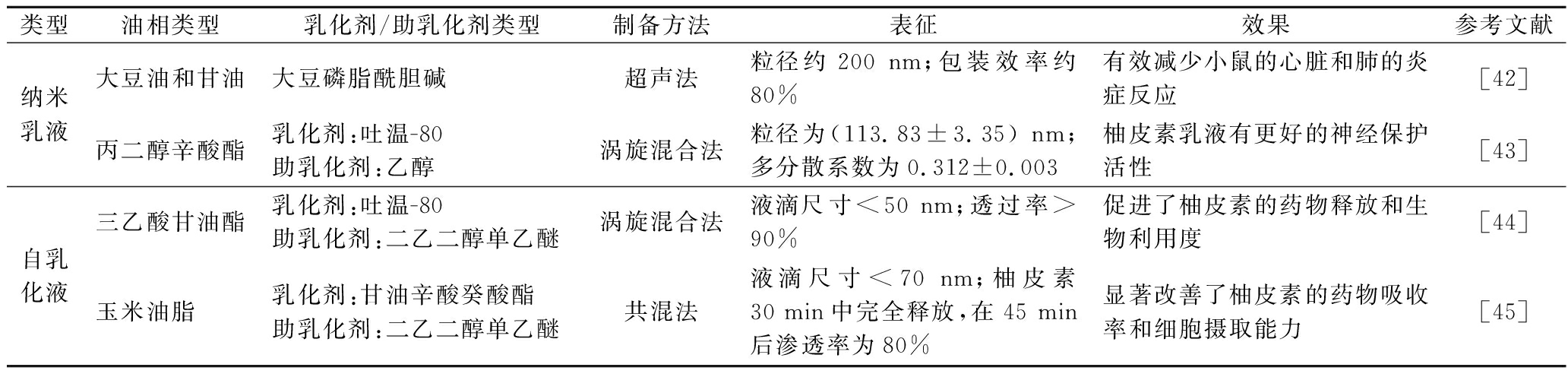
类型油相类型乳化剂/助乳化剂类型制备方法表征效果参考文献纳米乳液大豆油和甘油大豆磷脂酰胆碱超声法粒径约200 nm;包装效率约80%有效减少小鼠的心脏和肺的炎症反应[42]丙二醇辛酸酯乳化剂:吐温-80助乳化剂:乙醇涡旋混合法粒径为(113.83±3.35) nm;多分散系数为0.312±0.003柚皮素乳液有更好的神经保护活性[43]自乳化液三乙酸甘油酯乳化剂:吐温-80助乳化剂:二乙二醇单乙醚涡旋混合法液滴尺寸<50 nm;透过率>90%促进了柚皮素的药物释放和生物利用度[44]玉米油脂乳化剂:甘油辛酸癸酸酯助乳化剂:二乙二醇单乙醚共混法液滴尺寸<70 nm;柚皮素30 min中完全释放,在45 min后渗透率为80%显著改善了柚皮素的药物吸收率和细胞摄取能力[45]
3.3.2 自乳化液
自乳化液是由油相、表面活性剂和助表面活性剂形成的无水均匀液体混合物,是一种无水的纳米乳剂浓缩液。自乳化液的最大特点是在胃肠道蠕动及胃肠液水性介质环境下,它们迅速并自发地乳化形成尺寸小于200 nm的纳米油滴[46]。这些纳米油滴含有溶解在油相中的药物,并且增强了界面表面积,从而改善药物的增溶和渗透性能。此外,自乳化液含有高浓度的表面活性剂和助表面活性剂,具有提高药物渗透性和提高载药能力的优点,可以显著促进高亲脂性药物的生物利用度。
对于自乳化液递送系统,油相、表面活性剂和助表面活性剂的选择至关重要。合适的体系可以有效促进药物的溶解,避免药物在肠腔内稀释后的沉淀,同时也保证制备过程需要较少的油相和乳化剂。通过优化可以选择合适的油相、表面活性剂和助表面活性剂,进而提升药物的溶解速率、多分散性和释放速度。例如,KHAN等[44]根据柚皮素在不同油相中的溶解度差异,选择了溶解度最高的三乙酸甘油酯作为油相,并根据乳化剂/助乳化剂对油相的乳化效率选择了吐温-80和二乙二醇单乙基醚,分别作为乳化剂和助乳化剂用于柚皮素自乳化递送系统的制备(表2)。
3.4 纳米混悬液递送系统
纳米混悬液,也称为纳米晶体,是一种无载体的药物传递系统,由纯药物和稳定剂(表面活性剂或聚合物)组成,平均粒径通常为10~1 000 nm[47]。该系统可作为不溶性药物的递送工具,可降低共溶剂毒性、颗粒大小,并提高药物溶解度、生物利用度、载药量和稳定性等。纳米悬浮液的制备涉及到颗粒的形成,这些颗粒可以通过缩小较大晶体的颗粒尺寸形成纳米晶体(自上而下的方法),也可以通过使溶解分子的沉淀获得颗粒(自下而上的方法)来获得[47]。纳米混悬液中的稳定剂对于维持纳米颗粒的稳定性、抑制颗粒自发的晶体生长、保持颗粒均匀的粒径分布等方面起着重要作用。用于制备纳米悬浮液的稳定剂主要为表面活性剂或聚合物,包括吐温-80、泊洛沙姆188、聚乙二醇(polyethylene glycol,PEG)、聚乙烯醇(polyvinyl alcohol,PVA)、D-α-生育酚聚乙二醇琥珀酸酯(tocofersolan,TPGS)和聚乙烯吡咯烷酮等[48-49]。
当前,许多报道证实了纳米混悬液系统能够显著提高柚皮素的物理化学和药代动力学特性。GERA等[48]将聚乙烯吡咯烷酮作为稳定剂制备了柚皮素纳米悬浮液(naringenin-nanosuspension,NRG-NS)。与纯柚皮素相比,NRG-NS粒径显著减小,柚皮素在胃肠道中表现出良好的通透性,并且其溶解度和生物利用度也得到显著提高。SINGH等[49]采用沉淀超声法,将不同类型的表面活性剂和聚合物,包括胆酸钠、十二烷基硫酸钠、PEG、吐温-80、泊洛沙姆188和TPGS用于柚皮素纳米混悬液制备,发现与其他表面活性剂相比,TPGS具有更高的乳化效率,显著提高了柚皮素的溶解度(10.19倍)和口服利用度,这主要归因于TPGS使得柚皮素由晶体变成无定形,促进了柚皮素的溶解,并使得柚皮素颗粒从微米减少到纳米。此外,RAJAMANI等[50]通过高压均质制备了柚皮素/TPGS纳米悬浮液,与游离柚皮素相比,柚皮素/TPGS纳米混悬液可以更有效地缓解抗肿瘤药物治疗后氧化应激引起的肝中毒和肾中毒。
4 结论与展望
柚皮素是一种大量存在于柑橘类水果中的类黄酮化合物。作为一种天然活性物质,许多研究证实柚皮素具有抗氧化、抗菌、抗癌、心脏保护和神经保护等多种生物功效,具有应用于功能食品和医药的潜能。然而,柚皮素本身微溶于水、生物利用低、稳定性差的特点严重限制了其在相关领域中的应用。研究发现,一些纳米递送体系,包括聚合物纳米颗粒、脂质体、纳米乳液和混悬液等可以显著改善柚皮素的水溶性、稳定性、提高生物利用度。纳米递送系统的出现为柚皮素的应用提供了多种选择,极大地提高了柚皮素的应用范围。尽管如此,柚皮素在临床试验中的研究报道和治疗效果还是很有限的,未来仍需要进一步研究人体中的柚皮素负载纳米系统的效果及与人体健康的作用机制,同时需要探究柚皮素与其他药物的协同作用,以最大限度地提高疗效,同时降低昂贵药物的剂量。相信随着科技的不断发展,柚皮素纳米递送系统的研究将会得到越来越多的报道与应用。
[1] 陈习霞, 郭晓倩, 袁琳, 等.柚皮素的提取、结构衍生和药理作用研究进展[J].山东化工, 2023, 52(1):85-87;90.
CHEN X X, GUO X Q, YUAN L, et al.Research progress on the extraction, structure derivation and pharmacological effects of naringenin[J].Shandong Chemical Industry, 2023, 52(1):85-87;90.
[2] BHIA M, MOTALLEBI M, ABADI B, et al.Naringenin nano-delivery systems and their therapeutic applications[J].Pharmaceutics, 2021, 13(2):291.
[3] SINGH S, SHARMA A, MONGA V, et al.Compendium of naringenin:Potential sources, analytical aspects, chemistry, nutraceutical potentials and pharmacological profile[J].Critical Reviews in Food Science and Nutrition, 2023, 63(27):8868-8899.
[4] 杨安源, 郑泽洋, 林丹, 等.浅谈柑橘类黄酮纳米递送系统研究进展[J].现代食品, 2021(16):69-73.
YANG A Y, ZHENG Z Y, LIN D, et al.Research progress of citrus flavonoid nano delivery system[J].Modern Food, 2021(16):69-73.
[5] CHEN Y Y, WANG J T, RAO Z N, et al.Study on the stability and oral bioavailability of curcumin loaded (-)-epigallocatechin-3-gallate/poly(N-vinylpyrrolidone) nanoparticles based on hydrogen bonding-driven self-assembly[J].Food Chemistry, 2022, 378:132091.
[6] WANG Q M, RAO Z N, CHEN Y Y, et al.Characterization of responsive zein-based oleogels with tunable properties fabricated from emulsion-templated approach[J].Food Hydrocolloids, 2022, 133:107972.
[7] JOSHI R, KULKARNI Y A, WAIRKAR S.Pharmacokinetic, pharmacodynamic and formulations aspects of Naringenin:An update[J].Life Sciences, 2018, 215:43-56.
[8] LATOS-BROZIO M, MASEK A, PIOTROWSKA M.Novel polymeric biomaterial based on naringenin[J].Materials, 2021, 14(9):2142.
[9] KUMAR R P, ABRAHAM A.Inhibition of LPS induced pro-inflammatory responses in RAW 264.7 macrophage cells by PVP-coated naringenin nanoparticle via down regulation of NF-κB/P38MAPK mediated stress signaling[J].Pharmacological Reports, 2017, 69(5):908-915.
[10] WANG L H, ZENG X N, WANG M S, et al.Modification of membrane properties and fatty acids biosynthesis-related genes in Escherichia coli and Staphylococcus aureus:Implications for the antibacterial mechanism of naringenin[J].Biochimica et Biophysica Acta.Biomembranes, 2018, 1860(2):481-490.
[11] ZHANG S, LI D D, ZENG F, et al.Efficient biosynthesis, analysis, solubility and anti-bacterial activities of succinylglycosylated naringenin[J].Natural Product Research, 2019, 33(12):1756-1760.
[12] MOON Y J, WANG X D, MORRIS M E.Dietary flavonoids:Effects on xenobiotic and carcinogen metabolism[J].Toxicology in Vitro:an International Journal Published in Association with BIBRA, 2006, 20(2):187-210.
[13] GALLUZZO P, ASCENZI P, BULZOMI P, et al.The nutritional flavanone naringenin triggers antiestrogenic effects by regulating estrogen receptor α-palmitoylation[J].Endocrinology, 2008, 149(5):2567-2575.
[14] ANAND K, SARKAR A, KUMAR A, et al.Combinatorial antitumor effect of naringenin and curcumin elicit angioinhibitory activities in vivo[J].Nutrition and Cancer, 2012, 64(5):714-724.
[15] ZAIDUN N H, THENT Z C, LATIFF A A.Combating oxidative stress disorders with citrus flavonoid:Naringenin[J].Life Sciences, 2018, 208:111-122.
[16] LI H, LIU M W, YANG W, et al.Naringenin induces neuroprotection against homocysteine-induced PC12 cells via the upregulation of superoxide dismutase 1 expression by decreasing miR-224-3p expression[J].Journal of Biological Regulators and Homeostatic Agents, 2020, 34(2):421-433.
[17] DOU W, ZHANG J J, SUN A N, et al.Protective effect of naringenin against experimental colitis via suppression of Toll-like receptor 4/NF-κB signalling[J].The British Journal of Nutrition, 2013, 110(4):599-608.
[18] CHTOUROU Y, FETOUI H, JEMAI R, et al.Naringenin reduces cholesterol-induced hepatic inflammation in rats by modulating matrix metalloproteinases-2, 9 via inhibition of nuclear factor κB pathway[J].European Journal of Pharmacology, 2015, 746:96-105.
[19] ORREGO-LAGAR N N, MART
N N, MART NEZ-HUÉLAMO M, VALLVERD
NEZ-HUÉLAMO M, VALLVERD -QUERALT A, et al.High gastrointestinal permeability and local metabolism of naringenin:Influence of antibiotic treatment on absorption and metabolism[J].The British Journal of Nutrition, 2015, 114(2):169-180.
-QUERALT A, et al.High gastrointestinal permeability and local metabolism of naringenin:Influence of antibiotic treatment on absorption and metabolism[J].The British Journal of Nutrition, 2015, 114(2):169-180.
[20] BAI Y, PENG W, YANG C P, et al.Pharmacokinetics and metabolism of naringin and active metabolite naringenin in rats, dogs, humans, and the differences between species[J].Frontiers in Pharmacology, 2020, 11:364.
[21] CHEN T B, SU W W, YAN Z H, et al.Identification of naringin metabolites mediated by human intestinal microbes with stable isotope-labeling method and UFLC-Q-TOF-MS/MS[J].Journal of Pharmaceutical and Biomedical Analysis, 2018, 161:262-272.
[22] JEEVANANDAM J, CHAN Y S, DANQUAH M K.Nano-formulations of drugs:Recent developments, impact and challenges[J].Biochimie, 2016, 128-129:99-112.
[23] VENDITTI I.Morphologies and functionalities of polymeric nanocarriers as chemical tools for drug delivery:A review[J].Journal of King Saud University-Science, 2019, 31(3):398-411.
[24] SMRUTHI M R, NALLAMUTHU I, ANAND T.A comparative study of optimized naringenin nanoformulations using nano-carriers (PLA/PVA and zein/pectin) for improvement of bioavailability[J].Food Chemistry, 2022, 369:130950.
[25] WANG K, LIU T T, LIN R, et al.Preparation and in vitro release of buccal tablets of naringenin-loaded MPEG-PCL nanoparticles[J].RSC Advances, 2014, 4(64):33672-33679.
[26] KUMAR R P, ABRAHAM A.PVP-coated naringenin nanoparticles for biomedical applications-in vivo toxicological evaluations[J].Chemico-Biological Interactions, 2016, 257:110-118.
[27] PARASHAR P, RATHOR M, DWIVEDI M, et al.Hyaluronic acid decorated naringenin nanoparticles:Appraisal of chemopreventive and curative potential for lung cancer[J].Pharmaceutics, 2018, 10(1):33.
[28] FUSTER M G, CARISSIMI G, MONTALB N M G, et al.Improving anticancer therapy with naringenin-loaded silk fibroin nanoparticles[J].Nanomaterials, 2020, 10(4):718.
N M G, et al.Improving anticancer therapy with naringenin-loaded silk fibroin nanoparticles[J].Nanomaterials, 2020, 10(4):718.
[29] LI M, WANG K L, WANG Y X, et al.Effects of genipin concentration on cross-linked β-casein micelles as nanocarrier of naringenin:Colloidal properties, structural characterization and controlled release[J].Food Hydrocolloids, 2020, 108:105989.
[30] SHPIGELMAN A, SHOHAM Y, ISRAELI-LEV G, et al.β-Lactoglobulin-naringenin complexes:Nano-vehicles for the delivery of a hydrophobic nutraceutical[J].Food Hydrocolloids, 2014, 40:214-224.
[31] DARA P K, MAHADEVAN R, DIGITA P A, et al.Synthesis and biochemical characterization of silver nanoparticles grafted chitosan (Chi-Ag-NPs):In vitro studies on antioxidant and antibacterial applications[J].SN Applied Sciences, 2020, 2(4):665.
[32] MAITY S, MUKHOPADHYAY P, KUNDU P P, et al.Alginate coated chitosan core-shell nanoparticles for efficient oral delivery of naringenin in diabetic animals:An in vitro and in vivo approach[J].Carbohydrate Polymers, 2017, 170:124-132.
[33] 刘艳新, 李湘洲, 周军, 等.纤维素纳米晶体提升柚皮素抗氧化活性的研究[J].中国造纸, 2019, 38(9):8-13.
LIU Y X, LI X Z, ZHOU J, et al.Cellulose nanocrystals as carriers for hydrophobic naringenin to enhance its anti-oxidation activity[J].China Pulp &Paper, 2019, 38(9):8-13.
[34] MÜLLER R H, M DER K, GOHLA S.Solid lipid nanoparticles (SLN) for controlled drug delivery-a review of the state of the art[J].European Journal of Pharmaceutics and Biopharmaceutics:Official Journal of Arbeitsgemeinschaft Fur Pharmazeutische Verfahrenstechnik e.V, 2000, 50(1):161-177.
DER K, GOHLA S.Solid lipid nanoparticles (SLN) for controlled drug delivery-a review of the state of the art[J].European Journal of Pharmaceutics and Biopharmaceutics:Official Journal of Arbeitsgemeinschaft Fur Pharmazeutische Verfahrenstechnik e.V, 2000, 50(1):161-177.
[35] YANG F, HU S H, SHENG X, et al.Naringenin loaded multifunctional nanoparticles to enhance the chemotherapeutic efficacy in hepatic fibrosis[J].Biomedical Microdevices, 2020, 22(4):68.
[36] JI P, YU T, LIU Y, et al.Naringenin-loaded solid lipid nanoparticles:Preparation, controlled delivery, cellular uptake, and pulmonary pharmacokinetics[J].Drug Design, Development and Therapy, 2016, 10:911-925.
[37] WANG L Y, WANG X B, SHEN L N, et al.Paclitaxel and naringenin-loaded solid lipid nanoparticles surface modified with cyclic peptides with improved tumor targeting ability in glioblastoma multiforme[J].Biomedecine &Pharmacotherapie, 2021, 138:111461.
[38] HU R, LIU S, ANWAIER G, et al.Formulation and intestinal absorption of naringenin loaded nanostructured lipid carrier and its inhibitory effects on nonalcoholic fatty liver disease[J].Nanomedicine:Nanotechnology, Biology, and Medicine, 2021, 32:102310.
[39] AKBARZADEH A, REZAEI-SADABADY R, DAVARAN S, et al.Liposome:Classification, preparation, and applications[J].Nanoscale Research Letters, 2013, 8(1):102.
[40] WANG Y W, WANG S C, FIREMPONG C K, et al.Enhanced solubility and bioavailability of naringenin via liposomal nanoformulation:Preparation and in vitro and in vivo evaluations[J].AAPS PharmSciTech, 2017, 18(3):586-594.
[41] TSAI M J, HUANG Y B, FANG J W, et al.Preparation and characterization of naringenin-loaded elastic liposomes for topical application[J].PLoS One, 2015, 10(7):e0131026.
[42] FUIOR E V, MOCANU C A, DELEANU M, et al.Evaluation of VCAM-1 targeted naringenin/indocyanine green-loaded lipid nanoemulsions as theranostic nanoplatforms in inflammation[J].Pharmaceutics, 2020, 12(11):1066.
[43] MD S, GAN S Y, HAW Y H, et al.In vitro neuroprotective effects of naringenin nanoemulsion against β-amyloid toxicity through the regulation of amyloidogenesis and tau phosphorylation[J].International Journal of Biological Macromolecules, 2018, 118(Pt A):1211-1219.
[44] KHAN A W, KOTTA S, ANSARI S H, et al.Self-nanoemulsifying drug delivery system (SNEDDS) of the poorly water-soluble grapefruit flavonoid Naringenin:Design, characterization, in vitro and in vivo evaluation[J].Drug Delivery, 2015, 22(4):552-561.
[45] SANDHU P S, KUMAR R, BEG S, et al.Natural lipids enriched self-nano-emulsifying systems for effective co-delivery of tamoxifen and naringenin:Systematic approach for improved breast cancer therapeutics[J].Nanomedicine:Nanotechnology, Biology, and Medicine, 2017, 13(5):1703-1713.
[46] REHMAN F U, SHAH K U, SHAH S U, et al.From nanoemulsions to self-nanoemulsions, with recent advances in self-nanoemulsifying drug delivery systems (SNEDDS)[J].Expert Opinion on Drug Delivery, 2017, 14(11):1325-1340.
[47] JACOB S, NAIR A B, SHAH J.Emerging role of nanosuspensions in drug delivery systems[J].Biomaterials Research, 2020, 24:3.
[48] GERA S, TALLURI S, RANGARAJ N, et al.Formulation and evaluation of naringenin nanosuspensions for bioavailability enhancement[J].AAPS PharmSciTech, 2017, 18(8):3151-3162.
[49] SINGH M K, POOJA D, RAVURI H G, et al.Fabrication of surfactant-stabilized nanosuspension of naringenin to surpass its poor physiochemical properties and low oral bioavailability[J].Phytomedicine:International Journal of Phytotherapy and Phytopharmacology, 2018, 40:48-54.
[50] RAJAMANI S, KALYANASUNDARAM G, SENGODAN T, et al.Hepato &nephro protective effects of naringenin-loaded tpgs polymeric nanosuspension against cisplatin-induced toxicity[J].International Journal of Research in Pharmaceutical Sciences, 2019, 10(4):2755-2764.