海参属于棘皮动物门(Echinodermata)海参纲(Holothuroidea)。目前全球已发现1 700多种海参,分布于温带区和热带区,其中种类最多,资源量最大的地区当属印度西太平洋海域[1]。据统计,我国有约140种海参,其中可食用海参约20种,其中最为名贵、食用价值最高的当属辽宁和山东的刺参[2]。海参中含有海参酸性多糖、海参皂苷、胶原蛋白、海参脑苷脂等生物活性成分,矿物质和微量元素含量也很丰富,是一种高蛋白、低脂肪、低胆固醇的健康食品。
海参多糖约占干海参总有机物的4%~10%,以往的研究通常将其分为海参糖胺聚糖(Holothurians glycosaminoglycan,HGAG)和海参岩藻聚糖硫酸酯(Hohthurians fucan,HF)2种组分,近几年的研究发现海参中还存在一种特殊的不含硫酸酯基的中性聚糖。海参多糖具有免疫调节、抗肿瘤、抗凝血、抗炎、降血糖、降血脂、抗氧化等生物活性。鉴于海参多糖的多样性和生物活性,对其制备、化学分析方法和生物活性进行综述具有重要意义,本文总结了海参多糖的提取、分离纯化,含量测定,化学成分和结构分析的方法及其生物活性,为进一步研究海参多糖提供参考。
1 海参多糖的提取方法
海参多糖是蛋白多糖的糖链部分,通过糖肽键与蛋白多糖的核心蛋白相连,并通过非共价键和其他蛋白质形成具有空间构象的大分子聚集体,海参多糖的提取需要在尽量不破坏其结构的前提下将其与蛋白分开。海参多糖的提取方法有化学水解法(热水提取、稀碱提取),酶解法(单一酶解法、复合酶解法),物理辅助提取法(超声波辅助提取法、微波辅助提取法),其中最常用的方法是酶解法、稀碱提取法。近几年关于海参多糖不同提取方法和产率的比较见表1。
表1 海参多糖提取方法总结
Table 1 Summary of extraction methods of sea cucumber polysaccharide
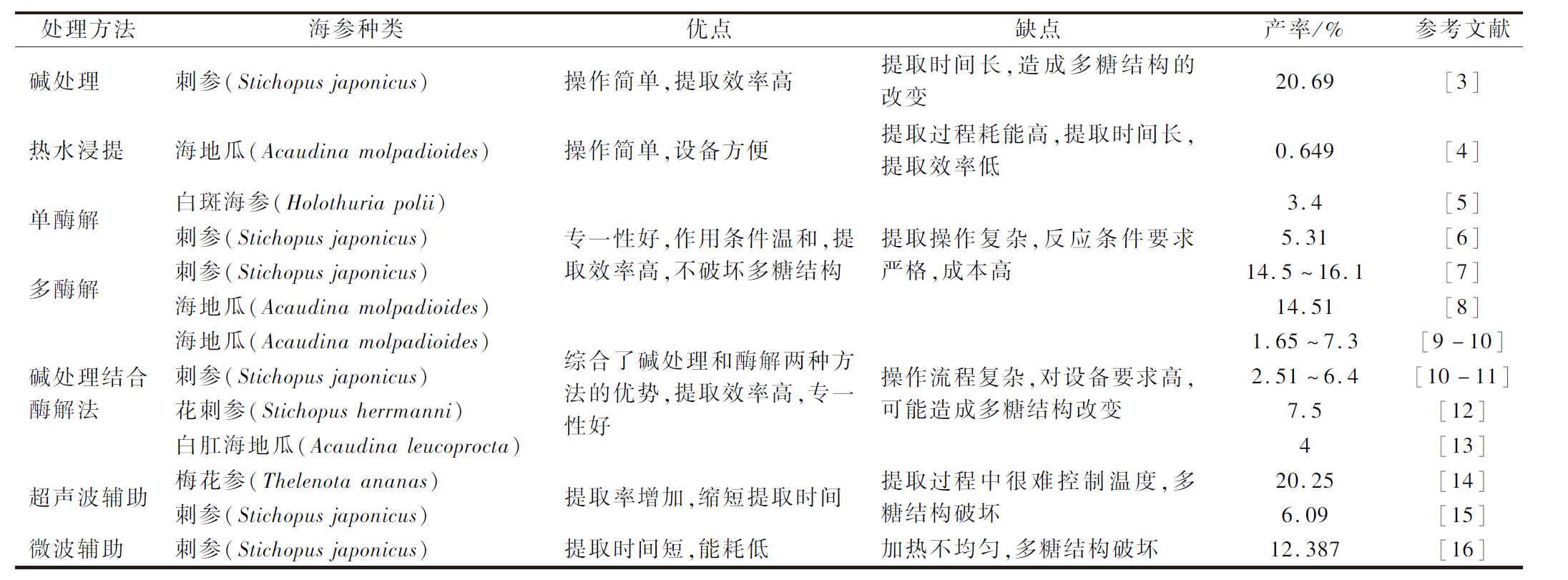
处理方法海参种类优点缺点产率/%参考文献碱处理刺参(Stichopus japonicus)操作简单,提取效率高提取时间长,造成多糖结构的改变20.69[3]热水浸提海地瓜(Acaudina molpadioides)操作简单,设备方便提取过程耗能高,提取时间长,提取效率低0.649[4]单酶解多酶解白斑海参(Holothuria polii)刺参(Stichopus japonicus)刺参(Stichopus japonicus)海地瓜(Acaudina molpadioides)专一性好,作用条件温和,提取效率高,不破坏多糖结构提取操作复杂,反应条件要求严格,成本高3.4[5]5.31[6]14.5~16.1[7]14.51[8]碱处理结合酶解法海地瓜(Acaudina molpadioides)刺参(Stichopus japonicus)花刺参(Stichopus herrmanni)白肛海地瓜(Acaudina leucoproc-ta)综合了碱处理和酶解两种方法的优势,提取效率高,专一性好操作流程复杂,对设备要求高,可能造成多糖结构改变1.65~7.3[9-10]2.51~6.4[10-11]7.5[12]4[13]超声波辅助梅花参(Thelenota ananas)刺参(Stichopus japonicus)提取率增加,缩短提取时间提取过程中很难控制温度,多糖结构破坏20.25[14]6.09[15]微波辅助刺参(Stichopus japonicus)提取时间短,能耗低加热不均匀,多糖结构破坏12.387[16]
1.1 化学水解法
碱处理水解法主要利用碱断裂蛋白多糖中的糖肽键,提取溶剂一般为稀碱和稀碳酸钾的水溶液,其特点是操作简单,提取效率高。但是碱处理后,多糖易发生Walden反应,或形成3,6-内醚衍生物而发生脱硫现象[17],造成多糖结构的改变,因此,碱解提取时,碱的浓度、温度和时间都需要实验优化以得到最佳提取条件。韩秋菊等[3]采用碱法提取海参多糖,用30 g/L的KOH水溶液在60 ℃下提取4 h,料液比1∶50(g∶mL),粗多糖的提取率可达20.69%。
水提醇沉法是提取动植物多糖最常见的一种方法,但对于海参多糖的提取应用较少。由于海参多糖是通过糖肽键与蛋白质共价结合,单纯的热水浸提往往无法将两者分开,提取效果较差。冯骏[4]通过热水浸提法提取海参多糖后发现得率仅有0.649%。海参多糖的连接方式特殊,导致单独使用热水浸提无法有效的破坏共价键,且长时间的热水浸提可能会造成多糖结构和化学活性的改变,影响其生物活性。
1.2 酶解法
酶解法作用条件温和,不会改变多糖链的结构,但提取效率较碱提取法低,蛋白酶多选用对肽键断裂作用专一性低的、广谱的微生物酶、植物酶和动物酶,如中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶和胃蛋白酶等,其中以木瓜蛋白酶应用最为广泛[18]。根据酶解过程中添加酶的类别不同可分为单一酶解法和复合酶解法,单酶法中最常用的酶是木瓜蛋白酶,LI等[5]使用木瓜蛋白酶,从白斑海参(Holothuria polii)、冰刺参(Holothuria tubulosa)、刺参(Stichopus japonicus)中提取海参多糖,纯化后的多糖提取率在1.83%~3.4%。为了使蛋白质水解更充分,采用两种及以上的酶制剂增强水解效果的方法称为复合酶解法,采用较多的搭配有胃蛋白酶和胰蛋白酶联合使用,该方法在接近生物体温度条件下酶解蛋白,避免了高温对生物活性成分的破坏,适用于富含蛋白的动物类药物的提取[19]。韩慧敏等[7]采用仿生提取法提取海参多糖,产率达到14.5%~16.1%。陈发河等[8]采用胰蛋白酶、中性蛋白酶、木瓜蛋白酶3种酶依次酶解海地瓜(Acaudina molpadioides)提取海参多糖,多糖提取率可达12.51%,多酶法较单酶法对海参多糖的提取率明显提高。
1.3 碱处理法结合酶解法
碱处理结合酶解法即先用稀碱的水溶液水解海参,再调节至适宜的pH后加入蛋白酶酶解海参蛋白。海参经过碱处理后其海参多糖与蛋白结合更加松散,有助于提高下一步酶解效果,既避免了长时间的碱提取对多糖结构的破坏,又提高了酶解效率。国内外学者采用碱处理结合酶法从海地瓜(Acaudina molpadioides)[9-10]、刺参(Stichopus japonicus)[10-11]、绿刺参(Stichopus chloronotus)[10]、花刺参(Stichopus herrmanni)[12,20]、白肛海地瓜(Acaudina leucoprocta)[13]提取海参多糖,提取率为1.65%~7.5%。碱处理结合酶解法的处理方式综合了2种方法的优势,成为提取海参多糖应用最为广泛的方法。
1.4 物理辅助提取法
近年来超声波提取技术逐渐应用于多糖的提取,该方法是利用超声波增大物质分子运动频率和速度,增加溶剂穿透力,提高被提取化学成分的溶出度,从而缩短提取时间。王远红等[14]采用超声波辅助碱处理的方法提取海参多糖,得率可达20.25%。宋思媛等[21]采用超声波辅助热水浸提法提取海参多糖,粗多糖总糖含量可达24%。然而,一些学者认为超声波的使用可能会破坏多糖的结构,改变其生物活性,WANG等[15]比较了超声波辅助酶解法、酶解法和超声波法3种方法提取海参多糖的产率、多糖结构和分子质量,发现超声波辅助酶解法多糖产率显著高于其他2种方法,但分子质量最低,说明超声波的使用提高了多糖的产率,但可能引起海参多糖降解,导致其分子质量发生改变。
微波是频率0.3~300 GHz的电磁波,具有穿透力强、加热效率高、选择性高等特点[22],但微波容易产生局部高温导致多糖结构发生改变。王庆芬[16]采用超声波和微波协同提取刺参多糖,产率可达12.387%。目前对微波辅助提取海参多糖的研究相对较少。
2 海参多糖的分离与纯化
2.1 海参多糖的初步分离
海参经过简单的提取后,其水解液主要由海参多糖、蛋白、多肽和皂苷组成,因此,需通过物理和化学的方法对粗多糖进行纯化,去除非多糖成分。一种思路是将多糖沉淀,常用的方法有醇沉法、季铵盐沉淀法、乙酸钾沉淀法。醇沉法的原理是乙醇的加入降低溶液电离常数,多糖溶解度降低而沉淀分离。季铵盐和乙酸钾加入至一定浓度后,或达饱和状态,可使多糖在水中溶解度降低与水溶性大的杂质分离。另一种思路是将蛋白沉淀,常用的方法有Sevag法和三氯乙酸法,这2种方法的原理是使多糖不沉淀而使蛋白变性分离。Sevag法是经典的除蛋白的方法,但其操作过程过于复杂,需要反复多次除杂,且对多糖的损失较大。三氯乙酸法反应较为剧烈,对于含呋喃糖残基的多糖因其连接键不稳而不宜使用[23]。研究发现,单独一种分离方法的应用往往达不到好的分离效果,目前多使用醇沉法结合季铵盐沉淀法或乙酸钾沉淀法、醇沉法结合Sevag法或三氯乙酸法、多次醇沉法等多种不同分离方法结合的方式分离海参多糖。王远红等[14]采用二次醇沉的方法分离海参多糖,发现经过二次醇沉后的多糖峰后无明显的小分子峰,多糖纯度较一次醇沉明显提高。
2.2 脱色
经初步分离后获得的海参多糖仍为粗多糖,除多糖外还含有色素、无机盐、皂苷、少量的蛋白和多肽等物质,需要依靠分离效果更好、选择性更强的方法逐步将多糖与其他物质分离,以提高其纯度。初步分离获得的海参多糖首先要进行脱色处理,应用于海参多糖的脱色方法有活性碳吸附脱色、双氧水脱色和大孔吸附树脂脱色法。双氧水和活性炭脱色是多糖脱色的经典方法,也是目前海参多糖常用的脱色方法,2种方法各有优劣。张军瑞等[24]研究表明,2种方法都不可避免地造成多糖的损失,二者对多糖的损失率均超过25%。宿玮等[25]研究表明,双氧水处理并未有效去除掉色素,仅仅是将色素氧化,并未提高多糖纯度。
近年来,树脂吸附脱色法逐渐成为一种新兴的脱色方法。大孔树脂表面的多孔结构使其具有筛选性,通过分子间的氢键和范德华力进行吸附,根据多糖分子质量的差异和吸附力的强弱可实现分离、脱色的目的,具有理化性质稳定、机械强度高、吸附容量大等优点[26]。宿玮等[25]比较了活性炭吸附、双氧水脱色法及大孔树脂脱色法对海参多糖的脱色效果,研究表明树脂D392优于活性炭和双氧水,脱色率达 (84.2±0.6)%,多糖保留率为 (82.9±1.1)%。大孔树脂作为一种新型高分子材料,在海参多糖的纯化脱色方面展现出独特的优势,有着广泛的应用前景。
2.3 海参多糖的纯化
纯化海参多糖的常用方法有超滤法,离子交换色谱及凝胶色谱等柱层析法,离子交换柱层析搭配凝胶柱层析可以使海参多糖得到较好的分离效果。近年来,超滤法作为一种新型的膜分离技术广泛应用于多糖分离纯化。超滤膜是一种半透膜,根据被分离物质的分子质量大小和几何形态的不同将各组分分离[27]。该方法具有实验操作简易、纯度高、不破坏分子化学结构、耗能低等优秀特点。朱启源[28]采用Mw=10 000 Da的超滤膜纯化了10种低食用价值海参多糖组分,海参多糖组分的得率为3.90%~11.44%。不同分子质量的多糖往往具有不同的生物活性,超滤时使用不同分子质量的超滤膜,可以截留不同分子质量的多糖,从而获得具有不同生物活性的多糖组分。陈发河等[8]采用3种不同截留分子质量的超滤膜按照分子质量从小到大的顺序对海地瓜多糖提取液进行超滤,得到4种不同分子质量多糖组分。
近年来,离子交换、凝胶过滤、亲和色谱等色谱技术已成功应用于多糖的分级纯化[29],其中离子交换柱层析法和凝胶渗透柱层析法是纯化海参多糖常用的手段。常用于分离纯化海参多糖的阴离子交换剂有DEAE-纤维素、快流速Q琼脂糖凝胶、强离子交换树脂等。GONG等[6]使用DE-52阴离子交换柱,以用纯水洗脱得到一种海参中性多糖。LI等[12]使用FPA98通过强离子交换柱分离纯化粗多糖,分别用0~1 mol/L和2 mol/L NaCl溶液洗脱得到了HF和HGAG。HE等[13]使用快流速Q琼脂糖凝胶阴离子交换柱分离白肛海地瓜多糖,分别用蒸馏水和2 mol/L NaCl溶液洗脱得到HF和HGAG。YUAN等[20]采用负载强离子交换树脂的强阴离子交换柱分离纯化海参粗多糖,收集2.0 mol/L NaCl洗脱液,得到了纯度>99.9%HF。
凝胶色谱法是指混合物随流动相经过凝胶时,混合物中各组分按分子质量大小不同分离的一种技术,故又称为分子筛过滤色谱。凝胶是一种不带电荷的具有三维空间的多孔网状结构的物质,其根据分子质量大小选择性透过小分子,排阻大分子物质,具有分子筛的性质。它的优点是凝胶材料属惰性载体,不带电荷、吸附力弱、操作条件比较温和,能保持分离出化学成分的理化性质且不需要有机试剂。常用的凝胶基质有葡聚糖凝胶、琼脂糖凝胶和聚丙烯酰胺凝胶三大类[30],展层剂为各种浓度的盐溶液和缓冲溶液。海参多糖经阴离子交换柱纯化得到数个组分,各组分再经凝胶层析柱进一步纯化后即可得到高纯度海参多糖。LI等[5]采用快流速Q琼脂糖凝胶阴离子交换柱和Sephacryl S-400 HR凝胶层析柱对海参多糖分离纯化,得到一种海参岩藻聚糖,纯度可达占95%以上。CHANG等[31]使用Express-Ion D阴离子交换柱和Sephacryl S-500 HR凝胶层析柱分离出了一种海参岩藻聚糖。GONG等[32]使用快流速Q琼脂糖凝胶阴离子交换柱和Sephacryl S-300凝胶层析柱从海参粗多糖中分离纯化出一种HGAG。
3 海参多糖的化学分析方法
3.1 含量测定
海参多糖含量测定的方法有比色法和色谱法。应用于海参多糖的比色法包括硫酸苯酚法、蒽酮-硫酸法、强酸咔唑比色法、次甲基蓝法、天青I号染色剂法。其中最为常用的当属硫酸苯酚法,其原理多糖被浓硫酸水解为单糖后形成糠醛衍生物,该衍生物与苯酚反应后显色,显色后通过紫外分光光度计测定显色液吸光度,吸光度与多糖含量线性相关[33],该方法操作简单、方便快捷、重复性好。比色法虽然存在选择性不强,吸光度可能受其他物质干扰的问题,但由于其操作简单,测定结果较为准确,仍为海参多糖含量测定最常用的方法。
色谱法相较于比色法测定更具准确性,随着色谱技术的不断发展,色谱法成为分离、分析多糖的主流方法[34]。常用于多糖含量测定的色谱法包括:离子色谱法和高效液相色谱法。1-苯基-3-甲基-5-吡唑啉酮(3-methyl-1-phenyl-2-pyrazolin-5-one,PMP)柱前衍生高效液相色谱法利用三氟乙酸将多糖降解为单糖,对降解出的单糖进行衍生化处理之后,再运用紫外检测器测定其降解产物中岩藻糖的含量,通过换算系数得出海参多糖的总量,该方法已经成为刺参多糖含量测定的行业标准SC/T 3049—2015《刺参及其制品中海参多糖的测定 高效液相色谱法》。焦健等[35]在上述标准的基础上,建立了一种高效液相色谱-三重四极杆质谱联用技术测定海参多糖含量,该方法精准度高,特异性强。
3.2 化学成分分析
多糖的化学成分分析包括分子质量和纯度、单糖组成、取代基的种类等内容。海参多糖分子质量和纯度测定方法是高效凝胶排阻色谱法,其原理是被分离的成分经过凝胶分子筛的筛选后其保留时间与分子质量成线性关系,通过分子质量已知且不同分子质量大小的标准品建立标准曲线,计算未知组分分子质量。
在多糖结构的研究中,单糖组成是其重要的组成部分,也是开展多糖结构解析的基础。目前应用于单糖分析的方法有毛细管电泳法、气相色谱法、高效液相色谱法、气质联用法、液质联用法。海参多糖的结构复杂,单糖种类繁多,高效液相色谱法因其高精准度和高灵敏度成为分析复杂单糖组成的主流方法。测定海参多糖的单糖组成常用的方法是PMP柱前衍生高效液相色谱法,首先利用三氟乙酸将多糖降解为单糖,对降解出的单糖进行衍生化处理之后再运用高效液相色谱法测定含量,该方法简单易操作、灵敏度高、重复性好,适用于单糖的实验室常规检测。刘芬等[36]建立了一种高效阴离子交换-脉冲安培检测法分析海参多糖的单糖组成并测定含量,该方法分离效果好、精密度高,且不需经过衍生等复杂操作,大大提高了检测速率。
海参多糖中硫酸酯基含量的测定方法有明胶-氯化钡法和离子色谱法。明胶-氯化钡法是多糖中酸解出的硫酸基与钡离子反应生成硫酸钡明胶悬浊液,通过分光光度计进行测定[29]。离子色谱法是利用离子交换树脂对不同分离物质亲和力的不同,使能够离子化的化合物的分离,该方法检测时间短、灵敏度高。
3.3 化学结构
多糖是一种结构复杂的生物大分子,结构表征不仅包括单糖组成、分子质量、取代基种类等一级结构,还包括糖苷键的类型、糖残基的组成、连接位点和顺序等,准确建立和完善海参多糖的结构分析方法体系是其应用的前提。目前应用于海参多糖结构分析的方法有甲基化分析、Smith降解、高碘酸盐氧化、核磁共振、傅里叶变换红外光谱、高效液相色谱法、气相色谱-质谱法、扫描电子显微镜、原子力显微镜等方法。每种方法都能提供一些结构信息,需要合并总结多种不同分析方法获得的结构信息,才能得出最精确的多糖结构。不同海参品种、提取方法和分离纯化方法都可能会导致多糖结构的不同,表2总结了近年来各种海参多糖的化学成分和结构特征。
表2 海参多糖制备方法和化学成分特征
Table 2 Preparation method and chemical composition characteristics of sea cucumber polysaccharide

海参种类组分名称分子质量/kDa单糖组成(物质的量比)硫酸酯基含量/%主链生物活性参考文献仿刺参(Apostichopus japoni-cus)fCS Aj98.1GlcA∶GalNAc∶Fuc=0.98∶1∶1.1530-抗氧化[10]绿刺参(Stichopus chlorono-tus)fCSSc111.0GlcA∶GalNAc∶Fuc=0.9∶1∶1.0830[→4)GlcAβ(1→3)GalNAcβ(1→]抗氧化[10]海地瓜(Acaudina molpa-dioides)fCSAm93.3GlcA∶GalNAc∶Fuc=0.82∶1∶0.8830-抗氧化,抗炎[10]Stichopus herrmanniFG63.7GlcA∶GalNAc∶Fuc=1∶0.96∶1.02-[→4)-D-GlcA-β(1→3)-D-Gal-NAc4S6S-β(1→]抗凝血[12]花刺参(Stichopus monotuber-culatus)SmFG76.8 GalNAc∶Fuc∶GlcA=1∶0.91∶1.32--抗凝血[20]刺参(Stichopus japonicus)FCSsj60.99 GlcA∶GalNAc∶Fuc=1∶1.07∶1.21--抗糖尿病[33]白斑海参(Holothuria polii)Fuchp103.1±2.8GlcN∶GalN∶Gal∶Fuc=1.3∶0.81∶2.18∶95.739.5±1.4[→3-α-L-Fucp-1→3-α-L-Fucp2(OSO3-)-1→3-α-L-Fucp2(OSO3-)-1→3-α-L-Fucp2,4(OSO3-)-1→]抗血栓[5]秘鲁乌参(Pattalus mollis)PmFG60.3-30.4{-4-D-GlcA-β-1,3-D-GalNAc4S6S-β-1-}抗凝血[37]秘鲁乌参(Pattalus mollis)PmFS6.12Fuc30.4{-4-L-Fuc2S-α-1-}抗凝血[38]冰刺参(Holothuria tubulosa)Ht-FUC1 567.6±34.1Fuc31.2±1.6[→3-α-L-Fucp2(OSO3-)-1→3-α-L-Fucp2,4(OSO3-)-1→3-α-L-Fucp-1→3-α-L-Fucp2(OSO3-)-1→]-[31]白肛海地瓜(Acaudina leucoproc-ta)AL1593Fuc15[→3)-α-L-Fucp-(1→]抗凝血[13]刺参(Stichopus japonicus)NPsj301.75 Glc0[→1,4)-α-D-Glc-(1→]抗糖尿病[6]
注:-表示数据在参考论文中未说明;GlcA-葡萄糖醛酸;GalNAc-N-乙酰半乳糖胺;Fuc-岩藻糖;Gal-半乳糖;Glc-葡萄糖。
近几年研究发现,海参多糖主要有糖胺聚糖和岩藻聚糖硫酸酯2种,还有一种不常见的中性多糖。糖胺聚糖主链由D-葡萄糖醛酸和N-乙酰半乳糖胺交替连接而成,其单糖主要由葡萄糖醛酸、N-乙酰半乳糖胺、岩藻糖组成,分子质量范围在6.3~111.0 kDa,硫酸酯基含量在30%~40%。LI等[12]分离出一种在结构上高度规则的海参糖胺聚糖FG,分子质量为63.7 kDa,单糖主要由葡萄糖醛酸、N-乙酰半乳糖胺、L-岩藻糖组成,物质的量比为1∶0.96∶1.02,其主链序列为[→4)-D-GlcA-β(1→3)-D-GalNAc4S6S-β(1→],单糖L-岩藻糖侧链通过α(1→3)糖苷键与葡萄糖醛酸相连。YUAN等[20]分离出一种海参糖胺聚糖SmFG,分子质量为76.8 kDa,单糖由N-乙酰半乳糖胺、岩藻糖、葡萄糖醛酸组成,物质的量比为1∶0.91∶1.32,由C-4和C-6位置均被硫酸化的N-乙酰半乳糖胺和各种单糖侧链组成,其双糖侧链有着特殊的连接方式,通过α-1,3糖苷键与葡萄糖醛酸相连。LI等[5]从海参中提取并纯化一种糖胺聚糖Fuchp,分子质量为(103.1±2.8) kDa,单糖由氨基葡萄糖、半乳糖胺、半乳糖、岩藻糖组成,物质的量比为1.3∶0.81∶2.18∶95.7 其主链由一个四糖重复单元[→3-α-L-Fucp-1→3-α-L-Fucp2(OSO3-)-1→3-α-L-Fucp2(OSO3-)-1→3-α-L-Fucp2,4(OSO3-)-1→]组成。
HF是由多个硫酸基Fuc重复单元通过α-1,3糖苷键或α-1,4糖苷键连接而成的线性多糖[37],分子质量范围在59.3~1 567.6 kDa,硫酸酯基含量在15%~39.5%。CHANG等[31]分离出一种海参岩藻聚糖Ht-FUC,分子质量为(1 567.6±34.1) kDa,硫酸酯基含量为(31.2±1.6)%,Ht-FUC由一个四糖重复单元[→3-α-L-Fucp2(OSO3-)-1→3-α-L-Fucp2,4(OSO3-)-1→3-α-L-Fucp-1→3-α-L-Fucp2(OSO3-)-1→]组成。HE等[13]分离出一种海参岩藻聚糖AL1,分子质量为593 kDa,硫酸酯基含量为15%,AL1主链主要由[→3)-α-L-Fucp-(1→]组成。
目前对海参中性多糖结构的研究较少,其D-Glc残基主要通过α-1,4糖苷键连接,分支由α-1,6糖苷键连接[37]。海参中性多糖首次发现于红腹海参(Holothuria edulis)[39],分子质量为253.3kDa,单糖组成仅有葡萄糖。ZHENG等[38]从秘鲁乌参(Pattalus mollis)中分离得到2种中性多糖,分子质量分别为12.8 kDa和6.97 kDa。GONG等[6]从刺参(Stichopus japonicus)中分离出一种海参中性聚糖,分子质量为301.75 kDa,它由一个1,4-α-D-葡萄糖主链和一个β-D-葡萄糖分支,每7~9个葡萄糖残基与葡萄糖的O-6键相连。
4 生物活性
4.1 免疫调节
海参多糖可以显著提高机体细胞免疫和非特异性免疫功能,其通过与免疫细胞表面的受体结合,激活不同的信号通路来调节免疫系统,改善因化学药物引起的动物机体免疫力低下的状况。杨东达[40]研究表明海参多糖(SCVP-1)能够诱导巨噬细胞产生大量的NO和细胞因子(IL-1β、IL-6和TNF-α),增强巨噬细胞的吞噬活性,显著刺激相关基因(iNOS、IL-1β、IL-6和TNF-α)的表达,其作用机制与SCVP-1激活MAPKs和NF-κB信号通路,从而激活巨噬细胞有关。腹腔注射SCVP-1可以显著提高环磷酰胺致免疫低下小鼠免疫脏器指数,促进脾淋巴细胞的增殖率,提升小鼠的吞噬能力,有效促进小鼠溶血素抗体的生成[40]。
4.2 抗肿瘤
海参多糖对多种肿瘤的生长均有明显的抑制作用,能通过诱导细胞自噬、细胞凋亡、调控肿瘤细胞周期以及调节免疫等多种途径发挥抗肿瘤活性。王婷等[41]从海参精中提取的多糖(SCSCPA2)对Hela细胞和HepG2细胞表现出显著的体外抗肿瘤活性,当SCSPA2质量浓度为10 mg/mL时,对2种细胞抑制率分别为80.28%和83.11%。卢战辉等[42]研究表明,海参多糖可抑制人肝癌细胞的增殖,促进其凋亡,推测其机制可能是通过调控JAK2/STAT3/survivin通路中JAK2、STAT3、survivin蛋白磷酸化表达而实现的。李天等[43]研究表明,海参多糖能够显著抑制人肾癌细胞A498的增殖活力、黏附能力、迁移能力和侵袭能力,推测其机制可能是通过抑制NF-κB信号通路下调MMP-9和VEGF的表达。张晓媛[44]通过海参多糖联合放疗的方法处理A549肺癌细胞后发现,HGAG与放疗合作用呈现为互相协同性,HGAG可有效抑制癌细胞的增殖,促进其凋亡,推测其机制可能是通过Caspase蛋白和Bax蛋白表达上调,以及Survivin蛋白、Bcl-2蛋白的表达下调实现的。
4.3 抗凝血
海参多糖含有丰富的硫酸基团,其作用类似于肝素,具有较强的抗凝血作用。研究表明,海参多糖通过激活血浆中抗凝血酶或肝素辅助因子Ⅱ的表达,从而抑制内源性和外源性凝血途径中的凝血因子(Ⅱa和Xase)活性,发挥其抗凝血作用[45]。GAO等[46]从象牙参(Holothuria fuscopunctata)体壁分离出的糖胺聚糖和硫酸氨基聚糖表现出较强的抗凝血活性和内因Xase抑制活性。NING等[47]从佛罗里达海参(Holothuria floridana)中分离得到一种HF具有较强的抗凝血活性,且其活性随分子质量的降低而降低,Mw<11.5 kDa的HF片段表现出无明显抗凝作用。张哲娴[48]对玉足海参(Holothuria leucospilota)多糖及其解聚产物的抗凝血活性进行比较,发现玉足海参天然多糖具有显著的诱导人血小板聚集的活性,而解聚产物则对血小板聚集无显著影响。
4.4 抗炎
炎症是机体或细胞受到环境中不良因素的影响后,多种炎症因子过度表达的结果。炎症反应过程由大量的介质共同协调,形成的复杂调节网络。研究发现不同种类和分子质量海参多糖均具有一定抗炎作用,ZHU等[49]通过将不同分子质量和链构象的土耳其刺参(Holothuria tubulosa)多糖(Ht-FUC)作用于脂肪细胞和巨噬细胞组成的共培养体外炎症模型,发现所有Ht-FUC均通过激活PPARγ来减弱共培养巨噬细胞炎症因子的产生,促进M2表型极化。此外,Ht-FUC还通过抑制TLR4/NF-κB依赖通路来促进共培养脂肪细胞的脂解作用。体内高脂高蔗糖饲料喂养的肥胖小鼠模型实验表明,Ht-FUC可以降低血清炎症水平,减弱肝脏Kupffer细胞M1/M2极化,减弱附睾脂肪组织炎症浸润。张帅[50]通过构建以脂多糖诱导的RAW264.7小鼠巨噬细胞体外炎症模型,发现海参多糖可通过促进自噬对脂多糖所致细胞炎症反应有一定的抑制作用。
4.5 降血糖,降血脂
研究表明海参多糖对高血糖、高血脂、糖尿病具有较好的预防和控制作用。GONG等[6]通过酶解的方法从刺参(Stichopus japonicus)中分离出一种中性多糖(NPsj),通过建立体外胰岛素抵抗HepG2细胞模型和3T3-L1细胞模型,发现NPsj在10~100 μg/mL范围内对增加葡萄糖消耗有显著作用,且无毒性。此外,NPsj上调Akt1磷酸化,下调GSK3β磷酸化,进而下调GS磷酸化,提示其通过Akt/GSK3β/GS信号通路改善胰岛素抵抗的机制。袁义琼[51]研究了玉足海参(Holothuria leucospilota)多糖(HLP)对大鼠高脂血症的缓解作用机制,发现HLP具有改善大鼠的脂代谢紊乱、缓解肝损伤、调节炎症因子水平异常和脂质过氧化等高脂血症症状的功效,其作用机制为HLP通过调控NF-κB通路和减少ACC和CD36的表达来抑制肝脏脂质积累和胰岛素过量分泌,从而改善大鼠高脂血症。
4.6 抗氧化
一般认为自由基的活动与机体衰老密切相关,有研究表明海参多糖对多种自由基具有清除作用。李启冬[52]从刺参(Stichopus japonicus)肠壁中提取了硫酸软骨素(FCSiw)并对其清除自由基能力进行评价,发现FCSiw对DPPH自由基和ABTS阳离子自由基具有一定清除能力,且清除能力随着多糖浓度升高而增大。GAO等[53]从象牙参(Holothuria fuscopunctata)中制备岩藻聚糖硫酸酯(FSI)并通过酸处理对其进行解聚,对FSI及其解聚产物的抗氧化活性进行评价,发现FSI和解聚产物具有较强的超氧自由基清除活性,IC50分别为65.71、83.72 μg/mL,而对DPPH自由基、羟自由基和ABTS阳离子自由基无清除作用。
4.7 其他生物学活性
近几年研究发现,海参多糖还具有促进神经细胞生长[54]、恢复肠道菌群紊乱[20]、保肝[55]、预防老年痴呆[56]和预防肥胖[57]的作用,这些发现有助于海参多糖作为食品中功能性成分的应用,也为海参多糖在医药领域的开发提供了科学依据。
5 构效关系
近几年关于海参多糖的研究集中于其初级结构特征和生物活性,关于其高级结构的研究较少,复杂的海参多糖结构与其对应的生物学功能的构效关系至今还无法阐明,海参多糖构效关系的探索仍处于初级阶段。目前关于海参多糖构效关系的研究主要集中在其结构与抗凝血活性的关系,而其他活性的构效关系尚不清楚。
目前,海参多糖分子质量大小与抗凝血活性之间的关系已被广泛研究,经过解聚后的低聚糖仍具有抗凝血活性,且抗凝血活性与低聚糖分子质量呈正相关。LI等[58]通过芬顿解聚反应对糖胺聚糖进行化学解聚,发现糖胺聚糖低聚糖显示出与其分子质量呈正相关的抗凝血活性。WU等[59]通过钴-60照射的方法对糖胺聚糖进行解聚,评估了低分子质量片段的抗凝血活性,发现抗凝血活性随着分子质量的降低而降低。NING等[47]对一种HF进行解聚,发现抗凝血活性随分子质量的降低而降低,分子质量小于11.5 kDa的HF片段则无明显抗凝作用。
一般认为,硫酸岩藻糖分支结构是海参多糖发挥抗凝血和抗血栓作用的基础,没有硫酸岩藻糖分支的海参中性聚糖不具备抗凝作用。ZHENG等[38]从秘鲁乌参(Pattalus mollis)分离出海参糖胺聚糖(PmFG)、岩藻聚糖(PmFS)和中性聚糖(PmNG-1 &-2),对他们的体外抗凝血活性进行了比较,发现含有硫酸岩藻糖分支的PmFG和PmFS均具有较强的活化部分凝血活酶时间(activated partial thromboplatin time,APTT)延长活性和内源性凝血途径末端复合物(FXase)抑制活性,而不含硫酸岩藻糖分支的PmNG-1和PmNG-2则没有抗凝血活性。硫酸岩藻糖分支结构的硫酸化模式是影响海参多糖生物活性的主要因素,不同的硫酸化模式会导致海参多糖抗凝血活性的不同,CHEN等[60]分别从 墨西哥刺参(Isostichopus badionotus)和革皮氏海参(Pearsonothuria graeffei)分离出2种具有相同的硫酸软骨素主链和相似的岩藻糖分支的硫酸软骨素 fCS-Ib和fCS-Pg,两者的区别在于岩藻糖分支的硫酸化模式不同,体外抗凝血实验表明,在延长APTT、凝血酶时间和抑制凝血酶方面,具有Fucp2S4S分支的fCS-Ib较具有Fucp3S4S分支的fCS-Pg显示出更强的抗凝作用。
6 总结
海参作为一种珍贵的保健食品,除本身具有较高的营养价值,其独特的药理作用也备受关注。近年来随着海参多糖的制备与纯化工艺不断优化,海参多糖的产率和纯度得以不断提高,通过对不同海参品种海参多糖的化学结构和药理学活性研究的不断探索,其结构与生物学活性也逐渐清晰,使得海参多糖在功能性食品和医药领域有着巨大开发前景。目前海参多糖的开发研究仍然面临一些问题:一是目前的海参多糖的分离纯化方法过于繁琐,使其工厂化的批量生产不易实现,其分离纯化技术仍待突破。二是基于目前分析方法的局限性,对海参多糖复杂的高级结构与其对应的生物活性之间的关系没有深入进行探究,深入其构效关系和活性机制意义重大。海参多糖的研究是海参精深加工的重要内容,也是海洋功能食品和药物研发的前进方向,在未来有着广阔的应用前景。
[1] PANGESTUTI R, ARIFIN Z.Medicinal and health benefit effects of functional sea cucumbers[J].Journal of Traditional and Complementary Medicine, 2018, 8(3):341-351.
[2] 廖玉麟. 我国的海参[J].生物学通报, 2001, 36(9):1-3;47.
LIAO Y L.Sea cucumber in China[J].Bulletin of Biology, 2001, 36(9):1-3;47.
[3] 韩秋菊, 马宏飞.海参多糖的提取与纯化研究[J].安徽农业科学, 2012, 40(14):8071-8072;8074.
HAN Q J, MA H F.Extraction and purification of polysaccharides in sea cucumber[J].Journal of Anhui Agricultural Sciences, 2012, 40(14):8071-8072;8074.
[4] 冯骏. 海参多糖的分离纯化与化学组成的研究[D].厦门:集美大学, 2014.
FENG J.Study on isolation, purification and chemical component analysis of polysaccharides fromsea cucumber[D].Xiamen:Jimei University, 2014.
[5] LI C, NIU Q F, LI S J, et al.Fucoidan from sea cucumber Holothuria polii:Structural elucidation and stimulation of hematopoietic activity[J].International Journal of Biological Macromolecules, 2020, 154:1123-1131.
[6] GONG P X, WU Y C, LIU Y, et al.Structure and hypoglycemic effect of a neutral polysaccharide isolated from sea cucumber Stichopus japonicus[J].International Journal of Biological Macromolecules, 2022, 216:14-23.
[7] 韩慧敏, 谢安, 罗杰英.海参多糖提取工艺研究[J].湖南中医杂志, 2000, 16(1):56-57.
HAN H M, XIE A, LUO J Y.Study on extraction technology of polysaccharide from sea cucumber[J].Hunan Journal of Traditional Chinese Medicine, 2000, 16(1):56-57.
[8] 陈发河, 李真, 吴光斌.海地瓜多糖和多肽提取纯化工艺及抗氧化活性[J].集美大学学报(自然科学版), 2018, 23(2):105-118.
CHEN F H, LI Z, WU G B.Study on the extraction and antioxidant activities of polysaccharides and polypeptides from Acaudina molpadioides(semper)[J].Journal of Jimei University (Natural Science), 2018, 23(2):105-118.
[9] 徐逯, 叶立斌, 于平, 等.东海海参多糖酶解提取工艺优化[J].食品科学, 2010, 31(20):61-66.
XU L, YE L B, YU P, et al.Optimization of enzymatic polysaccharide extraction from Acaudina molpadioides semper by response surface methodology[J].Food Science, 2010, 31(20):61-66.
[10] MOU J J, LI Q, QI X H, et al.Structural comparison, antioxidant and anti-inflammatory properties of fucosylated chondroitin sulfate of three edible sea cucumbers[J].Carbohydrate Polymers, 2018, 185:41-47.
[11] 展学孔, 周海妹, 马小花, 等.海参多糖提取新工艺[J].中国实验方剂学杂志, 2011, 17(15):40-42.
ZHAN X K, ZHOU H M, MA X H, et al.New extraction technology of polysaccharide from sea cucumber[J].Chinese Journal of Experimental Traditional Medical Formulae, 2011, 17(15):40-42.
[12] LI X M, LUO L, CAI Y, et al.Structural elucidation and biological activity of a highly regular fucosylated glycosaminoglycan from the edible sea cucumber Stichopus herrmanni[J].Journal of Agricultural and Food Chemistry, 2017, 65(42):9315-9323.
[13] HE W T, SUN H H, SU L J, et al.Structure and anticoagulant activity of a sulfated fucan from the sea cucumber Acaudina leucoprocta[J].International Journal of Biological Macromolecules, 2020, 164:87-94.
[14] 王远红, 吕志华, 姜廷福, 等.梅花参中多糖提取工艺及含量测定的研究[J].中国海洋大学学报(自然科学版), 2005, 35(6):987-990.
WANG Y H, LV Z H, JIANG T F, et al.Extraction and determination of polysaccharides in the holothutia[J].Journal of Ocean University of Qingdao, 2005, 35(6):987-990.
[15] WANG J J, SHI S, LI F F, et al.Physicochemi-cal properties and antioxidant activity of polysaccharides obtained from sea cucumber gonads via ultrasound-assisted enzymatic techniques[J].LWT-Food Science and Technology, 2022, 160:113307.
[16] 王庆芬. 刺参中多糖的提取分离、结构表征及其核苷类物质的分析[D].福州:福建医科大学, 2017.
WANG Q F.Extraction, separation, structural characterization of polysaccharide and analysis on nucleoside in Stichopus japonicus[D].Fuzhou:Fujian Medical University, 2017.
[17] 王婧媛, 王联珠, 孙晓杰, 等.海参加工工艺、营养成分及活性物质研究进展[J].食品安全质量检测学报, 2018, 9(11):2749-2755.
WANG J Y, WANG L Z, SUN X J, et al.Research progress on processing technology, nutritive components and active substances of sea cucumber[J].Journal of Food Safety &Quality, 2018, 9(11):2749-2755.
[18] 于双, 李双双, 宋志远, 等.海参多糖提取 分离及纯化的研究概述[J].农产品加工, 2022(7):80-83;88.
YU S, LI S S, SONG Z Y, et al.Research on extraction separation purification methods of sea cucumber polysaccharides[J].Farm Products Processing, 2022(7):80-83;88.
[19] 汪国威. 海南玉足海参的化学成分研究[D].海口:海南大学, 2018.
WANG G W.Studies on the chemical constituents of sea cucumber in Yuzu, Hainan[D].Haikou:Hainan University, 2018.
[20] YUAN Q X, LI H, WANG Q, et al.Deaminative-cleaved S.monotuberculatus fucosylated glycosaminoglycan:Structural elucidation and anticoagulant activity[J].Carbohydrate Polymers, 2022, 298:120072.
[21] 宋思媛, 李美琪, 王泽旭, 等.海参多糖对小鼠肠道菌群紊乱的恢复作用[J].中国微生态学杂志, 2019, 31(9):1 023-1026; 1033.
SONG S Y, LI M Q, WANG Z X, et al. Restoration effect of sea cucumber polysaccharides on intestinal microbiota disorder in mice[J]. Chinese Journal of Microecology, 2019, 31(9):1023-1026; 1033.
[22] 巫若子. 紫米花青素稳定性及应用研究进展[J].印染助剂, 2022, 39(10):7-10.
WU R Z.Research progress on the stability and application of purple rice anthocyanin[J].Textile Auxiliaries, 2022, 39(10):7-10.
[23] 李哲斌. 芋头多糖提取纯化、结构表征及生物活性研究进展[J].食品与发酵工业, 2023, 49(24):354-360.
LI Z B.Research progress on extraction, purification, structure characterization, and biological activity of taro polysaccharides[J].Food and Fermentation Industries, 2023, 49(24):354-360.
[24] 张军瑞, 陈健.木瓜蛋白酶酶解白底辐肛参提取多糖的研究[J].现代食品科技, 2009, 25(5):542-545.
ZHANG J R, CHEN J.Papain-catalyzed hydrolysis of Actinopyga mauritiana for mucopolysaccharide preparation[J].Modern Food Science and Technology, 2009, 25(5):542-545.
[25] 宿玮, 王彦超, 张翠玉, 等.海地瓜多糖脱色工艺研究[J].离子交换与吸附, 2011, 27(6):521-529.
SU W, WANG Y C, ZHANG C Y, et al.Study on decolorization technology of polysaccharide from Acaudina molpadioides[J].Ion Exchange and Adsorption, 2011, 27(6):521-529.
[26] 钮婧杰, 孙延平, 李霄, 等.树脂在中药多糖脱色工艺中的研究进展[J].化学工程师, 2021, 35(1):48-51.
NIU J J, SUN Y P, LI X, et al.Research progress of microporous resin in decolorization of polysaccharides from traditional Chinese medicine[J].Chemical Engineer, 2021, 35(1):48-51.
[27] 韩伟, 黄兮, 张玲玲, 等.中药多糖的提取、分离纯化及分析方法的研究进展[J].机电信息, 2012(14):19-25.
HAN W, HUANG X, ZHANG L L, et al.Advances in the extraction, isolation, purification and assay methods of polysaccharides in Chinese traditional medicine[J].Mechanical and Electrical Information, 2012(14):19-25.
[28] 朱启源. 两种海参多糖组分的制备及其改善大鼠2型糖尿病作用研究[D].广州:华南理工大学, 2020.
ZHU Q Y.Preparation of two sea cucumber polysaccharide fractions and their ameliorative effects on type 2 diabetes in rats[D].Guangzhou:South China University of Technology, 2020.
[29] 高岳. 不同产地刺参多糖的分离纯化及其组分含量的研究[D].大连:大连海洋大学, 2015.
GAO Y.Purification of polysaccharides and analysis of their contents and compositions in sea cucumbers(Apostichopus japonicas) from four origins[D].Dalian:Dalian Ocean University, 2015.
[30] 朱俊友, 李志佳, 董赵微, 等.香菇多糖提取、结构和生物活性的研究进展[J].河南工业大学学报(自然科学版), 2022, 43(5):125-136.
ZHU J Y, LI Z J, DONG Z W, et al.Research progress of extraction, structure, and biological activity of lentinan[J].Journal of Henan University of Technology (Natural Science Edition), 2022, 43(5):125-136.
[31] CHANG Y G, HU Y F, YU L, et al.Primary structure and chain conformation of fucoidan extracted from sea cucumber Holothuria tubulosa[J].Carbohydrate Polymers, 2016, 136:1091-1097.
[32] GONG P X, LI Q Y, WU Y C, et al.Structural elucidation and antidiabetic activity of fucosylated chondroitin sulfate from sea cucumber Stichopus japonicas[J].Carbohydrate Polymers, 2021, 262:117969.
[33] NIELSEN S S.Phenol-Sulfuric Acid Method for Total Carbohydrates[M]//NIELSEN SS.Food Analysis Laboratory Manual.Boston, MA:Springer, 2010:47-53.
[34] 罗素菜, 张海江.王不留行药材中多糖含量测定研究[J].亚太传统医药, 2021, 17(11):47-50.
LUO S C, ZHANG H J.Study on the determination of polysaccharide content in Semen vaccaria[J].Asia-Pacific Traditional Medicine, 2021, 17(11):47-50.
[35] 焦健, 朱振军, 佟志晏, 等.HPLC-MS/MS法分析刺参及其制品中海参多糖的含量[J].中国渔业质量与标准, 2020, 10(5):12-17.
JIAO J, ZHU Z J, TONG Z Y, et al.Quantification of sea cucumber polysaccharide in Apostichopus japonicus and its relevant products[J].Chinese Fishery Quality and Standards, 2020, 10(5):12-17.
[36] 刘芬, 孙晓杰, 朱文嘉, 等.海参中单糖检测方法的建立及含量测定[J].渔业科学进展, 2018, 39(2):177-182.
LIU F, SUN X J, ZHU W J, et al.Establishment and determination of monosaccharide in sea cucumber[J].Progress in Fishery Sciences, 2018, 39(2):177-182.
[37] 顾兴宇, 白光辉, 刘璐, 等.海参多糖结构表征的研究进展[J].中国海洋药物, 2023, 42(1):66-75.
GU X Y, BAI G H, LIU L, et al.Research progress on structural characterization of sea cucumber polysaccharide[J].Chinese Journal of Marine Drugs, 2023, 42(1):66-75.
[38] ZHENG W Q, ZHOU L T, LIN L S, et al.Physicochemical characteristics and anticoagulant activities of the polysaccharides from sea cucumber Pattalus mollis[J].Marine Drugs, 2019, 17(4):198.
[39] LUO L, WU M Y, XU L, et al.Comparison of physicochemical characteristics and anticoagulant activities of polysaccharides from three sea cucumbers[J].Marine Drugs, 2013, 11(12):399-417.
[40] 杨东达.海参内脏多糖的分离、结构鉴定、免疫活性及其应用研究[D].泉州:华侨大学, 2020.
YANG D D.Study on isolation, structure identification, immune activity and application of polysaccharides from sea cucumber viscera[D].Quanzhou:Huaqiao University, 2020.
[41] 王婷, 刘京熙, 张健, 等.海参精多糖提取工艺优化及其体外抗肿瘤活性[J].食品工业科技, 2016, 37(17):68-74.
WANG T, LIU J X, ZHANG J, et al.Optimization of extraction of sea cucumber sperm polysaccharide and its antitumor activity in vitro[J].Science and Technology of Food Industry, 2016, 37(17):68-74.
[42] 卢战辉, 白阳秋, 孙趁意, 等.海参多糖调控JAK2/STAT3/survivin通路对肝癌细胞增殖和凋亡的影响[J].中国普外基础与临床杂志, 2022, 29(7):875-880.
LU Z H, BAI Y Q, SUN C Y, et al.Effects of sea cucumber polysaccharide regulating JAK2/STAT3/survivin pathway on proliferation and apoptosis of hepatocellular carcinoma cells[J].Chinese Journal of Bases and Clinics in General Surgery, 2022, 29(7):875-880.
[43] 李天, 刘一帆, 周东梅, 等.海参多糖抑制人肾癌细胞A498的生长转移作用机制[J].基因组学与应用生物学, 2020, 39(3):1344-1350.
LI T, LIU Y F, ZHOU D M, et al.Mechanism of the effect of sea cucumber polysaccharide on inhibiting the growth and metastasis of human RCC A498 cells[J].Genomics and Applied Biology, 2020, 39(3):1344-1350.
[44] 张晓媛. 海参多糖联合放疗对人肺腺癌A549细胞系的增殖抑制及促凋亡作用研究[D].青岛:青岛大学, 2019.
ZHANG X Y.Combination of holothurian glycosaminoglycan and radiation has synergistically inhibitory effects on human lung adenocarcinoma A549[D].Qingdao:Qingdao University, 2019.
[45] 王静杰, 钟强, 董春晖, 等.海参多糖生物学活性及其作用机制研究进展[J].食品科学, 2021, 42(23):370-380.
WANG J J, ZHONG Q, DONG C H, et al.Recent progress in the biological activity and mechanism of action of sea cucumber polysaccharides[J].Food Science, 2021, 42(23):370-380.
[46] GAO N, CHEN R, MOU R R, et al.Purification, structural characterization and anticoagulant activities of four sulfated polysaccharides from sea cucumber Holothuria fuscopunctata[J].International Journal of Biological Macromolecules, 2020, 164:3421-3428.
[47] NING Z M, WANG P, ZUO Z C, et al.A Fucan sulfate with pentasaccharide repeating units from the sea cucumber Holothuria floridana and its anticoagulant activity[J].Marine Drugs, 2022, 20(6):377.
[48] 张哲娴. 玉足海参(Holothuria leucospilota)多糖的化学结构与抗凝活性研究[D].武汉:中南民族大学, 2021.
ZHANG Z X.Studies on the chemical structure and anticoagulant activity of polysaccharides from Holothuria leucospilota[D].Wuhan:Central South University for Nationalities, 2021.
[49] ZHU Y J, TIAN Y Y, WANG N, et al.Structure-function relationship analysis of fucoidan from sea cucumber (Holothuria tubulosa) on ameliorating metabolic inflammation[J].Journal of Food Biochemistry, 2021, 45(1):e13500.
[50] 张帅. 刺参岩藻聚糖硫酸酯对RAW264.7细胞炎症和自噬的影响[D].杨凌:西北农林科技大学, 2021.
ZHANG S.Effects of fucoidan from Stichopus japonicus on inflammation and autophagy of RAW264.7 cells[D].Yangling:Northwest A &F University, 2021.
[51] 袁义琼. 玉足海参多糖对大鼠高脂血症的缓解作用及机制研究[D].海口:海南大学, 2020.
YUAN Y Q.Study on the alleviative effect and mechanism of polysaccharides from sea cucumber of Yuzu on hyperlipidemia in rats[D].Haikou:Hainan University, 2020.
[52] 李启冬. 海参肠壁硫酸软骨素的结构解析和活性研究[D].哈尔滨:哈尔滨工业大学, 2021.
LI Q D.Structure analysis and activity study of chondroitin sulfate from intestinal wall of sea cucumber[D].Harbin:Harbin Institute of Technology, 2021.
[53] GAO L, XU C, TAO X L, et al.Structure elucidation of Fucan sulfate from sea cucumber Holothuria fuscopunctata through a bottom-up strategy and the antioxidant activity analysis[J].International Journal of Molecular Sciences, 2022, 23(9):4488.
[54] WANG W L, MAO H, LI S J, et al.Branched chondroitin sulfate oligosaccharides derived from the sea cucumber Acaudina molpadioides stimulate neurite outgrowth[J].Marine Drugs, 2022, 20(10):653.
[55] 冯巧巧, 谢纪珍, 樊红延, 等.低分子量海参多糖胶囊对小鼠酒精性肝损伤的保护作用[J].卫生研究, 2018, 47(1):146-147.
FENG Q Q, XIE J Z, FAN H Y, et al.Protective effect of low molecular weight sea cucumber polysaccharide capsule on alcoholic liver injury in mice[J].Journal of Hygiene Research, 2018, 47(1):146-147.
[56] LI G, ZHOU Y, YANG W Y, et al.Inhibitory effects of sulfated polysaccharides from the sea cucumber Cucumaria frondosa against Aβ40 aggregation and cytotoxicity[J].ACS Chemical Neuroscience, 2021, 12(11):1854-1859.
[57] ZHU Z J, ZHU B W, SUN Y J, et al.Sulfated polysaccharide from sea cucumber and its depolymerized derivative prevent obesity in association with modification of gut microbiota in high-fat diet-fed mice[J].Molecular Nutrition &Food Research, 2018, 62(23):e1800446.
[58] LI J H, LI S, YAN L F, et al.Fucosylated chondroitin sulfate oligosaccharides exert anticoagulant activity by targeting at intrinsic tenase complex with low FXII activation:Importance of sulfation pattern and molecular size[J].European Journal of Medicinal Chemistry, 2017, 139:191-200.
[59] WU N, YE X Q, GUO X, et al.Depolymerization of fucosylated chondroitin sulfate from sea cucumber, Pearsonothuria graeffei, via 60Co irradiation[J].Carbohydrate Polymers, 2013, 93(2):604-614.
[60] CHEN S G, LI G Y, WU N, et al.Sulfation pattern of the fucose branch is important for the anticoagulant and antithrombotic activities of fucosylated chondroitin sulfates[J].Biochimica et Biophysica Acta (BBA)-General Subjects, 2013, 1830(4):3054-3066.