疲劳是指由于睡眠不足、长时间脑力或体力活动、或是长时间的压力或焦虑而导致的一种疲惫困倦的状态[1]。研究显示,30%~50%的受访群众有疲劳症状[2]。疲劳可分为心理疲劳和体力疲劳,其中体力疲劳又称运动疲劳,表现为运动耐力下降以及无法维持长时间或剧烈活动[3]。长期疲劳会导致一系列继发问题,如身体功能障碍、能量失衡、焦虑、抑郁、认知障碍、睡眠质量差等,甚至会加速慢性肾病等疾病的发生,严重影响身体健康[4-6]。因此,研发具有缓解体力疲劳的功能食品具有积极的健康促进意义。
灵芝(Ganoderma lucidum)是我国传统的药食两用真菌,含有多酚类、多糖类、类固醇类、三萜类化合物等天然生物活性成分,具有抗炎、抗菌、保肝、免疫调节等作用[7]。灵芝孢子是灵芝子实体的生殖细胞,其药用价值明显高于灵芝子实体[8]。灵芝孢子油(Ganoderma lucidum spore oil,GLSO)是通过超临界二氧化碳萃取技术从破壁灵芝孢子中提取得到的脂溶性活性物质[9-10]。研究表明,灵芝孢子油具有良好的抗氧化作用[11]及增强免疫功能[12-16]。目前关于灵芝在缓解体力疲劳上的相关研究主要集中在灵芝子实体、灵芝菌丝体和灵芝复方制剂上,对于灵芝孢子油的研究较少且其缓解体力疲劳的机制尚不明确。
因此,本研究参考《保健食品功能检验与评价方法(2023年版)》中缓解体力疲劳的检验方法,采用不同剂量的灵芝孢子油对小鼠进行灌胃,结合负重游泳时间、血清尿素氮(blood urea nitrogen, BUN)、肝糖原、肌糖原、血乳酸(blood lactic acid, BLD)以及腓肠肌糖原及肌细胞调亡等指标的测定,探讨灵芝孢子油缓解体力疲劳的作用及其体制,以期为灵芝孢子油抗疲劳保健食品的开发和利用提供依据。
1 材料与方法
1.1 受试物
灵芝孢子油,广州某公司,人体推荐摄入量为2.4 g/d。
1.2 实验动物
健康SPF级雄性KM小鼠144只,体重18~22 g[北京华阜康生物科技股份有限公司,动物合格证号SCXK(京)2019-0008],饲养于四川大学华西公共卫生学院屏障级动物房,饲料与垫料均由动物房提供。饲养条件:温度20~26 ℃,湿度40%~70%,明暗交替周期为12 h。本研究经四川大学华西第四医院/华西公共卫生学院伦理委员会批准(批件号:Gwll2023001)。
小鼠按体重随机分为4组,即溶剂对照组、灵芝孢子油低、中、高剂量组,每组36只动物,共分为4批。第I批的8只小鼠用于负重游泳实验,第II批的8只小鼠用于测定肝糖原,第III批的8只小鼠用于BUN测定、肌糖原测定以及后续机制指标的测定,第IV批的12只小鼠用于BLD测定。
1.3 剂量选择及受试物给予方式
灵芝孢子油的人体推荐剂量为2.4 g/d,成人体重以60 kg计,则每日推荐剂量为0.04 g/kg·bw。灵芝孢子油低、中、高剂量组分别为人体推荐剂量的5、10、20倍,即剂量分别为0.2、0.4、0.8 g/kg·bw。各组受试物溶于植物调和油配制。动物适应性喂养7 d后,经口灌胃给予受试物,每日1次,灌胃体积为1 mL/100 g·bw,溶剂对照组给予等量植物调和油,连续干预30 d。
1.4 主要仪器与试剂
AUY120分析天平,日本岛津shimadzu公司;D3024台式高速微量离心机、D3024R台式高速冷冻离心机、MX-S涡旋混合器,美国赛洛捷克SCILOGEX公司;THZ-82A数显气浴恒温振荡器,常州朗越仪器制造有限公司;KZ-III-F高速低温组织研磨仪,武汉赛维尔生物科技有限公司;TL-420D恒温水箱,江苏天力医疗器械有限公司;BK-200全自动生化分析仪,山东BIOBASE博科控股集团;SBA-40E生物传感分析仪,山东省科学院生物研究所。
浓硫酸,成都市科隆化学品有限公司;4%(质量分数,下同)多聚甲醛溶液、苏木素染液套装、DAB显色试剂盒(20×)、 PBS、TritonX-100,中国Biosharp公司;糖原试剂盒,南京建成生物工程研究所;高碘酸-希夫氏反应(periodic acid Schiff reagent, PAS)染液套装、DAB (SA-HRP) 原位末端标记(TdT-mediated dUTP nick-end labeling, TUNEL)试剂盒,武汉赛维尔生物科技有限公司。
1.5 实验方法
1.5.1 体重和一般情况
干预期内每隔1周称量1次小鼠体重并记录。每天观察小鼠的一般情况,包括活动状态、食欲、毛发光泽等。
1.5.2 脏器系数
取第III批小鼠的肝脏和肾脏,称重并计算脏器系数由公式(1)所示:
脏器系数![]()
(1)
1.5.3 负重游泳实验
使用第I批的8只小鼠按照《保健食品功能检验与评价方法(2023年版)》中缓解体力疲劳检验方法进行负重游泳实验。末次给予受试物30 min后,将尾根部负荷5%体重铅皮的小鼠置于游泳箱中游泳,水深约30 cm,水温为(25±1.0) ℃,游泳过程中注意使小鼠四肢保持运动。记录小鼠自游泳开始至死亡的时间,即负重游泳时间。
1.5.4 糖原、血尿素氮及血乳酸测定
实验第30天,末次给受试物30 min后,将第III批小鼠置于温度为30 ℃的水中不负重游泳90 min,休息60 min后立即拔眼球采血。血样在4 ℃冰箱静置过夜后离心(3 500 r/min, 15 min),收集血清,用全自动生化分析仪测定BUN。取第III批小鼠左侧腓肠肌,按照试剂盒说明书测定肌糖原的含量。取第II批小鼠的肝脏经生理盐水漂洗后冻存备用,按照试剂盒说明书采用蒽酮比色法测定肝糖原含量。第IV批小鼠在末次给予受试物30 min后采眼内眦血,采血后不负重游泳10 min立即擦干采眼内眦血,休息20 min后再次采眼内眦血,用乳酸仪测定BLD值。血乳酸曲线下面积计算由公式(2)所示:
血乳酸曲线下面积![]() 游泳前BLD值+游泳后
游泳前BLD值+游泳后![]() (游泳后0 min的BLD值+游泳后休息20 min的BLD值)×20
(游泳后0 min的BLD值+游泳后休息20 min的BLD值)×20
(2)
1.5.5 组织病理学检查
取第III批小鼠右侧腓肠肌,于4%多聚甲醛溶液中固定24 h,脱水、石蜡包埋、切片、脱蜡至水,苏木素-伊红(hematoxylin-eosin, HE)染色观察腓肠肌病理学变化。PAS染色观察腓肠肌糖原含量变化,显微镜镜检并采集图像,每张切片随机挑选3个视野拍照,应用Image-Pro Plus 6.0软件将切片中紫红色作为判断所有照片肌糖原沉积(阳性)的统一标准,对每张照片进行分析得出阳性面积占比,阳性面积占比计算由公式(3)所示:
糖原阳性面积![]()
(3)
1.5.6 TUNEL染色观察腓肠肌细胞凋亡
取第III批小鼠右侧腓肠肌,脱水、包埋、切片、脱蜡至水等同1.5.5节,按照TUNEL试剂盒说明书操作,DAB显色,复染细胞核,最后脱水封片,于显微镜下观察并采集图像,每张切片随机挑选3个视野,阳性凋亡细胞核为棕黄色,分析得出TUNEL阳性率,TUNEL阳性率计算由公式(4)所示。
TUNEL阳性率![]()
(4)
1.6 统计学处理
所有数据用平均数±标准差表示,采用SPSS 26.0软件进行统计分析。服从正态分布和方差齐的数据,采用单因素方差分析(one-way ANOVA)和Dunnet’t检验;不服从正态分布或方差不齐的数据可进行适当的变量转化,若转换后的数据仍方差不齐,则采用Tamhane’s T2法进行统计分析。P<0.05为差异有统计学意义。
2 结果与分析
2.1 灵芝孢子油对小鼠体重及一般情况的影响
灌胃30 d期间,各组小鼠的一般情况较好,食欲正常,毛发有光泽。与溶剂对照组相比,灵芝孢子油组小鼠更加活泼,喜攀爬嬉闹。各组小鼠体重变化曲线及增重情况如图1所示,干预期内,各组小鼠体重稳步增加,但各组间无显著差异(P>0.05)。
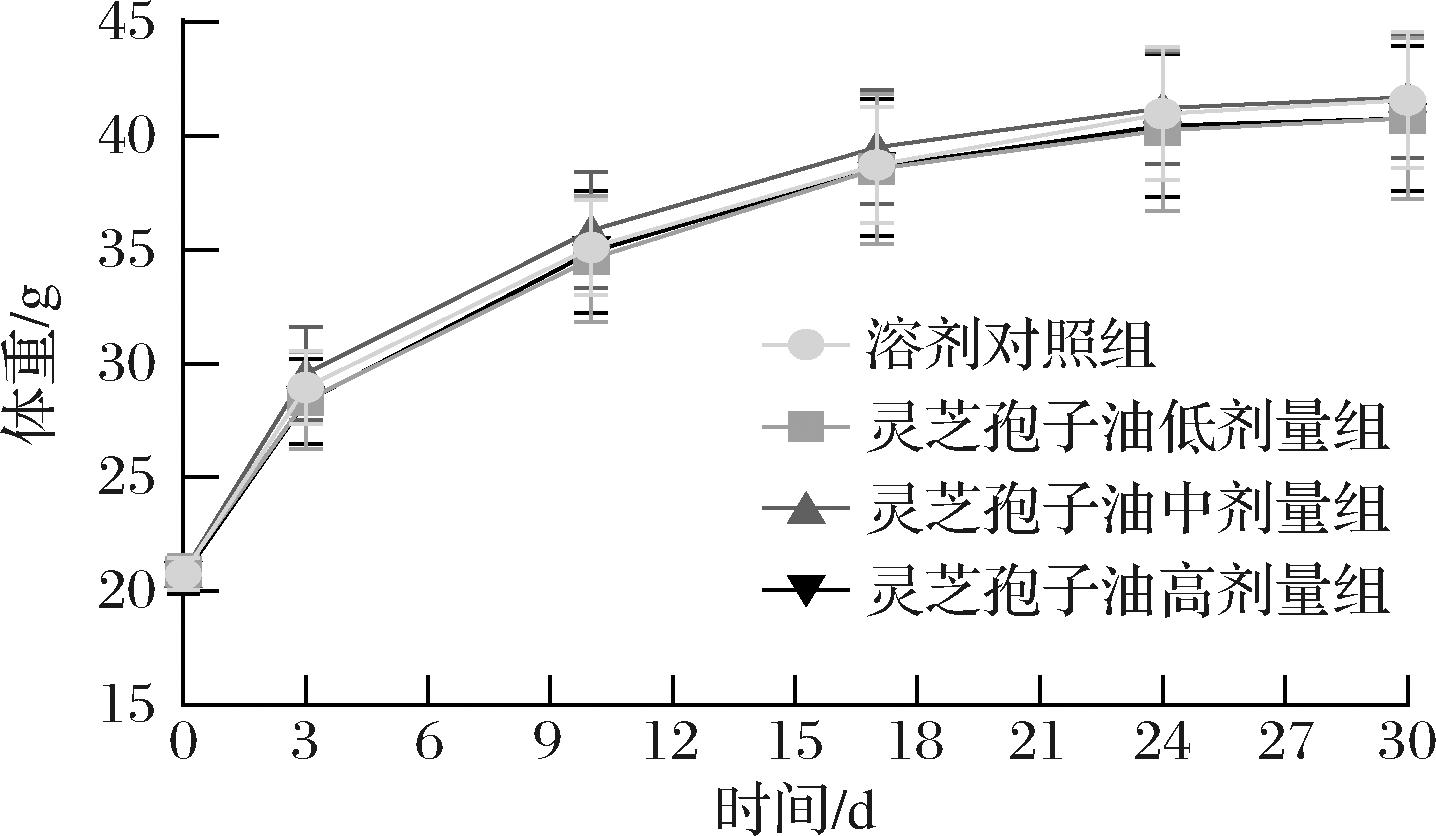
图1 灵芝孢子油对小鼠体重的影响(n=36)
Fig.1 Effect of GLSO on body weight (n=36)
2.2 灵芝孢子油对脏器系数的影响
各组小鼠脏器系数结果如图2所示,灵芝孢子油各剂量组小鼠的肝脏系数和肾脏系数与溶剂对照组相比无显著差异(P>0.05)。
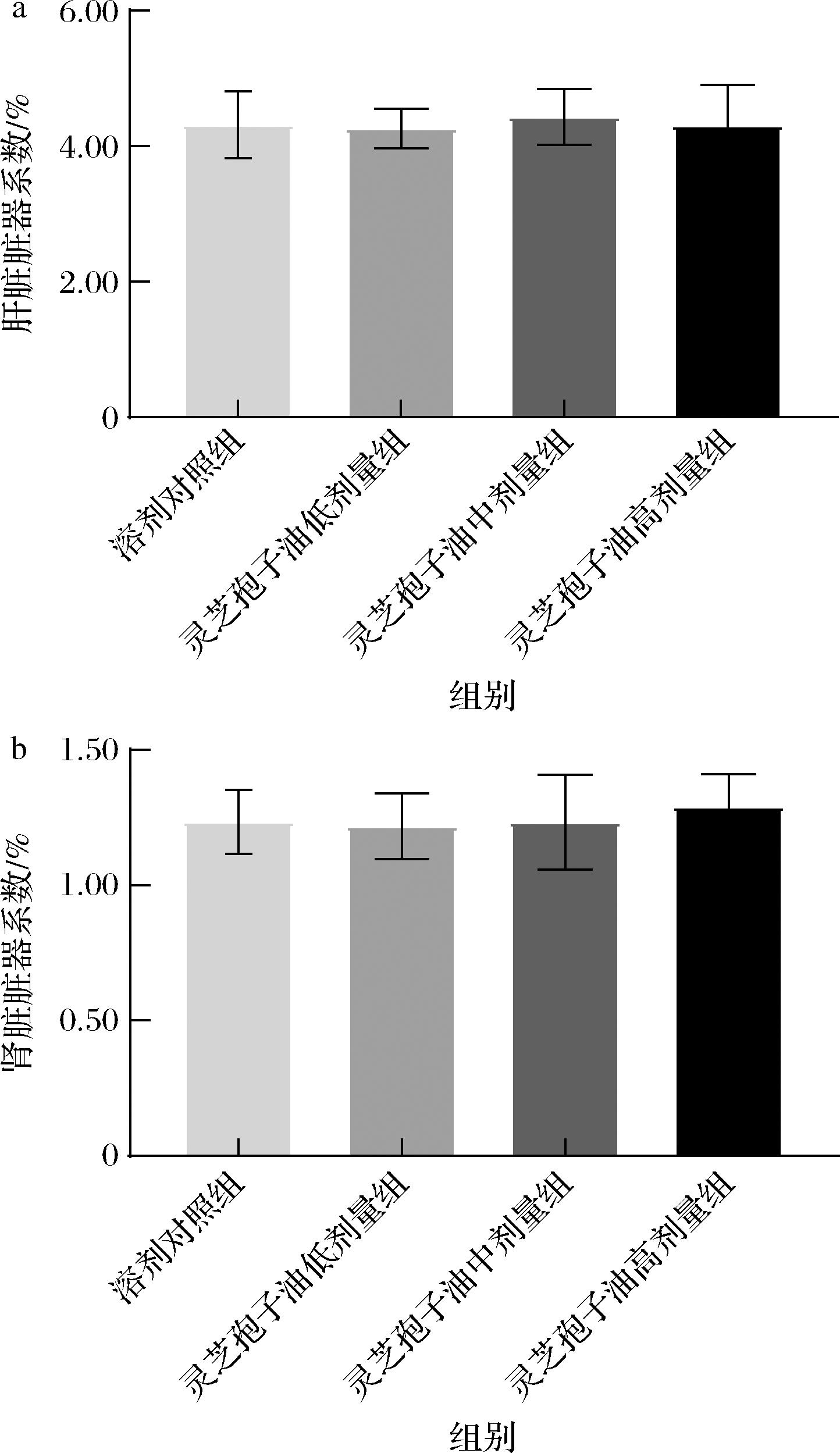
a-肝脏脏器系数;b-肾脏脏器系数
图2 灵芝孢子油对小鼠脏器系数的影响(n=8)
Fig.2 Effect of GLSO on liver and kidney coefficient (n=8)
2.3 灵芝孢子油对小鼠负重游泳时间的影响
运动疲劳发生的直接表现是运动耐力下降,而负重游泳时间可直接反映机体的运动耐力情况,即负重游泳时间越长,机体产生疲劳越慢,受试物的抗疲劳效果越好[17-19]。各组小鼠负重游泳时间结果如图3所示,灵芝孢子油各组小鼠负重游泳时间均高于溶剂对照组,分别增加了1.72%、101.93%和42.30%,其中灵芝孢子油中剂量组与溶剂对照组相比负重游泳时间极显著延长(P<0.01)。表明灵芝孢子油可提高小鼠的抗疲劳能力。
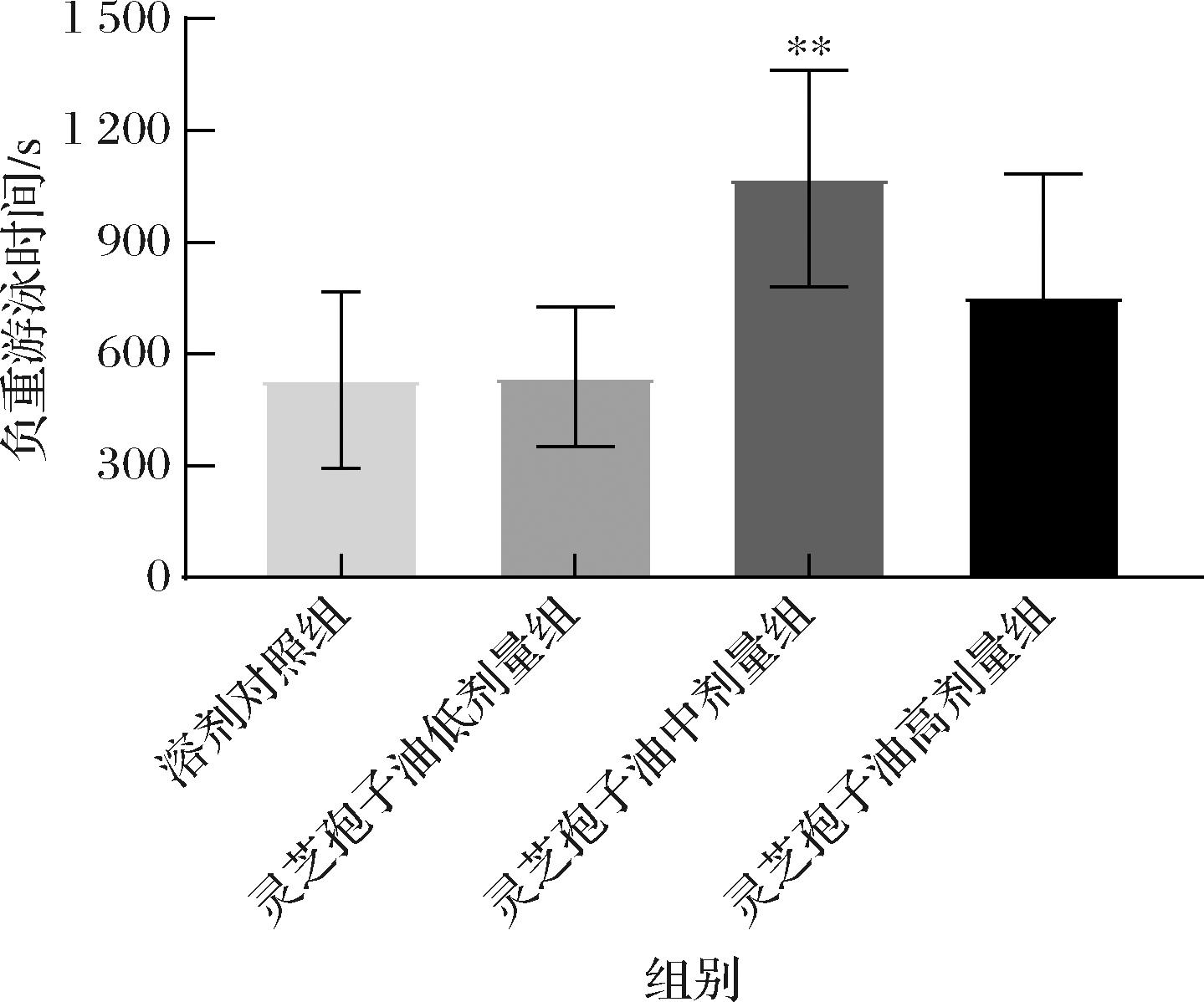
图3 灵芝孢子油对负重游泳时间的影响(n=8)
Fig.3 Effect of GLSO on weight-bearing swimming time (n=8)
注:与溶剂对照组相比,**表示差异极显著(P<0.01),
*表示差异显著(P<0.05)(下同)。
2.4 灵芝孢子油对小鼠血清BUN的影响
BUN是评价人体承受体力负荷能力的敏感指标,反映体内蛋白质氨基酸等含氮物质的分解代谢情况,体内BUN含量与运动负荷呈正相关[20-22]。各组小鼠BUN结果如图4所示。灵芝孢子油低、中、高剂量组小鼠的BUN水平均极显著低于溶剂对照组(P<0.01),这表明灵芝孢子油能有效降低机体蛋白质的供能比例,增强机体对耐力运动的适应性。
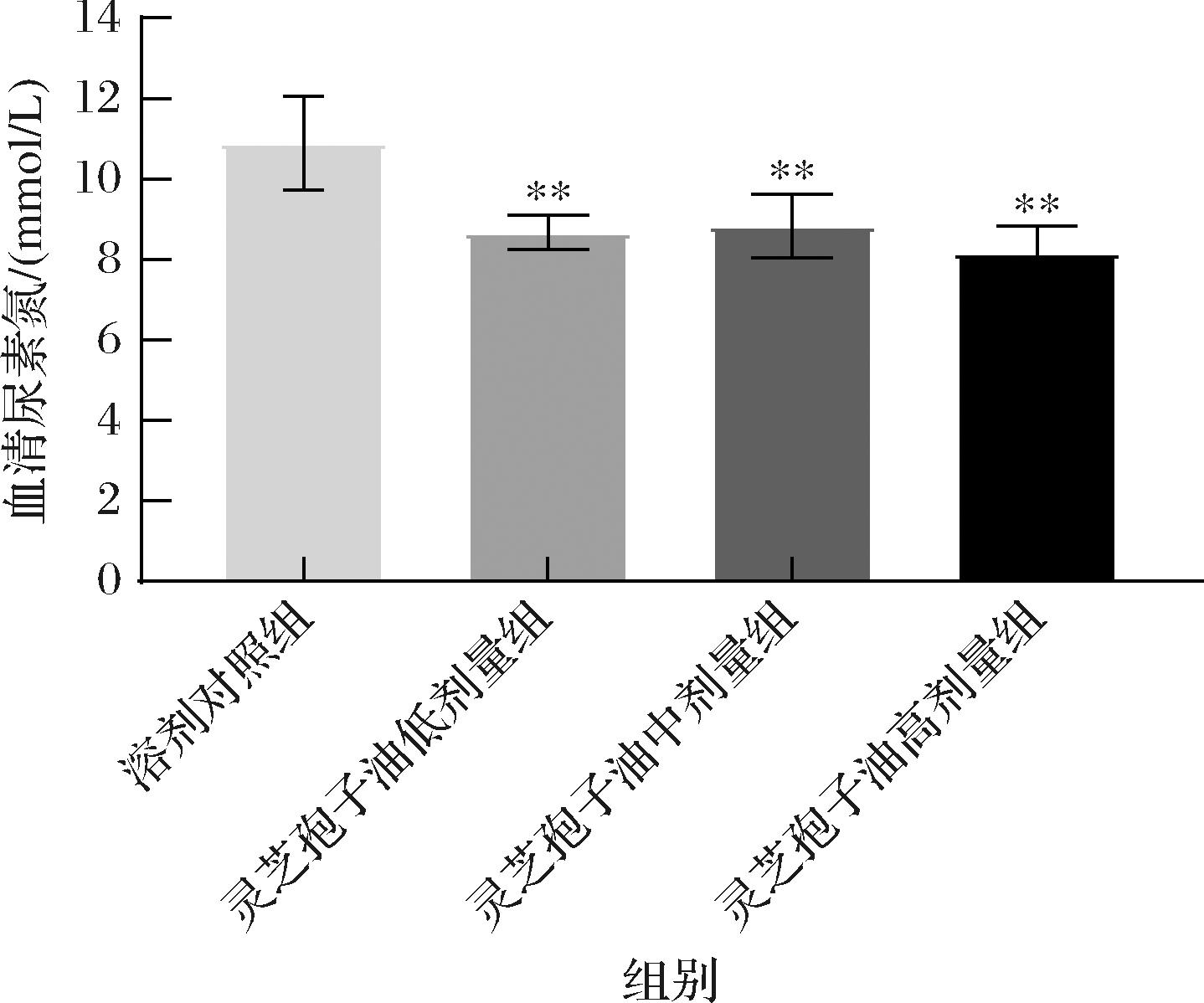
图4 灵芝孢子油对血清BUN的影响(n=8)
Fig.4 Effect of GLSO on BUN (n=8)
注:灵芝孢子油中剂量组由于负重游泳时有1只意外死亡,导致最终样本为7例。
2.5 灵芝孢子油对小鼠肝糖原和肌糖原含量的影响
糖原是机体运动时的首要供能物质,肝糖原和肌糖原分别是机体能量的储存和利用形式。运动时,机体消耗肌糖原供能,同时消耗肝糖原以维持体内血糖水平,因此运动强度越大,机体内糖原含量越低[23-25]。各组小鼠肝糖原和肌糖原结果如图5所示。灵芝孢子油各剂量组小鼠的肝糖原和肌糖原含量与溶剂对照组相比无显著差异(P>0.05),说明灵芝孢子油对机体的糖原含量无较大影响。由于肌糖原含量是采用第III批小鼠的腓肠肌进行测定,该批小鼠不负重游泳后消耗了较多糖原,因此肌糖原含量整体较低。
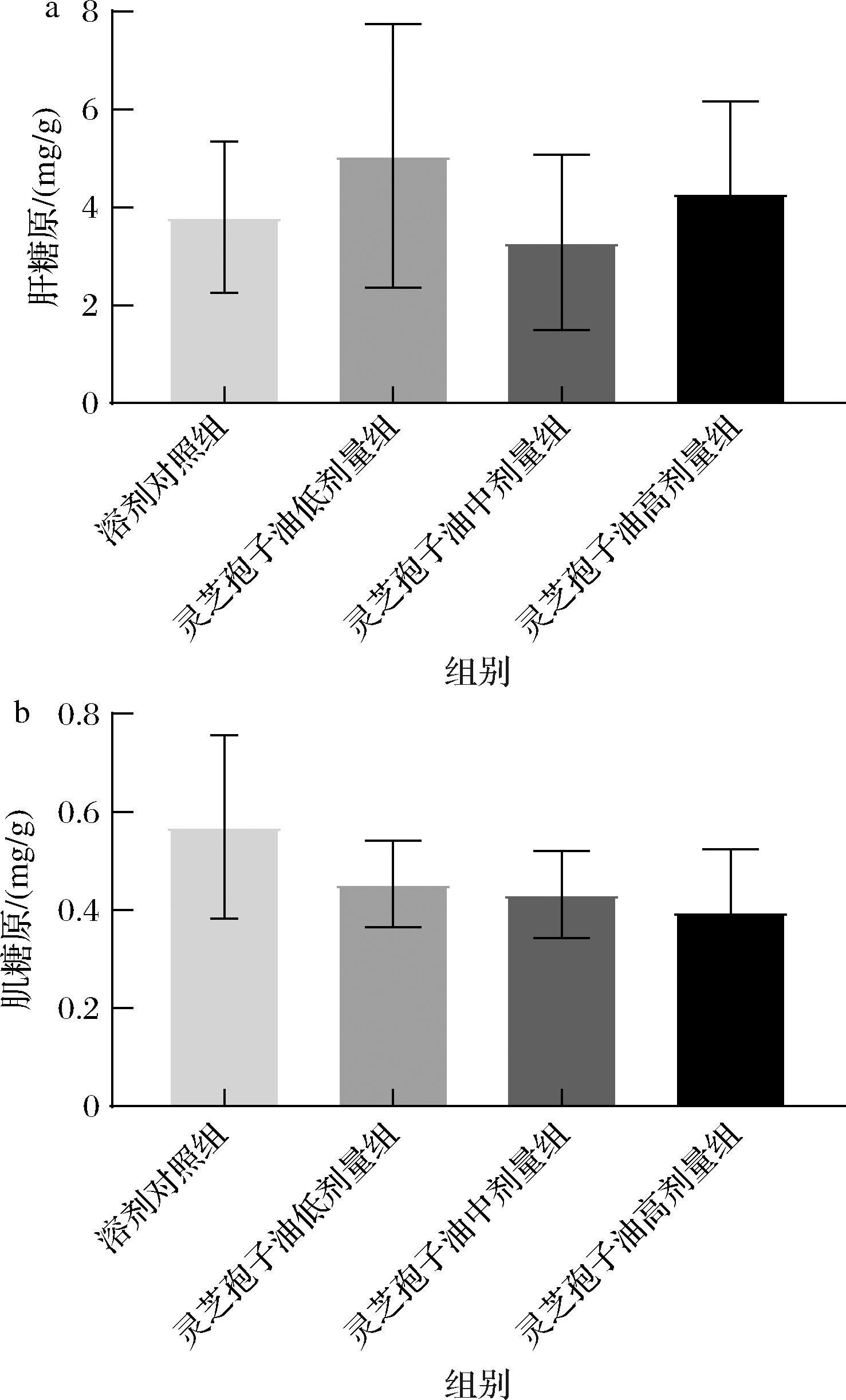
a-肝糖原含量;b-肌糖原含量
图5 灵芝孢子油对肝糖原和肌糖原含量的影响(n=8)
Fig.5 Effect of GLSO on hepatic and muscular glycogen level (n=8)
注:灵芝孢子油中剂量组由于负重游泳时有1只意外死亡,导致肌糖原含量最终样本为7例。
2.6 灵芝孢子油对小鼠BLD水平的影响
在长时间高强度运动中,肌肉的有氧供能转变为无氧酵解,糖原被迅速消耗,产生大量乳酸,乳酸在血液中堆积导致体内pH值下降,导致疲劳产生[26-29]。各组小鼠BLD水平及血乳酸曲线下面积如图6所示。游泳前,各组小鼠的BLD水平之间无显著差异(P>0.05);游泳后0 min,灵芝孢子油中和高剂量组小鼠的BLD含量均极显著低于溶剂对照组(P<0.01);休息20 min后,灵芝孢子油各剂量组小鼠的BLD含量均极显著低于溶剂对照组(P<0.01)。与溶剂对照组相比,灵芝孢子油各剂量组小鼠的血乳酸曲线下面积均极显著降低(P<0.01),且BLD水平及曲线下面积随剂量升高而降低,呈现一定的剂量-反应关系,表明灵芝孢子油能有效抑制乳酸生成或加速乳酸分解,起到缓解体力疲劳的作用。
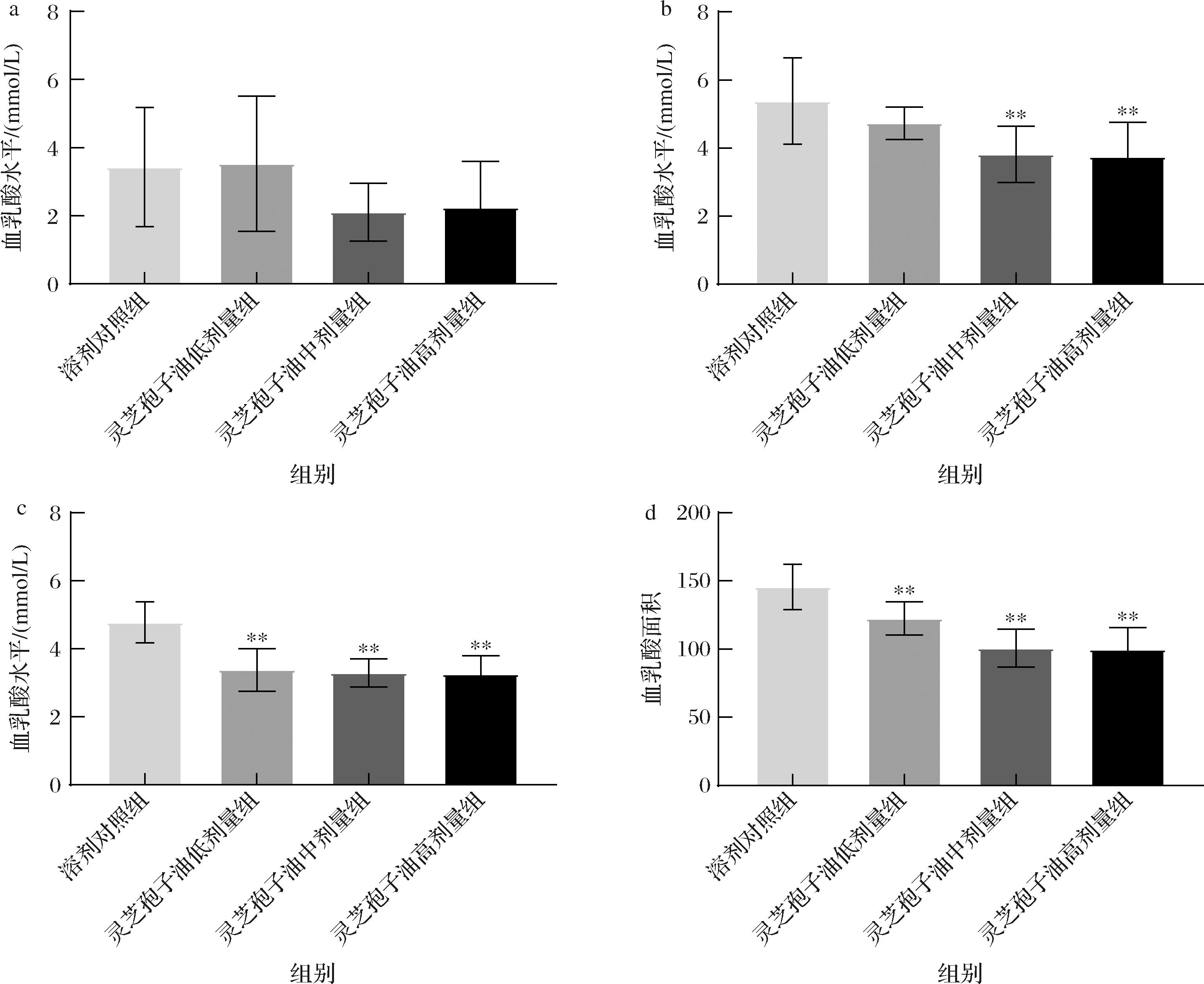
a-游泳前BLD值;b-游泳后0 min的BLD值;c-休息20 min后的BLD值;d-血乳酸曲线下面积
图6 灵芝孢子油对BLD水平及血乳酸曲线下面积的影响(n=12)
Fig.6 Effect of GLSO on BLD and area under curve of the blood lactic acid (n=12)
2.7 灵芝孢子油对小鼠组织病理学的影响
HE染色用于观察腓肠肌病理学变化,PAS染色用于观察腓肠肌肌糖原含量[30]。HE染色和PAS染色结果见图7。HE染色显示各组小鼠肌纤维排列紧密整齐,未见明显纤维组织或细胞增生及炎细胞浸润。PAS染色显示灵芝孢子油高剂量组腓肠肌着色最深。定量分析糖原阳性面积结果见图8。与溶剂对照组相比,灵芝孢子油高剂量组的肌糖原阳性面积显著增加(P<0.05),表明灵芝孢子油高剂量组可减少运动后小鼠的肌糖原消耗,但在此前的肌糖原生化检测中未见此结果,说明灵芝孢子油是否通过调控糖原代谢发挥抗疲劳作用还需进一步研究。
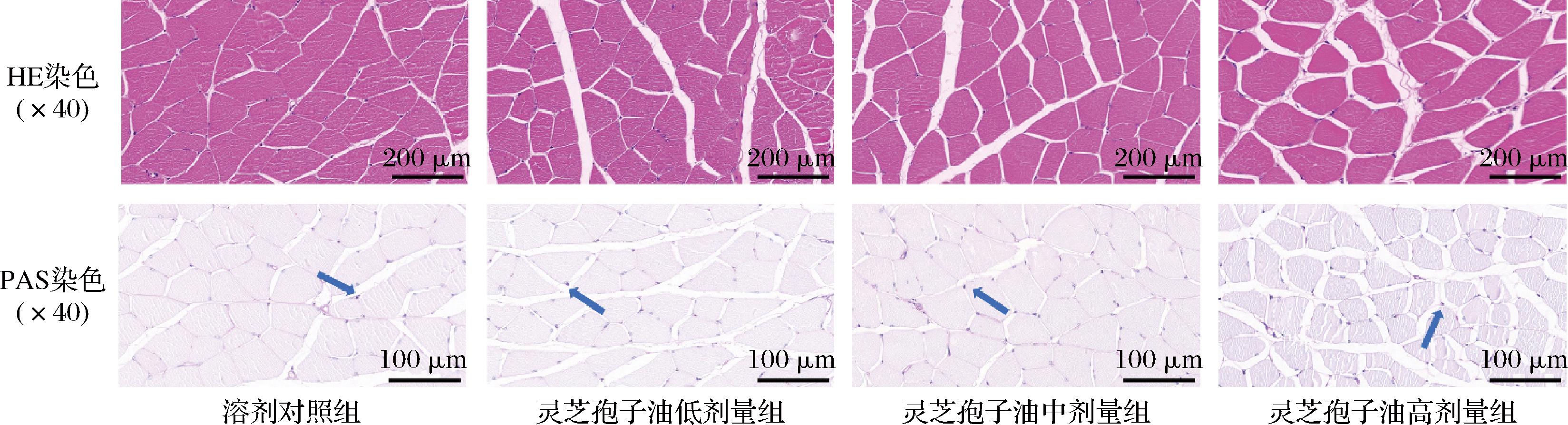
图7 各组小鼠腓肠肌HE染色和PAS染色情况(×40)
Fig.7 The HE staining and PAS staining of gastrocnemius in each group (×40)
注:蓝色箭头为PAS染色阳性。
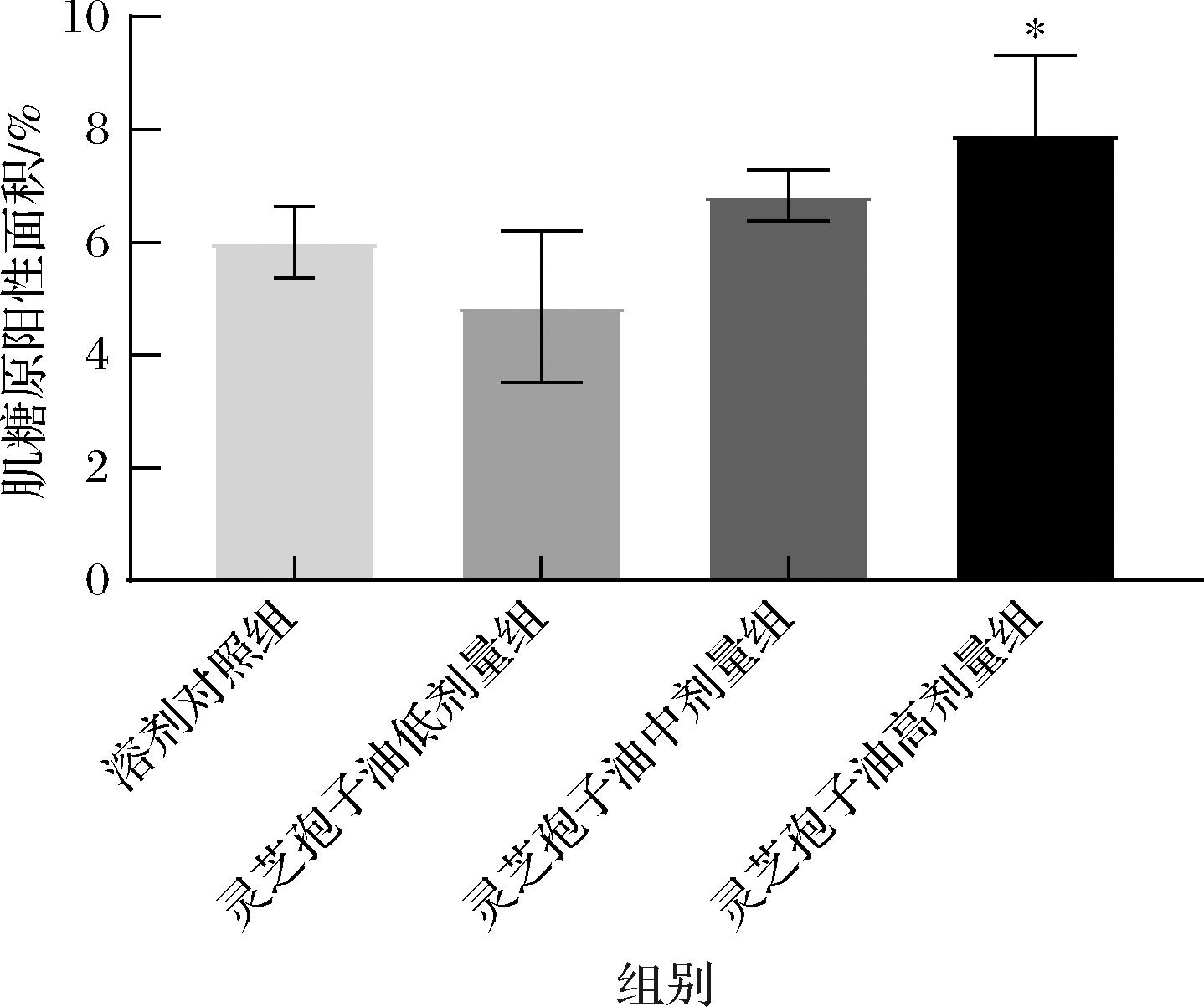
图8 灵芝孢子油对小鼠腓肠肌糖原的影响(n=5)
Fig.8 Effect of GLSO on muscular glycogen level of gastrocnemius (n=5)
2.8 灵芝孢子油对小鼠腓肠肌细胞凋亡的影响
TUNEL染色用于观察腓肠肌细胞凋亡情况。TUNEL染色典型示意图和TUNEL阳性率结果分别见图9和图10。TUNEL染色显示各组均只有少量细胞核中存在棕色颗粒,仅少量细胞凋亡。溶剂对照组存在更多的棕色细胞核,灵芝孢子油低和高剂量组的棕色细胞核较少。TUNEL阳性率结果显示,与溶剂对照组相比,灵芝孢子油低剂量组凋亡细胞阳性率显著降低(P<0.05),灵芝孢子油高剂量组阳性率降低但无显著差异(P>0.05)。TUNEL结果表明灵芝孢子油可能通过降低细胞凋亡来发挥抗疲劳作用。
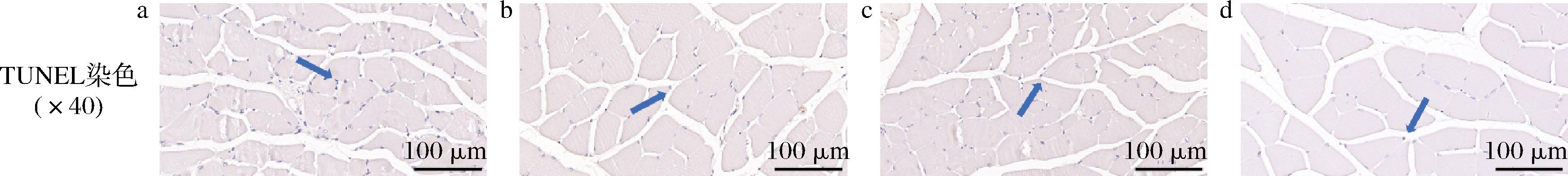
a-溶剂对照组;b-灵芝孢子油低剂量组;c-灵芝孢子油中剂量组;d-灵芝孢子油高剂量组
图9 各组小鼠腓肠肌TUNEL染色情况(×40)
Fig.9 The TUNEL staining of gastrocnemius in each group (×40)
注:蓝色箭头为TUNEL染色阳性。
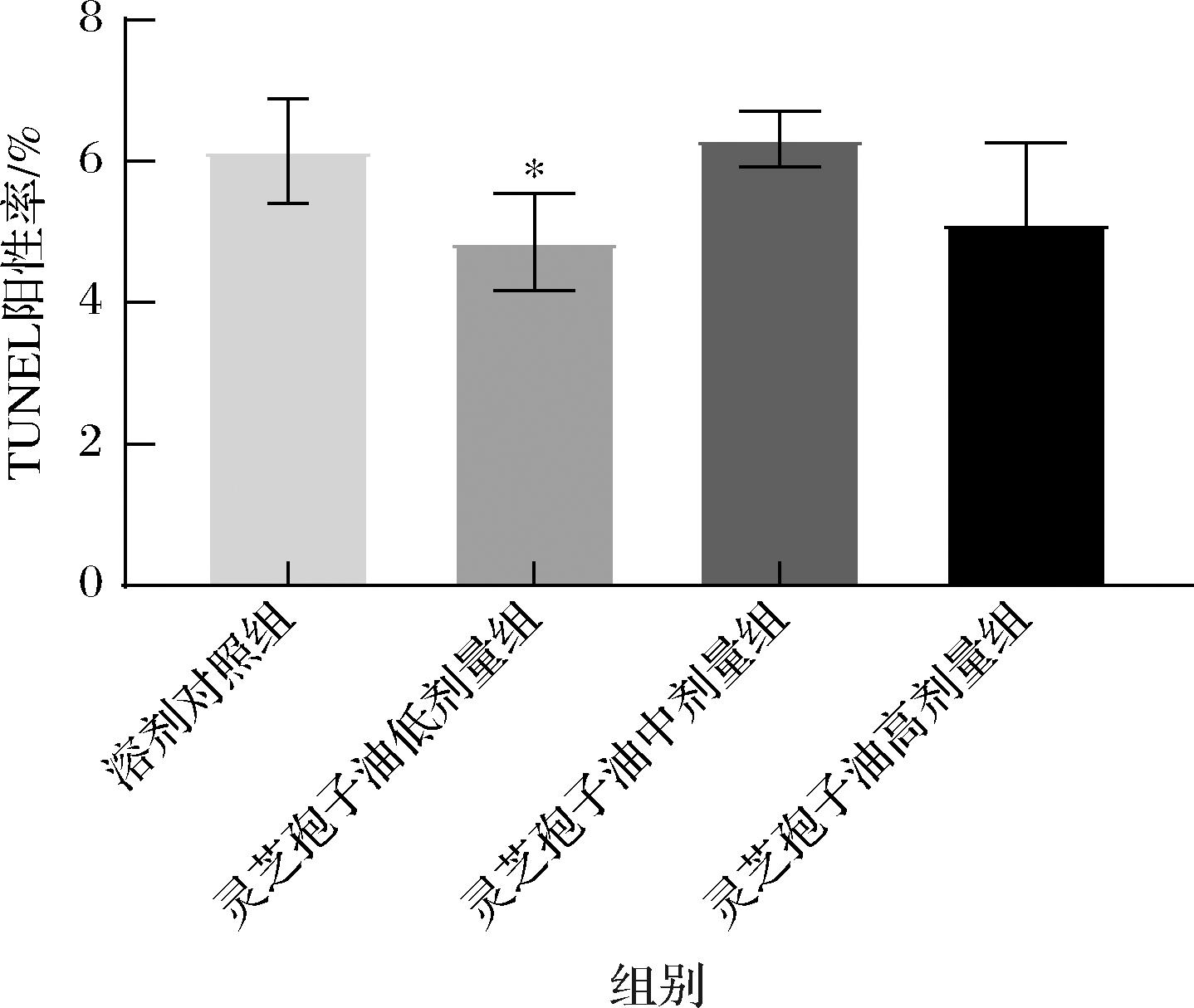
图10 灵芝孢子油对小鼠腓肠肌细胞凋亡的影响(n=5)
Fig.10 Effect of GLSO on apoptotic rate of injured gastrocnemius muscle tissue of mice (n=5)
3 结论
灵芝孢子油可延长小鼠负重游泳时间,减少BUN产生以及加速BLD的清除,依据《保健食品功能检验与评价方法(2023年版)》中缓解体力疲劳方法的结果判定,可认为该灵芝孢子油受试物具有缓解体力疲劳的作用,其机制可能与减少糖原消耗及减弱腓肠肌细胞凋亡有关。
[1] CALDWELL J A, CALDWELL J L, THOMPSON L A, et al.Fatigue and its management in the workplace[J].Neuroscience &Biobehavioral Reviews, 2019, 96:272-289.
[2] VAN’T LEVEN M, ZIELHUIS G A, VAN DER MEER J W, et al.Fatigue and chronic fatigue syndrome-like complaints in the general population[J].European Journal of Public Health, 2010, 20(3):251-257.
[3] WAN J J, QIN Z, WANG P Y, et al.Muscle fatigue:General understanding and treatment[J].Experimental &Molecular Medicine, 2017, 49(10):e384.
[4] MATURA L A, MALONE S, JAIME-LARA R, et al.A systematic review of biological mechanisms of fatigue in chronic illness[J].Biological Research for Nursing, 2018, 20(4):410-421.
[5] CHEN X L, LIANG D H, HUANG Z Q, et al.Anti-fatigue effect of quercetin on enhancing muscle function and antioxidant capacity[J].Journal of Food Biochemistry, 2021, 45(11):e13968.
[6] SUTHERLAND C, SMALLWOOD A, WOOTTEN T, et al.Fatigue and its impact on performance and health[J].British Journal of Hospital Medicine, 2023, 84(2):1-8.
[7] AHMAD R, RIAZ M, KHAN A, et al.Ganoderma lucidum (Reishi) an edible mushroom;a comprehensive and critical review of its nutritional, cosmeceutical, mycochemical, pharmacological, clinical, and toxicological properties[J].Phytotherapy Research:PTR, 2021, 35(11):6030-6062.
[8] 包县峰, 徐勇, 刘维明, 等.灵芝孢子粉生物活性成分及药理作用[J].食品工业科技, 2020, 41(6):325-331.
BAO X F, XU Y, LIU W M, et al.Research progress in bioactive ingredients and pharmacological functions of Ganoderma lucidum spores[J].Science and Technology of Food Industry, 2020, 41(6):325-331.
[9] HEO Y, KIM M, SUMINDA G G D, et al.Inhibitory effects of Ganoderma lucidum spore oil on rheumatoid arthritis in a collagen-induced arthritis mouse model[J].Biomedicine &Pharmacotherapy, 2023, 157:114067.
[10] JIAO C W, CHEN W, TAN X P, et al.Ganoderma lucidum spore oil induces apoptosis of breast cancer cells in vitro and in vivo by activating caspase-3 and caspase-9[J].Journal of Ethnopharmacology, 2020, 247:112256.
[11] 赵雅欣, 郭豫, 胡芳, 等.灵芝孢子油对老龄小鼠抗氧化能力的影响[J].农产品加工, 2020(5):4-7.
ZHAO Y X, GUO Y, HU F, et al.Effect of Ganoderma lucidum spore oil on antioxidative capacity of aged mice[J].Farm Products Processing, 2020(5):4-7.
[12] 陈铁晖, 陈润.灵芝孢子油软胶囊对小鼠免疫功能影响的实验研究[J].安徽预防医学杂志, 2016, 22(6):367-370, 374.
CHEN T H, CHEN R.Experimental study on effects of immune function in mice by ganderma ludidum spore oil capsule[J].Anhui Journal of Preventive Medicine, 2016, 22(6):367-370,374.
[13] 黄建康, 王凤岩, 黄琼, 等.灵芝孢子油增强小鼠免疫功能及护肝作用的实验研究[J].现代预防医学, 2007, 34(7):1272-1274.
HUANG J K, WANG F Y, HUANG Q, et al.Experimental study on the enhancement of immune function by the oil from spores of Ganoderma lucidum and it’s protective effects against liver injury in mice[J].Modern Preventive Medicine, 2007, 34(7):1272-1274.
[14] 陈新霞, 顾呈华, 吕中明, 等.灵芝孢子油免疫调节作用的研究[J].江苏预防医学, 2008, 19(3):8-10.
CHEN X X, GU C H, LV Z M, et al.Study on the immunoregulatory function of ganoderma iucidum spores oil[J].Jiangsu Journal of Preventive Medicine, 2008, 19(3):8-10.
[15] 鲍蕾蕾, 杨帆, 陈海飞, 等.复方灵芝孢子精油软胶囊抗疲劳增强免疫力作用研究[J].中国药业, 2015, 24(16):14-16.
BAO L L, YANG F, CHEN H F, et al.Effect of compound Ganoderma lucidum spore oil soft capsule on antifatigue and immunopotentiation[J].China Pharmaceuticals, 2015, 24(16):14-16.
[16] WU X, CAO J L, LI M X, et al.An integrated microbiome and metabolomic analysis identifies immunoenhancing features of Ganoderma lucidum spores oil in mice[J].Pharmacological Research, 2020, 158:104937.
[17] CHEN Y, WANG J J, JING Z H, et al.Anti-fatigue and anti-oxidant effects of curcumin supplementation in exhaustive swimming mice via Nrf2/Keap1 signal pathway[J].Current Research in Food Science, 2022, 5:1148-1157.
[18] CHEN C Y, YUEN H M, LIN C C, et al.Anti-fatigue effects of santé premium silver perch essence on exhaustive swimming exercise performance in rats[J].Frontiers in Physiology, 2021, 12:651972.
[19] LIN T C, WANG S H, HUANG C C, et al.Anti-fatigue, antioxidation, and anti-inflammatory effects of Eucalyptus oil aromatherapy in swimming-exercised rats[J].The Chinese Journal of Physiology, 2018, 61(5):257-265.
[20] TUNG Y T, WU M F, LEE M C, et al.Antifatigue activity and exercise performance of phenolic-rich extracts from Calendula officinalis, Ribes nigrum, and Vaccinium myrtillus[J].Nutrients, 2019, 11(8):1715.
[21] 张志超, 邱春媚, 殷光玲, 等.玛咖片缓解体力疲劳作用的研究[J].食品安全质量检测学报, 2019, 10(11):3595-3599.
ZHANG Z C, QIU C M, YIN G L, et al.Study on alleviating physical fatigue function of Maca Tablet[J].Journal of Food Safety &Quality, 2019, 10(11):3595-3599.
[22] CHAI X M, PAN M Y, WANG J J, et al.Cordycepin exhibits anti-fatigue effect via activating TIGAR/SIRT1/PGC-1α signaling pathway[J].Biochemical and Biophysical Research Communications, 2022, 637:127-135.
[23] 张颖捷, 杜万红.国内外抗疲劳研究进展[J].实用预防医学, 2012, 19(7):1112-1116.
ZHANG Y J, DU W H.Domestic and foreign research progress on anti-fatigue[J].Practical Preventive Medicine, 2012, 19(7):1112-1116.
[24] 于亚莉, 蒲奕灵, 高绿莎, 等.大豆肽缓解小鼠体力疲劳的功能评价[J].中国食品学报, 2022, 22(7):105-114.
YU Y L, PU Y L, GAO L, et al.Evaluation on anti-fatigue function of soybean peptide in mice[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(7):105-114.
[25] CHEN Y J, BASKARAN R, SHIBU M A, et al.Anti-fatigue and exercise performance improvement effect of Glossogyne tenuifolia extract in mice[J].Nutrients, 2022, 14(5):1011.
[26] LIU R, WU L, DU Q, et al.Small molecule oligopeptides isolated from walnut (Juglans regia L.) and their anti-fatigue effects in mice[J].Molecules, 2018, 24(1):45.
[27] 张志刚, 卢文婷, 董久霞, 等.肉苁蓉、淫羊藿与油莎豆油复配缓解小鼠疲劳的研究[J].粮食与油脂, 2022, 35(5):155-158.
ZHANG Z G, LU W T, DONG J X, et al.Study on the function of relieving physical fatigue by the combination of Cistanche deserticola, Epimedium and Cyperus esculentus oil in mice[J].Cereals &Oils, 2022, 35(5):155-158.
[28] 鲍蕾蕾, 陈海飞, 卞俊, 等.复方灵芝孢子精油软胶囊抗疲劳耐缺氧能力研究[J].中国实验方剂学杂志, 2014, 20(14):130-133.
BAO L L, CHEN H F, BIAN J, et al.Effect of compound Ganoderma lucidum spore oil soft capsule on antifatigue property and oxygen deficit-tolerance in mice[J].Chinese Journal of Experimental Traditional Medical Formulae, 2014, 20(14):130-133.
[29] ZHU H K, XU W Q, WANG N, et al.Anti-fatigue effect of Lepidium meyenii Walp.(Maca) on preventing mitochondria-mediated muscle damage and oxidative stress in vivo and vitro[J].Food &Function, 2021, 12(7):3132-3141.
[30] 杜伟, 吴思澜, 杨雪, 等.火把花根多糖对运动疲劳小鼠AMPK/mTOR信号通路的影响[J].天津医药, 2022, 50(11):1165-1170.
DU W, WU S L, YANG X, et al.Effects of tripterygium hypoflaucum(Levl.) hutch polysaccharide on the AMPK/mTOR signal pathway in mice with exercise-induced fatigue[J].Tianjin Medical Journal, 2022, 50(11):1165-1170.