益生菌泛指可在宿主肠道内定殖并改善微生态平衡、有益机体健康的一类微生物。近年来,肠道菌群对于人体健康的关键作用不断得到揭示,高效益生菌递送系统的开发成为研究热点[1-2]。益生菌产品的生产、储存与运输都会造成活力损失,而在益生菌被摄入之后,仍然需要面对食物组分互作、强酸性pH环境以及各类消化酶的挑战[3]。为了在到达肠道前为益生菌提供必要的保护,微胶囊化是当下的最优解,常见的途径包括挤压、乳化、凝聚、冻干和喷雾干燥[4-5]。除了增加稳定性与细胞活力外,微胶囊化后的益生菌往往还具备控制释放与肠道黏附作用。如今,益生菌微胶囊已经逐渐应用于乳制品、巧克力甚至谷物食品中,但是这项技术的工业规模应用仍存在许多问题亟待解决[1]。菌种与壁材之间的生物相容性及不同微胶囊制备技术需要验证,还要考虑多种环境胁迫因素对产品稳定性的影响。同时,为确保益生菌微胶囊的健康益处,要进一步解析对体内消化胁迫的抵抗力,调控益生菌胶囊在消化道中的控制释放。有关研究仍在不断涌现,由于益生菌菌种、壁材以及封装策略的种类繁多,一般的系统性综述难以具体量化它们的演变趋势,需要借助文献计量工具对科学文献进行大规模统计分析,深入探索以推进其产业化。
文献计量分析可以系统梳理国内外相关研究的热点迁移、发展脉络与前沿方向,展示国家与机构间合作关系,聚焦关键论文,此类研究方式已经在食品领域得到大量应用[6-7]。主流的文献计量软件包括CiteSpace、Vosviewer、Gephi、Histcite等,其中CiteSpace是一个动态的引文可视化平台,由于功能丰富常被作为研究者的首选[6]。此外,基于R语言的bibliometrix软件包也可以实现类似的功能[8]。文献计量学应用了数学与统计学方法,对已发表文献进行定量分析与描述,科学高效地探索、分析、聚类特定领域的知识。科研论文是基础科研成果的主要转化形式,借助文献计量学绘制科学知识图谱,本研究直观展现了益生菌微胶囊化领域内的信息全景,预测了未来发展趋势,有助于指导开辟新的研究方向。
1 文献计量分析策略
1.1 文献来源
中英文文献分别采集于China national knowledge infrastructure(CNKI)数据库与Web of Science(WOS)数据库,检索策略如表1。纳入文献池的文献均发表于学术期刊,排除会议论文、硕博士论文以及科普论文等,剔除重复发表文献。文献的发表时间为2004年1月至2023年3月。
表1 文献检索策略
Table 1 Search strategies for literature

文献来源文献类型检索策略发表时间文献数量总计数量清洗后数量CNKIWOS研究论文综述articlereview主题:(菌)and(胶囊化or包埋or封装)Term Search:(probiotic) and (encapsulat*)2004年1月-2023年3月273511 1781393242021 3171 236
注:*可以用任意字符(或空白)填充;检索中文文献时考虑到同义词较多,先扩大了检索范围,然后进行人工筛选。
1.2 研究方法及数据处理
检索收集得到的中英文文献以完整记录的方式分别导出为Refworks格式与纯文本(plain text file)。CiteSpace6.1.R6 (64-bit) Advanced主要用于实现关键词、机构等信息的聚类或共现,进行数据处理时,时间切片设置为1年,阈值(Top N)设置为50。Vosviewer1.6.19、Gephi0.10.0与Microsoft Charticulator用于绘制国家合作网络图。Bibliometrix平台和ggplot2软件包用于分析关键词频次与绘制分布热力图。在科学知识图谱中,节点的大小代表了权重或出现频率,网络密度从宏观上表示不同节点联系的强弱,2个节点间的连线表示两者同时出现的概率,连线越粗概率越大。
2 结果与分析
2.1 年度发文数量
年度发文量是体现特定研究领域发展速度的重要指标之一[9]。如图1-a所示,益生菌微胶囊化研究领域在2004年1月至2023年3月共发表文献1 438篇,其中中文202篇,英文1 236篇。从发表趋势来看,2009年前国内外发文量普遍偏低;2010—2013年期间英文文献发表速度显著增长,说明相关研究正处于起步阶段;2017—2022年期间,中英文文献年度增长速度均提升较快,处于快速发展阶段(2023年的文献统计仅截止3月底)。英文文献无论是整体发文量还是增长速率都要远高于中文文献,表明有关研究趋向国际化发展。
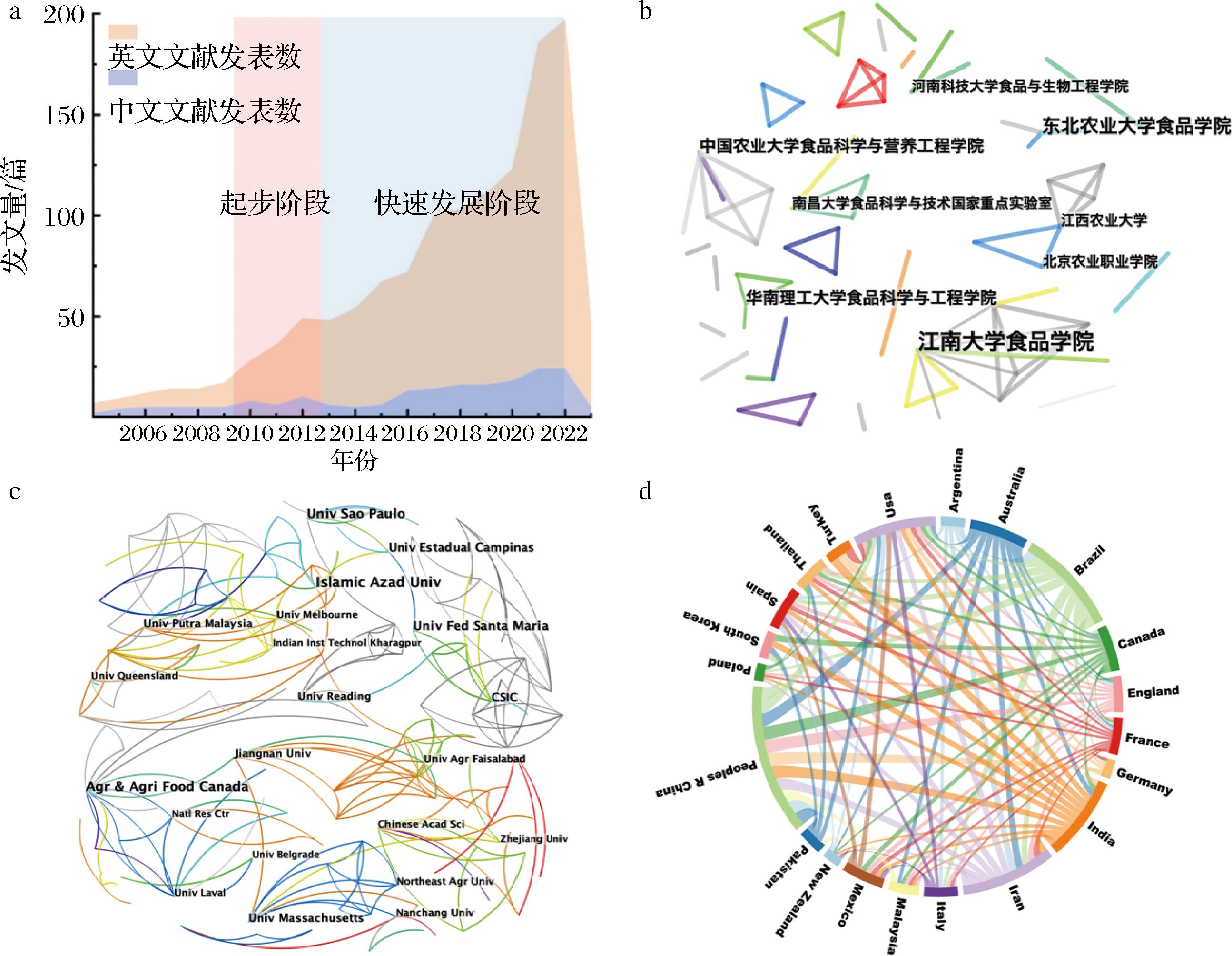
a-年度发文量统计;b-国内主要发文机构;c-国外主要发文机构;d-国际合作网络
图1 年度发文量统计与国内外主要发文机构以及国际合作网络
Fig.1 Annual publication statistics, domestic and foreign major publishing institutions and international cooperation network
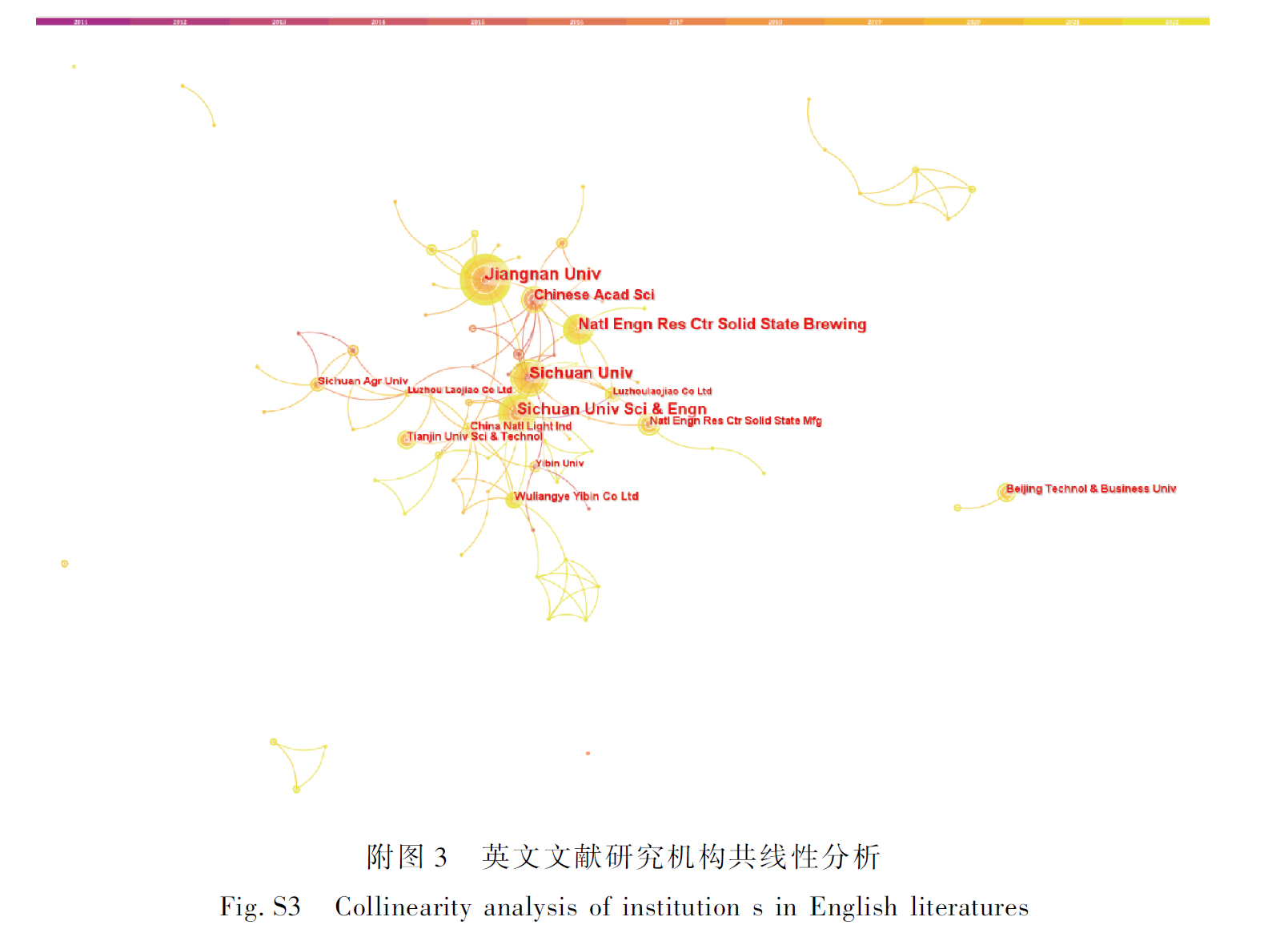
2.2 主要发文机构与国家合作网络
通过分析发文机构与国际合作网络,可以对益生菌微胶囊化研究领域内科研资源的分布与储备进行讨论,国内外机构合作网络如图1-b和图1-c所示。主要发文机构基本为高等院校,机构间合作通常展现很强的内聚性与地域性[10]。中文文献中的合作往往只在较少的几个机构之间进行,大多数科研成果仅涉及2~4个机构。国际机构间的合作更加密切,最大中介中心度是江南大学的0.05,体现了中国机构在该领域国际合作中的主导地位。江南大学在国内的合作网络也最为庞大,科研实力雄厚。一般来说,机构的中心度高于单一作者但是低于某个国家,这个中心度水平上较难形成清晰的差异网络[9,11]。伊斯兰阿扎德大学(Islamic Azad University)的发文量在所有机构中位居第一,为27篇。其次是加拿大农业食品协会(Agriculture and Agri-Food Canada)与圣保罗大学(University of Sao Paulo)并列第二,均为21篇。4个中国机构的发文量入围全球前20,分别为江南大学(12篇)、东北农业大学(10篇)、南昌大学(10篇)与中国科学院(9篇)。发文量前3的国家依次是中国(184篇)、巴西(124篇)与伊朗(118篇),其余前10的国家为美国、印度、澳大利亚、加拿大、西班牙、法国和英国。中国、美国、印度等国家的国际合作伙伴较为丰富,而巴基斯塔、韩国等国家在这方面有所欠缺(图1-d)。我国虽然发文量位居榜首,但起步时间较晚,中心度仅为0.15,远低于英国的0.36与美国的0.29。这说明我国仍然处于国际合作网络的外围,核心竞争力有待进一步提升[9]。
2.3 高被引文献
文章被引次数受到领域热度、作者数量等因素的影响,是文章价值的直观反映[8]。表2显示了益生菌微胶囊化相关的前10篇高被引文献。“Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery”被引用1 255次,是引用量最高的文章,重点综述了多糖相关的聚合物封装系统,如淀粉、壳聚糖、醋酸邻苯二甲酸纤维素、藻酸盐以及蛋白-多糖混合物[12]。而“Progress in microencapsulation of probiotics:A review”仅发行2年,就获得了175次引用。该研究重点讨论益生菌在储存和肠胃道系统中面临的挑战,同时提出多种递送系统效率评估的新兴手段,包括体内成像系统(in vivo imaging system,IVIS)、计算机辅助体外消化模型(dynamic gastrointestinal simulator,SIMGI)等[13]。引用量最高的研究论文“Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions”开发了一种海藻酸盐-壳聚糖胶囊,显著提高了益生菌在体外消化模型中的存活率,同时发现槲皮素等益生元会威胁益生菌的生理活动,应当单独胶囊化[14]。
表2 益生菌微胶囊化前10篇高被引文章
Table 2 Top 10 high-cited article in field of probiotic microencapsulation research
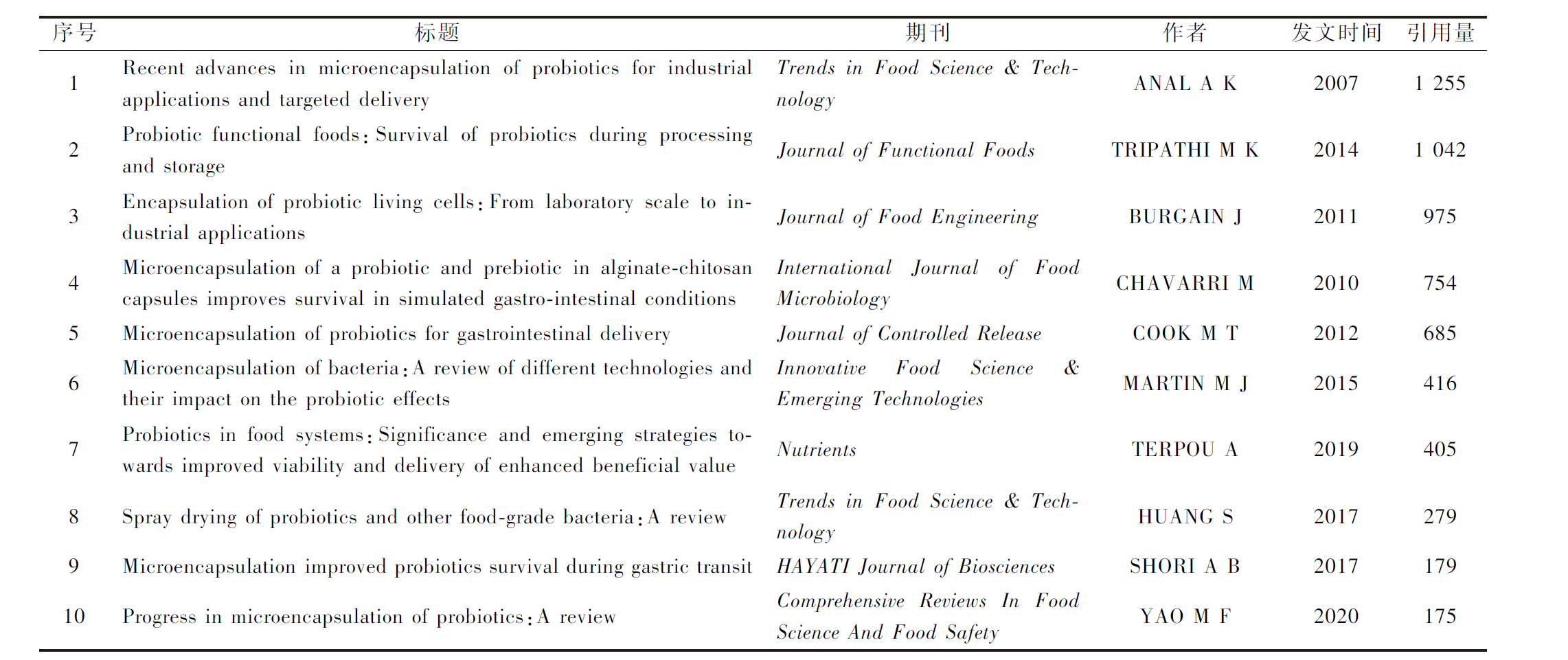
序号标题期刊作者发文时间引用量1Recent advances in microencapsulation of probiotics for industri-al applications and targeted deliveryTrends in Food Science & TechnologyANAL A K20071 2552Probiotic functional foods:Survival of probiotics during process-ing and storageJournal of Functional FoodsTRIPATHI M K20141 0423Encapsulation of probiotic living cells:From laboratory scale to industrial applicationsJournal of Food EngineeringBURGAIN J20119754Microencapsulation of a probiotic and prebiotic in alginate-chi-tosan capsules improves survival in simulated gastro-intestinal conditionsInternational Journal of Food MicrobiologyCHAVARRI M20107545Microencapsulation of probiotics for gastrointestinal deliveryJournal of Controlled ReleaseCOOK M T20126856Microencapsulation of bacteria:A review of different technolo-gies and their impact on the probiotic effectsInnovative Food Science & Emerging TechnologiesMARTIN M J20154167Probiotics in food systems:Significance and emerging strategies towards improved viability and delivery of enhanced beneficial valueNutrientsTERPOU A20194058Spray drying of probiotics and other food-grade bacteria:A re-viewTrends in Food Science & TechnologyHUANG S20172799Microencapsulation improved probiotics survival during gastric transitHAYATI Journal of Biosci-encesSHORI A B201717910Progress in microencapsulation of probiotics:A reviewComprehensive Reviews In Food Science And Food SafetyYAO M F2020175
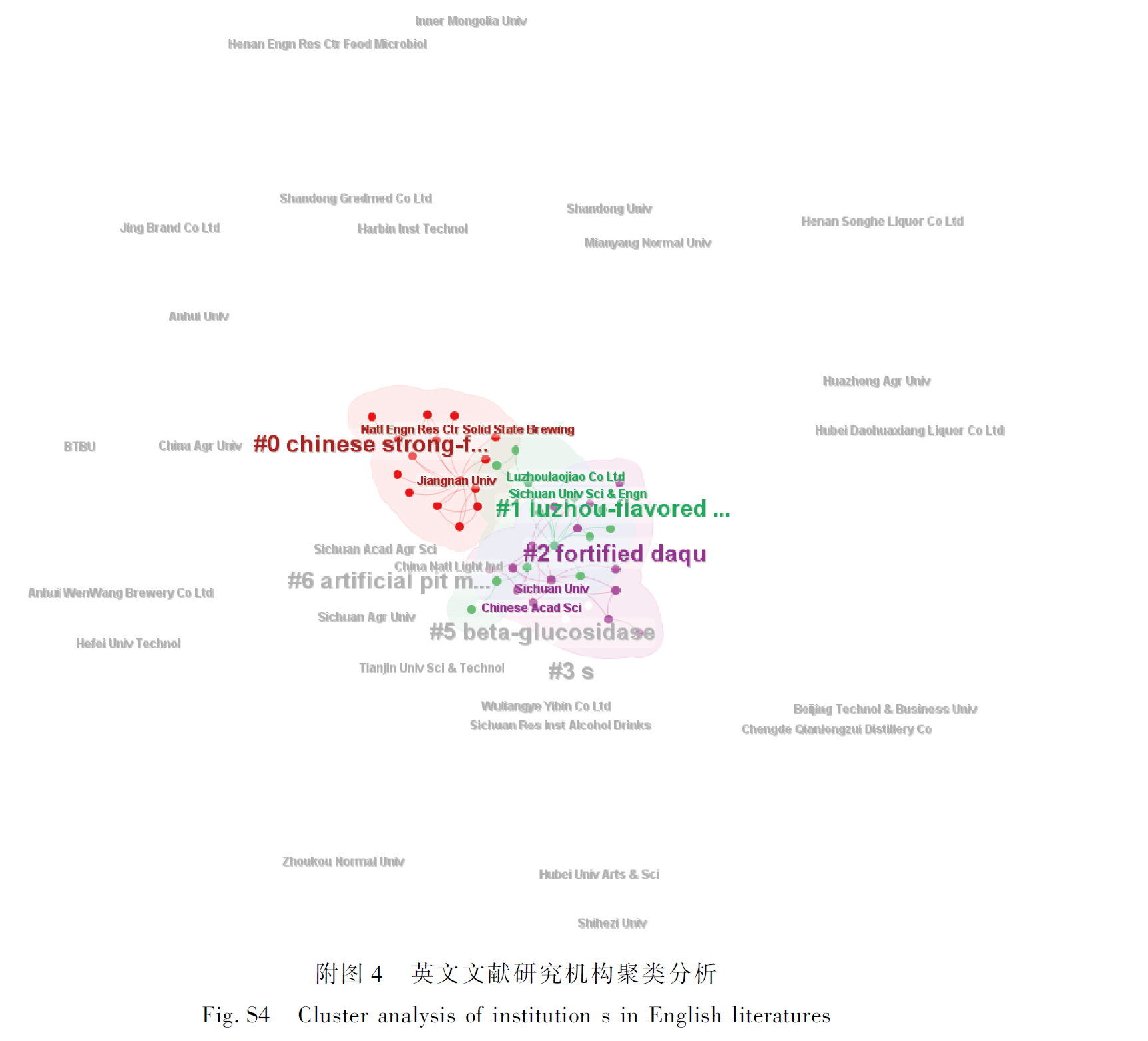
2.4 关键词聚类分析
关键词聚类分析旨在揭示本领域内研究人员主要探讨的焦点问题[6,11]。CiteSpace聚类分析结果显示,中文文献的模块化数据Q=0.564 3>0.3,S=0.859 7>0.5,网络密度为0.019 1;英文文献的Q=0.308 8>0.3,S=0.678 2>0.5,网络密度为0.025 2,表明关键词间联系紧密,聚类效果良好[15]。英文文献由于数量丰富,主题更加多元化,因此Q值、S值与单个关键词中心度都会有所下降[11]。如图2与表3所示,“乳酸菌(lactic acid bacteria)”“存活率(survival)”“海藻酸盐(alginate)”等关键词在中英文文献中出现频次都很高,占据主导地位,体现了益生菌微胶囊化研究中常用的菌种、壁材以及评估手段。英文文献中中心度最高的关键词为“嗜酸乳杆菌(Lactobacillus acidophilus)”,其次是“乳酸菌(lactic acid bacteria)”,这表明乳酸菌是研究中最常使用的一类益生菌。“喷雾干燥(spray drying)”说明喷雾干燥在过去20年中是研究最广泛的微胶囊化手段,而“模拟胃肠状况(simulated gastrointestinal condition)”是益生菌封装效果评价的必要步骤。英文文献的簇呈现更强的内聚性,说明相关研究可能更加全面,涉及更多表征技术与评价指标。
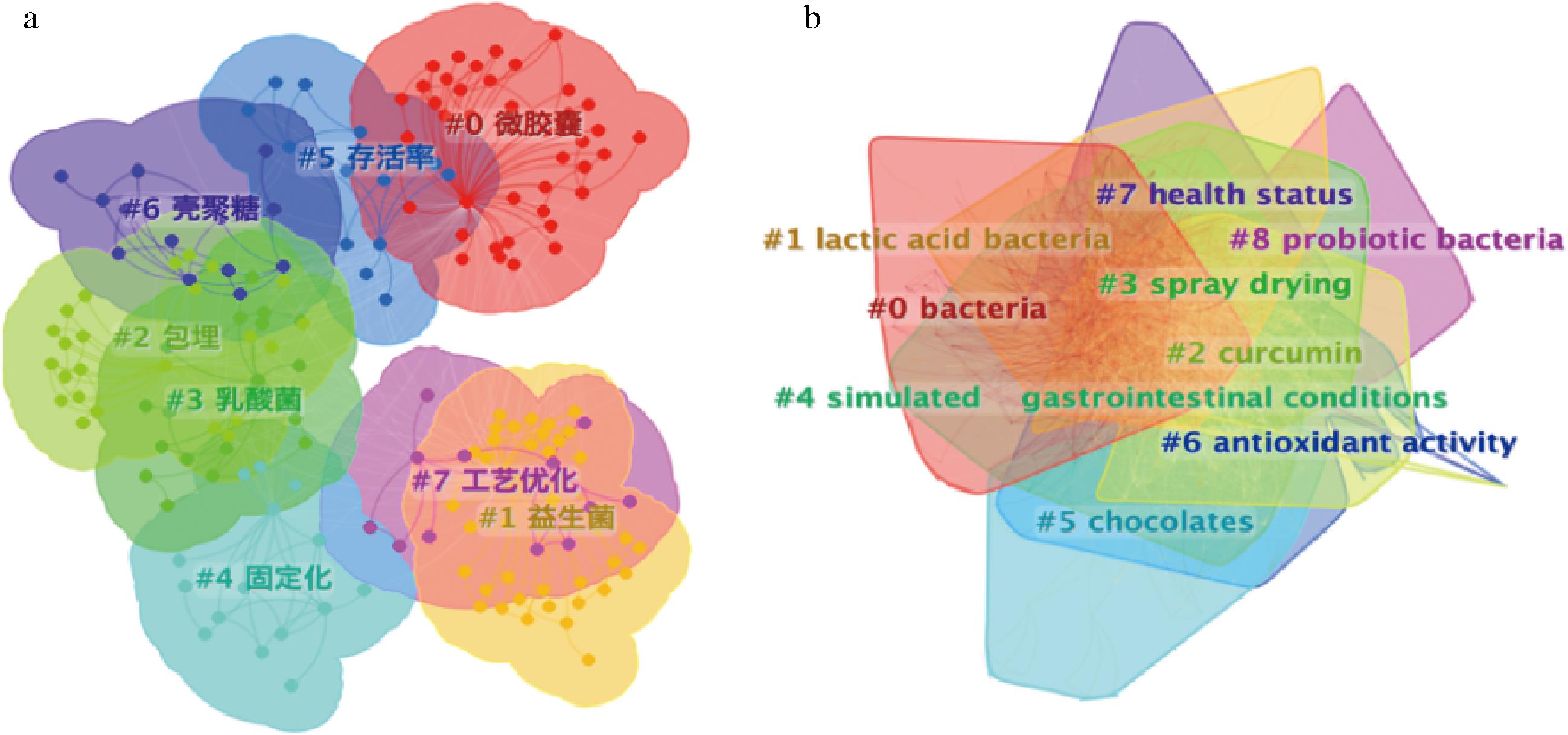
a-中文文献关键词;b-英文文献关键词
图2 益生菌微胶囊化中文及英文文献关键词聚类分析
Fig.2 Keyword cluster analysis of probiotic microencapsulation research in Chinese and English literature
表3 益生菌微胶囊化中英文文献10个主要关键词
Table 3 Top 10 main keywords of probiotic microencapsulation in Chinese and English literature
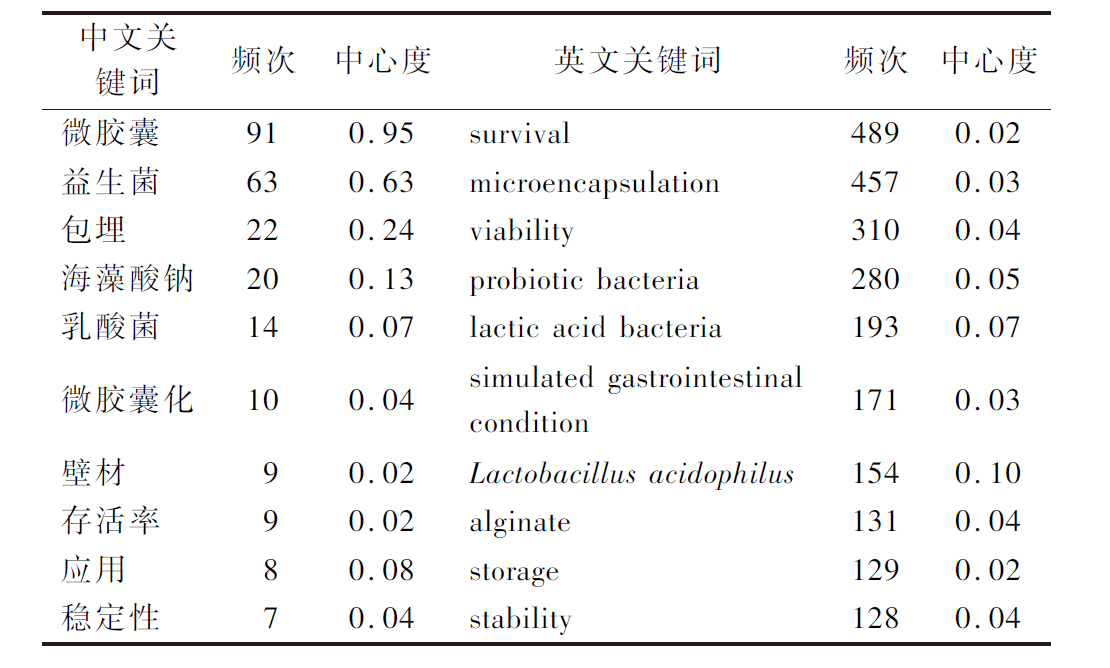
中文关键词频次中心度英文关键词频次中心度微胶囊910.95survival4890.02益生菌630.63microencapsulation4570.03包埋220.24viability3100.04海藻酸钠200.13probiotic bacteria2800.05乳酸菌140.07lactic acid bacteria1930.07微胶囊化100.04simulated gastrointesti-nal condition1710.03壁材90.02Lactobacillus acidoph-ilus1540.10存活率90.02alginate1310.04应用80.08storage1290.02稳定性70.04stability1280.04
2.4.1 菌种
益生菌以乳酸菌为主,包括双歧杆菌、肠球菌、链球菌等。此外,芽孢杆菌与酵母菌也属于益生菌的范畴[16]。它们的益生机制是竞争性排斥各类病原体,形成更健康的肠道环境,产生短链脂肪酸和细菌素等活性物质。不同益生菌菌种的益生功效各不相同,主要取决于自身的生理活性与代谢产物的属性。乳酸菌在相关研究中占据主导地位,在中文关键词聚类结果中排名第四(#A3乳酸菌),英文排名第二(#B1 乳酸菌lactic acid bacteria)。“嗜酸乳杆菌(lactobacillus acidophilus)”的频次达到154次,是最常使用的微胶囊化对象之一,其他如干酪乳杆菌和格氏乳杆菌等都是典型的乳酸菌,这是因为乳制品(牛奶、奶酪等)往往是最受消费者欢迎的益生菌产品形式[17]。乳酸菌还作为功能发酵剂赋予传统食品营养与药理价值,如韩国的泡菜、爱尔兰的切达干酪、泰式辣酱等。与传统发酵相比,微胶囊乳酸菌的发酵速度更快、细胞密度更高、使用周期长,还可以去除有毒的疏水物质[18]。除乳酸菌外,酵母菌等其他益生菌的封装策略亦有报道[2,19]。
2.4.2 壁材
壁材是影响益生菌微胶囊加工、储存与消化稳定性的关键因素。中文文献中以壳聚糖(#A6 壳聚糖)为代表的多糖在过去20年中是研究关注最多的壁材。壳聚糖是一种线性多糖,通过来源丰富的几丁质脱乙酰化制得,与纤维素和几丁质具有类似的化学结构,但作为包埋材料,一般不单独使用。例如,KIM等[20]研究了壳聚糖-植酸、壳聚糖-植酸-淀粉以及壳聚糖-植酸-CaCO3 3种壁材对嗜酸乳杆菌的保护作用,壳聚糖-植酸-CaCO3胶囊的负载容量最小但是抗酸能力最强,扫描电镜显示其微观结构最为致密。而壳聚糖-植酸-淀粉胶囊的外层起皱,呈现半透明状,储存稳定性较好。此外,壳聚糖还能够与羧甲基魔芋葡甘露聚糖作为罗伊氏乳杆菌保护剂,并形成稳定的W/O/W双乳液[21]。双乳化益生菌的活性一定程度提高,但在肠胃道中不太稳定,可能导致突然释放,控释效果较差。同时,海藻酸盐的浓度可以通过调节其与羧甲基魔芋葡甘露聚糖-壳聚糖之间的氢键影响水凝胶的溶胀行为,对释放调节起到一定效果。
藻酸盐也属于传统包埋材料,海藻酸钠在中文文献的主要关键词频次排名第4,“藻酸盐(alginate)”在英文文献中排名第8。藻酸盐也常与其他材料复合使用,纯藻酸盐甚至可能对益生菌产生负面影响,且几乎没有任何抗氧化活性。例如,在添加了一种果胶后,干酪乳杆菌对氧化损伤的抗性增强,胶囊表面的裂隙减少,持水能力增强,钙离子诱导产生的细胞活力损失减少[22]。董阳等[23]评估了内源乳化法封装乳酸菌的效果,发现当海藻酸钠质量分数为3%,CaCO3和海藻酸钠质量比为1.5∶9,水油质量比为30∶120时,包埋率最高可达86.3%。该研究进一步比较了只使用海藻酸钠与海藻酸钠-壳聚糖联用时的益生菌稳定性,复合胶囊的耐胃肠液的效果更好,但是释放速度较慢。此外,海藻酸钠对乳杆菌生产的乙醛脱氢酶同样具有突出保护效果,未经包埋的2种菌体中的乙醛脱氢酶在体外消化进行到30 min时就已完全失活,经过脱脂乳和海藻酸钠包埋后,消化180 min后酶活力保持率高达73.4%[24]。
其他多糖如果胶、麦芽糖糊精、黄原胶、明胶、k-角叉菜胶等均具备形成三维网络的能力[25]。明胶、黄原胶、卡拉胶等已经是成熟的工业原料,获取途径丰富,成本低廉。抗性淀粉的抗酶解性质优越,其本身含有多羟基基团,适合构建涂层材料。但抗性淀粉也会在一定程度上阻碍益生菌在肠道的释放与定殖,主要用于设计缓释体系[26-27]。抗性糊精除了具有封装能力,其本身就是一种益生元,有助于诱导形成对人体健康有利的肠道微生物群落[28]。研究报道,糊精通过抑制几种粪便酶(如β-葡萄糖醛酸酶和α-葡萄糖苷酶)活性,可有效降低结肠癌风险[26]。随着机械强度的提高,模拟胃液的扩散受到限制,益生菌细胞膜完整性提高。但是胆汁盐的扩散程度很难被这种结构较简单的微胶囊抑制,无论封装与否,处理过后的益生菌细胞膜完整性均在4%以下。这说明胆汁盐造成的细胞损伤往往比酸胁迫更严重,需要寻找并发展新的壁材。
2.4.3 微胶囊技术
微胶囊技术借助具有一定生物相容性的材料,通过构造物理屏障显著提升益生菌对环境胁迫的抵抗能力。中文文献中的相关关键词是固定化 (#A4 固定化)与工艺优化(#A7工艺优化),说明微胶囊技术是重要的研究内容,但这两个簇标签没有提供更多的信息。由图3-b中聚类结果可知,喷雾干燥(#B3 喷雾干燥)的影响力很强,它与凝聚技术的成本是最低廉的。喷雾干燥技术首先雾化物料,然后通过短时间脱水达到干燥的目的。喷雾干燥得到的微胶囊粒度很小,质地相对均匀,但是高温气流会造成益生菌活力损失,对壁材的要求比较严苛[17]。冷冻干燥的封装效率和细胞存活率通常高于喷雾干燥,但是生产效率较低且成本昂贵[29]。值得一提的是,新开发的喷雾冷冻干燥技术是将雾滴与-70 ℃的逆流气体瞬间接触,能最大程度保留益生菌活性。无论是与传统的喷雾干燥还是冷冻干燥相比,喷雾冷冻干燥后益生菌活力都要更高[30-31]。但是,在喷雾干燥时,有机酸会增强粉末的黏性从而降低干燥效率,需要尽可能去除[32]。果汁中的酚酸和内酯也会造成益生菌活力丧失,蔓越莓汁对乳杆菌和双歧杆菌的伤害要大于橙汁与菠萝汁[33]。
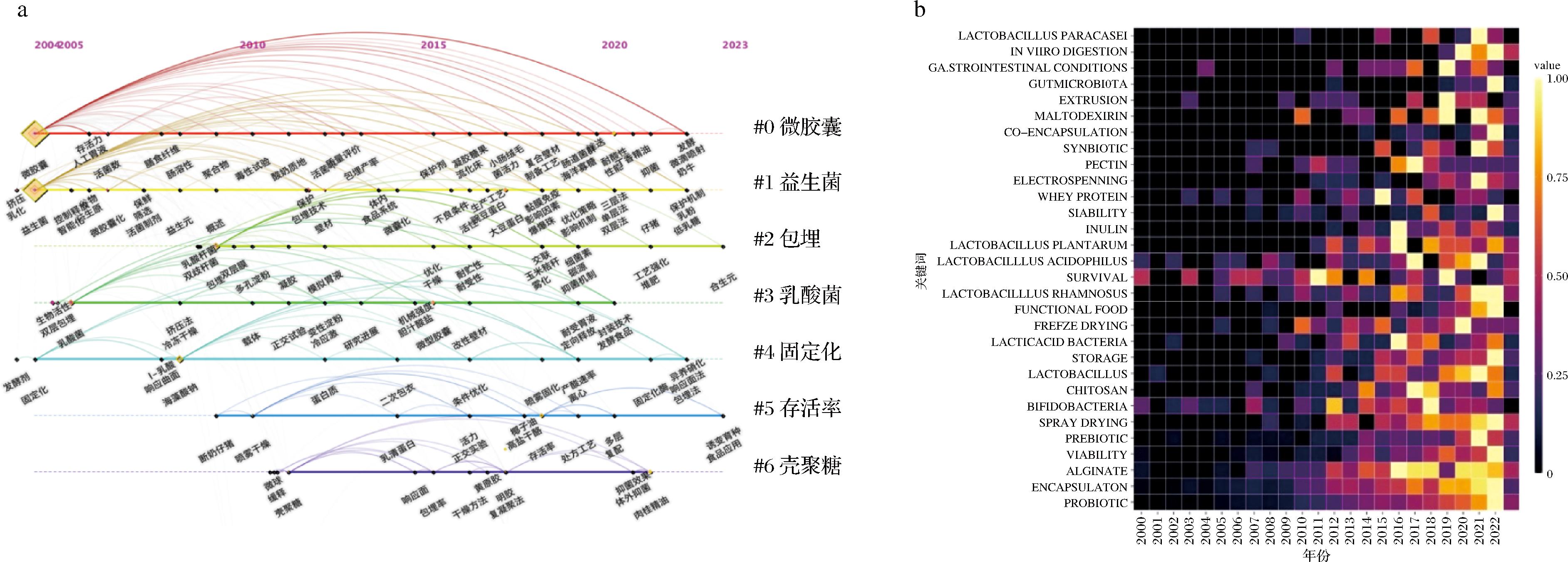
a-CNKI数据库关键词时间线图;b-WOS数据库关键词热力图
图3 CNKI数据库关键词时间线图与WOS数据库关键词热力图
Fig.3 Keyword timeline diagram of CNKI database and keyword heat map of WOS database
其他微胶囊化技术包括离心挤压、静电纺丝/电喷雾、冲击气溶胶、流化床包衣等,早期较多配合保护剂使用冷冻干燥技术[16]。冷冻干燥利用了升华,分为冷冻、初级干燥和二级干燥3个阶段,但是自由水可能会形成损害细胞的冰晶[34]。静电纺丝与电喷雾主要区别是溶液黏度,静电纺丝的聚合物溶液黏度较高,在封装药物和各类营养活性物质上已有进展。MA等[35]利用静电纺丝技术将4种乳杆菌包裹在阿拉伯树胶-支链淀粉形成的纳米纤维中,并借助普鲁兰多糖提供可纺性,益生菌存活率显著高于冷冻干燥。借助扫描电子显微镜分析,发现随着阿拉伯树胶比例的提高,纳米纤维的直径不断减小,但是超过60%后可能出现纺锤状的缺陷。喷雾气溶胶技术的优势在于生产的胶囊直径较小,平均尺寸为30~50 μm[36]。
2.4.4 存活率与理化性质
存活率(#A5存活率)的评估贯穿整个生产-加工-消费过程,是胶囊化效果最重要的指标之一。简单的微胶囊益生菌活性评估只需将胶囊分散在蛋白胨溶液中,均质化后进行平板涂布,培养一段时间进行活菌计数[37]。这种评价方式简单快速,可以作为商业化用途,但是准确性有待商榷。根据SUN等[38]的研究,使用聚多巴胺封装的细菌生长曲线表现出滞后性,这可能导致计算得到的活菌浓度较实际值偏低。用高速离心机破碎胶囊壁后涂布则可能导致部分益生菌受到机械破坏而失去活性,同样可能导致测定结果偏低。因此,存活率的评估方式应当是效率、成本以及应用场景等因素的折衷。其他理化性质的测定可以指导益生菌微胶囊产品的生产过程。环境抗性用抗热性、抗酸性以及抗机械剪切等参数体现,包封的完整程度可以使用扫描电子显微镜(scanning electron microscope,SEM)或激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)表征,静态光散射分析和粒度分析用来测定颗粒大小。对于添加在乳制品中的益生菌微胶囊,乳化行为与微观流变学测试也是必要的,可能还需要额外的巴氏消毒稳定性与絮凝聚结度评估[39]。
2.4.5 模拟消化
益生菌的脆弱性大大降低了它们在胃肠道转运过程中的活性。英文文献的关键簇#B4 模拟胃肠状况(simulated gastrointestinal condition)和#B7健康状态(health status)都说明了需要体外或体内实验对控释能力与益生效果进行检验,但是在中文文献中相关研究较少,未能出现相关簇。封装完成的微胶囊,针对性构建人体肠胃道(gastrointestinal tract,GIT)模型探究保护效果与释放速率,对于不必要的消化液可以适当简化。除了体外肠胃消化外,还可以使用志愿者的粪便补充结肠发酵实验,体外发酵用于确定包封的益生菌是否更易形成优势种[40]。体内实验多采用小鼠作为模型,相较体外实验更具说服力。如果该材料对小鼠健康有害,可能出现体重减轻、疾病活动指数增加、结肠长度缩短与粪便异常。益生菌在肠道中的靶向作用与驻留能力比较能借助光声成像实现,肠道组织切片或肠道外翻实验分析黏膜、绒毛完整性以及是否出现病变[41]。最后,依据生化和血液学进行系统的毒理学评价是特定材料-菌种应用到食品生产中的必需环节。
2.5 关键词演化
图3-a显示,多孔淀粉、变性淀粉与乳清蛋白等材料在2010年左右开始应用,而豌豆蛋白、大豆蛋白、海洋寡糖和丁香精油等出现较晚。“人工胃液”、“模拟胃液”、“胆汁酸盐”等消化模拟材料几乎贯穿了整个时间轴,突出体外消化实验的重要性。“断奶仔猪”首次出现在2009年左右,说明益生菌微胶囊有助于改善动物饲料品质[42]。微胶囊化益生菌在“凝胶糖果”、“爆爆珠”、“高盐干酪”等食品中的添加集中在2015年之后,“合生元”首次出现在2023年,符合国际研究趋势[43]。图3-b为WOS数据库中的学术产出增长情况,可以看出“双歧杆菌(bifidobacteria)”和“存活率(survival)”在过去20年内一直是相关研究的重要内容。“藻酸盐(alginate)”近2年热度开始消退,“果胶(pectin)”“菊粉(inulin)”和“壳聚糖(chitosan)”在2016~2017年得到的关注度最高,说明研究者在持续探索新型材料与组合。“储存(storage)”的研究逐年递增,或将成为未来研究热点。“喷雾干燥(spray drying)”的热度在2020—2021年完成了对“冷冻干燥(freeze-drying)”的超越,并持续增长。2023年的数据不完整,因此不具备参考意义。
3 展望与热点预测
本研究全面分析了益生菌微胶囊化领域内的研究现状、研究方向与热点,同时也应当说明一些局限性,因为CiteSpace、VOSviewer、bibliometrix等软件只能进行单语言分析,本文只建立了中英文文献池,没有收录其他语言撰写的高质量论文,可能导致研究结论存在轻微的偏差。为了更清晰地展示最新突现的研究内容、紧抓研究热点,本文整理了代表益生菌微胶囊化研究领域新兴趋势的15个关键词(表4),结合上文的可视化分析,提出对益生菌微胶囊化未来研究的建议与展望。
表4 代表益生菌微胶囊化研究领域新兴趋势的15个关键词
Table 4 Top 15 keywords representing emerging trends in probiotic microencapsulation research
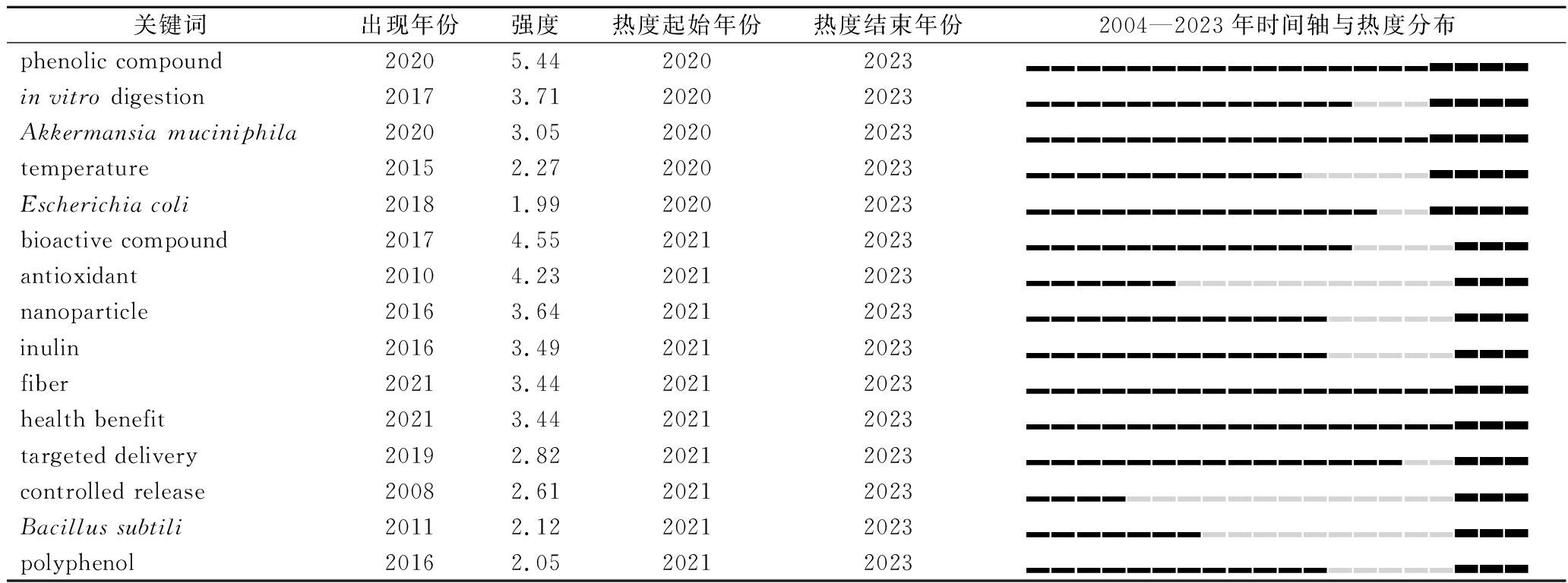
关键词出现年份强度热度起始年份热度结束年份2004—2023年时间轴与热度分布phenolic compound20205.4420202023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃▃in vitro digestion20173.7120202023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃▃Akkermansia muciniphila20203.0520202023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃▃temperature20152.2720202023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃▃Escherichia coli20181.9920202023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃▃bioactive compound20174.5520212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃antioxidant20104.2320212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃nanoparticle20163.6420212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃inulin20163.4920212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃fiber20213.4420212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃health benefit20213.4420212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃targeted delivery20192.8220212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃controlled release20082.6120212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃Bacillus subtili20112.1220212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃polyphenol20162.0520212023▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▂▃▃▃
注:强度与施引文献中该关键词出现的频次相关,是其突现性的映射[44]。深蓝色段表示关键词出现的时间段,红色段表示热度持续时间段。
众多研究证明了益生菌对人体健康的益处,包括调节肠道菌群组成、修复上皮组织、增强免疫力、治疗炎症性肠病、降低胆固醇和血脂,甚至抑制肿瘤和癌症[45]。如何选择合理的益生菌-壁材组合一直是益生菌微胶囊化领域的重要议题,根据图3-b,植物乳杆菌、嗜酸乳酸杆菌、鼠李糖乳杆菌等是过去使用最多的菌种。而嗜黏蛋白阿克曼氏菌(A. muciniphila, 强度3.05)、大肠杆菌(E. coli, 强度1.99)和枯草芽孢杆菌(B. subtili, 强度2.12)在2020—2021年间获得大量关注并持续至今(表4)。尽管大部分大肠杆菌都是有害菌,但其中的大肠杆菌Nissle1917(EcN)是热度最高的益生菌之一,在临床上治疗炎症性胃肠功能障碍,同时具有肿瘤靶向作用[46]。将枯草芽孢杆菌和乳酸菌共培养或者封装,枯草芽孢杆菌产生的过氧化氢酶、枯草杆菌蛋白酶和ε-聚谷氨酸可以促进乳酸菌的生长活力,提高冷冻干燥过程中的存活率[47]。
我国法规规定不提倡以液态形式生产益生菌类保健食品活菌产品。因此,益生菌的微胶囊制备是益生菌加工产业的核心,而壁材的更新有助于更高效的产品生产与储存、更优越的消化稳定性质以及更强的肠道定殖能力。早期的封装材料多为藻酸盐、壳聚糖、淀粉、蛋白质等,以乳清蛋白、大豆分离蛋白为代表的蛋白质常用于与多糖形成多尺度复合物(图4)。随着新材料的开发,菊粉(inulin, 强度3.49)的参与度提高。关键词中近年出现的酚类化合物(phenolic compound, 强度5.44)和多酚(polyphenol, 强度2.05)强度最高,是实现纳米封装的优越材料,可以为细胞提供前所未有的特性,抵抗高温与紫外线的伤害,生物相容性比壳聚糖更好[19,48]。利用这项技术制作的人工孢子能有效延长益生菌储存寿命,在生产加工与运输时,诱导产生的生物防御机制使其在压力环境中处于休眠状态。而当环境变得温和之后,细胞活力又会重新恢复。多酚材料的生物相容性好,可以直接与细胞接触,通常有2种形成机制(图4,改编自文献[49])。一种是邻苯二酚在氢键、疏水作用力等的作用下自发聚合形成薄膜,另一种则需要邻苯三酚通过三价金属离子配位聚合。多酚封装的菌体往往更加稳定,如茶多酚涂层会使天然酵母在指数增长之前表现约4 h的延滞期[19]。鉴于生物聚合物网络的孔径一般较大,氢离子与少部分消化酶仍能通过自由扩散通过壁材。采用逐层策略(layer-by-layer, LbL)包封的益生菌抵抗酸性环境与胆汁盐的能力更强,通过口服强饲法和生物发光实验可以定位肠道内的益生菌,进一步调整壁材组成与结构还可实现定点释放[2]。此外,酶作为一种具有高度催化效能的生物大分子,参与制备的微胶囊更具可设计性。人工酶武装的双歧杆菌能够缓解肠道炎症,保护结肠上皮细胞免受病理损伤并降低促炎因子与活性氧水平。在肠炎小鼠体内,香农熵减少,表明生物多样性减少。厚壁菌门的相对丰度增加,它们与炎症状态呈负相关,说明微生物群失调得到改善[41]。
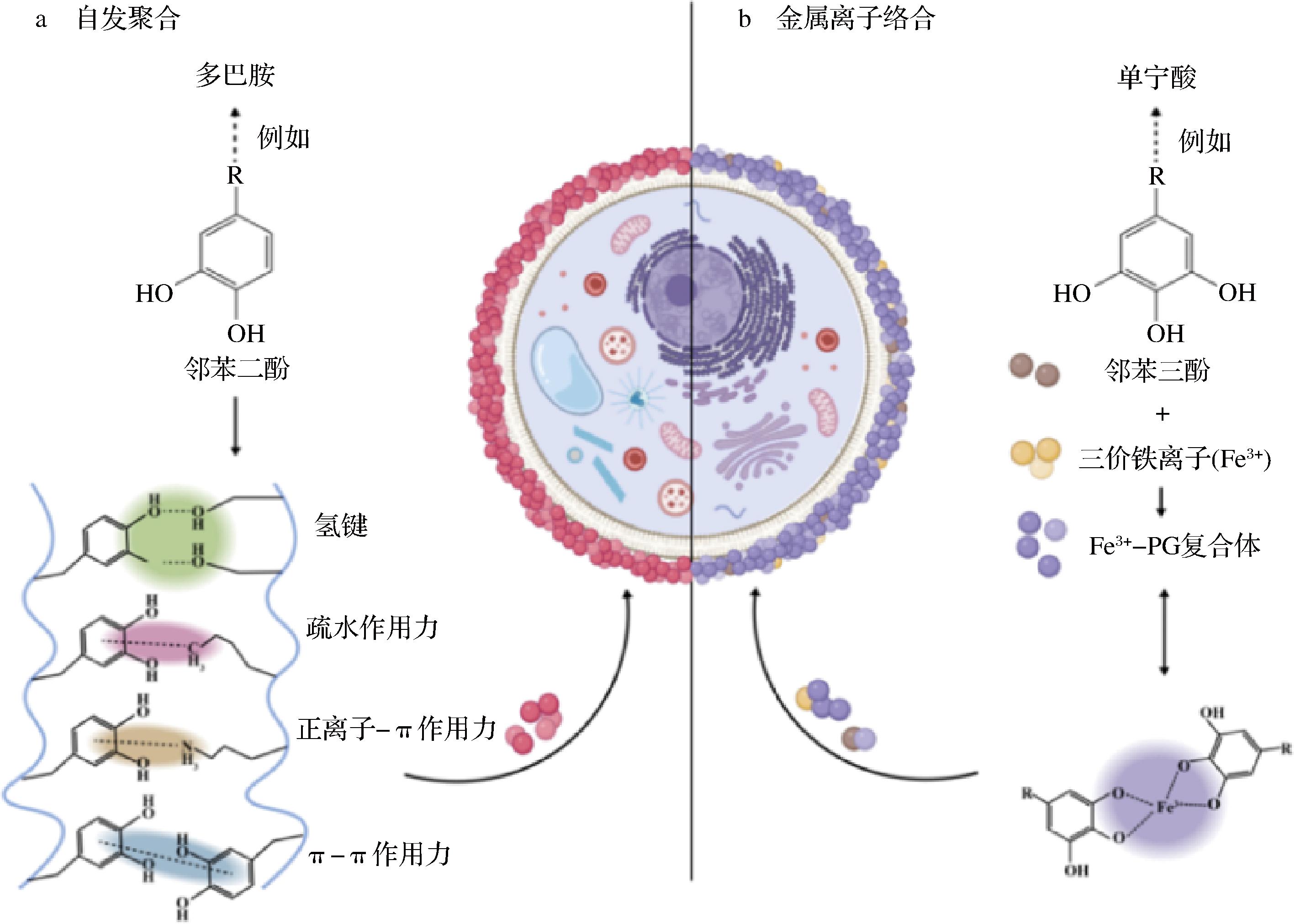
图4 两种不同的多酚网络形成机制[49]
Fig.4 Two different mechanisms of polyphenol network formation
除壁材外,微胶囊造粒的微观尺度也是重要的考量因素,尽可能实现纳米级封装或单细胞封装会显著提升微胶囊的功能性质。早期凝胶珠的粒度在微米级或者毫米级,通过二价阳离子溶液在水凝胶中的简单注射制备得到。而益生菌的直径一般为0.5~5 μm,每个单元内包含大量益生菌,效果不佳。现多采用的纳米胶囊化手段又可以分为纳米纤维、纳米颗粒(nanoparticle, 强度3.64)与纳米乳液,前者固定化效果较好,适应电流体动力学加工技术[50]。蛋白质与脂质的另一个重要特性就是可以发生乳化,与其他材料复配后可以采用微流控乳化技术,包封率高,胶囊尺寸更小,脂质还具有阻断H+的潜力[51-52]。SILVA等[53]将植物脂肪作为壁材,在9%的NaCl溶液或25%(均为质量分数)的蔗糖溶液中有效地保护益生菌,扩展在糖基食品和高盐食品中的应用场景。将益生菌与茶蛋白-黄原胶皮克林乳液混合之后再进行3D打印,打印前后细胞活力几乎不受影响,为益生菌产品的生产提供了新思路[54]。在封装策略上,温度(temperature, 强度2.27)逐渐成为重要的考量因素。此外,还要尽可能形成单包封结构,通过增加表面积/面积比提高生物利用度和肠道黏附能力[5]。
传统的微胶囊化技术通常不会形成多层结构,无法应对消化道复杂的物理化学环境或提供良好的肠道黏附能力,终产品可能在同类产品中竞争力不强。逐层组装技术可设计的空间大,厚度可以控制在纳米级,需要保留材料上的表面电荷,在反复交替沉积带有相反电荷的聚电解质形成功能薄膜,可以实现控制释放(controlled release, 强度2.61)和定点递送(targeted delivery, 强度2.82)[55]。将壳聚糖作为阳离子聚合物与不同分子质量的普朗尼克(聚丙二醇与环氧乙烷的加聚物)合成聚电解质逐层包装德氏乳杆菌,胶囊足以保护益生菌免受肠道疾病的影响,噬菌体、细菌素或潜在的有害酶被阻断,但单糖、双糖、氨基酸与小分子肽渗透性良好,表明包被益生菌在释放之前的正常生理活动仍能维持[3]。MOKHTARI等[56]同样采用逐层封装策略,在两层藻酸盐层中夹入一层酿酒酵母细胞壁,弥补了藻酸盐抗酸差的缺点。尽管这种封装方式对嗜酸乳杆菌是高效的,但由于双歧杆菌对低pH环境抵抗力很差,无论是藻酸盐层还是酵母细胞壁都没有展现明显的保护作用。可能需要发展具有生物活性的胶囊,抑制H+的自由扩散。
4 结论
肠道菌群的重要性被持续揭示,如何保护益生菌到达肠道并顺利定殖引发广泛关注。本文利用多款文献计量软件绘制了过去20年内益生菌微胶囊化领域内的科学知识图谱,为把控热点研究趋势提供重要参考。从关键词的分析结果看,微胶囊壁材正在逐步从藻酸盐、壳多糖等向其他材料转移,喷雾干燥技术也得到更多关注。本文还重点综述了最受关注的菌种、封装材料与技术以及封装效果的评价方式,并提出新的见解与研究展望。随着研究不断深入,益生菌微胶囊化技术还将与新兴技术结合,如CRISPR/Cas9等基因编辑技术用来控制益生菌细胞膜的特异性表达,与3D打印技术的联合要求微胶囊混入水凝胶后具有良好的流变学表现。综上所述,预测未来研究会主要集中在两个大类:一是新型微胶囊壁材的开发与理化性质分析;二是创新微胶囊化技术与体内体外评价体系。益生菌微胶囊化技术已俨然成为益生菌研究的一大热点,将持续助力大健康产业的蓬勃发展。
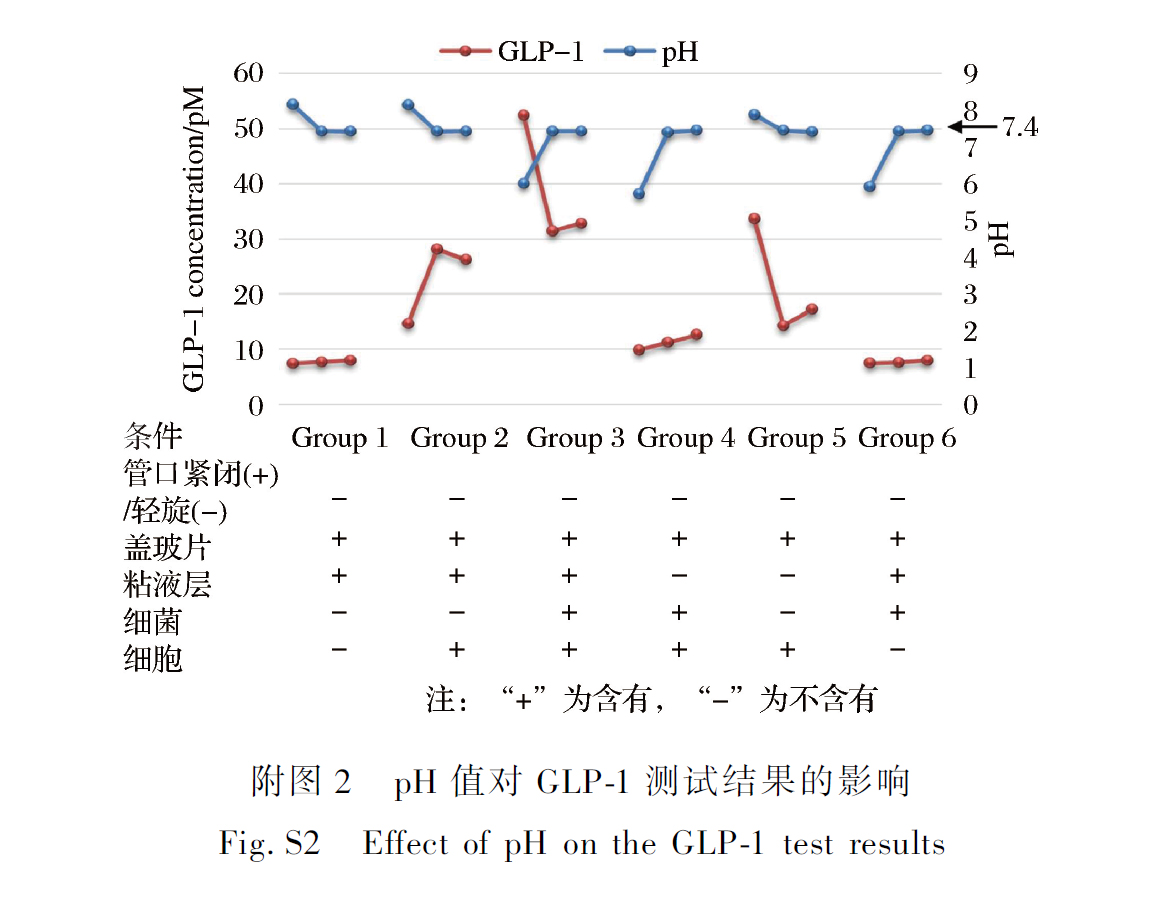

体系最上层为细胞生长所必须的DMEM 培养基,而后是附着有细胞的盖玻片,最下层为含有乳杆菌的MRS 琼脂培养基,粘液层位于MRS 培养基与盖玻片中间。
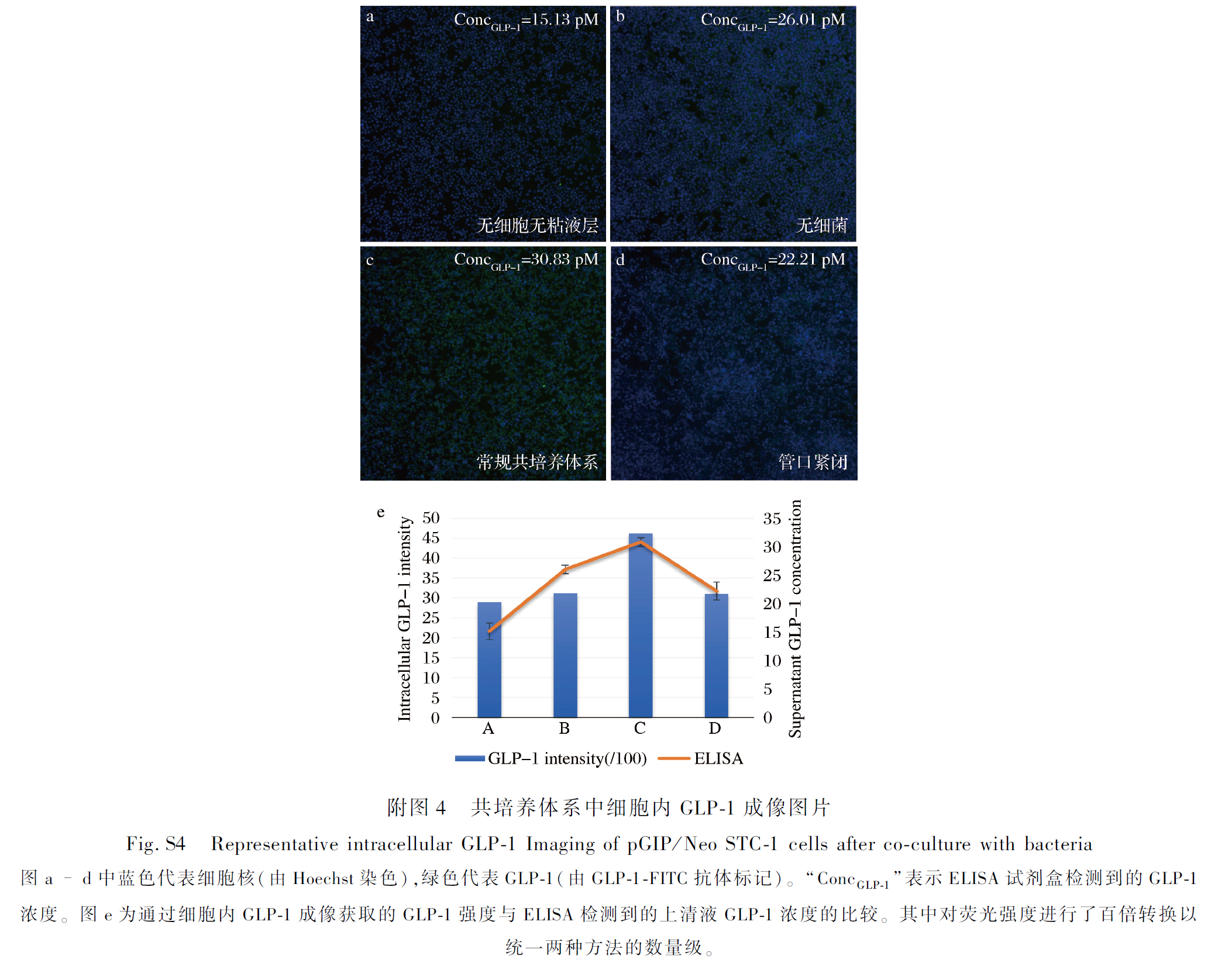


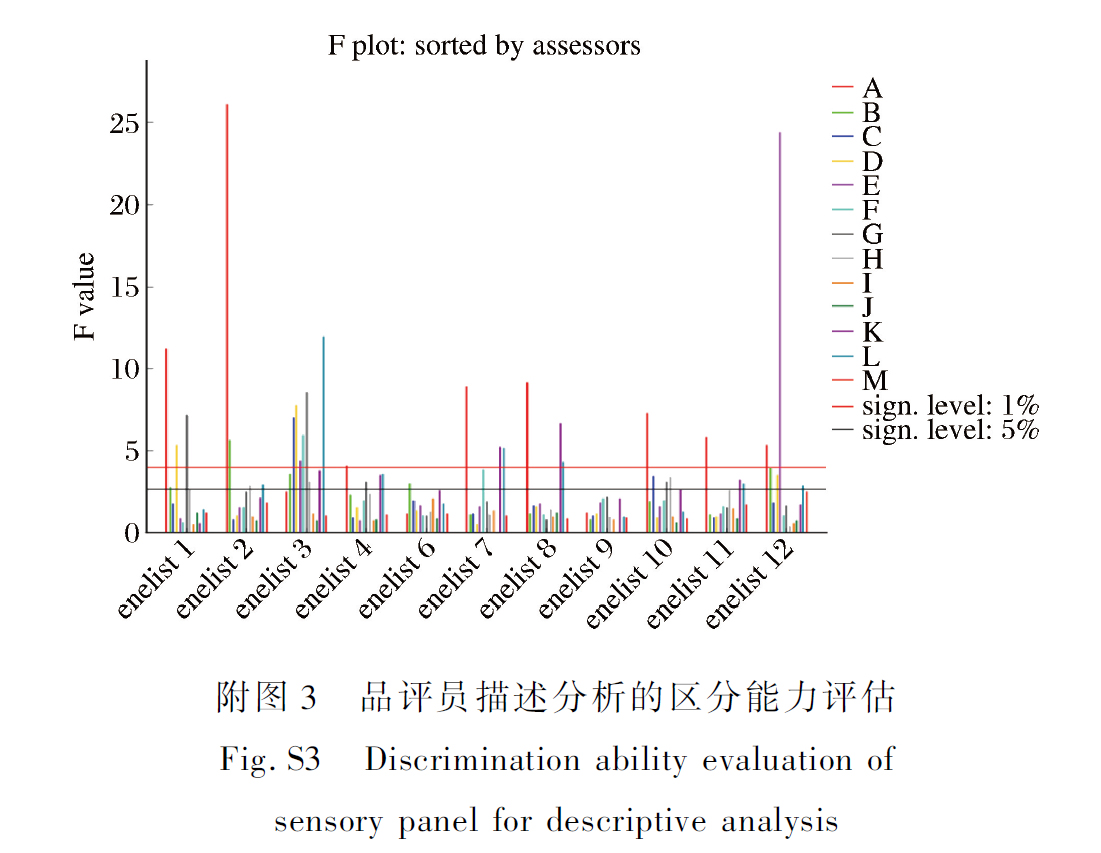
响应面试验结果及分析
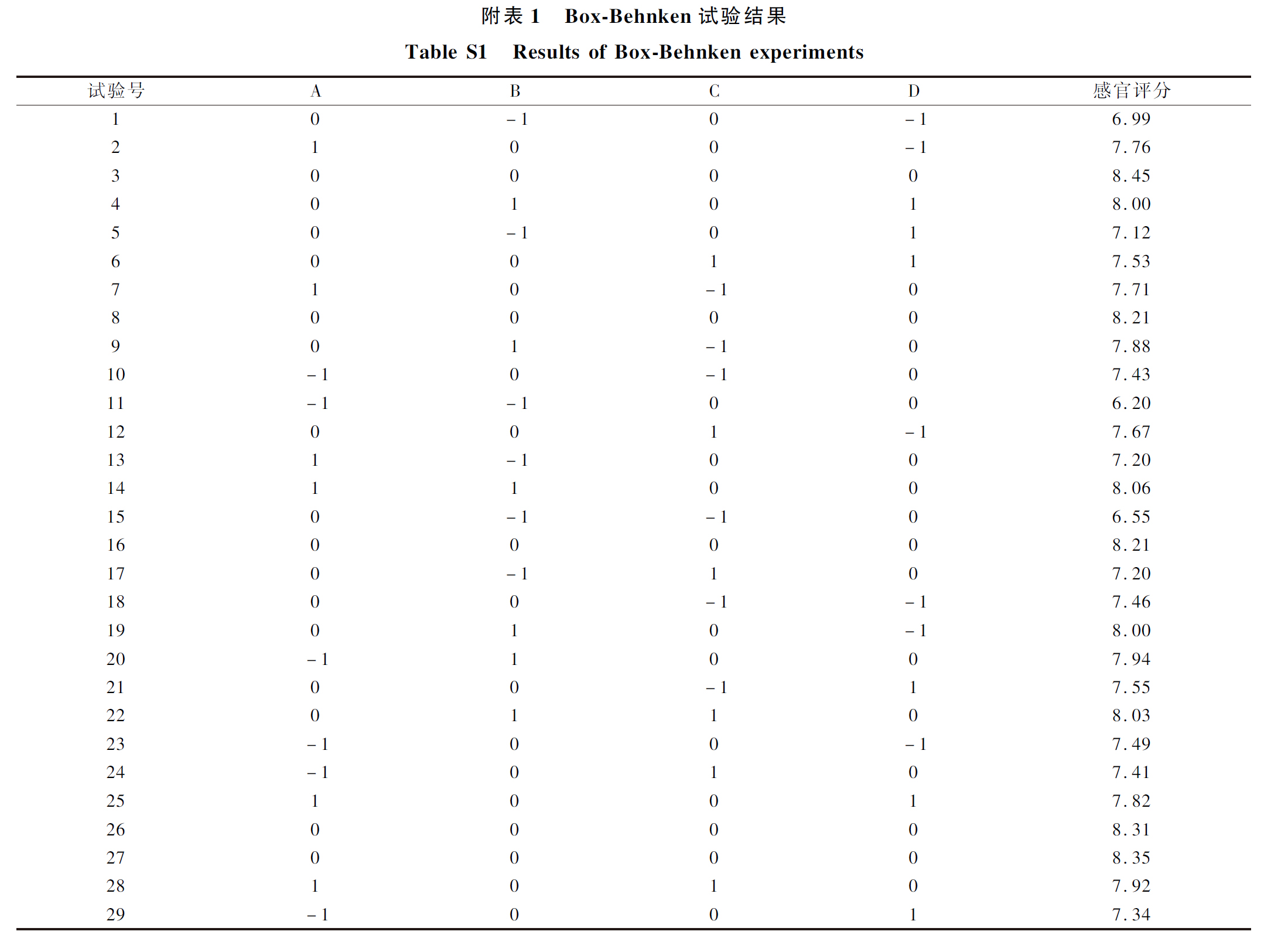
(A)、混菌添加量(B)、食盐添加量(C)、发酵时间(D)的较优水平,以模糊综合感官评分为响应值进行Box-Behnken 响应面优化试验,试验结果如附表1所示。
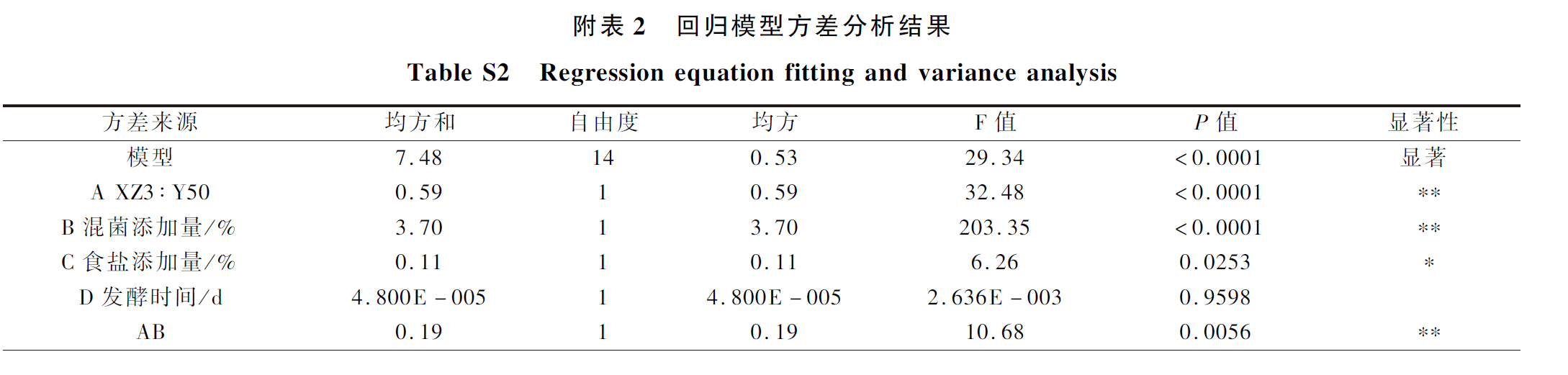
利用软件Design-Expert8.0.6 得到二次多项回归方程为:
Y=8.31+0.22A+0.56B+0.098C-2×10-3D-0.22AB+0.058AC+0.051AD-0.21BC-0.032BD -0.058CD-0.35A2-0.52B2-0.37C2-0.32D2
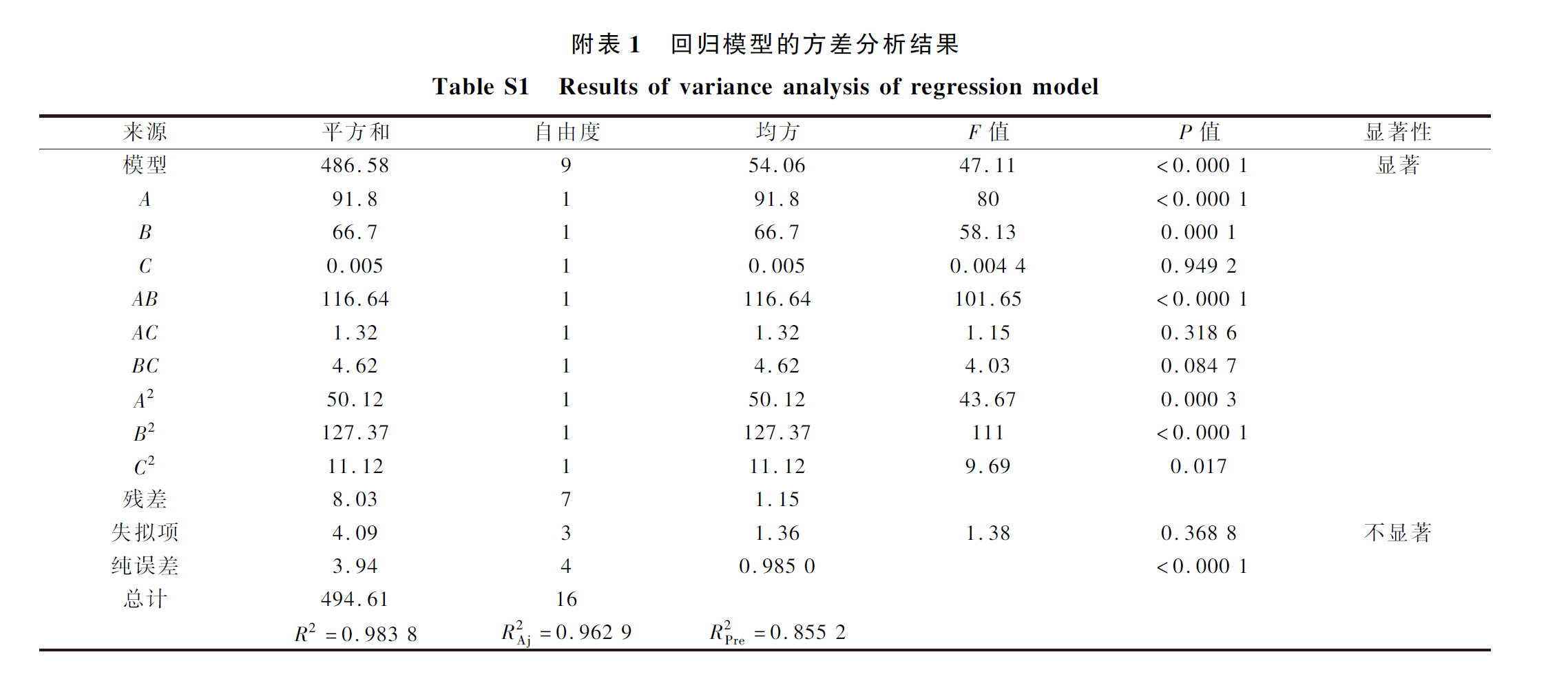
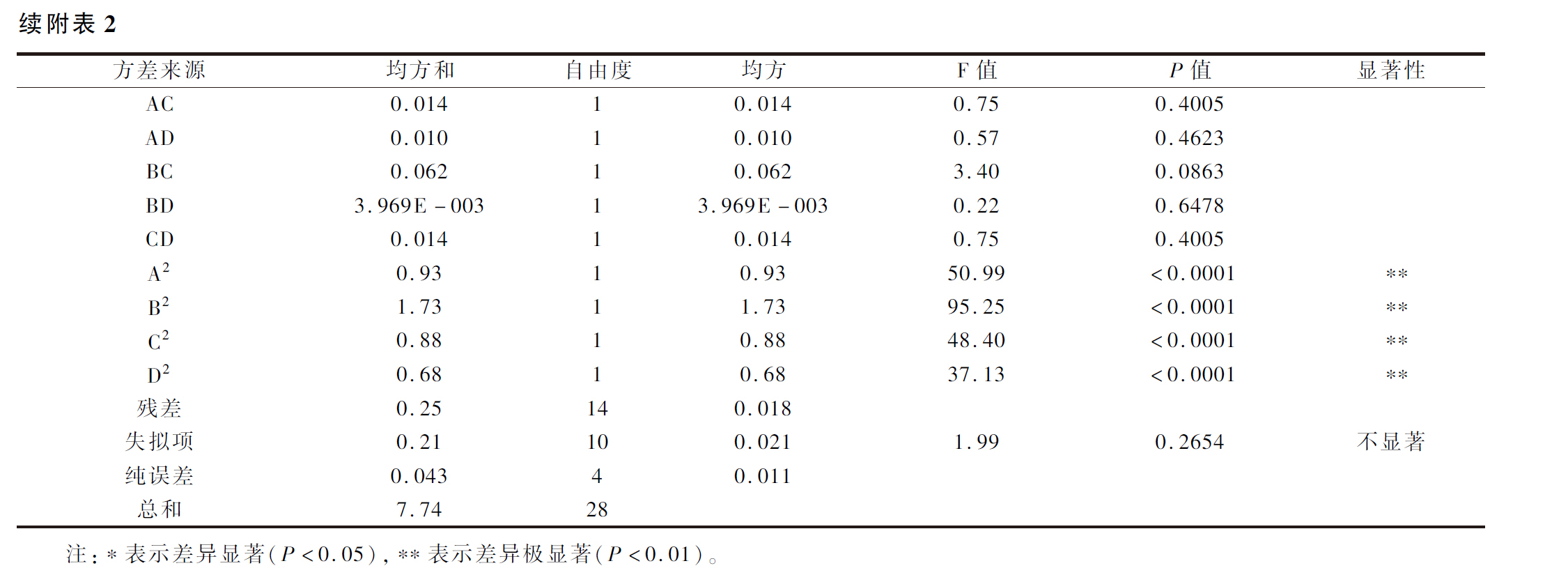
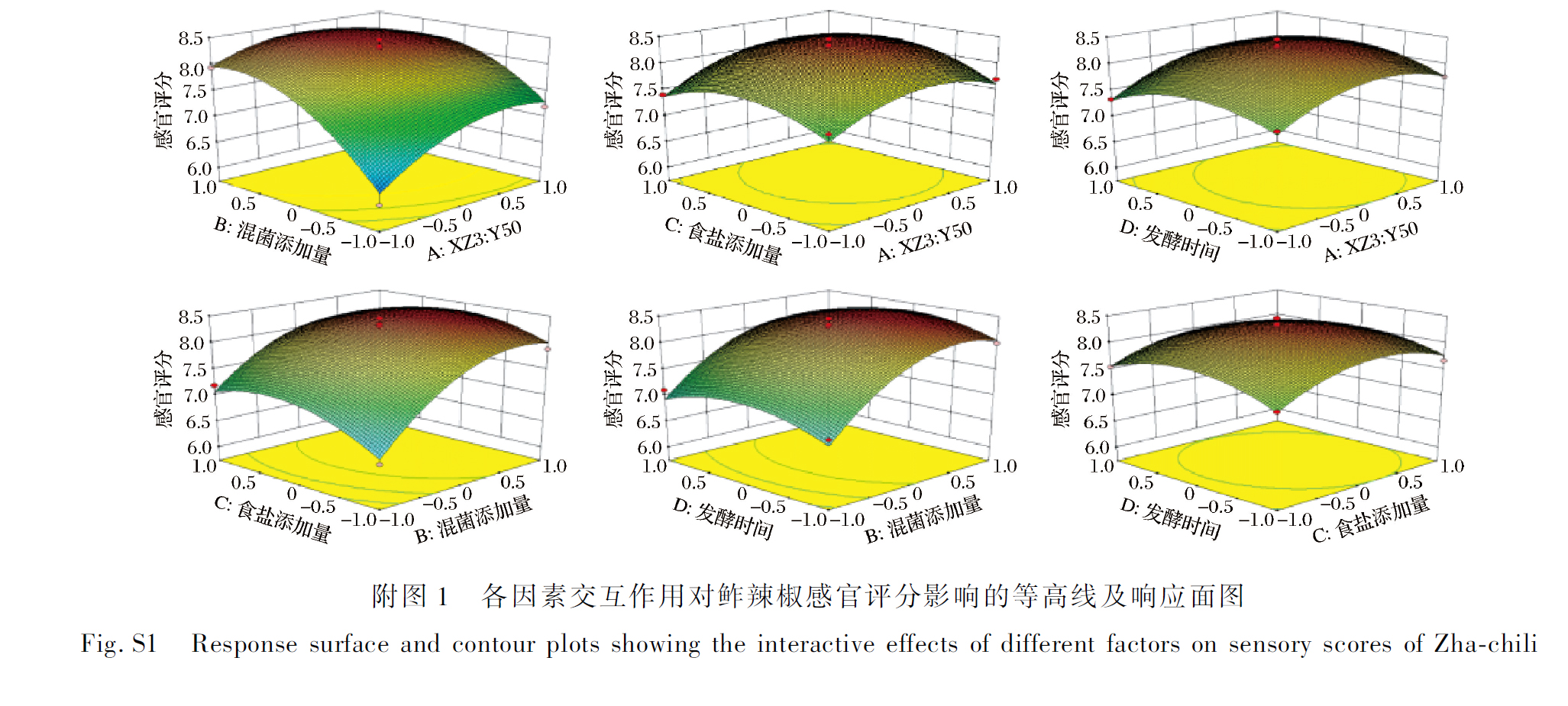
如附表2所示,回归模型效果显著(P<0.01),失拟项不显著(P>0.05),并且该模型能解释96.7%(R2=0.9670)响应值的变化。该模型校正系数(RAdj2=0.9341)接近于1,线性相关程度密切。这些参数表明此回归模型效果较好。从附表2还可知XZ3与Y50的添加比例(A)、混菌添加量(B)、AB、A2、B2、C2、D2对模糊综合感官评分影响极显著(P<0.01),且各因素对鲊辣椒感官评分影响作用的大小顺序为混菌添加量(B)>XZ3∶Y50(A)>食盐添加量(C)>发酵时间(D),说明混菌添加量和XZ3与Y50的比例对鲊辣椒发酵品质影响较大。
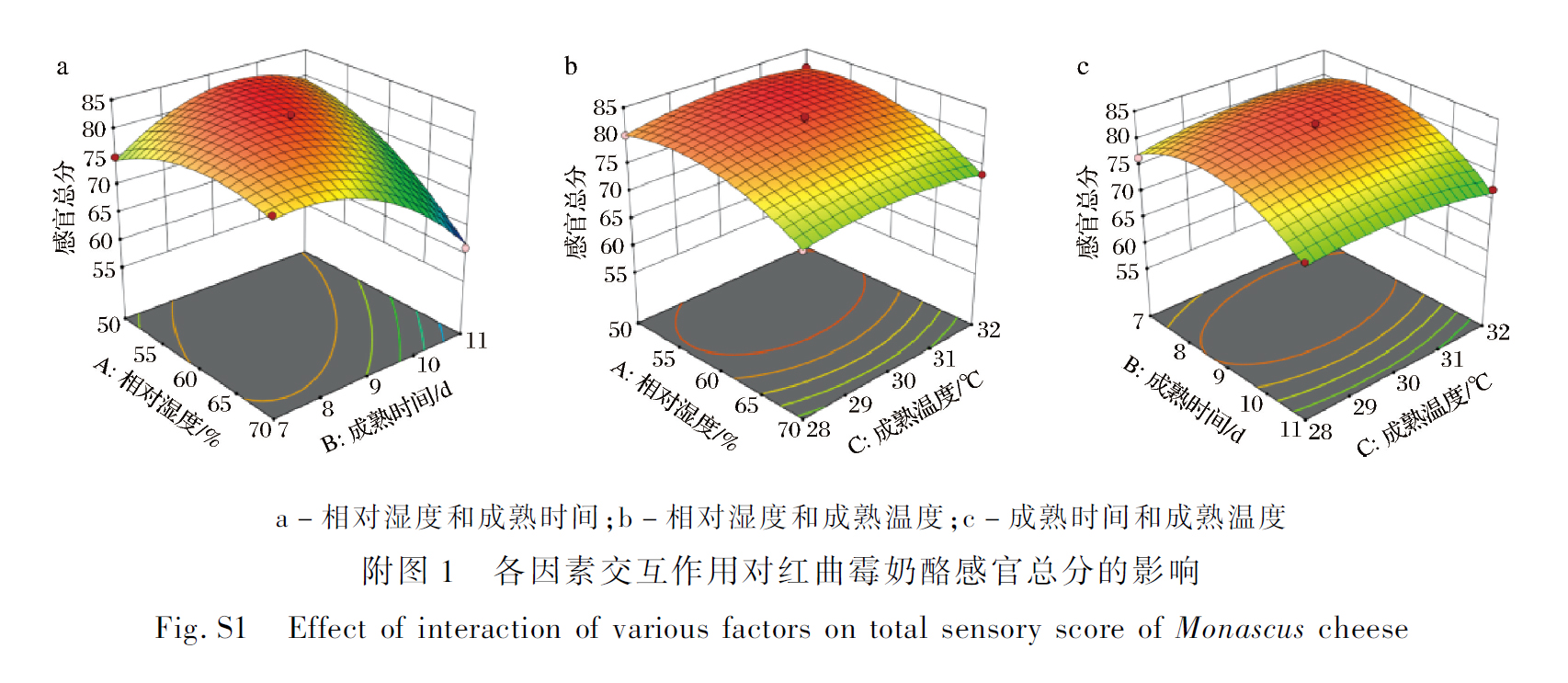
各因素交互项的响应面及等高线,如附图1 所示。曲面图越陡表示交互作用越强,反之,则交互作用越弱。可见XZ3 与Y50 的比例(A)和混菌添加量(B)之间的交互作用强于其他因素的交互作用。





[1] BURGAIN J, GAIANI C, LINDER M, et al.Encapsulation of probiotic living cells:From laboratory scale to industrial applications[J].Journal of Food Engineering, 2011, 104(4):467-483.
[2] ANSELMO A C, MCHUGH K J, WEBSTER J, et al.Layer-by-layer encapsulation of probiotics for delivery to the microbiome[J].Advanced Materials, 2016, 28(43):9486-9490.
[3] QUINTANA G, SIM ES M G, HUGO A, et al.Layer-by-layer encapsulation of Lactobacillus delbrueckii subsp.bulgaricus using block-copolymers of poly(acrylic acid) and pluronic for safe release in gastro-intestinal conditions[J].Journal of Functional Foods, 2017, 35:408-417.
ES M G, HUGO A, et al.Layer-by-layer encapsulation of Lactobacillus delbrueckii subsp.bulgaricus using block-copolymers of poly(acrylic acid) and pluronic for safe release in gastro-intestinal conditions[J].Journal of Functional Foods, 2017, 35:408-417.
[4] ASSADPOUR E, JAFARI S M.A systematic review on nanoencapsulation of food bioactive ingredients and nutraceuticals by various nanocarriers[J].Critical Reviews in Food Science and Nutrition, 2019, 59(19):3129-3151.
[5] CASSANI L, GOMEZ-ZAVAGLIA A, SIMAL-GANDARA J.Technological strategies ensuring the safe arrival of beneficial microorganisms to the gut:From food processing and storage to their passage through the gastrointestinal tract[J].Food Research International, 2020, 129:108852.
[6] 周钰, 刘庆梅, 张军, 等.基于CiteSpace对抗食物过敏研究领域的可视化分析[J].中国食品学报, 2021, 21(6):366-374.
ZHOU Y, LIU Q M, ZHANG J, et al.Visualization analysis of anti food allergy research based on CiteSpace[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(6):366-374.
[7] REN M N, YU X J, MUJUMDAR A S, et al.Visualizing the knowledge domain of pulsed light technology in the food field:A scientometrics review[J].Innovative Food Science &Emerging Technologies, 2021, 74:102823.
[8] HOU A J, YANG L, LYU J H, et al.A bibliometrics visualization analysis and hotspots prediction for natural product on osteoporosis research from 2000 to 2021[J].Journal of Future Foods, 2022, 2(4):326-337.
[9] 陈悦, 陈超美, 刘则渊, 等.CiteSpace知识图谱的方法论功能[J].科学学研究, 2015, 33(2):242-253.
CHEN Y, CHEN C M, LIU Z Y, et al.The methodology function of CiteSpace mapping knowledge domains[J].Studies in Science of Science, 2015, 33(2):242-253.
[10] 孙人杰, 何琴, 吴德智.基于CiteSpace知识图谱及专利计量对铁皮石斛相关研究的可视化分析[J].食品工业科技, 2023, 44(20):322-330.
SUN R J, HE Q, WU D Z.Visual analysis of Dendrobium candidum related research based on CiteSpace knowledge map and patent bibliometrics[J].Science and Technology of Food Industry, 2023, 44(20):322-330.
[11] 吴雨凌, 马雨辰, 邓胡雪, 等.基于CiteSpace的食品和肠道微生物研究的计量分析[J].食品工业科技, 2022, 43(23):1-10.
WU Y L, MA Y C, DENG H X, et al.Quantitative analysis of food and gut microbiota based on CiteSpace[J].Science and Technology of Food Industry, 2022, 43(23):1-10.
[12] ANAL A K, SINGH H.Recent advances in microencapsulation of probiotics for industrial applications and targeted delivery[J].Trends in Food Science &Technology, 2007, 18(5):240-251.
[13] YAO M F, XIE J J, DU H J, et al.Progress in microencapsulation of probiotics:A review[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(2):857-874.
[14] CH VARRI M, MARA
VARRI M, MARA
 N I, ARES R, et al.Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions[J].International Journal of Food Microbiology, 2010, 142(1):185-189.
N I, ARES R, et al.Microencapsulation of a probiotic and prebiotic in alginate-chitosan capsules improves survival in simulated gastro-intestinal conditions[J].International Journal of Food Microbiology, 2010, 142(1):185-189.
[15] 钱文文, 辛宝, 任晓梅, 等.CiteSpace联合VOSviewer对血糖生成指数相关文献的可视化分析[J].食品与发酵工业, 2022, 48(18):278-285.
QIAN W W, XIN B, REN X M, et al.Visualization analysis of literatures related to glycemic index based on CiteSpace and VOSviewer[J].Food and Fermentation Industries, 2022, 48(18):278-285.
[16] REQUE P M, BRANDELLI A.Encapsulation of probiotics and nutraceuticals:Applications in functional food industry[J].Trends in Food Science &Technology, 2021, 114:1-10.
[17] DE PRISCO A, MAURIELLO G.Probiotication of foods:A focus on microencapsulation tool[J].Trends in Food Science &Technology, 2016, 48:27-39.
[18] KAVITAKE D, KANDASAMY S, DEVI P B, et al.Recent developments on encapsulation of lactic acid bacteria as potential starter culture in fermented foods:A review[J].Food Bioscience, 2018, 21:34-44.
[19] CHEN W, KONG S, DU L P, et al.Tea polyphenol cytoprotective exoskeleton for living cells[J].Materials Letters, 2021, 293:129670.
[20] KIM J U, KIM B, SHAHBAZ H M, et al. Encapsulation of probiotic Lactobacillus acidophilus by ionic gelation with electrostatic extrusion for enhancement of survival under simulated gastric conditions and during refrigerated storage[J]. International Journal of Food Science &Technology, 2017, 52(2): 519-530.
[21] DING X Q, XU Y B, WANG Y Y, et al.Carboxymethyl konjac glucomannan-chitosan complex nanogels stabilized double emulsions incorporated into alginate hydrogel beads for the encapsulation, protection and delivery of probiotics[J].Carbohydrate Polymers, 2022, 289:119438.
[22] LI Q, LIN H Y, LI J, et al.Improving probiotic (Lactobacillus casei) viability by encapsulation in alginate-based microgels:Impact of polymeric and colloidal fillers[J].Food Hydrocolloids, 2023, 134:108028.
[23] 董阳, 贺佳鑫, 顾悦, 等.高吸附铅乳酸菌的微胶囊化及特性[J].中国食品学报, 2021, 21(3):173-182.
DONG Y, HE J X, GU Y, et al.Microencapsulation and its characteristic of lactic acid bacteria with highly adsorbed ability of lead[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(3):173-182.
[24] 万茵, 罗成, 张鸿婷, 等.海藻酸钠微胶囊对乳酸菌产乙醛脱氢酶在体外胃肠消化环境中保护作用[J].食品与发酵工业, 2018, 44(9):61-65.
WAN Y, LUO C, ZHANG H T, et al.Protection of Lactobacillus ALDH activity by sodium alginate microcapsule during gastrointestinal digestion in vitro[J].Food and Fermentation Industries, 2018, 44(9):61-65.
[25] SARAO L K, ARORA M.Probiotics, prebiotics, and microencapsulation:A review[J].Critical Reviews in Food Science and Nutrition, 2017, 57(2):344-371.
[26] W ODARCZYK M,
ODARCZYK M,  LIZ·EWSKA K, BARCZY
LIZ·EWSKA K, BARCZY SKA R, et al.Effects of resistant dextrin from potato starch on the growth dynamics of selected co-cultured strains of gastrointestinal bacteria and the activity of fecal enzymes[J].Nutrients, 2022, 14(10):2158.
SKA R, et al.Effects of resistant dextrin from potato starch on the growth dynamics of selected co-cultured strains of gastrointestinal bacteria and the activity of fecal enzymes[J].Nutrients, 2022, 14(10):2158.
[27] 李妍, 马蓁.抗性淀粉微胶囊壁材在生物功能活性物质传递系统中应用的研究进展[J].中国粮油学报, 2023, 38(7):238-248.
LI Y, MA Z.Research advances of microcapsule wall materials based on resistant starch in the application of bio-active substance delivery system[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(7):238-248.
[28] CHEN W W, ZHANG T, MA Q, et al.Structure characterization and potential probiotic effects of sorghum and oat resistant dextrins[J].Foods, 2022, 11(13):1877.
[29] OBRADOVI N, VOLI
N, VOLI M, NEDOVI
M, NEDOVI V, et al.Microencapsulation of probiotic starter culture in protein-carbohydrate carriers using spray and freeze-drying processes:Implementation in whey-based beverages[J].Journal of Food Engineering, 2022, 321:110948.
V, et al.Microencapsulation of probiotic starter culture in protein-carbohydrate carriers using spray and freeze-drying processes:Implementation in whey-based beverages[J].Journal of Food Engineering, 2022, 321:110948.
[30] VISHALI D A, MONISHA J, SIVAKAMASUNDARI S K, et al.Spray freeze drying:Emerging applications in drug delivery[J].Journal of Controlled Release, 2019, 300:93-101.
[31] SEMYONOV D, RAMON O, KAPLUN Z, et al.Microencapsulation of Lactobacillus paracasei by spray freeze drying[J].Food Research International, 2010, 43(1):193-202.
[32] SOBULSKA M, ZBICINSKI I.Advances in spray drying of sugar-rich products[J].Drying Technology, 2021, 39(12):1774-1799.
[33] SHEEHAN V M, ROSS P, FITZGERALD G F.Assessing the acid tolerance and the technological robustness of probiotic cultures for fortification in fruit juices[J].Innovative Food Science &Emerging Technologies, 2007, 8(2):279-284.
[34] CAMELO-SILVA C, VERRUCK S, AMBROSI A, et al.Innovation and trends in probiotic microencapsulation by emulsification techniques[J].Food Engineering Reviews, 2022, 14(3):462-490.
[35] MA J G, XU C, YU H L, et al.Electro-encapsulation of probiotics in gum Arabic-pullulan blend nanofibres using electrospinning technology[J].Food Hydrocolloids, 2021, 111:106381.
[36] RAMDHAN T, HUNG CHING S, PRAKASH S, et al.Evaluation of alginate-biopolymers (protein, hydrocolloid, starch) composite microgels prepared by the spray aerosol technique as a carrier for green tea polyphenols[J].Food Chemistry, 2022, 371:131382.
[37] COL N-CRUZ M A, PIMENTEL-GONZ
N-CRUZ M A, PIMENTEL-GONZ LEZ D J, CARRILLO-NAVAS H, et al.Co-encapsulation of bioactive compounds from blackberry juice and probiotic bacteria in biopolymeric matrices[J].LWT, 2019, 110:94-101.
LEZ D J, CARRILLO-NAVAS H, et al.Co-encapsulation of bioactive compounds from blackberry juice and probiotic bacteria in biopolymeric matrices[J].LWT, 2019, 110:94-101.
[38] SUN Z Y, HÜBNER R, LI J, et al.Artificially sporulated Escherichia coli cells as a robust cell factory for interfacial biocatalysis[J].Nature Communications, 2022, 13(1):3142.
[39] SU J Q, CAI Y J, TAI K D, et al.High-internal-phase emulsions (HIPEs) for co-encapsulation of probiotics and curcumin:Enhanced survivability and controlled release[J].Food &Function, 2021, 12(1):70-82.
[40] HOSSAIN M N, RANADHEERA C S, FANG Z X, et al.Impact of encapsulating probiotics with cocoa powder on the viability of probiotics during chocolate processing, storage, and in vitro gastrointestinal digestion[J].Journal of Food Science, 2021, 86(5):1629-1641.
[41] CAO F F, JIN L L, GAO Y, et al.Artificial-enzymes-armed Bifidobacterium longum probiotics for alleviating intestinal inflammation and microbiota dysbiosis[J].Nature Nanotechnology, 2023, 18(6):617-627.
[42] 刘耀东, 贾荣玲, 王国强.益生菌微胶囊化对仔猪生长性能及免疫功能的影响[J].中国饲料, 2021(3):55-59;63.
LIU Y D, JIA R L, WANG G Q.Effect of microencapsulation of probiotics on growth performance and immune function of piglets[J].China Feed, 2021(3):55-59;63.
[43] MISRA S, PANDEY P, MISHRA H N.Novel approaches for co-encapsulation of probiotic bacteria with bioactive compounds, their health benefits and functional food product development:A review[J].Trends in Food Science &Technology, 2021, 109:340-351.
[44] KLEINBERG J.Bursty and hierarchical structure in streams[J].Data Mining and Knowledge Discovery, 2003, 7(4):373-397.
[45] BALTHAZAR C F, GUIMAR ES J F, COUTINHO N M, et al.The future of functional food:Emerging technologies application on prebiotics, probiotics and postbiotics[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2560-2586.
ES J F, COUTINHO N M, et al.The future of functional food:Emerging technologies application on prebiotics, probiotics and postbiotics[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(3):2560-2586.
[46] LYNCH J P, GOERS L, LESSER C F.Emerging strategies for engineering Escherichia coli Nissle 1917-based therapeutics[J].Trends in Pharmacological Sciences, 2022, 43(9):772-786.
[47] YAHAV S, BERKOVICH Z, OSTROV I, et al.Encapsulation of beneficial probiotic bacteria in extracellular matrix from biofilm-forming Bacillus subtilis[J].Artificial Cells, Nanomedicine, and Biotechnology, 2018, 46(sup2):974-982.
[48] CHONG L S H, ZHANG J Y, BHAT K S, et al.Bioinspired cell-in-shell systems in biomedical engineering and beyond:Comparative overview and prospects[J].Biomaterials, 2021, 266:120473.
[49] LEE H, KIM N, RHEEM H B, et al.A decade of advances in single-cell nanocoating for mammalian cells[J].Advanced Healthcare Materials, 2021, 10(13):e2100347.
[50] 余帅朋, 崔玥, 王琳, 等.多尺度蛋白质-多糖基益生菌递送体系研究进展[J].食品工业科技, 2023, 44(17):470-482.
YU S P, CUI Y, WANG L, et al.Research advances in the multiscale protein-polysaccharide based systems for probiotics delivery[J].Science and Technology of Food Industry, 2023, 44(17):470-482.
[51] EKANEM E E, ZHANG Z L, VLADISAVLJEVI G T.Facile microfluidic production of composite polymer core-shell microcapsules and crescent-shaped microparticles[J].Journal of Colloid and Interface Science, 2017, 498:387-394.
G T.Facile microfluidic production of composite polymer core-shell microcapsules and crescent-shaped microparticles[J].Journal of Colloid and Interface Science, 2017, 498:387-394.
[52] OKURO P K, THOMAZINI M, BALIEIRO J C C, et al.Co-encapsulation of Lactobacillus acidophilus with inulin or polydextrose in solid lipid microparticles provides protection and improves stability[J].Food Research International, 2013, 53(1):96-103.
[53] SILVA M P, TULINI F L, MATOS-JR F E, et al.Application of spray chilling and electrostatic interaction to produce lipid microparticles loaded with probiotics as an alternative to improve resistance under stress conditions[J].Food Hydrocolloids, 2018, 83:109-117.
[54] XU D, LIU Z B, AN Z N, et al.Incorporation of probiotics into 3D printed Pickering emulsion gel stabilized by tea protein/xanthan gum[J].Food Chemistry, 2023, 409:135289.
[55] YUCEL FALCO C, SOTRES J, RASC N A, et al.Design of a potentially prebiotic and responsive encapsulation material for probiotic bacteria based on chitosan and sulfated β-glucan[J].Journal of Colloid and Interface Science, 2017, 487:97-106.
N A, et al.Design of a potentially prebiotic and responsive encapsulation material for probiotic bacteria based on chitosan and sulfated β-glucan[J].Journal of Colloid and Interface Science, 2017, 487:97-106.
[56] MOKHTARI S, JAFARI S M, KHOMEIRI M, et al.The cell wall compound of Saccharomyces cerevisiae as a novel wall material for encapsulation of probiotics[J].Food Research International, 2017, 96:19-26.