人参皂苷又称三萜皂苷,是从人参属药材中提取的一类固醇类化合物。研究发现人参皂苷具有多种药理学特性,包括免疫调节[1]、抗肿瘤和抗炎[2]等,对中枢神经、心脑血管和免疫系统均有显著的保护作用,可广泛用于相关疾病的治疗[3]。人参皂苷作为一种天然抗氧化剂,可以清除自由基,在抗氧化方面具有巨大潜力。
氧化应激是指抗氧化防御机制受到破坏,体内氧化与抗氧化作用失衡的一种状态,细胞内会大量产生和积累活性氧(reactive oxygen species,ROS)。ROS的生成会通过体外的异常刺激而增加,过量积累的ROS会直接破坏细胞内的生物分子,比如蛋白质氧化、破坏DNA[4-5]等,使得细胞结构和功能受损。H2O2是ROS的主要来源,通过产生羟自由基(·OH)直接损伤细胞内生物分子。引起肠道屏障功能丧失的主要原因之一就是氧化应激能够造成肠细胞上皮损伤。小肠上皮细胞是人体肠道重要的物理性防御结构,这种肠道屏障可以有效阻碍毒素、细菌和其他有害物质侵入血液系统[6],进而避免侵犯其他器官。人结肠癌(Caco-2)细胞与人类正常小肠上皮细胞结构和功能类似,具有与正常细胞类似的微绒毛和相关酶系,Caco-2细胞可用于肠上皮损伤和修复的体外研究[7-9]。因此本研究以H2O2诱导的Caco-2细胞建立氧化应激损伤模型,评估人参皂苷的抗氧化保护作用,为后续研究人参皂苷抗氧化产品的开发提供理论参考。
1 材料与方法
1.1 试验材料
1.1.1 细胞
人结肠癌Caco-2细胞株,上海启达科技有限公司,本实验室保存。
1.1.2 药品与试剂
人参皂苷(纯度≥99.5%),中国计量大学,实验室提取;30% H2O2,上海泰坦科技股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、DMEM培养基(Dulbecco’s modified eagle medium)、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶,上海启达科技有限公司;CCK-8试剂盒、BCA蛋白浓度测试试剂盒(P0012)、细胞毒性检测试剂盒(C0016),上海碧云天生物技术有限公司;谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒(A005-1)、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(A001-3)、丙二醛(malondialdehyde,MDA)(A003-1)试剂盒,南京建成生物工程研究所有限公司。
1.1.3 仪器与设备
TS100倒置显微镜,日本尼康公司;SpectraMax iD3/iD5多功能酶标仪,美谷分子仪器(上海)有限公司;HERAcell 240细胞恒温培养箱,赛默飞世尔科技公司。
1.2 实验方法
1.2.1 Caco-2细胞培养及分组
Caco-2细胞用DMEM细胞培养液(含体积分数10% FBS与1%青-链霉素双抗液)置于37 ℃、5% CO2恒温细胞培养箱中培养,每1~2 d换1次培养液。待长至80%进行传代培养。细胞分别接种于6孔(1×105 个/孔)和96孔(1×104 个/孔)细胞培养板中培养,对照组为未经任何处理的正常Caco-2细胞;损伤模型组以DMEM细胞培养液(含有200 μmol/L H2O2)继续培养4 h,制备H2O2诱导的Caco-2细胞氧化损伤应激模型。氧化损伤模型细胞以不同浓度的人参皂苷继续培养24 h后,进行后续实验。
1.2.2 CCK-8法检测细胞活性
Caco-2细胞经过孵育后,向每孔中加入10 μL CCK-8溶液,在37 ℃、5% CO2恒温细胞培养箱中培养2 h,采用多功能酶标仪在450 nm处测吸光值。根据CCK-8试剂盒提供公式(1)计算细胞存活率。
存活率![]()
(1)
式中:A,吸光值。
1.2.3 氧化应激模型的建立及毒性检测
细胞经过传代之后,待其长至80%左右,消化细胞,将Caco-2细胞分为对照组和氧化损伤模型组,每孔设置3个平行孔。将细胞以1×104个/孔的密度接种于96孔板,每孔100 μL,对照组加入相同体积细胞培养液,培养24 h,待细胞完全贴壁后,对照组和模型组分别加入10 μL细胞培养基,再向模型组加入不同浓度的H2O2,继续孵育2、4、6、8 h。最后加入CCK-8试剂并继续孵育2 h,用酶标仪检测450 nm处吸光度。
1.2.4 胞内ROS含量检测
细胞以4×104个/孔的密度接种至96孔板中,按照1.2.1节中的分组及实验要求干预细胞后,吸取细胞培养液,PBS冲洗2遍,再用无血清培养基稀释样品,加入新鲜培养基置于恒温箱中孵育30 min后,取出用PBS冲洗2遍,15 min内用酶标仪检测胞内ROS含量,并与模型组对比。
1.2.5 氧化损伤模型中胞内指标的检测
收集细胞并以5×105个/孔的密度接种于6孔板中进行孵育,将细胞分为对照组、H2O2组(200 μmol/L+4 h)和保护组(人参皂苷预处理+200 μmol/L+4 h),收集细胞,使用BCA蛋白浓度试剂盒测定每组细胞蛋白浓度,根据试剂盒说明书进行胞内抗氧化指标GSH-Px和MDA的测定。
采用WST-1法测定细胞中SOD活性,根据前段分组方法,孵育之后,去除培养基,加入细胞裂解液,每孔100 μL,低温下裂解10 min,裂解液4 ℃、离心(100×g,10 min)后,收集上清液采用BCA蛋白浓度试剂盒测定每组细胞蛋白浓度,再根据试剂盒说明书测定胞内SOD水平。
1.2.6 数据处理与统计学分析
所有试验重复3次,结果以均值±标准偏差表示,实验数据使用SPSS和Excel处理,由Origin绘图,通过单因素方差分析(ANOVA)进一步分析差异显著性,组间比较采用Duncan法进行显著性分析,P<0.05、P<0.01分别表示差异显著、极显著。
2 结果与分析
2.1 H2O2对Caco-2细胞存活率的影响
H2O2作为ROS主要成分之一,能够通过细胞膜结构,性质比较稳定,当与胞内Fe3+反应时会形成具有极强毒性的·OH,具有强氧化性,能引起细胞氧化应激,可作为细胞建立氧化应激损伤模型的诱导剂[10-11]。构建细胞氧化应激模型要求在适宜环境下,使细胞产生明显的氧化应激损伤,诱导时控制细胞存活率在50%左右为最佳[12],因为细胞存活率过高导致诱导不明显,不具目的性;过低会发生不可逆转的细胞损伤,即使添加抗氧化物质,也不能使细胞氧化损伤恢复。H2O2诱导Caco-2细胞氧化应激损伤模型的建立如图1所示。
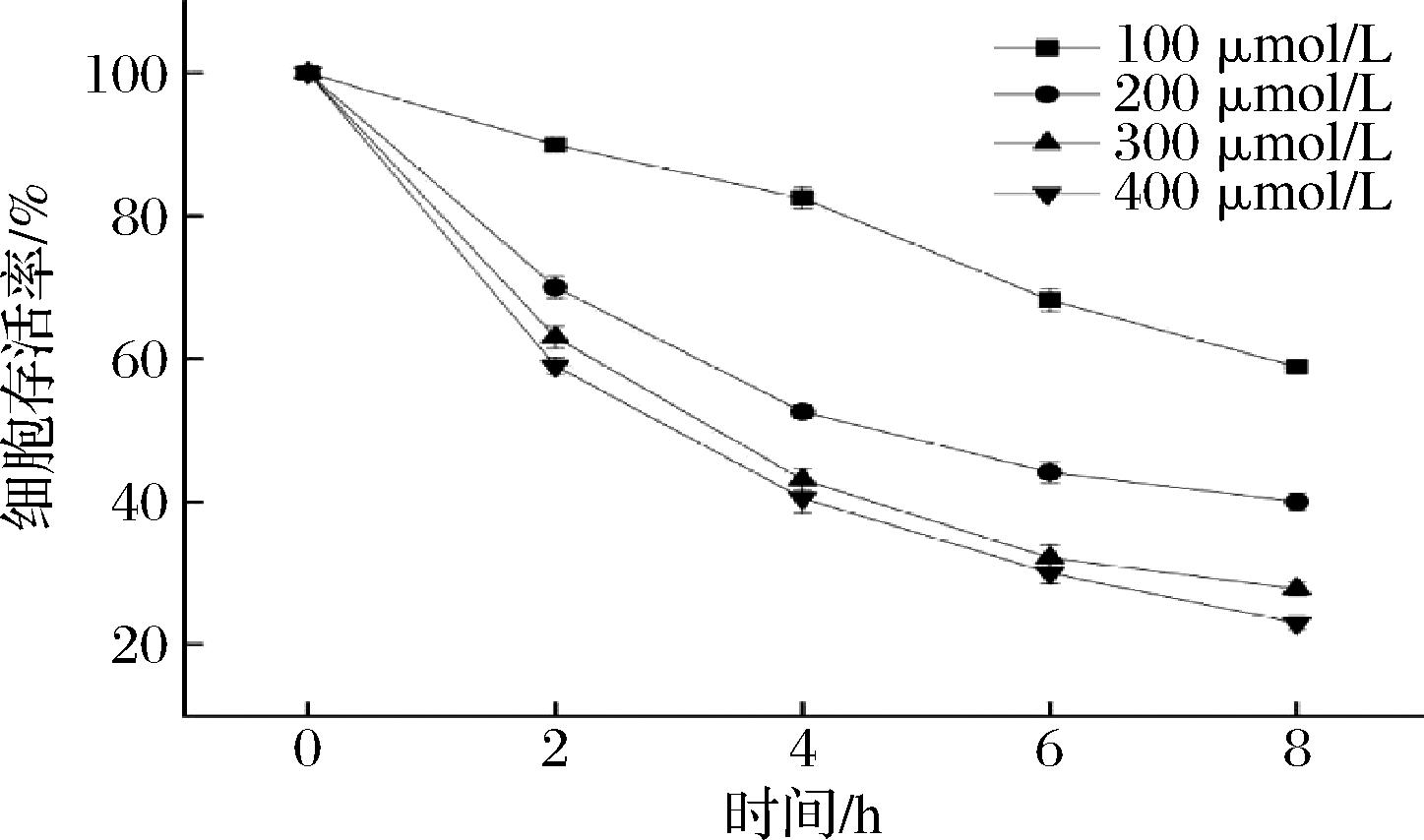
图1 不同浓度H2O2对Caco-2细胞存活率的影响
Fig.1 Effect of different concentration of H2O2 on survival rate of Caco-2 cells
采用100、200、300、400 μmol/L H2O2分别作用Caco-2细胞2、4、6、8 h,细胞活力均随时间的延长而逐渐下降,当H2O2浓度200 μmol/L,作用Caco-2细胞4 h时,细胞存活率为(53±2)%(P<0.05),具有统计学意义,因此采用该浓度和作用时间作为诱导Caco-2细胞氧化损伤的最佳条件。
2.2 人参皂苷预处理后每组Caco-2细胞的存活率
实验设置10、20、40、100、200、500 μg/mL的人参皂苷进行毒性试验,以基础培养基培养Caco-2细胞的存活率为100%进行对照,对不同浓度人参皂苷的安全计量进行分析,筛选人参皂苷最适浓度进行后续试验,结果如图2所示,人参皂苷的质量浓度在0~500 μg/mL时,每组对应的细胞存活率在95%~100%,即在此浓度范围内人参皂苷不具毒性。本实验选择0~50 μg/mL进行后续试验。
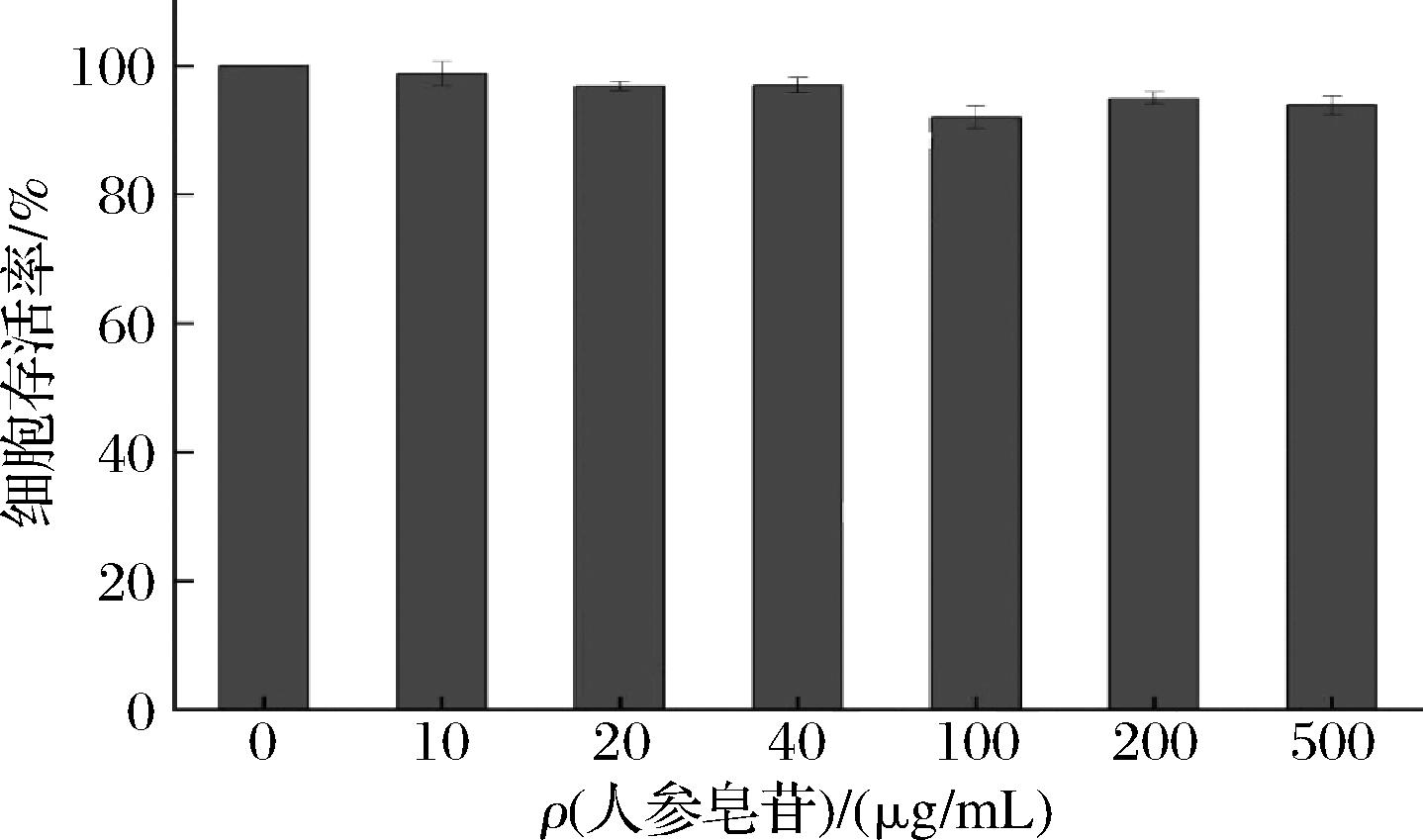
图2 不同浓度的人参皂苷对Caco-2细胞存活率的影响
Fig.2 Effects of different concentrations of ginsenosides on survival rate of Caco-2 cells
2.3 Caco-2细胞形态学观察
由图3可知,未经任何处理的Caco-2细胞紧密贴壁生长,细胞膜完整光滑;经H2O2处理后的细胞明显受到破坏,部分细胞膜破裂,细胞间孔隙增加,细胞数量急剧减少;而加入人参皂苷处理后可明显改善这些情况,添加10~500 μg/mL的人参皂苷可以明显改善H2O2引起的细胞损伤,使细胞恢复光滑完整的形态。
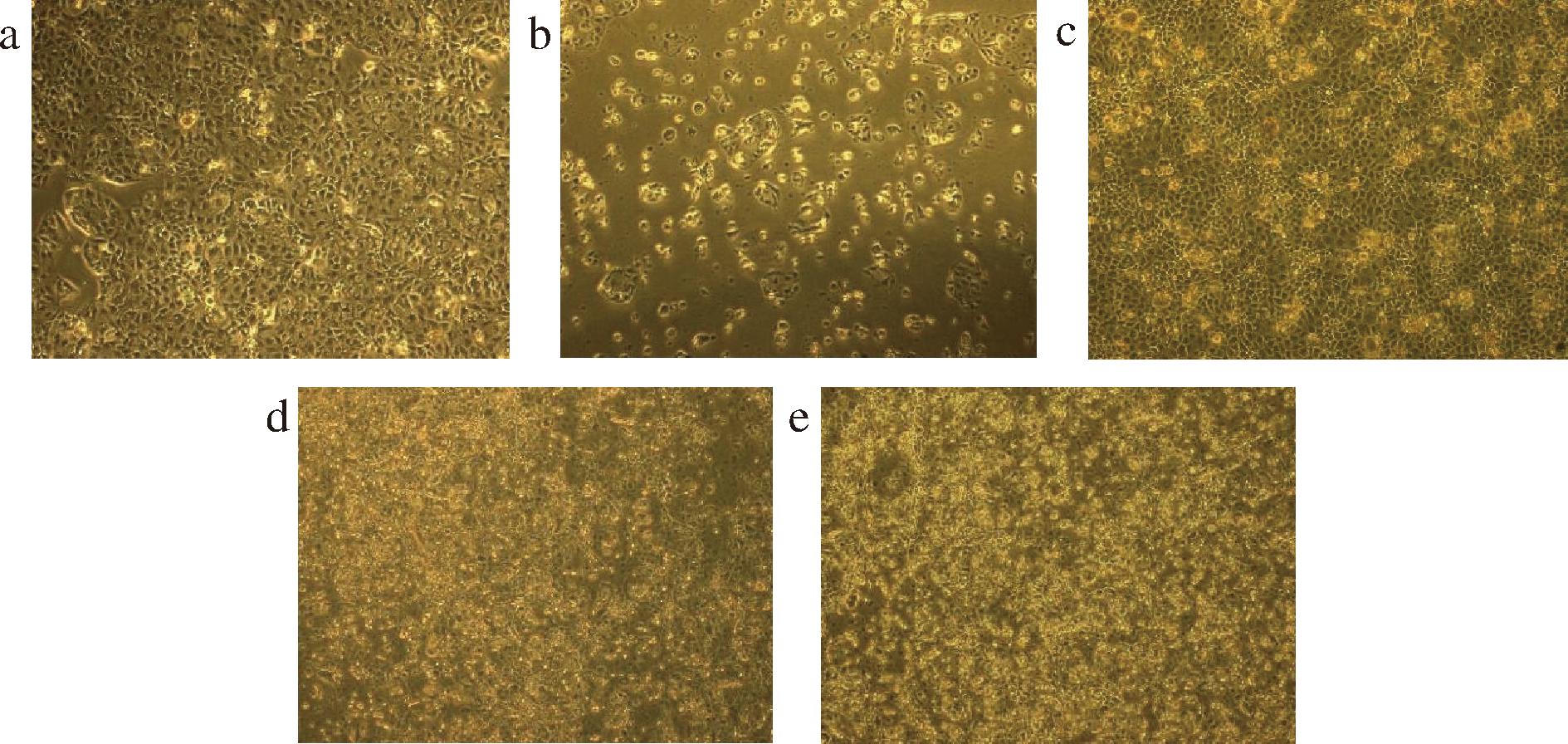
a-正常Caco-2细胞;b-H2O2诱导的Caco-2细胞;c-10 μg/mL人参皂苷预处理;d-100 μg/mL人参皂苷预处理;e-500 μg/mL人参皂苷预处理
图3 细胞形态观察(×20)
Fig.3 Observation of cell morphology(×20)
2.4 人参皂苷对H2O2氧化损伤Caco-2细胞活性的影响
以200 μmol/L H2O2作用4 h建立Caco-2细胞损伤模型,采用不同质量浓度(10、20、50 μg/mL)的人参皂苷干预H2O2诱导后的Caco-2细胞。如图4所示,与模型组相比干预组细胞存活率明显升高,分别达到(82.58±1.2)%、(86.5±0.8)%、(91.04±1.5)%,由此说明人参皂苷预处理可以使H2O2诱导的Caco-2氧化应激损伤得到缓解,同时也说明在选定浓度范围下呈剂量依赖关系,人参皂苷对H2O2诱导的Caco-2细胞氧化应激损伤具有一定保护作用。
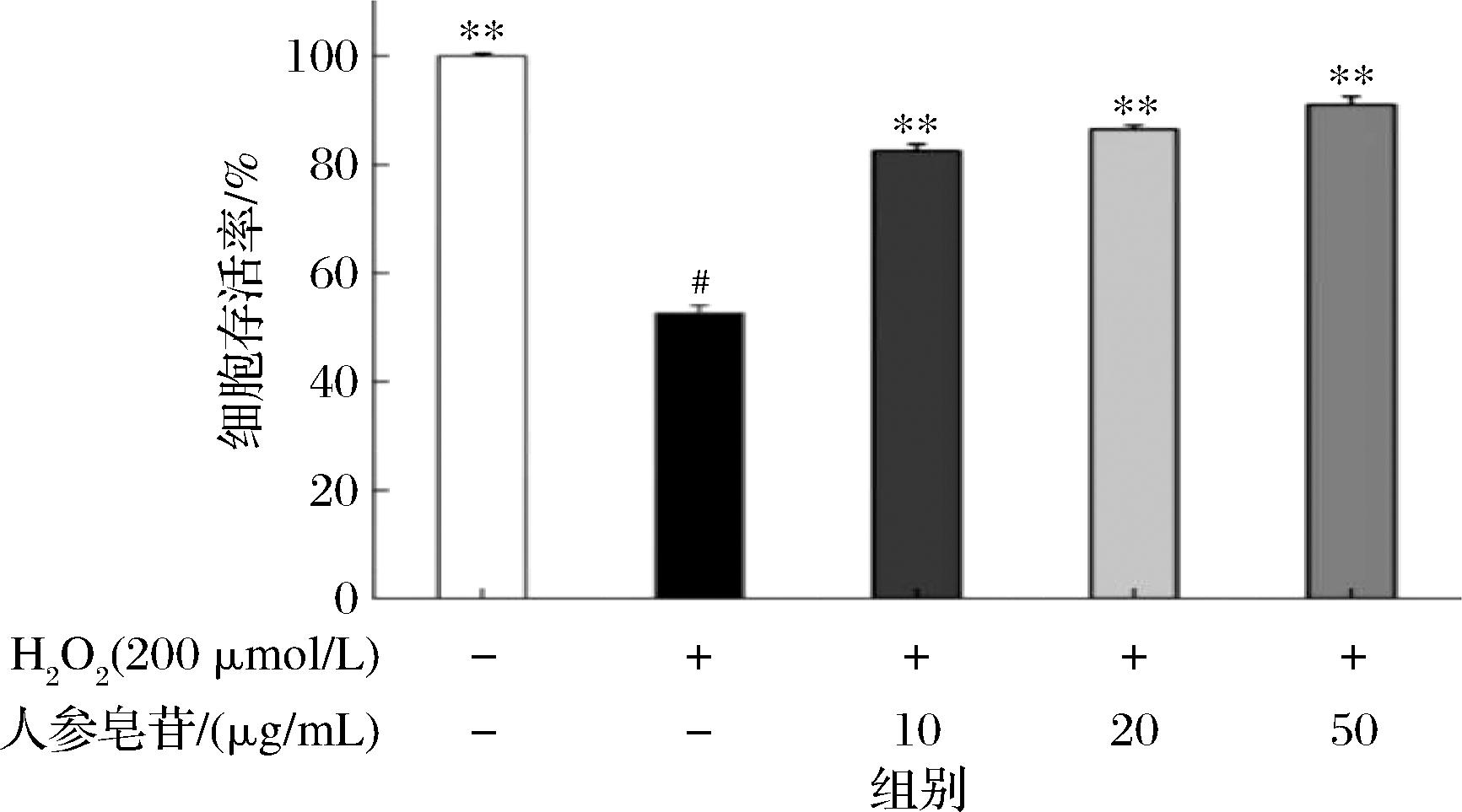
图4 人参皂苷对氧化损伤细胞活性的影响
Fig.4 Effect of ginsenosides on the activity of cells damaged by oxidation
注:*表示与H2O2诱导损伤组相比差异性显著(P<0.05),**表示极显著(P<0.01);#表示与对照组相比显著性差异显著(P<0.05),##极显著(P<0.01)(下同)。
2.5 人参皂苷对氧化应激模型中ROS产生的影响
氧化应激的形成是由于ROS的过量产生导致氧化失衡的结果,当自由基与抗氧化剂的水平失衡时,自由基会与人体细胞发生化学结合,导致细胞损伤而引起许多疾病[13-14]。因此,加强机体氧化系统的防御是拮抗氧化应激的重要手段。酶标仪检测Caco-2细胞内ROS含量结果显示,加入H2O2的Caco-2细胞内的ROS含量明显增加(P<0.01),当采用不同浓度的人参皂苷进行干预后,可以显著降低细胞内ROS水平,如图5所示,随着人参皂苷浓度的增加,胞内ROS含量下降,表现出良好的量效关系。因此人参皂苷可以抑制由于H2O2诱导所致的Caco-2细胞内ROS的生成量。
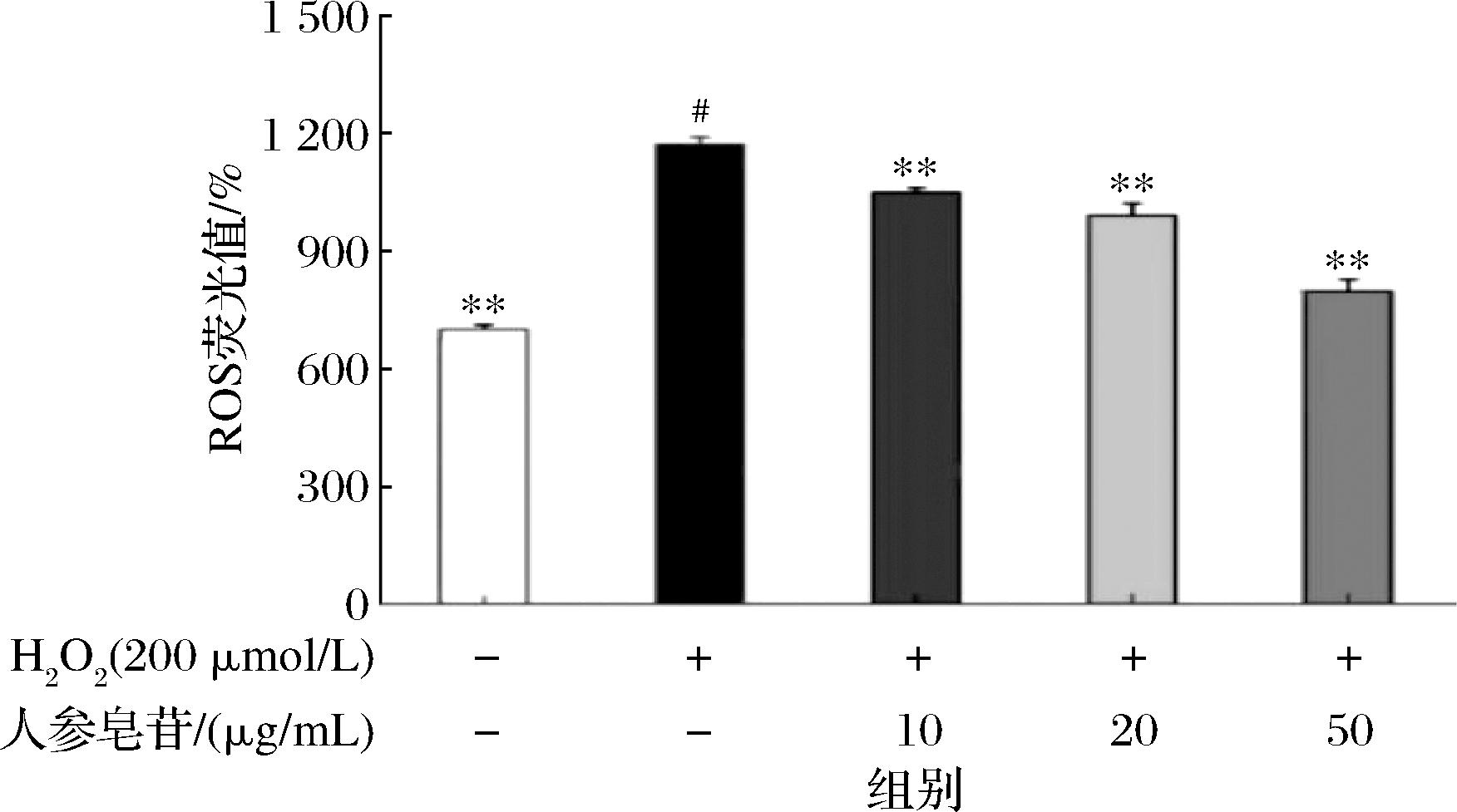
图5 人参皂苷对H2O2诱导损伤Caco-2细胞的ROS含量的影响
Fig.5 Effects of ginsenosides on ROS content in Caco-2 cells damaged by H2O2
2.6 人参皂苷对H2O2损伤Caco-2细胞中氧化酶的影响
SOD和GSH-Px是细胞中重要的抗氧化酶类,能有效清除自由基,具有解毒作用,同时也是细胞内抗脂质过氧化作用的主要成分,可以防御外源物质的刺激,阻止胞内脂质氧化,进而提高机体的抗氧化能力[15-16]。
如图6所示,与对照组相比,模型组中Caco-2细胞受到H2O2的刺激后,胞内SOD和GSH-Px的含量明显降低(P<0.01),与模型组相比,经过人参皂苷处理后,Caco-2细胞SOD的含量明显升高;与模型组相比,当添加10 μg/mL人参皂苷时,细胞内SOD的含量显著增加(P<0.05),当人参皂苷质量浓度≥20 μg/mL时,胞内SOD的含量极显著增加(P<0.01);此外,经人参皂苷处理后,显著提高了Caco-2细胞内GSH-Px的水平,且呈一定剂量依赖关系。
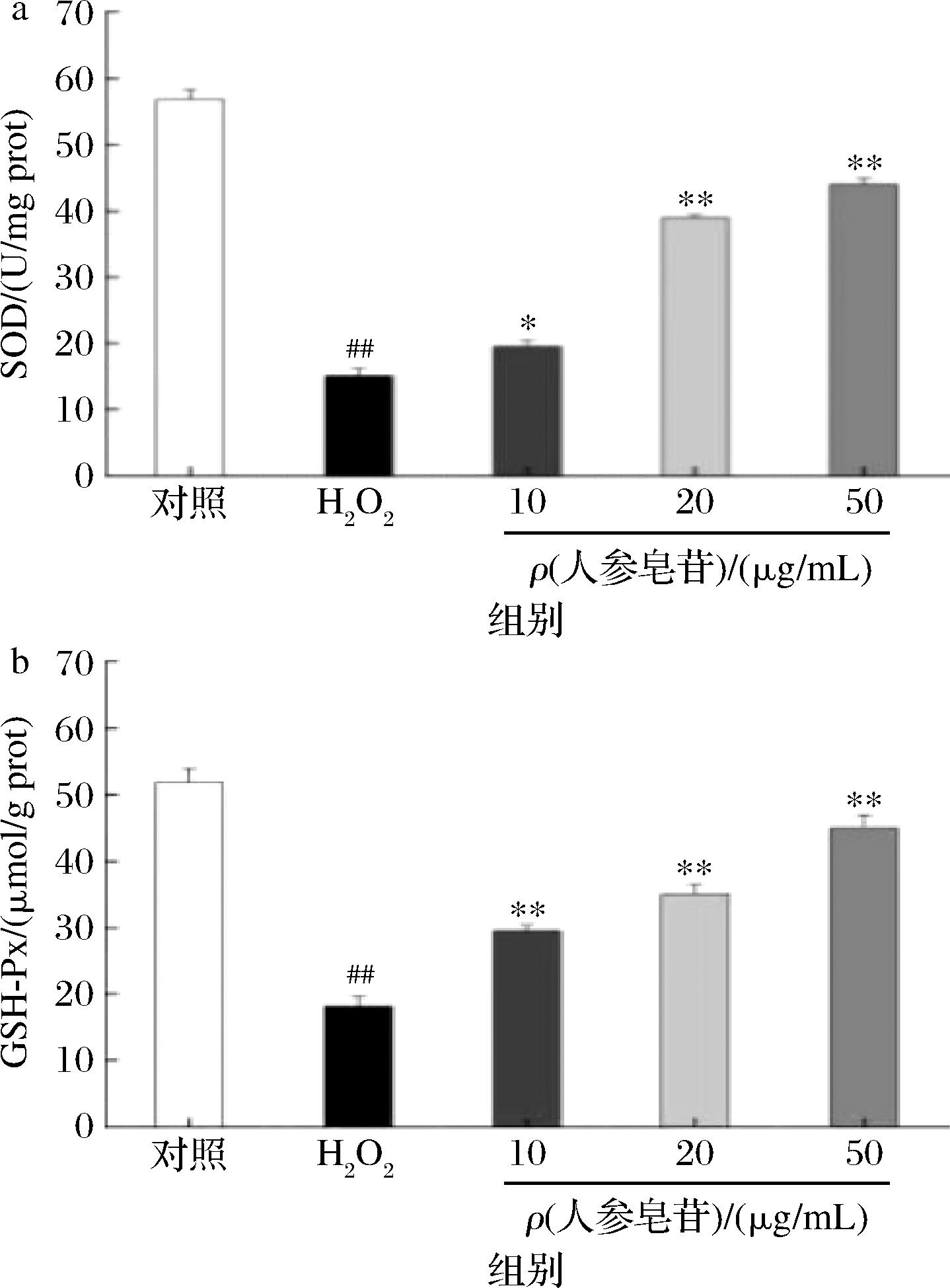
a-SOD;b-GSH-Px
图6 人参皂苷对H2O2损伤Caco-2细胞中SOD和GSH-Px水平的影响
Fig.6 Effects of ginsenosides on the levels of SOD and GSH-Px activity in Caco-2 cells damaged by H2O2
2.7 人参皂苷对H2O2损伤Caco-2细胞中MDA的影响
当细胞受到外界刺激后,氧化应激的程度被加深,打破原本平衡的状态,会引起细胞膜上不饱和脂肪酸发生氧化反应,而MDA正是脂质过氧化作用后的最终产物之一,细胞内脂质氧化程度可以用MDA水平来表示,其含量可以间接反映出氧化损伤的程度[17]。如图7所示,与对照组相比,模型组的MDA极显著提高(P<0.01);与损伤组相比,人参皂苷组(10~50 μg/mL)显著降低MDA含量,从而抑制Caco-2受到H2O2的破坏,人参皂苷对氧化应激引起的细胞损伤有保护作用。
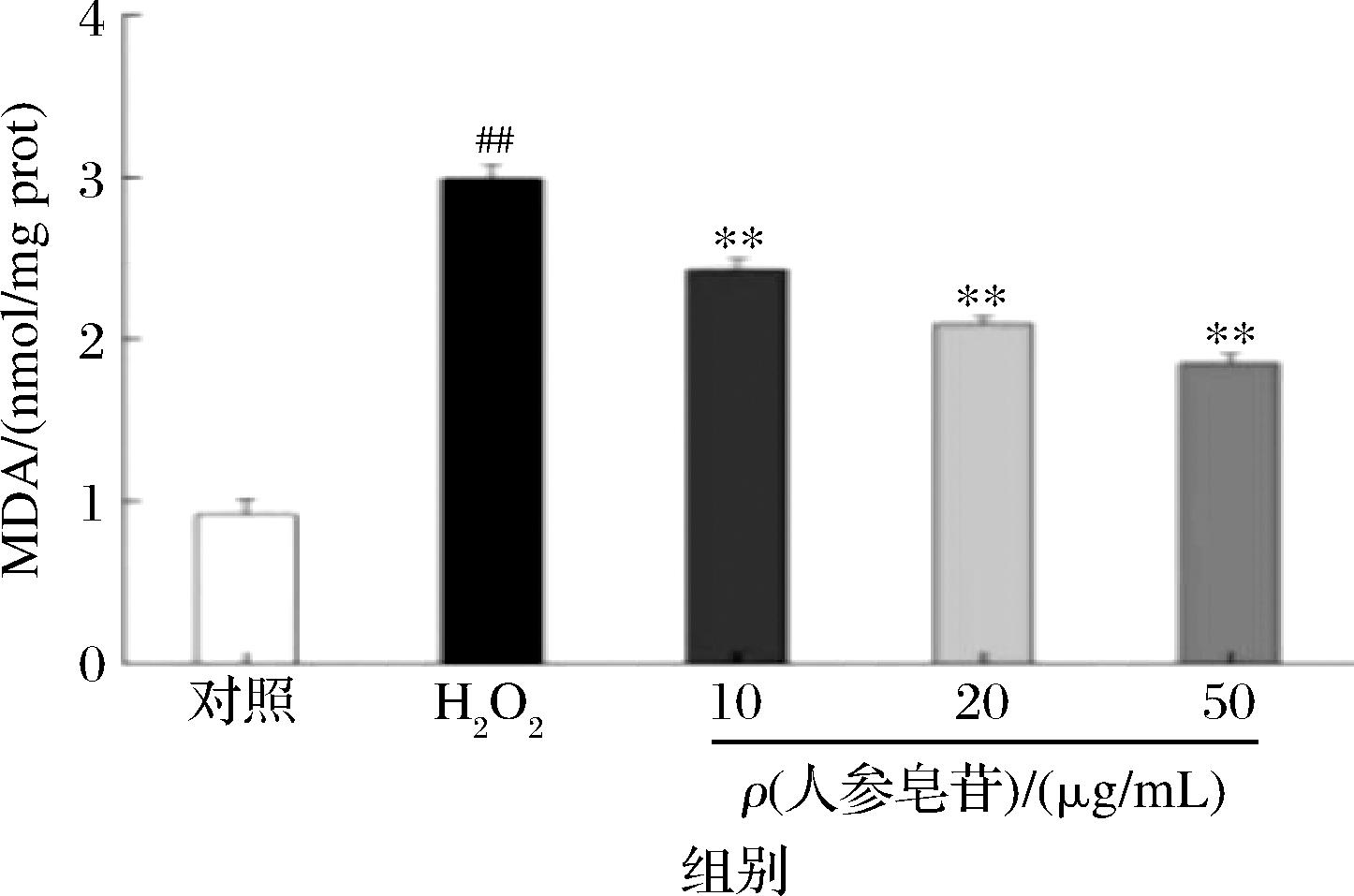
图7 人参皂苷对H2O2诱导损伤Caco-2细胞的MDA含量的影响
Fig.7 Effect of ginsenosides on MDA content in Caco-2 cells damaged by H2O2
3 结论
复杂的肠道环境使肠上皮细胞极易受到自由基的损伤,从而引发肠道炎症,肠道细胞氧化应激模型在抗氧化活性的研究中发挥重要作用。研究表明人参皂苷具有多种生理功能,本研究以H2O2诱导Caco-2细胞氧化应激损伤模型,选择SOD、GSH-Px和MDA作为评价肠细胞氧化损伤的指标,研究人参皂苷对细胞氧化应激的保护作用。试验设计了对照组、模型组和实验组,通过不同质量浓度(10~50 μg/mL)人参皂苷对产生氧化应激的细胞进行干预,结果证实了人参皂苷具有一定的清除自由基的能力,能够延缓氧化作用所造成的细胞死亡、提高细胞活力以及细胞自身的氧化损伤作用。在氧化损伤应激模型中,通过降低胞内ROS的生成,提高细胞内源性酶SOD和GSH-Px活性,降低胞内MDA含量来保护Caco-2细胞。人参皂苷能够预防和改善由氧化应激损伤带来的损伤。当机体抗氧化酶受到诱导表达增高时,被认为是组织细胞对氧化应激因素的适应性保护反应。研究表明氧化应激会引起机体内抗氧化系统失衡,从而使细胞内ROS等物质大量积累,导致细胞损伤。随着抗氧化深受重视,越来越多的研究发现,氧化应激损伤与老年性、慢性疾病密切相关,且其会引起一系列并发症。越来越多的天然活性物质抗氧化生理功效的相关研究表明,单一物质的抗氧化效果可能无法达到精准快速的抗氧化作用,多种天然活性物质的联合可以实现增效的效果,未来对联合使用多种物质治疗氧化应激引起的损伤是一种趋势,本研究可以为氧化应激引起损伤的治疗提供科学依据。
[1] 牛瑞娟, 马思佳, 唐亮, 等.人参皂苷Rh1免疫调节作用的研究进展[J].国际老年医学杂志, 2022, 43(3):368-371.
NIU R J, MA S J, TANG L, et al.Advances in immunomodulatory effects of ginsenoside Rh1[J].International Journal of Geriatrics, 2022, 43(3):368-371.
[2] JUNG D H, NAHAR J, MATHIYALAGAN R, et al.A focused review on molecular signalling mechanisms of ginsenosides anti-lung cancer and anti-inflammatory activities[J].Anti-Cancer Agents in Medicinal Chemistry, 2023, 23(1):3-14.
[3] REHMAN M U, ZHAO Q L, REFAAT A, et al.ROS associated ER-stress and intracellular calcium release contributes to CDDO-Me-mediated paraptosis in colorectal cancer cells[J].Free Radical Biology and Medicine, 2022, 180:s35.
[4] ZHOU Y M, XU B B, YU H Y, et al.Biochanin A attenuates ovariectomy-induced cognition deficit via antioxidant effects in female rats[J].Frontiers in Pharmacology, 2021, 12:603316.
[5] 林玥莹, 王敏奇.肠道微生物与肠上皮细胞互作关系的研究进展[J].中国畜牧杂志, 2021, 57(12):37-41;46.
LIN Y Y, WANG M Q.Research progress on interactions between intestinal microbiota and intestinal epithelial cells[J].Chinese Journal of Animal Science, 2021, 57(12):37-41;46.
[6] LIU C M, CHI K M, YANG M, et al.Staphylococcal enterotoxin A induces intestinal barrier dysfunction and activates NLRP3 inflammasome via NF-κB/MAPK signaling pathways in mice[J].Toxins, 2022, 14(1):29.
[7] KIMATU B M, FANG D L, ZHAO L Y, et al.Agaricus bisporus peptide fractions confer cytoprotective ability against hydrogen peroxide-induced oxidative stress in HepG2 and Caco-2 cells[J].Journal of Food Measurement and Characterization, 2020, 14(5):2503-2519.
[8] ZHANG L W, LI X L, ZHAO H B, et al.Influence of glutathione responsive tumor-targeted camptothecin nanoparticles on glioma based on oxidative stress[J].Colloid and Interface Science Communications, 2021, 42:100423.
[9] HOFFMANN P, BURMESTER M, LANGEHEINE M, et al.Caco-2/HT29-MTX co-cultured cells as a model for studying physiological properties and toxin-induced effects on intestinal cells[J].PLoS One, 2021, 16(10):e0257824.
[10] 刘聪秀,宋佳佳,王洪伟,等.发酵乳杆菌LFQ153胞外多糖对RAW264.7巨噬细胞氧化损伤的保护作用[J].食品与发酵工业, 2022, 48(8):1-8.
LIU C X, SONG J J, WANG H W, et al.Protective effect of exopolysaccharide from Lactobacillus fermentum LFQ153 against oxidative damage in RAW264.7 macrophages[J].Food and Fermentation Industries, 2022, 48(8):1-8.
[11] 何萍萍, 郑雅君, 郑明静, 等.红毛藻多糖对H2O2诱导的Caco-2细胞氧化损伤的保护作用[J].食品科学, 2021, 42(17):113-120.
HE P P, ZHENG Y J, ZHENG M J, et al.Protective effect of Bangia fusco-purpurea polysaccharide on H2O2-induced oxidative damage in Caco-2 cells[J].Food Science, 2021, 42(17):113-120.
[12] 吴金姗, 黄榕, 刘树英, 等.玉簪多糖对细胞氧化应激损伤的保护作用机制[J].食品科学, 2022, 43(17):138-146.
WU J S, HUANG R, LIU S Y, et al.Protective mechanism of polysaccharide from Hosta ventricosa against oxidative damage in cells[J].Food Science, 2022, 43(17):138-146.
[13] BUCKLEY S, BYRNES S, COCHRANE C, et al.The role of oxidative stress in HIV-associated neurocognitive disorders[J].Brain, Behavior, &Immunity-Health, 2021, 13:100235.
[14] VINU RAJAN P K.Activation of the oxidative stress in culex quinquefasciatus by the augmented production of reactive oxygen species (ROS) in response to Stachytarpheta jamaicensis exposure[J].Journal of Communicable Diseases, 2021, 53(2):43-51.
[15] 宁晨青. 人参皂苷Rg1的肝保护作用及其分子药理学机制[D].大连:大连医科大学, 2019.
NING C Q.Liver protective effects and molecular pharmacological mechanisms of ginsenoside Rg1[D].Dalian:Dalian Medical University, 2019.
[16] ZHENG Q H, TAN W J, FENG X L, et al.Protective effect of flavonoids from mulberry leaf on AAPH-induced oxidative damage in sheep erythrocytes[J].Molecules, 2022, 27(21):7625.
[17] ESMAEILNEJAD B, TAVASSOLI M, SAMIEI A, et al.Evaluation of oxidative stress and antioxidant status, serum trace mineral levels and cholinesterases activity in cattle infected with Anaplasma marginale[J].Microbial Pathogenesis, 2018, 123:402-409.