氧化应激是指由于某种原因体内产生了超出机体清除能力的多余活性氧(reactive oxygen species,ROS),破坏了机体正常状态下的氧化/还原平衡,使体内的生物大分子(蛋白质、脂质和核酸等)受到氧化损伤,甚至导致其功能紊乱,对机体正常代谢过程产生影响的一种异常应激状态[1]。体内自由基水平过高会将细胞膜、代谢酶系、蛋白质和DNA等物质氧化,还会诱导细胞异常凋亡,对机体的细胞造成损伤。研究表明,自由基过多可能引起衰老、炎症、癌症、心血管等疾病,因此,开发具有清除自由基和还原能力的功能性健康食品和药物日益受到重视。人工合成抗氧化剂具有较多不良反应,对人体的肝脏、脾、肺会产生不良影响。天然抗氧化剂与人工合成抗氧化剂相比,具有毒性低、绿色环保等优点[2]。植物蛋白来源广泛、容易获得、安全稳定且易被人体消化吸收。同时,植物蛋白还是一类天然的抗氧化物质[3],且中药中的植物蛋白具有优良的生物活性,对人体有特殊的保健作用[4-6]。目前已有诸多学者对黄芪[7]、山药[8]、枸杞[9]等中药植物蛋白展开研究,结果表明,中药植物蛋白多具有抗氧化,抗过敏、抗糖尿病、抗癌等多种生物活性。
项目组前期对北五味子蛋白(Schisandra chinensis protein,SCP)进行了深入研究,结果表明五味子蛋白具有优良的体内抗氧化和抗疲劳活性[10-11]。作为与北五味子处于相同属但不同种的南五味子,与北五味子具有相似传统功效和现代的生物活性。研究表明,五味子多糖、木脂素、酚酸均具有良好的抗氧化活性[12],但尚未见对不同品种五味子蛋白抗氧化活性相关的研究,尤其是南五味子蛋白(Schisandra sphenanthera protein,SSP)的抗氧化活性研究。本研究将SSP和SCP体外清除自由基能力和还原能力对比,之后利用H2O2诱导HepG2细胞氧化应激模型探究2种五味子蛋白的抗氧化能力,旨在从细胞活力、细胞形态、细胞ROS水平、抗氧化物质和抗氧化酶系活性方面综合评价2种五味子蛋白,从而为其在抗氧化功能性食品和健康产品中的开发提供理论依据,并为后续阐明其抗氧化的调控机制奠定基础。
1 材料与方法
1.1 材料试剂
南、北五味子药材,长春中医药大学附属医院,经长春中医药大学姜大成教授鉴定分别为木兰科植物南五味子(Schisandra sphenanthera Rehd.et Wils.)和北五味子[Schisandra chinensis (Turcz.) Baill.]干燥成熟的果实;邻啡罗啉(邻二氮菲)、DPPH、ABTS、维生素C(抗坏血酸),分析纯,北京索莱宝生物科技有限公司;人肝癌细胞HepG2、最小必需培养基(minimum essential medium,MEM),武汉普诺赛生命科技有限公司;胎牛血清、胰酶,美国Gibco有限公司;CCK-8、PBS,北京bioss有限公司;ELISA试剂盒[超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、丙二醛 (malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)],上海优选生物科技有限公司;活细胞/死细胞染色试剂盒,上海贝博生物科技有限公司;细胞ROS检测试剂盒,碧云天生物技术有限公司。
1.2 仪器与设备
Infinite M200 PRO酶标仪,瑞士TECAN公司;AB135-S十万分之一分析天平、S220-K-CN标准型pH计,梅特勒-托利多仪器有限公司;UV-2550紫外可见分光光度计,日本岛津仪器有限公司;SCIENTZ-50F真空冷冻干燥机,宁波新芝冻干设备股份有限公司;3131型细胞培养箱,美国Thermo Fisher有限公司;5920R低速离心机,德国Eppendorf公司。
1.3 实验方法
1.3.1 SCP和SSP制备
称取一定量南五味子与北五味子干燥脱脂药粉,按料液比1∶35(g∶mL)加蒸馏水匀浆,将原液pH值调至9.5,于35 ℃水浴中提取3 h,离心(3 500 r/min、15 min),弃沉淀,收集上清液,并将pH值调至3.4,静置2 h后离心,弃上清液,适量蒸馏水溶解沉淀,将pH值调至中性后,透析袋中4 ℃透析48 h,间隔2 h替换蒸馏水,将透析袋中液体冷冻干燥,此冷冻干燥物即为SCP、SSP。
1.3.2 自由基清除能力
1.3.2.1 超氧阴离子(·O2-)
取若干支干净试管,编号,加入0.1 mol/L Tris-HCl 3 mL,再加入0.1 mL质量浓度为0.1、0.5、1.0、1.5、2.0、2.5 mg/mL的SCP、SSP溶液,混合均匀,25 ℃保温20 min,加入7 mmol/L邻苯三酚溶液0.3 mL,反应4 min后加入1 mL 10 mol/L盐酸终止反应;样品对照组将邻苯三酚溶液用等体积的蒸馏水代替;空白对照组以0.1 mL蒸馏水代替样品溶液。维生素C为阳性对照,用蒸馏水做空白调零,于420 nm波长处测其吸光度,计算如公式(1)所示:
·O2-清除率![]()
(1)
式中:A0,空白对照组吸光度;A1,样品组吸光度;A2,样品对照组吸光度。
1.3.2.2 羟自由基(·OH)
采用邻二氮菲法测定SCP、SSP对·OH的清除作用。将0.75 mmol/L邻二氮菲溶液1 mL和0.2 mol/L PBS 2 mL加入试管中,随后加入1 mL不同质量浓度的SCP、SSP溶液,混匀后加入1 mL 0.75 mmol/L FeSO4溶液,立即混匀,最后加入1 mL 0.025% H2O2溶液,混匀,维生素C为阳性对照组,37 ℃水浴反应1 h后536 nm波长处测其吸光度。空白对照组以1 mL蒸馏水代替样品溶液,样品对照组以1 mL蒸馏水代替0.025% H2O2溶液,·OH清除率计算如公式(2)所示:
·OH清除率![]()
(2)
式中:A0,空白对照组吸光度;A1,样品组吸光度;A2,样品对照组吸光度。
1.3.2.3 DPPH自由基
将2 mL不同质量浓度的SCP、SSP溶液加入到具塞试管中,加入2 mL 0.04 mg/mL的DPPH溶液,涡旋混匀。避光反应30 min,以2 mL甲醇代替DPPH溶液作为样品对照组,以2 mL蒸馏水代替SCP、SSP溶液作为空白对照组,维生素C为阳性对照组,于517 nm处测定吸光度值。DPPH自由基清除率计算如公式(3)所示:
DPPH自由基清除率![]()
(3)
式中:A0,空白对照组吸光度;A1,样品组吸光度;A2,样品对照组吸光度。
1.3.2.4 ABTS阳离子自由基
去离子水配制7.4 mmol/L的ABTS溶液和2.6 mmol/L的过硫酸钾溶液,将2.5 mL ABTS储备液与44 μL过硫酸钾混匀作为工作液,4 ℃避光静置12~16 h,临用前用0.01 mol/L pH 7.4 PBS将工作液稀释至734 nm处吸光度值为0.7±0.2,作为空白对照组吸光度。将200 μL工作液与10 μL不同浓度的SCP、SSP溶液混匀,室温下避光反应8 min,于734 nm处测定吸光度值。ABTS阳离子自由基清除能力计算如公式(4)所示:
ABTS阳离子自由基清除率![]()
(4)
式中:A0,空白对照组吸光度;A1,样品组吸光度。
1.3.3 还原能力
1.3.3.1 Fe2+螯合能力
取96孔板,向100 μL不同浓度的南、北五味子样品溶液中加入50 μL 1.3 mmol/L FeCl2·4H2O,室温反应30 min,然后加入50 μL 0.1 mmol/L菲啰嗪溶液。以100 μL蒸馏水代替样品溶液作为样品对照组,以维生素C为阳性对照,测定562 nm处的吸光度值,Fe2+螯合能力计算如公式(5)所示:
Fe2+螯合能力![]()
(5)
式中:A0,样品对照组吸光度;A1,实验组吸光度。
1.3.3.2 Fe3+还原能力
将1 mL不同质量浓度的SCP、SSP溶液加入具塞试管中,分别加入2.5 mL 0.2 mol/L pH 6.6 PBS和10 g/L铁氰化钾溶液,迅速混匀后于50 ℃水浴反应20 min,冷却,加入2.5 mL 100 g/L三氯乙酸,混匀,3 000 r/min离心10 min,取上清液2.5 mL,依次加入2.5 mL蒸馏水和0.5 mL 1 g/L的FeCl3溶液,充分混匀,以蒸馏水做空白调零,于700 nm处测其吸光度值,以2.5 mL蒸馏水代替样品溶液作为样品对照组,以维生素C为阳性对照。通过公式(6)计算其还原能力:
A=A1-A2
(6)
式中:A1,样品组吸光度;A2,样品对照组吸光度。
1.3.4 HepG2 细胞氧化应激修复作用
1.3.4.1 HepG2 细胞培养与分组
将HepG2细胞置于含有10%(体积分数)胎牛血清、100 U/mL青霉素100 μg/mL链霉素的MEM培养基中,于37 ℃、5% CO2的饱和湿度培养箱中培养,待细胞生长密度达到80%~90%后弃掉原培养液,PBS冲洗2次,加入1 mL胰蛋白酶消化2 min,进行传代培养,定期更换培养基,至对数生长期用于后续实验。正常对照组:完全培养基;氧化应激模型组:加入终浓度为500 μmol/L H2O2培养基溶液刺激2 h后加入与正常对照组相同体积的完全培养基培养24 h;实验组:SCP与SSP低剂量组(SCP-L与SSP-L)、SCP与SSP中剂量组(SCP-M与SSP-M)、SCP与SSP高剂量组(SCP-H与SSP-H),先加入终浓度为500 μmol/L H2O2溶液刺激2 h后,采用终质量浓度分别为100、200、400 μg/mL SCP与SSP干预24 h。
1.3.4.2 SCP与SSP对H2O2诱导HepG2细胞增殖率的影响
96孔细胞培养板内接种处于对数生长期的HepG2细胞,每孔100 μL,接种密度为1×105 个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.4.1节分组方法处理细胞。采用CCK-8法检测细胞存活率,按试剂盒说明书检测各组吸光度,各组细胞存活率计算如公式(7)所示:
细胞存活率![]()
(7)
1.3.4.3 Calcein-AM/PI双色荧光凋亡染色
Calcein-AM/PI荧光染色鉴别细胞内活力的参数酯酶活性和细胞膜完整性,进而来检测活细胞与死细胞。选取对数生长期的HepG2细胞接种于24孔板内,每孔体积0.5 mL,接种密度为1.0×105 个/mL,置于37 ℃、5% CO2培养箱培养24 h,按照1.3.4.1节分组方法处理细胞后,用PBS洗涤细胞2~3次,每孔加入500 μL稀释后的Calcein-AM溶液于37 ℃培养箱中避光孵育20 min,PBS洗涤细胞3次,再加入200 μL稀释后的PI溶液于37 ℃避光反应5 min,PBS洗涤细胞2~3次,置于荧光显微镜下观察。
1.3.4.4 HepG2细胞ROS水平测定
选取对数生长期的HepG2细胞接种于6 孔板内,每孔体积2 mL,接种密度为1.0×105 个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.4.1节分组方法处理细胞后,每孔加入终浓度10 μmol/L的DCFH-DA荧光探针,37 ℃避光反应20 min后吸去探针,用预冷的PBS洗涤细胞3次,荧光倒置显微镜下记录细胞形态,采用酶标仪于488 nm 激发波长、525 nm发射波长测定细胞中ROS含量。
1.3.4.5 HepG2细胞中MDA和GSH水平的测定
选取对数生长期的HepG2细胞接种于6孔板内,每孔体积2 mL,接种密度为1.0×105 个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.4.1节分组方法处理细胞后,应用ELISA法,参照试剂盒说明书对MDA和GSH进行定量测定。
1.3.4.6 HepG2细胞中抗氧化物酶系活力的测定
选取对数生长期的HepG2细胞接种于6孔板内,每孔体积2 mL,接种密度为1.0×105个/mL,置于37 ℃、5% CO2培养箱培养,按照1.3.4.1节分组方法处理细胞后,ELISA法按照试剂盒说明书检测SOD、GSH-Px和CAT活力。
1.3.5 数据统计与分析
每组实验重复3次,实验数据采用平均值±标准差表示。实验数据使用SPSS 19.0软件进行统计分析,用方差分析法进行显著性检验,使用Origin 2019软件绘图。
2 结果与分析
2.1 自由基清除能力
2.1.1 ·O2-清除能力
邻苯三酚在弱碱性条件下会发生自氧化反应,形成一种新型的·O2-及有色中间体,可通过添加抗氧化剂来消除·O2-,从而降低其自身的氧化速度[13]。由图1可知,在测量的样品浓度范围内,SCP、SSP浓度与其清除率呈明显的正相关关系,但是低于维生素C对·O2-清除率。其中,在0.1~0.5 mg/mL,SCP对·O2-的清除作用强于SSP,然而当样品质量浓度>1.0 mg/mL时,SSP清除·O2-能力优于SCP,可能由于SCP的作用位点不同,在质量浓度为2.5 mg/mL时清除率达到最高,为58.61%。SCP、SSP的IC50值分别为3.15、1.70 mg/mL,IC50值越小,则说明样品的抗氧化能力越强。与SCP消除·O2-能力相比,SSP的清除能力较高。
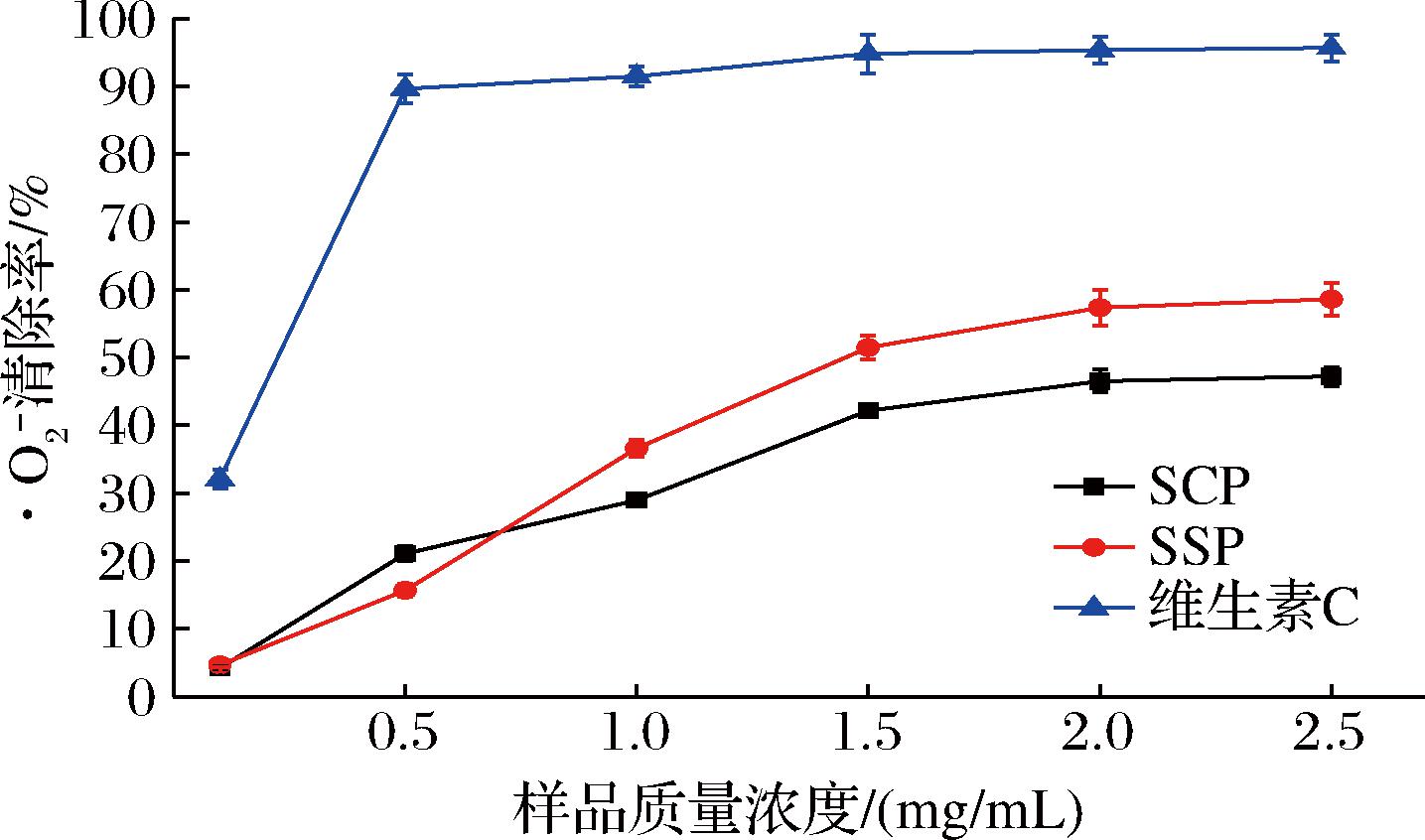
图1 SCP和SSP的·O2-清除能力
Fig.1 Superoxide anion free radical scavenging ability of SCP and SSP
2.1.2 ·OH清除能力
·OH清除能力是衡量抗氧化能力的重要指标[14],·OH是ROS中最活泼的氧自由基,也是毒性最大的自由基,是造成生物体损伤的主要因素。样品中的H与·OH结合,通过减少·OH的积累量,进一步使其在536 nm处的吸光度下降,从而反映SCP与SSP清除·OH的能力。图2结果表明,随着样品浓度的升高,SCP与SSP对·OH的清除率逐渐增大。在0.1~1.0 mg/mL,SCP对·OH的清除能力高于SSP,但在1.5 mg/mL后,SCP对·OH的清除能力低于SSP,且SCP和SSP在2.0 mg/mL时对·OH的清除能力趋向于平缓。由此表明,SCP、SSP具有一定·OH清除活性,IC50值分别为2.11、1.66 mg/mL,因此SSP清除·OH能力优于SCP。

图2 SCP和SSP的·OH清除能力
Fig.2 Hydroxyl free radical scavenging ability of SCP and SSP
2.1.3 DPPH自由基清除能力
DPPH自由基是一种稳定性较强的有机氮基团,在甲醇溶剂中表现出暗紫色,能吸附抗氧化物的电子,从而使样品的颜色发生变化,这种变化与所接收的电子数量成正比,当抗氧化性物质与DPPH自由基结合或发生替代,降低DPPH自由基数目,导致溶液颜色变浅,表现出在517 nm处的吸光度降低[15-16]。如图3所示,SSP DPPH自由基清除能力高于SCP,在0.1~1.5 mg/mL,随着样品浓度的增大,两者的清除能力呈现出增强的趋势。当质量浓度为1.5 mg/mL 时,SCP和SSP的清除能力几乎达到最大值,分别为72.84%和78.49%。SCP、SSP都具有较好的DPPH自由基清除活性,IC50值分别为0.58、0.40 mg/mL,SSP清除DPPH自由基能力优于SCP。
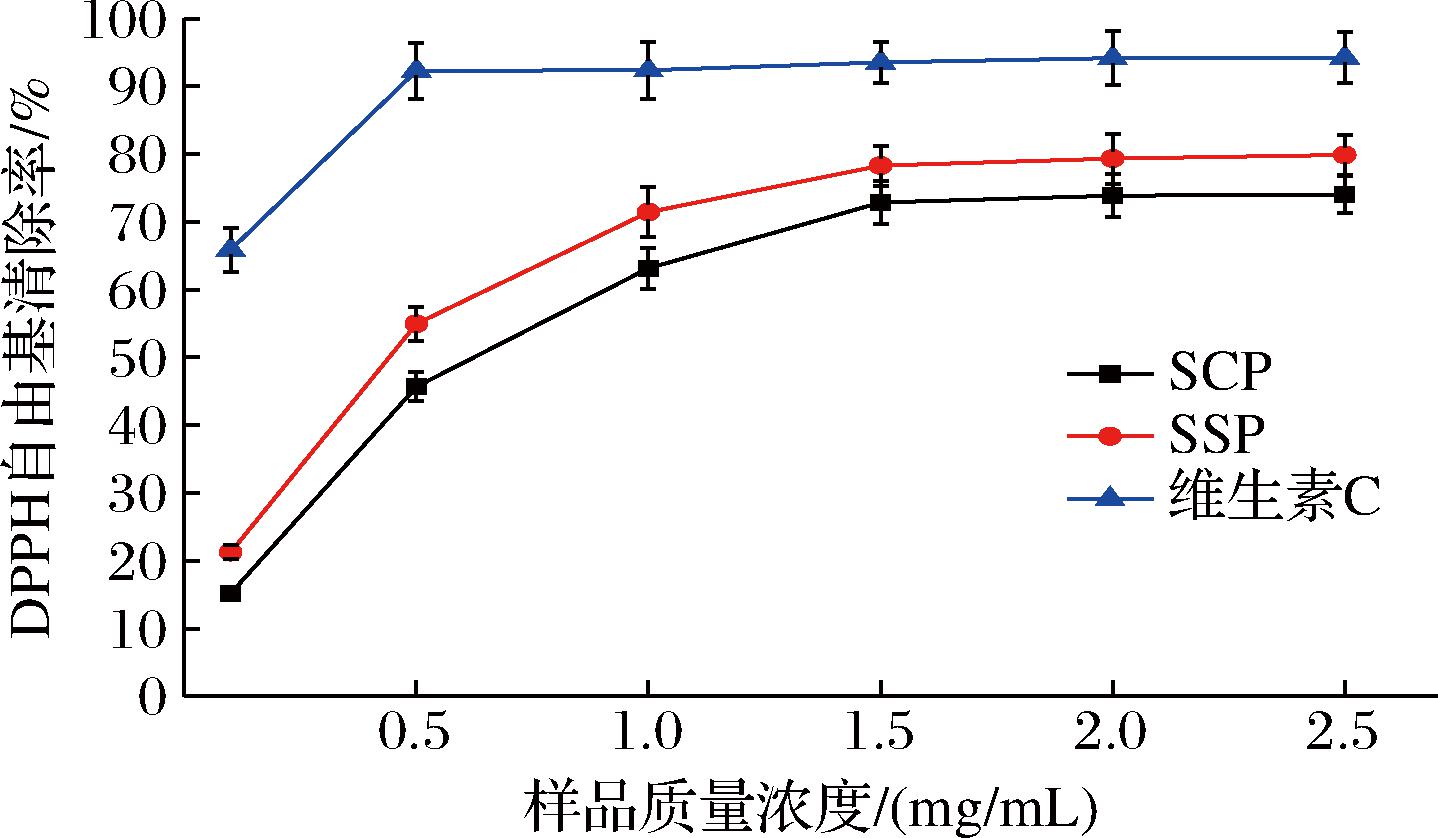
图3 SCP和SSP的DPPH自由基清除能力
Fig.3 DPPH free radical scavenging ability of SCP and SSP
2.1.4 ABTS阳离子自由基清除能力
在氧化剂作用下,ABTS被氧化成稳定的蓝绿色ABTS阳离子自由基[17-18]。当具有抗氧化活性的物质与ABTS阳离子自由基反应后,在734 nm处的吸光度降低,则说明该化合物具有ABTS阳离子自由基清除活性,吸光值越低则其清除率越高。由图4可知,在0.1~1.5 mg/mL,ABTS阳离子自由基被SSP清除能力随着样品浓度的增大而增强,且明显高于SCP,在1.5 mg/mL时趋向于平缓,此时清除能力接近阳性对照组维生素C的清除能力,当质量浓度为2.5 mg/mL 时达到最大值为 89.56%。SCP、SSP的IC50值分别为1.59、0.54 mg/mL,与SCP相比,SSP具有相对优良的自由基清除能力,可作为一种潜在的抗氧化剂。
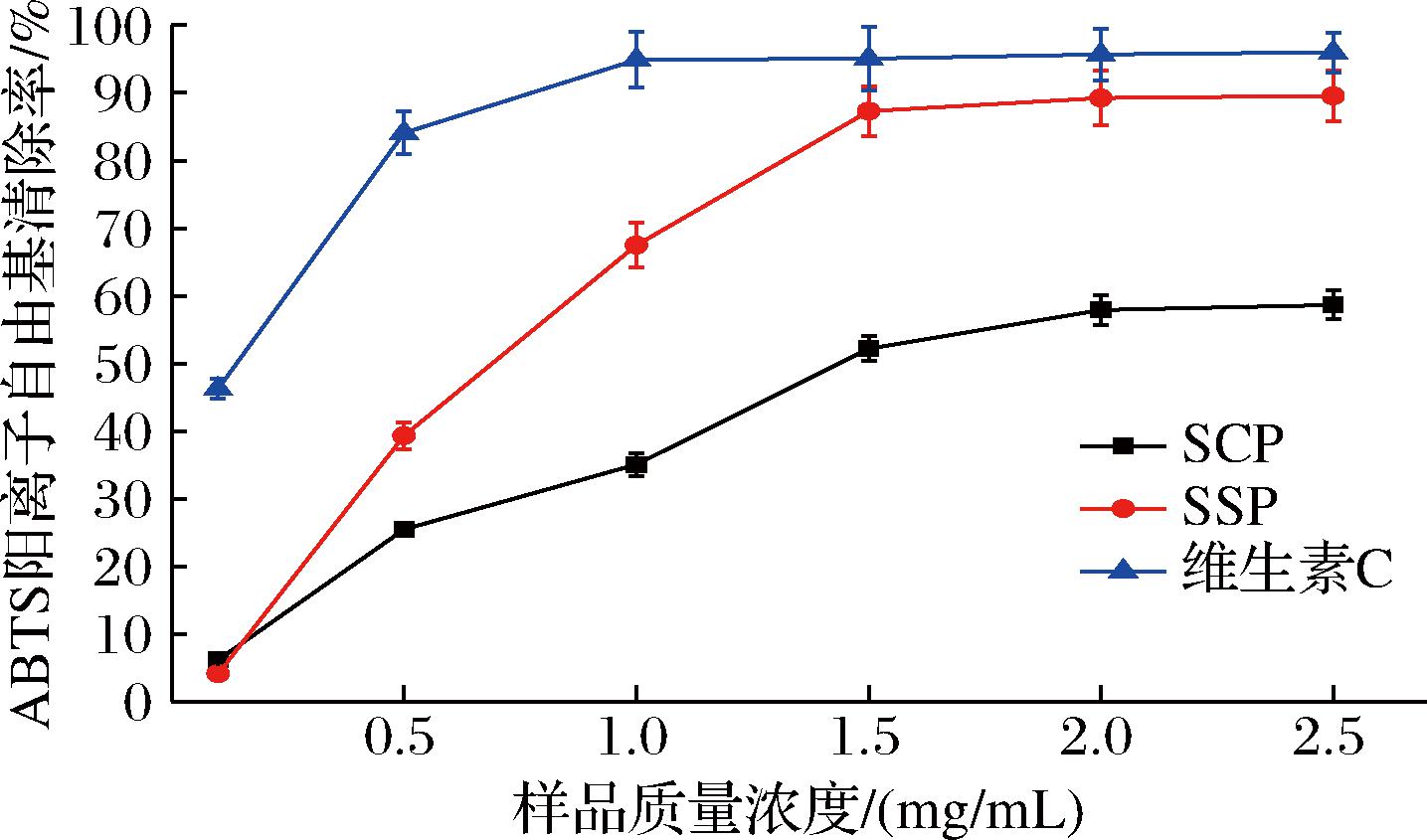
图4 SCP和SSP的ABTS阳离子自由基清除能力
Fig.4 ABTS cation free radical scavenging ability of SCP and SSP
2.2 还原能力
2.2.1 Fe2+螯合能力
Fe2+作为一种过渡态金属离子中最为强大的助氧化剂,通过Fenton反应或Haber-Weiss反应产生·OH。因此,具有Fe2+螯合能力的物质就能间接抑制·OH的产生,进而发挥抗氧化活性[19]。如图5所示,在0.1~2.0 mg/mL,SCP与SSP的Fe2+螯合能力随着样品浓度的增大而增强,且SSP的Fe2+螯合能力始终高于SCP,当质量浓度为2.5 mg/mL时,SSP的Fe2+螯合率达到最高为37.48%,SCP的Fe2+螯合率为31.61%。由此表明,SCP和SSP具有一定的Fe2+螯合能力,且SSP的Fe2+螯合能力优于SCP。蛋白质的金属离子螯合能力可以通过与带电荷的氨基酸残基之间发生静电作用来实现,也可能在空间结构上通过俘获过渡态金属离子的作用来完成,SSP这种作用优于SCP。因此SSP更适合作为一种相对优良的还原剂,通过螯合金属离子,间接阻止自由基的形成,从而达到抗氧化的目的。
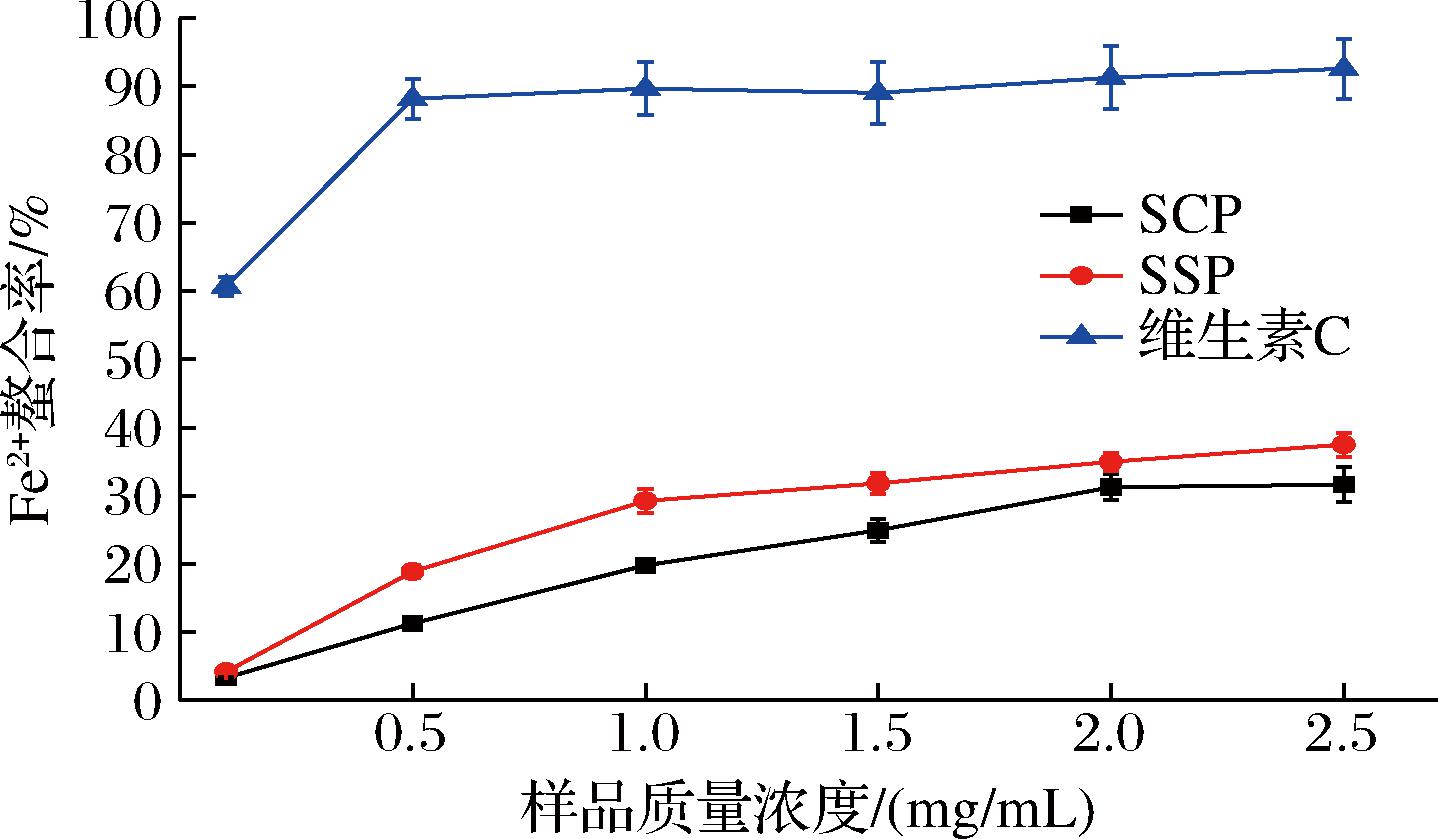
图5 SCP和SSP的Fe2+螯合能力
Fig.5 Fe2+ chelating ability of SCP and SSP
2.2.2 Fe3+还原能力
抗氧化物质通过自身的还原作用给出电子从而达到清除自由基的目的。因此测定还原能力可以评估抗氧化剂提供电子或氢原子的潜力。还原能力测定是以普鲁士蓝生成量为指标,样品将铁氰化钾的三价铁还原成亚铁氰化钾的二价铁,Fe3+与亚铁氰化钾可以发生反应,产生普鲁士蓝[20]。因此样品的还原能力可以通过测定 700 nm 处的吸光值间接来体现。吸光值越大,表明样品还原能力越强。由图6可知,SSP的Fe3+还原能力优于SCP,可能由于原料不同导致其碱液提取暴露出来的抗氧化肽含量存在差异。在0.1~1.5 mg/mL,SCP与SSP的Fe3+还原能力随着样品浓度的增大而增强,在2.0 mg/mL时还原能力几乎达到最高,分别为0.44和0.79,因此SSP表现出更强的还原能力。
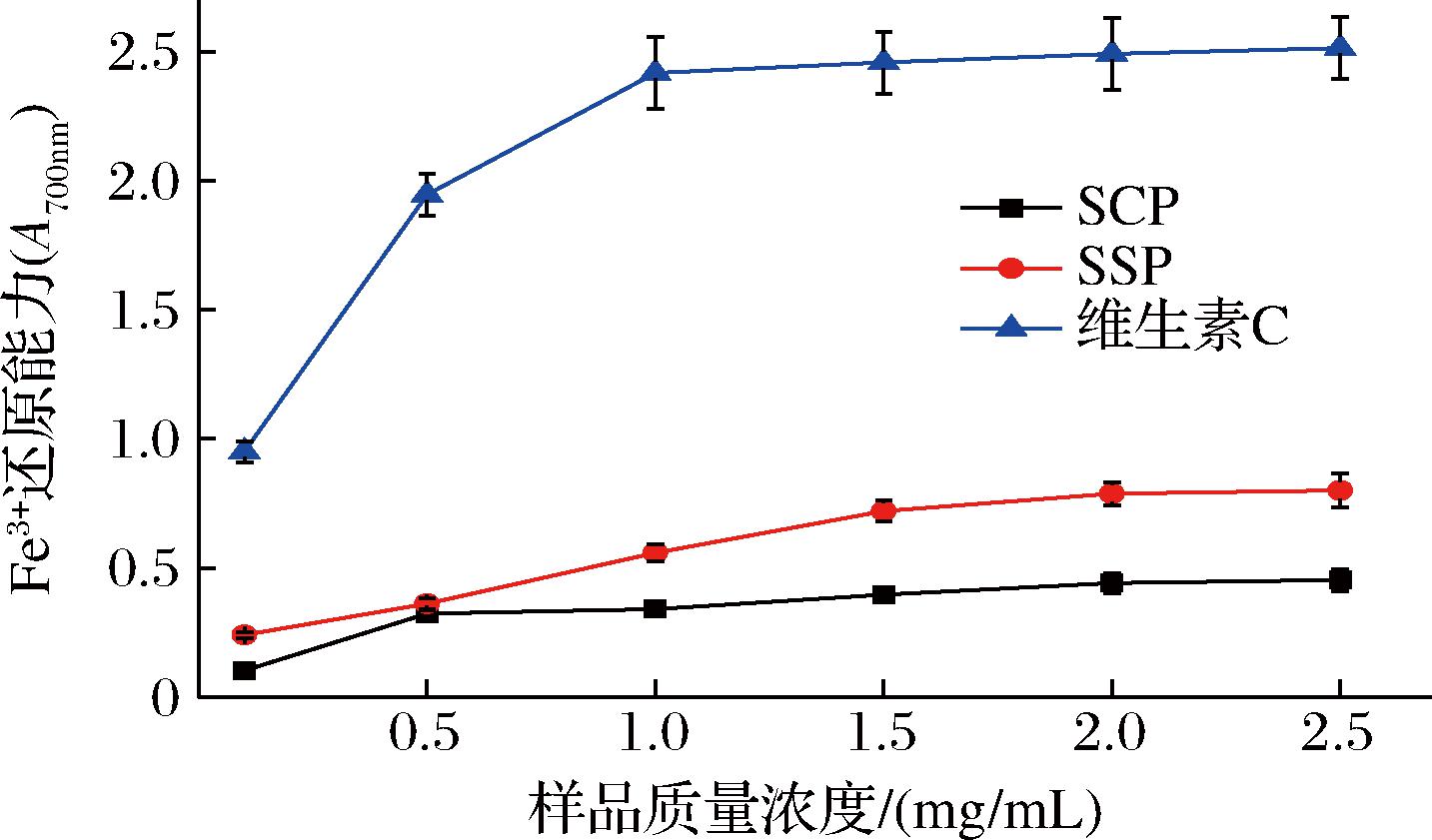
图6 SCP和SSP的Fe3+还原能力
Fig.6 Fe3+ reduction ability of SCP and SSP
2.3 HepG2细胞氧化应激修复作用
2.3.1 SCP与SSP对 HepG2细胞存活率的影响
如图7所示,当样品质量浓度在400 μg/mL时,SSP处理细胞活力最高,对于SCP,当样品质量浓度>300 μg/mL时,细胞活力开始下降,说明HepG2细胞在超过该浓度下受损,但存活率几乎都在90%以上,为该条件下细胞的正常存活率。考虑到SCP和SSP对细胞氧化应激模型的调节作用可能与剂量有关,同时为了研究不同浓度的SCP和SSP对细胞抗氧化能力的影响,选择3种质量浓度(100、200、400 μg/mL)的SCP和SSP进行进一步研究。
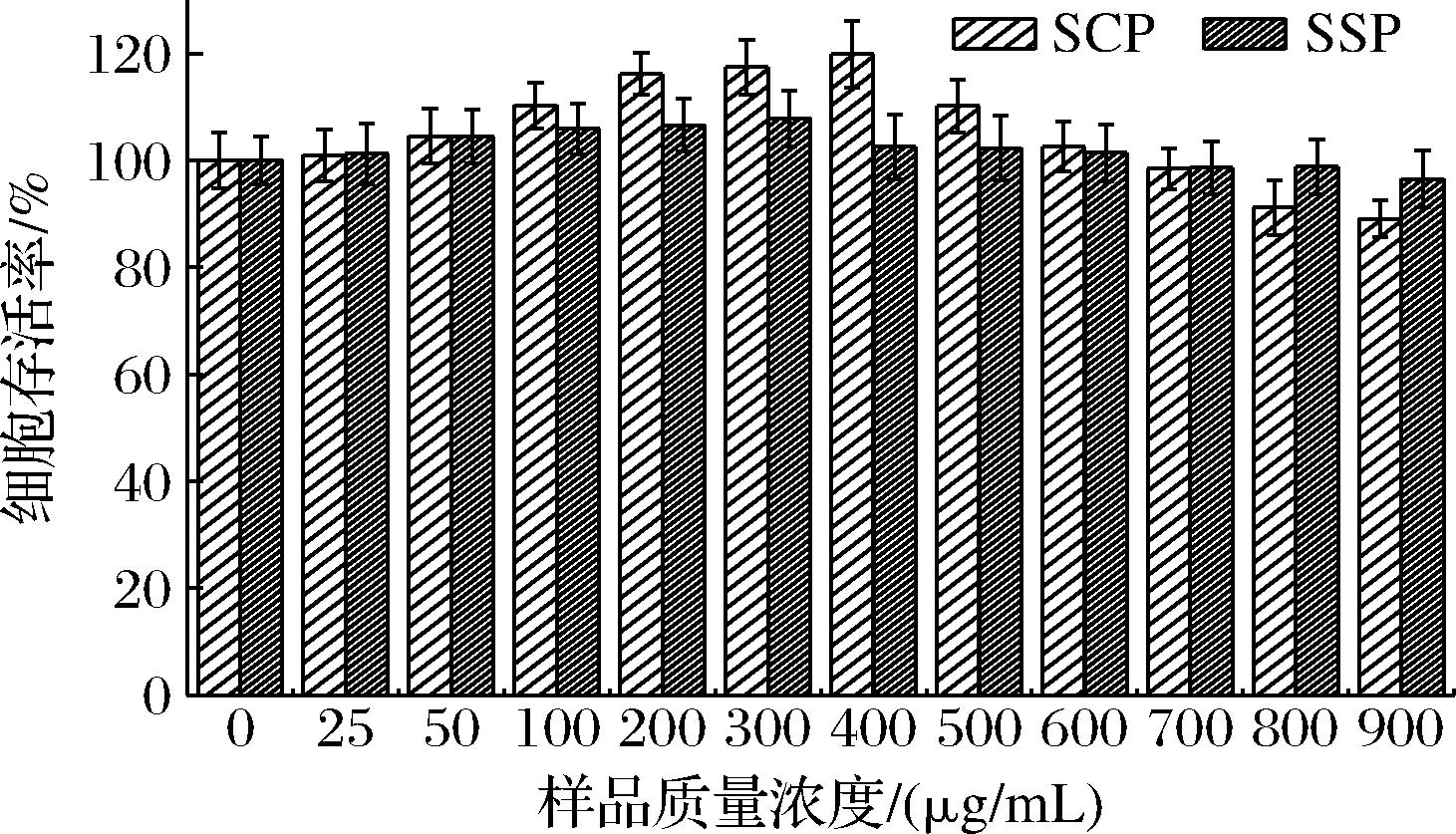
图7 SCP和SSP对HepG2细胞存活率的影响
Fig.7 Effect of SCP and SSP on the survival rate of HepG2 cells
2.3.2 H2O2对HepG2细胞损伤、细胞活力测定
H2O2是引起细胞发生氧化应激的主要因素,是细胞内最常用的氧自由基生成剂,它可以通过细胞膜渗透到细胞内部,产生其他自由基,主要是·O2-和·OH。由此产生的过量ROS将攻击生物分子,导致细胞或组织损伤,因此常作为体外氧化应激损伤的造模剂[21]。如图8所示,在低浓度时H2O2对HepG2细胞损伤较轻,而浓度过大又会对细胞造成不可逆转的损伤,所以一般应选择细胞存活率为50%~70%时的H2O2浓度,此时细胞既氧化损伤,又具有一定的恢复能力,因此选用500 μmol/L的H2O2干预2 h作为其造模条件用于后续研究。
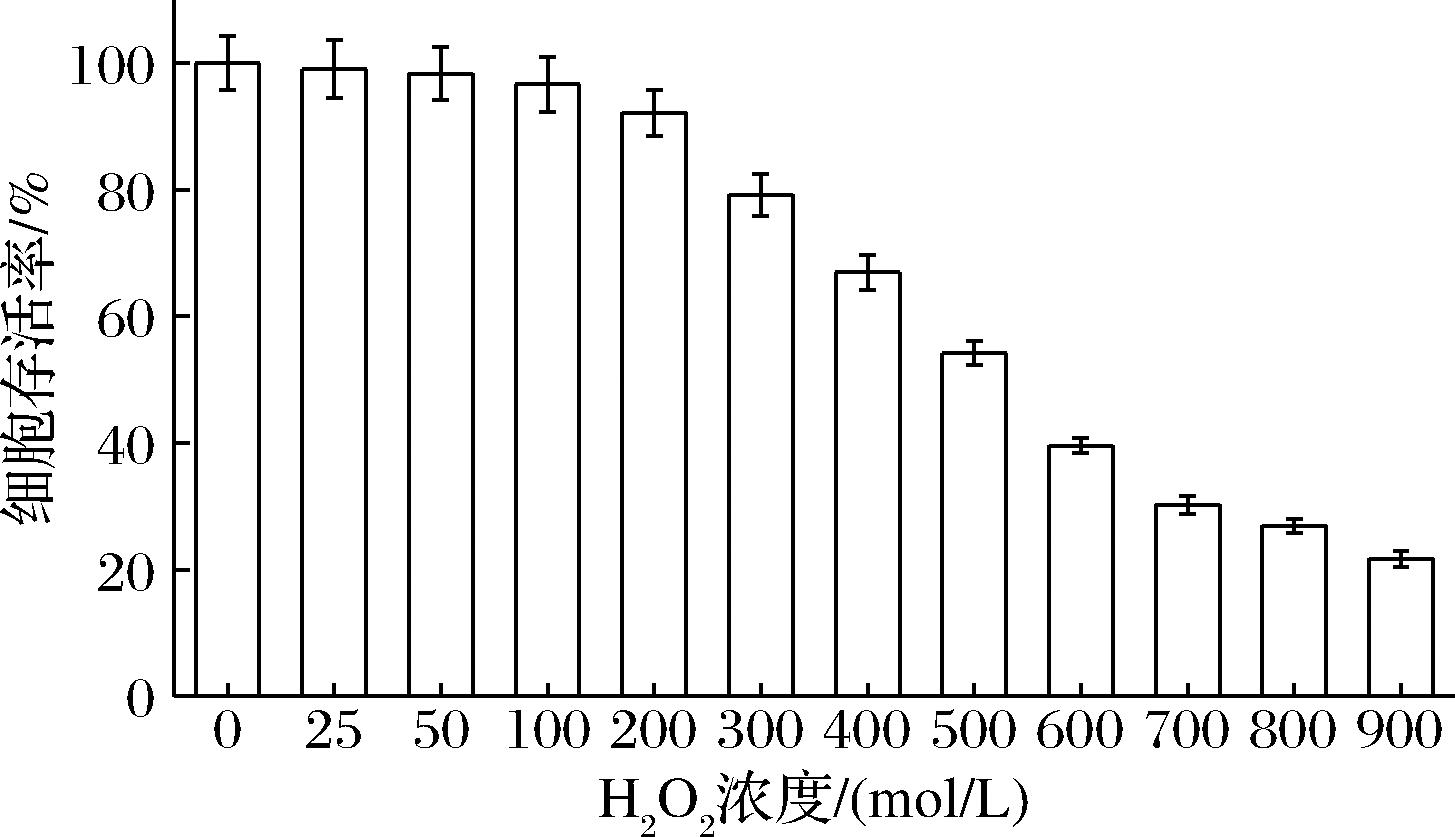
图8 不同浓度 H2O2对 HepG2细胞存活率的影响
Fig.8 Effect of different concentration of H2O2on the survival rate of HepG2 cells
2.3.3 SCP与SSP对 H2O2诱导HepG2细胞氧化应激损伤修复作用
细胞存活率是体现外界因素对细胞损伤程度的最直观指标。细胞遭受氧化应激后会使胞内ROS水平升高,对HepG2细胞造成氧化损伤进而诱导细胞凋亡甚至坏死。细胞存活率越高,说明HepG2细胞受到的氧化损伤越轻[22]。如图9所示,与空白组相比,模型组细胞存活率显著降低,只有56.71%,这表明H2O2诱导HepG2细胞构建的氧化应激模型成功。与模型组相比,经过100、200、400 μg/mL SCP与SSP处理HepG2细胞24 h后,细胞的存活率随着浓度增加显著升高(P<0.05)。其中,在测定的浓度范围内,SSP处理后的细胞存活率始终高于SCP,400 μg/mL时接近阳性对照组修复效果。实验结果表明,SCP与SSP在一定程度上可以对H2O2所造成的细胞损伤产生修复作用,且SSP对H2O2诱导HepG2细胞氧化应激损伤修复作用效果优于SCP。
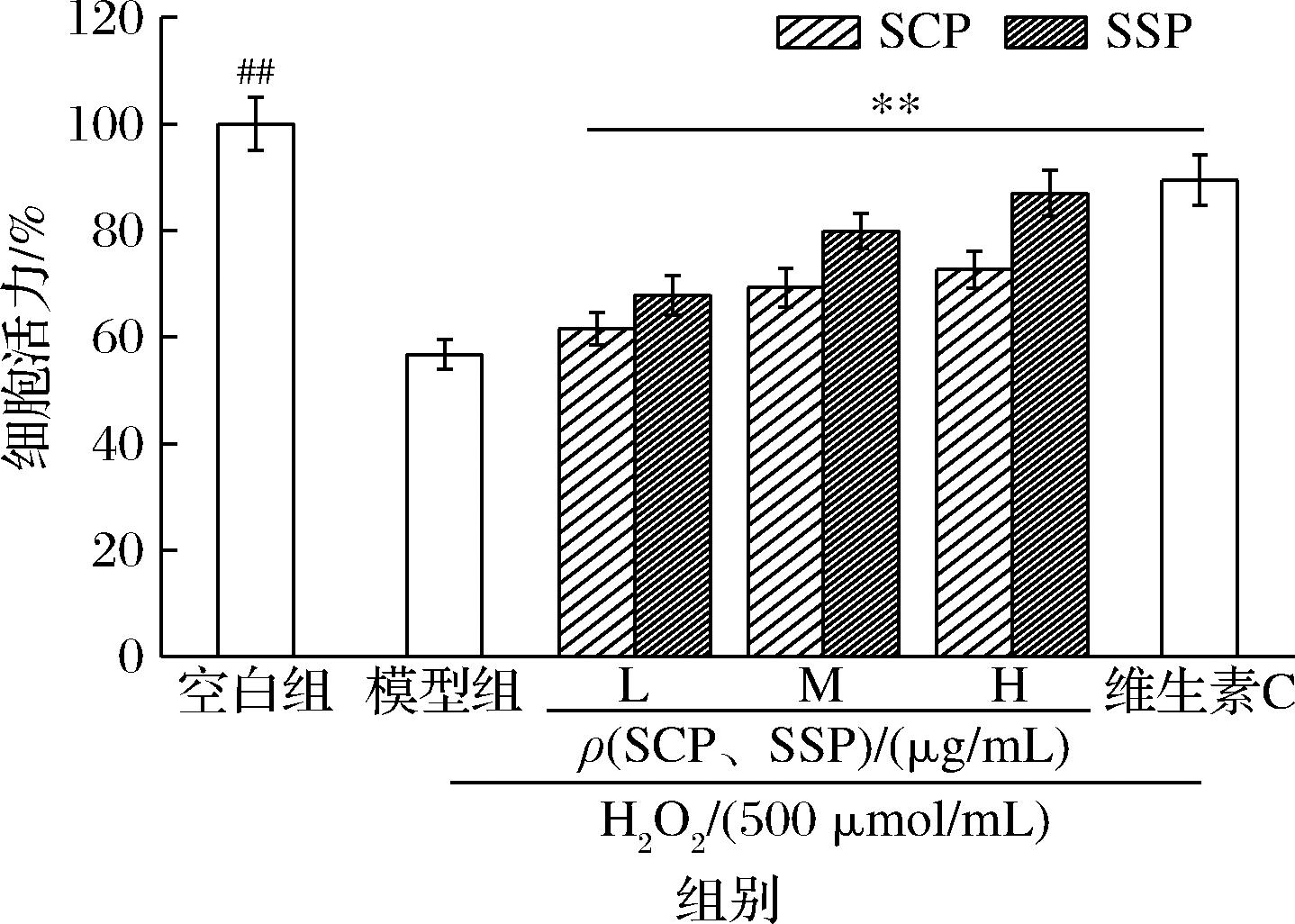
图9 不同浓度SCP与SSP对 H2O2诱导HepG2细胞氧化应激损伤修复作用
Fig.9 Effects of different concentrations of SCP and SSP on H2O2-induced oxidative stress injury and repair in HepG2 cells
注:#和*表示与模型组相比,差异性显著,L、M、H分别为100、200、400 μg/mL(下同)。
2.3.4 Calcein-AM/PI双色荧光凋亡染色
Calcein-AM仅对活细胞染色,使细胞质呈现绿色荧光,作为核染色染料的PI不会染色质膜完整的活细胞,仅对死细胞的细胞核染色[23-24]。如图10所示,与正常组相比,模型组细胞皱缩且细胞密度较低,绿色荧光较弱,红色细胞核相对明显,说明H2O2诱导HepG2细胞氧化应激后,促进细胞发生凋亡。然而,与模型损伤组相比,加入不同浓度的SCP与SSP后,绿荧光强度均有所提高,死细胞的细胞核红色荧光强度降低,且加入的SCP与SSP浓度越高,显示的绿色荧光强度越高,红色荧光强度越低,并显示出浓度依赖性效应。因此,SCP和SSP可以修复HepG2细胞受H2O2引起的形态学变化,并且SSP修复效果优于SCP。
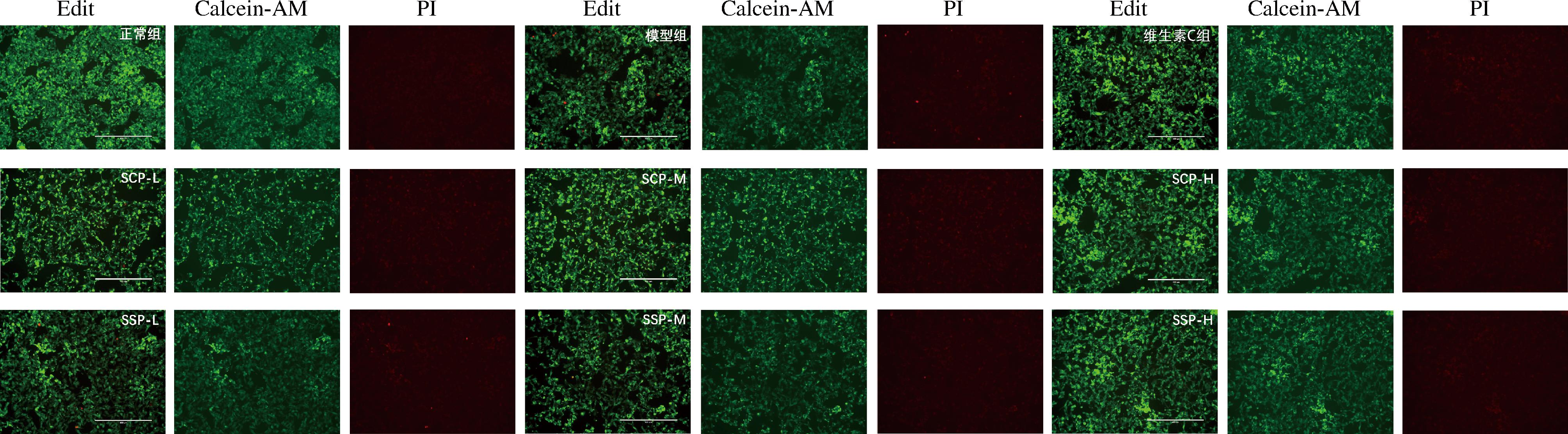
图10 Calcein-AM/PI双色荧光染色结果
Fig.10 Calcein-AM/PI double color fluorescence staining results
2.3.5 SCP与SSP对H2O2诱导HepG2细胞内ROS水平的影响
正常细胞内ROS生成和清除处于动态平衡。在外界刺激时胞内ROS升高,过量ROS会对细胞的核酸、蛋白质、生物膜造成氧化损伤,导致细胞内氧化还原稳态的改变,发生氧化应激现象,进而诱导细胞损伤和凋亡[25]。DCFH-DA荧光探针穿过质膜到达细胞质时,被胞内酯酶水解成成无荧光的DCFH,DCFH被细胞内的ROS氧化成DCF,可以产生绿色荧光。因此,细胞中的ROS水平可以通过荧光强度来显示。如图11、图12所示,与正常组相比,模型组的DCF荧光强度和ROS含量显著提高(P<0.05),ROS生成量是正常组的5.99倍,说明细胞遭受严重的氧化应激。加入了不同浓度的SCP与SSP后的DCF荧光强度和ROS含量与模型组相比均显著降低(P<0.05),且加入的SCP与SSP浓度越高,显示的荧光强度和ROS含量越低。其中在测定浓度范围内,SCP的DCF荧光强度和ROS含量始终高于SSP。实验结果表明,SCP与SSP能够以降低H2O2诱导HepG2细胞内ROS含量,从而发挥其抗氧化应激的功能,对细胞的氧化应激损伤起到一定的修复作用,且SSP对氧化应激损伤细胞内过量ROS的清除作用优于SCP。

图11 不同浓度SCP与SSP对H2O2诱导HepG2细胞胞内ROS水平荧光染色
Fig.11 Fluorescence staining of ROS levels in HepG2 cells induced by H2O2 with different concentrations of SCP and SSP
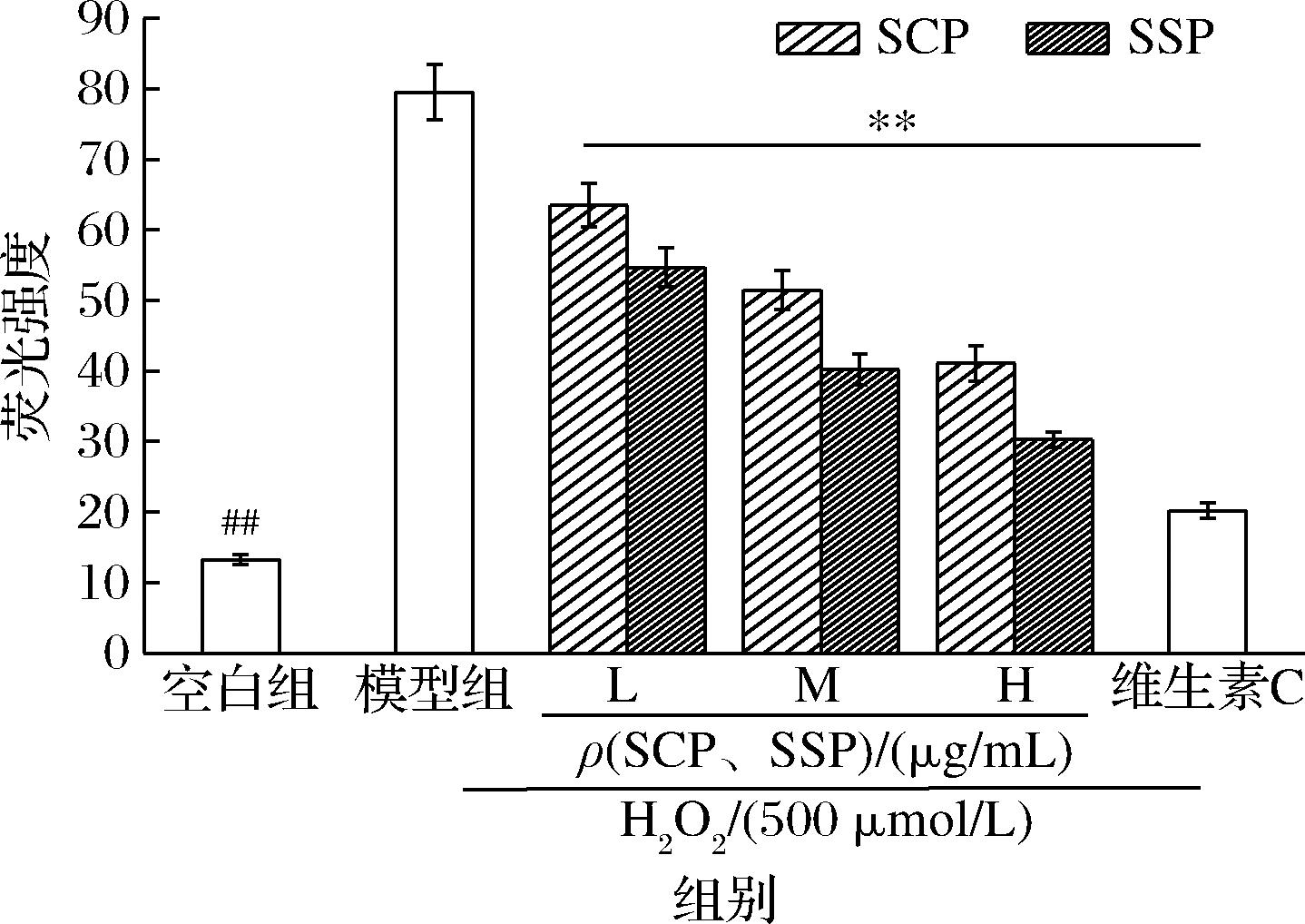
图12 不同浓度 SCP与SSP对H2O2诱导HepG2细胞内ROS水平的影响
Fig.12 Effects of different concentrations of SCP and SSP on intracellular ROS level of HepG2 cells induced by H2O2
2.3.6 SCP与SSP对H2O2诱导HepG2细胞GSH、MDA水平的影响
GSH是生物体内绝大多数细胞中巯基的主要来源,其中在肝细胞中可达95%以上,是一种内源性抗氧化剂,可有效清除体内脂质过氧化物,是机体抗自由基的主要成分,在维持机体氧化还原平衡和免疫功能中发挥重要的作用[26-28];ROS水平过高可引起脂质过氧化,直接增加MDA水平。MDA是由过氧化物多不饱和脂肪酸(主要是花生四烯酸)裂解形成的三碳化合物,被认为是脂质过氧化的主要产物之一。此外,过量的MDA对肿瘤形成、细胞代谢紊乱和细胞膜功能障碍有负面影响。因此,MDA的多少直接反映了体内过氧化的程度,间接反映了细胞损伤的程度。MDA含量越高,氧化应激损伤越严重[29]。
如图13所示,与空白组相比,H2O2诱导2 h后,HepG2细胞GSH显著降低,MDA的含量显著升高(P<0.05),模型组MDA水平显著升高表明细胞受到过量的ROS刺激后,细胞膜发生严重损伤。与模型组相比,经过不同质量浓度(100、200、400 μg/mL)SCP与SSP处理氧化损伤的HepG2细胞24 h后,细胞内GSH含量显著升高,MDA含量显著降低(P<0.05),并且在400 μg/mL时,MDA含量接近阳性对照组维生素C,分别为4.83、5.2 nmol/mL,结果与清除ROS的能力一致,而SSP处理后的GSH含量高于维生素C组,这说明经H2O2诱导后,SSP对HepG2的细胞膜损伤产生更好的修复作用。SCP和SSP能显著对细胞膜脂质氧化损伤起到改善作用,自由基对机体的氧化应激损伤得到较好的修复作用。

a-GSH;b-MDA
图13 不同浓度 SCP与SSP对H2O2诱导HepG2细胞GSH、MDA水平的影响
Fig.13 Effects of different concentrations of SCP and SSP on GSH and MDA in HepG2 cells induced by H2O2
结果表明,SSP对HepG2细胞遭受氧化应激后降低MDA和提升GSH含量能力优于SCP,在高浓度下,SSP和标准抗氧化剂维生素C的抗氧化活性接近。基于上述结果,从南、北五味子中提取的蛋白质通过减少ROS的产生来阻止H2O2诱导的MDA积累,并且有效提升GSH含量。其中,SSP表现出更强的修复作用,可能是SSP侧链上存在着更多的电子/质子供体基团,具有更强的自由基清除能力,从而对HepG2细胞氧化损伤起到更好的修复作用,与马萍等[30]研究的紫花芸豆肽对H2O2诱导HepG2细胞氧化应激损伤修复作用的结果一致。
2.3.7 SCP与SSP对H2O2诱导HepG2细胞抗氧化物酶系活力的影响
SOD、CAT和GSH-Px均为细胞抗氧化物酶系中的重要组成部分,在氧化应激状态下,这些抗氧化酶会作为内源性抗氧化剂在细胞内清除自由基来抑制过氧化反应。SOD催化·O2-分解为H2O2和O2,进而清除自由基[31];CAT通过清除体内产生的过量自由基,催化H2O2分解为H2O,维持机体氧化还原平衡[32-33];GSH-Px能催化GSH变为氧化型谷胱甘肽,将过氧化物还原成羟基化合物,与CAT促进H2O2分解,以保护细胞膜结构与功能[34]。体内抗氧化物酶系活力是生物氧化应激条件下细胞动态平衡的重要指标。
如图14所示与正常组相比,H2O2作用HepG2细胞2 h后,SOD、CAT和GSH-Px活力均显著降低(P<0.05),抑制率分别为44.80%、54.25%和48.23%,说明H2O2干扰了机体内的抗氧化剂调节机制,降低细胞内抗氧化酶系的活力,不足以应付外界刺激,细胞受到严重的氧化应激损伤;与模型组相比,经维生素C和SCP与SSP低、中和高剂量处理组的SOD、CAT和GSH-Px活力均显著升高(P<0.05),特别是高剂量的SSP作用24 h后,SOD、CAT和GSH-Px活力分别提升了53.33、125.34、182.35 U/mL,表明SSP表现出更好的抗氧化能力。SCP和SSP可以通过酶促抗氧化系统对H2O2诱导的HepG2细胞氧化应激产生修复作用,SSP比SCP表现出更加优良的提升抗氧化酶系的能力,这可能由于SSP侧链存在更多的氨基酸残基,发挥出更好的提供氢或质子的作用,这与郭增旺等[35]的研究结果相似。
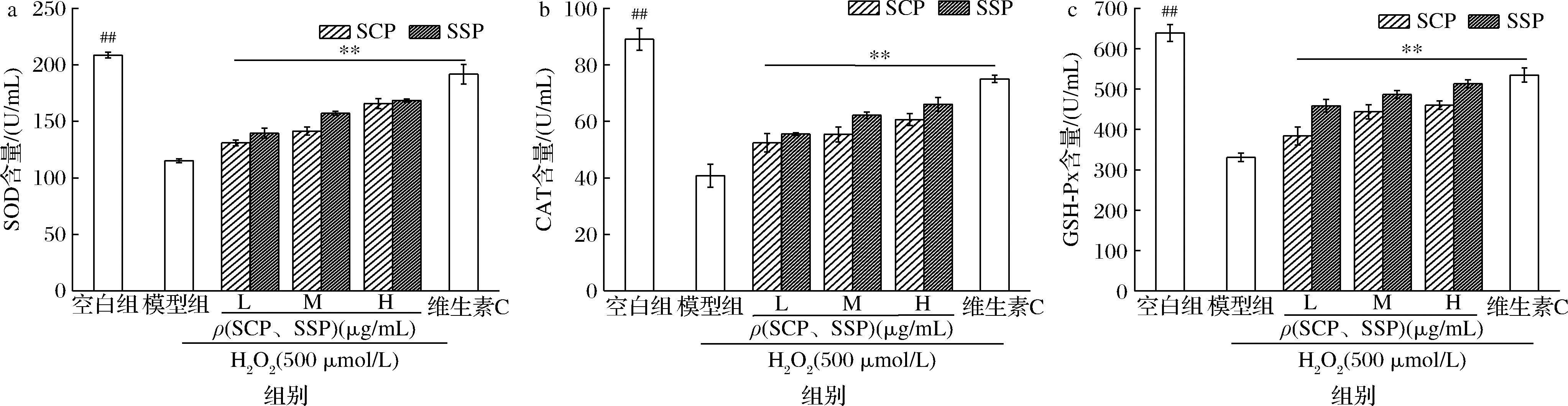
a-SOD含量;b-CAT含量;c-GSH-Px含量
图14 不同浓度 SCP与SSP对H2O2诱导HepG2细胞抗氧化物酶系活力的影响
Fig.14 Effects of different concentrations of SCP and SSP on antioxidant enzyme activity of HepG2 cells induced by H2O2
3 结论
本研究以SSP、SCP为研究对象,基于前期对SCP的研究基础,首次应用经典化学法结合细胞验证,比较了同属不同种的五味子蛋白体外清除自由基能力和还原能力,以H2O2诱导HepG2细胞构建氧化应激损伤模型,研究了SSP、SCP对细胞存活率、细胞形态、ROS水平、GSH含量、MDA水平和抗氧化酶系活力的影响。体外抗氧化实验表明SSP具有更强的自由基清除能力和还原能力。对于H2O2所引起的HepG2细胞氧化应激,SCP和SSP显著提升细胞存活率,在一定程度上可以改善细胞氧化应激后的形态,减少细胞凋亡。SCP和SSP可以有效抑制细胞中ROS和MDA水平,维持细胞膜系统稳定性,增加GSH含量和恢复抗氧化酶系活力,尤其SSP作用效果更好。综上所述,本研究可为SCP和SSP在抗氧化功能性保健食品和健康产品中的开发提供科学依据,并为后续阐明其修复氧化应激损伤的调控机制奠定理论基础。
[1] 吴金姗, 黄榕, 刘树英, 等.玉簪多糖对细胞氧化应激损伤的保护作用机制[J].食品科学, 2022, 43(17):138-146.
WU J S, HUANG R, LIU S Y, et al.Protective mechanism of polysaccharide from Hosta ventricosa against oxidative damage in cells[J].Food Science, 2022, 43(17):138-146.
[2] DEVI A, DWIBEDI V, KHAN Z A.Natural antioxidants in new age-related diseases[J].Revista Brasileira De Farmacognosia, 2021, 31(4):387-407.
[3] 江连洲, 田甜, 朱建宇, 等.植物蛋白加工科技研究进展与展望[J].中国食品学报, 2022, 22(6):6-20.
JIANG L Z, TIAN T, ZHU J Y, et al.Research progress on plant protein processing science and technology[J].Journal of Chinese Institute of Food Science and Technology, 2022, 22(6):6-20.
[4] 张雯雯, 张艳妮, 杨丽荣, 等.4种天然物质抗氧化能力的研究[J].食品研究与开发, 2022, 43(2):43-50.
ZHANG W W, ZHANG Y N, YANG L R, et al.Study of the antioxidant capacities of four natural substances[J].Food Research and Development, 2022, 43(2):43-50.
[5] GROSSMANN L, WEISS J.Alternative protein sources as technofunctional food ingredients[J].Annual Review of Food Science and Technology, 2021, 12:93-117.
[6] 乔杨波, 庄蕾, 黄伟华, 等.植物蛋白多肽的研究进展[J].中国调味品, 2021, 46(5):175-178;197.
QIAO Y B, ZHUANG L, HUANG W H, et al.Research progress of plant protein polypeptides[J].China Condiment, 2021, 46(5):175-178;197.
[7] 李敏, 岳晓华, 薛慧清, 等.响应面法优化黄芪蛋白水解工艺及其抗氧化活性研究[J].食品安全质量检测学报, 2021, 12(14):5758-5765.
LI M, YUE X H, XUE H Q, et al.Optimization of Astragalus membranaceus protein hydrolysis process by response surface methodology and its antioxidant activity[J].Journal of Food Safety &Quality, 2021, 12(14):5758-5765.
[8] 刘苏伟, 张骆琪, 高素霞, 等.不同品种山药多糖含量及体外抗氧化活性研究[J].中华中医药杂志, 2019, 34(12):5938-5941.
LIU S W, ZHANG L Q, GAO S X, et al.Study on polysaccharide content and antioxidant activity in vitro of different varieties of Dioscoreae Rhizoma[J].China Journal of Traditional Chinese Medicine and Pharmacy, 2019, 34(12):5938-5941.
[9] 刘鹏, 李达, 纪海玉, 等.枸杞多糖的提取及其体外抗氧化活性[J].食品研究与开发, 2022, 43(10):111-116.
LIU P, LI D, JI H Y, et al.Purification and antioxidant activity characterization of fructus lycii polysaccharides[J].Food Research and Development, 2022, 43(10):111-116.
[10] SHAO S, WANG M X, ZHANG H Y, et al.Antifatigue activity of glycoprotein from Schisandra chinensis functions by reducing oxidative stress[J].Evidence-Based Complementary and Alternative Medicine:ECAM, 2020, 2020:4231340.
[11] 王海东, 韩荣欣, 张红印, 等.Osborne法分级提取五味子蛋白及抗氧化活性比较[J].食品工业科技, 2021, 42(23):59-65.
WANG H D, HAN R X, ZHANG H Y, et al.Extraction of Schisandra chinensis protein by Osborne method and its antioxidant activity[J].Science and Technology of Food Industry, 2021, 42(23):59-65.
[12] 邢楠楠, 屈怀东, 任伟超, 等.五味子主要化学成分及现代药理作用研究进展[J].中国实验方剂学杂志, 2021, 27(15):210-218.
XING N N, QU H D, REN W C, et al.Main chemical constituents and modern pharmacological action of Schisandrae chinensis fructus:A review[J].Chinese Journal of Experimental Traditional Medical Formulae, 2021, 27(15):210-218.
[13] LIM S, CHOI A H, KWON M, et al.Evaluation of antioxidant activities of various solvent extract from Sargassum serratifolium and its major antioxidant components[J].Food Chemistry, 2019, 278:178-184.
[14] HU X J, MA X Y, TIAN J P, et al.Rapid and facile synthesis of graphene quantum dots with high antioxidant activity[J].Inorganic Chemistry Communications, 2020, 122:108288.
[15] 黄华希, 冯立新, 李金花, 等.苦木不同药用部位抗氧化活性研究[J].饲料研究, 2022, 45(15):67-70.
HUANG H X, FENG L X, LI J H, et al.Study on antioxidant activity from different medicinal parts of Picrasma quassioides[J].Feed Research, 2022, 45(15):67-70.
[16] QIU L Q, ZHANG M, MUJUMDAR A S, et al.Convenient use of near-infrared spectroscopy to indirectly predict the antioxidant activitiy of edible rose (Rose chinensis Jacq “Crimsin Glory” H.T.) petals during infrared drying[J].Food Chemistry, 2022, 369:130951.
[17] TAYADE K, YEOM G S, SAHOO S K, et al.Exploration of molecular structure, DFT calculations, and antioxidant activity of a hydrazone derivative[J].Antioxidants, 2022, 11(11):2138.
[18] DONG Y, YAN W, ZHANG Y Q.Effects of spray drying and freeze drying on physicochemical properties, antioxidant and ACE inhibitory activities of bighead carp (Aristichthys nobilis) skin hydrolysates[J].Foods, 2022, 11(14):2083.
[19] KORCZEK K R, TKACZEWSKA J, DUDA I, et al.Effect of heat treatment on the antioxidant and antihypertensive activity as well as in vitro digestion stability of mackerel (Scomber scombrus) protein hydrolysates[J].Journal of Aquatic Food Product Technology, 2020, 29(1):73-89.
[20] TADESSE A, BELACHEW N, HAGOS M, et al.Synthesis of fluorescent nitrogen and phosphorous Co-doped carbon quantum dots for sensing of iron, cell imaging and antioxidant activities[J].Journal of Fluorescence, 2021, 31(3):763-774.
[21] AL-OQAIL M M, FARSHORI N N, AL-SHEDDI E S, et al.Petroselinum sativum protects HepG2 cells from cytotoxicity and oxidative stress induced by hydrogen peroxide[J].Molecular Biology Reports, 2020, 47(4):2771-2780.
[22] HUANG J, HUANG A, POPLAWSKI A, et al.PAK2 activated by Cdc42 and caspase 3 mediates different cellular responses to oxidative stress-induced apoptosis[J].Biochimica et Biophysica Acta.Molecular Cell Research, 2020, 1867(4):118645.
[23] 饶秀茸, 崔博婧, 付凡, 等.Calcein-AM/PI双染法结合流式细胞术检测γδT细胞毒性的方法[J].免疫学杂志, 2016, 32(7):620-625.
RAO X R, CUI B J, FU F, et al.Methodology for detection of γδT-cell cytotoxicity by Calcein-AM/PI double-labeling coupling with flow cytometry[J].Immunological Journal, 2016, 32(7):620-625.
[24] CHU Q, JIA R Y, CHEN C W, et al.Apios americana Medik leaf extracts attenuate H2O2-induced hepatotoxicity[J].Food Bioscience, 2021, 41:100996.
[25] 赵丹, 刘晓兰, 郑喜群, 等.豌豆蛋白水解物体外及对HepG2细胞的抗氧化活性[J].食品与发酵工业, 2023, 49(11):170-177.
ZHAO D, LIU X L, ZHENG X Q, et al.Antioxidant activity of pea protein hydrolysates in vitro and on HepG2 cells[J].Food and Fermentation Industries, 2023, 49(11):170-177.
[26] 赵丽云, 刘爱莲, 刘美玉, 等.硫辛酸和白藜芦醇在对乙酰氨基酚致HepG2细胞损伤中的抗氧化作用[J].食品科学, 2020, 41(7):153-158.
ZHAO L Y, LIU A L, LIU M Y, et al.Comparative protective effect of lipoic acid and resveratrol on acetaminophen-induced cellular oxidative damage in HepG2 cells[J].Food Science, 2020, 41(7):153-158.
[27] 陶叶杏, 余倩, 刘瑞婷, 等.广陈皮中黄酮类化合物提取物对t-BHP诱导HepG2细胞氧化损伤保护作用机制[J].华中农业大学学报, 2022, 41(5):161-168.
TAO Y X, YU Q, LIU R T, et al.Protective mechanism of flavonoids extracts from Pericarpium Citri Reticulatae ‘Chachi’ on t-BHP-induced oxidative damage in HepG2 cells[J].Journal of Huazhong Agricultural University, 2022, 41(5):161-168.
[28] 朱琪, 吴雅雯, 王晓慧, 等.玉竹多糖对酒精诱导的HepG2细胞损伤的保护作用及其机制[J].中国应用生理学杂志, 2022, 38(3):227-232.
ZHU Q, WU Y W, WANG X H, et al.Protective effects of Polygonatum odoratum polysaccharides on alcohol-induced injury of HepG2 cells and its mechanisms[J].Chinese Journal of Applied Physiology, 2022, 38(3):227-232.
[29] LI G S, ZHAN J Q, HU L P, et al.Identification of a new antioxidant peptide from porcine plasma by in vitro digestion and its cytoprotective effect on H2O2 induced HepG2 model[J].Journal of Functional Foods, 2021, 86:104679.
[30] 马萍, 程天赋, 郭增旺, 等.紫花芸豆肽修复H2O2对HepG2细胞的氧化应激损伤[J].食品科学, 2020, 41(1):175-182.
MA P, CHENG T F, GUO Z W, et al.Cytoprotective effect of Phaseolus vulgaris peptides against H2O2-induced oxidative damage in HepG2 cells[J].Food Science, 2020, 41(1):175-182.
[31] 潘聪, 张大力, 段盛林, 等.高核苷酸酵母水解物调控HepG2细胞氧化损伤作用[J].中国食品学报, 2020, 20(9):10-18.
PAN C, ZHANG D L, DUAN S L, et al.High nucleotide yeast hydrolysate regulates oxidative damage of HepG2 cells[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):10-18.
[32] LI M F, CUI H L, LIU S Y, et al.The antioxidative capacities of Lactobacillus and its potential mechanisms via chemical and cellular assessments[J].International Journal of Food Science &Technology, 2022, 57(11):7340-7348.
[33] HU Y M, LU S Z, LI Y S, et al.Protective effect of antioxidant peptides from grass carp scale gelatin on the H2O2-mediated oxidative injured HepG2 cells[J].Food Chemistry, 2022, 373(Pt B):131539.
[34] LIANG R, CHENG S, DONG Y F, et al.Intracellular antioxidant activity and apoptosis inhibition capacity of PEF-treated KDHCH in HepG2 cells[J].Food Research International, 2019, 121:336-347.
[35] 郭增旺, 樊乃境, 田海芝, 等.小米糠黄酮对H2O2致HepG2氧化应激损伤的保护作用[J].食品科学, 2020, 41(5):159-165.
GUO Z W, FAN N J, TIAN H Z, et al.Protective effects of flavonoids from millet bran on H2O2-induced oxidative stress injury in HepG2 cells[J].Food Science, 2020, 41(5):159-165.