果胶是广泛存在于植物细胞壁中重要的水溶性膳食多糖,通常是以聚半乳糖醛酸(galacturonic acid,GalA)结构为主的复杂天然生物大分子,同时具有高度结构多样性[1],其结构的差异性主要体现在糖醛酸含量、酯化度(degree of esterfication,DE)及中性糖的组成上。苹果(Malus pumila)为蔷薇科苹果属落叶乔木的果实,因营养丰富而利于食用和保健。中医认为苹果有生津、润肺、醒酒、止泻等功效,现代研究还表明苹果具有抗癌作用[2]。苹果果胶(Malus pumila pectin,MP)作为苹果中重要的营养物质之一,作为凝胶剂、稳定剂、乳化剂及增稠剂等广泛应用于食品生产中[3],还具有抗氧化、抗菌等生理活性[4]。
目前,有关MP的研究大多是基于实验室条件下的酸提醇沉提取物,其制备工艺和质量控制尚不及商品化MP,而商品化MP亦缺乏理化特性的表征,除作为食品添加剂应用外,是否具有其他生物活性还有待于进一步研究。基于此,本文以商品化MP为研究对象,分析其理化特性,通过体外抗氧化实验评价MP的抗氧化能力;并利用高脂饮食诱导建立高脂血症大鼠模型,从生化指标和肝脏病理变化初步探讨MP降血脂作用,以期发掘MP结构与其功能活性的关系,拓展MP在生物医药方面的应用范围,为开发调节机体血脂平衡的天然功能性产品提供实验依据。
1 材料与方法
1.1 材料与试剂
MP购于上海源叶生物科技有限公司,批号:Z27F8X29788,含量≥65.8%,样品纯度满足本研究需求。
36只雄性SD大鼠,SPF级,6~8周龄,体重180~220 g,购于新疆医科大学动物实验中心,生产许可证号:SCXK(新)2018-0002。本研究过程中涉及实验动物的处理均符合新疆医科大学伦理委员会要求(批准文号:IACUC-20210405-1)。PMP(1-苯基-3-甲基-5-吡唑啉酮),上海麦克林生化科技有限公司;单糖标准品甘露糖(mannose,Man)、鼠李糖(rhamnose,Rha)、葡萄糖(glucose,Glu)、半乳糖(galactose,Gal)、半乳糖醛酸(galacturonic acid,GalA)、葡萄糖醛酸(glucuronic acid,GluA)、阿拉伯糖(arabinose,Ara),北京博奥拓达科技有限公司;乙腈(色谱纯),美国sigma公司;甲醇(色谱纯),美国Fisher公司;辛伐他汀片,山东鑫齐药业有限公司(批号:20230214);甘油三酯(total triglyceride,TG)测定试剂盒、总胆固醇(total cholesterol,TC)测定试剂盒、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)测定试剂盒、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒,南京建成生物工程研究所;还原性谷胱甘肽(glutathione,GSH)测定试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)测定试剂盒、丙二醛(malondialdehyde,MDA)测定试剂盒、总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒,北京索莱宝;其他化学试剂均为分析纯。
高脂饲料[维持底料49%(质量分数,下同)、胆固醇1.5%、胆酸钠0.5%、果糖20%、维生素混合物2%、磷酸氢钙2%、酪蛋白12%、猪油10%、麻油3%],北京博爱港生物科技有限公司。
1.2 仪器与设备
XPR分析天平,上海梅特勒-托利多仪器有限公司;UV2700紫外-可见分光光度计、IR-Prestige21红外光谱仪,日本岛津;Multiskan GO全波长酶标仪,赛默飞世尔(上海)仪器有限公司;Waters2695- 2998高效液相色谱仪,沃特世科技(上海)有限公司。
1.3 实验方法
1.3.1 分子质量测定
采用高效凝胶渗透色谱法测定果胶样品分子质量分布[5]。色谱条件:RI示差折光检测器;TSK-gel G-5000 PWXL色谱柱(7.5 mm×30 cm);流动相:超纯水;流速0.6 mL/min;柱温30 ℃,进样量10 μL。精密称取MP样品4.0 mg加入2 mL去离子水溶解,经0.45 μm水系微孔滤膜过滤后注入高效凝胶渗透色谱柱分析。同时,利用系列不同分子质量(5、10、40、150、410、2 000 kDa)的Dextran T按上述方法处理,以保留时间为纵坐标,分子质量的对数为横坐标绘制标准曲线。
1.3.2 酯化度测定
精密称取MP 100 mg,乙醇润湿后定容至100 mL。充分溶解后滴加1%酚酞指示剂2滴,用0.1 mol/L NaOH溶液滴定至粉红色,30 s内不变色,记录消耗NaOH的体积V1;然后向溶液中加入20 mL 0.5 mol/L NaOH溶液,室温下搅拌静置15 min后加入20 mL 0.5 mol/L HCl溶液,再继续用0.1 mol/L NaOH溶液滴定至粉红色,30 s内不变色,并记录消耗NaOH溶液的体积V2[6]。按公式(1)计算酯化度:
(1)
1.3.3 糖醛酸含量测定
糖醛酸含量测定采用间羟基联苯法[7]。分别取标准半乳糖醛酸液(100 μg/mL)0.00、0.05、0.10、0.15、0.20、0.25 mL于具塞试管中,去离子水补加至0.25 mL。在冰水浴中预冷后加入1.5 mL四硼酸钠-硫酸试液。振摇混匀,沸水浴加热5 min,冰水浴冷却至室温后,加入25 μL 1.5 g/L间羟基联苯试液。混匀后,在520 nm处测定其吸光度,并绘制标准曲线;另取100 μg/mL的样品0.25 mL按上述方法测定,平行测定3次,根据标准曲线,计算糖醛酸的含量,结果取平均值。按公式(2)计算糖醛酸含量:
(2)
式中:W,样品中糖醛酸含量,%;m,样品中半乳糖醛酸质量,μg;M,样品的质量,μg。
1.3.4 红外光谱分析
精密称取1.0 mg MP与100 mg KBr混合研磨压片,在4 000~400 cm-1进行红外光谱扫描,观察峰谱情况[8]。
1.3.5 单糖组成分析
采用PMP柱前衍生法测定MP样品中的单糖组成[9]。精密称取MP样品4.0 mg于安瓿瓶中,加入2 mL三氟乙酸(2 mol/L),充N2后封管,在110 ℃下水解6 h。冷却至室温,反复加入无水乙醇,70 ℃水浴蒸除三氟乙酸,加入去离子水1 mL并定容至10 mL。取果胶水解液200 μL加入0.5 mol/L PMP甲醇溶液和0.3 mol/L NaOH溶液各200 μL,混匀,在70 ℃水浴锅中反应1.0 h,再加入200 μL 0.3 mol/L HCl溶液,混匀,用CHCl3萃取3次,每次1 mL,弃去下层有机相,保留上层水相,经0.22 μm水系微孔滤膜过滤后注入进样小瓶,得供试品溶液。移取混合单糖标准品200 μL,衍生化操作,HPLC分析。
色谱条件:YMC-Pack ODS-A柱(250 mm×4.6 mm,5 μm),流动相为乙腈(A)-0.1 mol/L乙酸铵溶液(B),检测波长250 nm;流速1.0 mL/min;进样量10 μL;柱温30 ℃;梯度洗脱,洗脱程序见表1。
表1 梯度洗脱程序
Table 1 Gradient elution procedure

时间/min乙腈A/%乙酸铵/%02377121981262179452179
1.3.6 体外抗氧化能力测定
将MP溶于去离子水,配制不同浓度的溶液备用。以相同浓度的维生素C作阳性对照,测定MP对DPPH自由基、ABTS阳离子自由基、羟自由基的清除能力,并测定总抗氧化能力和还原能力[10-12]。
1.3.7 动物分组及给药
36只雄性SD大鼠,适应性喂养1周。将大鼠随机分为6组,每组6只,分别为正常组(NFD)、高脂饮食组(HFD)、辛伐他汀阳性组(PG)、低剂量MP(L-MP)、中剂量MP(M-MP)、高剂量MP(H-MP)。NFD组喂食基础饲料,HFD、PG、L-MP、M-MP、H-MP组喂食高脂饲料,自由进食、饮水。高脂饮食2周后开始给药(辛伐他汀于第8周开始给药),连续喂养13 周。实验动物分组设计见表2。
表2 实验动物分组设计
Table 2 Experimental design and animal grouping
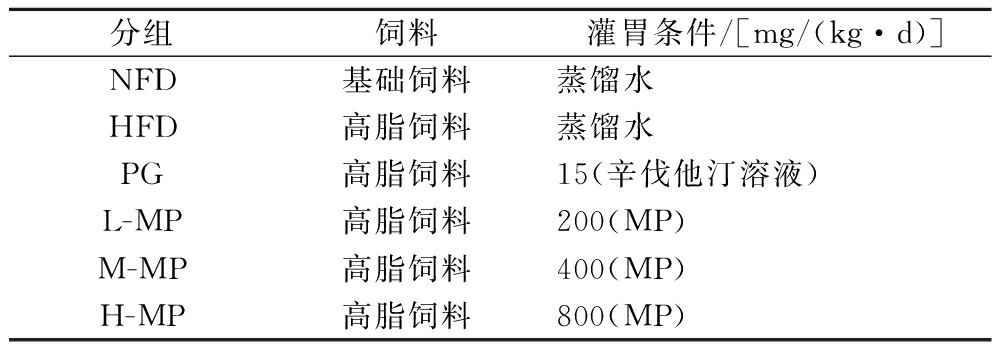
分组饲料灌胃条件/[mg/(kg·d)]NFD基础饲料蒸馏水HFD高脂饲料蒸馏水PG高脂饲料15(辛伐他汀溶液)L-MP高脂饲料200(MP)M-MP高脂饲料400(MP)H-MP高脂饲料800(MP)
表3 苹果果胶的相对分子质量及分布
Table 3 Relative molecular weight and distribution of MP

样品峰号保留时间/minMw/Da百分比/%MP峰18.051.44×1074.15峰215.114.21×10447.46峰318.712.14×10348.39
1.3.8 大鼠体重、肝重及附睾脂肪质量的测定
末次给药后,禁食12 h,称量各组大鼠体质量,腹腔注射5%水合氯醛麻醉大鼠,经腹主动脉取血,分离各组大鼠肝脏和附睾脂肪组织,并准确称量大鼠肝湿重变化和附睾脂肪组织质量。
1.3.9 大鼠血清血脂含量的测定
大鼠麻醉后,经腹主动脉取血,3 500 r/min离心15 min,收集血清。参照试剂盒说明书测定血清中TC、TG、LDL-C、HDL-C的含量。
1.3.10 大鼠肝组织苏木精-伊红(hematoxylin-eosin,HE)染色
大鼠肝脏于10%中性福尔马林中固定1周后,采用HE染色观察[13]。
1.3.11 大鼠血清中抗氧化指标的测定
大鼠血清中GSH、SOD、MDA、T-AOC水平依据试剂盒说明书测定。
1.4 数据处理
采用Excel 2019、SPSS 26.0、GraphPad Prism 8软件进行数据处理和绘图,采用ANOVA进行差异显著性分析,数据以平均值±标准差表示,P<0.05认为差异具有统计学意义。
2 结果与分析
2.1 果胶分子质量分布
由图1可知,MP分子质量分布不均匀,呈现宽分布现象。MP由一个弱峰、一个宽峰和一个尖峰组成,说明本实验用MP分子质量主要集中在2~45 kDa,主要由分子质量为1.44×107、4.21×104、2.14×103 Da的3个组分组成,分别占MP总分子的4.15%、47.46%和48.39%。有研究表明,低分子果胶更容易被吸收和利用[14],本实验所用MP的生物利用度与分子质量的相关性有待后续深入研究。
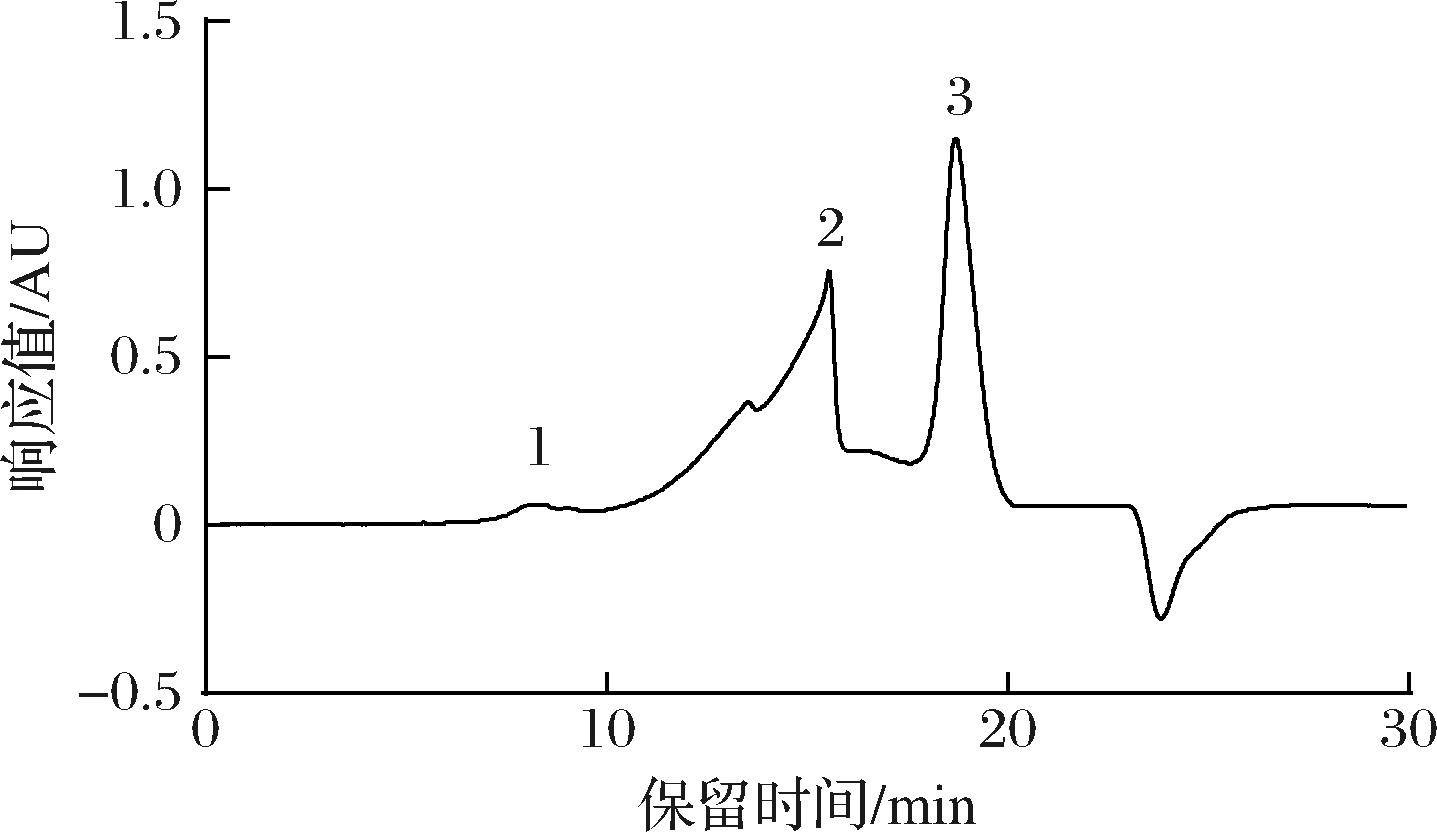
图1 苹果果胶分子质量分布
Fig.1 Molecular weight distribution of MP
注:1~3为MP组分形成峰。
2.2 酯化度和糖醛酸含量
通常将酯化度<50%的果胶划分为低酯果胶,本研究实际测得MP的酯化度为13.43%,与商品说明书标注的低酯化度一致。LUO等[15]发现通过金属离子沉淀法获取的MP表现出低酯化度(12.5%),与本文研究结果一致。由图2可知,半乳糖醛酸质量浓度在20~100 μg/mL线性关系良好,测得MP中糖醛酸含量为66.51%,同时测得其pH值为4.81,也说明MP为酸性多糖。
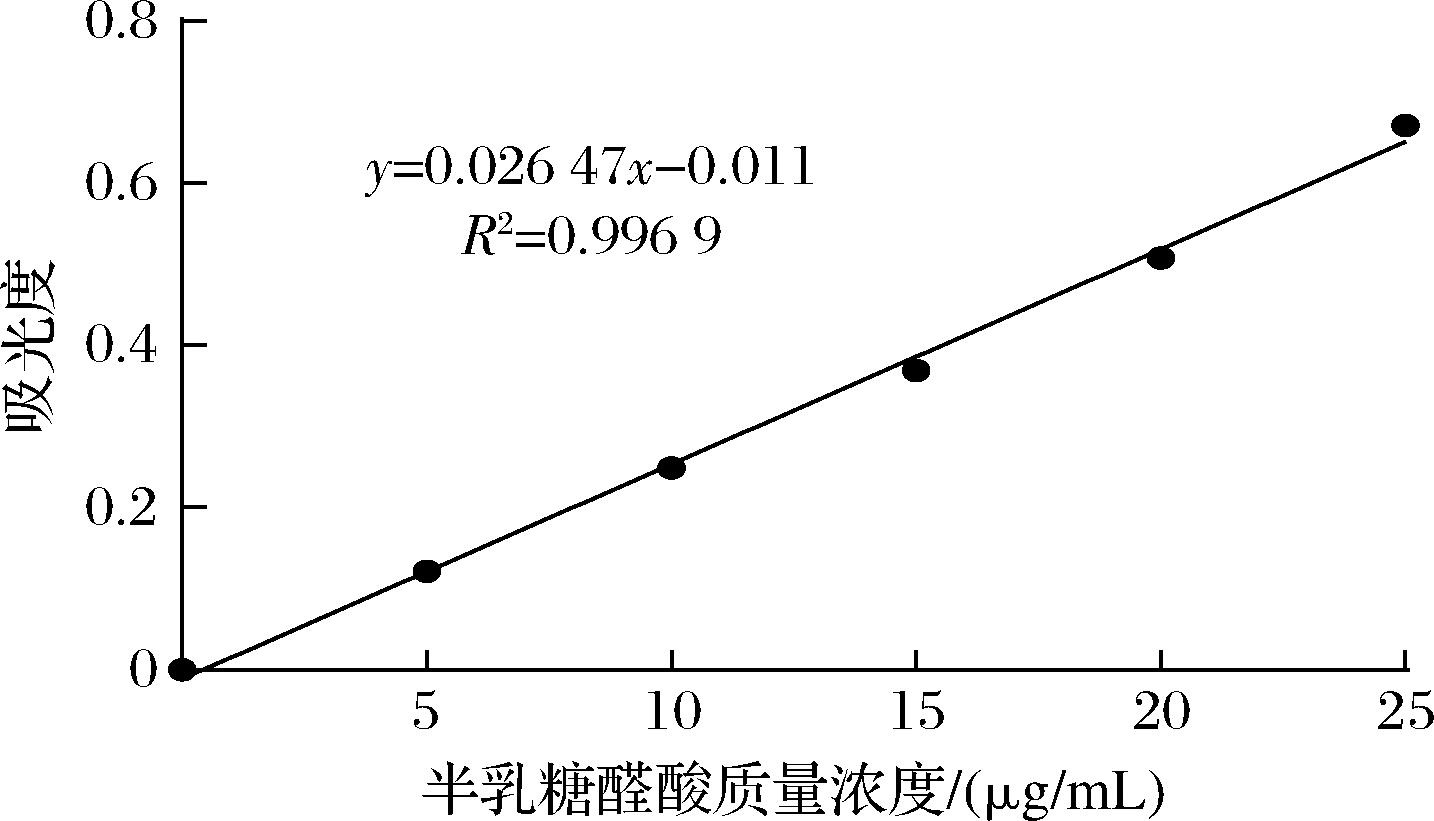
图2 半乳糖醛酸标准曲线
Fig.2 Standard curve of galacturonic acid
2.3 红外光谱分析
MP红外光谱如图3所示,在3 406.47 cm-1处较宽的吸收峰和2 917.91 cm-1处相对较弱的吸收峰分别是O—H和C—H的伸缩振动峰。1 625.73 cm-1存在糖醛酸COO—的不对称振动峰,再次证明MP中含有糖醛酸。有人将1 740 cm-1处的峰面积与1 740 cm-1和1 625 cm-1总面积之比定义为酯化度[16],在1 740 cm-1处吸收峰较弱,表明其酯化度较小,这与之前酯化度的滴定结果相一致。1 373.63 cm-1处吸收峰由C—H变形振动所引起。1 153.24 cm-1和1 115.37 cm-1吸收峰为C—O—C的伸缩振动峰,表明样品中存在吡喃糖环。在930.57 cm-1的吸收峰涉及D-吡喃糖基的吸收。
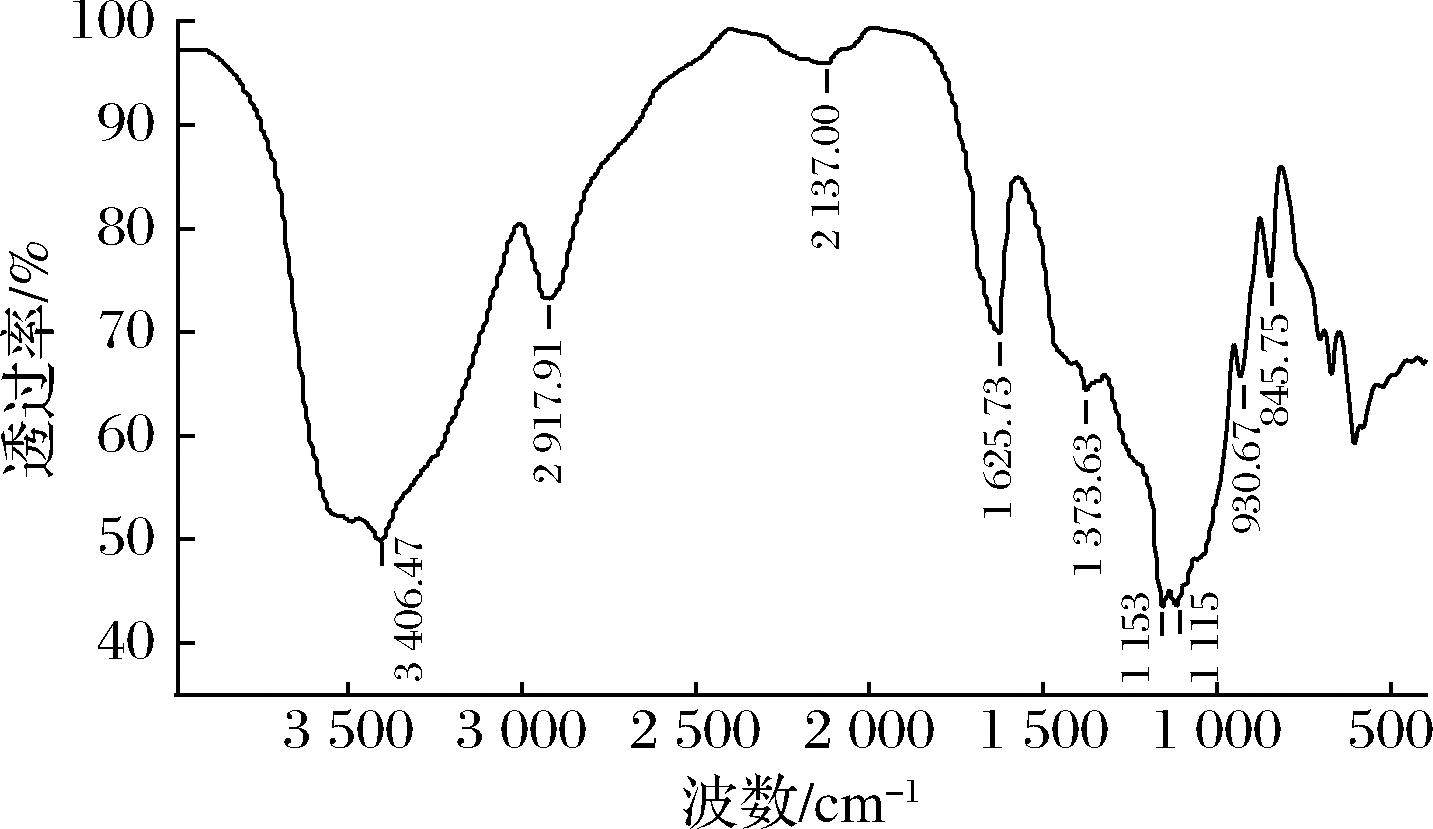
图3 苹果果胶红外光谱图
Fig.3 Infrared radiation spectra of MP
2.4 单糖组成分析
图4为单糖标准品和MP的HPLC图。根据标准单糖的保留时间确定MP多糖中的单糖种类,MP由5种单糖组成,分别是Rha、GalA、Glu、Gal、Ara,通过计算,各单糖的含量为44.04、673.80、37.96、81.94、57.49 μg/mg(表4),摩尔比为0.60∶9.35∶0.58∶1.14∶0.96。从单糖组成来看,GalA含量最高(≥65%),与2.2节测定结果一致,而Rha、Gal、Glu、Ara是MP中主要的中性糖。通常认为果胶主要由HG和RG-Ⅰ区域构成,HG区主要由GalA组成,而RG-Ⅰ区的主链由Rha和Gal组成[17]。因此,Rha/GalA的比值(0.05~1)可以用来反映果胶中RG-Ⅰ区结构的多少,比值越接近于1,果胶中RG-Ⅰ区结构占比越多[18]。(Ara+Gal)/Rha的比值则反映了RG-Ⅰ区分支度的情况[19]。本实验中Rha/GalA与(Ara+Gal)/Rha比值分别为0.06和3.72,说明MP中含有较多的RG-Ⅰ结构,并具有较好的分支度。
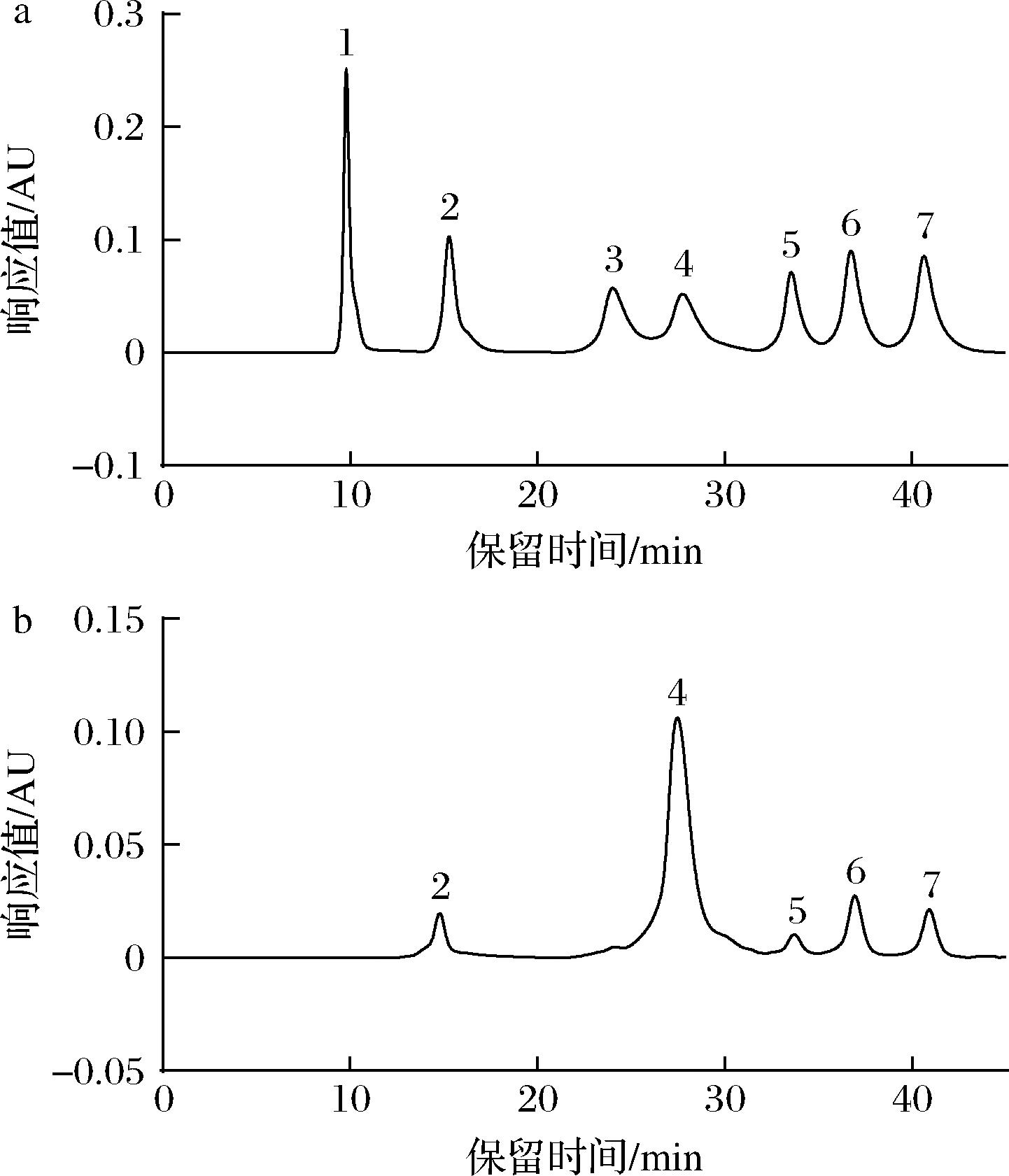
1-甘露糖;2-鼠李糖;3-葡萄糖醛酸;4-半乳糖醛酸;5-葡萄糖;6-半乳糖;7-阿拉伯糖a-标准品;b-MP
图4 苹果果胶多糖单糖组成
Fig.4 Composition of monosaccharides from the MP
表4 苹果果胶对大鼠体重、肝重及附睾脂肪质量的影响(n=6) 单位:g
Table 4 Effects of MP on body weight, liver weight and epididymal fat weight in rats (n=6)
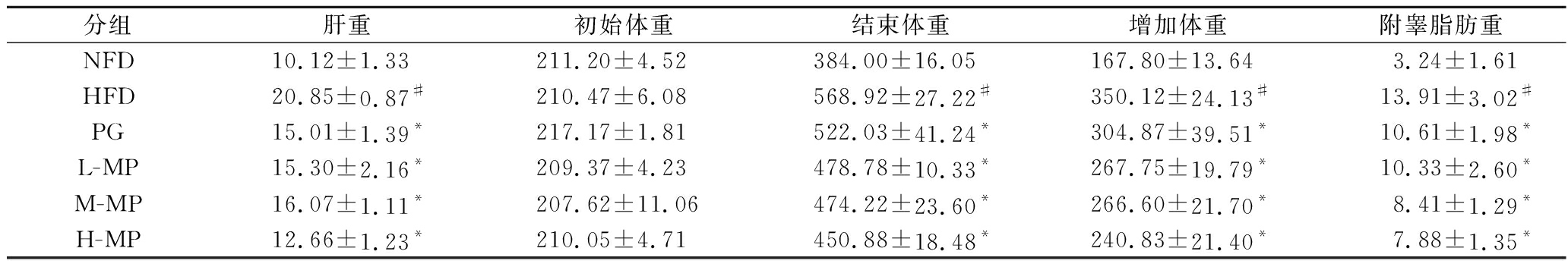
分组肝重初始体重结束体重增加体重附睾脂肪重NFD10.12±1.33211.20±4.52384.00±16.05167.80±13.643.24±1.61HFD20.85±0.87#210.47±6.08568.92±27.22#350.12±24.13#13.91±3.02#PG15.01±1.39*217.17±1.81522.03±41.24*304.87±39.51*10.61±1.98*L-MP15.30±2.16*209.37±4.23478.78±10.33*267.75±19.79*10.33±2.60*M-MP16.07±1.11*207.62±11.06474.22±23.60*266.60±21.70*8.41±1.29*H-MP12.66±1.23*210.05±4.71450.88±18.48*240.83±21.40*7.88±1.35*
注:与正常组比较,#P<0.05,与模型组比较,*P<0.05(下同)。
2.5 体外抗氧化能力分析
2.5.1 DPPH自由基清除能力
图5显示不同浓度的MP对DPPH自由基的清除率,并以维生素C作阳性对照。MP对DPPH自由基具有良好的清除作用,随着MP溶液浓度的增加,清除自由基的作用越强。当质量浓度达到10 mg/mL时,MP对DPPH自由基清除效果为70.05%,仍低于维生素C(95.05%)。据报道,具有更多的HG型结构和高GalA含量具有更高的抗氧化能力,其原因可能是较高的GalA含量增加了羟基和羧基的比例,同时又表明果胶中的RG-Ⅰ区比例越高,其抗氧化活性随之会相对降低[20]。
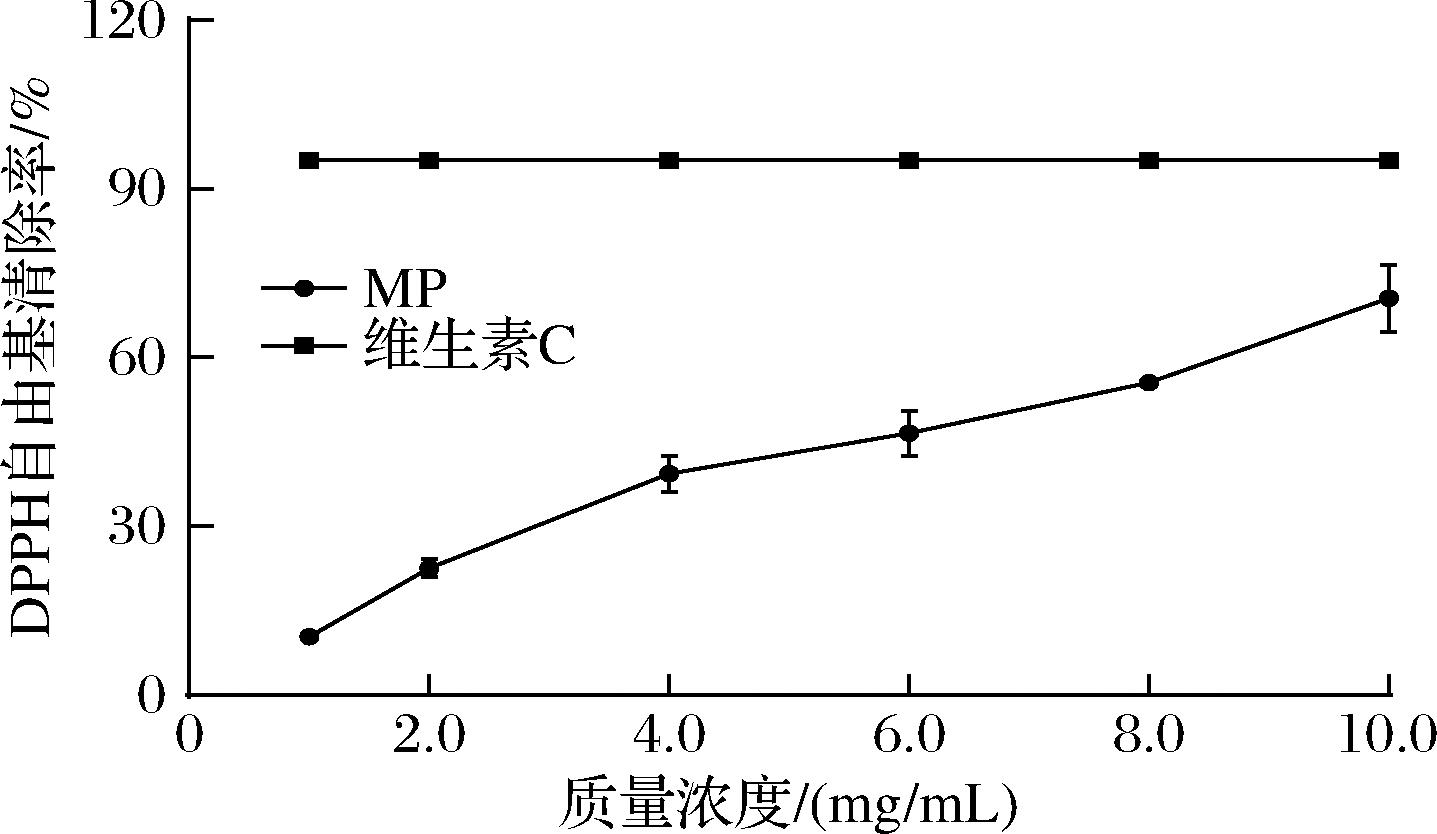
图5 苹果果胶对DPPH自由基的清除率
Fig.5 DPPH radicals scavenging rate on MP
2.5.2 ABTS阳离子自由基清除
图6显示不同浓度的MP溶液对ABTS阳离子自由基的清除率,维生素C为阳性对照。在1~10 mg/mL,其清除效果与浓度呈正相关,具有浓度依赖性。当质量浓度达到10 mg/mL时,MP对ABTS阳离子自由基清除效果为76.89%,低于维生素C(98.09%)。
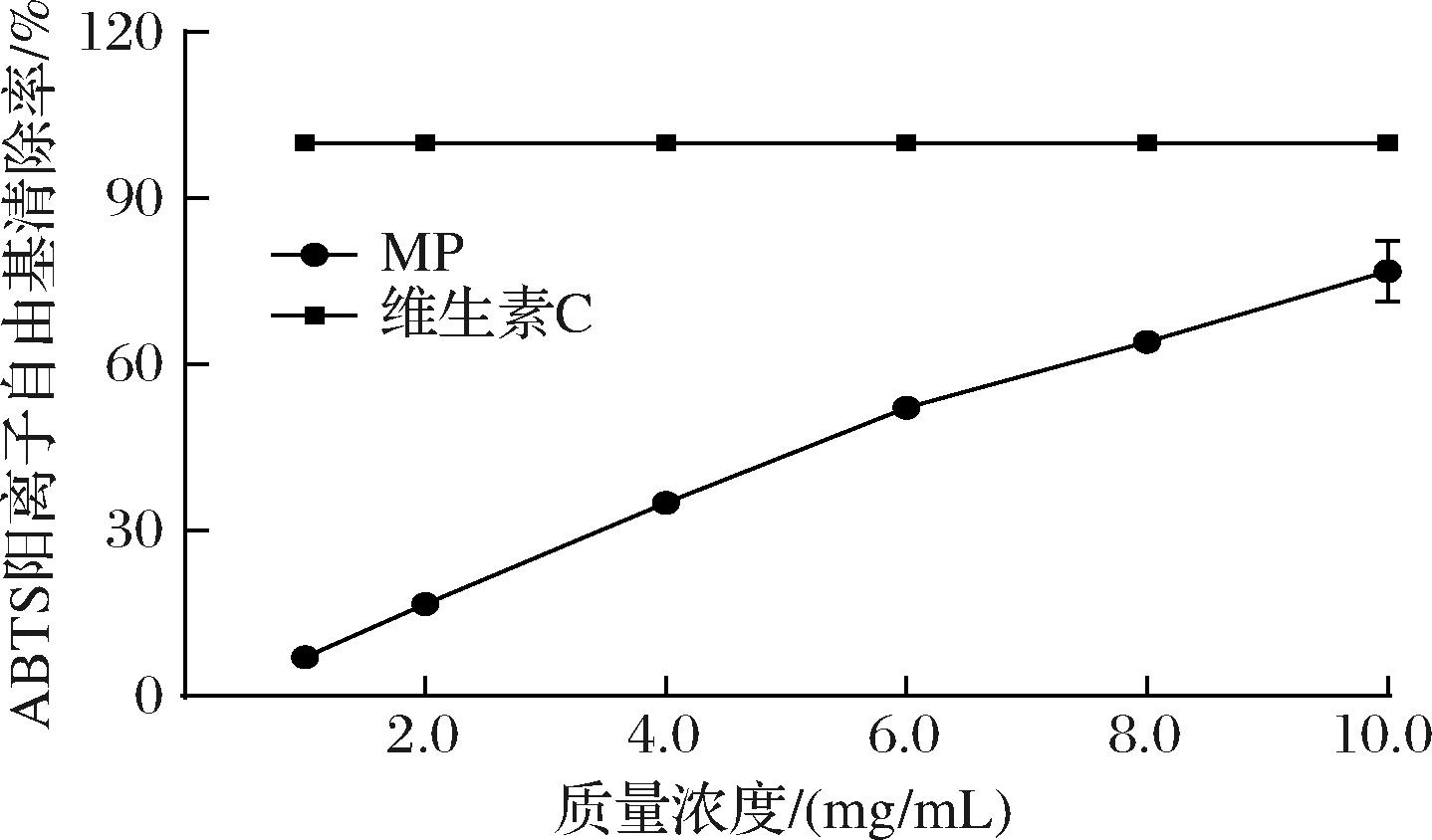
图6 苹果果胶对ABTS自由基的清除率
Fig.6 ABTS cationic radical scavenging rate on MP
2.5.3 羟自由基的清除
图7显示不同浓度的MP溶液对羟自由基的清除率,阳性对照维生素C。MP溶液对羟自由基具有一定的清除作用。随着MP溶液浓度增大,羟自由基清除率呈持续上升的趋势。当MP质量浓度为10 mg/mL时,其清除率为49.96%,但清除效果不如维生素C(99.5%)。
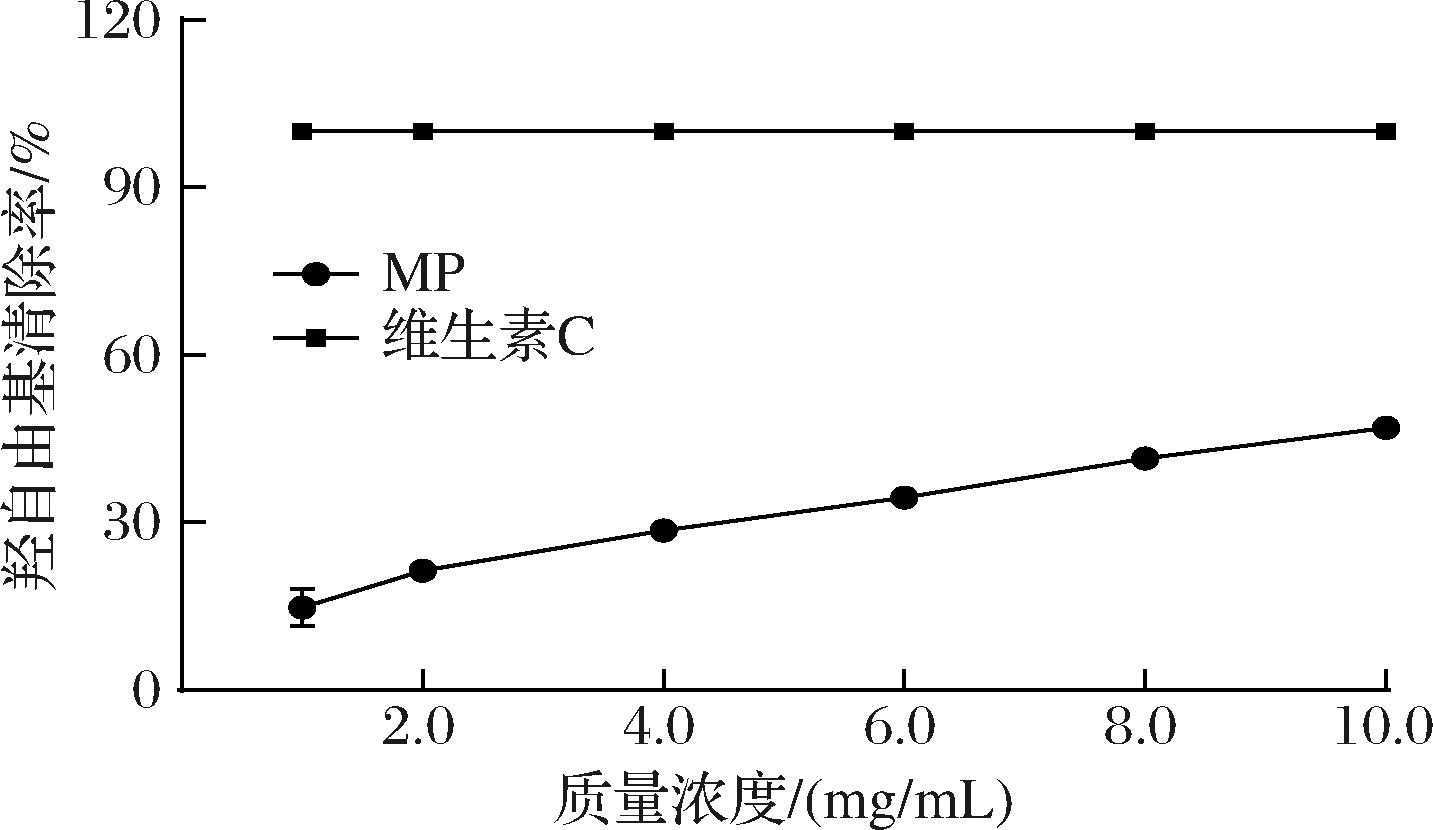
图7 苹果果胶对羟自由基的清除率
Fig.7 ·OH scavenging rate on MP
如图8所示,为不同浓度的MP溶液的总抗氧化能力和还原能力。随着MP溶液浓度的增加,其吸光度也随之增大;当MP质量浓度为10 mg/mL时,表征总抗氧化能力和还原能力的OD值分别为0.46和0.32,表明MP的抗氧化能力较低,但具有一定的还原能力。
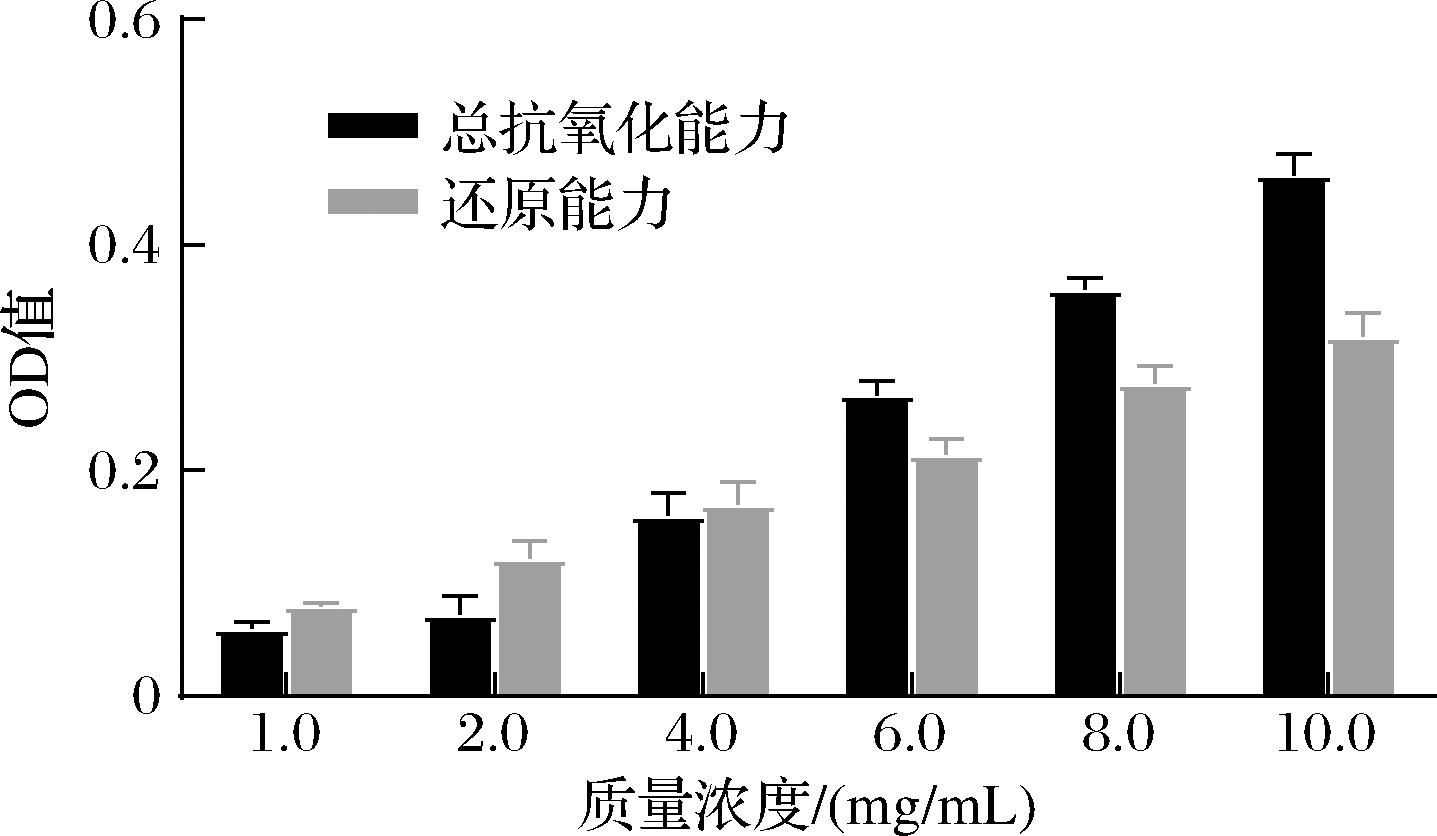
图8 苹果果胶的总抗氧化能力和还原能力
Fig.8 Total antioxidant capacity and reducing capacity on MP
2.6 大鼠体重、肝重和附睾脂肪质量的变化
由表4可知,各组大鼠的初始体重无显著差异。与NFD组相比,HFD组的最终体重和增加体重显著升高(P<0.05),且肝重也随之显著升高(P<0.05);此外,附睾脂肪组织质量显著增加。与NFD组相比,PG组与各剂量组的最终体重和肝重均显著低于NFD组(P<0.05),同时,附睾脂肪组织质量也低于模型组(P<0.05),由此说明,MP能够有效的抑制高脂饮食大鼠的体重增长,抑制脂肪在体内堆积。
2.7 苹果果胶对高脂饮食大鼠血清脂质水平的影响
MP对高脂饮食大鼠血清中TC、TG、LDL-C和HDL-C水平的影响如表5所示。与NFD组相比,HFD组大鼠血清TC、TG和LDL-C水平显著上升(P<0.05),HDL-C水平显著下降(P<0.05),说明高脂血症大鼠模型建立成功;与HFD组相比,PG组和各剂量MP组大鼠血清TC、TG和LDL-C水平均显著降低(P<0.05),M-MP组、H-MP组HDL-C水平显著升高(P<0.05),说明MP能够显著降低高脂血症大鼠血脂水平。
表5 苹果果胶对大鼠血清的TG、TC、LDL-C、HDL-C水平的影响(n=6) 单位:mmol/L
Table 5 Effects of MP on the levels of TG, TC, LDL-C,and HDL-C in serum of rats (n=6)
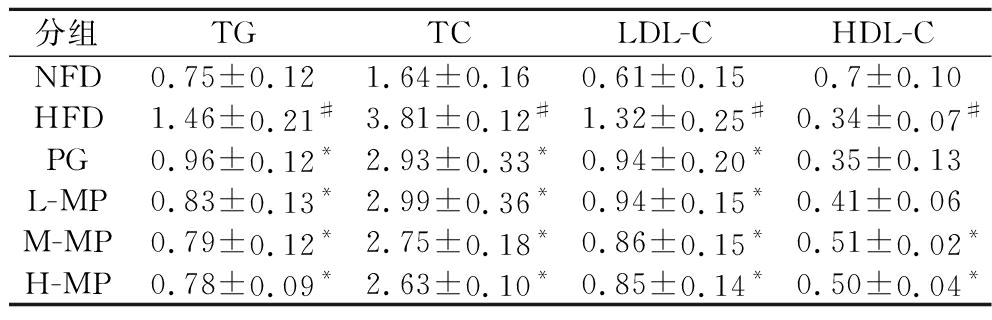
分组TGTCLDL-CHDL-CNFD0.75±0.121.64±0.160.61±0.150.7±0.10HFD1.46±0.21#3.81±0.12#1.32±0.25#0.34±0.07#PG0.96±0.12*2.93±0.33*0.94±0.20*0.35±0.13L-MP0.83±0.13*2.99±0.36*0.94±0.15*0.41±0.06M-MP0.79±0.12*2.75±0.18*0.86±0.15*0.51±0.02*H-MP0.78±0.09*2.63±0.10*0.85±0.14*0.50±0.04*
2.8 大鼠肝脏病理学观察
图9为大鼠肝组织HE染色结果,NFD组大鼠肝细胞形态大小正常,肝索排列整齐,细胞核清晰可见,未见脂肪空泡出现。HFD组大鼠肝脏呈现弥漫性脂肪变性,肝索排列紊乱,细胞内出现大量大小不等的脂滴,甚至出现大面积空泡,部分细胞的细胞核被挤在边缘,伴随有肝脏组织的气球样变性,细胞排列不紧密,细胞边界模糊[21]。经药物或MP干预后,肝脏病变得到明显的改善,PG组大鼠肝脏结构完整、清晰,肝组织较为紧密,肝细胞脂肪变性程度明显减轻,未见细胞气球样变性。MP组大鼠肝脏结构完整、清晰,L-MP组与H-MP组相比,细胞间隙较大;H-MP组肝组织状态最好,虽偶有脂滴,但无脂肪泡大面积出现,脂肪变性得到极大的改善,状态甚至接近NFD组。
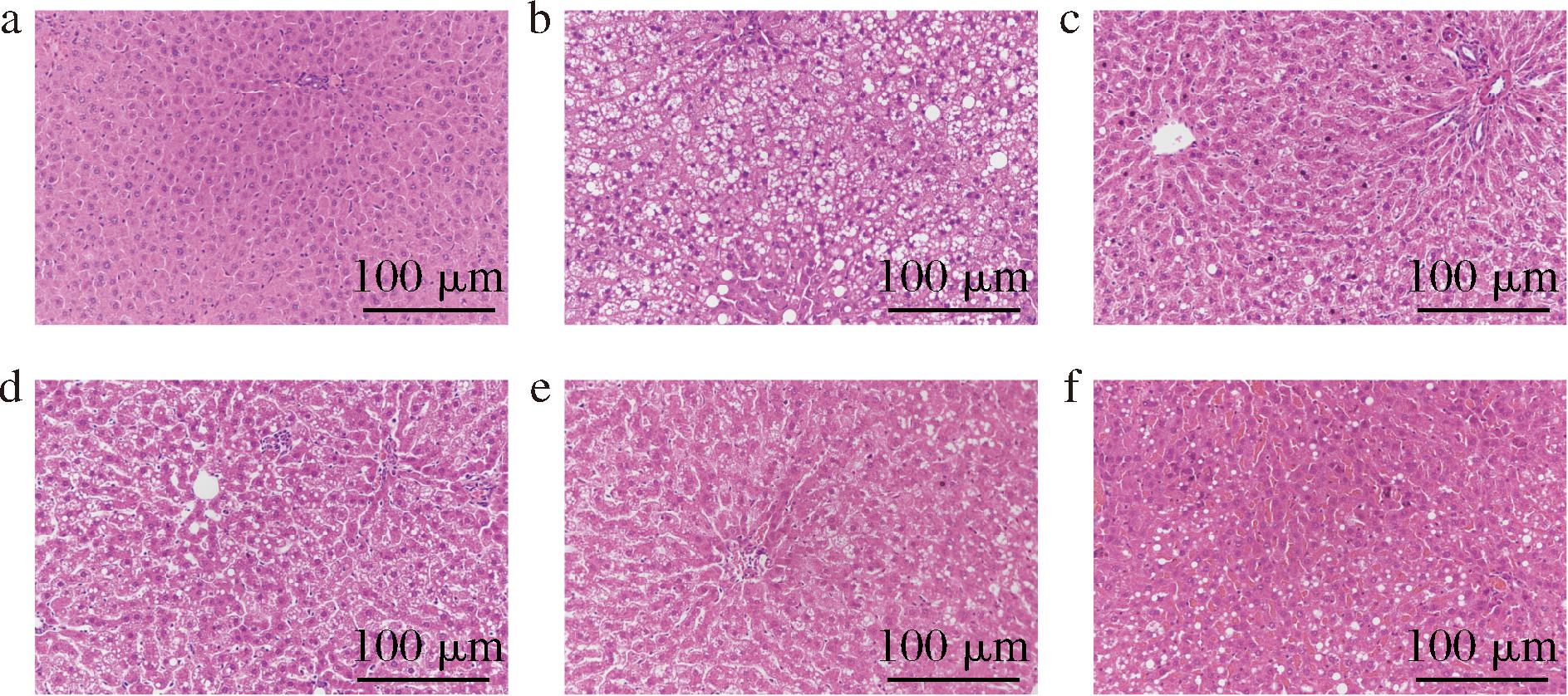
a-NFD组;b-HFD组;c-PG组;d-L-MP组;e-M-MP组;f-H-MP组
图9 大鼠肝脏组织HE染色(×200)
Fig.9 HE staining of rat liver tissue (×200)
2.9 苹果果胶对高脂饮食大鼠血清中抗氧化指标的影响
脂质过氧化反应在高脂饮食过程中会异常增加,并伴随氧化应激反应增加,这使得机体抗氧化体系紊乱,对抗氧化酶的消耗增加[22],MDA是脂质过氧化反应的最终产物,而MDA在机体内的堆积会加速生物膜的损伤[23]。因此,测定大鼠血清中抗氧化指标来评估大鼠体内的抗氧化体系(图10)。
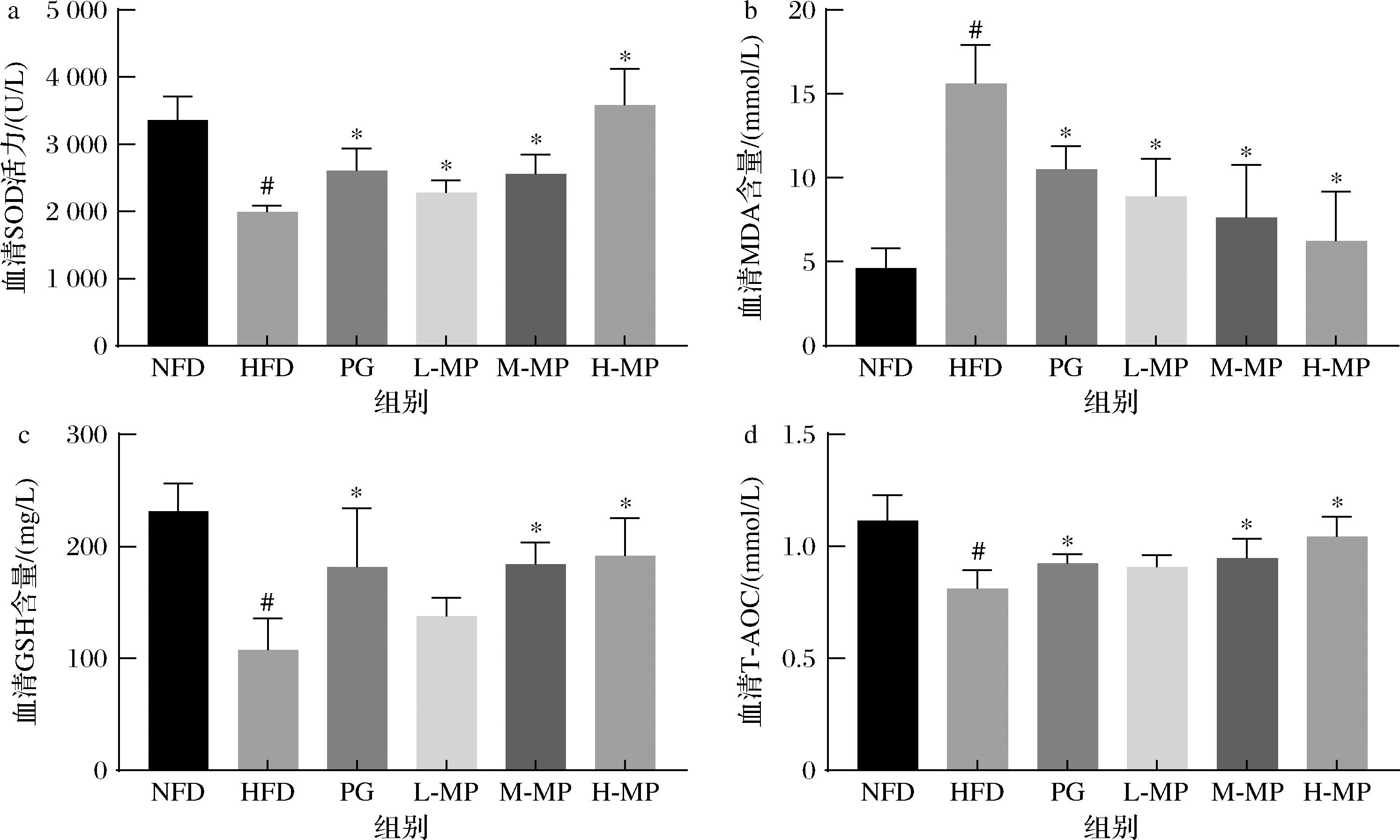
a-SOD;b-MDA;c-GSH;d-T-AOC
图10 苹果果胶对大鼠血清SOD、MDA、GSH、T-AOC水平的影响
Fig.10 Effects of MP on rat serum SOD, MDA, GSH, and T-AOC levels
注:与正常组比较,#P<0.05,与模型组比较,*P<0.05。
由图10-a、图10-c、图10-d可知,与NFD组相比,HFD组血清中SOD活力显著减弱(P<0.05),血清GSH含量显著降低(P<0.05),血清T-AOC水平显著降低(P<0.05)。说明高脂饮食引发高脂血症的同时,脂质在体内过度蓄积,导致大鼠的抗氧化体系失衡。不同剂量MP干预后,各剂量组的血清SOD活力显著高于HFD组(P<0.05),血清GSH含量和血清T-AOC水平均显著升高(P<0.05)。说明MP可以通过增强体内抗氧化物质的活性来调节大鼠抗氧化体系,使大鼠抗氧化能力增强。图10-b为各组大鼠血清MDA浓度的变化,HFD组MDA浓度较NFD组升高238%(P<0.05),说明高脂饮食致使体内脂质过氧化反应增加,降低了机体的抗氧化能力。与HFD组相比,L-MP、M-MP和H-MP组MDA浓度显著降低(P<0.05),分别下降了43.08%、51.15%和60.05%。
3 讨论与结论
本文以商品化的MP为研究对象,初步探究其分子质量、酯化度、糖醛酸含量、单糖组成和体外抗氧化能力,以及体内降血脂作用。结果表明,MP分子质量主要集中在2~45 kDa,糖醛酸含量为66.51%,酯化度为13.43%,说明本实验用MP是一种低酯化度的酸性多糖。体外抗氧化实验结果显示,MP对DPPH自由基、ABTS阳离子自由基、羟自由基均有一定的清除活性,并具有一定的总抗氧化和还原能力;在1~10 mg/mL DPPH自由基、ABTS阳离子自由基、羟自由基清除与总抗氧化和还原能力均与样品浓度呈正比,具有浓度依赖性。
饮食与能量消耗之间的失衡被认为是引发脂代谢紊乱的主要原因。本研究利用高脂饮食诱导建立高脂血症大鼠模型,HFD组大鼠肝重和附睾脂肪组织质量显著增加,血清TC、TG和LDL-C水平显著上升,HDL-C水平显著下降,提示高脂血症大鼠模型建立成功。经MP干预后,大鼠血清TC、TG和LDL-C水平显著降低,HDL-C水平显著升高,表明MP具有良好的降脂作用,并且H-MP组降血脂效果优于L-MP组和M-MP组。大鼠长期摄入高脂饲料可引起脂质在肝脏蓄积并发生病变,肝脏HE染色显示,HFD组发生了较严重的脂肪病变,并出现气球样变化。而经MP干预后,肝脏脂肪变性得到明显改善,病变逐步恢复。
高脂饮食会诱导自由基的产生,在自由基无法被及时清除时,过度自由基反过来加速高脂血的发生,将会进一步破坏生物膜的结构与功能[24]。MDA作为脂质过氧化反应的应激产物,其血清含量被认为是反映脂质过氧化程度的重要指标[25]。在本研究中,HFD组的SOD活力、GSH与T-AOC水平均显著低于NFD,同时MDA含量显著升高,这表明大鼠体内氧化还原系统失衡。经MP干预后,可以显著上调血清中SOD活力,增加血清中GSH和T-AOC水平以清除过量的自由基,使机体免受氧化应激反应造成持续性损伤,同时MP能降低MDA含量,降低脂质过氧化反应带来的损伤。
综上所述,本实验用MP是一类低酯化度的酸性果胶多糖,本MP具有体外抗氧化能力和降低高脂血症大鼠血脂作用,能抑制脂肪在体内堆积,同时增强机体抗氧化能力,降低脂质过氧化物的含量,并能明显改善因脂质过度摄入而受损的肝脏,推测MP可能通过提高机体抗氧化能力来改善血脂代谢异常,其具体的作用机制还需进一步深入的研究。
[1] MASUELLI.Pectins-Extraction, Purification, Characterization and Applications[M].IntechOpen, 2020.
[2] JEDRYCHOWSKI W, MAUGERI U, PAC A, et al.Reduced risk of colorectal cancer and regular consumption of apples:Hospital based case-control study in Poland[J].Central European Journal of Medicine, 2009, 4(3):320-326.
[3] 李雪璨, 刘佳.苹果渣果胶超声波辅助提取工艺优化与抗氧化性研究[J].食品安全质量检测学报, 2022, 13(3):767-773.
LI X C, LIU J.Study on the ultrasonic-assisted extraction process optimization and antioxidant activity of pectin from apple pomace[J].Journal of Food Safety &Quality, 2022, 13(3):767-773.
[4] 孙立军, 郭玉蓉, 田兰兰.苹果果胶研究进展[J].食品工业科技, 2012, 33(4):445-449.
SUN L J,GUO Y R,TIAN L L.Research progress of apple pectin[J].Science and Technology of Food Industry, 2012, 33(4):445-449.
[5] GIR N-HERN
N-HERN NDEZ J, PAZMINO M, BARRIOS-RODR
NDEZ J, PAZMINO M, BARRIOS-RODR GUEZ Y F, et al.Exploring the effect of utilising organic acid solutions in ultrasound-assisted extraction of pectin from apple pomace, and its potential for biomedical purposes[J].Heliyon, 2023, 9(7):e17736.
GUEZ Y F, et al.Exploring the effect of utilising organic acid solutions in ultrasound-assisted extraction of pectin from apple pomace, and its potential for biomedical purposes[J].Heliyon, 2023, 9(7):e17736.
[6] 张攀, 陈信, 熊双丽, 等.不同预处理对豆腐柴叶果胶理化性质的影响[J].食品工业科技, 2019, 40(1):82-86;91.
ZHANG P, CHEN X, XIONG S L, et al.Effects of different pretreatments on physicochemical properties of pectin from Premna microphylla Turcz leaves[J].Science and Technology of Food Industry, 2019, 40(1):82-86;91.
[7] 李楠, 张香飞, 杨春杰.板枣多糖初级结构表征及抗氧化活性[J].食品与机械, 2022, 38(10):24-28;49.
LI N, ZHANG X F, YANG C J.Primary structure characterization and antioxidant activity of polysaccharide from Zizyphus jujuba cv.Banzao[J].Food &Machinery, 2022, 38(10):24-28;49.
[8] 李衍衡, 赵明珠, 徐艺璇, 等.不同相对分子质量果胶多糖益生特性的比较研究[J].食品科技, 2022, 47(4):216-223.
LI Y H, ZHAO M Z, XU Y X, et al.Comparative study on probiotic properties of pectic polysaccharides with different relative molecular mass[J].Food Science and Technology, 2022, 47(4):216-223.
[9] 刘永玲, 赵建国, 赵治兵, 等.PMP柱前衍生hplc法测定八月瓜果皮多糖中单糖组成[J].食品研究与开发,2023,44(21):131-137.
LIU Y L, ZHAO J G, ZHAO Z B, et al.Determination of monosaccharide composition of polysaccharides from Akebia trifoliate Peel by PMP-HPLC with pre-column derivatization[J].Food Research and Development,2023,44(21):131-137.
[10] 李尧, 卢承蓉, 刘丹, 等.乳酸片球菌胞外多糖的分离纯化、结构分析及抗氧化活性研究[J].食品与发酵工业, 2021, 47(19):35-42.
LI Y, LU C R, LIU D, et al.Structure and antioxidant activity of Pediococcus lactis extracellular polysaccharide[J].Food and Fermentation Industries, 2021, 47(19):35-42.
[11] 丁子康, 李新月, 赵猛, 等.低分子量柘果多糖的制备及其抗氧化活性研究[J].食品工业科技, 2023, 44(19):39-46.
DING Z K, LI X Y, ZHAO M, et al.Study on the preparation and antioxidant activity of low molecular weight polysaccharide from Cudrania tricuspidata fruits[J].Science and Technology of Food Industry, 2023, 44(19):39-46.
[12] 刘欢, 赵巨堂, 何力, 等.金盏花精油的微波辅助提取及其成分与抗氧化活性研究[J].食品工业科技, 2022, 43(10):180-188.
LIU H, ZHAO J T, HE L, et al.Microwave-assisted extraction of essential oil from Calendula officinalis L.and its components and antioxidant activity[J].Science and Technology of Food Industry, 2022, 43(10):180-188.
[13] 张艳军, 李靖, 张玉领, 等.黄秋葵多糖对糖尿病大鼠糖脂代谢和肾脏损伤的改善作用[J].现代食品科技, 2021, 37(3):46-52.
ZHANG Y J, LI J, ZHANG Y L, et al.Okra polysaccharides improve glucose and lipid metabolism and kidney damage in diabetic rats[J].Modern Food Science and Technology, 2021, 37(3):46-52.
[14] ZHAO Y Y, BI J F, YI J Y, et al.Pectin and homogalacturonan with small molecular mass modulate microbial community and generate high SCFAs via in vitro gut fermentation[J].Carbohydrate Polymers, 2021, 269:118326.
[15] LUO S, WANG S D, YANG X D, et al.Gelation behaviors and mechanism of a new pectic polysaccharide from apple pomace as a potential gelatin substitute[J].International Journal of Biological Macromolecules, 2023, 241:124558.
[16] PAPPAS C S, MALOVIKOVA A, HROMADKOVA Z, et al.Determination of the degree of esterification of pectinates with decyl and benzyl ester groups by diffuse reflectance infrared Fourier transform spectroscopy (DRIFTS) and curve-fitting deconvolution method[J].Carbohydrate Polymers, 2004, 56(4):465-469.
[17] GUO Z L, WU S Z, ZHENG H, et al.Effects of dielectric barrier discharge plasma modification on structure, physicochemical and functional properties of watermelon peel pectin[J].Food Hydrocolloids, 2024, 147:109350.
[18] 刘莎, 邓利玲, 钟耕, 等.酶解法制备臭黄荆叶果胶结构、理化性质、抗氧化和抗菌活性[J].食品科学,2023,44(23):55-63.
LIU S, DENG L L, ZHONG G, et al.Structure, physicochemical properties, antioxidant and antimicrobial activities of pectin from the Premna ligustroides Hemsl.leaves prepared by enzymatic processes[J].Food Science,2023,44(23):55-63.
[19] HU W W, CHENG H, WU D M, et al.Enhanced extraction assisted by pressure and ultrasound for targeting RG-I enriched pectin from citrus peel wastes:A mechanistic study[J].Food Hydrocolloids, 2022, 133:107778.
[20] ZHAO X L, MENG Y, LIU Y, et al.Pectic polysaccharides from Lilium brownii and Polygonatum odoratum exhibit significant antioxidant effects in vitro[J].International Journal of Biological Macromolecules, 2024,257:128830.
[21] 黄桂华. 高纯度海带岩藻聚糖的制备及其生物活性研究[D].泉州:华侨大学, 2018.
HUANG G H.Study on the preparation and bioactivity of high purity fucoidan from Laminaria japonica[D].Quanzhou:Huaqiao University, 2018.
[22] 王璐, 李蓓蓓, 王参政, 等.秋葵果胶对糖尿病小鼠降糖、降脂作用研究[J].中国食品添加剂, 2023, 34(9):236-243.
WANG L, LI B B, WANG C Z, et al.Effect of okra pectin on lowering blood sugar and lipid in diabetic mice[J].China Food Additives, 2023, 34(9):236-243.
[23] 唐茹萌, 焦文雅, 桑亚新, 等.裙带菜多糖体外和体内降血脂活性[J].食品科学, 2022, 43(1):142-149.
TANG R M, JIAO W Y, SANG Y X, et al.In vitro and in vivo hypolipidemic effect of Undaria pinnatifida polysaccharide[J].Food Science, 2022, 43(1):142-149.
[24] 刘雯, 车心怡, 马志超, 等.铜藻岩藻聚糖硫酸酯的结构组成及降血脂作用[J].大连海洋大学学报, 2023, 38(2):323-330.
LIU W, CHE X Y, MA Z C, et al.Structural composition and hypolipidemic effect of fucoidan from Sargassum horneri[J].Journal of Dalian Ocean University, 2023, 38(2):323-330.
[25] 王晶晶, 赵则月, 张晓霞, 等.黑莓果渣花青素降血糖、降血脂及抗氧化研究[J].中国食品添加剂, 2023, 34(8):214-219.
WANG J J, ZHAO Z Y, ZHANG X X, et al.Study on the hypoglycemic, hypolipidemic and antioxidant effects of anthocyanins from blackberry pomace[J].China Food Additives, 2023, 34(8):214-219.