亚麻籽油含有丰富的不饱和脂肪酸,其中α-亚麻酸(α-linolenic acid,ALA)含量高达40%~60%[1-4],ALA属于ω-3多不饱和脂肪酸,在9、12和15位含有3个双键,是一种人体必需但自身不能合成的脂肪酸,是构成细胞膜和生物酶的基础物质。
ALA可以直接通过代谢合成二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosahexaenoic acid,DHA),这2种多不饱和脂肪酸是机体正常生理功能和生长发育所必需的。研究表明,ALA在调节血脂、胆固醇代谢、保护心血管系统等方面具有重要的作用[5-8]。磷虾油是以南极磷虾为原料提取的功能性油脂,含有丰富的EPA、DHA、磷脂、类黄酮等多种生物活性成分[9],磷虾油中30%~65%的ω-3多不饱和脂肪酸与磷脂结合[10],形成的结构使得磷虾油可直接进入小肠被人体吸收,生物利用度更高[11-12]。近年来的研究表明,富含磷脂和多不饱和脂肪酸的磷虾油具有预防心脑血管疾病、降血脂、改善神经认知障碍等多种功能[13-16]。
本研究以亚麻籽油、磷虾油为原料,蜂蜡、明胶、纯净水、甘油等为辅料进行复配,制备成亚麻籽油磷虾油软胶囊。按照国家食品药品监督管理局(国食药监保化[2012]107号)的辅助降血脂功能评价方法,对人体进行辅助降血脂功能研究,为开发亚麻籽油磷虾油复合类功能食品提供支持。
1 材料与方法
1.1 受试样品
亚麻籽油磷虾油软胶囊由上海某公司提供。亚麻籽油、磷虾油与辅料的质量比为62∶34∶4,其功效成分为ALA和磷脂。软胶囊核准净含量:1.0 g/粒×60/瓶。批号:20160510。人体推荐量为口服,每日2次,每次3粒。剂量为6.0 g/d。
1.2 受试者
1.2.1 纳入标准
原发性高脂血症人群,受试者在正常饮食情况下,检测禁食12~14 h后的血脂水平,半年内至少有2次血脂检测,血清总胆固醇(total cholesterol,TC)在5.18~6.21 mmol/L,且甘油三酯(triglyceride,TG)为1.70~2.25 mmol/L。所有受试者均获得知情同意书,为自愿参加试验者。
1.2.2 排除标准
年龄在18岁以下或65岁以上者;妊娠或哺乳期妇女,过敏体质或对本受试样品过敏者;合并有心、肝、肾和造血系统等严重疾病,精神病患者;近两周曾服用调脂药物,影响结果判断者;住院的高血脂症者;未按规定食用受试样品,或资料不全,影响功效或安全性判断者。
1.3 仪器与试剂
Modular P全自动生化分析仪,德国罗氏诊断公司;TBA-120全自动生化分析仪,东芝公司; Sysmex-K21三分类血液分析仪、Sysmex血细胞分析稀释液,Sysmex公司; linitek Advantus尿分析仪、Multistix 10SG尿分析试剂带,西门子公司;生化试剂盒,德国罗氏诊断产品(上海)有限公司。
1.4 试验方法
1.4.1 试验设计与分组
采用试验组内和试验组间2种对照方式进行试验设计。受试者根据血脂水平被随机分为对照组和试食组,对可能影响试验结果的主要因素(如受试者的年龄、性别、病程等)进行均衡性检验,以保证组间可比性。此外,每组受试者应不少于50例。试食组服用受试的亚麻籽油磷虾油软胶囊,对照组采用空白对照。
1.4.2 服用方法
受试者在受试期间保持平时的生活和饮食习惯。试食组服用样品,对照组采用空白对照,其他条件与试食组相同。服用方式为口服,每日2次,每次3粒,连续服用60 d。
1.4.3 检测指标
1.4.3.1 一般情况指标
包括受试者的精神状况、睡眠状况、饮食、大小便、血压等指标。
1.4.3.2 安全性指标
使用仪器测定安全性指标。包括血、尿、便常规检查:红细胞、血红蛋白、白细胞计数,尿、便常规检查;肝、肾功能检查:血清白蛋白、总蛋白、谷草转氨酶、谷丙转氨酶、尿素、肌酐、葡萄糖等;胸透、心电图、腹部B超检查(仅在试验开始前进行)。
1.4.3.3 功效性指标
血清中TC的含量及试食后TC降低的比例、TG含量及试食后TG降低比例、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)含量及试食后上升比例和低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)含量。功效性判定为有效的标准为TC降低>10%,TG降低>15%;HDL-C上升>0.104 mmol/L。观察TC有效率、TG有效率、HDL-C有效率及总有效率(TC有效且TG有效)。
1.4.4 数据处理
用SPSS软件对实验数据进行统计分析,自身对照采用配对t检验,两组均数比较采用成组t检验。
1.4.5 结果判定
经统计分析,试食组自身比较及试食组与对照组组间比较,受试者血清中TC、TG、LDL-C均显著降低,同时HDL-C无显著差异,同时试验组总有效率高于对照组,可判定该受试样品具有辅助降低血脂的功能。
2 结果与分析
2.1 均衡性比较结果
共纳入109例符合标准的受试者,试验过程中试食组脱失1例、对照组脱失2例,脱失率分别为1.9%、3.6%,因此实际有效例数为106例,试食组和对照组各53例。试食前试食组受试者的血脂水平、年龄、性别、病程与对照组比较,均无显著性差异(P>0.05),表明试食组和对照组具有均衡可比性,具体结果见表1。
表1 试食组和对照组试食前血脂、年龄、性别均衡性比较
Table 1 Comparisons of blood lipids, age, and gender between the test group and the control group before administration

指标试食组(n=53)对照组(n=53)年龄/岁58.87±7.3859.42±6.10性别(男/女)13/4022/31病程/年4.40±2.414.13±2.17TG/(mmol/L)5.66±0.295.72±0.32TC/(mmol/L)1.98±0.611.98±0.17HDL-C/(mmol/L)1.51±0.411.46±0.34
2.2 一般情况比较结果
对受试者精神状况、睡眠状况、饮食、大小便情况进行了问诊调查,按良好、一般、差进行分级统计,并测量受试者的血压、心率、胸透、心电图、腹部B超等指标。具体结果见表2,大部分受试者一般情况良好,试食组试食后精神状态、饮食情况正常;两组试食前后组内比较,所有指标差异均无显著性(P>0.05),表明试食对受试者无不良影响。
表2 试食组和对照组试食前后一般情况比较
Table 2 Comparisons of the general conditions between the test group and the control group before and after administration
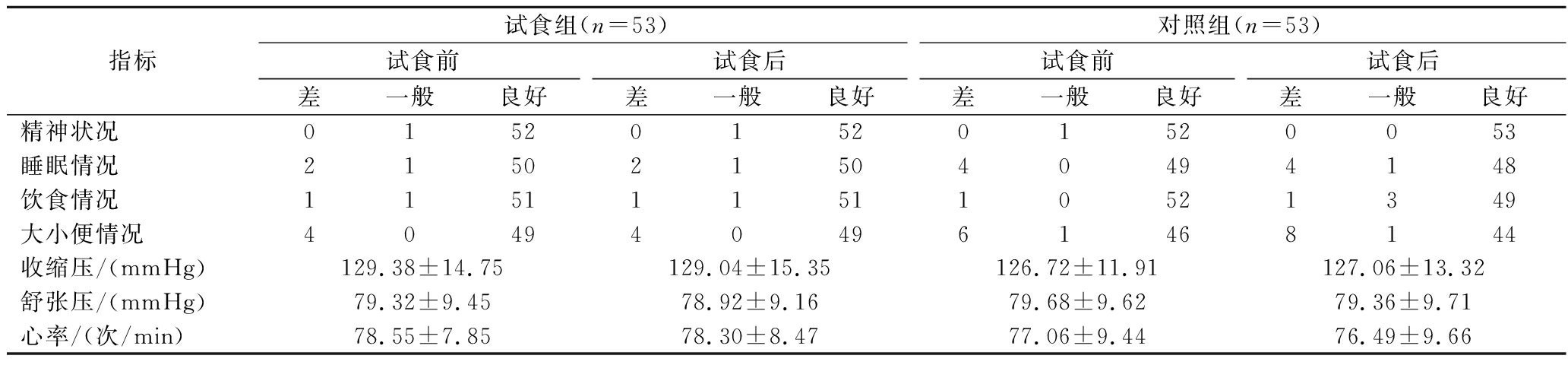
指标试食组(n=53)对照组(n=53)试食前试食后试食前试食后差一般良好差一般良好差一般良好差一般良好精神状况0152015201520053睡眠情况2150215040494148饮食情况1151115110521349大小便情况4049404961468144收缩压/(mmHg)129.38±14.75129.04±15.35126.72±11.91127.06±13.32舒张压/(mmHg)79.32±9.4578.92±9.1679.68±9.6279.36±9.71心率/(次/min)78.55±7.8578.30±8.4777.06±9.4476.49±9.66
2.3 安全性指标测定结果
对受试者试食前后的血常规、尿常规、便常规及血生化等安全性指标进行测定,测定结果见表3,试食组和对照组试食相关安全性指标均在正常范围。
表3 试食组和对照组试食前后血、尿、便常规及血生化变化
Table 3 Comparisons of blood, urine, stool routine, and blood biochemical changes between the test group and the control group before and after administration
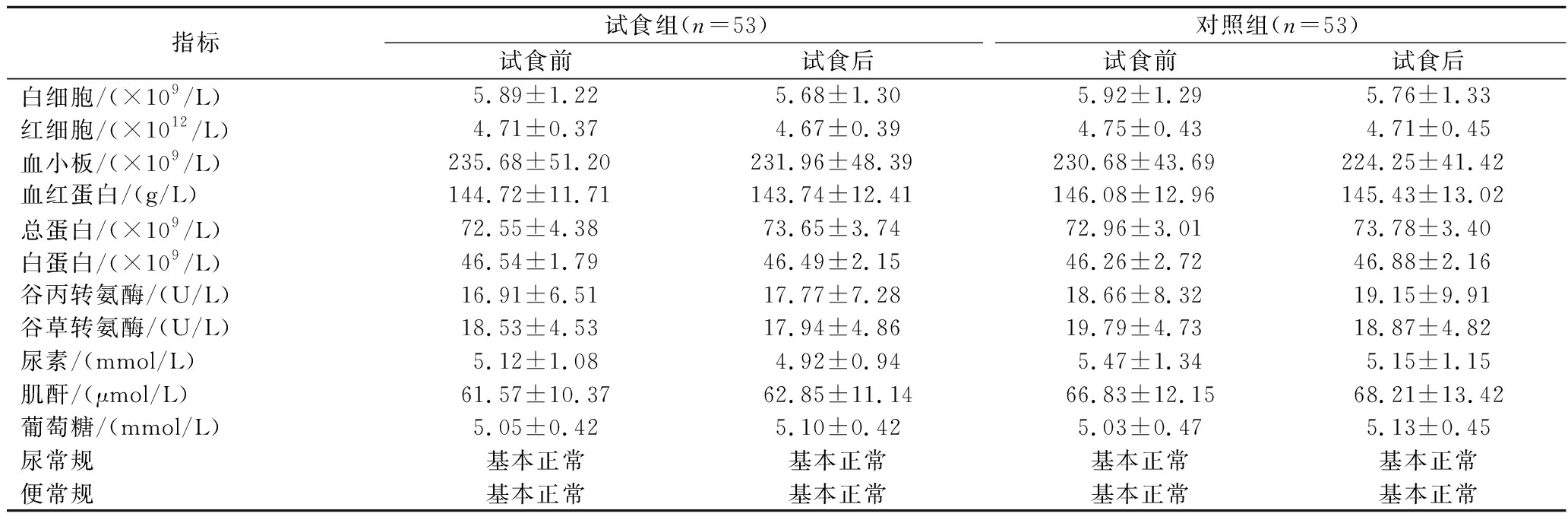
指标试食组(n=53)对照组(n=53)试食前试食后试食前试食后白细胞/(×109/L)5.89±1.225.68±1.305.92±1.295.76±1.33红细胞/(×1012/L)4.71±0.374.67±0.394.75±0.434.71±0.45血小板/(×109/L)235.68±51.20231.96±48.39230.68±43.69224.25±41.42血红蛋白/(g/L)144.72±11.71143.74±12.41146.08±12.96145.43±13.02总蛋白/(×109/L)72.55±4.3873.65±3.7472.96±3.0173.78±3.40白蛋白/(×109/L)46.54±1.7946.49±2.1546.26±2.7246.88±2.16谷丙转氨酶/(U/L)16.91±6.5117.77±7.2818.66±8.3219.15±9.91谷草转氨酶/(U/L)18.53±4.5317.94±4.8619.79±4.7318.87±4.82尿素/(mmol/L)5.12±1.084.92±0.945.47±1.345.15±1.15肌酐/(μmol/L)61.57±10.3762.85±11.1466.83±12.1568.21±13.42葡萄糖/(mmol/L)5.05±0.425.10±0.425.03±0.475.13±0.45尿常规基本正常基本正常基本正常基本正常便常规基本正常基本正常基本正常基本正常
2.4 功效性指标测定结果
2.4.1 对TC的影响
试食组试食前后组内比较发现,试食后受试者血清TC含量显著下降(P<0.01),试食后与试食前相比,下降了9.52%;对照组试食前后组内比较TC含量无显著性差异(P>0.05),仅下降1.52%;试食前试食组与对照组比较,TC含量无显著性差异(P>0.05),而试食后试食组TC含量显著低于对照组(P<0.01),具体结果见表4。
表4 受试物对TC的影响
Table 4 Effect of test sample on TC

分组试食前/(mmol/L)试食后/(mmol/L)差值/(mmol/L)下降率/%试食组5.66±0.295.11±0.51**##0.55±0.60##9.52±10.44##对照组5.72±0.325.63±0.470.09±0.441.52± 7.70
注:**表示组内比较P<0.01;##表示组间比较P<0.01(下同)。
2.4.2 对TG的影响
由表5可见,试食组试食前后组内比较发现,试食后受试者血清TG含量显著下降(P<0.01),试食后与试食前相比,下降率为23.43%;对照组试食前后组内比较TG含量无显著性差异(P>0.05);试食前试食组与对照组相比,TG含量无显著性差异(P>0.05),而试食后试食组TG含量显著低于对照组(P<0.01)。
表5 受试物对TG的影响
Table 5 Effect of test sample on TG

分组试食前/(mmol/L)试食后/(mmol/L)差值/(mmol/L)下降率/%试食组1.98±0.161.51±0.41**##0.47±0.42##23.43±21.28##对照组1.98±0.171.90±0.470.08±0.454.04±23.05
2.4.3 对LDL-C的影响
试食组试食前后自身比较发现,LDL-C含量显著下降(P<0.01),试食后低于试食前,差值为0.41 mmol/L;对照组试食前后组内比较血清LDL-C含量无显著性差异(P>0.05);试食前试食组与对照组比较LDL-C无显著性差异(P>0.05);试食后试食组LDL-C含量显著低于对照组(P<0.01),具体结果见表6。
表6 受试物对LDL-C的影响 单位:mmol/L
Table 6 Effect of test sample on LDL-C

分组试食前试食后差值试食组3.58±0.823.18±0.87**## 0.41±0.58##对照组3.49±0.883.61±0.80-0.12±0.68
2.4.4 对HDL-C的影响
由表7可见,试食前后试食组、对照组组内比较HDL-C含量差异均无显著性(P>0.05);试食前、后试食组与对照组相比HDL-C含量均无显著性差异(P>0.05)。
表7 对受试物对HDL-C的影响 单位:mmol/L
Table 7 Effect of test sample on HDL-C

分组试食前试食后差值试食组1.51±0.411.52±0.41-0.00±0.20对照组1.46±0.341.52±0.41-0.06±0.29
2.4.5 有效率比较
试食组总有效率为35.8%,对照组总有效率为1.9%,试食组总有效率高于对照组,具体结果见表8。
表8 有效率情况比较
Table 8 Comparison of efficiency
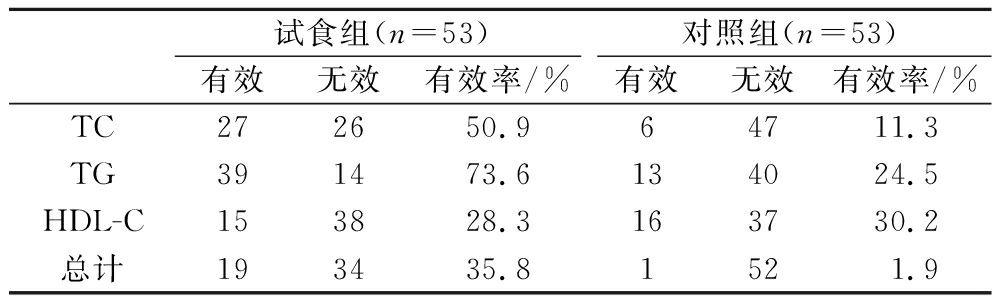
试食组(n=53)对照组(n=53)有效无效有效率/%有效无效有效率/%TC272650.964711.3TG391473.6134024.5HDL-C153828.3163730.2总计193435.81521.9
3 结论与讨论
心脑血管疾病已成为我国发病和死亡第一位的慢性疾病,血脂异常是心脑血管疾病的主要危险因素[17-18]。目前,市场的降血脂保健产品多以单一活性成分为主[19-20]。本产品以亚麻籽油磷虾油复配,主要功效成分为不饱和脂肪酸和磷脂,其中不饱和脂肪酸可以显著降低TC和LDL-C,磷脂可降低TC和TG,2种活性成分的协同作用下,可起到更好的降血脂作用。
本研究将符合纳入要求的高血脂受试者随机分为试食组和对照组,试食前两组间TC、TG、HDL-C无显著差异,具有可比性;试食组试食前后组内比较,TC平均下降0.55 mmol/L(P<0.01),平均下降百分率为9.52%,有效率50.9%;TG平均下降0.47 mmol/L(P<0.01),平均下降百分率为23.43%,有效率73.6%;LDL-C平均下降0.41 mmol/L(P<0.01),HDL-C无显著改变(P>0.05)。试食组53例中,总有效19例,总有效率35.8%,高于对照组(1.9%)。试食后试食组与对照组组间比较:试食组TC、TG、LDL-C含量均显著低于对照组(P<0.01),HDL-C含量差异无显著性(P>0.05)。因此,依据《关于印发抗氧化功能评价方法等9个保健功能评价方法的通知》(国食药监保化[2012]107号)附件6中的辅助降血脂功能评价方法,亚麻籽油磷虾油软胶囊具有辅助降血脂的功能。
[1] GOU Z Y, CUI X Y, LI L, et al.Effects of dietary incorporation of linseed oil with soybean isoflavone on fatty acid profiles and lipid metabolism-related gene expression in breast muscle of chickens[J].Animal:an International Journal of Animal Bioscience, 2020, 14(11):2414-2422.
[2] RAHIMINEZHAD Z, GAHRUIE H H, ESTEGHLAL S, et al.Oxidative stability of linseed oil nano-emulsions filled in calcium alginate hydrogels[J].LWT-Food Science and Technology, 2020, 127:109392.
[3] 杨敏, 魏冰, 孟橘, 等.ω-3多不饱和脂肪酸的来源及生理功能研究进展[J].中国油脂, 2019, 44(10):110-115.
YANG M, WEI B, MENG J, et al.Progress in sources and physiological function of ω-3 polyunsaturated fatty acids[J].China Oils and Fats, 2019, 44(10):110-115.
[4] 祁惠芳, 程子良, 孔维宝, 等.亚麻籽有效成分的提取及其综合利用研究进展[J].中国油脂, 2019, 44(11):102-107.
QI H F, CHENG Z L, KONG W B, et al.Progress in extraction and comprehensive utilization of effective components in flaxseed[J].China Oils and Fats, 2019, 44(11):102-107.
[5] ABDELHAMID A S, BROWN T J, BRAINARD J S, et al.Omega-3 fatty acids for the primary and secondary prevention of cardiovascular disease[J].The Cochrane Database of Systematic Reviews, 2018, 11(11):CD003177.
[6] AUNG T, HALSEY J, KROMHOUT D, et al.Associations of omega-3 fatty acid supplement use with cardiovascular disease risks:Meta-analysis of 10 trials involving 77917 individuals[J].JAMA Cardiology, 2018, 3(3):225-234.
[7] MANSON J E, COOK N R, LEE I M, et al.Marine n-3 fatty acids and prevention of cardiovascular disease and cancer[J].The New England Journal of Medicine, 2019, 380(1):23-32.
[8] SHRAMKO V S, POLONSKAYA Y V, KASHTANOVA E V, et al.The short overview on the relevance of fatty acids for human cardiovascular disorders[J].Biomolecules, 2020, 10(8):1127.
[9] XIE D, JIN J, SUN J, et al.Comparison of solvents for extraction of krill oil from krill meal:Lipid yield, phospholipids content, fatty acids composition and minor components[J].Food Chemistry, 2017, 233:434-441.
[10] CASTRO-G MEZ M P, HOLGADO F, RODR
MEZ M P, HOLGADO F, RODR GUEZ-ALCAL
GUEZ-ALCAL L M, et al.Comprehensive study of the lipid classes of krill oil by fractionation and identification of triacylglycerols, diacylglycerols, and phospholipid molecular species by using UPLC/QToF-MS[J].Food Analytical Methods, 2015, 8(10):2568-2580.
L M, et al.Comprehensive study of the lipid classes of krill oil by fractionation and identification of triacylglycerols, diacylglycerols, and phospholipid molecular species by using UPLC/QToF-MS[J].Food Analytical Methods, 2015, 8(10):2568-2580.
[11] AMATE L, GIL A, RAM REZ M.Feeding infant piglets formula with long-chain polyunsaturated fatty acids as triacylglycerols or phospholipids influences the distribution of these fatty acids in plasma lipoprotein fractions[J].The Journal of Nutrition, 2001, 131(4):1250-1255.
REZ M.Feeding infant piglets formula with long-chain polyunsaturated fatty acids as triacylglycerols or phospholipids influences the distribution of these fatty acids in plasma lipoprotein fractions[J].The Journal of Nutrition, 2001, 131(4):1250-1255.
[12] SUNG H H, SINCLAIR A J, HUYNH K, et al.Differential plasma postprandial lipidomic responses to krill oil and fish oil supplementations in women:A randomized crossover study[J].Nutrition, 2019, 65:191-201.
[13] LOBRAICO J M, DILELLO L C, BUTLER A D, et al.Effects of krill oil on endothelial function and other cardiovascular risk factors in participants with type 2 diabetes, a randomized controlled trial[J].BMJ Open Diabetes Research &Care, 2015, 3(1):e000107.
[14] TANDY S, CHUNG R W S, WAT E, et al.Dietary krill oil supplementation reduces hepatic steatosis, glycemia, and hypercholesterolemia in high-fat-fed mice[J].Journal of Agricultural and Food Chemistry, 2009, 57(19):9339-9345.
[15] LI Q, WU F J, WEN M, et al.The protective effect of Antarctic krill oil on cognitive function by inhibiting oxidative stress in the brain of senescence-accelerated prone mouse strain 8 (SAMP8) mice[J].Journal of Food Science, 2018, 83(2):543-551.
[16] BONATERRA G A, DRISCOLL D, SCHWARZBACH H, et al.Krill oil-in-water emulsion protects against lipopolysaccharide-induced proinflammatory activation of macrophages in vitro[J].Marine Drugs, 2017, 15(3):74.
[17] 孙丽英, 张翠, 康广盛.中医药治疗高脂血症的研究进展[J].中医药信息, 2004, 21(2):8-10.
SUN L Y, ZHANG C, KANG G S.Research progress of hyperlipidemia treated by traditional chinese medicine[J] Information on Traditional Chinese Medicine, 2004, 21(2):8-10.
[18] 王跃, 王恒哲, 杨露.高血脂症药物开发的发展态势分析[J].生物产业技术, 2016(5):89-98.
WANG Y, WANG H Z, YANG L.Analysis on the development trend of drug development for hyperlipidemia[J].Biotechnology &Business, 2016(5):89-98.
[19] 李彬, 彭亮, 赵鹏, 等.深海鱼油对人体安全性及降血脂作用研究[J].现代预防医学, 2014, 41(13):2339-2341.
LI B, PENG L, ZHAO P, et al.Study on the safety and antihyperlipidemic effects of deep-sea fish oil in human body[J].Modern Preventive Medicine, 2014, 41(13):2339-2341.
[20] 袁根良, 黄远英.鲑鱼油软胶囊辅助降血脂的人体作用研究[J].食品安全质量检测学报, 2016, 7(4):1568-1571.
YUAN G L, HUANG Y Y.Effects of salmon oil soft capsule on reducing blood lipids[J].Journal of Food Safety &Quality, 2016, 7(4):1568-1571.