甘露醇是具有多种功效的一种六糖醇,被广泛地应用于医药、食品、化工和电子等行业[1-2]。目前主要有4种方法生产甘露醇:海藻提取法产生大量废水、能耗高、污染严重;催化加氢法需在高温高压、贵金属催化和通氢气条件下进行且产物分离困难[3];酶转化法需要昂贵的辅酶,天津工业生物技术研究所构建了一锅化学计量合成法,但甘露醇产量只有9.6 g/L[4];微生物发酵法产甘露醇具有绿色清洁的特点,满足了产业转型升级的迫切需要。产甘露醇的细菌、酵母和霉菌中,进行异型乳酸发酵的细菌效果较好[5],其中明串珠菌、酒球菌和乳杆菌等[6]可将果糖底物转化为甘露醇。近几年本课题组[7-12]也尝试了基因敲除、基因过表达等手段改造菌株,转化率虽然较高,但甘露醇产量还未达到合成生物学“定量”投资逻辑学[13]和大宗化学品的高转化率、高产物浓度[14]的标准。另外,江南大学筛选获得了较优性能的甘露醇脱氢酶LpMDH编码基因和葡萄糖脱氢酶BaGDH编码基因并在大肠杆菌中共表达,以D-果糖为底物发酵24 h获得D-甘露醇的最高产量为81.9 g/L[15];HANKO等[16]利用钩虫贪铜菌经还原型戊糖磷酸循环途径自养生产了甘露醇,但产量只有3.9 g/L。
本研究提出了将底盘细胞转化为高产目标产物菌株的理论:细胞工厂的“源-库”学说,以便指导细胞工厂的遗传育种工作。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
肠膜明串珠菌(Leuconostoc mesenteroides)CCTCC M2018815[Δdts1ΔldhΔpat::mdhΔstpk::mdhΔfk::mdhΔaldh::(mtld-mlp)]、CGMCC1.10327、CCTCC M2020762[CCTCC M2018815 0385/0386::ldhA-eeΔadh::mepΔldh(0503)::mepΔldh(0373)::mep]、大肠杆菌(E.coli)DH5α、质粒pUC19均由本实验室保存。
1.1.2 试剂
高保真的DNA聚合酶、T4DNA连接酶,谦泰生物技术有限公司;PCR纯化试剂盒,Axygen公司;限制性内切酶、氨苄青霉素,大连宝生物工程有限公司;引物、FDH基因编码序列,金唯智生物科技有限公司(表1)。
表1 本研究中使用的引物
Table 1 Primers used in this study

名称序列ldhA1CGGAATTCAGTGCTTTAATTAGTG(EcoRI)ldhA2TCTTCATAAGATCCTCCAAAATTT(与FDH1序列互补配对)FDH1AGGATCTTATGAAGATCGTTTTA(与ldhA2序列互补配对)FDH2GCTCTAGATTACTTCTTATCGTG(XbaI)ldhA-ee1CCGTCTAGATAGAAAGTGCTTTAAT(XbaI)ldhA-ee2TCTGTCATATCCTCCAAAATTTTA(与0386-1序列互补配对)0386-1TGGAGGATATGACAGATATTAAAC(与ldhA-ee2序列互补配对)0386-2CAAGAATTCCTAAGTTCAACAATGA(EcoRI)0385-0386-l1GCGTCTAGAAGAGGTGTTGTTG(XbaI)0385-0386-l2TATTGGGTACCACTCGTGATGTGC(KpnI)0385-0386-r1CGAGTGGTACCCAATAGCCTCAAC(KpnI)0385-0386-r2CCCGAATTCCTGAACTAATACG(EcoRI)0385-1ATATCTAGAGTCAAAAACAACGTCT(XbaI)0385-2ACTTTCTATTATTCTGCCCCTTTCldhA-ee-0386-1CAGAATAATAGAAAGTGCTTTAATldhA-ee-0386-2ATAGAATTCCCTTGCGTAATAATAA(EcoRI)0373-l1GCGTCTAGAGATGAGTGGGCTG(XbaI)0373-l2GACTAGGTACCGTGTCGTTTCTGG(KpnI)0373-r1GACACGGTACCTAGTCTGAAGCCA(KpnI)0373-r2CGGGAATTCGCTGCCTTCGTAA(EcoRI)0503-l1CAGTCTAGATCCAGCAGTT(XbaI)0503-l2CAAACGGTACCCAATATCACG(KpnI)0503-r1TATTGGGTACCGTTTGATGTT(KpnI)0503-r2TATGAATTCGGGTTCTTGC(EcoRI)adhl1AGGTCGACTGATGGTTATG(SalI)adhl2ACACCGGTACCACAGGGTCTA(KpnI)adhr1CCTGTGGTACCGGTGTTACAA(KpnI)adhr2GCGGAATTCACTGTCTCAA(EcoRI)2043-l1CGGAATTCTTTTTATTGCTGTGTTTGTA(EcoRI)2043-l2GTGTATCTAGAATTAGATGATGCTTT-GTC(XbaI)2043-r1CTAATTCTAGATACACCAATCACAGCAAC(XbaI)2043-r2CCAAGCTTTGAAAAATGGACTGAAAAAA(HindIII)amy1CTTGGTACCTTTGGCGTGATTATCAG(KpnI)amy2TCAGGTACCCGAAGGTGAAGTTATAG(KpnI)amy01GCTCTAGATTTGGCGTGATTATCAG(XbaI)amy02GCTCTAGACGAAGGTGAAGTTATAG(XbaI)mep1GCGGTACCTAATTTTAAATATATG(KpnI)mep2CGGGTACCTATGTTAATCAAATAC(KpnI)FDH01GCTCTAGAAGTGCTTTAATTAGTGATTA-AAGCAA(XbaI)FDH02GCTCTAGATTACTTCTTATCGTGCTTAC-CGTAA(XbaI)
1.1.3 培养基与培养条件
E. coli用LB培养基培养,培养温度37 ℃;L. mesenteroides 用MRS培养基培养,培养温度30 ℃。
1.1.4 仪器
Eppendorf Mastercycler® nexus PCR仪,Eppendorf;Bio-Rad Gene Pluser XcellTM电转化仪,Bio-Rad;Agilent LC-20AD CTO-20A高效液相色谱仪,Agilent。
1.2 实验方法
1.2.1 基因表达盒的构建
(1)FDH基因表达盒:根据GenBank中登录号为AJ011046的博伊丁假丝酵母(Candida boidinii)的fdh(NAD+依赖型甲酸脱氢酶即EC 1.2.1.2)编码序列,按照明串珠菌染色体的密码子偏好性优化了核苷酸序列,并委托公司人工合成DNA序列。以L. mesenteroides CGMCC1.10327染色体DNA为模板,利用一对引物ldhA1/ldhA2 PCR扩增D-ldhA基因的表达元件;利用一对引物FDH1/FDH2 PCR扩增FDH编码序列;通过重叠延伸PCR将D-ldhA基因表达元件和FDH编码序列连接成为FDH基因表达盒。
(2)0386基因表达盒:以L. mesenteroides CGMCC1.10327染色体DNA为模板,利用2对引物ldhA-ee1/ldhA-ee2、0386-1/0386-2,通过重叠延伸PCR将表达元件序列和0386编码序列连接成为0386基因(部分序列)的表达盒。
1.2.2 同源重组载体的构建
(1)用于打断0385-0386操纵子和重叠基因模式的同源重组载体:利用2对引物0385-0386-l1/0385-0386-l2、0385-0386-r1/0385-0386-r2,通过重叠延伸PCR获得的产物后将其插入到pUC19的EcoRI和XbaI位点上,成为中间带有KpnI识别序列的0385-0386基因的同源重组载体。以L. mesenteroides CGMCC1.10327染色体DNA为模板,利用2对引物0385-1/0385-2、ldhA-ee-0386-1/ldhA-ee-0386-2,进行重叠延伸PCR,其产物为0385(以终止密码子结束的终止密码子一侧的部分序列)-ldhA-ee-A-0386(以起始密码子开始的起始密码子一侧部分序列)序列,即中间带有表达元件序列(ldhA-ee)-A的0385-0386基因同源重组载体。
(2)用于在染色体上定点插入mep序列(甘露醇外排泵蛋白)的同源重组载体:分别利用2对引物(0373-l1/0373-l2、0373-r/0373-r2)(0503-l1/0503-l2、0503-r1/0503-r2)(adhl1/adhl2、adhr1/adhr2),通过重叠延伸PCR后将其获得的产物插入到pUC19的EcoRI和XbaI(乙醇脱氢酶基因同源重组载体为SalI)位点上,分别成为中间带有KpnI识别序列的0373(乳酸脱氢酶)、0503(乳酸脱氢酶)和乙醇脱氢酶基因的同源重组载体。
(3)用于NADH再生的同源重组载体:利用2对引物2043-l1/2043-l2、2043-r1/2043-r2,通过重叠延伸PCR后将其获得的产物插入到pUC19的EcoRI和HindIII位点上,成为中间带有XbaI识别序列的2043(乳酸脱氢酶)基因的同源重组载体。
以pCW7[17]为模板,利用一对引物amy1/amy2(amy01/amy02)通过PCR获得的产物后将其插入到同源重组载体KpnI(XbaI)位点上,成为中间带有α-淀粉酶基因标记的同源重组载体。分别以mep序列和FDH表达盒序列为模板,分别利用一对引物mep1/mep2(FDH01/FDH02)通过PCR获得的产物后将其插入到同源重组载体的KpnI(XbaI)位点上,分别成为中间带有mep序列和FDH表达盒的同源重组载体。
1.2.3 突变菌株的构建和验证
参照文献[18]的方法进行明串珠菌的电击转化。通过2次同源重组获得相关序列定点插入到染色体的突变菌株。第一次同源重组:用中间带有α-淀粉酶基因标记的同源重组载体转化初始菌株,在平板上获得蓝色的目的菌株,即靶基因失活、带有标记基因的菌株。第二次同源重组:用中间带有表达元件序列-A的0385-0386基因同源重组载体或中间带有mep序列或FDH表达盒的同源重组载体转化第一次同源重组获得的目的菌株,在平板上获得白色的目的菌株,即靶基因失活、定点插入相关序列的菌株。
以染色体DNA为模板,利用一对引物进行PCR,经过琼脂糖凝胶电泳条带的大小来验证定点插入位点失活、插入位点带有标记基因和插入位点带有相关序列的菌株。
1.2.4 荧光定量PCR验证
以原始菌株与突变菌株RNA反转录得到的cDNA作为模板,以Test-F/R为引物,进行RT-PCR验证。以16S rRNA为管家基因,用相对定量2-ΔΔCT法计算0386基因(或FDH基因)在突变菌株与原始菌株之间的相对表达水平,重复3次。
1.2.5 发酵产甘露醇和液相检测
野生型菌株和突变菌株用发酵培养基[18]进行摇瓶发酵20 h,用HPLC测定甘露醇含量,参照文献[9]。敲入FDH表达盒菌株的发酵培养基中,添加15 g/L的甲酸钠。
2 结果与分析
2.1 基因表达盒的构建
第1轮PCR扩增得到了预期长度为1 111 bp的FDH编码序列(图1-a)和193 bp的D-ldh基因表达元件(图1-b)。第2轮PCR通过2个第1轮PCR产物末端的反向互补序列相互退火结合,构建成D-ldh基因表达元件和FDH编码序列连接在一起的DNA融合体。但是此时该融合体的量比较少,经过第3轮PCR特异性地扩增,成功得到了预期为1 296 bp的FDH基因表达盒(图1-c)。

a-FDH编码序列;b-D-ldh基因表达元件;c-FDH基因表达盒;d-D-ldh基因表达元件和0386部分编码序列;e-0386基因表达盒+起始密码子一侧的部分编码序列
图1 合成基因表达盒的重叠延伸PCR
Fig.1 Overlapping extension PCR for the synthesis of gene expression cassette
注:1-MarkerII;2-FDH编码序列;3-MarkerII;4-D-ldh基因表达元件;5-2K plus Marker;6-FDH表达盒;7-D-ldh基因表达元件;8-Marker;9-0386基因编码序列(起始密码子一侧的部分);10-0386基因(部分序列)表达盒;11-Marker。
第1轮PCR扩增得到了预期长度为180 bp的D-ldh基因表达元件和810 bp的0386部分编码序列(图1-d)。第2轮PCR利用2个第1轮PCR产物末端的反向互补序列相互退火结合,并通过8轮循环使2个DNA片段重叠延伸,经过第3轮PCR特异性地扩增,成功得到了预期为970 bp的0386基因表达盒+起始密码子一侧的部分编码序列(图1-e)。
2.2 同源重组载体的构建
构建好的同源重组载体经酶切验证,其琼脂糖凝胶电泳结果见图2~图6,可知定点插入位点序列的同源重组载体、携带α-淀粉酶基因标记的同源重组载体和携带欲敲入序列的同源重组载体都准确无误。

a-携带左右同源臂的同源重组载体;b-携带α-淀粉酶基因标记的同源重组载体;c-携带欲敲入序列的同源重组载体
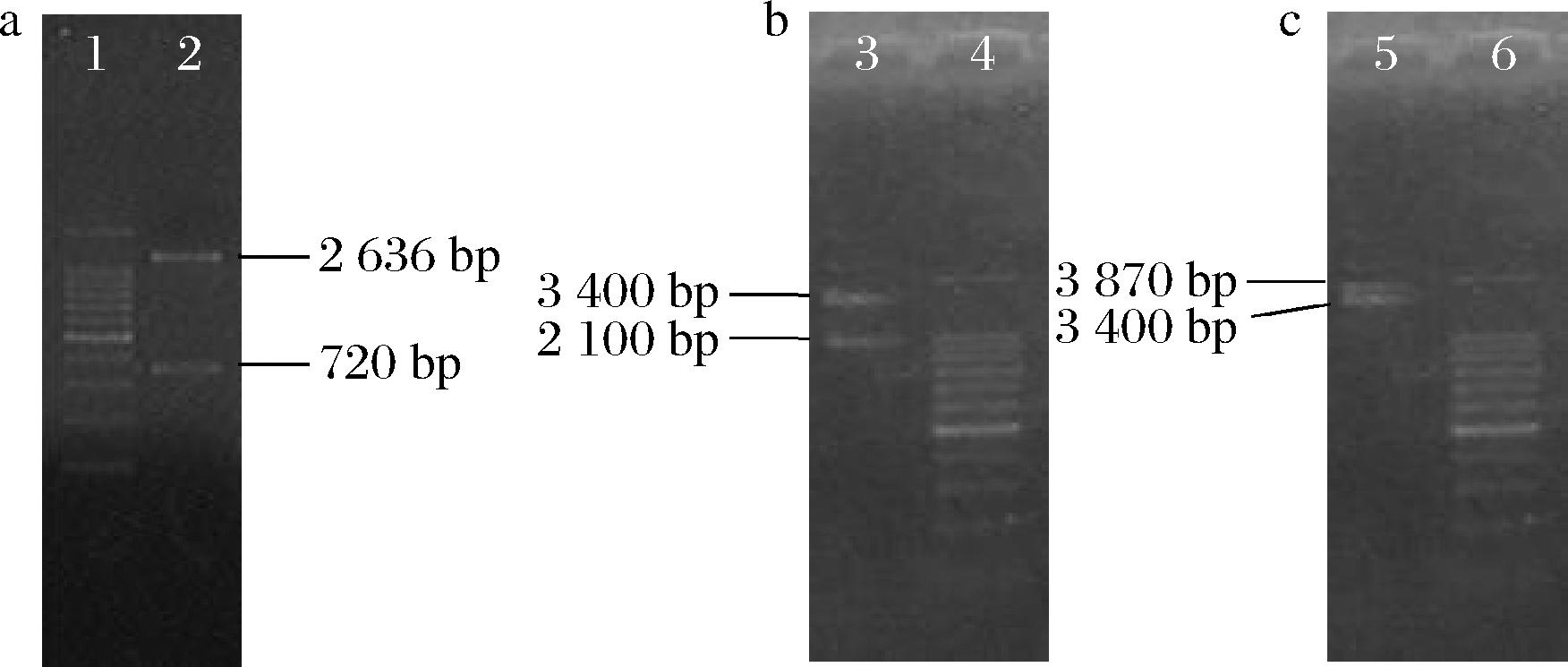
图2 用于打破0385-0386操纵子和重叠基因的同源重组载体
Fig.2 Vector of homologous recombination for breaking 0385-0386 operon and overlapping gene
注:2、3、6-Marker;1-同源重组载体经EcoRI和XbaI酶切产生的载体和左右同源臂连接体;4-携带α-淀粉酶基因标记的同源重组载体经KpnI酶切产生的载体+左右同源臂连接体和α-淀粉酶基因表达盒;5-携带欲敲入序列的同源重组载体经EcoRI和XbaI酶切产 生的载体和左右同源臂+表达元件序列-A连接体条带。
a-携带左右同源臂的同源重组载体;b-携带α-淀粉酶基因标记的同源重组载体;c-携带欲敲入序列的同源重组载体
图3 乳酸脱氢酶基因0373的同源重组载体
Fig.3 Vector of homologous recombination for lactate dehydrogenase gene 0373
注:1、4、6-Marker;2-同源重组载体经EcoRI和XbaI酶切产生的载体和左右同源臂连接体;3-携带α-淀粉酶基因标记的同源重组载体经KpnI酶切产生的载体+左右同源臂连接体和α-淀粉酶基因表达盒;5-携带欲敲入序列的同源重组载体经KpnI酶切产生的mep 条带和载体+左右同源臂连接体条带。

a-携带左右同源臂的同源重组载体;b-携带α-淀粉酶基因标记的同源重组载体;c-携带欲敲入序列的同源重组载体
图4 乳酸脱氢酶基因0503的同源重组载体
Fig.4 Vector of homologous recombination for lactate dehydrogenase gene 0503
注:1、4、6-Marker;2-同源重组载体经EcoRI和XbaI酶切产生的载体和左右同源臂连接体;3-携带α-淀粉酶基因标记的同源重组载体经KpnI酶切产生的载体+左右同源臂连接体和α-淀粉酶基因表达盒;5-携带欲敲入序列的同源重组载体经KpnI酶切产生的mep 条带和载体+左右同源臂连接体条带。

a-携带左右同源臂的同源重组载体;b-携带α-淀粉酶基因标记的同源重组载体;c-携带欲敲入序列的同源重组载体
图5 乙醇脱氢酶基因的同源重组载体
Fig.5 Vector of homologous recombination for alcohol dehydrogenase gene
注:2、4、6-Marker;1-同源重组载体经EcoRI和SalI酶切产生的载体和左右同源臂连接体;3-携带α-淀粉酶基因标记的同源重组载体经KpnI酶切产生的载体+左右同源臂连接体和α-淀粉酶基因表达盒;5-携带欲敲入序列的同源重组载体经KpnI酶切产生的mep 条带和载体+左右同源臂连接体条带。
a-携带左右同源臂的同源重组载体;b-携带α-淀粉酶基因标记的同源重组载体;c-携带欲敲入序列的同源重组载体
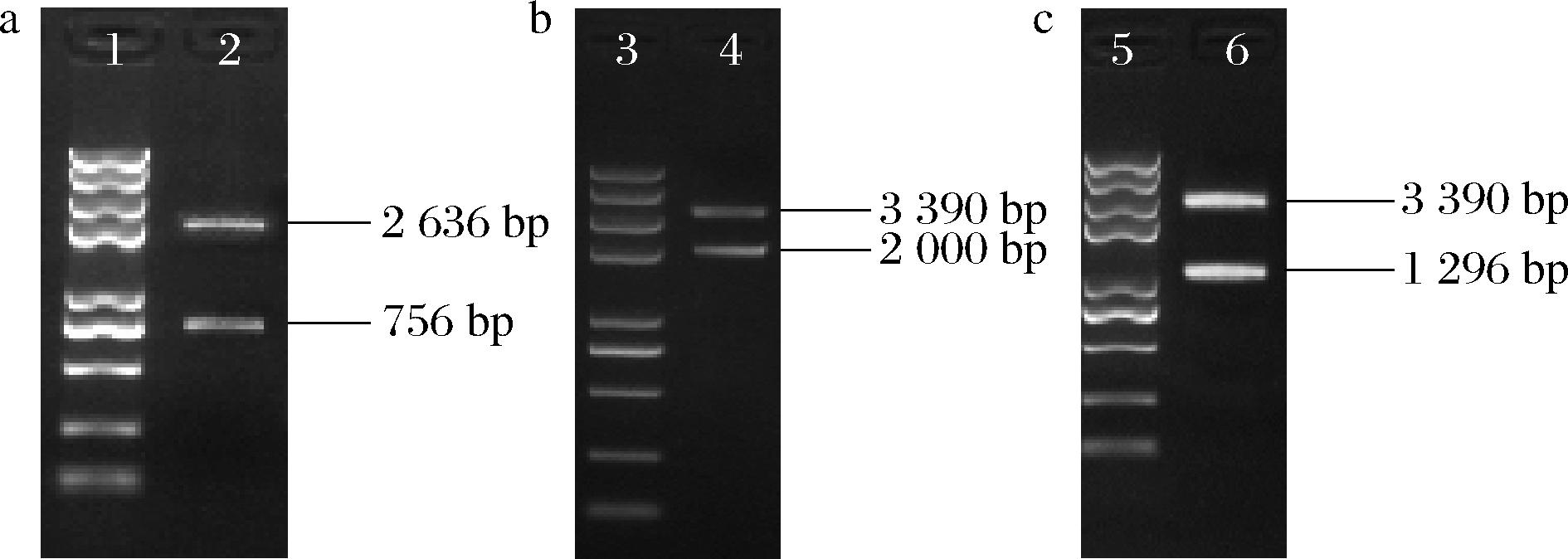
图6 乳酸脱氢酶基因2043的同源重组载体
Fig.6 Vector of homologous recombination for lactate dehydrogenase gene 2043
注:1、3、5-2K plus Marker;2-同源重组载体经EcoRI和HindIII酶切产生的载体和左右同源臂连接体;4-携带α-淀粉酶基因标记的同源重组载体经XbaI酶切产生的载体+左右同源臂连接体条带和α-淀粉酶标记基因;6-携带欲敲入序列的同源重组载体经XbaI酶切 产生的载体+左右同源臂连接体条带和FDH表达盒。
2.3 敲入基因表达盒的验证
设定原始菌株的表达量为1,由RT-定量PCR结果可知,在突变菌株中,0386的相对表达量在打断操纵子和重叠基因模式的菌株为1.081,敲入1个拷贝mep的菌株为1.450,敲入2个拷贝mep的菌株为2.972,敲入3个拷贝mep的菌株为5.882,证明了两点,一是打断操纵子和重叠基因模式也提升基因表达量,二是mep基因表达量随着0386拷贝数的增加而增加。
RT-定量PCR结果显示,在突变菌株中FDH的相对表达量0.506,说明原始菌株染色体中没有的FDH基因在突变菌株中异源表达成功。
2.4 基因的操纵子和重叠基因模式对产甘露醇的影响
在原核生物染色体中的很多基因以操纵子和/或重叠基因模式排列的,操纵子的相邻结构基因之间或重叠基因插入表达元件(启动子和RBS)和相关核苷酸序列,可以改善基因表达效率。
具有两个核苷酸结合域和两个跨膜结构域的ABC转运蛋白分为内向转运蛋白和外向转运蛋白2种,其中大多数原核生物的ABC型外向转运蛋白与胞内“有毒物质”的输出相关。肠膜明串珠菌L. mesenteroides subsp.mesenteroides ATCC8293的基因组中,注释为ABC型多药转运系统的LEUM_0385和LEUM_0386,经生物信息学分析表明,构成异源二聚体而发挥外排泵的作用。0385和0386以操纵子和重叠基因的方式存在于原始菌株的染色体中,即0385和0386共用同一个表达元件并依次排列着,而且0385和0386的编码框共用同一个核苷酸(A),见图7。乳糖操纵子中lacY和lacA表达效率的远低于lacZ[19],以α-淀粉酶基因为筛选标记、通过2次同源重组打破了基因的操纵子和重叠基因模式,即染色体0385和0386的核苷酸序列(0385的终止密码子TAA和0386的起始序列tg aca)之间敲入了D-ldh基因的EE(表达元件Expression Element)-A(核苷酸),从而提高0386的表达量,进而增加了甘露醇的产量(见图8)。本研究将打破操纵子和重叠基因模式的0385-EE-A-0386称为mep(甘露醇外排泵)。

图7 0385-0386基因序列在明串珠菌染色体中的排列
Fig.7 The arrangement of 0385-0386 gene sequence in Leuconostoc chromosome
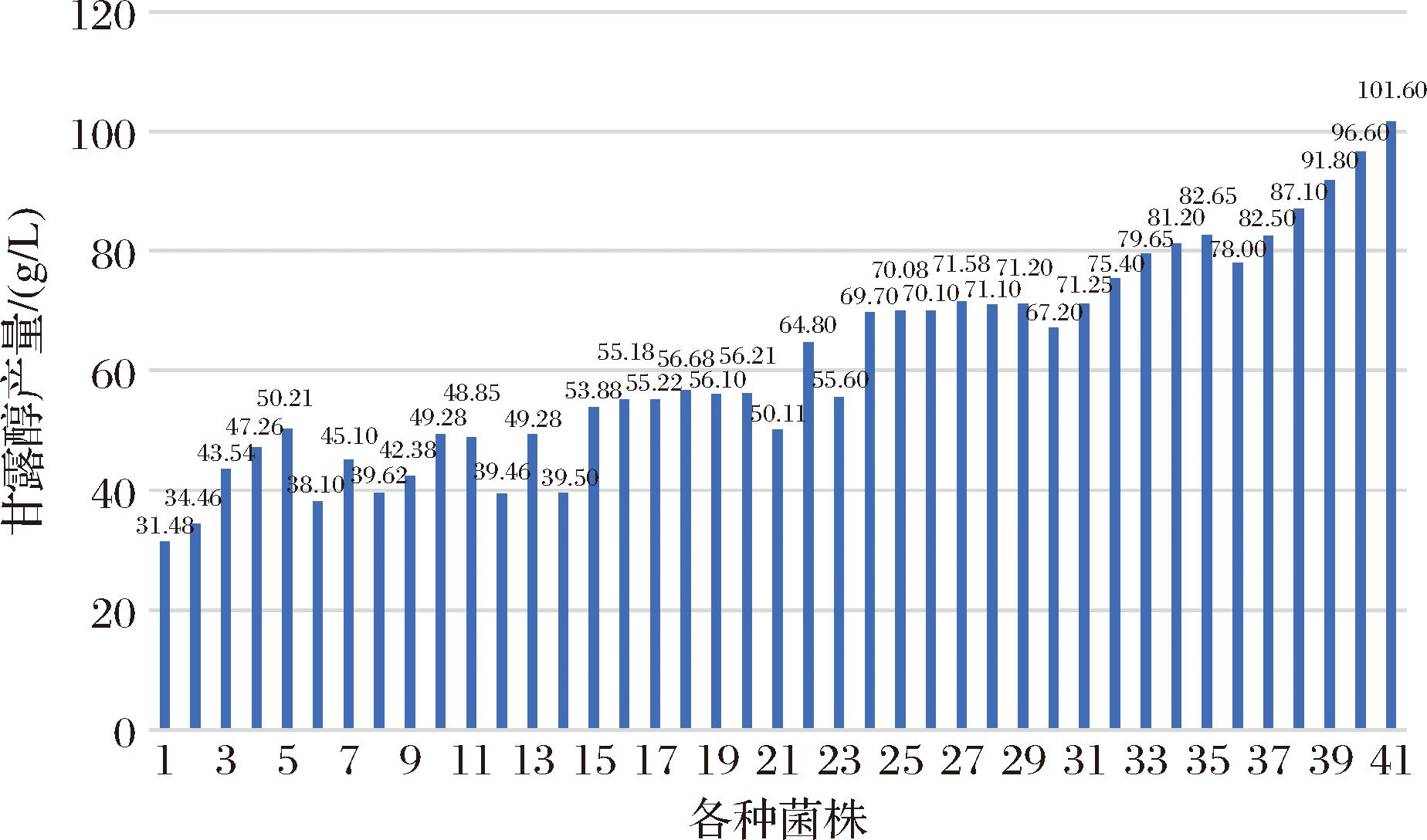
图8 明串珠菌发酵产甘露醇的产量
Fig.8 Yield of mannitol produced by Leuconostoc fermentation
1-原始野生菌株、底物-蔗糖为90 g/L;2~3-原始菌打破操纵子和重叠基因模式的菌株(2-蔗糖为90 g/L;3-蔗糖为110 g/L);4-CCTCC M2018815、蔗糖为90 g/L;5-CCTCC M2018815打破操纵子和重叠基因模式的菌株、蔗糖为90 g/L;6~7-原始菌adh位点敲入一个拷贝mep序列的菌株(6-蔗糖为90 g/L;7-蔗糖为110 g/L);8~9-原始菌aldh位点敲入一个拷贝AcrB序列的菌株(8-蔗糖为90 g/L;9-蔗糖为110 g/L);10-原始菌打破操纵子和重叠基因模式并乳酸脱氢酶0373位点敲入一个拷贝mep序列的菌株、蔗糖为110 g/L;11-原始菌aldh和dts(葡聚糖蔗糖酶)2个位点各敲入1个拷贝AcrB序列的菌株、蔗糖为110 g/L;12~13-原始菌打破操纵子和重叠基因模式并乳酸脱氢酶0373位点敲入一个拷贝mep序列的菌株(12-蔗糖为90 g/L;13-110 g/L);14~17-原始菌打破操纵子和重叠基因模式并乳酸脱氢酶0373和0503 2个位点各敲入一个拷贝mep序列的菌株(14-蔗糖为90 g/L;15-蔗糖为110 g/L;16-蔗糖为120 g/L;17-蔗糖为130 g/L);18~20-原始菌打破操纵子和重叠基因模式并乳酸脱氢酶0373、0503和adh 3个位点各敲入一个拷贝mep序列的菌株(18-蔗糖为120 g/L;19-蔗糖为130 g/L;20-蔗糖为135 g/L);21~22-CCTCC M2018815打破操纵子和重叠基因模式的菌株并乳酸脱氢酶0373位点敲入一个拷贝mep序列的(21-蔗糖为90 g/L;22-蔗糖为110 g/L);23~26-CCTCC M2018815打破操纵子和重叠基因模式并乳酸脱氢酶0373和0503两个位点各敲入一个拷贝mep序列的菌株(23-蔗糖为90 g/L;24-蔗糖为110 g/L;25-蔗糖为120 g/L;26-蔗糖为130 g/L);27~29-CCTCC M2018815打破操纵子和重叠基因模式并乳酸脱氢酶0373、0503和adh 3个位点各敲入一个拷贝mep序列的菌株(27-蔗糖为120 g/L;28-蔗糖为130 g/L;29-蔗糖为135 g/L);30~35-CCTCC M2018815为出发菌(30-蔗糖为120 g/L;31-蔗糖为125 g/L;32-蔗糖为130 g/L;33-蔗糖为135 g/L;34-蔗糖为140 g/L;35-蔗糖为145 g/L);36~41-CCTCC M2020762为出发菌(36-蔗糖为120 g/L;37-蔗糖为125 g/L;38-蔗糖为130 g/L;39- 蔗糖为135 g/L;40-蔗糖为140 g/L;41-蔗糖为145 g/L)
2.5 甘露醇外排泵对产甘露醇的影响
由图8可知,E.coli的AcrB敲入染色体中[20],在明串珠菌中异源表达时促进甘露醇的外排而提高甘露醇产量的作用,不如明串珠菌本身的mep,故本研究利用mep克服了培养基中添加底物的限制,即没有AcrB的异源表达或没有mep的超表达时,培养基中至多加入90 g/L底物-蔗糖。
由图8可知,以原始菌或为CCTCC M2018815出发菌,在染色体上敲入mep序列,都大幅度地提高了菌株的甘露醇产量,构建的较高产甘露醇的菌株-CCTCC M2020762,以120 g/L蔗糖为底物,达到甘露醇产量为71.58 g/L、转化率为59.65%。因克服了培养基中添加底物的限制,底物-蔗糖推动着葡萄糖到甘露醇的转化,从而使CCTCC M2020762比CCTCC M2018815不仅提高了甘露醇产量,还提升了转化率(CCTCC M2018815为52.51%[9])。
2.6 NADH再生对产甘露醇的影响
用于NADH再生的酶编码基因有甲酸脱氢酶[21-22]、亚磷酸脱氢酶[22-23]和葡萄糖脱氢酶[24],其中亚磷酸盐价钱较昂贵而不适合应用于甘露醇的发酵生产中,再生NADH时C6的葡萄糖用量为C1的甲酸6倍之多,故本研究采用甲酸脱氢酶基因。
由图8可知,不管是以CCTCC M2018815为出发菌,还是以CCTCC M2020762为出发菌,NADH的再生使明串珠菌提高了甘露醇产量,最终构建的高产菌株,底物-蔗糖为145 g/L、甘露醇产量为101.60 g/L、转化率为70.0%。NADH不仅推动蔗糖中果糖部分转化为甘露醇,还推动葡萄糖→葡萄糖-6-磷酸→果糖-6-磷酸→甘露醇-1-磷酸→甘露醇途径的转化,进而提高转化率。
2.7 甘露醇外排泵和还原力的协同
以CCTCC M2018815为出发菌,敲入mep序列而构建的菌株转化率为59.65%,敲入FDH表达盒的菌株最高的转化率为57.0%,只有同时敲入mep序列和FDH表达盒的菌株转化率最高提升到70.0%。在胞内底物转化为甘露醇的过程中蔗糖和NADH都缺一不可,且甘露醇的产量形成过程中甘露醇外排泵蛋白的作用也是非常重要的。
3 讨论
3.1 细胞工厂的“源-库”
“源-库”学说,是指源和库在控制绿色植物同化物运输和分配方面的理论;源是指生产同化物及向其他器官提供营养的器官,而库是指消耗或积累同化物的接纳器官。库对源有反馈作用,能调动源内有机物向其转移;源库之间运输流畅是指源端物质的不断输出和库端的及时利用与储备;如果库端不能充分容纳与利用源端的同化物,则同化物不能及时从通道上部输出,源端同化物的供应及继续合成过程就会减弱,引起反馈抑制。借鉴植物生理学中的“源-库”学说,细胞工程中建立细胞工厂的“源-库”学说,来指导构建高产目标代谢物的细胞菌株。
通过甘露醇脱氢酶的催化将果糖转化为甘露醇过程中,可以把果糖和NADH当作底物。敲除乙醇脱氢酶基因、乙醛脱氢酶基因[7]、乳酸脱氢酶基因[7]、乙酰磷酸转移酶基因[7]都能节约NADH而提高果糖的转化率,敲除葡聚糖蔗糖酶基因[18]、敲除丝氨酸/苏氨酸蛋白激酶基因[7]能节约蔗糖而提高果糖的转化率,敲除果糖激酶基因能节约果糖而提高果糖的转化率,属于节流手段;敲入甘露醇脱氢酶基因[7]、利用菊粉产甘露醇[10]、开辟葡萄糖→葡萄糖-6-磷酸→果糖-6-磷酸→甘露醇-1-磷酸→甘露醇的途径[9]、增强产NADH的能力而提高甘露醇产量等手段都属于开源;通过开源节流而增强“源”能,最终达到甘露醇高产的目的。
在明串珠菌染色体中定点插入甘露醇外排泵蛋白编码基因表达盒,将更多的产物排出到胞外,若产物为抗生素,进行自我解毒(将抗生素进行化学修饰、或将抗生素以无/低活性前体形式储存在体内、或将抗生素在体内区域化隔离、或产生抗生素的抗性蛋白)[25]。在大肠杆菌细胞质内构建超分子支架系统,增加乙醇的产生[26];在酵母菌中通过区室化代谢途径将代谢途径分隔在特定的亚细胞区域(过氧化物酶体或线粒体或液泡),可以隔离含毒性化合物,将酶催化反应导向特定底物以及建立不同的化学反应[27];在盐单胞菌构建PHB生物合成体系时,过表达细胞分裂抑制剂MinCD而使细胞拉长[28]、改变细胞形状(从杆状变为纤维状或者小球体变成大球体)[29]、失活细胞骨架蛋白编码基因mreB和细胞分裂蛋白编码基因ftsZ而增加细胞大小和长度并增大细胞容积[30]。细胞工厂生产的化合物溶解性差或毒性高时,通过硫酸化将目的化合物转化为硫酸盐结合物[31]或包裹在细菌微室中[32];通过糖基化修饰将柚皮素转化为柚皮素-7-O-葡萄糖苷,从而降低酵母细胞的毒性并促进胞外分泌和增加水溶性[33]。酵母发酵生产虾青素时,脂滴成为虾青素的库[34],这些都属于增大“库”容的手段。
3.2 FDH和mep的作用机理
FDH促进产甘露醇,在明串珠菌细胞中甘露醇脱氢酶以蔗糖中的果糖部分为底物产生甘露醇,这一过程中产生一分子甘露醇就消耗一分子NADH。FDH以甲酸为底物,产生还原型辅酶NADH。本研究中底物甲酸钠为15 g/L,从而至多产生0.220 5 mol的NADH。FDH提供NADH而直接推动果糖→甘露醇的转化;CCTCC M2018815(构建有葡萄糖→葡萄糖-6-磷酸→果糖-6-磷酸→甘露醇-1-磷酸→甘露醇的途径)的果糖-6-磷酸→甘露醇-1-磷酸的转化过程也消耗NADH,就是说,NADH还推动果糖-6-磷酸→甘露醇-1-磷酸的转化,最终效果是提高甘露醇产量。简而言之,NADH是促进底物转化为产物的直接“源能”,在发酵过程中表现为打破添加底物的限制。
mep促进产甘露醇,将胞内的甘露醇转运到胞外,从而提高甘露醇产量;从化学平衡角度讲,不断地将胞内目的代谢物泵到胞外,腾出胞内的代谢物“库容”,进而促进反应物不断地向产物方向转化,在发酵过程中表现为打破添加底物的限制。
4 结论
(1)改变原核生物染色体中的操纵子和重叠基因排列模式,可以改善基因表达效率;(2)使细胞工厂具备更强的“源”能和更大的“库”容,从而达到目标产物超高产的目的。不管“源”能还是“库”容,最终都归结到底物转化为目标产物的化学平衡。
[1] MART NEZ-MIRANDA J G, CHAIREZ I, DUR
NEZ-MIRANDA J G, CHAIREZ I, DUR N-P
N-P RAMO E.Mannitol production by heterofermentative lactic acid bacteria:A review[J].Applied Biochemistry and Biotechnology, 2022, 194(6):2762-2795.
RAMO E.Mannitol production by heterofermentative lactic acid bacteria:A review[J].Applied Biochemistry and Biotechnology, 2022, 194(6):2762-2795.
[2] LIANG P X, CAO M F, LI J, et al.Expanding sugar alcohol industry:Microbial production of sugar alcohols and associated chemocatalytic derivatives[J].Biotechnology Advances, 2023, 64:108105.
[3] ZHANG M, GU L, CHENG C, et al.High-yield production of mannitol by Leuconostoc pseudomesenteroides CTCC G123 from chicory-derived inulin hydrolysate[J].Journal of Industrial Microbiology &Biotechnology, 2017, 44(8):1237-1244.
[4] WEI X L, LI Q Z, HU C C, et al.An ATP-free in vitro synthetic enzymatic biosystem facilitating one-pot stoichiometric conversion of starch to mannitol[J].Applied Microbiology and Biotechnology, 2021, 105(5):1913-1924.
[5] SAHA B C, RACINE F M.Biotechnological production of mannitol and its applications[J].Applied Microbiology and Biotechnology, 2011, 89(4):879-891.
[6] OTGONBAYAR G E, EOM H J, KIM B S, et al.Mannitol production by Leuconostoc citreum KACC 91348P isolated from Kimchi[J].Journal of Microbiology and Biotechnology, 2011, 21(9):968-971.
[7] PENG Y W, JIN H X.Effect of the pat, fk, stpk gene knock-out and mdh gene knock-in on mannitol production in Leuconostoc mesenteroides[J].Journal of Microbiology and Biotechnology, 2018, 28(12):2009-2018.
[8] 金红星, 卢哲, 成文玉.一株高产甘露醇的肠膜明串珠菌突变菌株及其应用方法:中国, CN201711169481[P].2018-04-06.
JIN H X, LU Z, CHENG W Y.Leuconostoc mesenteroides mutant strain with high mannitol yield and application method:China, CN201711169481[P].2018-04-06.
[9] 金红星, 王星, 彭钰玮.在明串珠菌中构建葡萄糖到甘露醇的转化体系[J].食品与发酵工业, 2019, 45(12):96-100;108.
JIN H X, WANG X, PENG Y W.Enhanced biosynthesis of mannitol in Leuconostoc sp.expressed mt1 d-m1p[J].Food and Fermentation Industries, 2019, 45(12):96-100;108.
[10] 金红星, 彭钰玮, 成文玉.一株能利用菊粉的肠膜明串珠菌突变菌株及其应用方法:中国, CN 2019113382168[P].2020-04-24.
JIN H X, PENG Y W, CHENG W Y.Leuconostoc mesenteroides mutant strain capable of utilizing inulin and application method:China, CN 2019113382168[P].2020-04-24.
[11] 金红星, 闫博.一株高产甘露醇的肠膜明串珠菌突变菌株及其应用方法:中国, CN 2018115455031[P].2019-04-09.
JIN H X, YAN B.Leuconostoc mesenteroides mutant strain with high mannitol yield and application method:China, CN 2018115455031[P].2019-04-09.
[12] 金红星, 刘玉秀, 成文玉.一株高产甘露醇的肠膜明串珠菌突变菌株及其应用方法:中国, CN 2018115617407[P].2019-04-09.
JIN H X, LIU Y X, CHENG W Y.Leuconostoc mesenteroides mutant strain with high mannitol yield and application method:China, CN 2018115617407[P].2019-04-09.
[13] CHOI K R, JANG W D, YANG D, et al.Systems metabolic engineering strategies:Integrating systems and synthetic biology with metabolic engineering[J].Trends in Biotechnology, 2019, 37(8):817-837.
[14] SELVARAJOO K.Computational Biology and Machine Learning for Metabolic Engineering and Synthetic Biology[M].New York:Humana Press, 2023.
[15] 潘珊, 胡孟凯, 潘学玮, 等.基于双酶级联协调表达策略高效催化合成D-甘露醇[J].生物工程学报, 2022, 38(7):2549-2565.
PAN S, HU M K, PAN X W, et al.Efficient biosynthesis of D-mannitol by coordinated expression of a two-enzyme cascade[J].Chinese Journal of Biotechnology, 2022, 38(7):2549-2565.
[16] HANKO E K R, SHERLOCK G, MINTON N P, et al.Biosensor-informed engineering of Cupriavidus necator H16 for autotrophic D-mannitol production[J].Metabolic Engineering, 2022, 72:24-34.
[17] 田云飞, 刘晓莉, 成文玉, 等.α-淀粉酶基因在肠膜明串珠菌基因表达中的应用[J].食品工业科技, 2016, 37(10):203-207.
TIAN Y F, LIU X L, CHENG W Y, et al.Study on application of α-amylase gene in the gene expression of Leuconostoc mesenteroides[J].Science and Technology of Food Industry, 2016, 37(10):203-207.
[18] ZHANG Z, CHENG W Y, JU X Y, et al.The effect of dextransucrase gene inactivation on mannitol production by leuconostoc mesenteroides[J].Indian Journal of Microbiology, 2015, 55(1):35-40.
[19] STEVENS C S, DEVILLEZ R L.Enzymology, with applications to dermatology[J].International Journal of Dermatology, 1980, 19(6):295-309.
[20] 刘玉秀. AcrB基因敲入对明串珠菌产甘露醇的影响[D].天津:河北工业大学, 2019.
LIU Y X.Effect of the AcrB knock-in on mannitol production in Leuconostoc[D].Tianjin:Hebei University of Technology, 2019.
[21] M DJE K, SCHMÖLZER K, NIDETZKY B, et al.Host cell and expression engineering for development of an E.coli ketoreductase catalyst:Enhancement of formate dehydrogenase activity for regeneration of NADH[J].Microbial Cell Factories, 2012, 11:7.
DJE K, SCHMÖLZER K, NIDETZKY B, et al.Host cell and expression engineering for development of an E.coli ketoreductase catalyst:Enhancement of formate dehydrogenase activity for regeneration of NADH[J].Microbial Cell Factories, 2012, 11:7.
[22] RESHAMWALA S M S, PAGAR S K, VELHAL V S, et al.Construction of an efficient Escherichia coli whole-cell biocatalyst for D[J].Journal of Bioscience and Bioengineering, 2014, 118(6):628-631.
[23] COSTAS A M G, WHITE A K, METCALF W W.Purification and characterization of a novel phosphorus-oxidizing enzyme from Pseudomonas stutzeri WM88[J].Journal of Biological Chemistry, 2001, 276(20):17429-17436.
[24] LI J X, HUANG Y Y, CHEN X R, et al.Enhanced production of optical (S)-acetoin by a recombinant Escherichia coli whole-cell biocatalyst with NADH regeneration[J].RSC Advances, 2018, 8(53):30512-30519.
[25] GUI C, CHEN J, XIE Q, et al.CytA, a reductase in the cytorhodin biosynthesis pathway, inactivates anthracycline drugs in Streptomyces[J].Communications Biology, 2019, 2:454.
[26] LEE M J, MANTELL J, HODGSON L, et al.Engineered synthetic scaffolds for organizing proteins within the bacterial cytoplasm[J].Nature Chemical Biology, 2018, 14:142-147.
[27] DELOACHE W C, RUSS Z N, DUEBER J E.Towards repurposing the yeast peroxisome for compartmentalizing heterologous metabolic pathways[J].Nature Communications, 2016, 7:11152.
[28] TAN D, WU Q, CHEN J C, et al.Engineering Halomonas TD01 for the low-cost production of polyhydroxyalkanoates[J].Metabolic Engineering, 2014, 26:34-47.
[29] JIANG X R, CHEN G Q.Morphology engineering of bacteria for bio-production[J].Biotechnology Advances, 2016, 34(4):435-440.
[30] JIANG X R, YAO Z H, CHEN G Q.Controlling cell volume for efficient PHB production by Halomonas[J].Metabolic Engineering, 2017, 44:30-37.
[31] JENDRESEN C B, NIELSEN A T.Production of zosteric acid and other sulfated phenolic biochemicals in microbial cell factories[J].Nature Communications, 2019, 10(1):4071.
[32] YANG M R, SIMPSON D M, WENNER N, et al.Decoding the stoichiometric composition and organisation of bacterial metabolosomes[J].Nature Communications, 2020, 11(1):1976.
[33] LI H B, MA W J, LYU Y, et al.Glycosylation modification enhances (2 S)-naringenin production in Saccharomyces cerevisiae[J].ACS Synthetic Biology, 2022, 11(7):2339-2347.
[34] LI M, ZHOU P P, CHEN M K, et al.Spatiotemporal regulation of astaxanthin synthesis in S.cerevisiae[J].ACS Synthetic Biology, 2022, 11(8):2636-2649.