黄精(Polygonatum Mill)是一种药食同源的食物资源,已成为我国首批列入《按照传统既是食品又是中药材物质目录》的天然资源之一[1]。黄精根茎具有补中益气、滋阴养肺等功效,其主要化学成分包括多糖、黄酮、甾体皂苷、三萜、生物碱、植物甾醇及挥发油和微量元素等[2]。多糖是黄精中含量最高(≥7%)的活性物质,具有抗氧化、抗炎、降血糖血脂、抗癌和调节免疫力等功效[3-6]。目前,多糖提取的方法主要有溶剂提取法、酶提取法、超声波提取法和微生物发酵法等。其中,微生物发酵法不仅可以提高黄精多糖的得率,还可以增强黄精多糖的抗氧化活性和降血糖降血脂功能[7-8]。固态发酵相比于液态发酵成本更低、产物更易分离、多糖转化率更高、发酵过程不容易造成污染[9]。当前微生物发酵法中对多糖的提取多聚焦在液态发酵,固态发酵提取多糖的研究较少。经研究,适宜的菌种是固态发酵提取多糖的关键。常用的发酵菌种包括乳杆菌、酵母菌和芽孢杆菌等,其中使用最广泛的菌种为乳杆菌,乳杆菌是一类多功能益生菌,具有抗氧化、增强免疫力和调节宿主肠道菌群平衡等功效[10]。
本研究以黄精为原料,利用7株乳杆菌进行固态发酵,筛选出最佳发酵菌种,然后通过单因素试验和响应面试验优化发酵条件,最后对比研究固态发酵黄精多糖(solid state fermentation Polygonatum sibiricum polysaccharide, SF-PSP)和相同条件下未经发酵黄精多糖(P. sibiricum polysaccharide, PSP)的理化特性和抗氧化活性,以期为发酵黄精提取多糖的结构及活性研究提供理论参考。
1 材料与方法
1.1 材料与菌种
黄精(一蒸一制:经一次蒸制一次晾晒处理),河南联源生物科技股份有限公司。
植物乳杆菌(Lactobacillus plantarum)GDMCC 1.380、植物乳杆菌ATCC 14917、副干酪乳杆菌(Lactobacillus paracasei)ATCC 334、L. plantarum ACCC 11095、L. paracasei CICC 20109、L. paracasei CICC 20245、短乳杆菌(Lactobacillus brevis)CMCC 1.288,北京生物保藏中心。
1.2 主要试剂
乙二胺四乙酸二钠、十二烷基硫酸钠、FeSO4、无水乙醇(均为分析纯),天津市科密欧化学试剂有限公司;菲啰嗪(分析纯),上海麦克林生化科技有限公司;MRS液体培养基、MRS固体培养基(生物试剂),北京奥博星生物技术有限公司;DPPH、ABTS(均为标准品),上海源叶生物科技有限公司。
1.3 仪器与设备
HH-2型数显恒温水浴锅,金坛市晶玻实验仪器厂;UV-752 N紫外可见分光光度计,北京普析通用仪器有限责任公司;ME-204E电子分析天平,奥斯豪仪器(上海)有限公司;LC-20A高效液相色谱仪,岛津仪器有限公司;Xtimate C18柱,月旭科技(上海)股份有限公司;JSM-7900F场发射扫描电子显微镜,日本电子株式会社。
1.4 试验方法
1.4.1 菌种活化及筛选
将7株菌种分别接种到MRS液体培养基中活化,根据菌种最适温度摇床培养48 h[11]。将干燥的黄精粉碎,粉末过60目筛。采用固态发酵的方式,分别将活化后的菌种(1.0×108~1.5×108 CFU/mL)以接种量10%、液料比1∶1(mL∶g)接入灭菌的黄精粉末中,依据各菌种最适的培养温度发酵48 h。以黄精多糖的得率为指标,确定最佳发酵菌种。
1.4.2 固态发酵黄精的单因素优化试验
取灭菌后黄精粉末,培养温度37 ℃,固定条件为:接菌量10%,液料比1∶1(mL∶g),发酵时间48 h。设置各因素梯度分别为:接菌量(5%、10%、15%、20%、25%),液料比(0.75∶1、1∶1、1.25∶1、1.5∶1、1.75∶1,mL∶g),发酵时间(12、24、36、48、60 h)。改变以上某种因素,其他条件不发生改变,考察不同因素对多糖得率的影响,确定最佳因素水平[12]。
1.4.3 固态发酵黄精的响应面优化试验
基于上述单因素结果,进行响应面优化试验。以液料比(A)、接菌量(B)、发酵时间(C)为自变量,多糖得率为响应值,以得到最佳的提取工艺。响应面实验因素水平设计如表1所示。
表1 响应面试验因素与水平
Table 1 Factors and levels of response surface test

水平因素A液料比(mL∶g)B接菌量/%C发酵时间/h-10.75∶113601∶15.54811.25∶11060
1.4.4 黄精多糖得率和纯度的测定
黄精多糖得率参考包智影[13]的方法,采用水提醇沉法提取,苯酚-硫酸法测定;黄精多糖纯度参考房雷雷等[14]的方法,采用苯酚-硫酸法测定吸光度,结果以葡萄糖含量表示。
1.4.5 柱前衍生法测定单糖组分
采用柱前衍生法[7],精密称取3 mg黄精多糖样品,加入3 mL 2 mol/L三氟乙酸,充氮封管,于120 ℃下酸解4 h。取出后加入甲醇,氮吹干后加3 mL水复溶,摇匀备用。精确吸取250 μL样品溶液,加入250 μL 0.6 mol/L NaOH溶液,500 μL 0.4 mol/L PMP-甲醇,70 ℃反应1 h。在冷水中冷却10 min;加入500 μL 0.3 mol/L HCl溶液中和,再加入1 mL氯仿漩涡1 min,3 000 r/min离心10 min,取上清液,萃取3次。色谱条件为:Xtimate C18色谱柱(4.6 mm×200 mm,5 μm),柱温30 ℃,检测波长250 nm。流动相A为乙腈,B为0.05 mol/L KH2PO4溶液(pH 6.70),流速为1.0 mL/min,进样量为20 μL;采用等度洗脱方式。
1.4.6 微观分析
取适量干燥后SF-PSP和PSP,黏着于附有导电胶带的样品台上,置于离子溅射仪中镀一层导电金粉,之后安放在扫描电镜下观察,加速电压2.00 kV,在1 500×和3 000×下进行观察[15]。
1.4.7 热重分析
称取SF-PSP和PSP各4 mg,适当处理后,使用热分析仪进行热重扫描,比较两者结构稳定性的变化。升温速率10 ℃/min,升温范围25~600 ℃,气氛为N2[16]。
1.4.8 抗氧化活性测定
总抗氧化活性参考I
 L BERKER等[17]方法,结果以抗坏血酸当量表示(mg/g);DPPH自由基清除能力采用ZHOU等[18]的方法,以抗坏血酸为阳性对照;ABTS阳离子自由基清除能力采用CHEN等[19]方法,以抗坏血酸为阳性对照;亚铁离子螯合能力采用徐寅等[20]方法,以EDTA为阳性对照。
L BERKER等[17]方法,结果以抗坏血酸当量表示(mg/g);DPPH自由基清除能力采用ZHOU等[18]的方法,以抗坏血酸为阳性对照;ABTS阳离子自由基清除能力采用CHEN等[19]方法,以抗坏血酸为阳性对照;亚铁离子螯合能力采用徐寅等[20]方法,以EDTA为阳性对照。
1.5 数据处理与统计分析
采用SPSS 23软件分析处理数据,Design-Expert 12进行响应面设计及分析,Origin 2022绘图,其中P<0.05表示显著性差异。
2 结果与分析
2.1 固态发酵黄精菌种的筛选
由图1可知,与CON组相比,E组多糖得率降低,其他发酵组多糖得率均显著提高(P<0.05)。多糖得率低于CON组可能是黄精发酵体系中代谢产物或其他成分对菌种的数量及胞内发生的生化反应产生影响,从而出现多糖得率降低的现象[21];多糖得率高于CON组是由于黄精经微生物发酵处理后,使黄精细胞结构被破坏,胞内多糖可以有效溶出,从而提高多糖得率[22]。C组多糖得率最高为6.24%,显著高于其他组(P<0.05),可能是由于L. paracasei ATCC 334菌种可以很好地适应黄精发酵体系,更适合在发酵黄精体系中提取多糖。因此,选用L. paracasei ATCC 334作为最佳发酵菌种,进一步探究其发酵工艺。
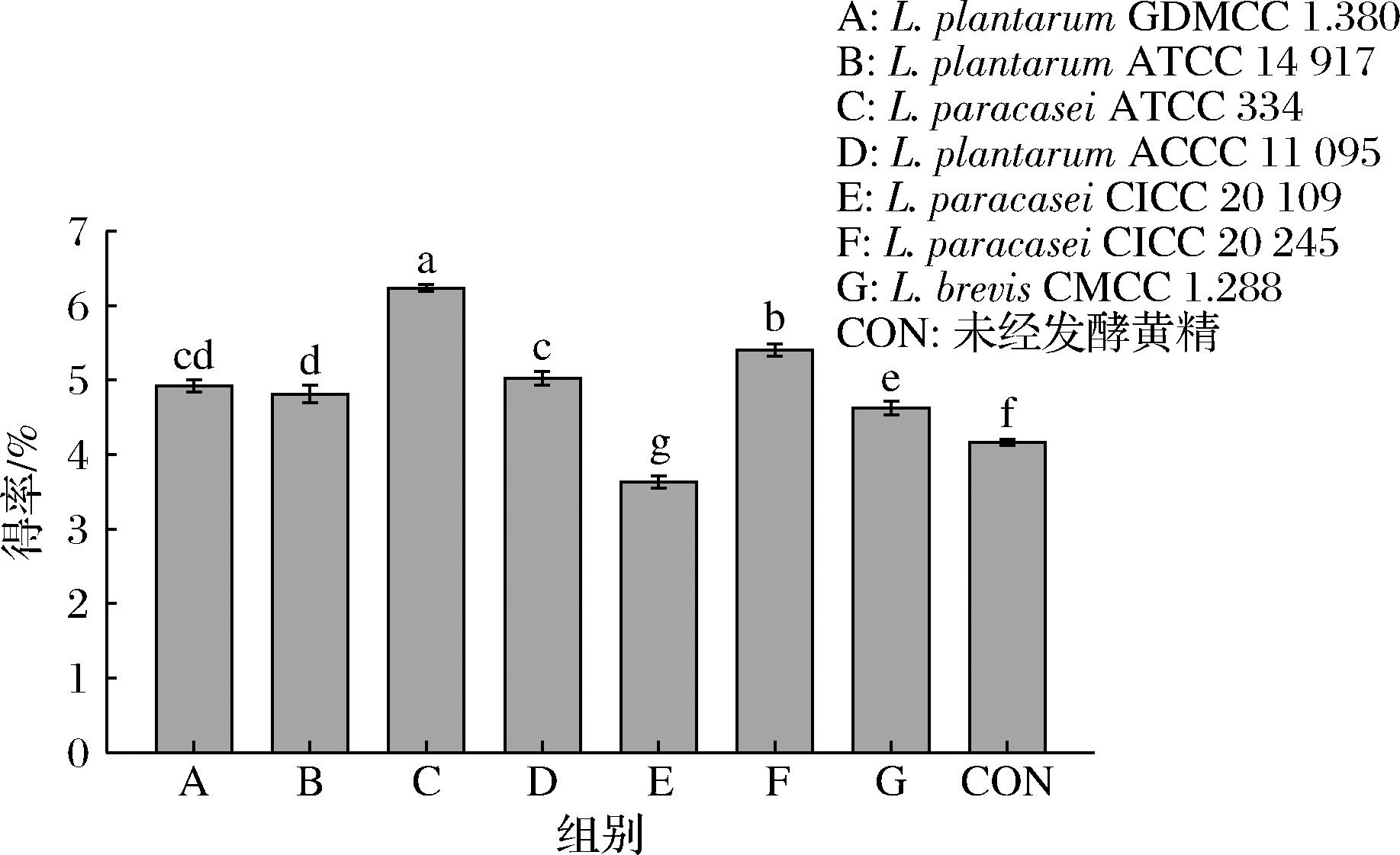
图1 不同菌种发酵黄精的多糖得率
Fig.1 The yield of polysaccharides from P. sibiricum fermented by different strains
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 固态发酵黄精单因素试验结果
由图2-a可知,当接菌量达到5%时,多糖得率为6.32%,显著高于其他组(P<0.05),接菌量超过5%后,多糖得率逐渐下降,可能是由于接菌量过高,营养物质消耗快,不利于菌种生长繁殖及产生代谢产物;接菌量过低,菌种生长缓慢,发酵时间延长,易被杂菌污染[23],从而影响多糖得率。由图2-b可知,液料比为1∶1(mL∶g)时,多糖得率显著高于其他组(P<0.05),液料比高于1∶1(mL∶g)后,多糖得率开始降低,可能是过多的水分使体系变得黏稠,不利于空气流通,导致菌种生长和代谢产物合成缓慢;水分较少,影响菌种的生长和代谢,影响多糖物质溶出[24]。由图2-c可知,发酵时间在12~60 h时,多糖得率先增加后降低,可能是菌种的生长速率提高,使得合成代谢产物的量也增多;当发酵时间超过48 h,推测是随着发酵时间的延长,营养物质被消耗,无法维持菌种的正常生长代谢,导致产物合成速率下降[25]。因此本研究选择接菌量1%~10%、液料比0.75∶1~1.25∶1(mL∶g)、36~60 h进行后续固态发酵工艺参数的优化。
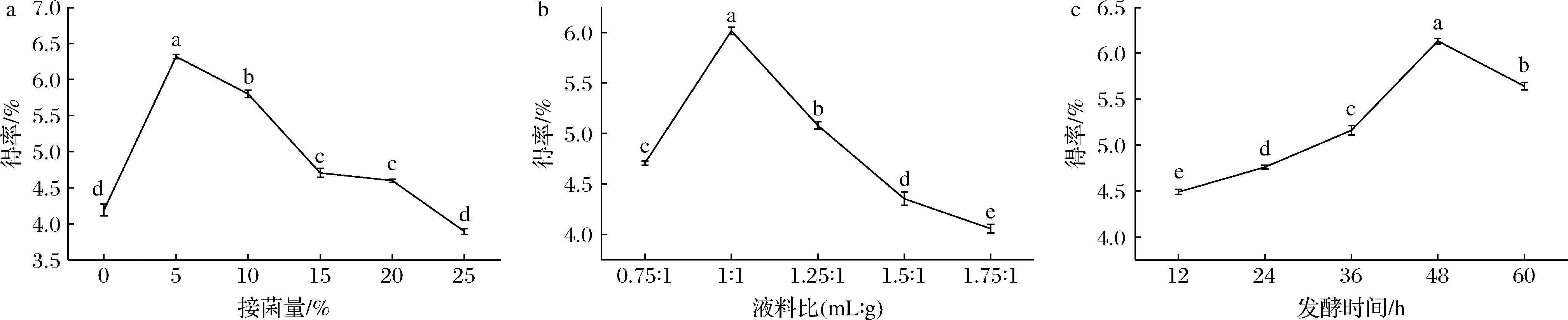
a-接菌量;b-料液比;c-发酵时间
图2 不同发酵因素对SF-PSP得率的影响
Fig.2 Effect of different fermentation factors on the yield of SF-PSP
2.3 固态发酵黄精响应面优化试验结果
2.3.1 响应面模型回归分析
以液料比(A)、接菌量(B)、发酵时间(C)为变量,黄精多糖得率为响应值,使用Design Expert软件,Box-Behnken实验设计结果如表2所示。
表2 工艺优化Box-Behnken试验设计及结果
Table 2 Process optimization Box-Behnken experimental design and results
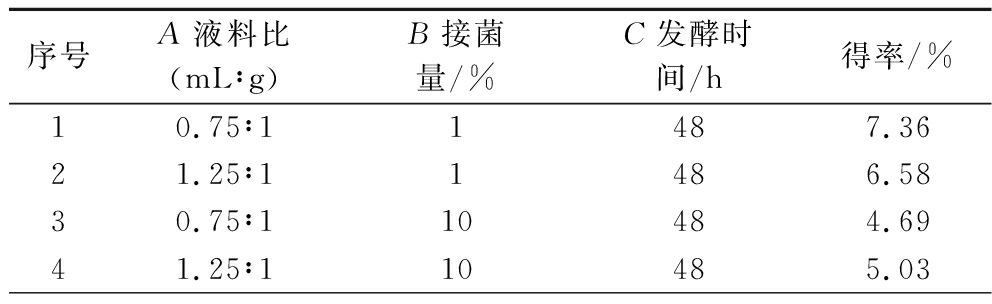
序号A液料比(mL∶g)B接菌量/%C发酵时间/h得率/%10.75∶11487.3621.25∶11486.5830.75∶110484.6941.25∶110485.03
续表2
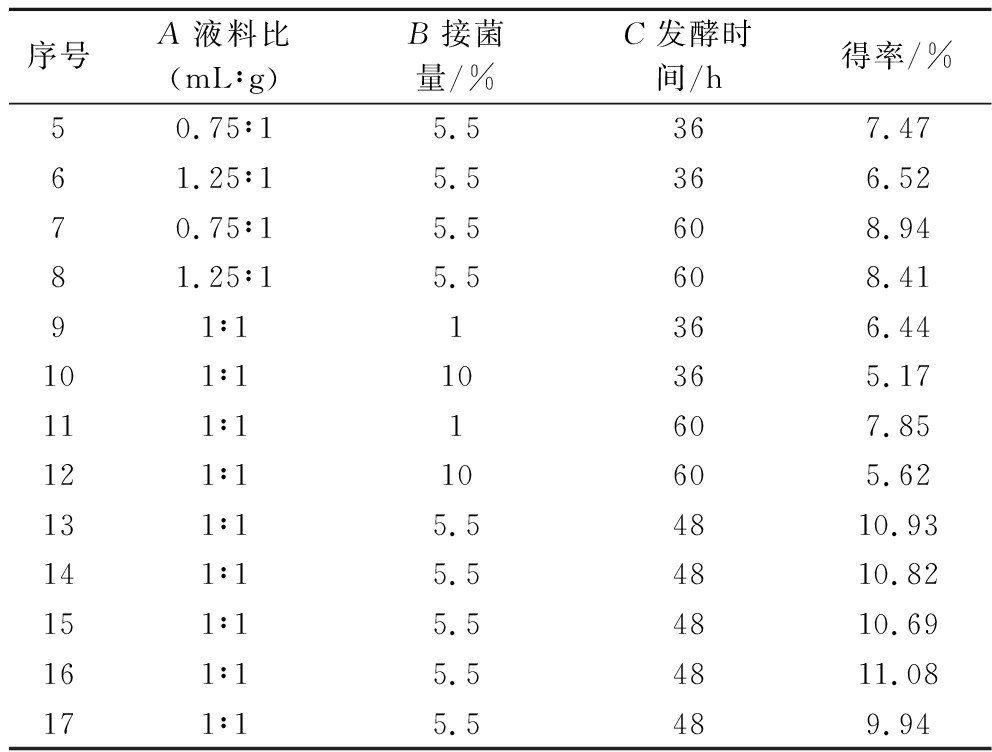
序号A液料比(mL∶g)B接菌量/%C发酵时间/h得率/%50.75∶15.5367.4761.25∶15.5366.5270.75∶15.5608.9481.25∶15.5608.4191∶11366.44101∶110365.17111∶11607.85121∶110605.62131∶15.54810.93141∶15.54810.82151∶15.54810.69161∶15.54811.08171∶15.5489.94
试验数据进行回归分析后,得出回归方程为:Y=10.69-0.24A-0.96B+0.65C+0.28AB+0.11AC-0.24BC-1.61A2-3.17B2-1.25C2。
固态发酵黄精工艺优化的响应面试验回归模型方差分析结果见表3。由表3结果可知,所建立模型显著(P<0.01),失拟项(P>0.05)不显著,模型的拟合程度较好,可靠性较高。R2=0.983 8说明方程的回归效果较好,决定系数![]() 可预测96.3%响应值。该模型能够反映各个因素之间的关系,可以用来预测固态发酵黄精提取多糖的工艺参数。一次项B对结果影响极显著(P<0.01),C对结果影响显著(P<0.05),A对结果影响不显著(P>0.05),交互项AB、AC、BC对结果影响不显著(P>0.05),交互作用较弱。二次项A2、B2、C2对结果影响极显著(P<0.01)。由F值可知,各因素对多糖得率的影响顺序为接菌量>发酵时间>液料比。
可预测96.3%响应值。该模型能够反映各个因素之间的关系,可以用来预测固态发酵黄精提取多糖的工艺参数。一次项B对结果影响极显著(P<0.01),C对结果影响显著(P<0.05),A对结果影响不显著(P>0.05),交互项AB、AC、BC对结果影响不显著(P>0.05),交互作用较弱。二次项A2、B2、C2对结果影响极显著(P<0.01)。由F值可知,各因素对多糖得率的影响顺序为接菌量>发酵时间>液料比。
表3 工艺优化回归模型方差分析
Table 3 Analysis of variance for process optimization regression model
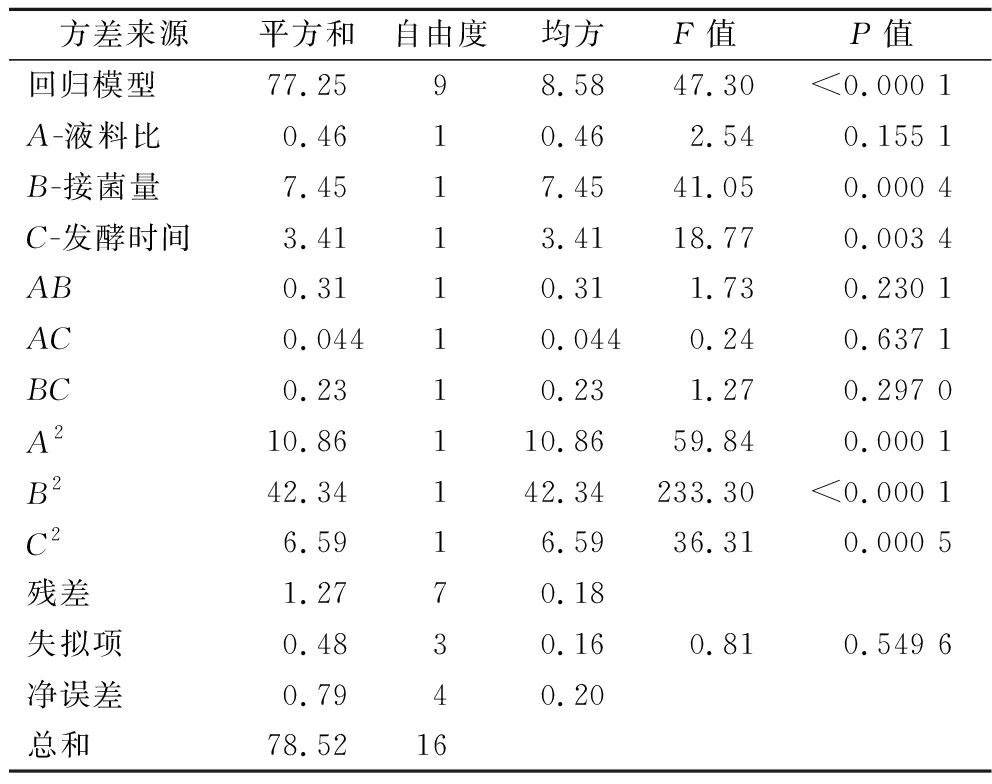
方差来源平方和自由度均方F值P值回归模型77.2598.5847.30<0.000 1A-液料比0.4610.462.540.155 1B-接菌量7.4517.4541.050.000 4C-发酵时间3.4113.4118.770.003 4AB0.3110.311.730.230 1AC0.04410.0440.240.637 1BC0.2310.231.270.297 0A210.86110.8659.840.000 1B242.34142.34233.30<0.000 1C26.5916.5936.310.000 5残差1.2770.18失拟项0.4830.160.810.549 6净误差0.7940.20总和78.5216
2.3.2 验证实验
根据响应面预测的最优参数为液料比0.98∶1(mL∶g),接菌量4.76%,发酵时间51.28 h,考虑到实验的可操作性,所以将最优条件调整为液料比0.98∶1(mL∶g),接菌量4.80%,发酵时间51.30 h,重复3次实验,得率平均值为(11.14±0.89)%,与预测值10.87%相差不大,说明通过该响应面优化得到的固态发酵黄精提取多糖的最佳工艺条件可靠。
2.4 黄精多糖的单糖组成和纯度分析
PSP和SF-PSP中单糖变化如图3所示。
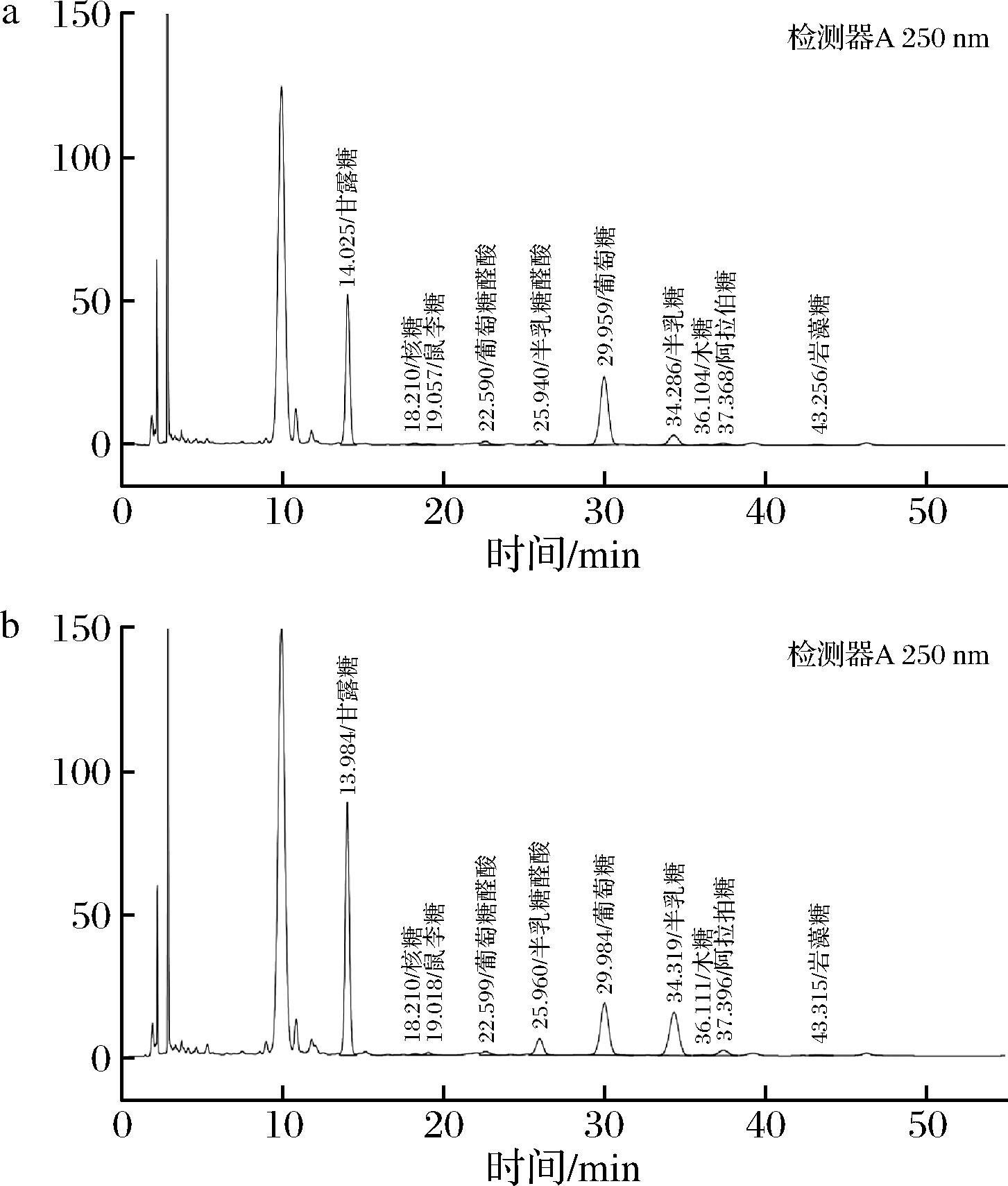
a-PSP单糖组成;b-SF-PSP单糖组成
图3 单糖分析结果
Fig.3 Results of monosaccharide composition
由图3和表4中可知,PSP和SF-PSP的单糖种类没有变化,但单糖含量发生了较大变化,且SF-PSP中总糖含量增加到(10.225±0.007)%,高于PSP含量[7]。PSP和SF-PSP中甘露糖、半乳糖醛酸、半乳糖和葡萄糖含量较多,核糖、鼠李糖、葡萄糖醛酸、木糖、阿拉伯糖和岩藻糖含量较少。相比于PSP,SF-PSP中核糖、岩藻糖、木糖及葡萄糖含量降低,而鼠李糖、半乳糖醛酸和半乳糖含量分别为(0.119±0.001)%、(0.708±0.001)%、(1.859±0.05)%,均高于PSP含量的4倍。已有研究表明,植物多糖经微生物发酵后,单糖含量会发生变化[26]。发酵后黄精的主要单糖含量变化可能是由于在微生物发酵的作用下,黄精的葡萄糖和其他含碳物质被微生物的生长代谢所利用,产生其他种类的单糖物质[27]。
表4 PSP和SF-PSP中单糖成分含量 单位:%
Table 4 Content of monosaccharide components in PSP and SF-PSP

种类甘露糖核糖鼠李糖葡萄糖醛酸半乳糖醛酸葡萄糖半乳糖木糖阿拉伯糖岩藻糖总含量PSP2.826±0.010b0.051±0.010a0.029±0.002b0.184±0.002b0.174±0.002b2.718±0.003a0.437±0.002b0.190±0.000a0.075±0.001b0.038±0.002a6.549±0.017bSF-PSP4.850±0.003a0.040±0.002b0.119±0.001a0.203±0.002a0.708±0.001a2.171±0.002b1.859±0.05a0.025±0.001b0.215±0.001a0.034±0.001b10.225±0.007a
注:不同小写字母表示差异显著(P<0.05)。
黄精多糖纯度采用苯酚-硫酸法测定,以葡萄糖的质量为横坐标,以吸光度为纵坐标绘制标准曲线,得标准曲线方程y=0.112x+0.006 4,R2=0.991 8,由此计算得SF-PSP和PSP纯度分别为(85.50±0.99)%和(88.20±0.99)%。
2.5 扫描电子显微镜分析
由图4中可知,PSP和SF-PSP的微观形态不均匀,这可能归因于多糖较强的交联聚集。PSP具有清晰可见的聚集块,表面凹凸不平,结构较为紧密,孔径不规则且稀疏。而SF-PSP呈细碎颗粒状,表面粗糙不光滑,分布着致密的小孔,结构疏松,该结构使得SF-PSP吸水能力更强。两种多糖形貌存在差异,推测是由于发酵后改变了多糖物质的结构分布,这种差异可能会使多糖的理化特性发生改变[15]。

a-PSP(1 500×);b-PSP(3 000×);c-SF-PSP(1 500×);d-SF-PSP(3 000×)
图4 多糖的扫描电镜图谱
Fig.4 Scanning electron microscopy atlas of polysaccharides
2.6 热重分析
如图5所示,根据热重分析曲线,PSP的热重曲线分为3个阶段。第一阶段从25~172 ℃,样品损失的质量百分比为7.2%,在这一阶段中,发生脱水,去除组分中自由水的含量。从DTG曲线可以看出,多糖的含水量和杂质含量较低[28]。该阶段损失越少,说明多糖保水性能越好[29]。第二阶段在172~249 ℃,失重率为28.6%。第三阶段在249~600 ℃,失重率为44.3%。后两个阶段失重是由于多糖组分结构的解聚和热分解[16]。
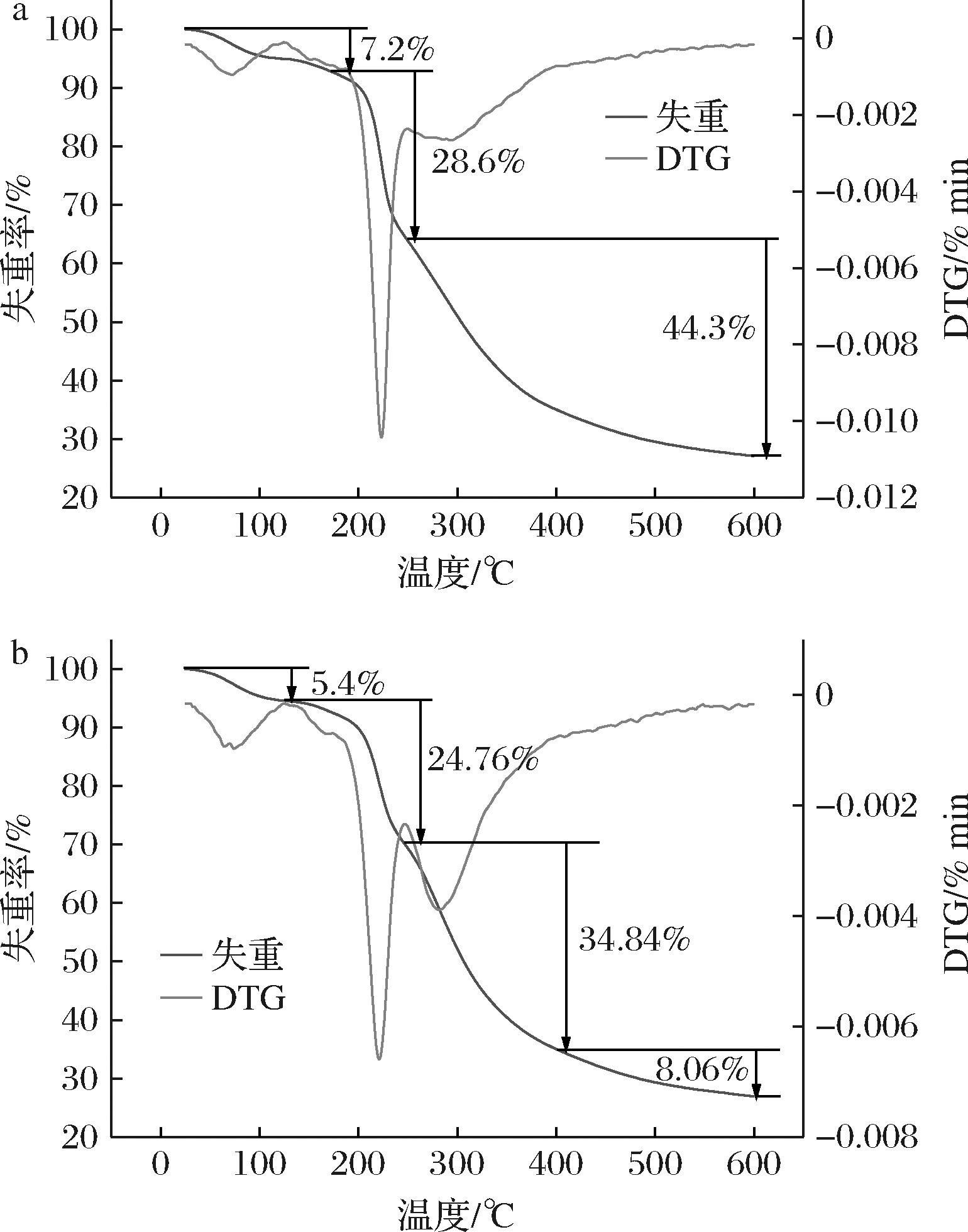
a-PSP热重分析图;b-SF-PSP热重分析图
图5 多糖的热特性
Fig.5 Thermal properties of polysaccharides
SF-PSP与PSP整体趋势基本一致,除温度节点不同外,可分为4个阶段。第一阶段在25~124 ℃,失重率为5.4%,主要是自由水的消失,损失少于PSP,保水性能较好。第二阶段和第三阶段的温度分别为124~248 ℃和248~400 ℃,失重率分别为24.76%和34.84%,第四阶段温度为400~600 ℃,失重率在8.06%呈平缓下降趋势。后3个阶段失重都是与多糖组分结构的解聚和热分解有关[30]。与PSP不同的是,SF-PSP失重率的快速下降分为2个阶段,可能与发酵后结构的改变有关。
2.7 体外抗氧化活性
如表5所示,阳性对照品质量浓度为2~6 mg/mL时,DPPH自由基清除率、ABTS阳离子自由基清除率和亚铁离子螯合能力均显著高于两种多糖的抗氧化效果。SF-PSP的DPPH自由基清除率、ABTS阳离子自由基清除率、亚铁离子螯合能力、总抗氧化性均高于PSP。在2~6 mg/mL时,两种多糖的抗氧化能力与多糖浓度均呈剂量依赖性。可以看出,SF-PSP在4 mg/mL时,DPPH自由基清除率、亚铁离子螯合能力及总抗氧化性均高于PSP在6 mg/mL时,SF-PSP的抗氧化效果在浓度较低条件下可以达到PSP在较高浓度时候的效果。通过SPSS 23计算,PSP对DPPH自由基和亚铁离子螯合能力的IC50值分别为15.29 mg/mL和10.55 mg/mL,而SF-PSP的值分别为7.65 mg/mL和4.61 mg/mL,均低于PSP,说明SF-PSP在这两种抗氧化试验之中显著性高于PSP(P<0.05)。发酵后多糖的抗氧化能力得到提高,与王若男等[8]研究结果一致。
表5 不同浓度PSP和SF-PSP的抗氧化能力
Table 5 Antioxidant capacity of different concentrations of PSP and SF-PSP
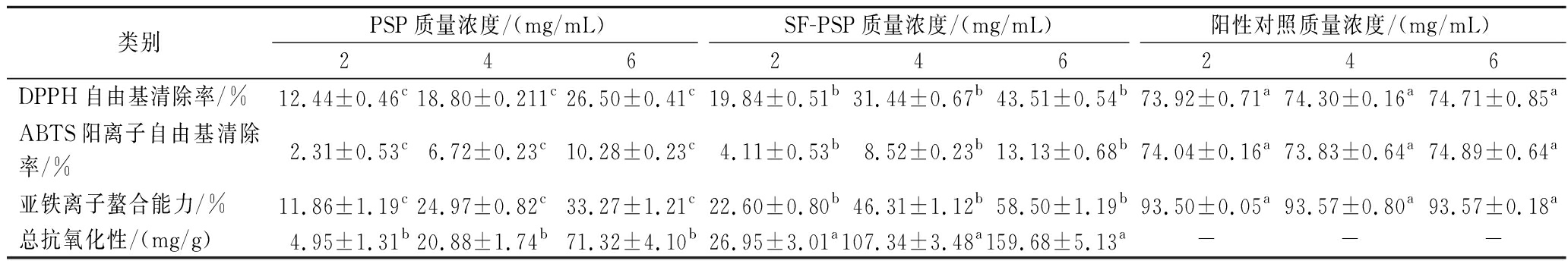
类别PSP质量浓度/(mg/mL)SF-PSP质量浓度/(mg/mL)阳性对照质量浓度/(mg/mL)246246246DPPH自由基清除率/%12.44±0.46c18.80±0.211c26.50±0.41c19.84±0.51b31.44±0.67b43.51±0.54b73.92±0.71a74.30±0.16a74.71±0.85aABTS阳离子自由基清除率/%2.31±0.53c6.72±0.23c10.28±0.23c4.11±0.53b8.52±0.23b13.13±0.68b74.04±0.16a73.83±0.64a74.89±0.64a亚铁离子螯合能力/%11.86±1.19c24.97±0.82c33.27±1.21c22.60±0.80b46.31±1.12b58.50±1.19b93.50±0.05a93.57±0.80a93.57±0.18a总抗氧化性/(mg/g)4.95±1.31b20.88±1.74b71.32±4.10b26.95±3.01a107.34±3.48a159.68±5.13a---
注:不同小写字母表示差异显著(P<0.05);-表示无阳性对照。
3 结论
本研究利用7株乳杆菌对黄精进行固态发酵,筛选出最佳发酵菌种为L. paracasei ATCC 334。最佳发酵工艺为:液料比0.98∶1(mL∶g)、接菌量4.80%、发酵时间51.30 h,此条件下多糖得率为(11.14±0.89)%。单糖组成分析发现,PSP和SF-PSP中甘露糖、半乳糖醛酸、半乳糖和葡萄糖含量均较多,发酵前后单糖组分占比发生改变。扫描电镜结果表明,SF-PSP相比于PSP结构更加疏松,小孔更加致密。热重分析结果表明,SF-PSP相比于PSP保水能力更强。体外抗氧化活性表明,SF-PSP抗氧化性能显著高于PSP。本试验对微生物固态发酵法提取黄精多糖进行了工艺优化,对黄精多糖的理化特性表征以及抗氧化活性进行分析,以期为黄精资源的综合开发利用提供理论参考。
[1] 汪涛, 周新群, 孙君社, 等.黄精水解液制备工艺优化及新型黄精黄酒的酿制[J].中国酿造, 2020, 39(10):198-204.
WANG T, ZHOU X Q, SUN J S, et al.Preparation process optimization of Polygonatum sibiricum hydrolysate and brewing of new P.sibiricum Huangjiu[J].China Brewing, 2020, 39(10):198-204.
[2] TANG C, YU Y M, GUO P, et al.Chemical constituents of Polygonatum sibiricum[J].Chemistry of Natural Compounds, 2019, 55(2):331-333.
[3] CUI X W, WANG S Y, CAO H, et al.A review:The bioactivities and pharmacological applications of Polygonatum sibiricum polysaccharides[J].Molecules, 2018, 23(5):1170.
[4] LIU B, TANG Y, SONG Z Y, et al.Polygonatum sibiricum F.Delaroche polysaccharide ameliorates HFD-induced mouse obesity via regulation of lipid metabolism and inflammatory response[J].Molecular Medicine Reports, 2021, 24(1):501.
[5] KUANG M T, LI J Y, YANG X B, et al.Structural characterization and hypoglycemic effect via stimulating glucagon-like peptide-1 secretion of two polysaccharides from Dendrobium officinale[J].Carbohydrate Polymers, 2020, 241:116326.
[6] WANG Y J, LIU N, XUE X, et al.Purification, structural characterization and in vivo immunoregulatory activity of a novel polysaccharide from Polygonatum sibiricum[J].International Journal of Biological Macromolecules, 2020, 160:688-694.
[7] LI C Y, LI J X, SHANG Y X, et al.Hypoglycemic and hypolipidemic activity of Polygonatum sibiricum fermented with Lactobacillus brevis YM 1301 in diabetic C57BL/6 mice[J].Journal of Medicinal Food, 2021, 24(7):720-731.
[8] 王若男, 厉荣玉, 郑鹏, 等.黄精多糖微生物发酵提取、表征及其抗氧化活性分析[J].中国食品添加剂, 2022, 33(9):54-62.
WANG R N, LI R Y, ZHENG P, et al.Microbial fermentation extraction, characterization and antioxidant activity of Polygonatum polysaccharide[J].China Food Additives, 2022, 33(9):54-62.
[9] CAMELINI C M, GOMES A, CARDOZO F T G S, et al.Production of polysaccharide from Agaricus subrufescens Peck on solid-state fermentation[J].Applied Microbiology and Biotechnology, 2013, 97(1):123-133.
[10] LA FATA G, WEBER P, MOHAJERI M H.Probiotics and the gut immune system:Indirect regulation[J].Probiotics and Antimicrobial Proteins, 2018, 10(1):11-21.
[11] 张廷辉, 汤承浩, 王晓铭, 等.腌韭菜根中五种腐败菌菌液OD值与其活菌数相关性研究[J].贵州科学, 2021, 39(6):17-21.
ZHANG T H, TANG C H, WANG X M, et al.Correlation between OD value and number of live bacteria of five kinds of spoilage bacteria in pickled Chinese chives roots[J].Guizhou Science, 2021, 39(6):17-21.
[12] 赵礼真. 纳豆芽孢杆菌固态发酵麦麸制备膳食纤维的研究[D].南京:南京农业大学, 2020.
ZHAO L Z.Research on preparation of dietary fibre of wheat bran by solid state fermentation with Bacillus natto[D].Nanjing:Nanjing Agricultural University, 2020.
[13] 包智影. 微生物法提取黄精多糖及其降脂功能的研究[D].哈尔滨:东北林业大学, 2021.
BAO Z Y.Preparation of Polygonatum sibiricum polysaccharide by microbial method and its lipid-lowering function[D].Harbin:Northeast Forestry University, 2021.
[14] 房雷雷, 赵肖通, 辛慧洁, 等.一种姬松茸多糖的纯度鉴定与单糖组成分析[J].食品工业科技, 2018, 39(13):94-97; 267.
FANG L L, ZHAO X T, XIN H J, et al.Purity identification and monosaccharide composition analysis of a polysaccharide derived from Agaricus brasiliensis[J].Science and Technology of Food Industry, 2018, 39(13):94-97; 267.
[15] AHMAD M M, ALI SHAHID CHATHA S, HUSSAIN A I, et al.Chemical modification and antioxidant activities of Carissa carandas fruit polysaccharides[J].Journal of Food Measurement and Characterization, 2023, 17(2):1175-1185.
[16] WANG B H, CAO J J, ZHANG B, et al.Structural characterization, physicochemical properties and α-glucosidase inhibitory activity of polysaccharide from the fruits of wax apple[J].Carbohydrate Polymers, 2019, 211:227-236.
[17] I
 L BERKER K, GÜÇLÜ K, TOR I, et al.Total antioxidant capacity assay using optimized ferricyanide/prussian blue method[J].Food Analytical Methods, 2010, 3(3):154-168.
L BERKER K, GÜÇLÜ K, TOR I, et al.Total antioxidant capacity assay using optimized ferricyanide/prussian blue method[J].Food Analytical Methods, 2010, 3(3):154-168.
[18] ZHOU S Y, HUANG G L.Extraction, structure characterization and biological activity of polysaccharide from coconut peel[J].Chemical and Biological Technologies in Agriculture, 2023, 10(1):15.
[19] CHEN C, ZHAO Z Y, MA S S, et al.Optimization of ultrasonic-assisted extraction, refinement and characterization of water-soluble polysaccharide from Dictyosphaerium sp.and evaluation of antioxidant activity in vitro[J].Journal of Food Measurement and Characterization, 2020, 14(2):963-977.
[20] 徐寅, 黄玉军, 陈霞, 等.乳酸菌发酵豆乳体内外抗氧化效应研究[J].中国乳品工业, 2012, 40(8):16-19.
XU Y, HUANG Y J, CHEN X, et al.In vitro and in vivo studies on the antioxidant effects of soymilk fermented with lactic acid bacteria[J].China Dairy Industry, 2012, 40(8):16-19.
[21] 魏萌. 发酵黄芪菌株的筛选及对其功能的影响[D].保定:河北农业大学, 2014.
WEI M.Screening strain for Radix astragali fermentation and the influence of its function[D].Baoding:Hebei Agricultural University, 2014.
[22] 赵洋. 植物乳杆菌ATCC-14917发酵对灵芝孢子粉多糖结构及抗氧化活性的影响[D].长春:吉林农业大学, 2022.
ZHAO Y.Effects of Lactiplantibacillus plantarum ATCC-14917 fermentation on polysaccharide structure and antioxidant activity of Ganoderma lucidum spore powder[D].Changchun:Jilin Agricultural University, 2022.
[23] 郭珍红, 管军军, 杨刚, 等.混菌固态发酵菜籽粕提高可溶性蛋白的研究[J].食品与发酵工业, 2023, 49(13):121-128.
GUO Z H, GUAN J J, YANG G, et al.Improvement of soluble protein in rapeseed meal by mixed culture solid-state fermentation[J].Food and Fermentation Industries, 2023, 49(13):121-128.
[24] 王明瑞, 邓永平, 宋青燕, 等.蛹虫草固态发酵联产多糖和纤溶酶的工艺优化[J].食品工业科技, 2021, 42(4):71-76.
WANG M R, DENG Y P, SONG Q Y, et al.Optimization of polysaccharides and fibrinolytic enzyme co-production from Cordyceps militaris through solid state fermentation[J].Science and Technology of Food Industry, 2021, 42(4):71-76.
[25] 韩鹏飞, 朱璇, 杨敏, 等.戴氏虫草产多糖的固体发酵工艺优化[J].食品工业科技, 2023, 44(14):130-136.
HAN P F, ZHU X, YANG M, et al.Solid-state fermentation of Cordyceps taii for polysaccharide production[J].Science and Technology of Food Industry, 2023, 44(14):130-136.
[26] HUANG F, HONG R Y, ZHANG R F, et al.Physicochemical and biological properties of Longan pulp polysaccharides modified by Lactobacillus fermentum fermentation[J].International Journal of Biological Macromolecules, 2019, 125:232-237.
[27] 刘玉辉, 王瑞芳, 安晓萍, 等.玉米芯多糖的微生物发酵工艺及其单糖组成和体外益生活性研究[J].食品工业科技, 2020, 41(5):107-112.
LIU Y H, WANG R F, AN X P, et al.Study on microbial fermentation technology of corn cob polysaccharide and its monosaccharide composition and prebiotic activity in vitro[J].Science and Technology of Food Industry, 2020, 41(5):107-112.
[28] MOHAMMED J K, ALI MAHDI A, AHMED M I, et al.Preparation, deproteinization, characterization, and antioxidant activity of polysaccharide from Medemia argun fruit[J].International Journal of Biological Macromolecules, 2020, 155:919-926.
[29] WU F F, HUANG H H.Surface morphology and protective effect of Hericium erinaceus polysaccharide on cyclophosphamide-induced immunosuppression in mice[J].Carbohydrate Polymers, 2021, 251:116930.
[30] ZAVASTIN D E, BILIUT G, DODI G, et al.Metal content and crude polysaccharide characterization of selected mushrooms growing in Romania[J].Journal of Food Composition and Analysis, 2018, 67:149-158.
G, DODI G, et al.Metal content and crude polysaccharide characterization of selected mushrooms growing in Romania[J].Journal of Food Composition and Analysis, 2018, 67:149-158.