发酵全混合日粮(total mixed ration, TMR)是在厌氧条件下通过乳酸发酵生产的营养相对均衡的饲料,不仅能解决粗精料分开饲喂的问题,而且可以提高饲料利用率和生产性能[1]。近年来,大量的农业、食品副产物被调配成发酵TMR,包括啤酒糟、绿茶渣和土豆皮等[2],并获得了发酵品质较好的饲料。中国每年都会产生大量的水稻秸秆[3]、四棱豆藤和甜茶渣,如果将这些农副产物混合作为发酵TMR的原料,不仅可以扩大饲料来源,还能有效地利用农副产物。水稻秸秆和甜茶渣都含有丰富的粗纤维,缺乏水溶性碳水化合物(water soluble carbohydrate,WSC)和粗蛋白,未加工的水稻秸秆和甜茶渣是适口性差、采食率低的劣质饲料,而四棱豆藤富含WSC和粗蛋白,可以弥补水稻秸秆和甜茶渣蛋白质含量不足、适口性差的缺点。
发酵TMR在开袋后和长距离运输过程中容易发生有氧变质,降低品质。因此,提高发酵TMR的品质是非常重要的。双乙酸钠是一种用于饲料、食品领域的防霉保鲜剂,有较强的抑菌、杀菌作用,使用相对安全[4],近年来,双乙酸钠作为添加剂在反刍动物饲料中得到了广泛的应用。张新慧等[5]研究发现双乙酸钠并没有改善青贮饲料的发酵品质,但能提高青贮饲料的有氧稳定性。绿汁发酵液(fermented juice of epiphytic lactic acid bacteria, FJLB)是指将植物匀浆后,利用其表面附生的乳酸菌在厌氧环境中利用植物绿汁发酵富集乳酸菌的一种青贮添加剂,可以促进乳酸发酵,通常用于提高青贮饲料的发酵品质[6]。
本研究以水稻秸秆、四棱豆藤和甜茶渣为原料制备发酵TMR,探究双乙酸钠和FJLB对TMR发酵品质和有氧稳定性的影响,为更好的开发和利用当地的农副产物,调制优质的发酵TMR提供科学依据。
1 材料和方法
1.1 发酵TMR的制备
TMR由水稻(Oryza sativa L.)秸秆、四棱豆[Psophocarpus tetragonolobus (L.) DC.]藤、甜茶[Lithcarpus litseifolius (Hance) Chun]渣和精料混合而成,水分含量约为50%。甜茶渣是甜茶提取后的湿残留物。精料由玉米粉、豆粕、菜籽粕、棉粕、麦麸、预混料、酒糟蛋白饲料(distillers dried grains with solubles, DDGS)和食盐组成,发酵TMR的调配均以干物质(dry matter,DM)为基础将原料进行混合,参照当地奶牛场采用的配方,奶牛处于泌乳中期,蛋白需要量维持在14%左右,发酵TMR配方中原料的化学成分如表1所示。将50 g四棱豆鲜叶榨汁过滤,滤液中加入2%蔗糖,调节发酵pH值至4.2,在30 ℃恒温培养箱中厌氧培养48 h,获得FJLB。用切割机将水稻秸秆、四季豆藤和甜茶渣切成1~2 cm长。实验分为4组:对照组(C,不添加)、双乙酸钠组[S,0.5%鲜重(fresh weight,FW)]、FJLB组(L,2.0 mL/kg FW)、双乙酸钠+FJLB组(SL,0.5%+2.0 mL/kg FW)。每个聚乙烯青贮袋装入8 kg TMR,每个处理设5个重复,抽真空密封。TMR在25 ℃的厌氧条件下发酵35 d,获得发酵TMR。
表1 发酵TMR原材料化学成分
Table 1 Chemical composition of raw materials used in fermented TMR
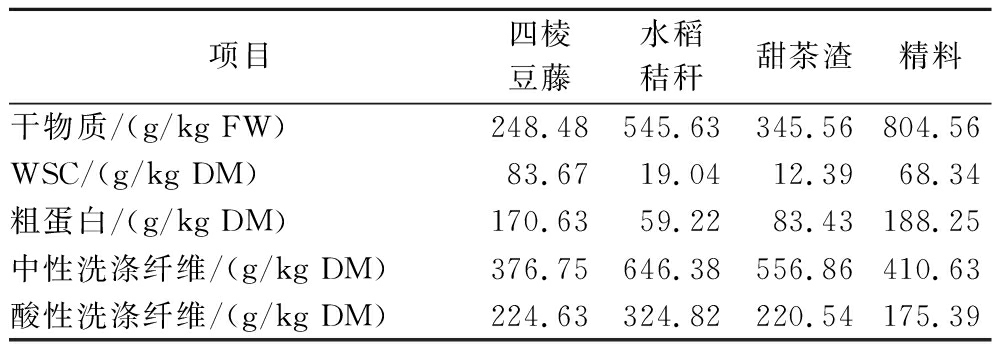
项目四棱豆藤水稻秸秆甜茶渣 精料干物质/(g/kg FW)248.48545.63345.56804.56WSC/(g/kg DM)83.6719.0412.3968.34粗蛋白/(g/kg DM)170.6359.2283.43188.25中性洗涤纤维/(g/kg DM)376.75646.38556.86410.63酸性洗涤纤维/(g/kg DM)224.63324.82220.54175.39
注:精料:30%玉米粉,4%豆粕,12%菜籽粕,8%棉粕,15%DDGS,20%麦麸,9%预混料,2%食盐(DM)(下同)。
1.2 化学成分和微生物分析
将样品放入65 ℃烘箱中烘48 h,恒重测定DM含量。用PHS-3C型雷诺pH计测定pH值。乳酸和挥发性脂肪酸的含量用GC-2014气相色谱仪测定[7]。采用硫酸-蒽酮比色法测定WSC的含量。氨态氮含量的测定采用苯酚-次氯酸钠比色法[8]。粗蛋白用KjeltecTM2300全自动氮分析仪测定。采用高温燃烧法测定粗灰分。用Van-Soest法测定中性洗涤纤维和酸性洗涤纤维。缓冲能用盐酸-氢氧化钠法测定。乳酸菌用琼脂培养基培养,好氧微生物用营养培养基培养,酵母菌用马铃薯葡萄糖培养基培养。乳酸菌在37 ℃厌氧条件下培养。在37 ℃生化培养箱中培养好氧性微生物和酵母菌[9]。
1.3 有氧稳定性试验
有氧稳定性由热电偶测定[10]。同时,检测发酵TMR的化学成分变化和微生物数量,这些指标可以反映发酵TMR在有氧条件下的腐败程度。
1.4 体外消化率
采用体外两步法测定发酵TMR的消化率。瘤胃液采集自具有永久性瘤胃瘘的西门塔尔杂交公牛。中性洗涤纤维消化率和DM消化率分别为在体外消化过程中中性洗涤纤维和DM的损失[11]。
1.5 统计分析
用SPSS 22.0统计软件对测试数据进行统计分析,用平均值和标准差表示测试结果。采用Duncan法进行多因素比较。P<0.05表示差异显著有统计学意义。
2 结果与分析
2.1 发酵TMR的化学成分
3种粗饲料中,四棱豆藤的粗蛋白和WSC含量最高,甜茶渣和水稻秸秆的中性洗涤纤维含量相近,均高于四棱豆藤。水稻秸秆的酸性洗涤纤维含量最高(表1)。TMR的DM含量为507.16 g/kg FW。粗蛋白质含量为134.35 g/kg DM。乳酸菌和酵母菌数量约为5 lg CFU/g FW(表2)。
表2 发酵前TMR组成、化学成分及微生物数量
Table 2 Ingredients and chemical composition and microbial populations of total mixed ration before fermentation
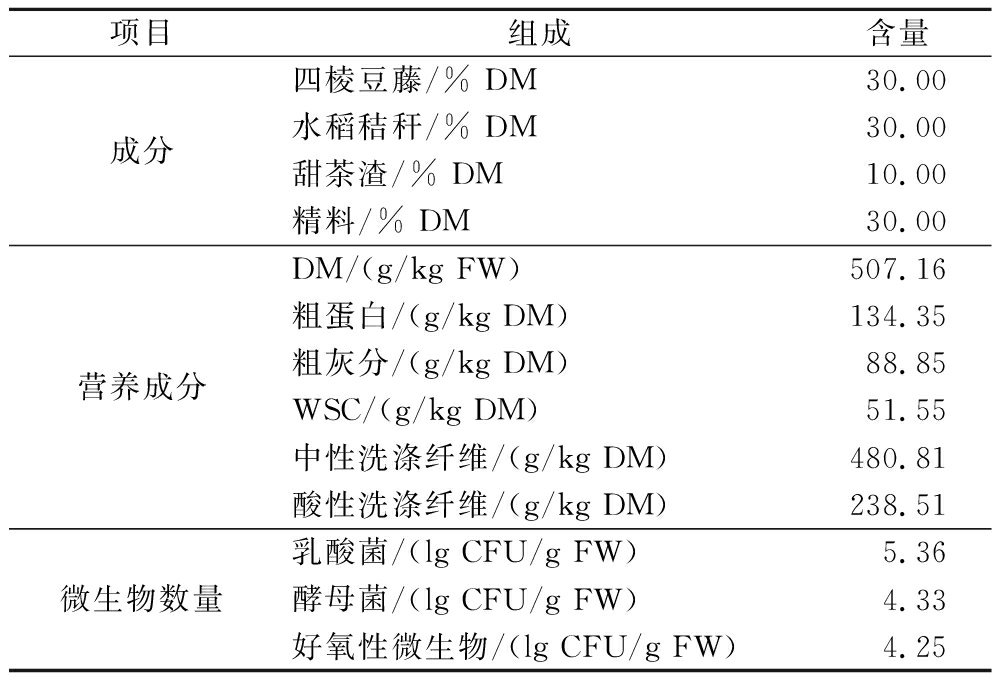
项目组成含量成分四棱豆藤/% DM30.00水稻秸秆/% DM30.00甜茶渣/% DM10.00精料/% DM30.00营养成分DM/(g/kg FW)507.16粗蛋白/(g/kg DM)134.35粗灰分/(g/kg DM)88.85WSC/(g/kg DM)51.55中性洗涤纤维/(g/kg DM)480.81酸性洗涤纤维/(g/kg DM)238.51微生物数量乳酸菌/(lg CFU/g FW) 5.36酵母菌/(lg CFU/g FW)4.33好氧性微生物/(lg CFU/g FW)4.25
2.2 发酵TMR的发酵品质
如表3所示,L和SL组发酵TMR的pH值均低于对照组和S组(P<0.05),L组的乳酸含量最高(P<0.05),对照组、S组和SL组的乳酸含量无显著性差异(P>0.05)。与对照组相比,添加双乙酸钠、双乙酸钠+FJLB显著提高了乙酸浓度(P<0.05)。L组和SL组的酵母菌和好氧性微生物数量显著低于对照组和S组(P<0.05)。4种发酵TMR之间的缓冲能、丁酸浓度和乳酸菌数量差异均不显著(P>0.05)。L组的WSC和粗灰分含量最低(P<0.05),SL组的WSC含量显著高于对照组(P<0.05)。S组中性洗涤纤维显著高于对照组(P<0.05),L组中性洗涤纤维显著低于对照组(P<0.05)。添加剂对DM、粗蛋白、酸性洗涤纤维含量及DM消化率、中性洗涤纤维消化率影响较小(P>0.05)。
表3 青贮35 d后TMR的发酵品质
Table 3 Fermentation quality of TMR silages of different treatments after 35 days of ensiling
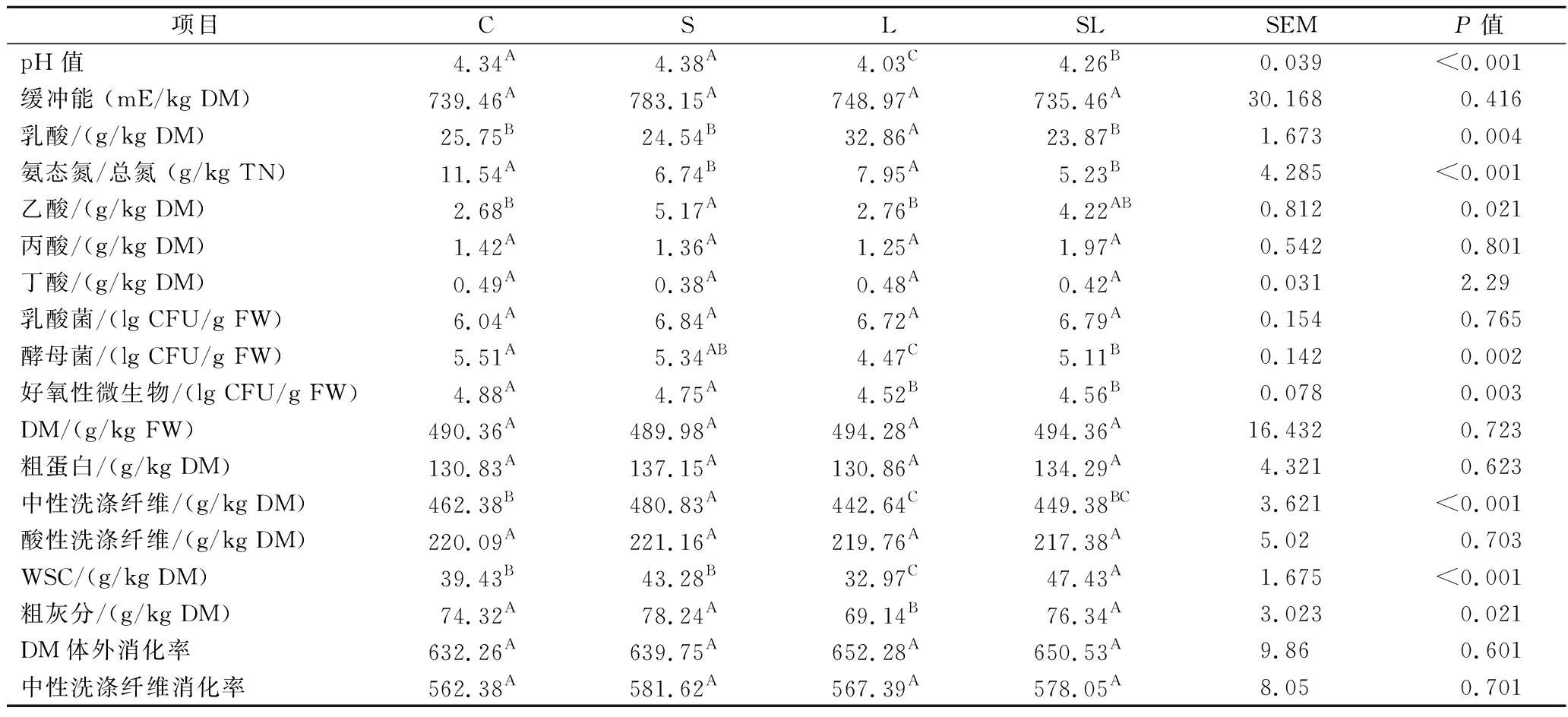
项目CSLSLSEMP值pH值4.34A4.38A4.03C4.26B0.039<0.001缓冲能 (mE/kg DM)739.46A783.15A748.97A735.46A30.1680.416乳酸/(g/kg DM)25.75B24.54B32.86A23.87B1.6730.004氨态氮/总氮 (g/kg TN)11.54A6.74B7.95A5.23B4.285<0.001乙酸/(g/kg DM)2.68B5.17A2.76B4.22AB0.8120.021丙酸/(g/kg DM)1.42A1.36A1.25A1.97A0.5420.801丁酸/(g/kg DM)0.49A0.38A0.48A0.42A0.0312.29乳酸菌/(lg CFU/g FW)6.04A6.84A6.72A6.79A0.1540.765酵母菌/(lg CFU/g FW)5.51A5.34AB4.47C5.11B0.1420.002好氧性微生物/(lg CFU/g FW)4.88A4.75A4.52B4.56B0.0780.003DM/(g/kg FW)490.36A489.98A494.28A494.36A16.4320.723粗蛋白/(g/kg DM)130.83A137.15A130.86A134.29A4.3210.623中性洗涤纤维/(g/kg DM)462.38B480.83A442.64C449.38BC3.621<0.001酸性洗涤纤维/(g/kg DM)220.09A221.16A219.76A217.38A5.020.703WSC/(g/kg DM)39.43B43.28B32.97C47.43A1.675<0.001粗灰分/(g/kg DM)74.32A78.24A69.14B76.34A3.0230.021DM体外消化率632.26A639.75A652.28A650.53A9.860.601中性洗涤纤维消化率562.38A581.62A567.39A578.05A8.050.701
注:SEM为标准误差(standard error of the mean)(下同);同行不同大写字母表示不同处理间差异显著(P<0.05)。
2.3 发酵TMR的有氧稳定性
如图1所示,S组的有氧稳定性达到312 h,显著高于L组和对照组(P<0.05),L组最先变质,对照组次之,S组和SL组之间无显著差异(P>0.05)。
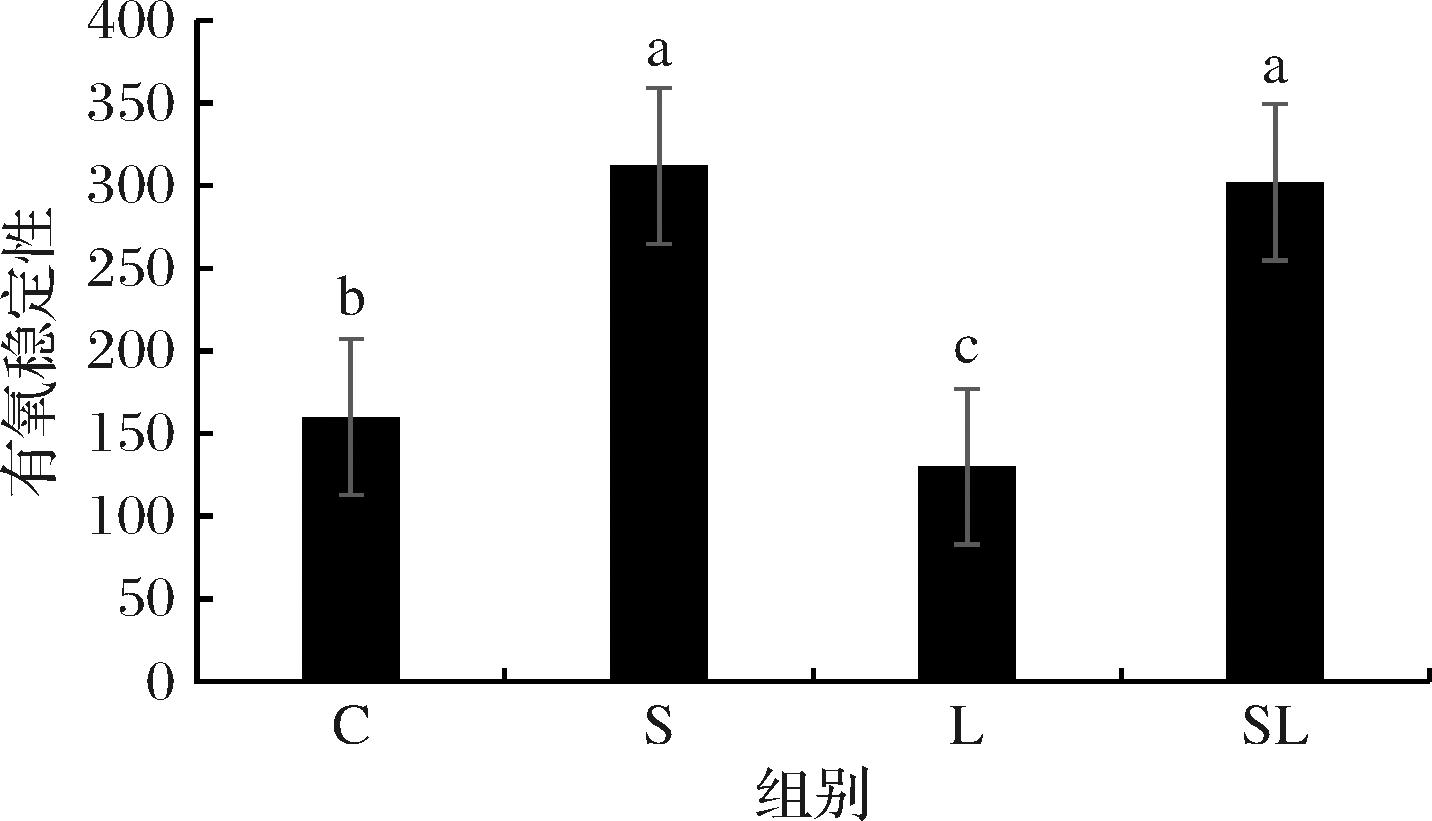
图1 添加剂对发酵全混合日粮有氧稳定性的影响
Fig.1 Effect of each additive on the aerobic stability of fermented total mixed ration
注:不同小写字母表示差异显著。
如表4所示,除丙酸和丁酸含量外,其他添加剂对发酵TMR在有氧稳定过程中的化学成分含量均有显著影响(P<0.05)。除氨态氮、乙酸和丁酸含量外,有氧暴露时间对发酵TMR的有氧稳定性也有显著影响(P<0.05)。处理与有氧暴露时间的交互作用显著影响pH值、乳酸、WSC含量和微生物数量(P<0.05)。有氧暴露0~15 d,对照组和L组pH值呈上升趋势,第15天分别上升至6.98和8.14,显著高于S组和SL组(P<0.05)。对照组、S组和SL组在有氧暴露后第9、6、15天乳酸含量分别显著下降(P<0.05),而S组乳酸含量呈先下降后上升再下降的趋势。各组WSC含量均呈下降趋势。各组在有氧暴露期间氨态氮含量均呈上升趋势,在有氧暴露第15天,对照组和L组的氨态氮含量显著高于S组和SL组(P<0.05)。在整个有氧暴露过程中,S组的丁酸含量显著高于其他3组(P<0.05)。在有氧暴露的第3天,对照组、L组和SL组的好氧菌数显著增加(P<0.05)。在整个有氧暴露过程中,S组和SL组的酵母菌数无显著变化(P>0.05)。在整个有氧暴露过程中,各组乳酸菌数量均呈下降趋势。
表4 开窖后发酵TMR的品质
Table 4 Quality of total mixed ration silages during exposed to air

项目处理有氧暴露时间/d03691215SEMP值TDT×DpH值C4.34Ac4.32Ac4.35Bc6.11Ab7.15Aa6.98Bab0.19<0.001<0.001<0.001S4.38Aa4.26Bb4.15Bc4.24Bb4.34Ba4.36CaL4.03Cd4.05Cd6.24Ac7.98Ab7.91Aa8.14AaSL4.25Bb4.22Bb4.21Bb4.26Bab4.32Ba4.34Ca
续表4

项目处理有氧暴露时间/d03691215SEMP值TDT×D乳酸/(g/kg DM)C25.75Ba25.23ABa24.62Aa15.82Bb10.73Bc9.68Bc1.24<0.001<0.001<0.001S24.54Bab23.03Bbc25.55Aa23.62Aab21.38Ac19.43AcL32.86Aa28.93Aa13.97Bb13.85Cbc9.92Bbc8.58BcSL23.87Bab24.96Bab25.83Aa23.83Aab21.94Aab20.75AbWSC/(g/kg DM)C39.43Ba35.32Bb35.67Ab16.34Bc10.92Bd8.38Cd1.53<0.001<0.001<0.001S43.28Ba37.88Bb35.76Ab31.65Ac26.57Ad19.78BeL32.97Ca30.23Ca20.42Bb12.63Cc9.56Bcd7.76CdSL47.43Aa43.08Ab38.24Ac31.37Ad27.29Ad23.09Ae氨态氮/(g/kg DM)C57.16Ac63.23Abc71.28Aab 70.32ABabc 67.36ABabc78.96ABa4.25<0.0010.0530.504S37.63Bb40.09Cb52.32Ca61.22ABa63.23ABa64.26BCaL36.36Be49.65Bde60.53Bcd71.08Abc79.85Aab88.94AaSL23.64Cd32.53Dcd36.89Dbc48.04Bab56.55Ba58.94Ca乙酸/(g/kg DM)C2.68Ba2.23Bab1.59Bb2.03Bab1.84ABab1.41Bb0.72 0.025 0.153 0.235S5.17Aa4.79Aa4.51Aa3.95Aab2.60Ab2.93AbL2.76Ba1.95Bab1.61Bb1.48Bb1.54Bb1.67BbSL4.22ABa2.65Bb2.02Bb1.84Bb1.47Bb1.89ABb丙酸/(g/kg DM)C1.42Ba1.14Bab0.98Bb0.96Cb0.87Cb0.86Bb0.14 0.101 0.107 0.204S1.36Bb1.62Aab1.32Ab1.99Aa1.19Bb1.26AbL1.25Ba0.82Bb0.72Bb0.75Cb0.77Cb0.64BbSL1.97Aa1.51Aab1.53Abc1.62Bd1.52Acd1.29Acd丁酸/(g/kg DM)C0.49Ab0.53Aab0.58ABab0.61ABa0.55Aab0.53ABab0.04 0.131 0.162 0.326S0.38Abc0.42Bb0.43Bb0.44Bb0.50Aa0.38BcL0.48Ab0.56Ab0.64Aab0.73Aa0.65Aab0.61AabSL0.42Ab0.48Bab0.53ABa0.42Bb0.51Aab0.40Bb好氧性微生物/(lg CFU/g FW)C4.88Ac5.67Ab6.11Abc6.03Abc6.46Aab6.81Aa0.07 0.003<0.001<0.001S4.75Ab4.83Ab5.93Aa5.62Aa6.09Aa6.35AaL4.52Bd5.47Ac6.32Aab6.08Ab6.36Aab6.75AaSL4.56Bd5.08Ac5.63Ab5.81Ab6.60Aa6.76Aa酵母菌/(lg CFU/g FW)C5.51Ab5.57Ab5.61Ab6.28Aa6.49Aa5.88Aab0.16 0.001 0.031 0.029S5.34ABa5.31Aa5.55Aa5.53Ba5.68Ba5.45AaL4.47Cc5.06Ab5.76Aa5.80ABa5.85ABa5.38AabSL5.11Ba5.17Aa5.68Aa5.32Ba5.26Ba5.27Aa乳酸菌/(lg CFU/g FW)C6.04Aa6.34Aa5.87BCa5.63ABa4.84Bb4.73Ab0.15<0.001 0.002<0.001S6.84Aa6.76Aa6.14ABb6.02Ab5.65Ac4.88AdL6.72Aa6.06Ab6.33Aab6.08Ab5.50Ac4.52BdSL6.79Aa6.63Aa5.81Cb5.09Bc5.64Ab4.47Bd
注:同列不同大写字母表示同一暴露时间不同处理间差异显著(P<0.05),同列不同小写字母表示相同处理不同暴露时间差异显著(P<0.05)。
3 讨论
发酵TMR原料是发酵成功的关键,充足的发酵底物和乳酸菌会促进乳酸发酵,从而迅速降低pH值,抑制不良微生物的生长[12]。一般认为,当乳酸菌超过5 lg CFU/g FW,WSC含量超过25~35 g/kg DM时,可以获得高质量的青贮饲料[13]。本试验青贮前TMR中乳酸菌数量接近5 lg CFU/g FW,WSC含量为54.92 g/kg DM,满足青贮发酵成功的条件。青贮35 d后,各试验组仅检出少量丁酸(0.43~0.53 g/kg DM),氨态氮也低于100 g/kg TN。各组TMR均获得了较好的发酵品质。各处理组的pH值均在4.2以上,可能与发酵TMR原料中DM含量较高有关。YUAN等[14]的研究表明,当青贮原料的DM含量较高时,pH值在4.5左右,也可以使饲料保存良好。本试验中添加FJLB明显降低了发酵TMR的pH值,提高乳酸含量,这是因为乳酸菌在发酵初期以乳酸菌的增殖为主,加速了pH值的下降,从而抑制了不良菌的影响,减少了蛋白质的水解,提高了发酵TMR的品质。这一结果与BUREENOK等[15]的研究一致。氨态氮/总氮主要体现蛋白质和氨基酸的降解程度,数值越低,发酵品质越好[16]。S组和SL组的氨态氮/总氮值明显低于非双乙酸钠组,可能是双乙酸钠抑制了丁酸菌等有害微生物的生长,从而减少了蛋白质和氨基酸的分解。国卫杰等[17]还报道了添加双乙酸钠可以抑制有害细菌的生长,延长储藏时间。本研究中在青贮35 d后,添加双乙酸钠与组合添加双乙酸钠组的乳酸含量与乳酸菌数量与对照组相比均没有显著性差异,这可能是双乙酸钠对乳酸菌发酵过程没有影响,双乙酸钠主要靠分解的分子态乙酸起抗菌作用,对霉菌、酵母和细菌等有害微生物有良好的抑制能力。张新慧等[5]的研究也表明双乙酸钠(0.4%,质量分数)对乳酸菌发酵可溶性糖产生乳酸的过程没有影响。刘振阳等[18]的研究则表明,双乙酸钠有降低了青贮饲料pH值,减少了青贮饲料的营养损失,但是较高的双乙酸钠添加量会抑制青贮饲料乳酸菌的活性。
在青贮35 d后,添加FJLB显著降低了NDF的含量,这种降低可能归因于细胞壁组分的酸解[19],L组和SL组较高的乳酸含量可以准确地解释这一点。同样,YUAN等[14]也报道了青贮饲料中较高的乳酸含量会导致酸解,从而减少中性洗涤纤维的含量。本研究中,青贮35 d后,L和SL组的中性洗涤纤维低于对照组,而L和SL组的酸性洗涤纤维与对照组相比无明显差异,绿汁发酵液对中性洗涤纤维来源材料的影响较大,对酸性洗涤纤维影响较小,中性洗涤纤维比酸性洗涤纤维多含半纤维素,因此对发酵的影响更大。在本研究中,添加剂不影响中性洗涤纤维消化率和DM消化率。也有研究者发现,添加微生物不会影响用象草制成的青贮饲料的DM消化率[20]。
当青贮饲料处于有氧暴露阶段时,乳酸、蛋白质和WSC被好氧微生物分解和利用,产生氨、CO2和水等产物并释放热量,导致有氧变质[7]。有氧稳定性通常用青贮饲料核心温度比外部温度高出2 ℃所需的时间来表示[21]。pH值在有氧暴露阶段的变化也是发酵TMR腐烂程度的指标之一,本研究中,S和SL组发酵TMR在有氧暴露12 d后的pH值保持在4.5左右,添加双乙酸钠增强了发酵TMR的有氧稳定性,这可归因于双乙酸钠中含有两个乙酸根,可以缓慢分解并释放单分子物质乙酸,而乙酸类似于脂类,可以穿透霉菌和酵母的细胞壁,干扰细胞间酶的识别、传递和转化,促进蛋白质变性,改变细胞通透性,起到杀菌作用。乙酸还可以通过降低物质的pH值来抑制细菌和杀灭细菌[14]。因此,乙酸也是预测发酵TMR有氧稳定性的主要指标之一,乙酸的浓度越高,有氧腐烂的时间就越长[18]。在本试验中,S和SL组发酵TMR的乳酸含量高于对照和L组,而氨态氮含量低于对照和L组发酵TMR,这与双乙酸钠改善有氧稳定性的效果是一致的。JOHNSON等[22]报道,WSC和乳酸可以为好氧微生物、酵母和霉菌的生长和增殖提供底物,导致青贮饲料中营养物质的损失。在本试验中,对照组和L组发酵TMR在发酵35 d后的WSC含量较高,而有氧稳定性低于双乙酸钠组。
4 结论
各组发酵TMR均具有良好的发酵品质。添加双乙酸钠可使发酵TMR保存12 d以上,提高发酵TMR的有氧稳定性。因此,添加0.5%(质量分数)双乙酸钠可在不影响发酵品质的前提下提高发酵TMR的有氧稳定性,可用于生产。
[1] CHEN L, GUO G, YU C Q, et al.The effects of replacement of whole-plant corn with oat and common vetch on the fermentation quality, chemical composition and aerobic stability of total mixed ration silage in Tibet[J].Animal Science Journal=Nihon Chikusan Gakkaiho, 2015, 86(1):69-76.
[2] YANI S, ISHIDA K, GODA S, et al.Effects of utilization of local food by-products as total mixed ration silage materials on fermentation quality and intake, digestibility, rumen condition and nitrogen availability in sheep[J].Animal Science Journal=Nihon Chikusan Gakkaiho, 2015, 86(2):174-180.
[3] 胡伟, 陈豫.多粮型白酒酒糟与水稻秸秆混合厌氧发酵产沼气特性研究[J].食品与发酵工业, 2014, 40(12):15-19.
HU W, CHEN Y.Study on characteristics of biogas production of rice straw mixed with distiller’s grains of multiple-grains in anaerobic fermentation[J].Food and Fermentation Industries, 2014, 40(12):15-19.
[4] HUISDEN C M, ADESOGAN A T, KIM S C, et al.Effect of applying molasses or inoculants containing homofermentative or heterofermentative bacteria at two rates on the fermentation and aerobic stability of corn silage[J].Journal of Dairy Science, 2009, 92(2):690-697.
[5] 张新慧, 张永根, 赫英飞.添加两种乙酸钠盐对玉米青贮品质及有氧稳定性的影响[J].中国农业科学, 2008, 41(6):1810-1815.
ZHANG X H, ZHANG Y G, HE Y F.Effect of adding two types of sodium acetate compounds on corn silage quality and aerobic stability[J].Scientia Agricultura Sinica, 2008, 41(6):1810-1815.
[6] ZHANG Y C, LI D X, WANG X K, et al.Fermentation quality and aerobic stability of mulberry silage prepared with lactic acid bacteria and propionic acid[J].Animal Science Journal=Nihon Chikusan Gakkaiho, 2019, 90(4):513-522.
[7] YUAN X J, WANG J, GUO G, et al.Effects of ethanol, molasses and Lactobacillus plantarum on fermentation characteristics and aerobic stability of total mixed ration silages[J].Grass and Forage Science, 2016, 71(2):328-338.
[8] DESTA S T, YUAN X J, LI J F, et al.Ensiling characteristics, structural and nonstructural carbohydrate composition and enzymatic digestibility of Napier grass ensiled with additives[J].Bioresource Technology, 2016, 221:447-454.
[9] CHEN L, YUAN X J, LI J F, et al.Effect of lactic acid bacteria and propionic acid on conservation characteristics, aerobic stability and in vitro gas production kinetics and digestibility of whole-crop corn based total mixed ration silage[J].Journal of Integrative Agriculture, 2017, 16(7):1592-1600.
[10] NKOSI B D, MEESKE R.Effects of ensiling totally mixed potato hash ration with or without a heterofermentative bacterial inoculant on silage fermentation, aerobic stability, growth performance and digestibility in lambs[J].Animal Feed Science and Technology, 2010, 161(1-2):38-48.
[11] CHEN L, GUO G, YUAN X J, et al.Effect of applying molasses and propionic acid on fermentation quality and aerobic stability of total mixed ration silage prepared with whole-plant corn in Tibet[J].Asian-Australasian Journal of Animal Sciences, 2014, 27(3):349-356.
[12] ZHANG J G.Roles of biological additives in silage production and utilization[J].Research advance in food science, 2002, 3:37-46.
[13] 邱小燕, 奚恺锋, 谢新辉, 等.秸秆替代全株四棱豆对全混合日粮发酵品质及有氧稳定性的影响[J].食品与发酵工业, 2019, 45(24):98-104.
QIU X Y, XI K F, XIE X H, et al.Fermentation quality and aerobic stability of the total mixed ration after replacing winged bean with straw[J].Food and Fermentation Industries, 2019, 45(24):98-104.
[14] YUAN X J, YU C Q, SHIMOJO M, et al.Improvement of fermentation and nutritive quality of straw-grass silage by inclusion of wet hulless-barley distillers’ grains in Tibet[J].Asian-Australasian Journal of Animal Sciences, 2012, 25(4):479-485.
[15] BUREENOK S, SUKSOMBAT W, KAWAMOTO Y.Effects of the fermented juice of epiphytic lactic acid bacteria (FJLB) and molasses on digestibility and rumen fermentation characteristics of ruzigrass (Brachiaria ruziziensis) silages[J].Livestock Science, 2011, 138(1-3):266-271.
[16] WEN A Y, YUAN X J, WANG J, et al.Effects of four short-chain fatty acids or salts on dynamics of fermentation and microbial characteristics of alfalfa silage[J].Animal Feed Science and Technology, 2017, 223:141-148.
[17] 国卫杰, 王加启, 王晶, 等.添加不同水平双乙酸钠对裹包TMR贮存效果的影响[J].西北农林科技大学学报(自然科学版), 2009, 37(12):45-50.
GUO W J, WANG J Q, WANG J, et al.Effect of the different levels of sodium diacetate supplementation on the storage of the baled TMR[J].Journal of Northwest A &F University (Natural Science Edition), 2009, 37(12):45-50.
[18] 刘振阳, 孙娟娟, 姜义宝, 等.双乙酸钠对苜蓿与小麦混合青贮发酵品质和有氧稳定性的影响[J].中国草地学报, 2017, 39(2):85-89.
LIU Z Y, SUN J J, JIANG Y B, et al.Effect of sodium diacetate on fermentation quality and aerobic stability of mixed alfalfa and wheat silage[J].Chinese Journal of Grassland, 2017, 39(2):85-89.
[19] MOHAMMADZADEH-AGHDASH H, SOHRABI Y, MOHAMMADI A, et al.Safety assessment of sodium acetate, sodium diacetate and potassium sorbate food additives[J].Food Chemistry, 2018, 257:211-215.
[20] DE JESUS FERREIRA D, DE PAULA LANA R, DE MOURA ZANINE A, et al.Silage fermentation and chemical composition of elephant grass inoculated with rumen strains of Streptococcus bovis[J].Animal Feed Science and Technology, 2013, 183(1-2):22-28.
[21] WILKINSON J M, DAVIES D R.The aerobic stability of silage:Key findings and recent developments[J].Grass and Forage Science, 2013, 68(1):1-19.
[22] JOHNSON L M, HARRISON J H, DAVIDSON D, et al.Corn silage management:Effects of maturity, inoculation, and mechanical processing on pack density and aerobic stability[J].Journal of Dairy Science, 2002, 85(2):434-444.