免疫应答是人体免疫系统的关键防御机制,对生命健康至关重要。免疫稳态通过T淋巴细胞介导的细胞免疫和B淋巴细胞介导的体液免疫进行调节。营养不良、化疗和压力等多种因素可导致免疫低下,免疫低下与各种疾病发展密切相关,如化疗、放疗和免疫抑制剂所致的免疫低下会增加癌症的风险[1]。因此,寻求预防和缓解免疫低下的有效策略至关重要。
酸奶中富含多种具有免疫调节活性的物质,在调节机体免疫方面具有较大的潜力[2]。以往关于酸奶的免疫调节作用研究大多聚焦于益生菌、蛋白质或维生素等[3-4],然而,D-乳酸作为酸奶中乳酸菌发酵的重要代谢产物却很少受到关注。乳酸包含D-乳酸和L-乳酸两种光学异构体,广泛存在于传统发酵食品中,如酸奶、泡菜等[5]。在酸奶生产过程中,保加利亚乳杆菌可以将90%的丙酮酸转化为D-乳酸[6]。研究普遍认为,人体内只存在可以快速代谢L-乳酸的L-乳酸脱氢酶,而不存在D-乳酸脱氢酶,因此血浆D-乳酸浓度升高会导致酸中毒[5]。然而,最新研究对D-乳酸的安全性和有效性进行了全面评估,证明小鼠每天摄入2 000 mg/kg的D-乳酸并不影响其正常生长发育,且与L-乳酸相比,D-乳酸由于其药代动力学优势而具有更强的抗炎特性[7]。此外,D-乳酸在酸奶预防小鼠结肠炎相关结直肠癌中具有重要作用,对肠巨噬细胞具有一定的免疫调控潜力[8]。因此,D-乳酸很可能是一种潜在的食品营养因子。
本文利用环磷酰胺建立免疫低下模型,通过分析小鼠体质量、免疫器官指数、迟发型变态反应程度、骨髓形态、外周血细胞数量、免疫细胞核转录因子、血清细胞因子水平等指标,评估D-乳酸对免疫低下小鼠的免疫功效,为缓解免疫低下提供新思路,并为传统发酵食品的生理功效和D-乳酸的进一步开发提供科学依据。
1 材料与方法
1.1 实验动物
健康SPF级Balb/c雌性小鼠,体质量(20.0±2.0) g,6周龄,购自北京维通利华实验动物技术有限公司。
1.2 试剂与仪器
D-乳酸钠、环磷酰胺、盐酸左旋咪唑,Sigma-Aldrich;5%和20%(体积分数)绵羊红细胞,南京森贝伽生物科技有限公司;Annexin V-FITC细胞凋亡检测试剂盒,上海碧云天生物技术有限公司;外周血淋巴细胞提取试剂盒,北京索莱宝生物科技有限公司;免疫球蛋白(immunoglobulin, Ig)M、白细胞介素(interleukin, IL)-2、IL-4试剂盒,南京建成生物工程研究所。
实时荧光定量PCR仪,美国Bio-Rad公司;全自动血液细胞分析仪,深圳迈瑞生物医疗电子股份有限公司;流式细胞分选仪,美国BD公司;落地式离心机,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 动物实验分组
6周龄SPF级Balb/c雌性小鼠饲养于江南大学实验动物中心,许可证号为SYXK(苏)2021-0056。动物实验通过江南大学实验动物管理与动物福利伦理委员会批准,伦理编号为JN.No20220315c0900425[012]。小鼠饲养屏障环境为:温度21~25 ℃,相对湿度50%~60%,12 h昼夜循环。适应性饲养7 d后,将实验动物随机分为空白组、环磷酰胺模型组、盐酸左旋咪唑阳参组及D-乳酸低、中、高剂量组,每组各7只。除空白组外,其余各组每天腹腔注射80 mg/kg bw的环磷酰胺,建立免疫低下小鼠模型,空白组腹腔注射等量的生理盐水,连续3 d。从第4天开始,阳参组给予小鼠灌胃40 mg/kg bw盐酸左旋咪唑,D-乳酸低、中、高剂量组分别灌胃75、150、300 mg/kg bw D-乳酸钠溶液,空白组和模型组灌胃等量的蒸馏水,每日观察各组小鼠状态,连续治疗15 d后,按照动物福利原则处死小鼠并取材,检测各项指标。
1.3.2 体质量和免疫器官指数
在小鼠造模前称其体质量,记为初始体质量;在小鼠造模后称其体质量,记为造模后体质量;在D-乳酸灌胃15 d后称其体质量,记为终末体质量。小鼠处死后,取脾脏和胸腺,分别称重。将免疫器官质量与体质量的比值定义为免疫器官指数,单位为mg/g。免疫器官指数按公式(1)计算:
免疫器官指数![]()
(1)
1.3.3 迟发型变态反应
迟发型变态反应是一种体内细胞免疫检测方式,当致敏的T淋巴细胞与抗原再次接触时,引起T淋巴细胞的激活,受刺激部位出现明显肿胀,肿胀程度表明T淋巴细胞的免疫应答水平[9]。在给药第11天,将0.2 mL 5%(体积比)的绵羊红细胞注射到小鼠腹腔内,使用游标卡尺测量右后足跖的厚度。第4天后,将20 μL 20%(体积比)的绵羊红细胞注入到右后足跖。在第二次注射后的24 h内,测定足跖的厚度。同一部位测量3次,取平均值。厚度的增加量作为评估迟发型变态反应程度的指标[10]。
1.3.4 骨组织形态学
摘除小鼠股骨,小心去除肌肉组织,将小鼠股骨组织在4%多聚甲醛中固定24 h后,经脱钙、脱水、透明、浸蜡、包埋和切片步骤完成标本的制作。标本经过烤片、二甲苯脱蜡、复水、苏木精-伊红(H&E)染色、脱水、透明及中性树胶封片后,在切片扫描仪下观察[11]。
1.3.5 骨髓细胞凋亡检测
无菌条件下摘除小鼠股骨,小心去除肌肉组织,无菌注射器插入骨髓腔内,使用DMEM培养基(胎牛血清10%,青霉素100 U/mL,链霉素0.1 mg/mL)提取骨髓细胞,将液体样品收集到无菌离心管中离心,计数备用[12]。按照Annexin V-FITC细胞凋亡检测试剂盒操作说明[13],取5×104个细胞,用195 μL Annexin V-FITC结合液轻轻重悬细胞,分别加入5 μL Annexin V-FITC和10 μL碘化丙啶染色液,轻轻混匀。室温(20~25 ℃)避光孵育10~20 min,立即用流式细胞仪检测细胞凋亡率,细胞凋亡率按公式(2)计算:
凋亡率![]()
(2)
1.3.6 外周血细胞计数
末次灌胃第1天,小鼠眼眶后静脉丛取血。麻醉小鼠并进行眼部消毒,用毛细管轻轻穿刺小鼠眼眶下方的静脉血管,取50 μL全血于EDTA抗凝管中。完成取样后,用干净棉球轻轻压迫取样处,帮助止血,确保小鼠恢复到正常状态。将样本充分混匀,立即采用全自动血细胞分析仪对血细胞进行计数。
1.3.7 外周血淋巴细胞提取
末次灌胃第2天,小鼠眼眶后静脉丛取血,方法同1.3.6节。取适量全血于EDTA抗凝管中,充分混匀。采用小鼠外周血淋巴细胞分离液试剂盒,无菌条件下分离外周血淋巴细胞,按照操作说明,使用与血液等体积的组织稀释液稀释全血,加入适量分离液,离心后小心吸取白膜层细胞,用PBS洗涤并重悬2次后,离心去上清,将淋巴细胞分离出来备用[14]。
1.3.8 免疫细胞核转录因子表达
按照Trizol说明书提取外周血淋巴细胞的总RNA,使用逆转录试剂盒将RNA转化为cDNA。使用实时定量PCR系统评估基因表达水平,引物序列见表1。通过将目标基因与β-actin进行比较,并使用2-ΔΔCt方法对目标基因进行相对定量。
表1 引物序列
Table 1 Primer sequences

基因名称正向序列反向序列T-betCAACAACCCCTTTGCCAAAGTCCCCCAAGCAGTTGACAGTGATA3AGGATGTCCCTGCTCTCCTTGCCTGCGGACTCTACCATAAβ-actinTGCTCTCCCTCACGCCATCGAGGAAGAGGATGCGGCAGT
1.3.9 血清细胞因子水平
将新鲜全血在室温条件下静置1 h,4 ℃条件下3 000 r/min离心15 min。吸取上清液即为血清,采用ELISA试剂盒测定血清中细胞因子IL-2、IL-4、IgM的含量。
1.4 数据统计分析
使用Graphpad Prism 8.0软件进行数据分析和绘图,采用均值±标准差表示,采用单因素方差分析(one-way ANOVA),并认为P<0.05差异有统计学意义。以符号数目区分显著性等级,其中,与空白组相比,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1;与模型组相比,#P<0.05,##P<0.01,###P<0.001,####P<0.000 1。
2 结果与分析
2.1 体质量
如表2所示,各组小鼠初始体质量无统计学差异,环磷酰胺造模3 d后,与空白组相比,各组小鼠的体质量均显著降低(P<0.01)。实验15 d后,与模型组相比,阳参组小鼠的终末体质量得到显著恢复(P<0.01),而D-乳酸低剂量组小鼠的终末体质量无明显变化,D-乳酸中高剂量组小鼠的终末体质量得到显著恢复(P<0.05)。研究结果表明中高剂量D-乳酸可以恢复环磷酰胺所致的小鼠体质量下降。
表2 D-乳酸对免疫低下小鼠体质量的影响
Table 2 Effect of D-lactate on the body weight of immunosuppressive mice
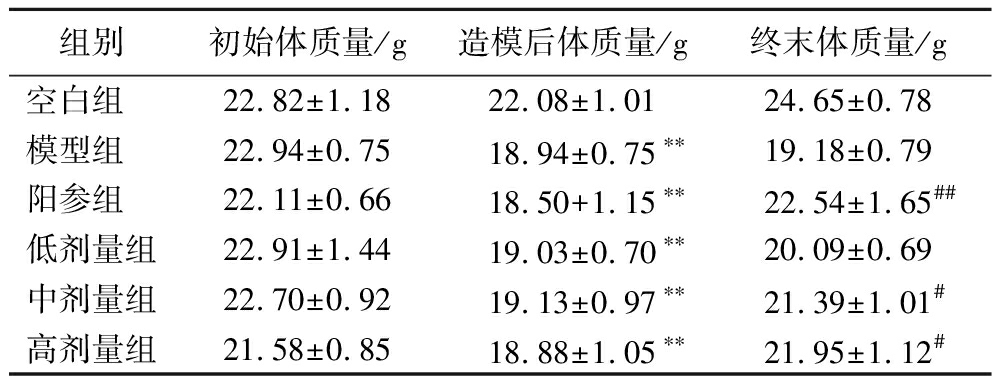
组别初始体质量/g造模后体质量/g终末体质量/g空白组 22.82±1.1822.08±1.0124.65±0.78模型组 22.94±0.7518.94±0.75∗∗19.18±0.79阳参组 22.11±0.6618.50+1.15∗∗22.54±1.65##低剂量组22.91±1.4419.03±0.70∗∗20.09±0.69中剂量组22.70±0.9219.13±0.97∗∗21.39±1.01#高剂量组21.58±0.8518.88±1.05∗∗21.95±1.12#
2.2 免疫器官指数
如图1所示,与空白组相比,模型组小鼠的脾脏指数和胸腺指数均显著减小(P<0.001)。实验15 d后,与模型组相比,阳参组小鼠脾脏指数(P<0.01)和胸腺指数(P<0.01)显著增加,D-乳酸低、中、高剂量组小鼠脾脏指数(P<0.05)和胸腺指数(P<0.01)均有不同程度的增加。以上结果说明D-乳酸可以提高免疫低下小鼠的免疫器官发育指数。
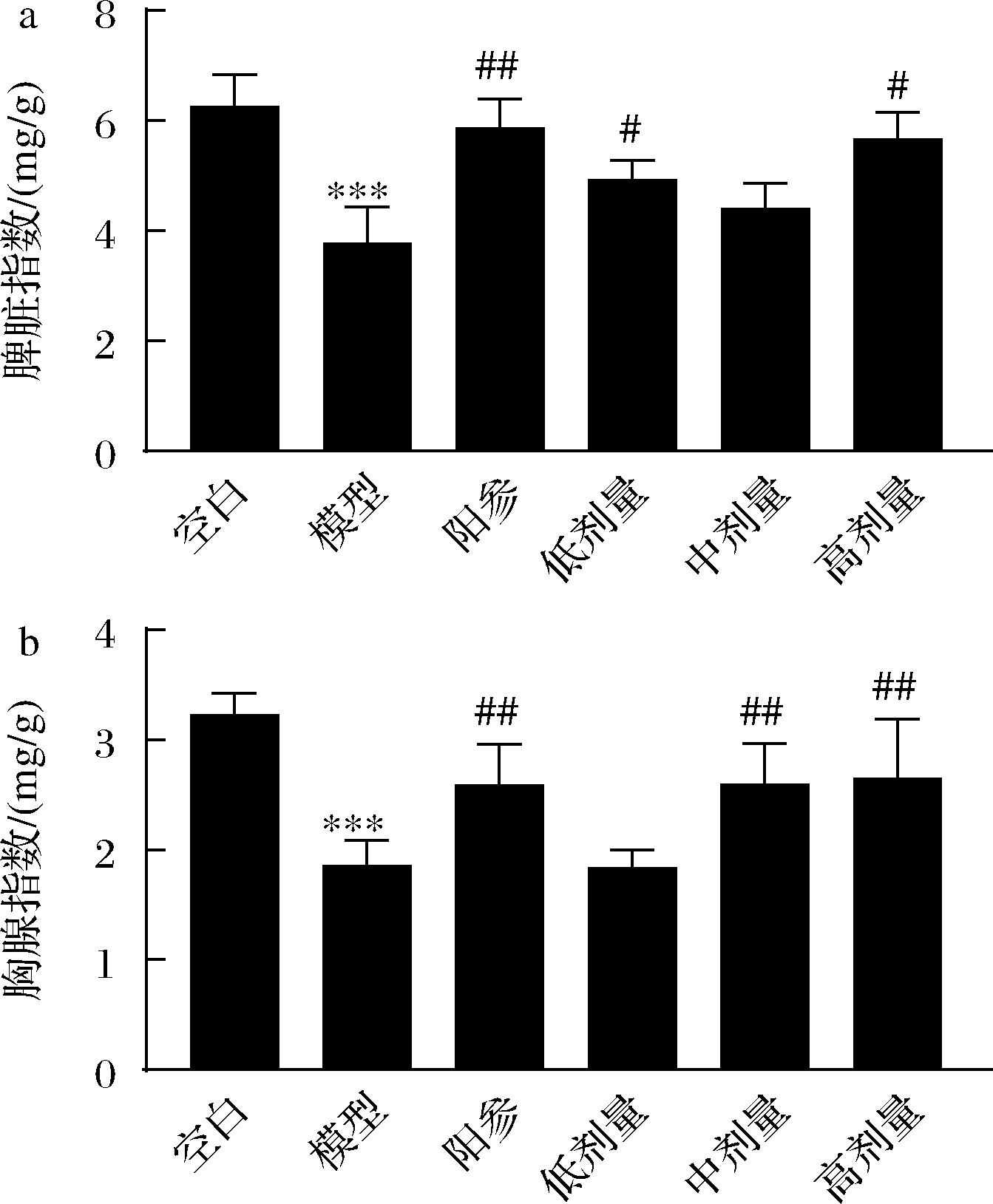
a-脾脏指数;b-胸腺指数
图1 D-乳酸对免疫低下小鼠免疫器官指数的影响
Fig.1 Effect of D-lactate on the immune organ indexes of immunosuppressive mice
2.3 迟发型变态反应
如图2所示,与空白组相比,模型组小鼠足跖肿胀程度显著降低(P<0.001)。与模型组比较,阳参组小鼠足跖肿胀程度显著增加(P<0.001),D-乳酸中剂量组(P<0.05)和高剂量组(P<0.01)小鼠足跖肿胀程度均显著增加。以上结果说明D-乳酸可以剂量依赖性地提高免疫低下小鼠的迟发型变态反应程度。
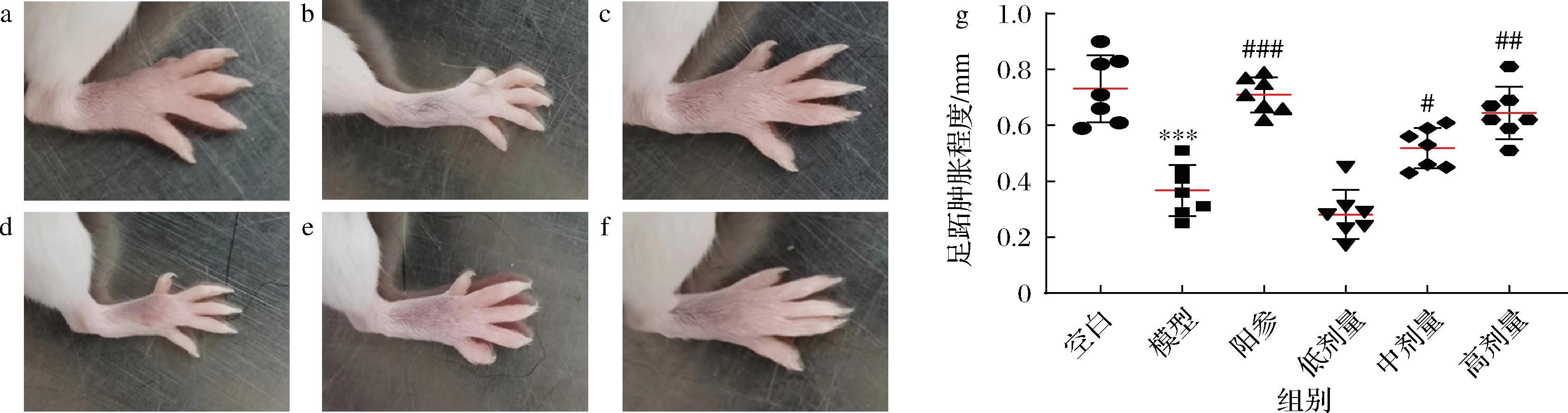
a-空白组;b-模型组;c-阳参组;d-低剂量组;e-中剂量组;f-高剂量组;g-足跖肿胀程度
图2 D-乳酸对免疫低下小鼠迟发型变态反应程度的影响
Fig.2 Effect of D-lactate on the degree of delayed-type hypersensitivity of immunosuppressive mice
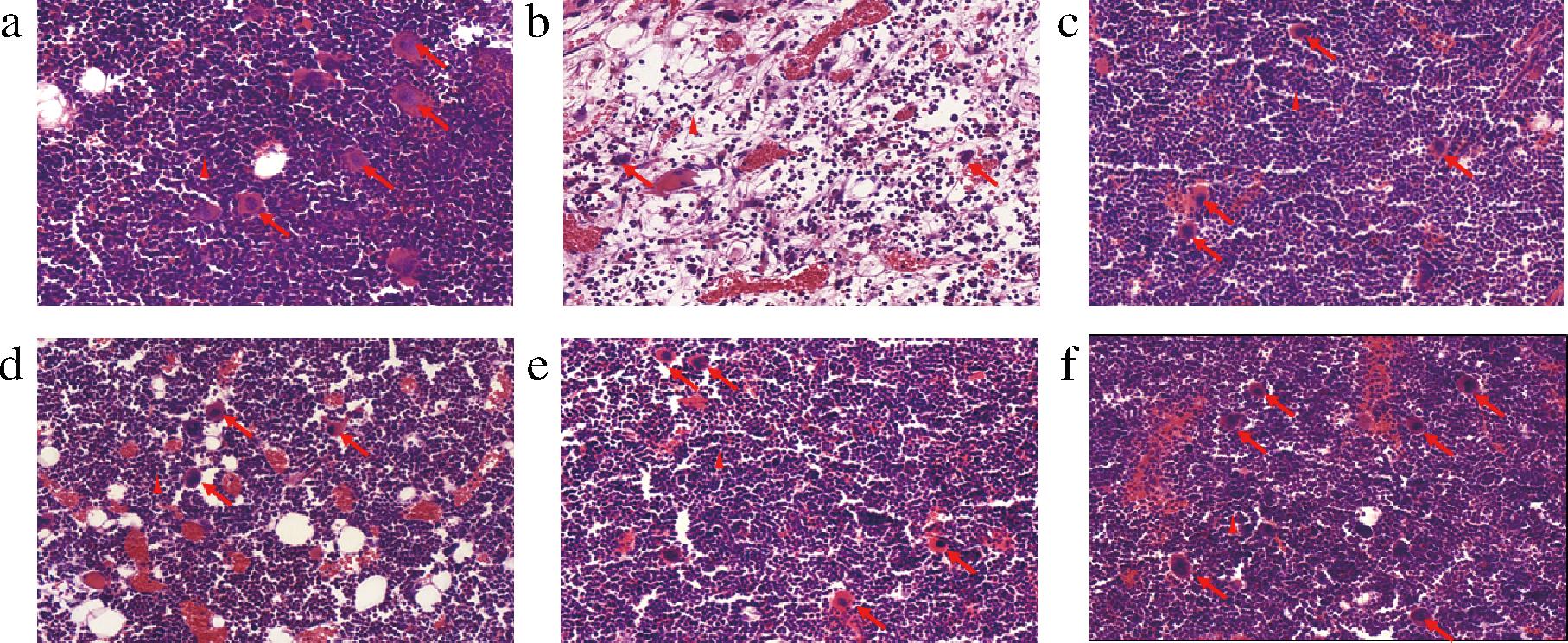
a-空白组;b-模型组;c-阳参组;d-低剂量组;e-中剂量组;f-高剂量组
图3 小鼠股骨组织H&E染色(×50)
Fig.3 H&E staining of mouse femur tissue (×50)
2.4 骨髓结构形态
如图3所示,空白组小鼠的骨髓组织结构清晰,其中成骨细胞(箭头所示)和髓样细胞(三角所示)数量众多,紧密排列。与空白组相比,环磷酰胺模型组的骨髓组织结构混乱,成骨细胞和髓样细胞数量明显减少,排列松散。与模型组相比,阳参组骨髓组织结构得到改善,成骨细胞和髓样细胞数量得到恢复,D-乳酸摄入后也有相似的结果,特别是中高剂量的D-乳酸可以明显恢复骨髓组织结构与成骨细胞和髓样细胞的数量。以上结果说明,D-乳酸可以恢复免疫低下小鼠的骨髓形态结构。
2.5 骨髓细胞凋亡
如图4和图5所示,空白组的细胞凋亡率为(1.45±0.22)%,而与空白组相比,模型组的细胞凋亡率显著上升(P<0.000 1),为(12.50±1.08)%。与模型组相比,阳参组的细胞凋亡率显著降低(P<0.01),为(7.30±0.85)%,D-乳酸中剂量组(P<0.05)和高剂量组(P<0.01)的细胞凋亡率显著降低,分别为(8.80±0.49)%和(8.11±0.64)%。以上结果说明,D-乳酸可以改善免疫低下小鼠的骨髓细胞凋亡。
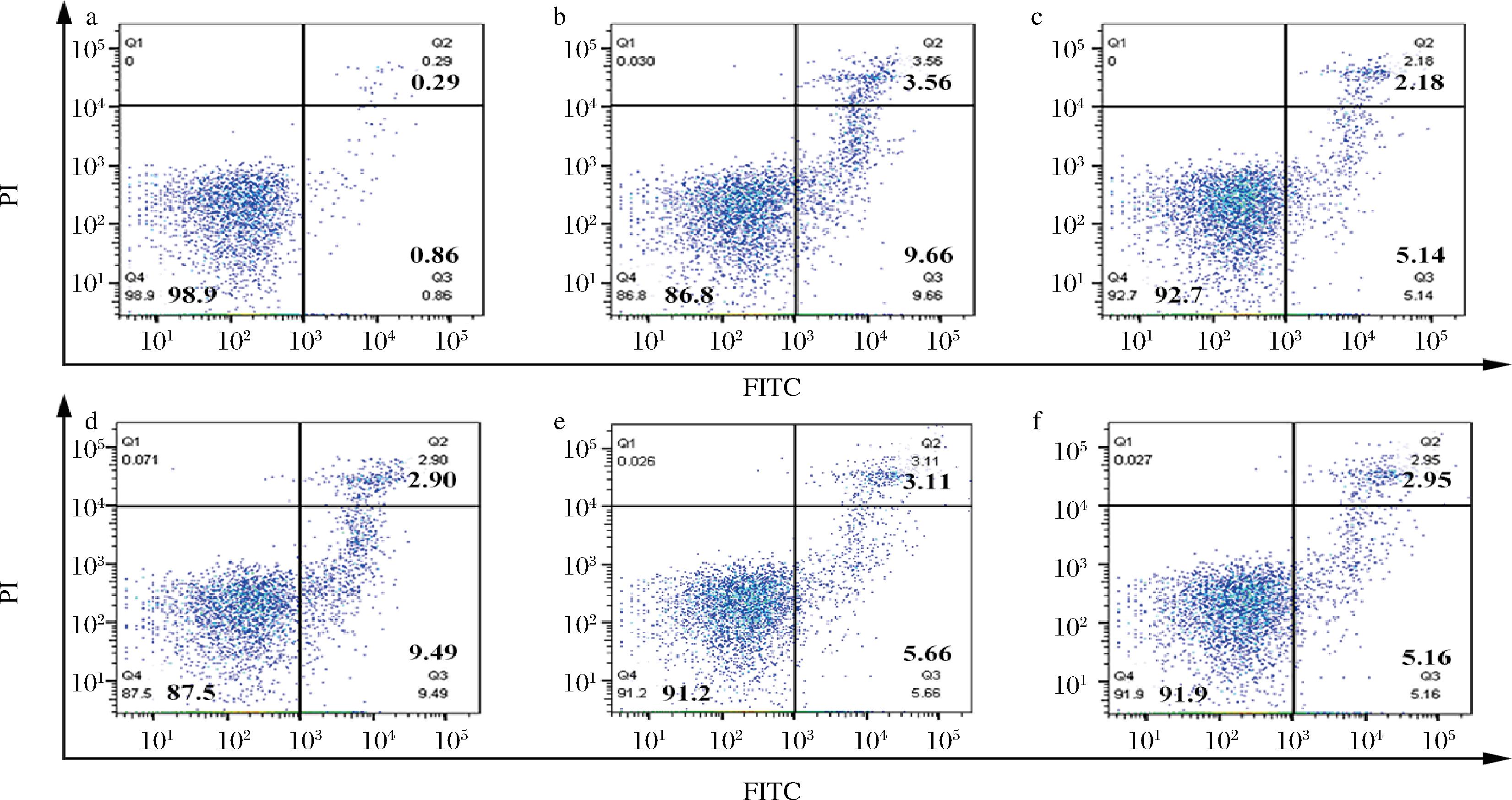
a-空白组;b-模型组;c-阳参组;d-低剂量组;e-中剂量组;f-高剂量组
图4 免疫低下小鼠骨髓流式细胞图
Fig.4 Bone marrow flow cytometry of immunosuppressive mice

图5 D-乳酸对免疫低下小鼠骨髓细胞凋亡的影响
Fig.5 Effect of D-lactate on the bone marrow cell apoptosis of immunosuppressive mice
2.6 血细胞计数
如图6所示,与空白组相比,环磷酰胺模型组小鼠的外周血白细胞、淋巴细胞和红细胞数量显著减少(P<0.001),血红蛋白浓度没有明显变化。与模型组相比,阳参组白细胞数量(P<0.001)、淋巴细胞数量(P<0.001)和红细胞数量(P<0.01)显著增加,D-乳酸灌胃后,各剂量组的白细胞和淋巴细胞数量恢复至空白组水平,而各组间红细胞与血红蛋白浓度均无显著变化。以上结果说明,D-乳酸可以恢复免疫低下小鼠血液中的白细胞和淋巴细胞数量,而对红细胞数量和血红蛋白浓度无显著影响。
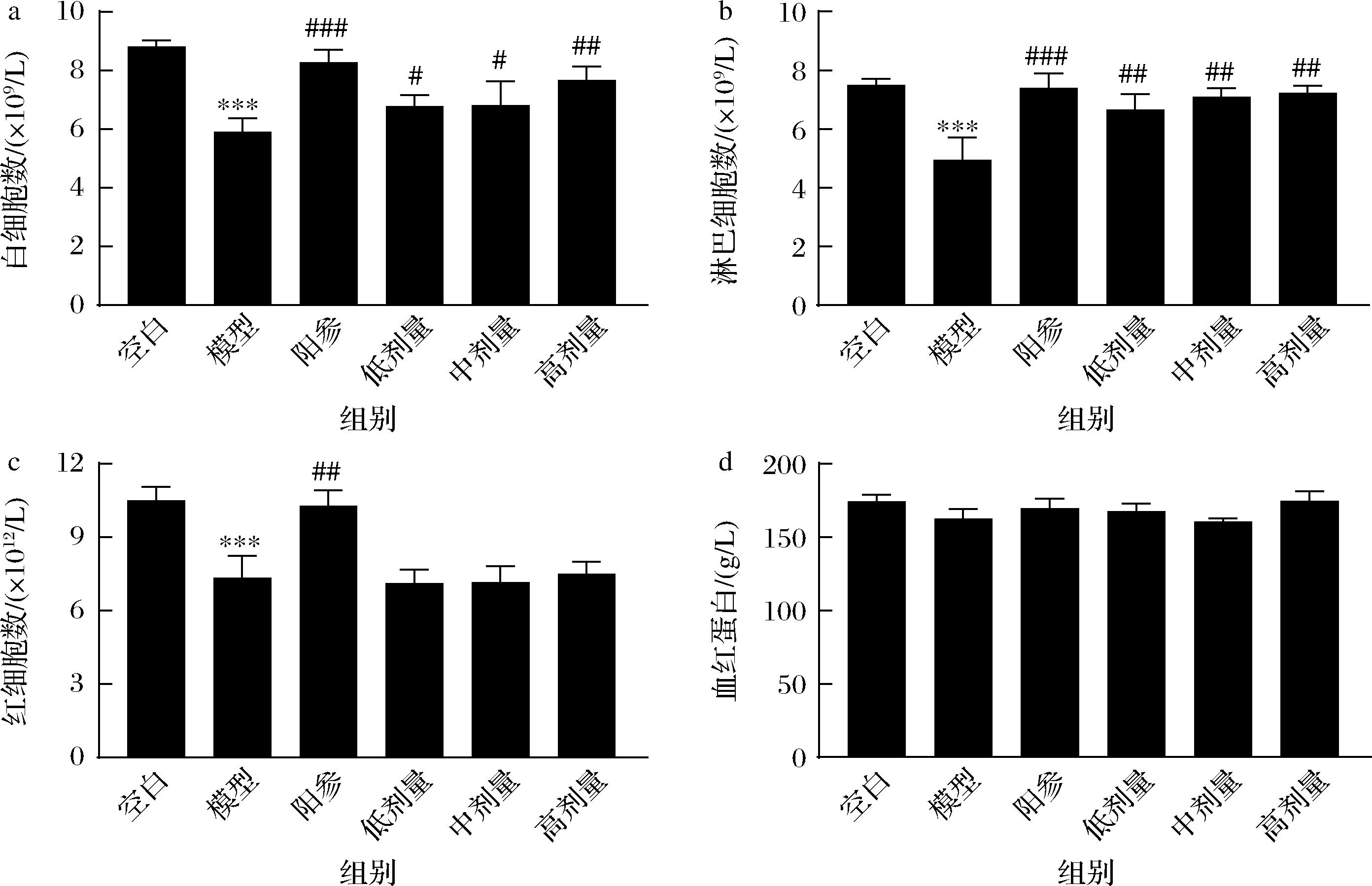
a-白细胞数;b-淋巴细胞数;c-红细胞数;d-血红蛋白
图6 D-乳酸对免疫低下小鼠血细胞数量的影响
Fig.6 Effect of D-lactate on the blood cell count of immunosuppressive mice
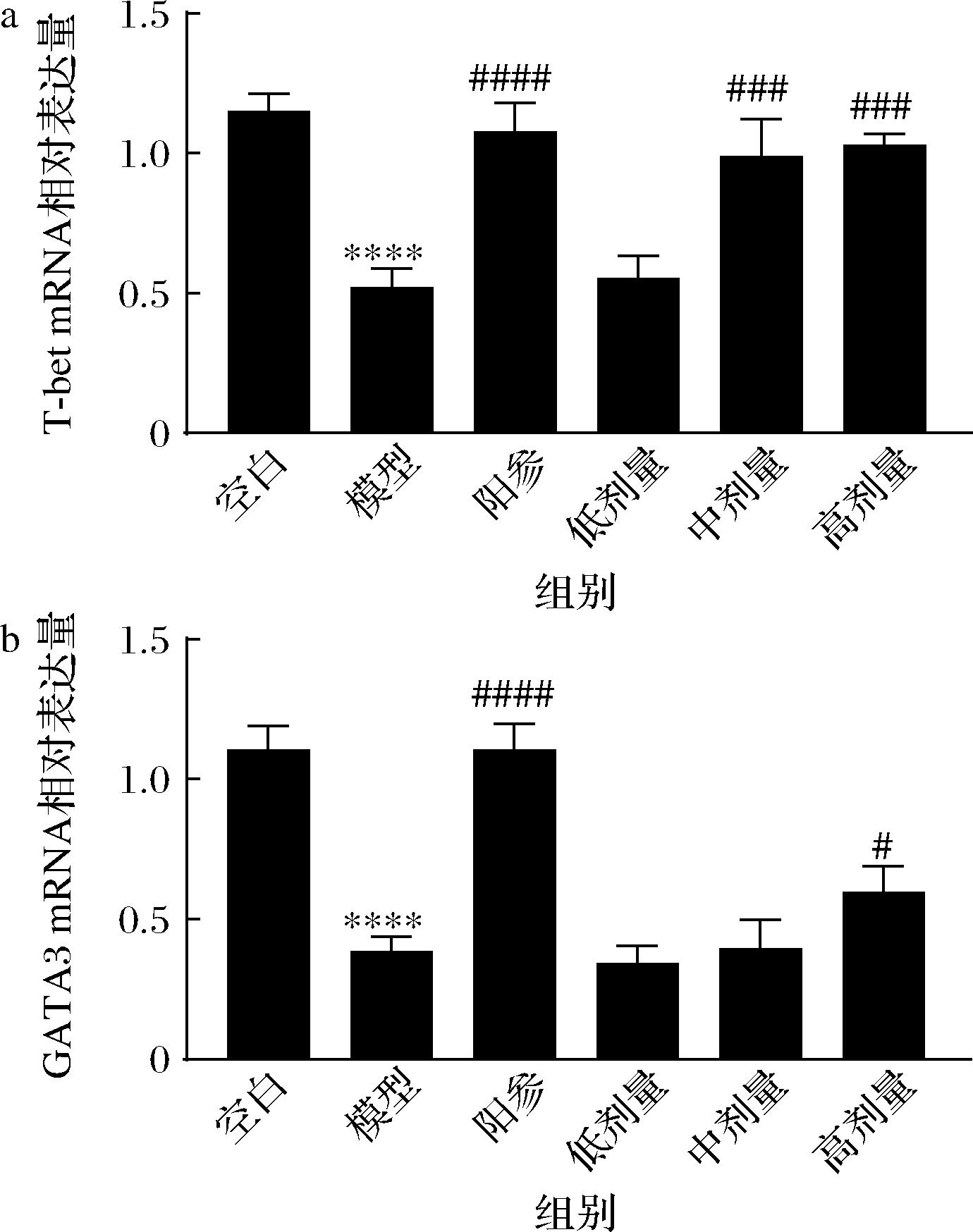
a-T-bet mRNA相对表达量;b-GATA3 mRNA相对表达量
图7 D-乳酸对免疫低下小鼠外周血淋巴细胞核转录 因子mRNA相对表达水平的影响
Fig.7 Effect of D-lactate on the relative mRNA expression levels of nuclear transcription factors in the peripheral blood lymphocytes of immunosuppressive mice
2.7 免疫细胞核转录因子表达
如图7所示,与空白组比较,模型组T-bet,GATA3 mRNA相对表达量均显著降低(P<0.000 1)。与模型组比较,阳参组的T-bet和GATA3 mRNA相对表达量显著升高(P<0.000 1),D-乳酸中高剂量组的T-bet mRNA相对表达量显著升高(P<0.001),只有D-乳酸高剂量组GATA3的mRNA相对表达量显著升高(P<0.05)。以上结果说明,D-乳酸可以部分恢复免疫低下小鼠的免疫细胞核转录因子表达水平。
2.8 血清细胞因子水平
如图8所示,与空白组相比,模型组小鼠血清中IL-2,IL-4,IgM质量浓度显著降低(P<0.001)。与模型组相比,阳参组IL-2,IL-4,IgM质量浓度显著增加(P<0.001),D-乳酸中剂量组(P<0.01)和高剂量组(P<0.001)的IL-2质量浓度显著升高,D-乳酸中高剂量组的IL-4质量浓度显著升高(P<0.05),D-乳酸高剂量组的IgM水平显著升高(P<0.05)。上述结果表明,D-乳酸可以改善免疫低下小鼠的血清细胞因子水平。
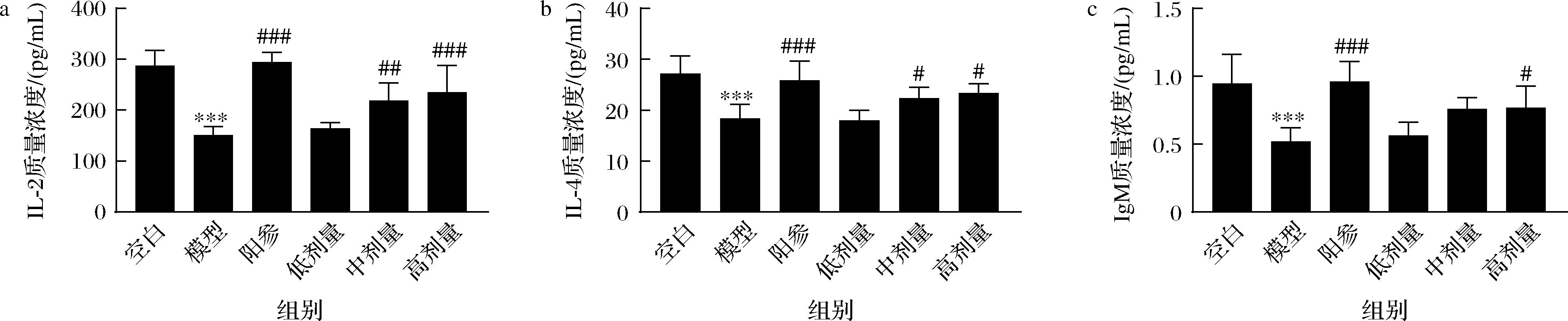
a-IL-2质量浓度;b-IL-4质量浓度;c-IgM质量浓度
图8 D-乳酸对免疫低下小鼠血清细胞因子水平的影响
Fig.8 Effect of D-lactate on the serum cytokine levels of immunosuppressive mice
3 讨论
环磷酰胺是一种广谱的化疗药物,通过代谢产物的交联作用来烷基化DNA和蛋白质,影响癌细胞增殖的能力。环磷酰胺在杀死肿瘤细胞的同时会对机体免疫系统产生毒副作用,影响免疫器官发育,导致体重减轻和骨髓抑制等[15]。骨髓抑制往往伴随着骨髓结构紊乱,血细胞数量减少、功能减弱,血清细胞因子分泌异常等现象,从而进一步削弱机体免疫能力[16]。
本文主要从D-乳酸改善骨髓抑制的角度,为缓解环磷酰胺所致的免疫低下寻求一种有效的策略。
酸奶通常含有约0.7%的D-乳酸,体质量80 kg成人的酸奶每日推荐摄入量为150~200 g,相当于给小鼠每日口服D-乳酸剂量为150 mg/kg[7]。本文探究了不同剂量的D-乳酸对环磷酰胺所致的免疫低下小鼠的免疫调节作用。结果显示,中高剂量D-乳酸治疗显著恢复了白细胞和淋巴细胞的数量,对红细胞和血红蛋白含量没有显著影响,这与徐光沛等[17]研究结果一致,表明D-乳酸在短期内并未对红细胞和血红蛋白含量产生显著影响,可能与红细胞的生长周期较长有关。因此,D-乳酸缓解环磷酰胺所致的骨髓抑制与白细胞数量的提高有关,在短期内与红细胞和血红蛋白含量可能没有直接关系。
淋巴细胞是白细胞的一种,T-bet和GATA3分别为辅助性T淋巴细胞(helper T cell,Th)1、Th2的特异性核转录因子,分别调控机体细胞免疫和体液免疫功能及相关细胞因子(IL-2, IL-4)的产生[18]。将小鼠外周血淋巴细胞分离提取作进一步研究,发现中高剂量的D-乳酸可以显著恢复淋巴细胞核转录因子T-bet的mRNA表达量,而只有高剂量的D-乳酸可以显著恢复核转录因子GATA3的mRNA表达量。因此,D-乳酸恢复骨髓抑制可能与促进T淋巴细胞向Th1分化有关,在提高细胞免疫功能方面具有显著的作用,这与迟发型变态反应实验结果恰好吻合。
本研究利用环磷酰胺建立免疫低下小鼠模型,从多个方面对D-乳酸缓解环磷酰胺所致的小鼠免疫低下进行初步研究,包括体质量、免疫脏器指数、迟发型变态反应程度、骨髓抑制等。结果表明,D-乳酸在免疫器官、免疫细胞和免疫活性分子等方面均显示出改善效果,在中高剂量下尤为显著,且不同剂量D-乳酸体现了改善免疫低下小鼠不同免疫指标的潜力。尽管本研究探索了D-乳酸对免疫低下的改善作用,但其调控机制需进一步探究。未来工作可采用流式细胞术、免疫磁珠等,分型鉴定免疫细胞,进一步探讨D-乳酸与其受体的关系,有助于更全面地了解D-乳酸在免疫功能调控中的作用途径以及其在免疫治疗中的潜在应用前景。
[1] MARTIN T D, PATEL R S, COOK D R, et al.The adaptive immune system is a major driver of selection for tumor suppressor gene inactivation[J].Science, 2021,373(6561):1327-1335.
[2] 孙思远, 周丽免, 姜云芸, 等.热灭活BBMN68常温酸奶对小鼠免疫和肠道菌群的调节功能研究[J].中国奶牛, 2023(10):42-47. SUN S Y, ZHOU L M, JIANG Y Y, et al.Effects of heat-treated bifidobacterium longum BBMN68 fortified pasteurized yogurt on modulating immunity and gut microbiota of mice[J].China Dairy Cattle, 2023(10):42-47.
[3] ASLAM H, MARX W, ROCKS T, et al.The effects of dairy and dairy derivatives on the gut microbiota:a systematic literature review[J].Gut Microbes, 2020,12(1):1799533.
[4] DANIEL N, NACHBAR R T, TRAN T, et al.Gut microbiota and fermentation-derived branched chain hydroxy acids mediate health benefits of yogurt consumption in obese mice[J].Nature Communications, 2022,13(1):1343.
[5] ADEVA-ANDANY M, L PEZ-OJÉN M, FUNCASTA-CALDER
PEZ-OJÉN M, FUNCASTA-CALDER N R, et al.Comprehensive review on lactate metabolism in human health[J].Mitochondrion, 2014,17:76-100.
N R, et al.Comprehensive review on lactate metabolism in human health[J].Mitochondrion, 2014,17:76-100.
[6] JIA B L, PU Z J, TANG K, et al.Catalytic, computational, and evolutionary analysis of the D-lactate dehydrogenases responsible for D-lactic acid production in lactic acid bacteria[J].Journal of Agricultural and Food Chemistry, 2018,66(31):8371-8381.
[7] YAN Y H, LI X, YANG Q, et al.Dietary D-lactate intake facilitates inflammatory resolution by modulating M1 macrophage polarization[J].Molecular Nutrition &Food Research, 2022,66(24):e2200196.
[8] LI X J, YAN Y H, DU X R, et al.Yogurt prevents colitis-associated colorectal cancer in mice[J].Molecular Nutrition &Food Research, 2023,67(24):e2300444.
[9] BAI R B, ZHANG Y J, FAN J M, et al.Immune-enhancement effects of oligosaccharides from Codonopsis pilosula on cyclophosphamide induced immunosuppression in mice[J].Food Function, 2020,11(4):3306-3315.
[10] YU F M, HE K, DONG X Z, et al.Immunomodulatory activity of low molecular-weight peptides from Nibea japonica skin in cyclophosphamide-induced immunosuppressed mice[J].Journal of Functional Foods, 2020,68:103888.
[11] BAO W R, ZHANG Q W, ZHENG H M, et al.Radix Astragali polysaccharide RAP directly protects hematopoietic stem cells from chemotherapy-induced myelosuppression by increasing FOS expression[J].International Journal of Biological Macromolecules, 2021,183:1715-1722.
[12] ZHANG D, TANG Z Y, HUANG H, et al.Metabolic regulation of gene expression by histone lactylation[J].Nature, 2019,574(7779):575-580.
[13] CHEN B L, YAN Y, YANG Y, et al.A pyroptosis nanotuner for cancer therapy[J].Nature Nanotechnology, 2022,17(7):788-798.
[14] CHENG H, CHEN X, SHENG Y, et al.Perovskite-derived pro-photosensitizer enables sustainable photodynamic therapy in hypoxia tumors[J].Chemical Engineering Journal, 2023,468:143457.
[15] 李睿珺, 秦勇, 周雅琳, 等.鹰嘴豆肽对免疫低下小鼠免疫功能的影响[J].食品科学, 2020,41(21):133-139. LI R J, QIN Y, ZHOU Y L, et al.Effect of Chickpea peptide on immune function of immunocompromised mice[J].Food Science, 2020,41(21):133-139.
[16] 王雨, 晏群, 田艳, 等.五红汤对环磷酰胺所致免疫低下小鼠免疫功能的影响[J].中医药学报, 2023,51(3):30-34. WANG Y, YAN Q, TIAN Y, et al.Effect of Wuhong Decoction on immune function of immunocompromised mice induced by CTX[J].Acta Chinese Medicine and Pharmacology, 2023,51(3):30-34.
[17] 徐光沛, 李涵涛, 邓奇元, 等.环磷酰胺对小鼠血常规、血液生化指标的影响及构树叶多糖的干预作用[J].安徽科技学院学报, 2023,37(3):76-82. XU G P, LI H T, DENG Q Y, et al.Effects of cyclophosphamide on routine blood and blood biochemical indices in mice and interventional effects of Broussonetia papyrifera polysaccharides[J].Journal of Anhui Science and Technology University, 2023,37(3):76-82.
[18] ZHONG W H, HUANG H, YANG Z X, et al.rhCNB improves cyclophosphamide-induced immunodeficiency in BALB/c mice[J].Evidence-Based Complementary and Alternative Medicine, 2022,2022:4891399.