氧化应激是指机体内氧化与抗氧化系统不平衡引起的一种损伤状态,从而导致活性氧(reactive oxygen species,ROS)增多[1]。机体在氧化应激状态下可引起炎症反应、细胞凋亡、自噬和神经元功能障碍,这与阿尔茨海默病(Alzheimer disease,AD)、帕金森病(Parkinson′s disease,PD)和亨廷顿氏病(Huntington′s disease,HD)等神经退行性疾病(neurodegeneration disease,NDD)密切相关[2]。机体在受到外部有害刺激H2O2作用时,ROS的产生增多,并且细胞氧化还原稳态遭到破坏时,抗氧化酶如还原型谷胱甘肽(glutathione,GSH)、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)等活性降低[3],而丙二醛(malondialdehyde,MDA)含量激增[4],过度积累的MDA将间接导致凋亡蛋白的过表达从而引发细胞凋亡。
细胞内ROS水平增加能够激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)介导的信号通路,进一步起到改变细胞增殖、分化、凋亡等多种作用[5]。ROS也可以激活c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)信号通路,其活性通常参与细胞凋亡的进展,JNK的活化可以导致半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)活化和基因表达,也会增加Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)与B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)的比值,导致神经元死亡[6]。此外有研究表明ROS的积累会导致机体内的核因子E-2-相关因子(nuclear factor erythroid-2-related factor 2,Nrf2)的表达水平降低[7],Nrf2是一种转录因子,可调节基因稳定性和转录活性,当机体遭受氧化损伤时Nrf2易位到细胞核,增强下游基因的转录水平从而达到一定的抗氧化效果[8]。因此有效激活MAPK、JNK、Nrf2等信号通路有助于研究一些天然抗氧化物的作用机制。天然产物一直是治疗NDD的新药的主要来源,在近年的研究中近90%来源于天然化合物[9],如灯盏花素[10]、姜黄素[11]、人参皂苷[12]、黄芩素[13]可以抑制细胞内ROS的积累,提高抗氧化酶活性。目前许多研究表明饮食中添加一些天然抗氧化产物可以有效维持机体内抗氧化平衡[14],因此开发一些具有抗氧化活性的具有药食同源的功能性食品并阐明其作用机制具有十分重要的意义。
桑葚(Fructus mori)属于桑科属植物的果穗,又名桑果[15],是一种药食同源的食品[16],其不仅含有多种营养成分,如维生素、有机酸、胡萝卜素、矿物质等,同时也富含花青素和酚类等化学成分[17]。花青素是一种天然色素,属于二苯基色原酮类成分,对肿瘤、炎症、心脑血管疾病等多种疾病具有预防和治疗作用[18]。此外花青素具有很强的抗氧化活性,可以通过抵抗细胞内的氧化应激水平从而对对神经细胞起到保护作用[19],从而有效预防和改善神经退行性疾病。矢车菊素类衍生物是桑葚中花色苷的主要存在形式,其主要成分是矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)和矢车菊素-3-O-芸香糖苷(cyanidin-3-O-rutinoside,C3R)[20]。C3G可以保护细胞免受氧化损伤、抑制结直肠癌细胞的增殖以及改善糖脂代谢障碍[21-23],C3R具有抵抗链脲佐菌素 (streptozotocin,STZ)诱导胰岛β细胞凋亡的作用[24]。虽然已有研究证明,桑葚花色苷具有显著的神经保护作用,但是其物质基础和相关作用机制尚不明确。基于此,本论文通过H2O2诱导建立大鼠肾上腺嗜铬细胞瘤细胞(PC12细胞)氧化损伤模型来考察桑葚花青素中的2个主要单体化合物的C3G和C3R对H2O2诱导的氧化损伤保护作用及其潜在机制,从而为桑葚花色苷的神经保护作用的研究提供一定科学依据。
1 材料与方法
1.1 材料与试剂
C3G、C3R由实验室自制,纯度均在90%以上,结构如图1所示。
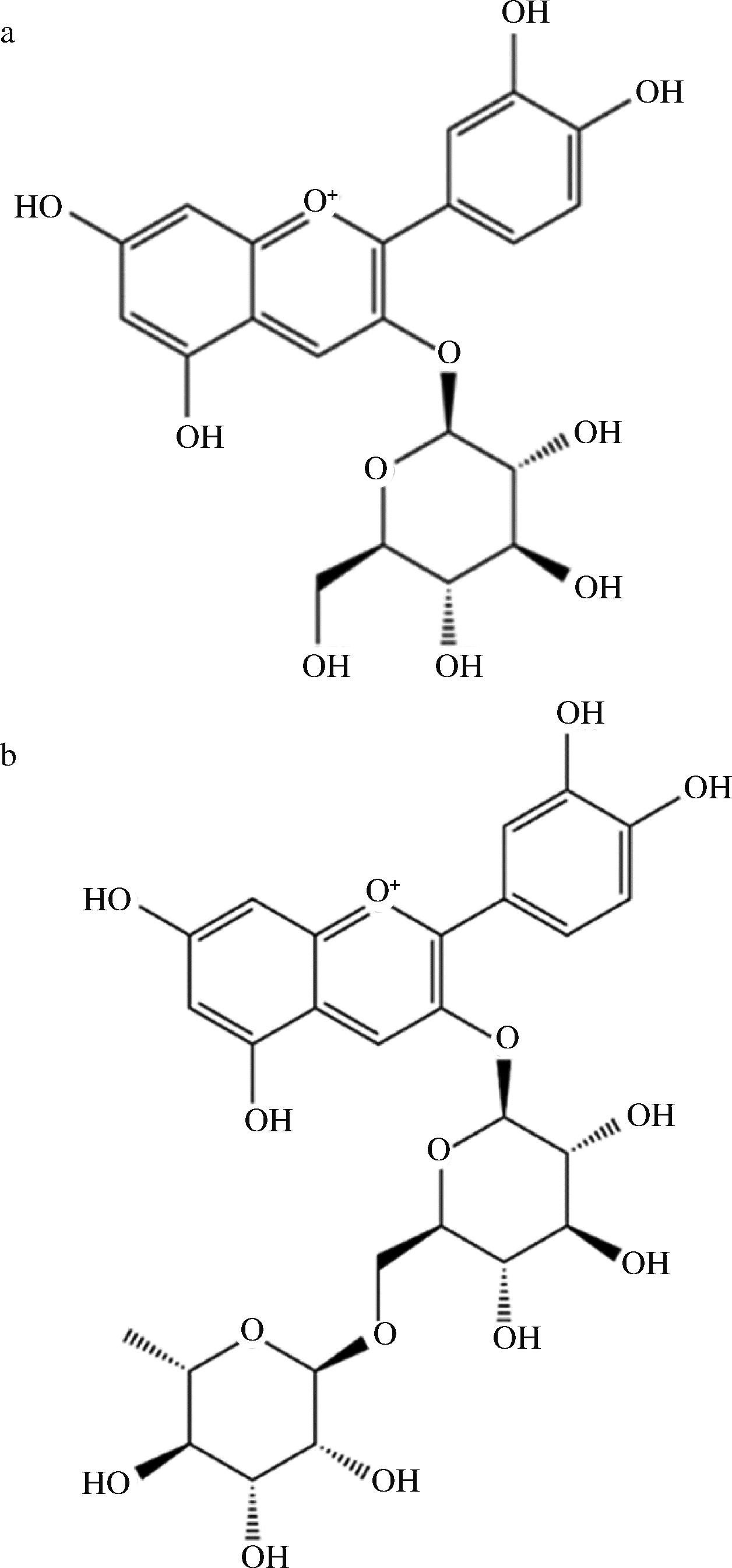
a-C3G;b-C3R
图1 C3G和C3R的结构式
Fig.1 Structural formula of C3G and C3R
PC12细胞株,中国科学院上海细胞库;噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT),北京索莱宝科技有限公司;DCFH-DA荧光染料,美国Sigma公司;SOD、GSH检测试剂盒,南京建成生物工程研究所;MDA、CAT检测试剂盒,上海碧云天生物技术有限公司;JNK、细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK1/2)、Nrf2、血红素加氧酶1(heme oxygenase-1,HO-1)抗体、半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)、Bax,美国CST公司;兔二抗,武汉三鹰生物科技有限公司。
1.2 仪器与设备
酶标仪,美国BioTek公司;激光共聚焦显微镜,德国Leica公司;Tanon 5200化学发光成像系,上海天能科技有限公司;电泳仪,美国Bio-rad公司。
1.3 实验方法
1.3.1 C3G、C3R溶液制备
将冷冻干燥后的C3G、C3R粉末用二甲基亚砜(dimethyl sulfoxide,DMSO)配制成100 mmol/L储备液,使用时用含各种氨基酸和葡萄糖的培养基(dulbecco′s modified eagle medium,DMEM)稀释1 000倍得到浓度为100 μmol/L C3G、C3R溶液,随后进行等比稀释即可。
1.3.2 细胞培养与传代
将PC12细胞接种在高糖DMEM培养基[10%胎牛血清 (fetal bovine serum,FBS)]中,然后置于二氧化碳培养箱培养,细胞融合度达到80%左右时将原代细胞按1∶4分种传代培养。
1.3.3 H2O2诱导的细胞氧化损伤模型建立
实验每组设置6个复孔,细胞在96孔板培养24 h后,加入用DMEM培养基配制的10个不同浓度(0、50、100、200、400、500、600、700、800、1 000 μmol/L)的H2O2溶液,继续培养12 h;随后弃掉培养基,然后每孔加入100 μL DMEM和10 μL MTT,孵育4 h,弃掉上清液,各孔中加入100 μL DMSO,37 ℃振荡10 min,490 nm处测量吸光度值,并根据公式(1)计算存活率:
细胞存活率![]()
(1)
1.3.4 检测H2O2及C3G、C3R对细胞活力影响
细胞于96孔板培养24 h后,加入用DMEM配制好的不同浓度的(0、1、2、5、10、25、50、100 μmol/L)含有或不含有H2O2的C3G和C3R溶液,培养12 h;弃掉培养基,然后每孔加入100 μL DMEM和10 μL MTT,孵育4 h,弃去上清液,各孔中加入100 μL DMSO,37 ℃振荡10 min,490 nm处测量吸光度值,并根据公式(1)计算存活率。
1.3.5 C3G、C3R对H2O2诱导PC12细胞内ROS含量测定
细胞于24孔板中培养24 h后,每孔加入不同浓度(25、50、100 μmol/L)且含有650 μmol/L H2O2的C3G、C3R干预12 h后,吸走培养基,每孔加入10 μmol/L的DCFH-DA探针孵育30 min,孵育结束后用PBS清洗3次,利用激光共聚焦显微镜进行拍照(激发波长Ex:504 nm、发射波长Em:529 nm)。
1.3.6 C3G、C3R对H2O2诱导PC12细胞内MDA含量以及抗氧化酶活性的影响
细胞接种于6孔板中培养24 h后,每孔加入不同浓度(25、50、100 μmol/L)且含有650 μmol/L H2O2的C3G、C3R干预12 h后进行MDA、GSH、CAT、SOD生化指标测定并计算MDA含量以及抗氧化酶(SOD、GSH、CAT)的含量,计算如公式(2)~公式(5)所示:
细胞MDA含量(nmol/mg蛋白)![]()
(2)
细胞GSH活性(U/mg蛋白)=
(3)
细胞过氧化氢酶活性(U/mg蛋白)=
(4)
细胞SOD活性(U/mg蛋白)=
(5)
1.3.7 C3G、C3R对H2O2诱导PC12细胞内抗氧化及凋亡蛋白表达量的影响
细胞接种于6孔板中培养24 h后,每孔加入不同浓度(25、50、100 μmol/L)且含有650 μmol/L H2O2的C3G、C3R干预12 h,随后加入细胞裂解液裂解15 min后进行蛋白提取。蛋白定量变性后,进行电泳分离,随后在冰浴下将蛋白转至聚偏二氟乙烯(polyvinylidene difluoride,PVDF)膜上,5%脱脂牛奶封闭1 h,随后加入对应一抗(JNK、p-JNK、ERK1/2、p-ERK1/2、Tubulin、Nrf2、HO-1、Cleaved-Caspase-3、Caspase-3、Bax),4 ℃条件下孵育过夜,次日用1∶3 000稀释的辣根过氧化物酶(horse radish peroxidase,HRP)标记的二抗孵育1 h,随后进行化学发光显影。
1.4 数据处理
Westerm Blot以及荧光照片数据采用Image J软件进行处理,采用GraphPad Prism 8.0统计软件进行统计学分析。数据用平均数±标准差(x±s)表示,各组均数之间采用单因素方差分析(one-way ANOVA),P<0.05认为差异具有统计学意义。
2 结果与分析
2.1 不同浓度C3G、C3R对细胞活力的影响
不同浓度的C3G、C3R作用PC12细胞12 h后,在1~100 μmol/L内对PC12细胞活力均在90%以上(图2),说明C3G、C3R对细胞存活率没有显著影响。
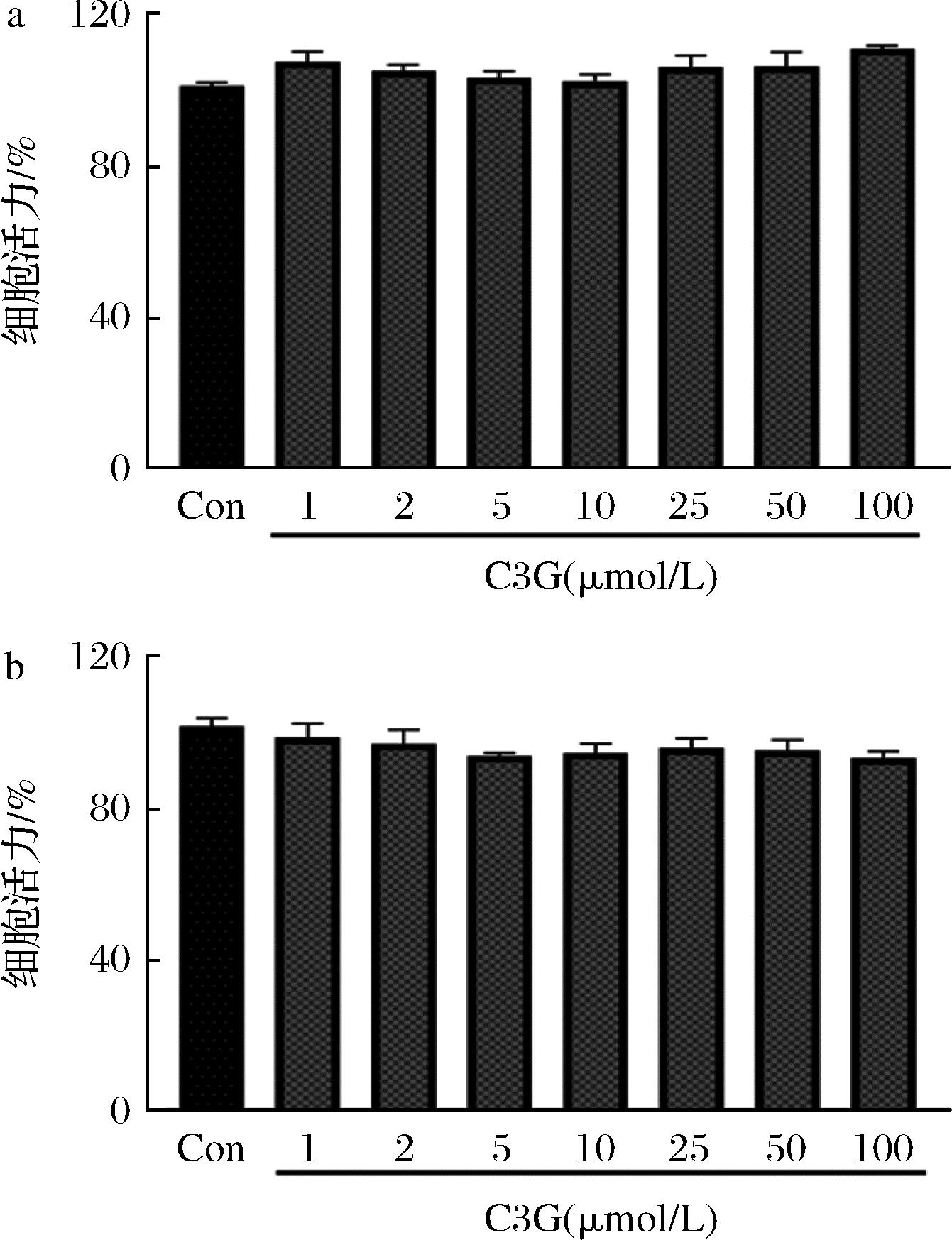
a-C3G;b-C3R
图2 不同浓度C3G、C3R对细胞活力的影响
Fig.2 Effect of different concentrations of C3G and C3R on cell viability
注:Con表示正常组(下同)。
2.2 PC12细胞氧化损伤模型建立
用不同浓度的H2O2刺激PC12细胞12 h后,结果如图3所示,细胞活力随着H2O2浓度的升高呈现下降的趋势,当浓度在100 μmol/L时细胞活力急剧下降,细胞存活数量较少,而在650 μmol/L的浓度时细胞存活率由99.99%降至45.53%(P<0.01),因此最终选择实验H2O2浓度为650 μmol/L。
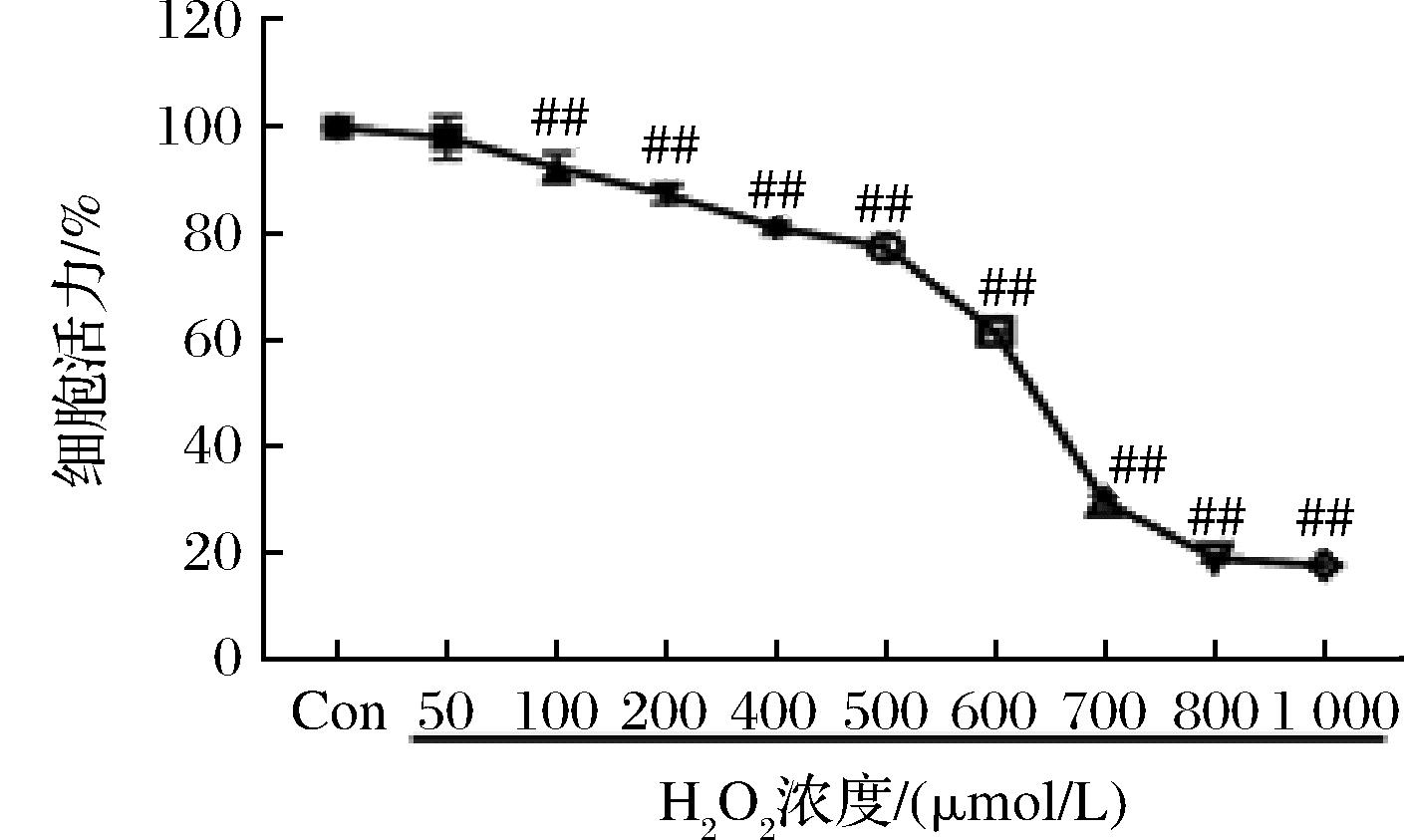
图3 不同浓度H2O2对细胞活力的影响
Fig.3 The effect on cell viability of different concentrations for H2O2
注:与正常组比,#P<0.05,##P<0.01(下同)。
2.3 C3G、C3R对H2O2损伤PC12细胞活力的影响
细胞存活率能够直接反映外界刺激对细胞的影响,而细胞内氧化应激水平的上升可以进一步诱导细胞凋亡。如图4所示,与正常组相比,H2O2组细胞活力下降至50%~60%。与H2O2组相比,1~25 μmol/L的C3G、C3R处理后,细胞活力没有明显提高。而50、100 μmol/L C3G、C3R能够显著提高细胞活力。细胞活力是衡量细胞氧化损伤的标志之一,细胞活力升高,细胞氧化损伤程度降低,说明C3G、C3R对细胞具有一定的保护作用,能够缓解PC12细胞的氧化损伤。
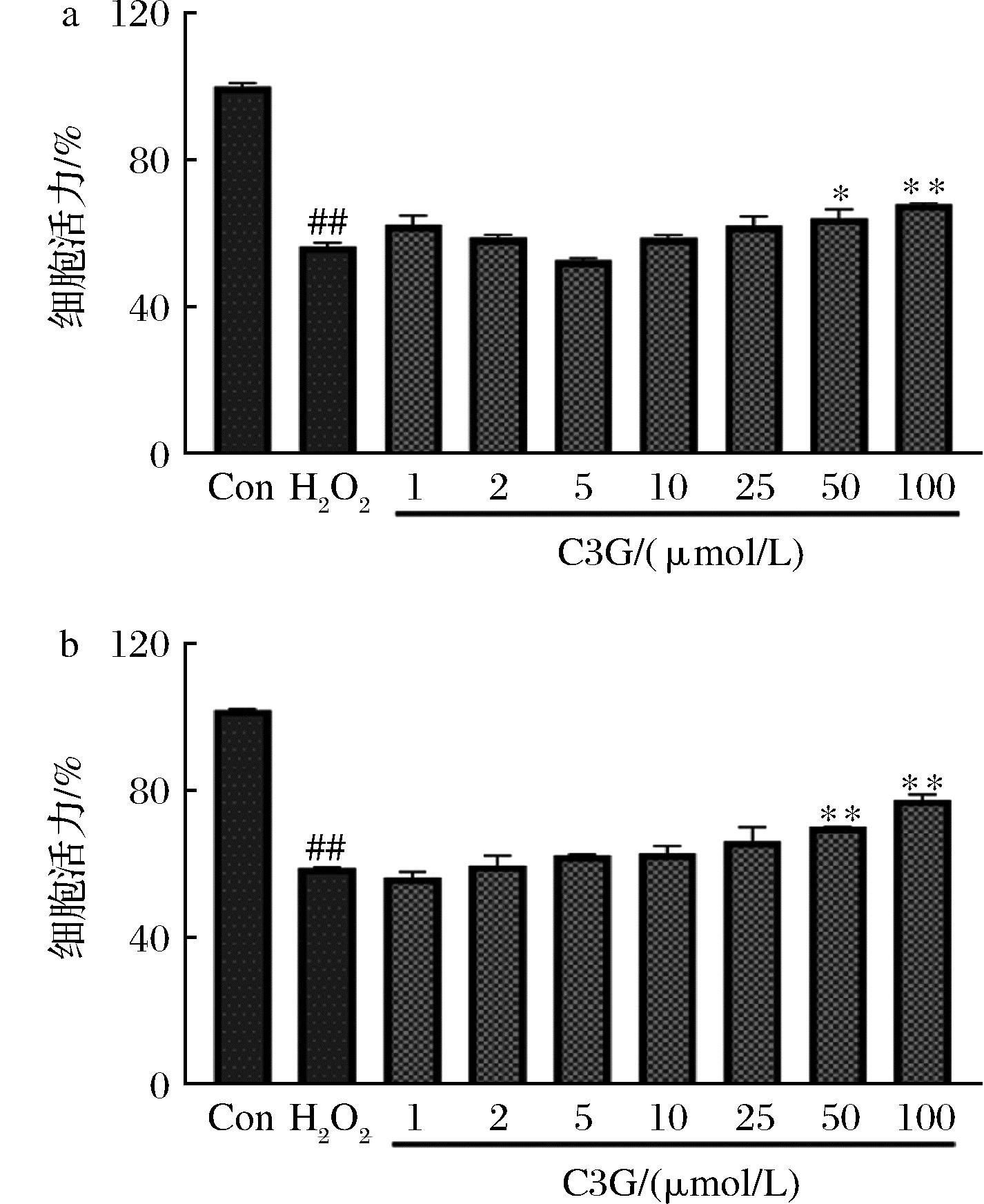
a-C3G;b-C3R
图4 C3G、C3R对H2O2损伤PC12细胞活力的影响
Fig.4 The effect on the viability of C3G and C3R for PC12 cells injured by H2O2
注:与H2O2组,相比*P<0.05,**P<0.01(下同)。
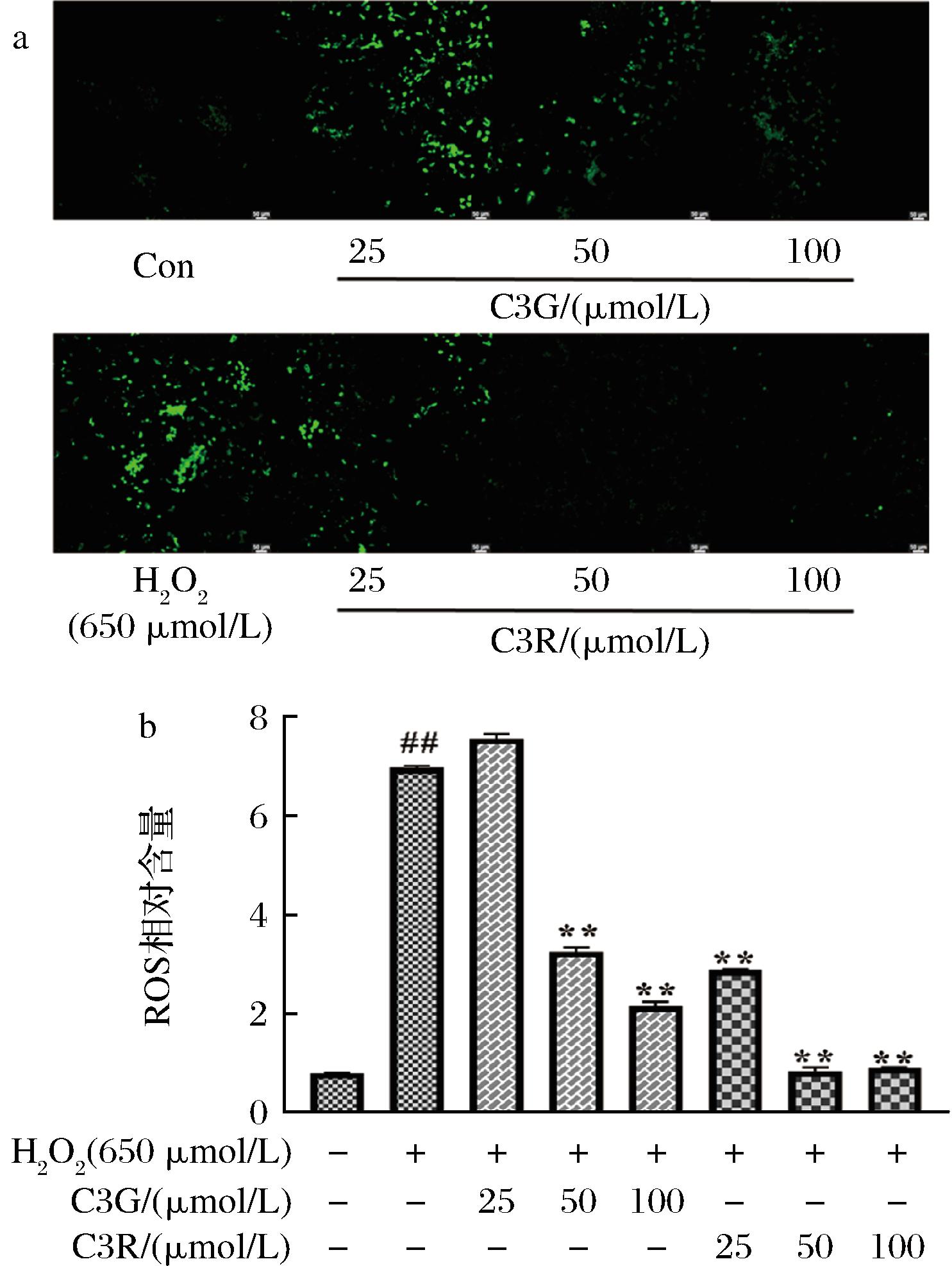
a-ROS荧光照片(200×);b-ROS定量分析图
图5 C3G、C3R对H2O2损伤的PC12细胞中ROS的影响
Fig.5 Effect of C3G and C3R on ROS production in H2O2-injured PC12 cells
2.4 C3G、C3R对H2O2损伤的PC12细胞中ROS含量影响
ROS包括羟自由基、单线态氧和超氧阴离子等,在正常生理状态下,ROS的产生和清除处于动态平衡过程,机体在受到外部刺激时,体内有大量ROS产生,对细胞膜等造成一定的损伤,进而加剧细胞凋亡。细胞孵育DCFH-DA探针后,利用共聚焦荧光显微镜进行拍照。结果如图5所示,与正常组相比,H2O2损伤后绿色荧光强度显著上升(P<0.01),表明细胞内的ROS的含量明显增加,说明细胞氧化损伤模型进一步建立成功。50、100 μmol/L浓度的C3G、C3R能够显著降低细胞内ROS的产生(P<0.01),有利于维持细胞内部的稳态,保护细胞膜、蛋白质、核酸等免受氧化损伤从而减少细胞凋亡,因此C3G、C3R可能通过降低ROS含量来减轻细胞膜以及胞内物质的氧化损伤,进一步发挥抗氧化作用。
2.5 C3G、C3R对H2O2损伤PC12细胞MDA含量和抗氧化酶的影响
机体自身存在两大抗氧化体系(酶抗氧化体系和非酶抗氧化体系)来共同抵御外界氧化应激,机体在受到强烈的氧化损伤时,抗氧化体系无法维持稳定,细胞膜上的不饱和脂肪酸发生过氧化,MDA不断积累,MDA可以反映细胞受氧化损伤的程度;当机体受到外部刺激时,自身的酶抗氧化体系也会发生改变,机体自身的抗氧化酶如GSH、SOD、CAT等能够直接反映机体抵抗氧化应激水平的程度。如图6所示,与正常组相比,H2O2损伤后MDA的含量增加,神经细胞被损伤(P<0.01),经C3G、C3R处理后,低浓度的C3G、C3R能显著降低MDA水平,且C3G、C3R浓度越大,效果越明显(P<0.01)。此外与正常组相比,H2O2损伤组的SOD活性显著下降(P<0.01),C3R在50 μmol/L及以上浓度时能够提高SOD活性(P<0.05),且呈现剂量依赖性;H2O2损伤后GSH和CAT活性也呈现下降的趋势(P<0.01),C3G、C3R浓度大于50 μmol/L时,GSH和CAT活性均有所升高(P<0.05)。结果表明H2O2破坏PC12细胞的氧化还原水平,降低细胞内抗氧化酶的活力,使得PC12细胞内氧化动态失衡并产生大量MDA,导致细胞发生不可逆的氧化损伤,以上结果可以进一步说明细胞氧化损伤模型构建成功。而经过C3G、C3R处理后,可以显著提高胞内抗氧化酶的活性,降低胞内MDA水平,使PC12细胞很大程度上缓解H2O2所造成的氧化损伤,同时能提高机体对抗外部氧化应激的调控能力。该结果与C3G、C3R能够抑制H2O2所引起的细胞存活力降低和ROS水平增加的结果一致。
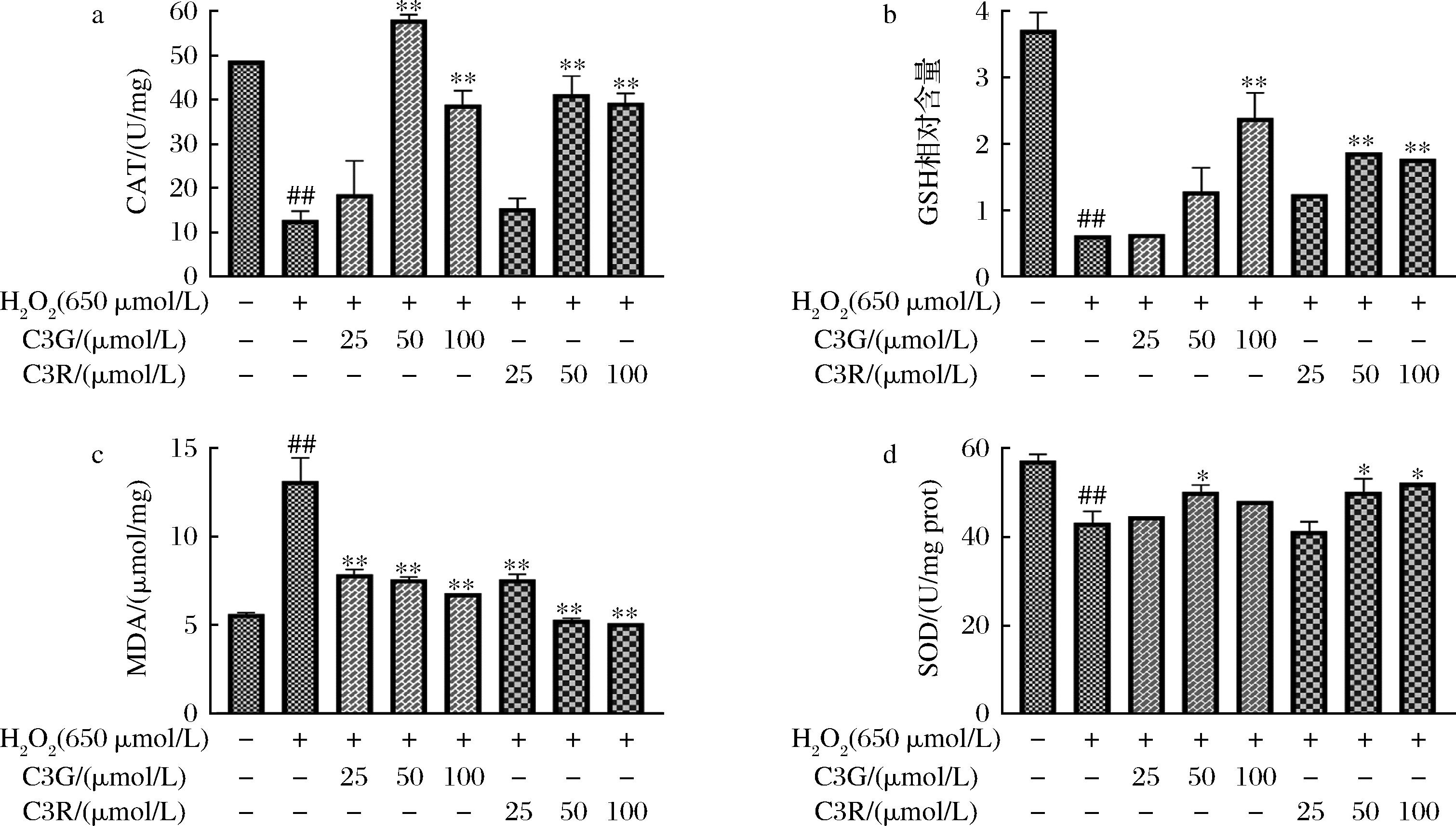
a-CAT;b-GSH;c-MDA;d-SOD
图6 C3G、C3R对H2O2损伤PC12细胞MDA含量以及抗氧化酶的影响
Fig.6 Effects of C3G and C3R on MDA content and antioxidant enzymes in PC12 cells induced by H2O2
2.6 C3G、C3R对H2O2损伤的PC12细胞中JNK,ERK1/2蛋白表达的影响
ERK、JNK是MAPK家族中的主要成员,ERK主要调节细胞的增殖与分化,在神经系统中还会对突触与学习记忆的形成起到重要作用;JNK主要在细胞增殖,凋亡等过程中发挥重要作用。结果如图7所示,H2O2刺激后PC12细胞中JNK和ERK1/2磷酸化的水平增加(P<0.01),经过化合物处理后发现50 μmol/L及其以上浓度的C3G、C3R能显著抑制p-JNK/JNK和p-ERK1/2与ERK1/2比值的增加(P<0.01),且随着C3G、C3R浓度的增加,抑制效果越显著。JNK在调控神经细胞凋亡方面有着重要作用,JNK磷酸化水平的增加可以刺激下游凋亡蛋白的过量表达,从而加速细胞凋亡,结果说明C3G、C3R可能通过调控JNK的水平来减少细胞凋亡从而提高细胞抵抗氧化应激的能力。
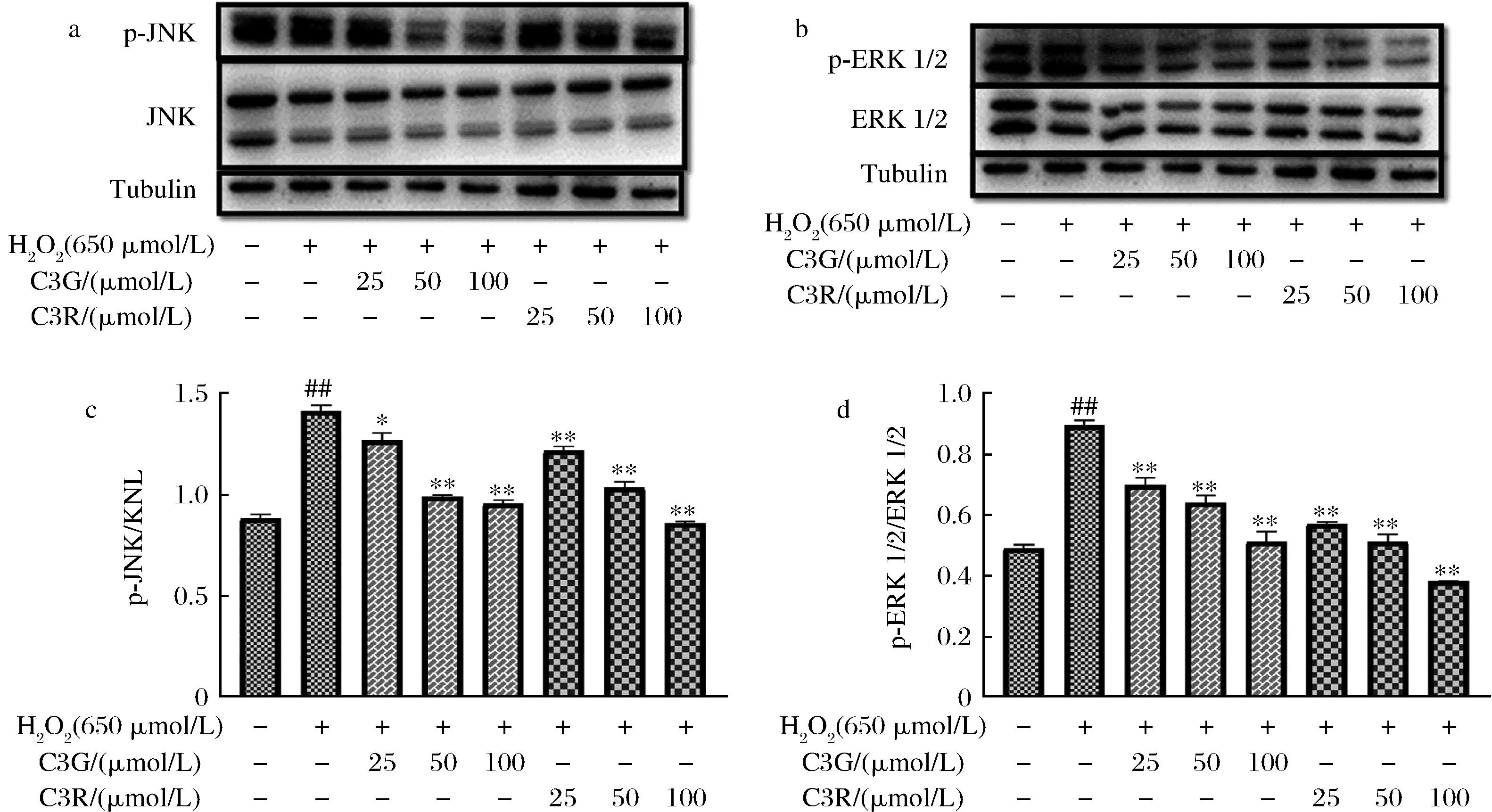
a-JNK蛋白免疫印迹图;b-ERK蛋白免疫印迹图;c-JNK蛋白定量分析;d-ERK蛋白定量分析
图7 C3G、C3R对H2O2损伤的PC12细胞中JNK,ERK1/2蛋白表达的影响
Fig.7 Effect of C3G and C3R on JNK, ERK1/2 protein expression in PC12 cells injured by H2O2
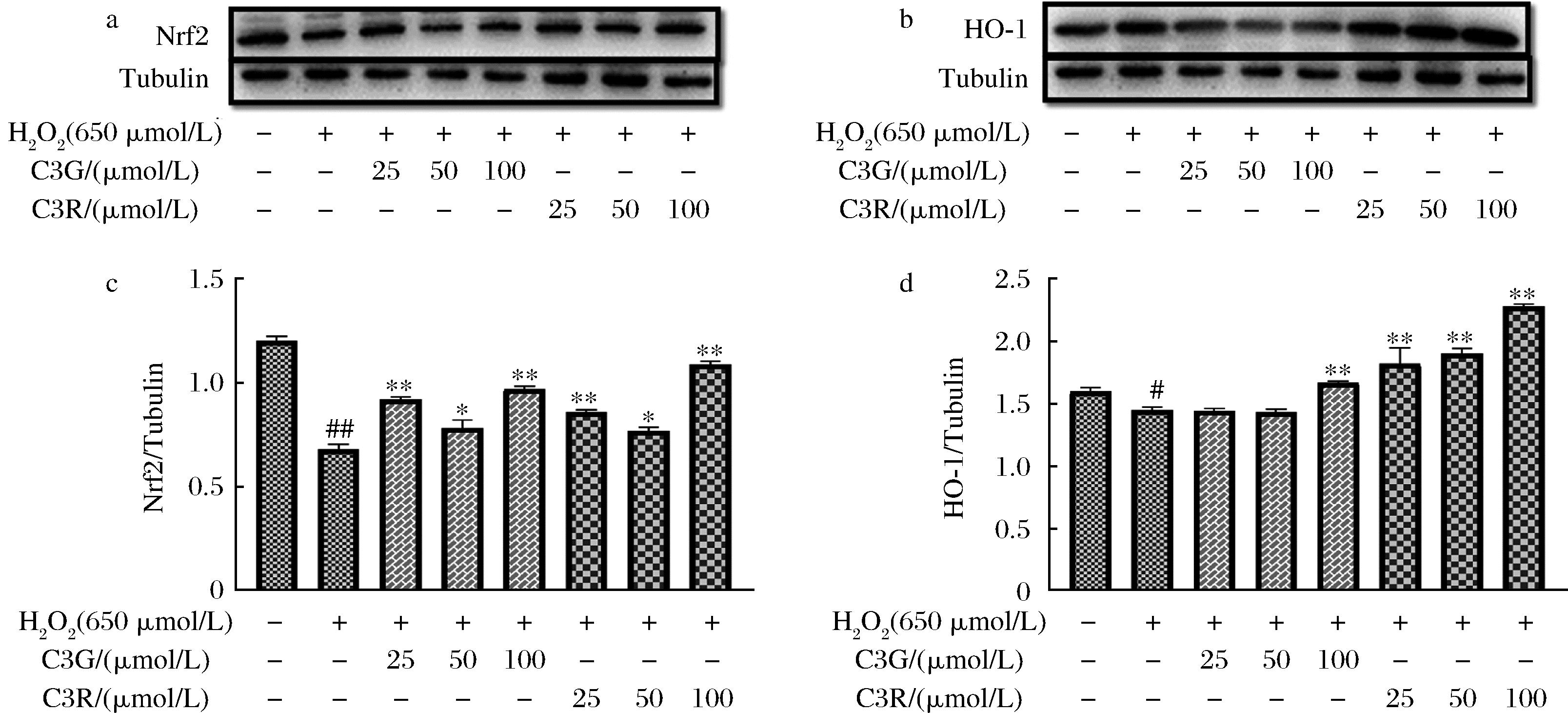
a-Nrf2蛋白免疫印迹图;b-HO-1蛋白免疫印迹图;c-Nrf2蛋白定量分析;d-HO-1蛋白定量分析
图8 C3G、C3R对H2O2损伤的PC12细胞中Nrf2/HO-1通路蛋白表达的影响
Fig.8 Effects of C3G and C3R on Nrf2/HO-1 pathway protein expression in H2O2-injured PC12 cells
2.7 C3G、C3R对H2O2损伤的PC12细胞中Nrf2/HO-1通路蛋白表达的影响
Nrf2/HO-1通路在AD等神经退行性疾病中发挥重要作用,其机制与减少神经元凋亡、降低炎性因子水平和减轻氧化应激损伤相关。Nrf2已经被证实可以调节细胞氧化还原稳态和细胞自我保护,这与神经退行性疾病密切相关,可作为重要靶点。在正常情况下,Nrf2水平在细胞核中较低,在氧化应激下,ROS可以增加细胞核中Nrf2水平,细胞质中Nrf2的减少可引起线粒体功能障碍,进一步导致细胞凋亡。实验结果如图8所示,PC12细胞H2O2刺激后,Nrf2和HO-1蛋白表达量显著下降(P<0.01),其激活的抗氧化信号通路受阻,而C3G、C3R作用后明显上调了Nrf2蛋白的表达,其下游蛋白HO-1的表达水平也随之上升(P<0.05),且浓度越高恢复效果越好。Nrf2的激活可以促进下游抗氧化因子的表达,HO-1主要催化血红素分解代谢成亚铁、一氧化碳和胆绿素,是一种重要的抗氧化酶,其中胆绿素还具有ROS清除活性,可以抵御过氧化物和自由基。此外有研究发现Nrf2还可以激活机体内的抗氧化酶(CAT、SOD、GSH)来起到抵御氧化应激作用。综上表明C3G、C3R可能通过激活Nrf2的表达从而增加HO-1蛋白的表达以及抗氧化酶的活性从而发挥抗氧化作用。
2.8 C3G、C3R对H2O2损伤的PC12细胞中Caspase-3及Bax表达的影响
NDD患者通常伴随着大脑中神经元的丧失,特别是在海马体中,很大一部分是由细胞凋亡引起的,而线粒体作为凋亡途径中的关键途径,上游连接凋亡蛋白的表达,下游执行死亡命令。大量研究表明H2O2可以产生过量的ROS进入线粒体,破坏线粒体电子传递系统,以激活“内源性凋亡”或线粒体凋亡途径,从而导致更多的ROS产生,Caspase家族蛋白和Bax蛋白是细胞凋亡机制中必不可少的蛋白,活化后的Caspase-3蛋白可以直接反映细胞的凋亡水平,Bax是Caspase-3的上游蛋白,其过量表达可以激活Caspase-3的表达,最终诱导细胞凋亡。实验结果如图9所示,H2O2刺激后Cleaved-Caspase-3以及Bax的表达量均呈现上升的趋势(P<0.01),细胞凋亡水平增加,能够说明外源性的刺激导致细胞发生氧化损伤,从而加剧细胞凋亡,提示细胞模型建立成功,此外C3G、C3R处理以后能够明显抑制细胞凋亡蛋白的表达,且在较高浓度时呈现良好的抗凋亡效果(P<0.01),进一步说明C3G、C3R可通过协助细胞抵御氧化应激对线粒体的损伤,降低细胞氧化损伤和提高机体抗氧化应激的调控能力,最终达到缓解细胞凋亡的结果。
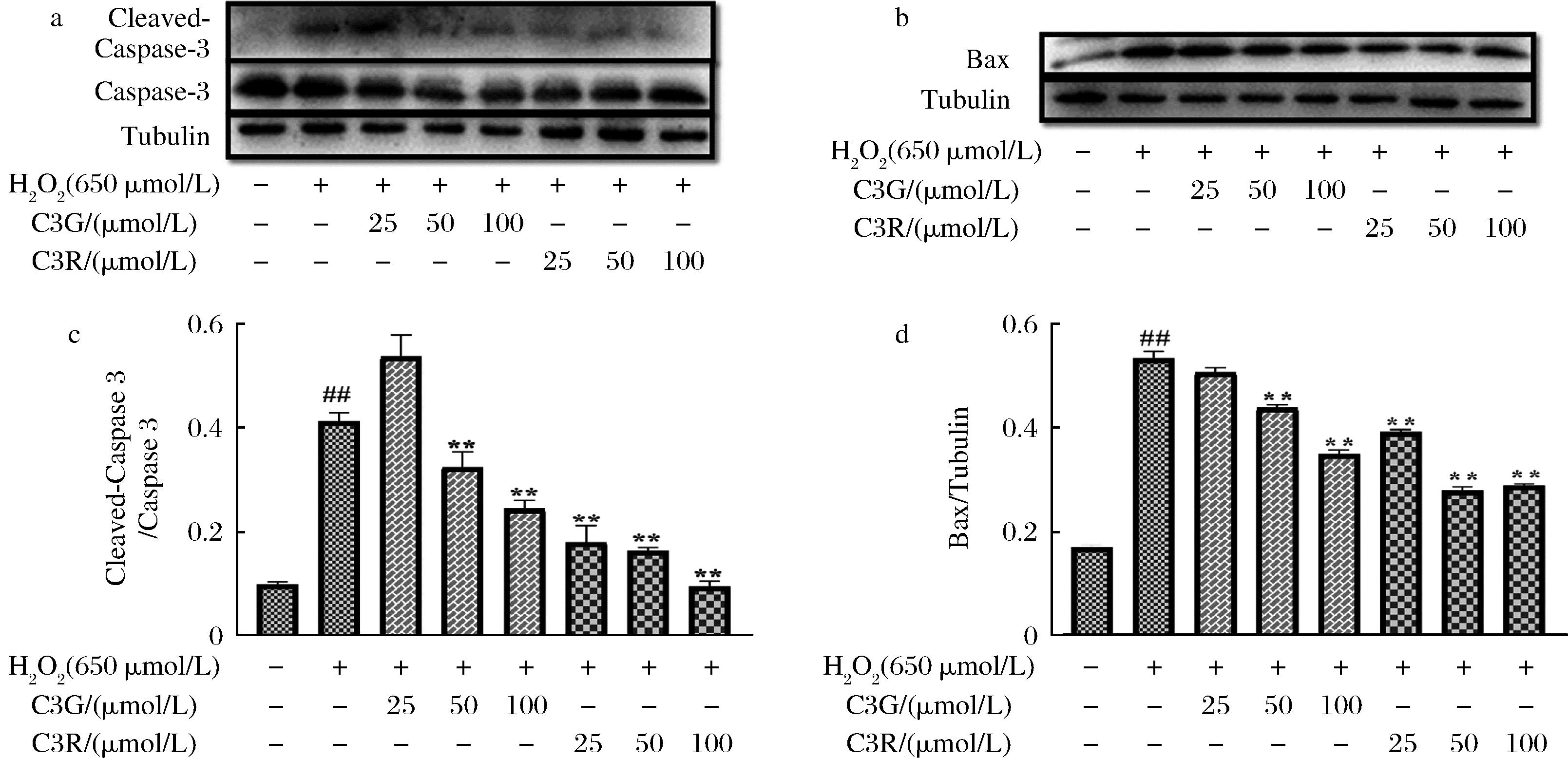
a-Caspase-3蛋白免疫印迹图;b-Bax蛋白免疫印迹图;c-Caspase-3蛋白定量分析;d-Bax蛋白定量分析图
图9 C3G、C3R对H2O2损伤的PC12细胞中凋亡蛋白表达的影响
Fig.9 Effects of C3G and C3R on the expression of apoptotic proteins in PC12 cells injured by H2O2
3 结论与讨论
本研究主要以桑葚中2种主要的花色苷为研究对象,用H2O2诱导PC12细胞12 h构建神经细胞氧化损伤模型,分别从细胞活力、ROS含量、MDA的水平,抗氧化酶SOD、GSH和CAT的活性、抗氧化蛋白以及凋亡蛋白等方面来探讨其保护作用机制。研究发现C3G、C3R处理后,能够显著增加氧化损伤的PC12细胞内抗氧化酶和Nrf2的抗氧化活性,抑制JNK的磷酸化以及有害物质MDA水平,降低Bax、Cleaved-Caspase-3蛋白表达量,有效预防和逆转了细胞凋亡。此外C3G、C3R在结构性质上存在差异,一方面C3R所带有的芸香糖苷的—OH数目要多于C3G所带有的葡萄糖苷,另一方面C3R所带的芸香糖苷属于二糖,极性大于C3G带有的葡萄糖苷,这都是C3R抗氧化效果优于C3R的重要因素。
综上,C3G、C3R改善H2O2诱导的PC12细胞氧化损伤,其保护作用可能是C3G、C3R通过调控Nrf2/JNK信号通路来减轻H2O2诱导的PC12细胞氧化损伤和凋亡(图10),但这种抗氧化保护作用的具体分子生物学机制及其在体内的抗氧化机制还有待进一步的深入研究,另外该结果还暗示着C3G、C3R可能是预防NDD的一个有前景的候选天然药物。
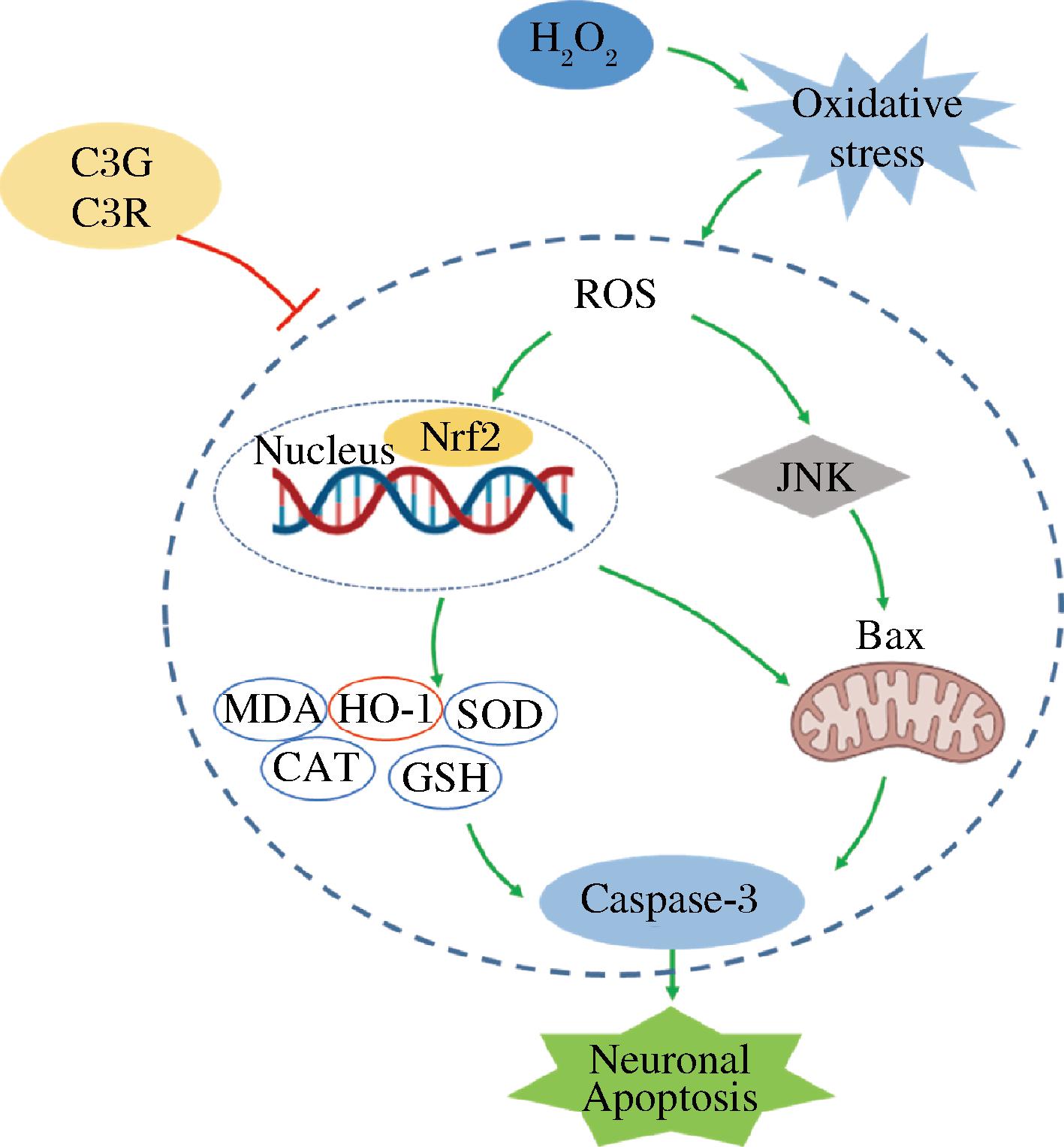
图10 C3G、C3R对PC12细胞保护作用信号通路图
Fig.10 Signal pathway diagram of protective effect of C3G and C3R on PC12 cells
注:Oxidative stress:氧化应激;Nucleus:细胞核; Neuronal Apoptosis:神经元凋亡。
[1] WAN T, WANG Z H, LUO Y, et al. FA-97, a new synthetic caffeic acid phenethyl ester derivative, protects against oxidative stress-mediated neuronal cell apoptosis and scopolamine-induced cognitive impairment by activating Nrf2/HO-1 signaling[J]. Oxidative Medicine and Cellular Longevity, 2019, 2019:8239642.
[2] CHIU Y J, HSIEH Y H, LIN T H, et al. Novel compound VB-037 inhibits Aβ aggregation and promotes neurite outgrowth through enhancement of HSP27 and reduction of P38 and JNK-mediated inflammation in cell models for Alzheimer′s disease[J]. Neurochemistry International, 2019, 125:175-186.
[3] GU Y P, HAN J X, JIANG C P, et al. Biomarkers, oxidative stress and autophagy in skin aging[J]. Ageing Research Reviews, 2020, 59:101036.
[4] LIU Y M, LI L, ZHENG L, et al. Antioxidant responses of triangle sail mussel Hyriopsis cumingii exposed to harmful algae Microcystis aeruginosa and high pH[J]. Chemosphere, 2020, 243:125241.
[5] YANG L Y, LI X Y, JIANG A L, et al. Metformin alleviates lead-induced mitochondrial fragmentation via AMPK/Nrf2 activation in SH-SY5Y cells[J]. Redox Biology, 2020, 36:101626.
[6] HAN T, ZHANG S, WEI R Y, et al. Synthesis and biological evaluation of scutellarein derivatives as neuroprotective agents via activating Nrf2/HO-1 pathway[J]. Fitoterapia, 2022, 160:105207.
[7] 白振军, 张慧宇, 郭敏芳. 毛蕊异黄酮通过激活Nrf2/HO-1信号通路减轻H2O2导致的SH-SY5Y细胞损伤[J]. 中国比较医学杂志, 2020, 30(10):37-43. BAI Z J, ZHANG H Y, GUO M F. Calycosin attenuates damage induced by H2O2 in SH-SY5Y cells by activating the Nrf2/HO-1 signaling pathway[J]. Chinese Journal of Comparative Medicine, 2020, 30(10):37-43.
[8] QU Z, SUN J C, ZHANG W N, et al. Transcription factor NRF2 as a promising therapeutic target for Alzheimer′s disease[J]. Free Radical Biology &Medicine, 2020, 159:87-102.
[9] NEWMAN D J, CRAGG G M. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019[J]. Journal of Natural Products, 2020, 83(3):770-803.
[10] 唐钧, 曹红梅, 余婷婷, 等. 灯盏花素通过Nrf2/HO-1抑制缺血性脑卒中脑内氧化损伤的作用研究[J]. 老年医学与保健, 2022, 28(4):756-760. TANG J, CAO H M, YU T T, et al. Study on the effects of breviscapine on inhibiting oxidative damage in the brain of ischemic stroke rats through Nrf2/HO-1 pathway[J]. Geriatrics &Health Care, 2022, 28(4):756-760.
[11] 张鹏, 张宇晨, 王润智. 姜黄素通过SIRT1/Nrf2信号通路缓解幼鼠肺组织损伤的作用研究[J]. 华南国防医学杂志, 2021, 35(11):781-785. ZHANG P, ZHANG Y C, WANG R Z. Effect of curcumin on alleviating lung injury in mice through SIRT1/Nrf2 signaling pathway[J]. Military Medical Journal of South China, 2021, 35(11):781-785.
[12] 赵宇萌, 陈吉聪, 肖洪贺, 等. 人参皂苷Rg1通过激活Nrf2/HO-1信号通路抑制H2O2-N2a细胞氧化应激损伤的研究[J]. 现代中药研究与实践, 2022, 36(1):26-31. ZHAO Y M, CHEN J C, XIAO H H, et al. Study on the inhibition of oxidative stress injury in H2O2-induced N2a cells by ginsenoside Rg1 via activation of Nrf2/HO-1 signaling pathway[J]. Research and Practice on Chinese Medicines, 2022, 36(1):26-31.
[13] 徐由财, 丁文俊, 陈思, 等. Nrf2在黄芩素抑制氧化应激诱导心肌细胞凋亡中的作用[J]. 中成药, 2022, 44(5):1434-1440. XU Y C, DING W J, CHEN S, et al. Effects of baicalein on inhibition of oxidative stress-induced apoptosis of cardiomyocytes via Nrf2[J]. Chinese Traditional Patent Medicine, 2022, 44(5):1434-1440.
[14] 杨兆艳, 胡红娟, 李新, 等. 蓝莓花色苷对H2O2诱导A549细胞氧化损伤的保护作用[J]. 中国食品学报, 2021, 21(12):33-45. YANG Z Y, HU H J, LI X, et al. Protective effects of blueberry anthocyanins on H2O2-induced oxidative damage in A549 cells[J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(12):33-45.
[15] 王晗, 朱华平, 李文钊, 等.桑葚提取物中花青素分析及其体外抗氧化活性研究[J]. 食品与发酵工业, 2019, 45(15):170-175. WANG H, ZHU H P, LI W Z, et al. Anthocyanins in mulberry extract and their in vitro antioxidant activity[J]. Food and Fermentation Industries, 2019, 45(15):170-175.
[16] 栾琳琳, 卢红梅, 陈莉. 桑葚花青素提取纯化研究进展[J]. 中国调味品, 2019, 44(3):156-160; 164. LUAN L L, LU H M, CHEN L. Research progress of extraction and purification of mulberry anthocyanins[J]. China Condiment, 2019, 44(3):156-160; 164.
[17] 张新灿, 郭浩然, 张静, 等. 桑葚干和桑葚酒中花青素稳定性分析[J]. 食品研究与开发, 2022, 43(24):51-57. ZHANG X C, GUO H R, ZHANG J, et al. Stability analysis of anthocyanins in dried mulberry and mulberry wine[J]. Food Research and Development, 2022, 43(24):51-57.
[18] 乔廷廷, 郭玲. 花青素来源、结构特性和生理功能的研究进展[J]. 中成药, 2019, 41(2):388-392. QIAO T T, GUO L. Research progress on the source, structural characteristics and physiological functions of anthocyanins[J]. Chinese Traditional Patent Medicine, 2019, 41(2):388-392.
[19] 徐玉岩, 张韵寒, 钱远宇, 等. 花青素类成分药理作用的研究进展[J]. 现代药物与临床, 2022, 37(8):1886-1891. XU Y Y, ZHANG Y H, QIAN Y Y, et al. Research progress on pharmacological effects of anthocyanins[J]. Drugs &Clinic, 2022, 37(8):1886-1891.
[20] 夏川林, 殷浩, 王香君, 等. 桑葚功能性成分研究现状与综合利用[J]. 四川蚕业, 2021, 49(3):42-45. XIA C L, YIN H, WANG X J, et al. Research status and comprehensive utilization of functional components in mulberry[J]. Sichuan Silkworm Industry, 2021, 49(3):42-45.
[21] 薛宏坤, 谭佳琪, 李倩, 等. 矢车菊素-3-O-葡萄糖苷保护RAW264.7细胞免受过氧化氢诱导的氧化损伤[J]. 食品科学, 2021, 42(13):103-113. XUE H K, TAN J Q, LI Q, et al. Cyanidin-3-O-glucoside protects RAW264.7 cells against hydrogen peroxide-induced oxidative damage[J]. Food Science, 2021, 42(13):103-113.
[22] 王丽, 刘锋瑞, 刘亚娟, 等. 矢车菊素-3-O-葡萄糖苷(C3G)通过靶向TOPK抑制结直肠癌细胞的增殖[J]. 细胞与分子免疫学杂志, 2019, 35(12):1101-1108. WANG L, LIU F R, LIU Y J, et al. Cyanidin-3-O-glucoside inhibits proliferation of colorectal cancer cells by targeting TOPK[J]. Chinese Journal of Cellular and Molecular Immunology, 2019, 35(12):1101-1108.
[23] 宋楠, 张玲, 陈巍, 等. 矢车菊素-3-葡萄糖苷对APPswe/PS1ΔE9阿尔茨海默病模型小鼠糖脂代谢的影响[J]. 中国比较医学杂志, 2016, 26(7):15-23. SONG N, ZHANG L, CHEN W, et al. Effect of cyaniding-3-glucoside on glucose and lipid metabolism in the APPswe/PS1ΔE9 mouse model of Alzheimer’s disease[J]. Chinese Journal of Comparative Medicine, 2016, 26(7):15-23.
[24] 柳丽萍, 朱俭勋, 钟石, 等. 桑椹矢车菊素-3-芸香糖苷抵抗链脲佐菌素诱导胰岛β细胞凋亡的作用[J]. 蚕业科学, 2016, 42(3):507-512. LIU L P, ZHU J X, ZHONG S, et al. Protective effect of cyanidin-3-rutinoside from mulberry fruit on pancreatic β-cell apoptosis induced with streptozotocin[J]. Science of Sericulture, 2016, 42(3):507-512.