玫瑰是蔷薇科蔷薇属多种花卉的通称,是最重要的商业花卉之一。其中,食用玫瑰以花器官为可食部分,是可用于加工或食用玫瑰的统称[1]。在世界范围内,食用玫瑰被广泛种植,主要分布在亚洲、中东、北美和欧洲等;国内总种植面积达800 hm2,主要分布在山东、甘肃、新疆、贵州、云南等地,食用品种包括平阴玫瑰、苦水玫瑰、滇红玫瑰和墨红玫瑰等[2]。食用玫瑰具有亮丽的颜色和浓郁的香气,常用于制作鲜花饼、果酱、花茶、蛋糕、酸奶、糖果以及风味物质提取[1]。
食用玫瑰花瓣含有丰富的营养成分,主要成分为碳水化合物(60%~86%,以干重计),其次是蛋白质(2.5%~12.2%)和脂肪(<4%)。此外,其中还含有微量元素和类黄酮、类胡萝卜素、酚酸及花色苷等功能成分[1]。这些活性成分赋予食用玫瑰抗氧化、抗菌、抗炎和抗衰老等特性。BAYDAR等[3]研究发现50 μg/mL的新鲜大马士革玫瑰甲醇提取物对DPPH自由基的清除率为(77.02±0.09)%,高于丁基羟基茴香醚(butyl hydroxyanisole,BHA)和二丁基羟基甲苯。BELAL等[4]的研究表明科尔德斯月季的甲醇提取物清除DPPH自由基和ABTS阳离子自由基的IC50分别为21.93 μg/mL和10.38 μg/mL。由此可见,食用玫瑰具有较强的自由基清除能力。墨红玫瑰是云南省的主要食用玫瑰品种,由德国的KORDES于1935年用香水月季和长春月季杂交选育而成[5]。目前关于墨红玫瑰抗氧化性的研究较少,多酚类物质是植物中含量最丰富的次级代谢产物,具有良好的抗氧化性能,常作为天然抗氧化剂而得到广泛应用[6]。因此,本研究以墨红玫瑰为原料,分析玫瑰多酚提取物(rose polyphenols extraction,RPE)的稳定性及抗氧化性,为食用玫瑰相关产品开发提供科学依据。
1 材料与方法
1.1 材料与试剂
墨红玫瑰(Rosa chinensis Jacq ‘Crimson Glory’ H.T.)采自云南省红河哈尼族彝族自治州;HCl(AR)、甲醇(HPLC级)、乙醇(AR)、维生素C(99%)、没食子酸(gallic acid,GA,98%)、氯化铁(AR)、硫酸亚铁(AR)、菲啰嗪(98%)、EDTA(AR)、2,4,6-三吡啶基三嗪(98%),国药集团有限公司;AB-8大孔树脂、DPPH(96%)、ABTS(98%)、茶多酚(tea polyphenols,TP,97%)、α-生育酚(维生素E,97%)、特丁基对苯二酚(tert-butyl hydroquinone,TBHQ,98%)、BHA(98%)、硫酸铜,麦克林试剂有限公司;槲皮素、没食子酸、儿茶素、表儿茶素、没食子儿茶素、杨梅素、鞣花酸(标准品,纯度均≥98%),北京索莱宝科技有限公司。
1.2 仪器与设备
UV mini-124紫外分光光度计,日本岛津公司;Ultrospec 7000紫外分光光度计,英国柏楉有限公司;TANKPE 060 Milli-Q超纯水产生装置,法国密理博公司;RV8旋转蒸发仪,德国艾卡公司;DC801真空冷冻干燥机,大和科学株式会社;SQP型电子天平,赛多利斯科学仪器有限公司;Sorvall LYNX 4000冷冻离心机, 德国赛默飞世尔科技公司;MALDI SYNAPT MS超高效液相色谱串联四级杆飞行时间质谱联用仪,美国沃特世公司;HL-2S恒流泵,上海沪西分析仪器厂有限公司;DELTA 320 pH计,瑞士梅特勒-托利多公司;SY-1220恒温水浴槽,美国精骐有限公司。
1.3 实验方法
1.3.1 多酚提取纯化
参考ZHANG等[7]的方法并稍作修改,以30%甲醇溶液[含0.5%(体积分数)HCl]在0 ℃下萃取24 h后过滤,以5 000 r/min离心20 min。将提取液过AB-8大孔树脂柱,上样流速为1.0 mL/min,以70%(体积分数)乙醇洗脱,洗脱流速为1.0 mL/min[8]。将洗脱后的提取液浓缩,并冷冻干燥成粉末状待用。
1.3.2 RPE的组成分析
根据朱文娴[9]的方法测定总酚含量。取1 mL提取液,加入1 mL福林酚试剂,静置5 min后,加入3 mL 75 g/L Na2CO3 溶液和5 mL去离子水,在30 ℃条件下恒温反应1 h,冷却至室温后于765 nm处测定吸光值。标准曲线绘制:配制浓度为10、20、30、40、50、60 mg/L没食子酸标准溶液,采用上述方法进行测定并绘制标准曲线。
根据严勇强等[10]采用蒽酮-硫酸比色法测定总糖含量。取1 mL提取液,加入4 mL蒽酮试剂(0.2 g蒽酮溶于100 mL浓H2SO4),混匀后置于沸水浴中加热10 min,冷却至室温于610 nm 波长处测定吸光度。标准曲线:以5、10、20、40、60、80、100 μg/mL的葡萄糖标准溶液建立标准曲线。
采用考马斯亮蓝法检测蛋白质含量。取10 μL样品于96孔板中,加入300 μL G250染色液,用酶标仪测定其在595 nm处的吸光度。标准曲线绘制:配制0.1、0.2、0.4、0.6、0.8、1.0 mg/mL蛋白标准溶液,使用与样品相同的方法进行标准曲线的制作。
参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》,采用灼烧法测定总灰分含量。将坩埚置于马弗炉中,在550 ℃下灼烧至恒重,称取2~3 g样品于恒重的坩埚中,继续灼烧至恒重。
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》,采用直接干燥法测定水分含量。将称量瓶置于101~105 ℃干燥箱中加热至恒重。称取2~10 g试样放入称量瓶中,继续加热至恒重。
参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》,采用酸水解法测定脂肪含量。称取2~5 g样品,加入8 mL水,混匀后加10 mL HCl,于70~80 ℃水浴中至试样消化完全。再加入10 mL乙醇。冷却后将混合物移入具塞量筒中,以30 mL无水乙醚分次萃取合并于接收瓶,旋转蒸发回收无水乙醚,最后于(100±5) ℃干燥至恒重,测定脂肪含量。
1.3.3 RPE的多酚成分分析
采用LC-MS分析RPE的酚类组成,方法如下[9]:配制0.1 mg/mL RPE溶液,在 4 ℃下8 000 r/min离心15 min,收集上清液,过0.22 μm滤膜,用于测试。检测条件为:BEH C18(100 mm×2.1 mm,1.7 μm);DAD检测器,检测波长为280 nm;进样量2 μL;流动相A:0.1%甲酸水溶液,流动相B:乙腈;流速0.3 mL/min;柱温45 ℃;梯度洗脱,洗脱时间10 min。MS条件参数为:ESI+离子扫描,m/z:20~1 000;脱溶剂温度:400 ℃,脱溶剂气体流量为700 L/h;碰撞能量25 eV,锥电压30 V,雾化器压力50 psi,毛细管电压3.5 kV。
1.3.4 RPE的温度、pH稳定性
配制20 mg/L的RPE溶液,用0.1 mol/L HCl和NaOH 溶液调节其pH值为1.0~12.0,30 min后拍照记录RPE溶液的颜色变化,并用紫外可见分光光度计在波长450~700 nm扫描。
参考段云剑[11]的方法,配制质量浓度为20 mg/L的RPE溶液,分放置于20、40、60、80、100 ℃的水浴锅中,在0、1、2、4、6 h时测定其含量,并按公式(1)计算保留率,降解速率与浓度的一阶相关关系式如公式(2)所示:
保留率![]()
(1)
式中:Cx,x小时后样品的含量,C0,样品的初始含量。
lnC=-Kt+lnC0
(2)
式中:K,降解速率常数,h-1;t,时间,h;C0为样品原质量浓度,mg/mL;C为经过t时间后的样品质量浓度,mg/mL。
1.3.5 RPE对DPPH自由基和ABTS阳离子自由基的清除作用
参考段云剑[11]的方法并稍作修改,分别配制0.01、0.02、0.05、0.10、0.20、0.40、0.60、0.80 mg/mL的RPE溶液及对照样品溶液,DPPH自由基清除能力测定:配制0.14 mmol/L的DPPH乙醇溶液,在试管中分别加入100 μL样品和4 mL DPPH溶液,振荡混匀后40 ℃下避光反应30 min后于517 nm下测定吸光度值。ABTS阳离子自由基清除能力测定:将7 mmol/L的ABTS溶液和2.45 mmol/L的过硫酸钾溶液按照1∶1体积比混合,避光反应16~24 h,得到ABTS阳离子工作液,使用前以无水乙醇进行稀释,使其在734 nm处的吸光度值为0.7±0.02。在试管中分别加入0.1 mL样品与3.9 mL ABTS阳离子工作液,置于暗处反应7 min后于734 nm下测定吸光度值。以去离子水作为空白,按公式(3)计算自由基清除率:
自由基清除率![]()
(3)
式中:A1,样品的吸光度值;A0,空白的吸光度值。
1.3.6 RPE对铁离子的还原能力
参考JING等[12]的方法并稍作修改,将300 mmol/L醋酸钠溶液(pH为3.6)、10 mmol/L的TPTZ溶液和20 mmol/L的FeCl3溶液,按照体积比10∶1∶1混合制成FRAP工作液。标准曲线的制作:配制浓度为100、200、400、800、1 600 μmol/L的FeSO4标准溶液,分别加入3 mL FRAP工作液、100 μL FeSO4溶液与2 mL去离子水,在37 ℃下孵育30 min后于593 nm下测定吸光度值。样品的Fe3+还原能力检测步骤同标准曲线测定,样品的铁离子还原能力以达到同样吸光度值所需的Fe2+的微摩尔数表示。
1.3.7 RPE对亚铁离子和铜离子的螯合作用
参考WANG等[13]的方法并稍作修改,对Fe2+的螯合能力分析:分别配制0.01、0.02、0.05、0.10、0.20、0.40、0.60、0.80 mg/mL的RPE溶液,2 mmol/L的FeSO4溶液和5 mmol/L的菲啰嗪溶液;在试管中分别加入4.7 mL样品和0.1 mL FeSO4溶液,混合后静置30 s, 加入0.2 mL菲啰嗪溶液,反应10 min后于562 nm下测定吸光值。对Cu2+的螯合能力分析:分别配制2 mmol/L的CuSO4溶液、10%(体积分数)吡啶溶液和10%(质量分数)邻苯二酚紫溶液;在试管中分别加入1 mL CuSO4溶液、1 mL吡啶溶液、20 μL邻苯二酚紫和1 mL 样品,反应10 min后于562 nm下测定吸光度值。按照公式(4)计算螯合率:
金属离子螯合率![]()
(4)
式中:Ax,样品的吸光度值,A0,空白的吸光度值。
1.4 数据统计及分析
所有测试均重复3次,所有数据均以平均值±标准差表示,采用SPSS 24软件进行数据分析,在P<0.05为显著性水平进行单因素ANOVA分析,采用MassLynx 4.1软件进行LC-MS结果分析,采用Origin 2019软件绘制图。
2 结果与分析
2.1 RPE组成分析与多酚成分鉴定
经测定,提取液中玫瑰多酚含量为(3.70±0.03) mg/mL,提取量为(117.71±0.82) mg/g。ZHANG等[14]将10 g玫瑰粉与200 mL水混合,在50 ℃下通过80 W超声提取30 min,多酚提取量为110.9 mg/g。王晓艺等[15]以含水量为30%的氯化胆碱-乳酸(物质的量之比1∶2)为溶剂提取重瓣玫瑰中的多酚,料液比1∶40(g∶mL)、超声时间10 min、超声功率400 W,超声温度50 ℃、提取2次,提取量为(136.20±1.23) mg/g,高于本研究中的提取量,这是由于玫瑰品种以及提取方法不同。综上可以发现,多酚的提取量与其含量、提取方法(有机溶剂提取法、超声辅助提取、微波辅助提取、超临界二氧化碳萃取等)以及提取条件(溶剂、温度、pH、时间、料液比等)有关。经过大孔树脂柱后,RPE中糖、蛋白质和脂肪等物质被洗脱,其浓度均显著降低(P<0.05);而总酚含量达到(9.82±0.34) mg/mL(表1),显著提高(P<0.05)。将提纯后的RPE溶液冷冻干燥得到冻干粉,其成分为多酚[(85.43±1.80)%]、水分[(8.25±0.24)%]、糖类[(1.75±0.22)%]、蛋白质[(2.06±0.54)%]和灰分[(1.88±0.09)%]。提取液含有中的脂肪则未检出,原因可能是其含量较低,低于所用方法的检测限。
表1 RPE纯化前后成分比较 单位:mg/mL
Table 1 Composition comparison of phenol extracts before and after purification
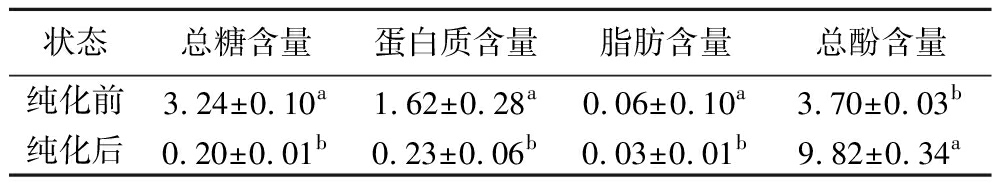
状态总糖含量蛋白质含量脂肪含量总酚含量纯化前3.24±0.10a1.62±0.28a0.06±0.10a3.70±0.03b纯化后0.20±0.01b0.23±0.06b0.03±0.01b9.82±0.34a
注:图中同列不同小写字母表示有显著性差异(P<0.05)。
进一步经LC-MS分析(图1、图2),结合前人研究结果[16]对比分析,可知RPE中的酚类物质含量由高到低为:矢车菊素-3,5-二葡萄糖苷>鞣花酸>槲皮素>没食子儿茶素>Bis-六羟基二苯酰基-葡萄糖苷>山奈酚>儿茶素>杨梅素(表2)。相似研究分析出平阴玫瑰中含有没食子酸、原儿茶酸、山奈酚、草质素-8-甲醚、异槲皮苷、紫云英苷6种成分[20]。此外,刘红燕[21]从平阴玫瑰中鉴定出没食子酸、咖啡酸、木犀草素、槲皮素、乔松素-7-O-β-D-葡萄糖苷、槲皮素-4′-O-β-D-葡萄糖苷、刺槐苷等7种组分。在本研究中,8种多酚含量低于RPE中总酚含量,一方面在于福林酚法测定的总酚含量是以没食子酸当量来表征,与实际多酚种类存在差异[18];另一方面,部分多酚结构待鉴定。
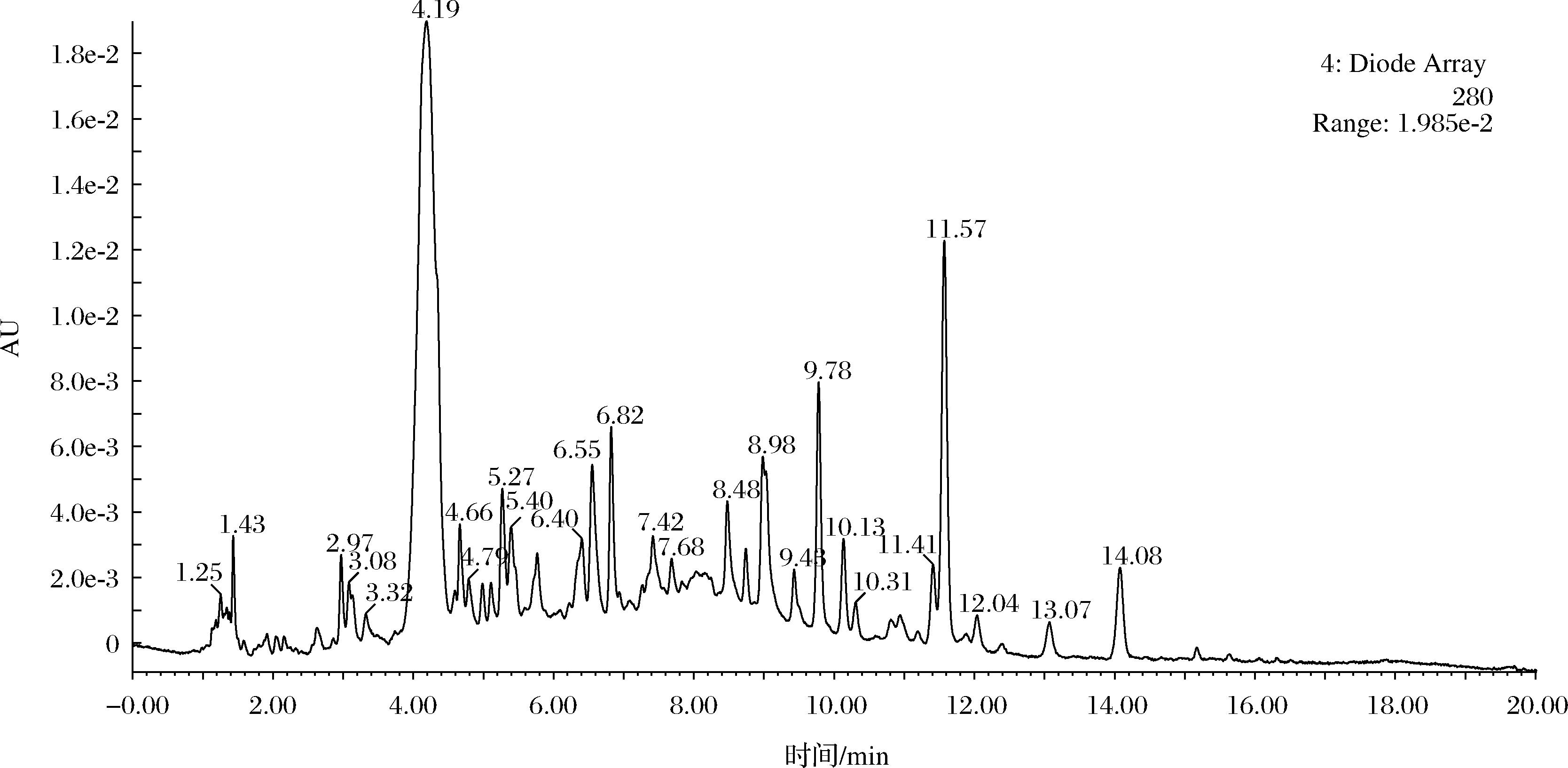
图1 RPE的液相色谱图
Fig.1 Liquid chromatogram of RPE
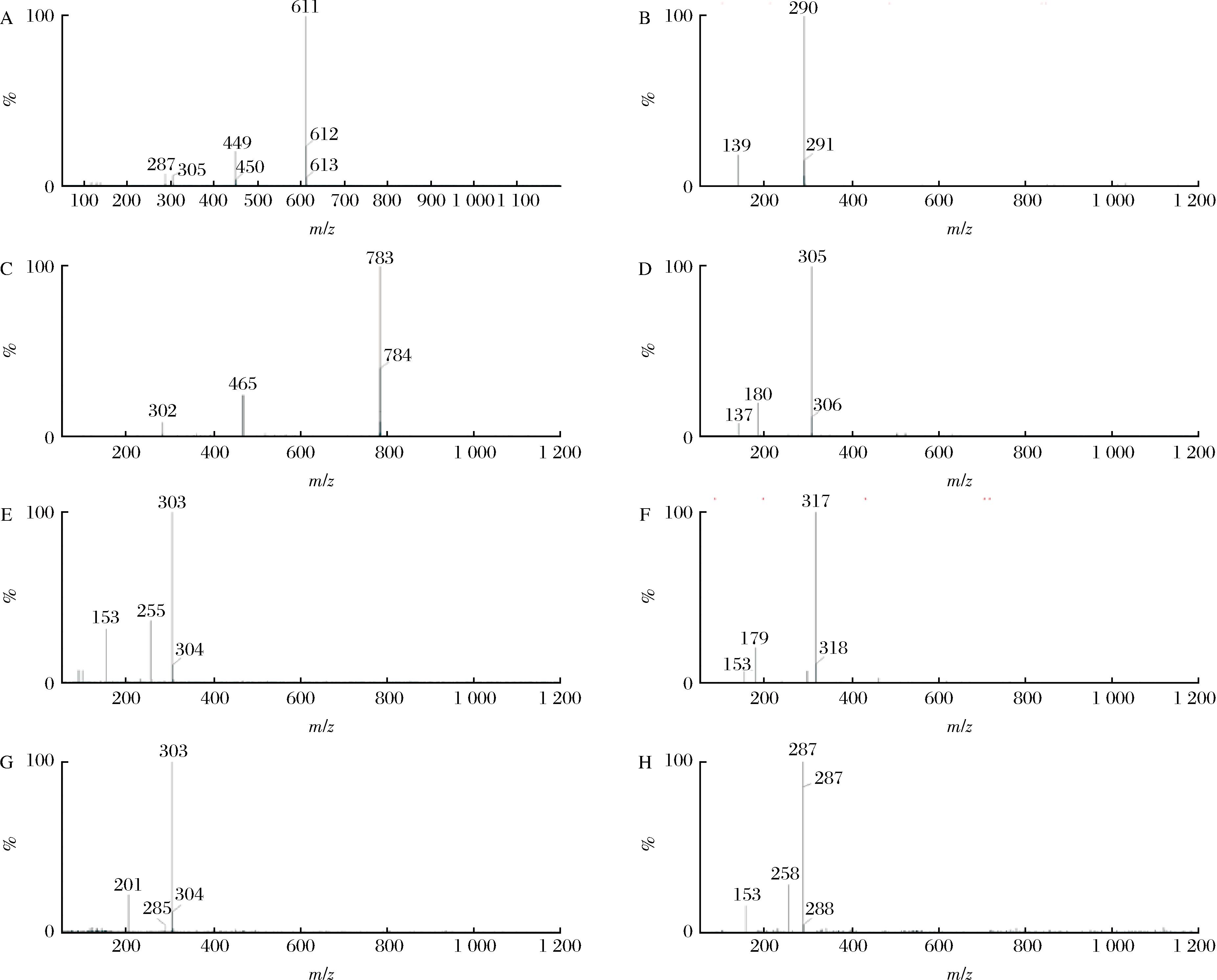
A-矢车菊素-3,5-二葡萄糖苷;B-儿茶素;C-Bis-六羟基二苯酰基-葡萄糖苷;D-没食子儿茶素;E-槲皮素;F-杨梅素;G-鞣花酸;H-山奈酚
图2 RPE中酚类成分的质谱图
Fig.2 Mass spectrum of phenolic components in RPE
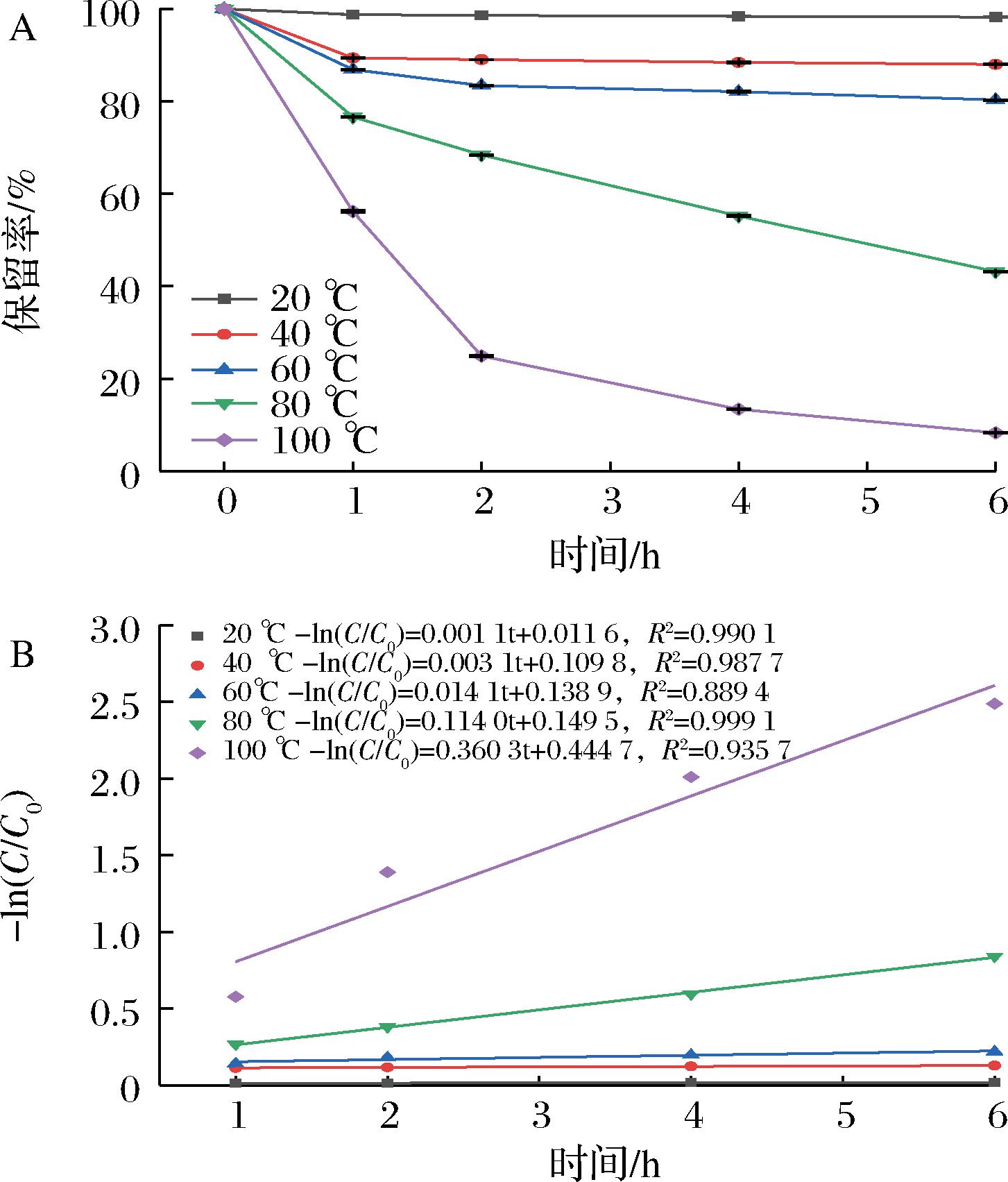
A-保留率;B-降解速率
图3 温度(20~100 ℃)对RPE稳定性的影响
Fig.3 Effect of temperature ( 20-100 ℃) on the retention rates of RPE
表2 RPE中酚类成分含量
Table 2 Comparison of phenolic components in RPE

移动时间/min分子离子(m/z)碎片离子(m/z)化学名称分子式相对含量/%参考文献4.19611287;305;449矢车菊素-3,5-二葡萄糖苷C27H31O1634.80[17]5.40290139儿茶素C15H16O62.21[16]6.82784302;465Bis-六羟基二苯酰基-葡萄糖苷-C34H24O222.90[18]8.98305137;180没食子儿茶素C15H14O74.28[19]9.78303153;255槲皮素C15H10O74.26[16]10.13317153;179杨梅素C15H10O81.56[16]11.57303201;285鞣花酸C15H10O78.91[16]14.08287153;258山奈酚C15H10O62.50[16]
2.2 RPE的稳定性评价
2.2.1 热稳定性
多酚尤其是花色苷的稳定性会受温度影响,较高温度下其保留率降低(图3-A)。在20 ℃下,RPE较稳定,其在6 h后的保留率为(98.20±0.07)%;随着温度升高至60 ℃,其保留率逐渐下降,6 h后保留率为(80.37±0.07)%;当温度升高至80~100 ℃,降解更快;其中100 ℃下经2 h后保留率仅为(24.93±0.20)%。在各个温度的热处理过程中,RPE的保留率在0~1 h下降最快,在1~6 h保留率下降速度变缓,并且随着温度升高,K值逐渐升高,温度越高花色苷的降解速率越快,表明其在1~6 h内的降解过程符合一级动力学反应(图3-B)。矫馨瑶[22]的研究表明蓝莓多酚提取物的热降解也符合一级动力学模型。VOSS等[23]对锦葵素-3-葡萄糖苷、天竺葵素-3-葡萄糖苷和矢车菊素-3-葡萄糖苷进行热处理,发现90 ℃处理0.5 h后出现降解产物,并且每种花色苷都产成了间苯三酚醛和酚酸类化合物等降解产物。综上所述,由于花色苷等酚类物质在高温下会发生降解,因此低温条件(≤20 ℃)更有利于RPE的保存。
2.2.2 pH稳定性
RPE中的主要成分之一矢车菊素-3,5-二葡萄糖苷是一种天然色素,其颜色随着pH值的变化而变化(图4-A)。pH值为1~4时,溶液呈红色,并且随着pH值增大,溶液的颜色逐渐变浅。pH值为7~8时,溶液呈紫色,并且颜色随着pH值增大而加深。pH值增大到9时,溶液呈深蓝绿色,增大到10~11时,溶液呈绿色,当pH值为12时,溶液呈棕黄色。根据全波段扫描图谱(图3-B),pH值1~4时,吸收峰的高度降低,宽度增大,pH值为5~6时,没有出现吸收峰,pH值增大至7时,重新出现吸收峰。pH值为7~9时,吸收峰的宽度降低,高度增加,并向右偏移。出现上述现象的原因是pH值的变化使花色苷的结构发生变化,pH值为1~4时,花色苷以黄酮阳离子的形式存在,呈现红色;pH值为5~6时,花色苷水解形成无色的半缩醛形式;当pH值进一步升高至7~8,花色苷脱水、去质子化,变为紫色,当pH值升高至10以上时,花色苷转变为查尔酮结构[24]。此外,ZHANG等[14]研究发现pH值为7时,玫瑰提取物中总酚的含量要远低于pH值为2和5时的总酚含量(P<0.05),原因是多酚在非酸性条件下更易形成沉淀。综上所述,RPE应保存在pH≤4的环境中以防止其结构发生变化。

A-颜色;B-全波段扫描
图4 pH值(1~12)对RPE溶液(20 mg/L)的颜色及 紫外全波段扫描图谱的影响
Fig.4 Effects of pH value (1-12) on the color and UV scanning of RPE solution (20 mg/L)
2.3 RPE的抗氧化能力评价
2.3.1 RPE的自由基清除能力
根据对ABTS阳离子自由基的清除率达到100%时的浓度(图5-A),推断ABTS阳离子自由基清除能力从强到弱为RPE>GA>TP>维生素C>TBHQ>BHA>维生素E。在质量浓度为0.05 mg/mL时,RPE对ABTS阳离子自由基的清除率达到100%。多项研究表明RPE中的主要成分矢车菊素-3,5-二葡萄糖苷和鞣花酸等均具有良好的自由基清除能力[19,25]。
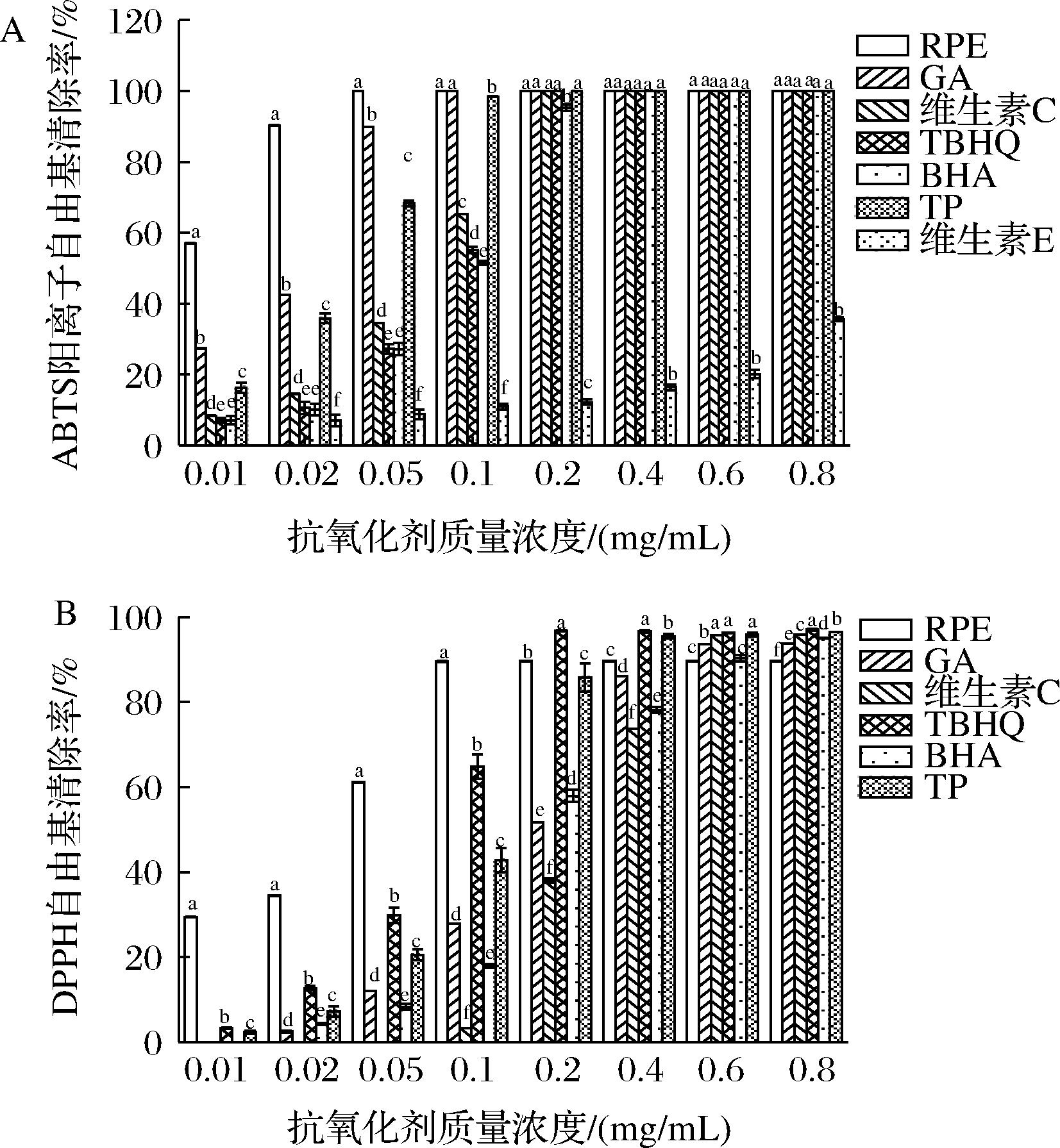
A-ABTS阳离子自由基;B-DPPH自由基
图5 抗氧化剂种类对ABTS阳离子自由基(7 mmol/L)和 DPPH自由基(0.14 mmol/L)清除率的影响
Fig.5 Effect of antioxidant types on scavenging rates of ABTS cation free radical(7 mmol/L) and DPPH free radical (0.14 mmol/L)
注:图中同一浓度下,不同字母表示具有显著性差异(P<0.05)(下同)。
如图5-B所示,在低浓度的情况下,RPE的DPPH自由基清除能力显著高于其他对照,当RPE质量浓度为0.1 mg/mL时,RPE的清除能力达到饱和,对DPPH自由基清除率为89.53%。当质量浓度为0.8 mg/mL时,RPE的清除率最低。葛芹[8]发现云南安宁玫瑰提取物对DPPH自由基的EC50值为20.8 μg/mL,其清除能力为GA的8.9倍。李坪[26]的研究表明云南玫瑰多酚提取物清除DPPH自由基的能力弱于维生素C,存在差异的原因可能在于玫瑰提取物的成分不同。此外,α-生育酚在此浓度范围内对DPPH自由基的清除率为0,原因可能是其浓度过低。杨盈等[27]研究发现α-生育酚与DPPH自由基反应的计量比为1∶2,而本实验中样品与DPPH自由基的体积比为0.1∶4,因此难以体现出α-生育酚对DPPH自由基的清除能力。
综上,RPE对ABTS阳离子自由基和DPPH自由基具有较强的清除能力,当RPE的质量浓度达到0.1 mg/mL时,自由基清除能力达到饱和。
2.3.2 RPE的Fe3+还原能力
如图6所示,RPE对Fe3+的还原力显著高于对照组(P<0.05)。SINAN等[28]研究发现Fe3+还原能力与抗氧化剂结构中酚羟基的位置、数量以及甲氧基的数量密切相关。从玫瑰多酚的成分来看,矢车菊素-3,5-二葡萄糖苷、鞣花酸以及儿茶素等都含有多个羟基并具有邻位酚羟基。赵靖[29]的研究表明邻位酚羟基的抗氧化性能优于非邻位结构,可能在于邻位酚羟基具有较好的氧化还原可逆性,其抗氧化性能具有再生性。因此,RPE具有较强的Fe3+还原能力。

图6 抗氧化剂种类对铁离子还原能力的影响
Fig.6 Effect of antioxidant types on iron reduction capacity
2.3.3 RPE的金属离子螯合能力
如图7所示,相同质量浓度下,RPE对Fe2+和Cu2+的螯合率低于EDTA,高于其他对照组,原因在于EDTA中含有多个胺和羧基结构,能够提供多个N、O配位原子与金属离子的空价电子轨道相结合,形成稳定的环状结构[30]。此外,BHA、TBHQ和茶多酚对Cu2+的螯合率则随着质量浓度的升高而降低,目前关于脂溶性抗氧化剂螯合铜离子的研究不足,可能是由于螯合物不稳定,在测试的过程中发生分解,还需要进一步研究验证。
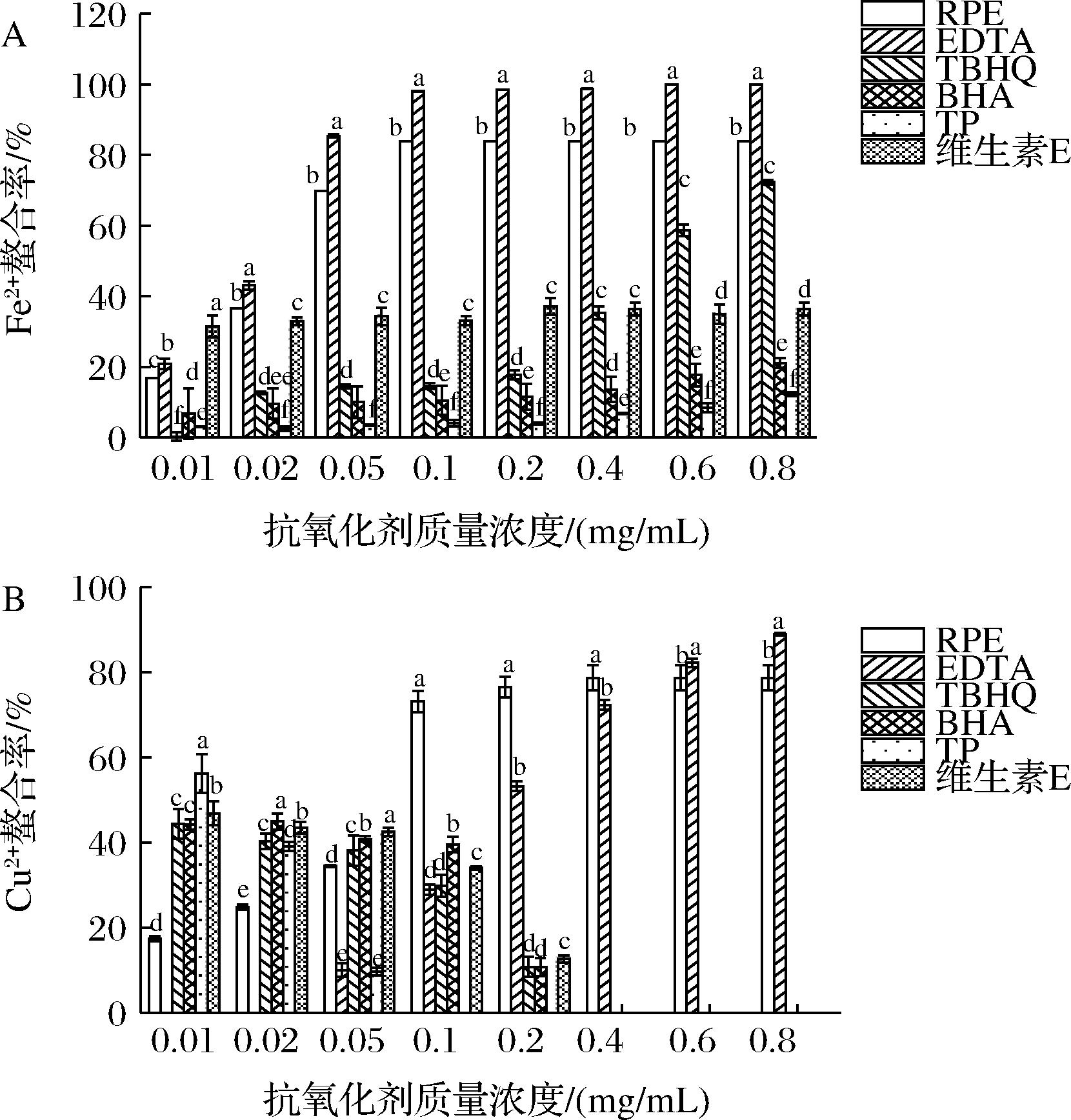
A-Fe2+;B-Cu2+
图7 抗氧化剂种类对金属离子螯合率的影响
Fig.7 Effect of antioxidant types on chelation rate of metal ions
3 结论
本研究对墨红玫瑰多酚进行了提取,并分析其稳定性和抗氧化能力。通过LC-MS鉴定出墨红玫瑰含有矢车菊素-3,5-二葡萄糖苷、鞣花酸、儿茶素、槲皮素、杨梅素、山奈酚、bis-六羟基二苯酰基-葡萄糖苷和没食子儿茶素,并且在低pH和低温的环境中结构较为稳定。通过与维生素C、GA、BHA、TBHQ、TP、维生素E等抗氧化剂的对比发现:在较低浓度下,玫瑰多酚提取物即表现出好的抗氧化性能,在质量浓度为0.1 mg/mL时,其抗氧化能力基本已达到饱和,但同浓度下其对金属离子的螯合率低于EDTA。从结构上来看,RPE的抗氧化性主要来源于各组分的酚羟基,其能通过转移氢原子来捕获自由基。未来可以通过直接添加到食品中或用于食品的抗氧化包装来发挥其抗氧化能力。由于目前对玫瑰多酚的鉴定研究不足,今后可对其各组分进行分离鉴定,以期更全面地了解玫瑰多酚的结构和性能,有助于开发新的天然抗氧化剂。本研究为墨红玫瑰花色苷的应用提供了可靠思路和理论支撑。
[1] HEGDE A S, GUPTA S, SHARMA S, et al.Edible rose flowers:A doorway to gastronomic and nutraceutical research[J].Food Research International, 2022, 162(Pt A):111977.
[2] 王珍珍, 王其刚, 唐开学, 等.云南主栽食用玫瑰花香成分及关键花香基因表达分析[J].植物生理学报, 2019, 55(7):1038-1046. WANG Z Z, WANG Q G, TANG K X, et al.Analysis of volatile components and scent-related gene expressions of edible roses in Yunnan[J].Plant Physiology Journal, 2019, 55(7):1038-1046.
[3] BAYDAR N G, BAYDAR H.Phenolic compounds, antiradical activity and antioxidant capacity of oil-bearing rose (Rosa damascena Mill.) extracts[J].Industrial Crops and Products, 2013, 41:375-380.
[4] BELAL H, YESMIN R, ISLAM D, et al.Evaluation of phytochemical and antioxidative properties of Rosa kordesii petal extracts[J].IOSR Journal of Pharmacy and Biological Sciences, 2016, 11(3):50-60.
[5] CUI W H, DU X Y, ZHONG M C, et al.Complex and reticulate origin of edible roses (Rosa, Rosaceae) in China[J].Horticulture Research, 2022, 9:uhab051.
[6] DZAH C S, DUAN Y Q, ZHANG H H, et al.The effects of ultrasound assisted extraction on yield, antioxidant, anticancer and antimicrobial activity of polyphenol extracts:A review[J].Food Bioscience, 2020, 35:100547.
[7] ZHANG Y, LIAO X J, NI Y Y, et al.Kinetic analysis of the degradation and its color change of cyanidin-3-glucoside exposed to pulsed electric field[J].European Food Research and Technology, 2007, 224(5):597-603.
[8] 葛芹. 食用玫瑰色素的提取、纯化及性质研究[D].无锡:江南大学, 2013. GE Q.Study on extraction, purification and properties of pigment from edible rose[D].Wuxi:Jiangnan University, 2013.
[9] 朱文娴. 声热联合加工红肉火龙果清汁中色泽变化原因及其护色研究[D].无锡:江南大学, 2020. ZHU W X.Study on the reason of color change in clear red pitaya juice during thermosonication processing and of its color retention[D].Wuxi:Jiangnan University, 2020.
[10] 严勇强, 李威, 刘娟, 等.超高压与热处理对火龙果汁流变特性的影响[J].食品与发酵工业, 2011, 37(8):190-194. YAN Y Q, LI W, LIU J, et al.Comparison of ultra-high pressure and heat treatment on rheological property of pitaya juice[J].Food and Fermentation Industries, 2011, 37(8):190-194.
[11] 段云剑. 玫瑰茄花色苷的提取纯化及活性研究[D].福州:福州大学, 2018. DUAN Y J.Extraction, purification and activity study of roselle anthocyanins[D].Fuzhou:Fuzhou University, 2018.
[12] JING P, YE T, SHI H M, et al.Antioxidant properties and phytochemical composition of China-grown pomegranate seeds[J].Food Chemistry, 2012, 132(3):1457-1464.
[13] WANG L L, XIONG Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural and Food Chemistry, 2005, 53(23):9186-9192.
[14] ZHANG Q Q, RUI X, LI W, et al.Anti-swarming and-biofilm activities of rose phenolic extract during simulated in vitro gastrointestinal digestion[J].Food Control, 2016, 64:189-195.
[15] 王晓艺, 李培坤, 李锦红, 等.超声辅助低共熔溶剂提取玫瑰多酚及其抗氧化活性[J].食品研究与开发, 2022, 43(8):98-105. WANG X Y, LI P K, LI J H, et al.Ultrasonic-assisted extraction of rose polyphenols by deep eutectic solvent and antioxidant activity [J].Food Research and Development, 2022, 43(8):98-105.
[16] 吴妙鸿, 邱珊莲, 林宝妹, 等.不同品种嘉宝果叶提取物的酚类成分及生物活性分析[J].南方农业学报, 2022, 53(8):2231-2240. WU M H, QIU S L, LIN B M, et al.Phenolic components and biological activity analysis of extracts from leaves of different cultivars of jaboticaba[J].Journal of Southern Agriculture, 2022, 53(8):2231-2240.
[17] LEE J H, LEE H J, CHOUNG M G.Anthocyanin compositions and biological activities from the red petals of Korean edible rose (Rosa hybrida cv.Noblered)[J].Food Chemistry, 2011, 129(2):272-278.
[18] 张娟梅. 玫瑰花渣中多酚的超声辅助提取制备、组分分析及其生物活性研究[D].南京:南京农业大学, 2014. ZHANG J M.Study on ultrasound-assisted extraction, preparation, Charactenation and bioactivity of polyphenols from Rosea rugosea drags[D].Nanjing:Nanjing Agricultural University, 2014.
[19] 汪雪莲, 冯慧祥, 薛世华, 等.绿茶茶末多酚的提取、鉴定及其生物活性研究[J].轻工学报, 2022, 37(6):58-67. WANG X L, FENG H X, XUE S H, et al.Extraction, identification and bioactivities of polyphenols from green tea dust[J].Journal of Light Industry, 2022, 37(6):58-67.
[20] 马昌豪. 玫瑰花化学成分与质量标准研究[D].济南:山东中医药大学, 2012. MA C H.The chemical constituents and quality of Rosae rugosae Flos[D].Jinan:Shandong University of Traditional Chinese Medicine, 2012.
[21] 刘红燕. 玫瑰花的化学成分研究(英文)[J].天然产物研究与开发, 2013, 25(1):47-49. LIU H Y.Chemical constituents from flowers of Rosa rugosa Thunb.[J].Natural Product Research and Development, 2013, 25(1):47-49.
[22] 矫馨瑶. 蓝莓多酚的稳定性及对高脂膳食小鼠的辅助抗肥胖作用机制研究[D].沈阳:沈阳农业大学, 2019. JIAO X Y.Study on the stability and mechanism of assisted anti-obesity effect on high-fat diet mice of blueberry polyphenols[D].Shenyang:Shenyang Agricultural University, 2019.
[23] VOSS D M, MIYAGUSUKU-CRUZADO G, GIUSTI M M.Thermal stability comparison between 10-catechyl-pyranoanthocyanins and anthocyanins derived from pelargonidin, cyanidin, and malvidin[J].Food Chemistry, 2023, 403:134305.
[24] ZHAO L, LIU Y Q, ZHAO L, et al.Anthocyanin-based pH-sensitive smart packaging films for monitoring food freshness[J].Journal of Agriculture and Food Research, 2022, 9:100340.
[25] 崔珊珊, 毕凯媛, 吴杰, 等.响应面法优化树莓鞣花酸提取工艺及其体外抗氧化活性[J].食品工业科技, 2019, 40(1):149-155;161. CUI S S, BI K Y, WU J, et al.Optimization of extraction technology and antioxidative activity of ellagic acid in raspberry by response surface methodology[J].Science and Technology of Food Industry, 2019, 40(1):149-155;161.
[26] 李坪. 玫瑰花多酚提取、分离纯化及其生物活性研究[D].绵阳:西南科技大学, 2022. LI P.Extraction, separation, purification and biological activity of rose polyphenols[D].Mianyang:Southwest University of Science and Technology, 2022.
[27] 杨盈, 严宝珍, 聂舟, 等.α-生育酚与自由基DPPH·的反应机理研究[J].波谱学杂志, 2008, 25(3):331-336. YANG Y, YAN B Z, NIE Z, et al.The mechanism of a reaction between α-tocopherol and DPPH studied by NMR and ESR spectroscopy[J].Chinese Journal of Magnetic Resonance, 2008, 25(3):331-336.
[28] SINAN K I, MAHOMOODALLY M F, EYUPOGLU O E, et al.HPLC-FRAP methodology and biological activities of different stem bark extracts of Cajanus cajan (L.) Millsp[J].Journal of Pharmaceutical and Biomedical Analysis, 2021, 192:113678.
[29] 赵靖. 黄酮异构体的抗氧化性与电化学特性对比研究[D].大连:辽宁师范大学, 2015. ZHAO J. Comparative study on oxidation resistance and electrochemical characteristics of flavonoids isomers[D]. Dalian: Liaoning Normal University, 2015.
[30] 于振. 基于金属离子螯合原理的抗氧化活性包装膜制备及性能研究[D].无锡:江南大学, 2021. YU Z.Preparation and properties of antioxidant active packaging film based on metal ions chelation principle[D].Wuxi:Jiangnan University, 2021.