植物乳杆菌(Lactobacillus plantarum)是常见的益生菌,存在于各种传统发酵食品中,具有改善肠道健康[1]、抑制有害菌生长等益生作用。植物乳杆菌代谢物是由植物乳杆菌生长过程中产生的代谢物质,包括有机酸[2]、脂肪酸[3]、细菌素[4]等多种抑菌物质,对腐败菌具有较强的抑菌活性。目前,关于植物乳杆菌代谢物的抑菌机制研究较少,WANG等[5]基于代谢组学研究了植物乳杆菌无细胞上清液对嗜水气单胞菌的抑菌机理,证明植物乳杆菌无细胞上清液能够影响嗜水气单胞菌的三羧酸循环、氨基酸代谢、碳水化合物代谢和核苷酸代谢,并破坏细胞膜完整性,有效抑制指示菌生长,但是其并未对上清液中的有效抑菌成分进行分析。现阶段大部分研究认为植物乳杆菌的抑菌活性主要来自于细菌素,并以细菌素为主要研究对象,例如plantaricin LP 21-2[6]、plantaricin DL3[7]等新型细菌素对革兰氏阳性菌、革兰氏阴性菌和真菌具有广谱抑菌活性,高热稳定性,能够作用于细菌特定位点使得细菌表面产生孔洞,引起胞内物质泄漏,从而杀死细菌。
液化沙雷氏菌(Serratia liquefaciens)属于肠杆菌科、沙雷氏菌属,是一种在冷藏食品中常见的腐败菌,存在于各种冷冻蔬菜和肉制品中,引起食品腐败变质[8-9]。液化沙雷氏菌属于条件致病菌,能够导致人体食物中毒。液化沙雷氏菌在低温食品中具有较强的致腐能力,MACHADO等[10-12]发现液化沙雷氏菌能够产生耐热蛋白酶和脂肪酶,引起生乳腐败,是冷生乳的主要腐败菌,也能导致冰鲜鸡肉表面产生黏液,引起冰鲜鸡肉腐败[13]。目前,MATAMOROS等[14]用嗜冷乳酸菌作为抑制剂评价其对液化沙雷氏菌的抑菌性能,发现乳球菌属、明串珠菌属和部分乳杆菌对液化沙雷氏菌有抑菌活性,但并未进行抑菌机制的探究。
本实验基于前期筛选得到的一株拮抗液化沙雷氏菌SCB2649菌株生长的专利菌株植物乳杆菌SCB2505,提取其代谢物,通过测定其对液化沙雷氏菌SCB2649菌株的抑菌活性及其对细胞壁与细胞膜完整性、生物被膜及菌体结构等的影响,探究植物乳杆菌SCB2505代谢物的抑菌成分及其对液化沙雷氏菌SCB2649菌株的作用机理,为其在畜产食品防腐中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
指示菌为液化沙雷氏菌SCB2649菌株,分离自味燃食品(深圳)有限公司提供的熟成牛肉中,由华南农业大学食品学院发酵工程团队保藏;植物乳杆菌SCB2505分离自开菲尔粒(西伯利亚地区),由华南农业大学食品学院发酵工程团队保藏。
碱性磷酸酶(alkaline phosphatase, AKP)试剂盒、乳酸(lactic acid, LD)测试盒,南京建成生物工程研究所;胰蛋白胨大豆肉汤(TSB)培养基、MRS培养基、LB琼脂培养基、碘化丙啶(PI),广东环凯微生物科技有限公司;结晶紫,天津市大茂化学试剂厂;无水乙醇、甲醇(分析纯)。
1.2 仪器与设备
全自动生长曲线分析仪,芬兰Bioscreen公司;冷冻干燥机,德国Christ公司;光栅型酶标仪,美国Melecular Devices公司;倒置荧光显微镜,德国Carl Zeiss公司;冷冻高速离心机,德国Eppendorf公司;生化培养箱,韶关市泰宏医疗器械有限公司;高压灭菌锅,日本HIRAYAMA公司;场发射扫描电子显微镜,美国FEI公司。
1.3 实验方法
1.3.1 SCB2505代谢物的制备
将菌株SCB2505经MRS液体培养基中经活化2~3代后,以接种量2%接种于MRS液体培养基中,30 ℃培养16~18 h,后在4 ℃下,以5 000 r/min离心10 min,经0.22 μm无菌滤膜过滤,收集滤液,冻干。
1.3.2 制备液化沙雷氏菌菌悬液
液化沙雷氏菌SCB2649菌株经LB固体培养基活化2代后,用无菌接种环挑取单菌落一环于5 mL TSB液体培养基中,28 ℃培养20 h,6 000 r/min离心5 min,弃上清液,用无菌胰蛋白胨大豆肉汤稀释至1~2×107CFU/mL,备用。
1.3.3 最小抑菌浓度(minimum inhibitory concentration, MIC)的测定
采用倍比稀释法测定植物乳杆菌SCB2505代谢物对液化沙雷氏菌的最小抑菌浓度[15]。取菌悬液100 μL至96孔细胞培养板中,再取溶于无菌去离子水的代谢物100 μL加到上述孔中,使代谢物终质量浓度分别为32、16、8、4、2、1、0.5、0.25 mg/mL。对照组加入100 μL去离子水和100 μL菌悬液。将96孔细胞培养板放置于28 ℃生化培养箱培养24 h,培养后用肉眼观察孔中菌液的浊度,选定菌液澄清透明的最低植物乳杆菌SCB2505代谢物浓度为MIC。
1.3.4 SCB2505对液化沙雷氏菌生长曲线的影响
参照石超[16]的方法并稍作修改。取1.3.2节所得菌悬液100 μL至96孔细胞培养板中,再取浓度分别为1.0 MIC、2.0 MIC代谢物溶液100 μL加到上述孔中,使代谢物终质量浓度分别为0.5 MIC、1.0 MIC,以无菌去离子水替代代谢物作为对照,每个浓度3孔。将96孔细胞培养板于28 ℃培养24 h,每间隔1 h测定1次OD600nm值,并以时间为横坐标,光密度值为纵坐标绘制生长曲线。
1.3.5 植物乳杆菌代谢物的抑菌成分分析
1.3.5.1 SCB2505代谢物溶液的制备
用无菌去离子水溶解代谢物,使代谢物的质量浓度为43 mg/mL,放置于4 ℃中待用。
1.3.5.2 温度敏感性测定
将LB培养基融化后待其冷却至48~50 ℃,加入指示菌液化沙雷氏菌菌液,使培养基含菌量为5×105 CFU/mL,混匀后倒入平板,晾干后用打孔器(d=7.8 mm)在平板上打孔并挑去琼脂块。将1.3.5.1节制备的代谢物溶液分别在70、100、121 ℃加热处理20 min,以未处理的代谢物溶液为对照,每孔滴加样液90 μL,于28 ℃培养10 h,测量抑菌圈直径。
1.3.5.3 pH敏感性测定
采用1.3.5.2节的方法制备指示菌平板。用1 mol/L稀盐酸、氢氧化钠溶液调整代谢物溶液pH值分别为3.0、5.0、7.0、9.0,将乳酸(与未处理的代谢物溶液pH值一致)和未处理的代谢物溶液(pH 3.54)为对照,每孔滴加样液90 μL,于28 ℃培养10 h,测量抑菌圈直径。
1.3.5.4 乳酸验证试验
采用1.3.5.2节的方法制备指示菌平板。参考乳酸测试盒步骤进行操作,测定20 mL植物乳杆菌SCB2505代谢物溶液中的乳酸含量。取试管,在A管中注入6 mL代谢物溶液,在B、E管中注入6 mL无菌MRS液体培养基,C、D管注入6 mL无菌水,然后用25%乳酸调节B管(同时记录乳酸添加量)、C管至与A管相同pH,在D管中注入与B管等量的乳酸,实验以E管为空白对照,每孔滴加样液90 μL,28 ℃培养10 h,测量抑菌圈直径。
1.3.5.5 酶敏感性测定
采用1.3.5.2节的方法制备指示菌平板。将胰蛋白酶、胃蛋白酶、过氧化氢酶分别加入到装有5 mL代谢物溶液的试管中,使各酶终质量浓度为1 mg/mL,用1 mol/L稀盐酸、氢氧化钠溶液分别将pH调整为8.0(胰蛋白酶)、1.8(胃蛋白酶)、过氧化氢酶(7.0),37 ℃水浴2 h,再用稀盐酸和氢氧化钠溶液调至初始pH,以未进行蛋白酶处理的代谢物溶液为对照,每孔滴加样液90 μL,28 ℃培养10 h,测量抑菌圈直径。
1.3.6 SCB2505代谢物对液化沙雷氏菌生物被膜的影响
参考王琳等[17]的方法稍作修改。取1.3.2节所得菌悬液100 μL至96孔细胞培养板中,再取浓度分别为1.0 MIC、2.0 MIC和4.0 MIC代谢物溶液100 μL加到上述孔中,使代谢物终质量浓度分别为0.5 MIC、1.0 MIC、2.0 MIC,以无菌去离子水替代代谢物作为对照,每个浓度3孔。将96孔细胞培养板于28 ℃培养24 h。然后弃去菌液,用PBS清洗3次,加入200 μL甲醇固定15 min,后弃去甲醇,加入200 μL 0.1%结晶紫染液染色20 min,弃去染色液,用PBS清洗3次,干燥后,加入200 μL 95%乙醇溶液溶解残留的染色液,用酶标仪测定OD590nm值,计算生物被膜抑制率。生物被膜抑制率的计算如公式(1)所示:
生物被膜抑制率![]()
(1)
1.3.7 SCB2505代谢物对液化沙雷氏菌细胞壁完整性的影响
取1.3.2节所得菌悬液500 μL至2 mL离心管中,再取质量浓度分别为1.0 MIC、2.0 MIC和4.0 MIC代谢物溶液500 μL加到离心管中,使代谢物终质量浓度分别为0.5 MIC、1.0 MIC、2.0 MIC,以无菌去离子水替代代谢物作为对照,每个浓度3个管,于28 ℃培养4 h。5 000 r/min,4 ℃离心10 min,取上清液。参考AKP试剂盒步骤进行操作,测定上清液中AKP活力。
1.3.8 SCB2505代谢物对液化沙雷氏菌细胞膜完整性的影响
参照苏晓丹[18]的PI染色法并稍作修改。取1.3.2节所得菌悬液500 μL至2 mL离心管中,再取浓度分别为1.0 MIC、2.0 MIC和4.0 MIC代谢物溶液500 μL加到上述离心管中,使代谢物终质量浓度分别为0.5 MIC、1.0 MIC、2.0 MIC,以无菌去离子水替代代谢物作为对照,每个浓度3个管,于28 ℃培养4 h。将培养好的菌液以5 000 r/min,4 ℃离心10 min,弃上清液,所得菌体用PBS重悬洗涤2次后,离心弃上清液,PBS重悬,加入PI染料(终质量浓度为10 μg/mL),4 ℃避光孵育30 min,PBS重悬洗涤2次,离心弃上清液,PBS重悬,取菌悬液10 μL在荧光显微镜下观察。激发波长为535 nm,发射波长为615 nm。
1.3.9 SCB2505代谢物对液化沙雷氏菌细胞形态的影响
取1.3.2节所得菌悬液20 mL于50 mL离心管中,再取浓度分别为1.0 MIC、2.0 MIC和4.0 MIC代谢物溶液20 mL加到上述管中,使代谢物终质量浓度分别为0.5 MIC、1.0 MIC、2.0 MIC,以无菌去离子水替代代谢物作为对照,于28 ℃培养10 h。将培养好的菌液4 000 r/min离心10 min,弃上清液,所得到的菌体用PBS重悬洗涤2次后,将菌体悬浮于2.5%戊二醛-PBS溶液固定(4 ℃)。过夜后用PBS洗涤菌体3次,后置于1%锇酸中固定30 min,随后用不同浓度的乙醇梯度洗脱。最后将样品滴加至专用玻片并贴附于场发射扫描电镜载物台,用临界点干燥仪干燥8 h后镀金,使用场发射扫描电子显微镜(field-emission scanning electron microscope, FESEM)观测细菌细胞形态。
1.3.10 数据统计分析
采用Origin 2022软件(OriginLab Corporation,USA)进行绘图,SPSS Statistics 26.0(IBM Corp., USA)对数据进行ANOVA分析或t检验,实验重复3次,取测定结果的平均值,数据用平均值±标准误差表示。
2 结果与分析
2.1 SCB2505代谢物MIC的测定
由表1可知,对于液化沙雷氏菌SCB2649菌株,植物乳杆菌SCB2505代谢物质量浓度为4 mg/mL时,液体培养基浑浊,指示菌液化沙雷氏菌SCB2649菌株有明显的生长现象发生,但质量浓度为8 mg/mL的试管中液体清澈,指示菌SCB2649菌株无明显的生长现象,因此植物乳杆菌SCB2505代谢物对该指示菌的MIC可确定为8 mg/mL。
表1 SCB2505代谢物对液化沙雷氏菌最小抑菌浓度
Table 1 The minimum inhibitory concentration of Lactobacillus plantarum SCB2505 metabolites against Serratia liquefaciens
SCB2505代谢物质量浓度/(mg/mL)321684210.50.25对照组指示菌生长情况(+/-)---++++++
注:“+”代表浑浊;“-”代表澄清。
2.2 SCB2505代谢物对液化沙雷氏菌生长曲线的影响
由图1可知,对照组的液化沙雷氏菌SCB2649菌株在24 h内快速增长,在24 h时OD600nm值为0.912。加入植物乳杆菌SCB2505代谢物浓度为0.5 MIC时,液化沙雷氏菌SCB2649菌株生长受到明显的抑制作用,相同时间的OD值明显低于对照组。加入代谢物浓度达到1.0 MIC时,液化沙雷氏菌SCB2649菌株生长完全被抑制,24 h内其OD600nm值没有变化。说明植物乳杆菌SCB2505代谢物浓度达到1.0 MIC时,在液体培养时也能够有效抑制液化沙雷氏菌SCB2649菌株生长繁殖。
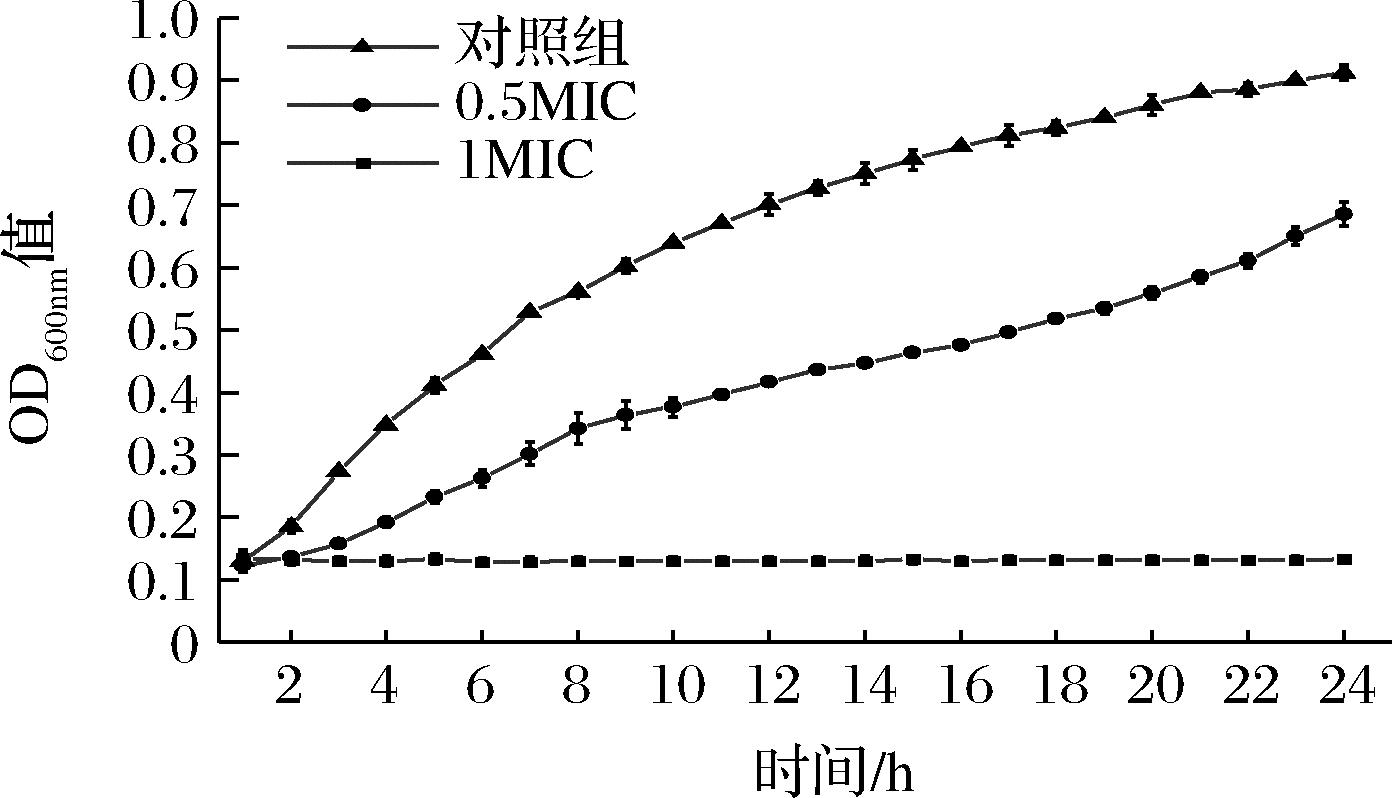
图1 SCB2505代谢物对液化沙雷氏菌SCB2649 菌株生长的影响
Fig.1 Effects of Lactobacillus plantarum SCB2505 metabolites on the growth of Serratia liquefaciens
2.3 SCB2505代谢物抑菌成分分析
2.3.1 热稳定性
如表2所示,经70 ℃处理20 min后,SCB2505代谢物对液化沙雷氏菌SCB2649菌株的抑菌效果与对照组相比无显著差异(P>0.05),而100 ℃和121 ℃处理后的代谢物抑菌效果显著下降(P<0.05),但相对抑菌活性仍有90%左右保留。说明植物乳杆菌SCB2505代谢物中抑菌活性物质具有较好的耐热性,但可能其中有部分抑菌物质对热较为敏感。
表2 高温处理对SCB2505代谢物抑菌活性的影响
Table 2 Antibacterial activity of Lactobacillus plantarum SCB2505 metabolites treated at different temperatures
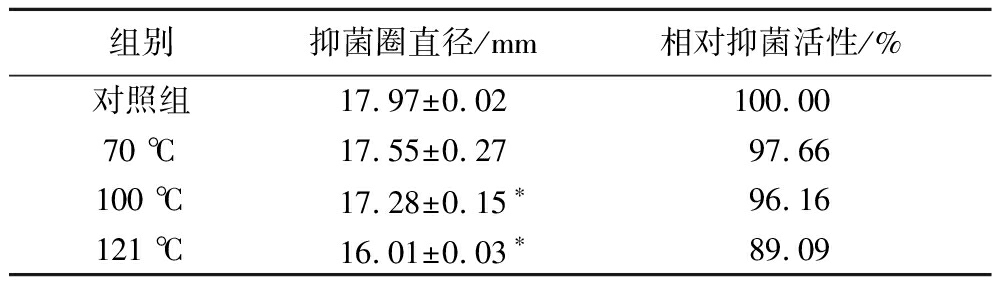
组别抑菌圈直径/mm相对抑菌活性/%对照组17.97±0.02100.0070 ℃17.55±0.2797.66100 ℃17.28±0.15∗96.16121 ℃16.01±0.03∗89.09
注:采用t检验分析实验组及对照组抑菌圈直径的显著性差异(P<0.05),以*表示。
2.3.2 酶敏感性
如图2所示,与对照组相比,植物乳杆菌代谢物经过胰蛋白酶、胃蛋白酶处理后抑菌圈直径显著下降(P<0.05),抑菌活性分别丧失了6.8%、4.93%。说明植物乳杆菌代谢物对液化沙雷氏菌SCB2649菌株具有抑菌活性的物质中,存在对蛋白酶敏感的抑菌物质,推测为蛋白或肽类物质,但蛋白酶处理后其相对抑菌活性仍>90%,说明起主要作用的可能是非蛋白类的其他物质。
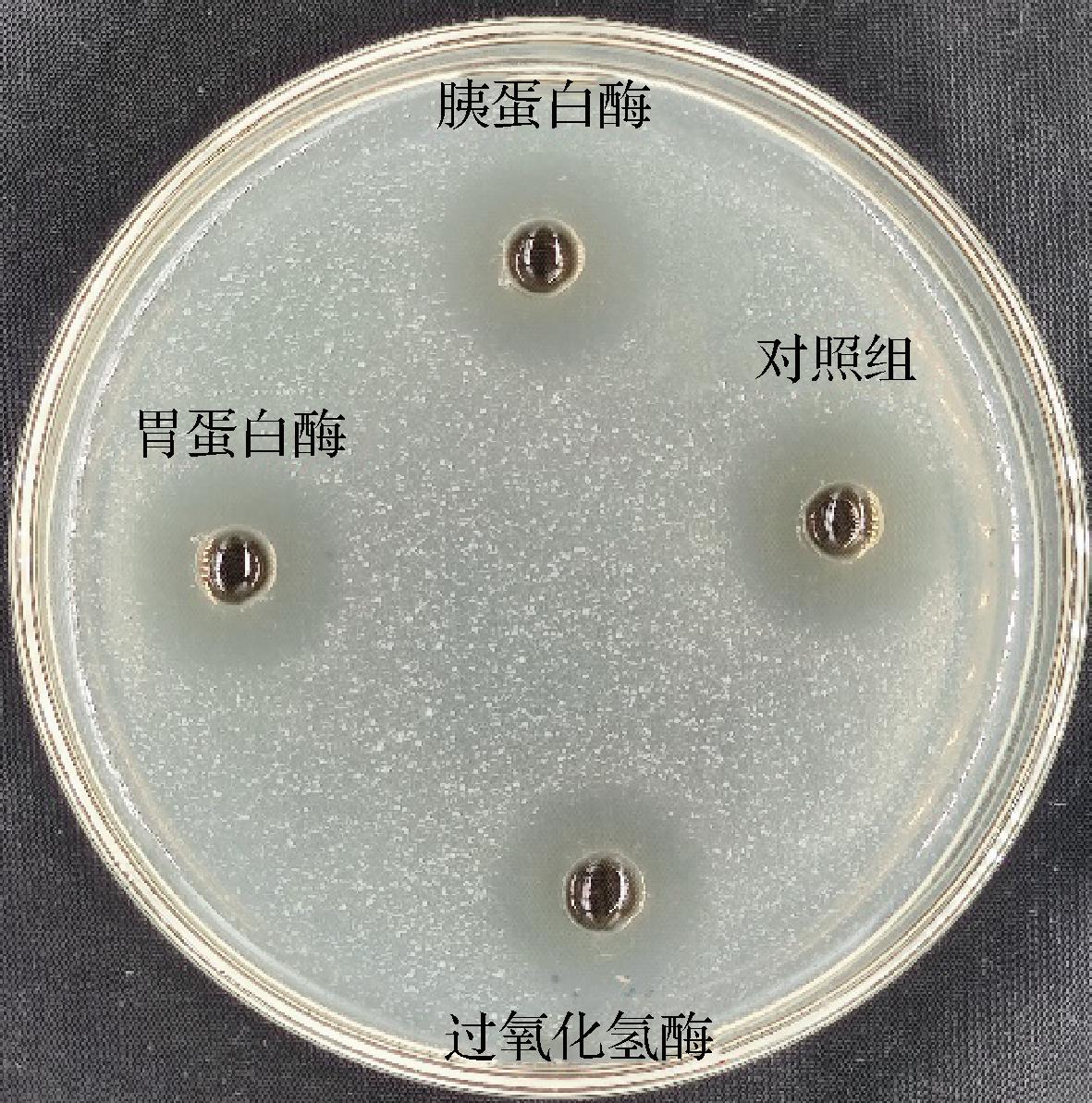
图2 酶处理对SCB2505代谢物抑菌活性的影响
Fig.2 Antibacterial activity of Lactobacillus plantarum SCB2505 metabolites treated at different enzymes
与对照组相比,SCB2505代谢物经过氧化氢酶处理后抑菌圈直径显著下降(P<0.05),抑菌活性丧失了6.16%,说明SCB2505代谢物对液化沙雷氏菌SCB2649菌株具有抑菌活性的物质中,存在过氧化氢,但过氧化氢酶处理后其相对抑菌活性仍>90%,说明其中含有过氧化氢,但该物质并非主要抑菌活性物质。可见,蛋白酶、过氧化氢酶均能影响SCB2505代谢物对指示菌的抑菌活性,但处理后相对抑菌活性均大于90%,由于蛋白类和过氧化氢对高温较为敏感,这可能是代谢物在热稳定性测试中抗菌活性部分丧失的原因。
2.3.3 pH敏感性
如表3所示,与不调节pH的代谢物(CK组)相比,将pH值调整为3.0时代谢物抑菌效果最强,且显著优于CK组(P<0.05),而pH值为5.0、7.0、9.0时,代谢物对液化沙雷氏菌SCB2649菌株均不显示抑菌能力。可见,pH对植物乳杆菌SCB2505代谢物的抑菌活性具有显著影响,且随着pH降低,抑菌活性上升,说明该菌株发酵过程中产生的有机酸在抑菌活性中发挥重要的作用,但有机酸和氢离子浓度在抑菌过程中发挥的作用还需要进一步验证。
表3 pH对植物乳杆菌SCB2505代谢物抑菌活性的影响
Table 3 Antibacterial activity of Lactobacillus plantarum SCB2505 metabolites treated with different pH
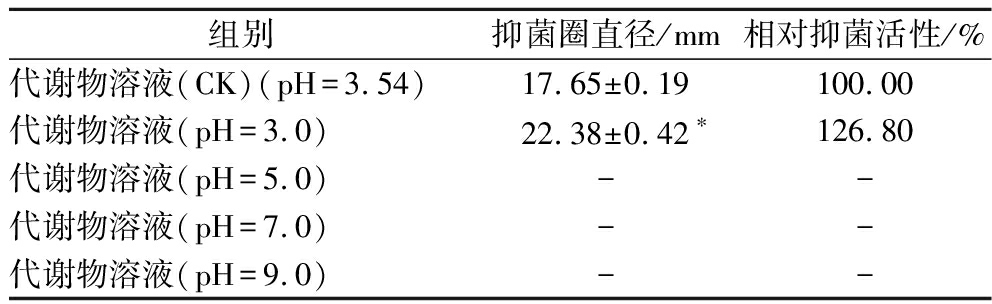
组别抑菌圈直径/mm相对抑菌活性/%代谢物溶液(CK)(pH=3.54)17.65±0.19100.00代谢物溶液(pH=3.0)22.38±0.42∗126.80代谢物溶液(pH=5.0)--代谢物溶液(pH=7.0)--代谢物溶液(pH=9.0)--
注:采用t检验分析实验组及对照组抑菌效果的显著性差异(P<0.05),以*表示;“-”表示没有出现抑菌圈。
2.3.4 乳酸验证试验
由表4可知,植物乳杆菌SCB2505代谢物具有较好的抑菌活性,抑菌圈直径达到(18.75±0.11) mm(A)。MRS液体培养基(E)不具有抑菌活性,但用乳酸将MRS调至与A组相同的pH(B)时,抑菌圈直径达到(15.37±0.24) mm,其抑菌活性大大提高,与对照组(A)比较相对抑菌活性为81.97%。但是,与A组(植物乳杆菌SCB2505代谢物组)相同pH的乳酸水溶液(C)不具有抑菌圈,而添加与B组相同乳酸添加量的水溶液(D)抑菌圈直径达到(14.73±0.37) mm,与B组不具有显著性差异(P>0.05)。由此可见,在中酸性环境下,氢离子浓度(即pH值)并不是影响代谢物抑菌活性的主要原因,其抑菌活性主要是乳酸所起的作用。在相同pH值下,低浓度的乳酸水溶液不具有抑菌活性,而在MRS体系中,由于乳酸与MRS中的缓冲物质中和,导致乳酸根离子累积,随着pH下降,氢离子与乳酸根离子反应形成未解离的乳酸,乳酸浓度超过阈值,从而使其产生抑菌活性[19]。据报道,未解离的乳酸具有亲脂性,能过穿过细胞膜,在细菌内释放氢离子,降低细菌内pH值,进而影响细菌的生长速度[20]。此外,乳酸还可以通过破坏酶、抑制蛋白质合成、中断营养吸收、破坏细胞壁和细胞膜的亚结构和功能来影响细胞代谢,破坏细胞生长[21]。
表4 不同情况下乳酸对指示菌抑菌效果对比实验结果图
Table 4 Inhibition zone experiment of Lactobacillus plantarum SCB2505 metabolites treated with different methods
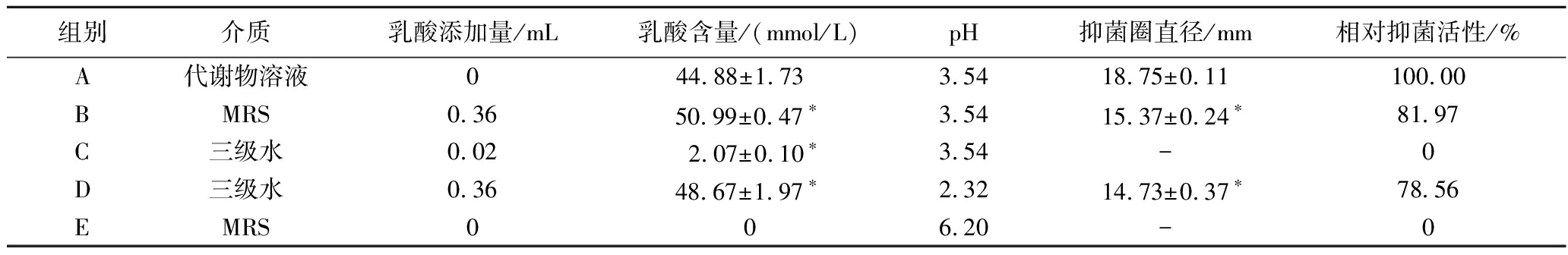
组别介质乳酸添加量/mL乳酸含量/(mmol/L)pH抑菌圈直径/mm相对抑菌活性/%A代谢物溶液044.88±1.73 3.5418.75±0.11100.00BMRS0.3650.99±0.47∗3.5415.37±0.24∗81.97C三级水0.02 2.07±0.10∗3.54-0D三级水0.3648.67±1.97∗2.3214.73±0.37∗78.56EMRS006.20-0
注:A-未处理的代谢物溶液(pH=3.54);B-乳酸处理的MRS;C-乳酸溶液(pH=3.54);D-与B等量乳酸的水溶液(pH=2.32);E-未处理的MRS;采用t检验分析实验组与对照组(A)的显著性差异(P<0.05),以*表示,“-”表示没有出现抑菌圈。
结合2.3节对抑菌物质的分析,推测植物乳杆菌代谢物中的乳酸为主要抑菌物质,过氧化氢、细菌素则发挥协同作用,且其需要在酸性(pH<5.0)的条件下才能发挥抑菌活性。
2.4 SCB2505代谢物对液化沙雷氏菌SCB2649菌株生物被膜的影响
生物被膜是由细菌或真菌分泌的一层能包裹自身群落的外膜,由胞外聚合物组成[22]。其成分复杂,能够保护膜内菌体抵御外界环境变化及一些抗生素的作用,具有很强的耐受性[17,23]。如图3所示,当代谢物浓度在0.5 MIC时,抑制率为17.29%;浓度在1.0 MIC时,抑制率为68.50%,与0.5 MIC组相比,生物被膜抑制效果明显上升(P<0.05),代谢物浓度上升到2.0 MIC时,抑制率上升至为74.00%,但与1.0 MIC相比差异不显著(P>0.05)。说明植物乳杆菌SCB2505代谢物能够抑制指示菌生物被膜生成,且呈现一定的梯度依赖关系,但代谢物浓度上升到1.0 MIC后,抑菌效果基本不变。

图3 SCB2505代谢物对液化沙雷氏菌SCB2649 菌株生物被膜的影响
Fig.3 Effects of Lactobacillus plantarum SCB2505 metabolites on Serratia liquefaciens SCB2649 biofilm
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.5 SCB2505代谢物对液化沙雷氏菌SCB2649菌株细胞壁完整性的影响
AKP是一种位于细菌细胞壁和细胞膜之间的酶[24]。当细胞壁完整性被破坏时,AKP就会渗出细胞外,因此可以通过测定菌悬液中的AKP活力来反映细菌细胞壁的完整性[25]。如图4所示,液化沙雷氏菌SCB2649菌株在正常情况下,AKP活力在0.24金氏单位/100 mL。分别经0.5、1.0、2.0 MIC SCB2505代谢物处理后,菌悬液中的AKP活力上升至0.504、0.686、0.944金氏单位/100 mL(P<0.05)。可见,随着代谢物浓度上升,细胞壁通透性增加,细胞壁的完整性已被破坏,导致AKP向胞外泄露越多,并呈现明显的梯度依赖关系。革兰氏阴性菌细胞壁中的脂多糖是细胞壁的重要成分,能够控制细菌的营养吸收,抵抗外界有害刺激,维持细菌内环境稳定[26]。研究发现,乳酸等有机酸能降解脂多糖,从而破坏细胞壁[27]。因此推测代谢物中的乳酸作用于液化沙雷氏菌的细胞壁,使得细胞壁完整性被破坏,导致胞外AKP活力上升,此推测与2.3节中代谢物主要抑菌物质为乳酸的论述相符。
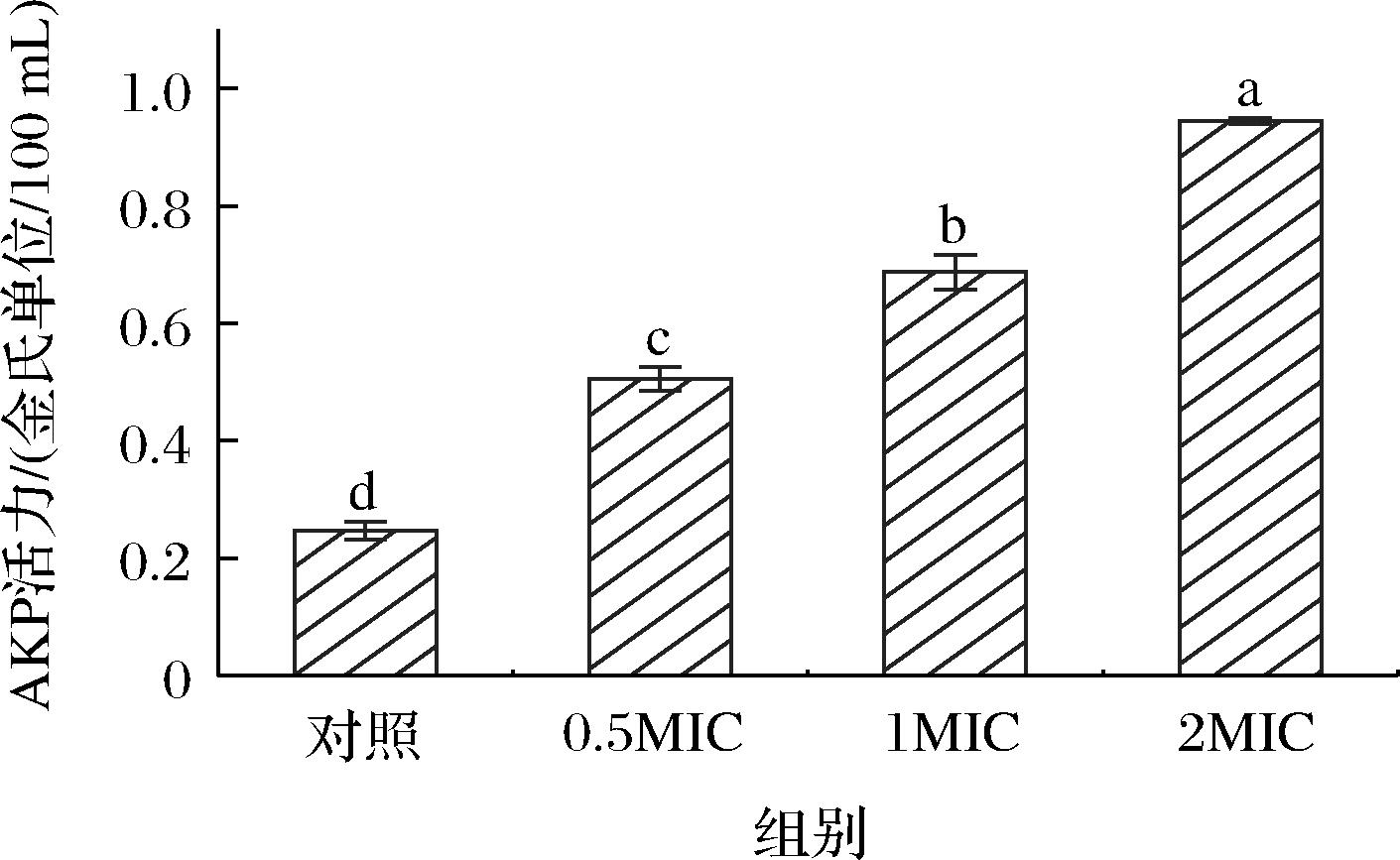
图4 植物乳杆菌SCB2505代谢物对液化沙雷氏菌 SCB2649菌株AKP活力的影响
Fig.4 Effects of Lactobacillus plantarum SCB2505 metabolites on AKPase activity of Serratia liquefaciens SCB2649
2.6 SCB2505代谢物对液化沙雷氏菌细胞膜完整性的影响
PI是一种膜不透性的荧光染料。当细胞膜的完整性被破坏时,PI能够进入细胞与遗传物质结合,发出红色荧光[28]。因此能够通过荧光显微镜检测PI荧光反映细胞膜的完整性。如图5所示,PI染色后对照组基本无可观测的荧光,0.5 MIC代谢物处理4 h的液化沙雷氏菌组发出零星的红色荧光,而随着代谢物质量浓度升高,红色荧光逐渐增强。当质量浓度为2.0 MIC时,观察到大量的红色荧光,说明经过SCB2505代谢物处理后,液化沙雷氏菌的细胞膜被破坏,导致大量PI进入细胞与遗传物质结合,发出红色荧光。PENG等[6]研究发现,植物乳杆菌细菌素能够透化细胞膜,促进细胞膜形成孔洞,使得细胞膜破损以杀死细菌。此外,LINLEY等[29]认为,过氧化氢能够氧化细胞膜的脂质和蛋白质,导致膜结构和功能受损。而乳酸具有亲脂性,能够透过细胞膜进入细菌体内,影响细菌正常代谢,从而影响细胞膜的合成。推测随着代谢物浓度增加,液化沙雷氏菌的细胞壁完整性被破坏,植物乳杆菌SCB2505代谢物中的抑菌物质更好地与液化沙雷氏菌的细胞膜进行作用,最终破坏细胞膜完整性,增大细胞膜通透性。这些能够进一步说明SCB2505代谢物能够破坏细胞膜完整性,进而起到抑菌作用。
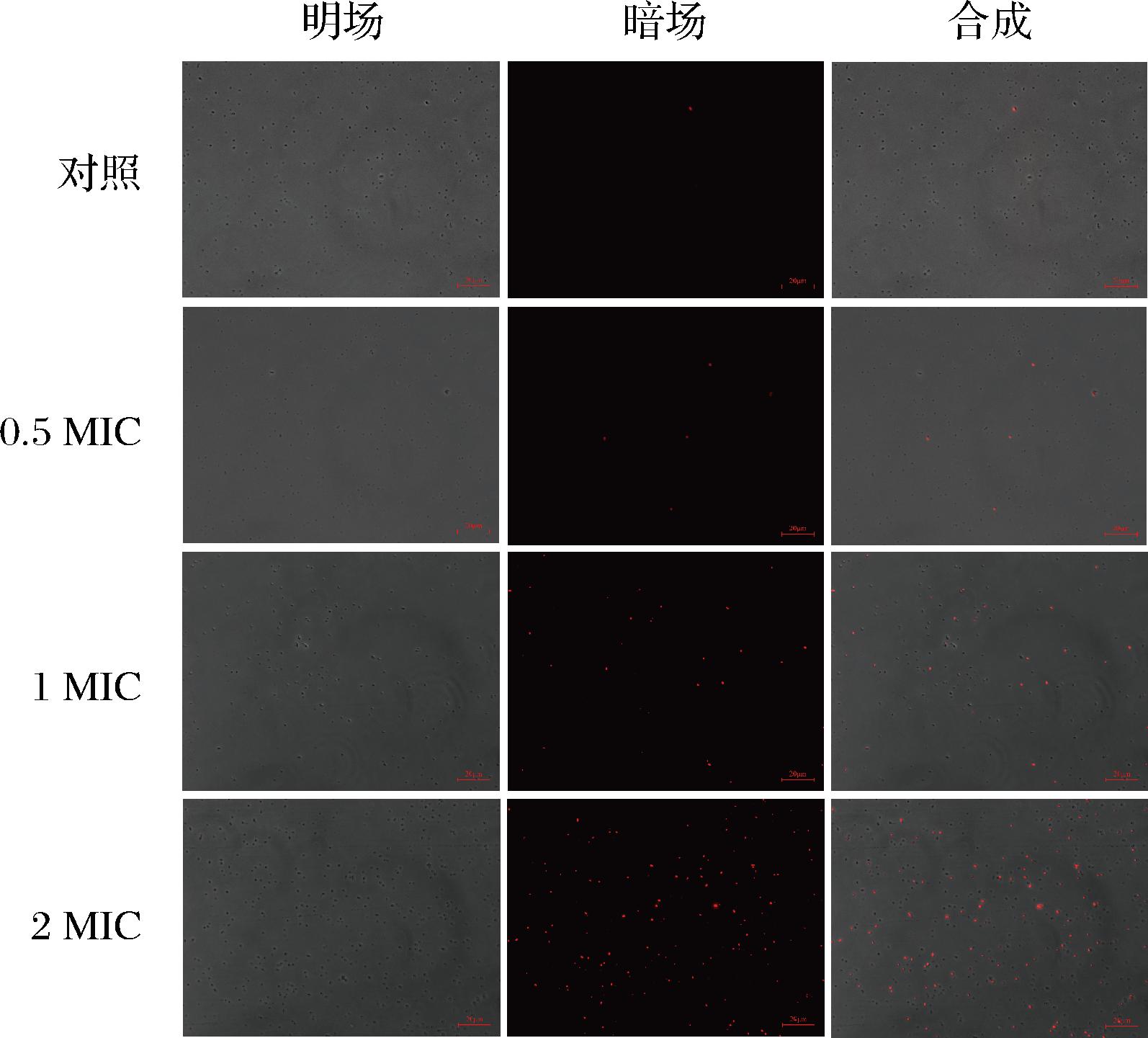
图5 不同代谢物浓度对液化沙雷氏菌SCB2649菌株 细胞膜完整性的影响(荧光显微镜图)
Fig.5 Effects of Lactobacillus plantarum SCB2505 metabolites on cell membrane integrity of Serratia liquefaciens SCB2649 observed by fluorescence microscopy
2.7 植物乳杆菌SCB2505代谢物对液化沙雷氏菌细胞形态的影响
用代谢物处理10 h后的液化沙雷氏菌SCB2649菌株菌体形态如图6所示。对照组(图6-a)菌体形态呈短杆状,表面相对完整,没有明显皱纹和裂纹;经过0.5 MIC代谢物处理后,菌体表面相比对照组略显粗糙(图6-b)。而经过1.0 MIC代谢物处理后,菌体表面褶皱萎缩,凹陷(图6-c),而2.0 MIC处理组菌体与1 MIC处理组相比,其菌体萎缩、干瘪更为明显,部分菌体被溶解(图6-d)。
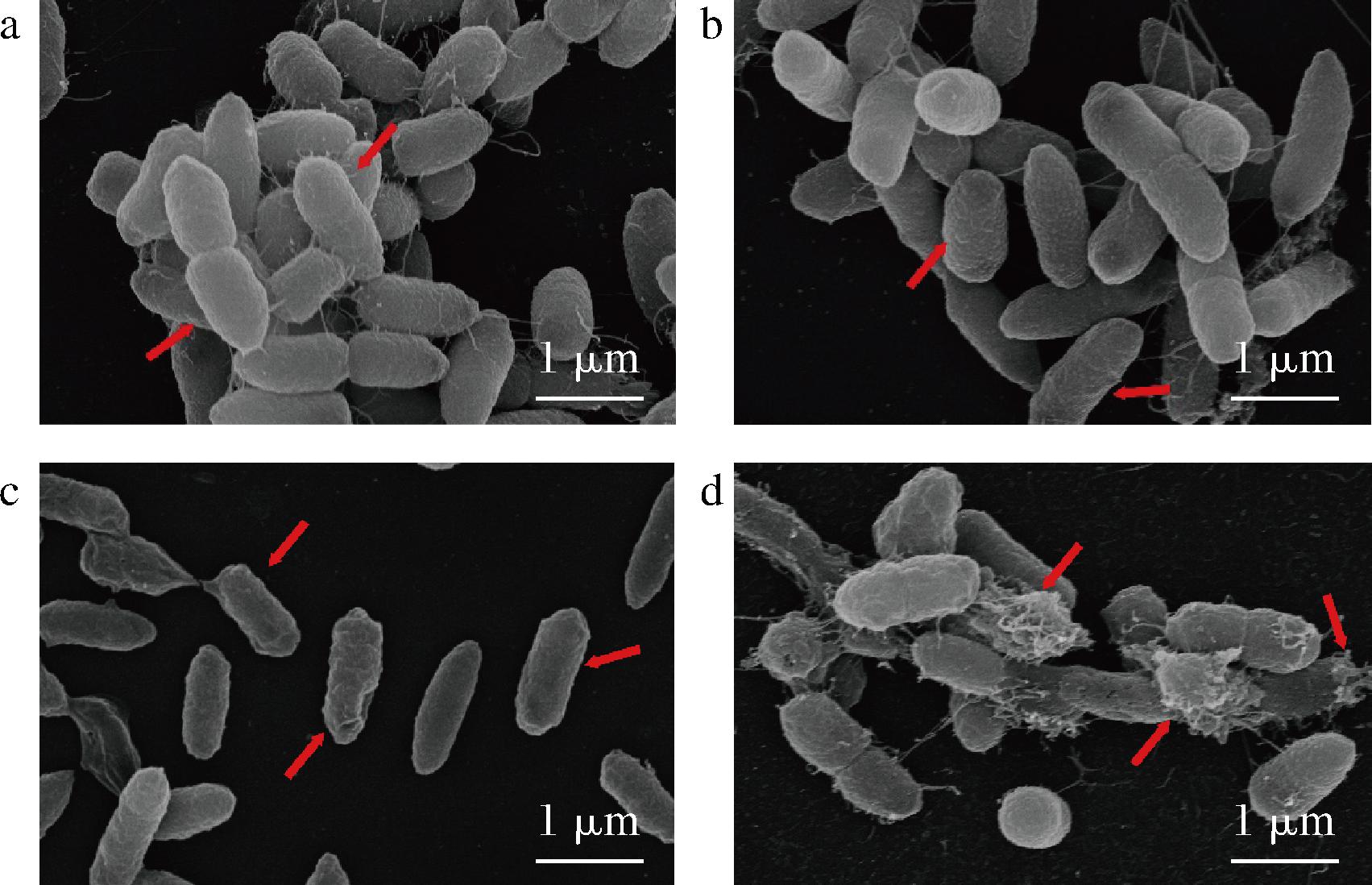
a-对照组;b-0.5 MIC代谢物处理组;c-1.0 MIC代谢物处理组; d-2.0 MIC代谢物处理组
图6 植物乳杆菌SCB2505代谢物对指示菌表面 超显微结构的影响
Fig.6 Effects of Lactobacillus plantarum SCB2505 metabolites on the ultramicrostructure of indicator bacteria
植物乳杆菌SCB2505代谢物浓度较低时,乳酸等有机酸进入液化沙雷氏菌SCB2649菌株,初步解离细胞壁,细菌表面从光滑变得粗糙。而随着代谢物浓度的上升,细胞壁破坏性加深,代谢物中的细菌素、过氧化氢、乳酸进一步破坏细胞膜完整性,细胞内容物渗出导致菌体表面出现凹陷和皱缩的现象发生。表明SCB2505代谢物可以破坏液化沙雷氏菌的细胞壁与细胞膜的完整性,导致胞内物质外泄,菌体皱缩。此结论与上述细胞壁、细胞膜完整性实验结果一致。
3 结论
植物乳杆菌SCB2505代谢物对液化沙雷氏菌SCB2649菌株具有较好的抑菌活性,乳酸浓度、过氧化氢酶和蛋白酶对于其抑菌活性均具有显著影响,推测抑菌物质是乳酸、细菌素与过氧化氢的复合物。植物乳杆菌SCB2505代谢物通过抑制液化沙雷氏菌生物被膜的合成,破坏其细胞壁和细胞膜的完整性,增加膜的通透性,使胞内物渗出,菌体表面逐渐凹陷皱缩,甚至裂解死亡。但目前的研究没有深入探究植物乳杆菌SCB2505代谢物的物质组成,也无法解释代谢物中有效抑菌成分对于液化沙雷氏菌SCB2649菌株的深层控制机制,后续研究将采用色谱和组学方法,从分子层面探究植物乳杆菌SCB2505代谢物的物质组成和有效抑菌成分,并进一步阐明植物乳杆菌SCB2505代谢物对液化沙雷氏菌的抑菌机制。
[1] 伊婷, 乔家运, 李玉鹏, 等.植物乳杆菌对小鼠体重、炎症反应及肠道健康的影响[J].动物营养学报, 2023, 35(4):2668-2676. YI T, QIAO J Y, LI Y P, et al.Effects of Lactobacillus plantarum on body weight, inflammatory response and intestinal health of mice[J].Chinese Journal of Animal Nutrition, 2023, 35(4):2668-2676.
[2] MAO Y, ZHANG X J, XU Z H.Identification of antibacterial substances of Lactobacillus plantarum DY-6 for bacteriostatic action[J].Food Science &Nutrition, 2020, 8(6):2854-2863.
[3] SJÖGREN J, MAGNUSSON J, BROBERG A, et al.Antifungal 3-hydroxy fatty acids from Lactobacillus plantarum MiLAB14[J].Applied and Environmental Microbiology, 2003, 69(12):7554-7557.
[4] 高兆建, 黄亮浩, 丁飞鸿, 等.源自泡菜的植物乳杆菌产新型广谱抑菌细菌素的特性分析[J].食品科学, 2021, 42(10):171-177. GAO Z J, HUANG L H, DING F H, et al.Characterization of novel broad-spectrum bacteriocin produced by Lactobacillus plantarum from pickles[J].Food Science, 2021, 42(10):171-177.
[5] WANG D, LIU Y F, LI X P, et al.Unraveling the antibacterial mechanism of Lactiplantibacillus plantarum MY2 cell-free supernatants against Aeromonas hydrophila ST3 and potential application in raw tuna[J].Food Control, 2023, 145:109512.
[6] PENG S D, SONG J J, ZENG W Y, et al.A broad-spectrum novel bacteriocin produced by Lactobacillus plantarum SHY 21-2 from yak yogurt:Purification, antimicrobial characteristics and antibacterial mechanism[J].LWT, 2021, 142:110955.
[7] LV X R, LIN Y, JIE Y, et al.Purification, characterization, and action mechanism of plantaricin DL3, a novel bacteriocin against Pseudomonas aeruginosa produced by Lactobacillus plantarum DL3 from Chinese Suan-Tsai[J].European Food Research &Technology, 2018, 244(2):323-331.
[8] 骆业巧, 司波.低温保存肉制品中液化沙雷氏菌的分离鉴定与耐药性分析[J].食品安全质量检测学报, 2019, 10(18):6119-6123. LUO Y Q, SI B.Isolation, identification and drug resistance analysis of Serratia liquefaciens in low-temperature preserved meat products[J].Journal of Food Safety &Quality, 2019, 10(18):6119-6123.
[9] 王文静, 韩月杰, 王立钊.低温肉制品微生物污染风险及防控关键技术[J].当代畜禽养殖业, 2018(11):40. WANG W J, HAN Y J, WANG L Z.Risk of microbial contamination of low temperature meat products and key technologies for prevention and control[J].Modern Animal Husbandry, 2018(11):40.
[10] MACHADO S G, DA SILVA F L, BAZZOLLI D M S, et al. Pseudomonas spp. and Serratia liquefaciens as predominant spoilers in cold raw milk[J].Journal of Food Science, 2015, 80(8):M1842-M1849.
[11] SALGADO C A, BAGLINI RE F, VANETTI M C D.Spoilage potential of a heat-stable lipase produced by Serratia liquefaciens isolated from cold raw milk[J].LWT, 2020, 126:109289.
RE F, VANETTI M C D.Spoilage potential of a heat-stable lipase produced by Serratia liquefaciens isolated from cold raw milk[J].LWT, 2020, 126:109289.
[12] MACHADO S G, HEYNDRICKX M, DE BLOCK J, et al.Identification and characterization of a heat-resistant protease from Serratia liquefaciens isolated from Brazilian cold raw milk[J].International Journal of Food Microbiology, 2016, 222:65-71.
[13] WANG G Y, WANG H H, HAN Y W, et al.Evaluation of the spoilage potential of bacteria isolated from chilled chicken in vitro and in situ[J].Food Microbiology, 2017, 63:139-146.
[14] MATAMOROS S, PILET M F, GIGOUT F, et al.Selection and evaluation of seafood-borne psychrotrophic lactic acid bacteria as inhibitors of pathogenic and spoilage bacteria[J].Food Microbiology, 2009, 26(6):638-644.
[15] 周倩倩, 方士元, 梅俊, 等.丁香酚对腐败希瓦氏菌和荧光假单胞菌的抑制机理[J].食品科学, 2020, 41(9):1-6. ZHOU Q Q, FANG S Y, MEI J, et al.Inhibitory mechanism of eugenol on Shewanella putrefaciens and Pseudomonas fluorescens[J].Food Science, 2020, 41(9):1-6.
[16] 石超. 柠檬醛对阪崎克罗诺肠杆菌抑菌和抗感染作用及其分子机制[D].杨凌:西北农林科技大学食品科学, 2017. SHI C.The antimicrobial activity and antiinfection effect against Cronobacter sakazakii of citral and mechanisms of action[D].Yangling:西北农林科技大学食品科学, 2017.
[17] 王琳, 李宇轩, 刘国荣, 等.金银花和蒲公英提取物对肉源性假单胞菌生物被膜的清除作用[J].食品工业科技, 2020, 41(12):106-111,120. WANG L, LI Y X, LIU G R, et al.Scavenging effect of honeysuckle and dandelion extracts on the biofilm of Pseudomonas Stains from meat[J].Science and Technology of Food Industry, 2020, 41(12):106-111,120.
[18] 苏晓丹. 花椒精油和丁香精油的抑菌作用及对火腿防腐作用研究[D].太原:山西师范大学, 2019. SU X D.Study on antibacterial effect of essential oil from pepper and clove and antiseptic effect on ham[D].Taiyuan:Shanxi Normal University, 2019.
[19] 陆振鑫, FRANK, SYSTERMANS.乳酸盐在肉制品中延长货架期和抑制致病菌的作用[J].中国食品添加剂, 2000(2):22-25. LU Z X, FRANK, SYSTERMANS.Lactates extend shelf-life of meat products and control their pathogens[J].China Food Additives, 2000(2):22-25.
[20] GAO Z H, DALIRI E B M, WANG J, et al.Inhibitory effect of lactic acid bacteria on foodborne pathogens:A review[J].Journal of Food Protection, 2019, 82(3):441-453.
[21] WANG C J, CHANG T, YANG H, et al.Antibacterial mechanism of lactic acid on physiological and morphological properties of Salmonella enteritidis, Escherichia coli and Listeria monocytogenes[J].Food Control, 2015, 47:231-236.
[22] 肖梦圆, 武瑞赟, 谭春明, 等.群体感应系统及其抑制剂对细菌生物被膜调控的研究进展[J].食品科学, 2020, 41(13):227-234. XIAO M Y, WU R Y, TAN C M, et al.Recent advances in understanding the role of quorum sensing system and quorum sensing inhibitors in regulating bacterial biofilm formation[J].Food Science, 2020, 41(13):227-234.
[23] RODRIGUES A C, ALMEIDA F A, ANDRÉ C, et al.Phenolic extract of Eugenia uniflora L.and furanone reduce biofilm formation by Serratia liquefaciens and increase its susceptibility to antimicrobials[J].Biofouling, 2020, 36(9):1031-1048.
[24] HAN Y J, CHEN W X, SUN Z C.Antimicrobial activity and mechanism of limonene against Staphylococcus aureus[J].Journal of Food Safety, 2021, 41(5):e12918.
[25] SUN Z L, ZHANG X X, WU H H, et al.Antibacterial activity and action mode of chlorogenic acid against Salmonella enteritidis, a foodborne pathogen in chilled fresh chicken[J].World Journal of Microbiology and Biotechnology, 2020, 36(2):24.
[26] ZHANG G, MEREDITH T C, KAHNE D.On the essentiality of lipopolysaccharide to gram-negative bacteria[J].Current Opinion in Microbiology, 2013, 16(6):779-785.
[27] ALAKOMI H L, SKYTT E, SAARELA M, et al.Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane[J].Applied and Environmental Microbiology, 2000, 66(5):2001-2005.
E, SAARELA M, et al.Lactic acid permeabilizes gram-negative bacteria by disrupting the outer membrane[J].Applied and Environmental Microbiology, 2000, 66(5):2001-2005.
[28] 窦勇, 姚妙爱, 闾怀中, 等.冷等离子体对单核增生李斯特菌的杀菌机理[J].中国农业科学, 2020, 53(24):5104-5114. DOU Y, YAO M A, LYU H Z, et al.Antibacterial mechanism of cold plasma against Listeria monocytogenes[J].Scientia Agricultura Sinica, 2020, 53(24):5104-5114.
[29] LINLEY E, DENYER S P, MCDONNELL G, et al.Use of hydrogen peroxide as a biocide:New consideration of its mechanisms of biocidal action[J].The Journal of Antimicrobial Chemotherapy, 2012, 67(7):1589-1596.