木瓜蛋白酶(papain,PAP)是从番木瓜中提取到的水解酶,不但广泛应用于食品加工行业,如:对肉质品嫩化、提升啤酒清澈度、改善豆类食品口感等,在医药、美容、皮革等领域也是重要的工业酶[1-4]。游离PAP重复使用受限制,酸、碱、热和贮存稳定性较差,设计一种绿色环保、成本低廉的固定化方法具有现实意义。磁性纳米颗粒是维度在1~100 nm的超细颗粒,Fe3O4纳米颗粒具有易于磁分离和功能化修饰、较强亲和力、低毒性、超顺磁性、制作工艺简单且成本低等特性,广泛应用于固定化酶、靶向给药、造影剂、细菌检测等生物医药的研究领域[5-9]。单体甲基丙烯酸甲酯(methylmethacrylate, MMA)聚合后的聚甲基丙烯酸甲酯(poly methylmethacrylate,PMMA)环保无毒,具有良好的耐热性和稳定性,PMMA与纳米颗粒反应后能产生性能更好的复合材料[10]。戊二醛(glutaraldehyde,GA)作为交联剂常用来固定酶或细胞,交联密度可调控,强化交联稳定性的同时构建三维亲水网络结构[11-12]。聚乙烯亚胺(polyethyleneimine, PEI)是乙烯亚胺聚合产生的水溶性聚合物,带有丰富的正电基团而具有高吸附性能,可显著提高酶的活性和稳定性[13-14]。
本研究为实现PAP在磁性纳米微球上的可控固定化,设计了一种既能保持酶的空间结构又易于通过磁分离能重复使用的载体,该载体能通过接枝不同分子质量PEI实现固载量调控。过程如下:a)首先通过悬浮聚合法在磁性微球Fe3O4表面均匀地包覆PMMA,制备核-壳结构的磁性Fe3O4纳米粒子,标记为Fe3O4@PMMA,Fe3O4表面包覆PMMA一方面能有效避免反应过程中对微球表面的损伤腐蚀等破坏,另一方面能使Fe3O4@PMMA表面酯解形成羧基,可接枝不同分子量PEI(600/1 800/70 000)作为空间臂;b)将PAP物理吸附在PEI长链上,以GA为交联剂,构筑具有磁响应且表面富含氨基的亲水性三维立体空间结构的固定化载体Fe3O4@PMMA-PEI,能最大限度保护酶构象动态变化以保持其催化活力,同时又能将酶牢固的封装在三维立体结构之中,实现对PAP的固定化。
纳米磁球对PAP的固载量可通过接枝PEI的分子质量进行调控。选用Fe3O4@PMMA-PEI 1800为固定化载体,分析评价Fe3O4@PMMA-PEI 1800的微观形貌和结构特征,对固定化酶Fe3O4@PMMA-PEI 1800-PAP的酶学性质初步表征,研究结果证明,以Fe3O4为磁核的Fe3O4@PMMA纳米磁球,表面接枝PEI 1800后通过GA交联构建分子笼效应的载体能对PAP有效固定,为固定化PAP的研究和应用提供实验依据。
1 材料与方法
1.1 实验材料
FeSO4·7H2O、偶氮二异丁腈、GA、氯化钠、85%磷酸、上海麦克林生化科技有限公司;FeCl3 6H2O,油酸,无水乙醇,MMA、聚乙烯醇(醇解度:98%~99% mol/mol)、酚酞、N-羟基琥珀酰亚胺、PEI(分子量分别为600、1 800、70 000)、牛血清蛋白、PAP(≥2 000 units/mg),阿拉丁试剂有限公司;氨水、盐酸、二乙烯基苯、磷酸二氢钠、磷酸氢二钠,国药集团化学试剂有限公司;实验用水为去离子水。
1.2 仪器与设备
SU8010型扫描电子显微镜(scanning electron microscope,SEM),日本株式会社日立制作所(HITACHI);TESNSORⅡ型傅里叶变换红外光谱仪,德国Bruker公司;ASAP 2420型快速比表面积和孔隙率仪,美国麦克默瑞提克;D2F-6050型真空干燥箱,上海精宏实验设备有限公司;HZ9310K型摇床,华利达实验设备有限公司;UV5500PC型紫外可见光光度计,上海元析仪器有限公司;KQ-600KDE型超声波清洗器,昆山市超声仪器有限公司;WP-UP-GX-80型超纯水机,四川沃尔科技有限责任公司;DF-101S恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;BSA124S型电子天平,赛多利斯科学仪器有限公司。
1.3 实验方法
1.3.1 固定化酶Fe3O4@PMMA-PEI 1800-PAP的制备
参考文献[15],通过化学共沉淀法制作Fe3O4磁性粒子,以Fe3O4为磁核心制备Fe3O4@PMMA[16],接着进行以下步骤:a)对微球表面PMMA酯解和活化;b)微球表面接枝PEI(600/1 800/70 000):称取40 mg酯解活化后的磁性微球,向其中加入1%(1 g/100 mL)不同分子量的PEI水溶液2 mL,在摇床中设置温度25 ℃、转速160 r/min的条件下反应4 h,反应结束用磁铁使沉淀析出,蒸馏水反复洗涤,50 ℃真空干燥备用,根据PEI分子量分别标记为:Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000。
称取20 mg的Fe3O4@PMMA-PEI 600、Fe3O4@PMMA-PEI 1800、Fe3O4@PMMA-PEI 70000,分别添加2 mL 1.5 mg/mL PAP(pH 7.0,0.1 mol/L的PBS缓冲液配制),置于摇床中110 r/min、30 ℃下振荡4 h至吸附平衡,随后向试管中加入2 mL GA溶液(移取4 mL 25%的GA,加入96 mL pH 7.0的0.20 mmol/L磷酸盐缓冲液,配制为1%的溶液,稀释至0.02 %备用),110 r/min交联反应30 min,结束后利用磁分离将上清液和固定化酶分开,缓冲液洗涤沉淀3次,收集上清液和洗涤的缓冲液。将上清液和洗涤液按一定比例稀释,用Bradford法测定上清液和洗涤液中PAP浓度,计算PAP固载量和解吸率[17]。
1.3.2 磁性微球的性质表征
1.3.2.1 固定化情况及化学性质
参考文献[16],采用化学滴定法,测定磁性微球表面的羧基和氨基含量。
1.3.2.2 SEM分析
采用SU8010型发射扫描电子显微镜观察纳米磁球微观形貌。
1.3.2.3 X射线衍射表征(X-ray diffraction,XRD)
以Cu-Ka为辐射源,管压40 kv,电流30 mA,扫描速度2°/min,扫描范围2θ为5°~90°。
1.3.2.4 热重分析测定(thermogravimetric,TG)
称量10 mg磁性微球,使用美国沃特斯SDT650热重分析仪进行热重分析。在N2气氛下,设定起止温度25 ℃,终止温度800 ℃,升温速率10 ℃/min,吹扫气流速20 mL/min。
1.3.2.5 比表面积与孔隙测定
将适量Fe3O4@PMMA-PEI 1800微球样品置于50 ℃真空干燥箱中干燥2 h后放入样品管内,50 ℃下进行脱气8 h。在77.35 K液氮环境、N2气氛下进行全孔分析,绘制样品在N2气氛下的吸附-脱附等温线,计算样品比表面积。
1.3.3 酶学性质研究
1.3.3.1 蛋白质浓度测定
采用Bradford法测定,以牛血清蛋白为标准,得到标准曲线方程:y=1.803 7x-0.02 60,R2=0.999 4。根据标准曲线可计算出样品中蛋白质含量[17]。
1.3.3.2 酶活力测定
酶活力定义:在测定条件下(pH 7.0,37 ℃),1 min内PAP催化酪蛋白水解生成1 μg酪氨酸所需要的酶量为一个酶活力单位(U)。参考文献[18-19],绘制L-酪氨酸标准曲线,y=129.63x-0.339 9,R2=0.999 3,计算酶活力。相对酶活力是指某一条件时酶的活力与相同反应条件下最大酶活力的比值。
1.3.3.3 温度对游离酶与固定化酶的影响
取1.5 mg/mL游离PAP (pH 7.0磷酸盐缓冲液配制) 0.2 mL,和等当量的Fe3O4@PMMA-PEI 1800-PAP样品,分别在20~90 ℃条件下,每间隔10 ℃作为一组进行测定,按照文献[19-21]酶活力的测定方法进行反应,分别将未经处理过的游离PAP和Fe3O4@PMMA-PEI 1800-PAP的酶活力作为100%。
1.3.3.4 游离酶与固定化酶的热稳定性比较
取1.5 mg/mL游离PAP (pH 7.0磷酸盐缓冲液配置) 0.2 mL,和等当量的Fe3O4@PMMA-PEI 1800-PAP样品,分别在20~90 ℃条件下保温2 h,温育结束后按照上述酶活力的测定方法进行反应,分别将未经保温处理过的游离PAP和Fe3O4@PMMA-PEI 1800-PAP的酶活力作为100%。
1.3.3.5 pH对游离酶与固定化酶酶活力的影响
取1.5 mg/mL游离PAP(pH 7.0磷酸盐缓冲液配制) 0.2 mL,和等当量的Fe3O4@PMMA-PEI 1800-PAP样品,分别在pH 5.0~11.0反应,将未经处理过的游离PAP和Fe3O4@PMMA-PEI 1800-PAP的酶活力作为100%。
1.3.3.6 固定化酶操作稳定性
称取20 mg Fe3O4@PMMA-PEI 1800-PAP,根据固载量计算酶的等当量。用3 mL、1 mol/L的NaCl磷酸缓冲溶液(pH 7.0)对其进行振荡洗脱,以35 ℃、110 r/min振荡洗脱4 h。振荡洗脱结束后将上清液按照一定比例稀释,每次洗脱后测定Fe3O4@PMMA-PEI 1800-PAP酶活力,共测7次。将第一次测定的酶活力设为100%,其余数据以相对酶活力表示。
1.4 数据处理
实验数据使用Excel 2013、Design Expert 8.0、SPSS 23软件计算差异显著性和相关性并绘图。
2 结果与分析
2.1 性质表征
2.1.1 纳米磁球对PAP的固定情况
如表1所示,Fe3O4@PMMA-PEI对PAP的固载量与Fe3O4@PMMA相比显著提高,与PEI特殊的长链结构有关。
表1 纳米磁球对PAP的固定情况
Table 1 The immobilization of PAP nano-magnetic

试样微球类型固载量/(mg/g)PAPFe3O4@PMMA31.65Fe3O4@PMMA-PEI 600107.46Fe3O4@PMMA-PEI 1800139.80Fe3O4@PMMA-PEI 70000100.19
PEI长链上富含氨基,柔软的长链结构和良好的亲水性将酶吸附并包裹在聚合链中,交联剂GA的醛基与PEI长链上的氨基反应促进交联网状结构形成,使得酶以立体结构包裹在聚合链中,能维持酶舒展的状态;LEE等[22]通过GA对脂肪酶-Cu2+杂化纳米酶交联后测定其活性,证明GA交联非但不影响酶的空间构象和形态,还能增强重复使用性。立体网状结构聚合链位于纳米磁球的外表面,将酶包裹起来防止脱落的同时也可预防空间位阻对酶活力的影响[16]。PAP在Fe3O4@PMMA-PEI 1800上的固载量最大,过长的PEI分子链容易容易发生缠绕。测定Fe3O4@PMMA-PEI 1800表面的基团含量,氨基含量0.33 mmol/g,羧基含量0.95 mmol/g。
考察Fe3O4@PMMA-PEI 1800对PAP的物理吸附、封装固定与解吸情况,由表2可知,物理吸附法的固载量比交联封装法的低;交联封装法得到的固定化酶的经洗脱后解吸率显著降低。
表2 反应方法对固定和解吸的影响
Table 2 The reaction method’s impact onization and desorption

方法磁性微球类型固载量/(mg/g)解吸率/%物理吸附Fe3O4@PMMA-PEI 1800120.7163.94交联封装Fe3O4@PMMA-PEI 1800139.802.78
2.1.2 微观结构—SEM分析
由图1-a可知,纳米磁球球体大小基本均匀、外表面较为光滑平整,球体粒径大约在100~250 nm,球体分散性能良好,可能是接枝PEI能调节立体空间的电荷层,抑制了Fe3O4的团聚现象。由于载体本身具有导电性,拍照时有拖尾而导致纳米磁球略微变形。由图1-b看出,PAP均匀地包覆在Fe3O4@PMMA-PEI 1800外表面,PAP负载量较多且轮廓清晰,微球粒子分散性能较好,球体粒径约120~250 nm,局部未见有明显的团聚现象,单体分散性良好,有利于酶促反应的有效发生。江维婷等[23]通过水热法制备的Fe/Fe3C/Fe3O4磁性微球粒径大小分布在2~6 μm,分布范围较大,球体表面粗糙,而本文制备的Fe3O4@PMMA-PEI 1800球体粒径分布在100~250 nm。

a-Fe3O4@PMMA-PEI 1800;b-Fe3O4@PMMA-PEI 1800-PAP
图1 Fe3O4@PMMA-PEI 1800和Fe3O4@PMMA-PEI 1800-PAP的SEM图
Fig.1 SEM images of Fe3O4@PMMA-PEI 1800 and Fe3O4@PMMA-PEI 1800-PAP
2.1.3 XRD测定
纳米磁球样品的XRD图谱与Fe3O4标准卡(JCPDS NO 19-0629)卡片对比可知(图2),在2θ=30.1°、35.5°、43.1°、53.6°、57.1°、62.7°观察到(220)、(311)、(400)、(422)、(511)、(440)特征晶面峰与标准的Fe3O4晶体一致,对应的晶面间距也与PDF卡片(JCPDS NO 19-0629)一致,说明样品是具有特征立方结构的Fe3O4晶体,结晶状态良好[24-25]。图谱中特征衍射峰宽度窄且峰型尖锐,除Fe3O4特有的(220)、(311)、(400)、(422)、(511)、(440)特征晶面峰外,未出现其他杂质晶体衍射峰,说明该载体在一系列反应后,仍具有较高的纯度与结晶度[26],一些列的化学反应并未使Fe3O4与高分子化合物发生键合而改变特征晶型,Fe3O4磁性没有衰减,体现出纳米磁球载体的结晶纯净性与使用稳定性。
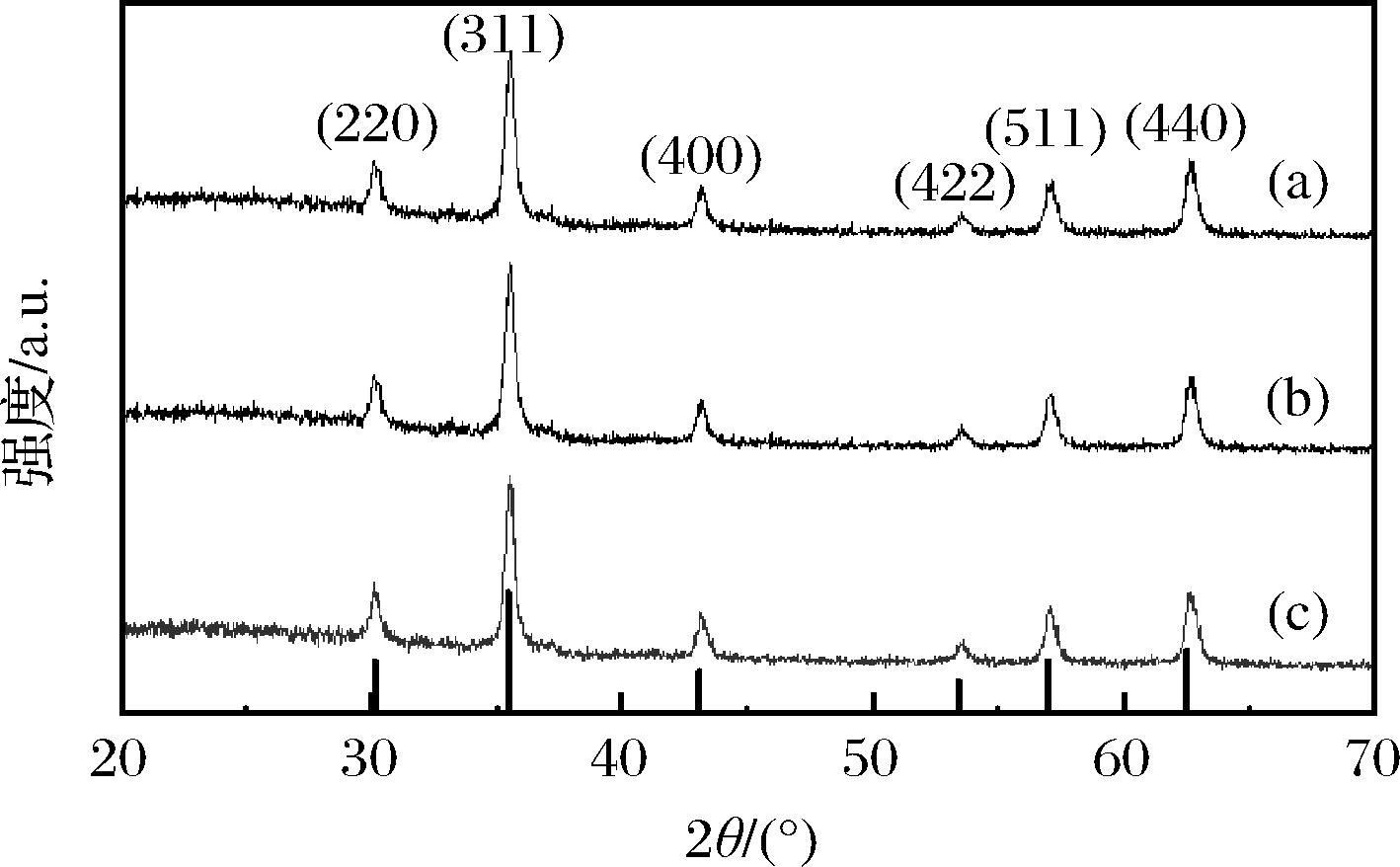
a-Fe3O4@PMMA;b-Fe3O4@PMMA-PEI 1800; c-Fe3O4@PMMA-PEI 1800-PAP
图2 纳米磁球的XRD谱图
Fig.2 XRD pattern of magnetic nanospheres
2.1.4 TG分析
图3为热损失曲线,失重分2个阶段:50~300 ℃为第一阶段,此阶段a、b、c质量损失分别仅为3.06%、4.38%、4.97%,该阶段质量损失主要可能是残留水份蒸发造成的。第二阶段温度范围在300~510 ℃,是主要失重阶段,a、b、c的质量损失分别是54.46%、52.85%、60.76%,a和b的失重率是PMMA聚合物以及PEI长链断裂造成的,b的质量损失略大于a可能是PMMA和PEI的相互作用提高了热稳定性,而c的质量损失最大则是蛋白酶的分解、PEI长链断裂以及Fe3O4向Fe2O3的相变等多重影响带来的,还有PAP的分解产物可能导致Fe3O4发生还原或分解等一些反应带来的质量损失[27]。在510 ℃之后的范围内,3种微球质量不再发生变化,趋于稳定。
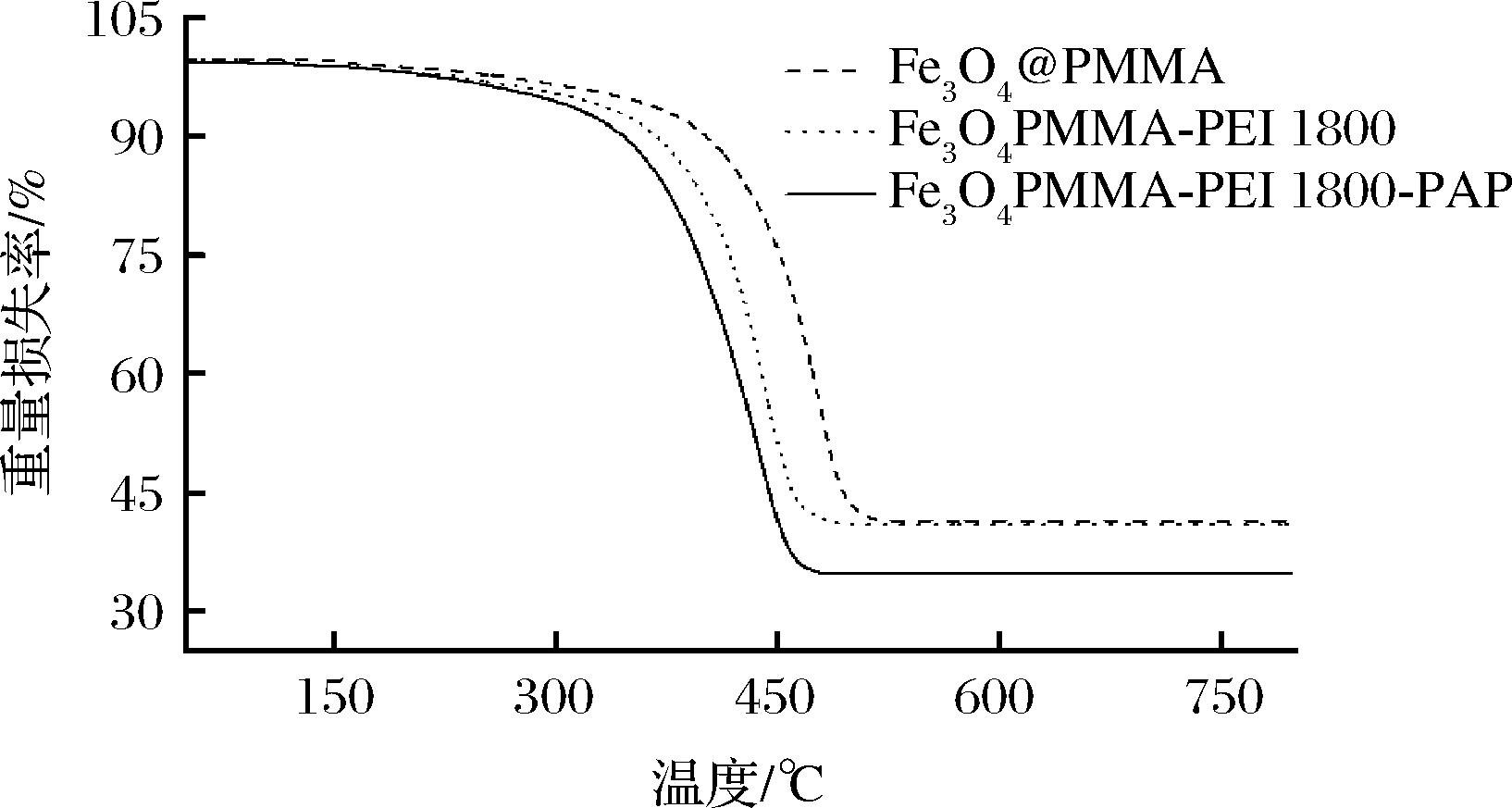
图3 纳米磁球的热重曲线图
Fig.3 TG curves of magnetic nanospheres
2.1.5 比表面积与孔隙测定
通过比表面积与孔隙测定得到Fe3O4@PMMA-PEI 1800纳米磁球的表面积为151.30 m2/g,孔容0.27 cm3/g,孔径3.27 nm。李玲慧[28]制备的Fe3O4@TiO2磁性微球比表面积为124.18 m2/g,孔径为18.547 nm;BAO等[29]制备的Fe3O4@SiO2磁性微球吸附剂,比表面积93.2 m2/g,Fe3O4@PMMA-PEI 1800在比表面积上具有优势,提高比表面积能增加纳米磁球与酶的物理接触,使材料获得更好的吸附能力,有利于酶的固定化。
Fe3O4@PMMA-PEI 1800孔径分布大致分布在3.0~5.0 nm附近。图4曲线呈现典型的Ⅳ型等温线形状,Fe3O4@PMMA-PEI 1800纳米磁球中具有多级多孔结构,根据IUPAC分类,孔径3.27 nm属于介孔结构。
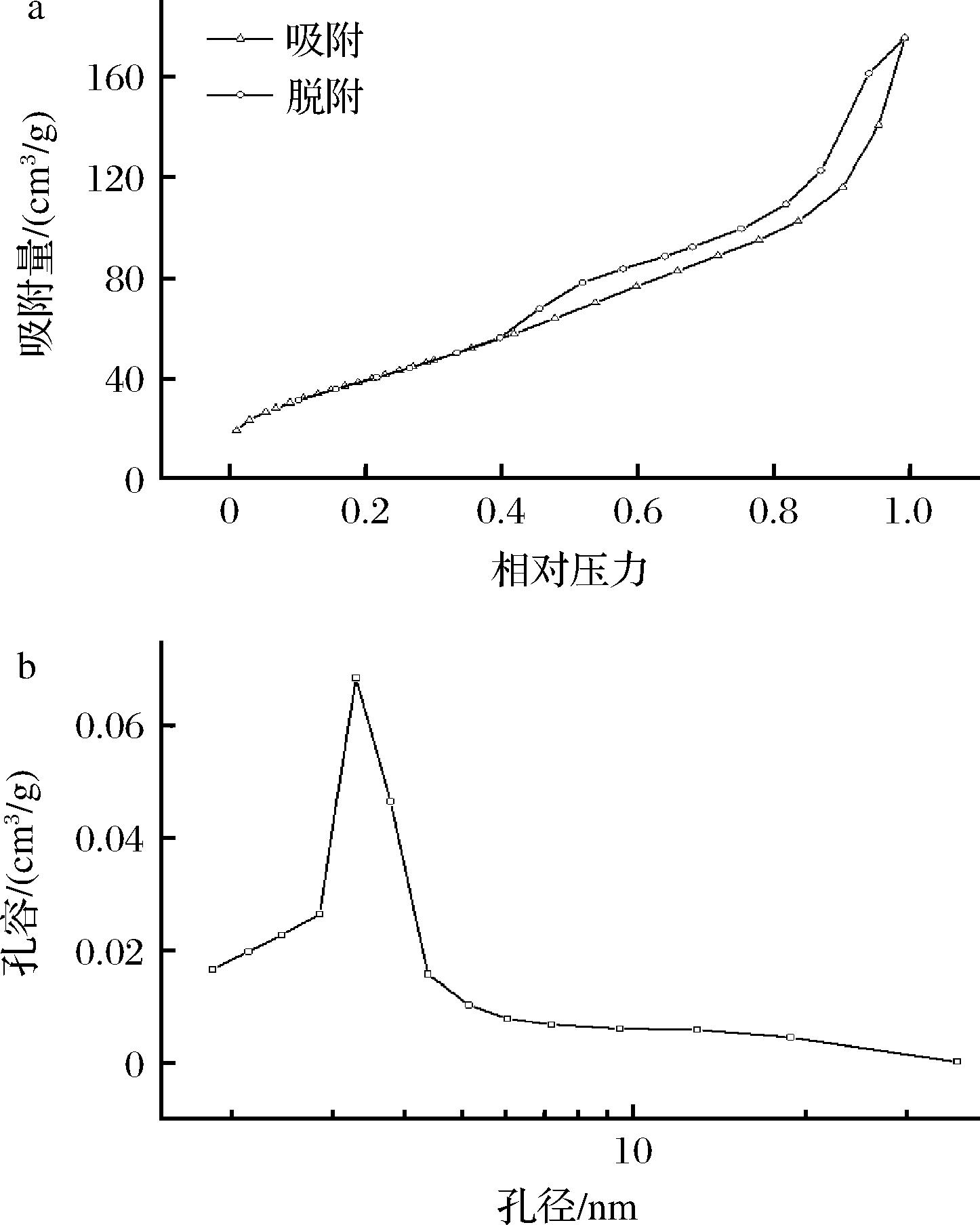
a-N2-吸脱附等温线;b-孔径分布曲线
图4 纳米磁球的N2-吸脱附曲线和孔径分布图
Fig.4 N2 adsorption-desorption curves and pore size distribution of magnetic nanospheres
2.2 酶学性质分析
2.2.1 最适反应温度
酶能否在高温下保持活性是其工业应用的一个重要指标。由图5可知,游离PAP的最适温度为50 ℃,温度高于70 ℃以后酶活力急剧下降。固定化酶的最适温度提升至60 ℃,在40~80 ℃能保持80%以上的相对酶活力,固定化酶能在更大的温度区间内保持高效催化能力。90 ℃时游离PAP相对酶活急速降低至30%以下,Fe3O4@PMMA-PEI 1800-PAP依然能保持66.84%的相对酶活力。GA与Fe3O4@PMMA-PEI 1800长链上的氨基构建的立体结构难以被破坏,能维持生物酶舒展的状态,产生酶活力缓释的效果,PMMA的耐热性能加强了热稳定性,保护Fe3O4@PMMA-PEI 1800-PAP免受高温钝化,降低酶的温度敏感性[30]。苏二正等[31]通过氨基载体原位固定化PEG相中的PAP,固定化PAP的最适温度在60~70 ℃,固定后的PAP比游离的PAP热稳定性都有所提升,高温对游离蛋白酶的空间结构、疏水作用、氢键等作用力产生影响破坏酶的活性部位导致酶失活,而固定化酶能使酶保持刚性的结构和舒展的空间构象,提升了稳定性。
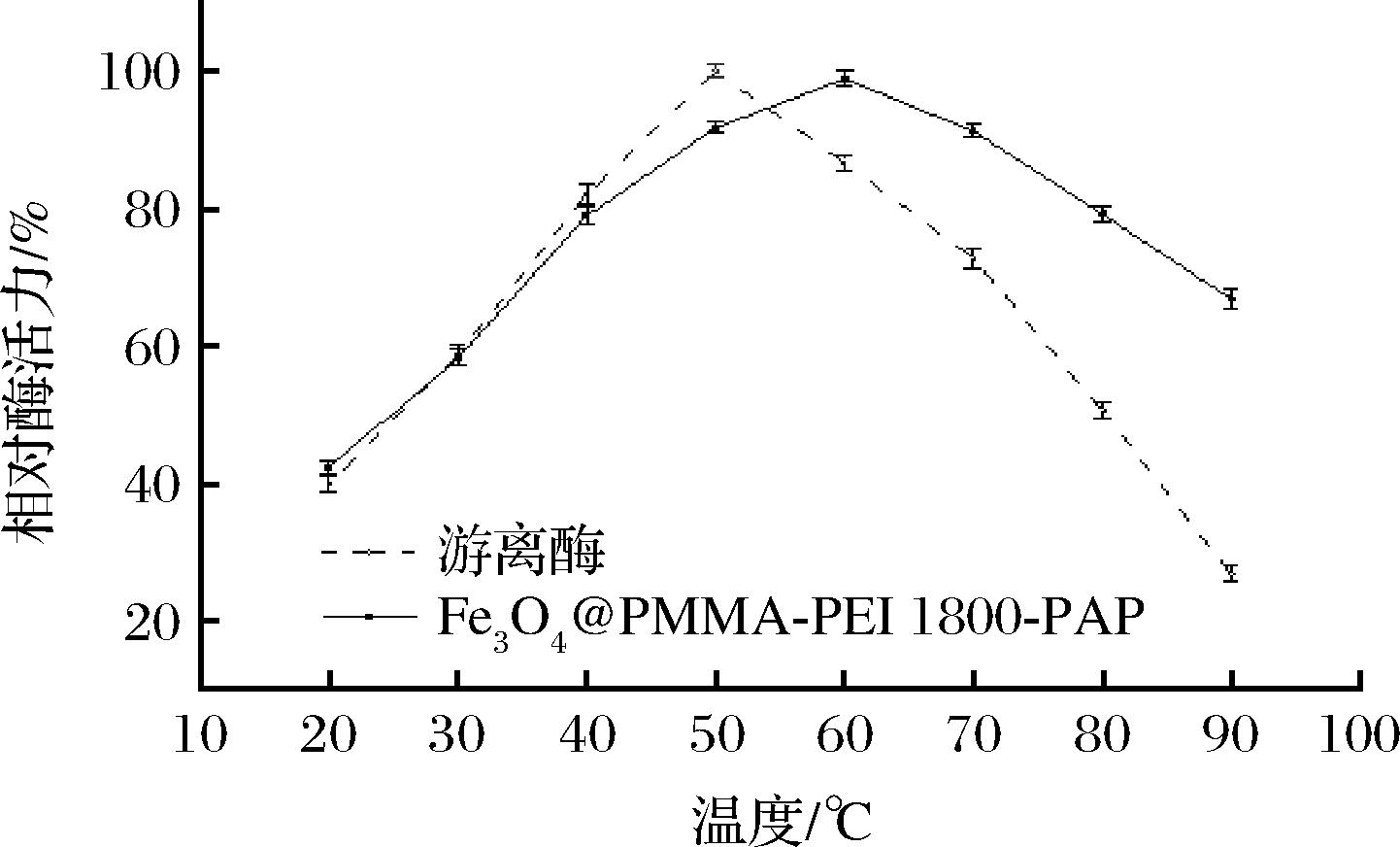
图5 游离酶与固定化酶的最适温度
Fig.5 The optimal temperature for free enzymes and immobil enzymes
2.2.2 热稳定性
热稳定性能是考察酶能否工业化使用的重要指标。分析图6,固定化酶热稳定性始终优于游离酶,随温度升高,Fe3O4@PMMA-PEI 1800-PAP与游离PAP酶活力均有所下降,Fe3O4@PMMA-PEI 1800-PAP热稳定性显著高于游离PAP,游离PAP在60 ℃下温育2 h后相对酶活力仅剩余58.72%,90 ℃环境下温育2 h后完全失活。Fe3O4@PMMA-PEI 1800-PAP在60 ℃下温育2 h相对酶活力能保持80.37%,90 ℃温育2 h后依然保持36.63%的酶活力,载体抑制蛋白酶空间构象发生改变的同时提供热阻,降低了酶对高温的敏感性。游离PAP对环境温度敏感,随着温度逐渐升高,游离PAP酶活力下降速度快。Fe3O4@PMMA-PEI 1800-PAP在20~60 ℃以内酶活力下降缓慢,60~80 ℃时依然保持70%以上的酶活力。随着温度升高,Fe3O4@PMMA-PEI 1800与PAP之间非共价结合的相互作用减弱,PAP从Fe3O4@PMMA-PEI 1800上脱落下来[27]。翟叶辉[32]制备的壳聚糖埃洛石微球固定化木瓜蛋白酶在70 ℃时酶活力仅剩余40%左右,而Fe3O4@PMMA-PEI 1800-PAP在70 ℃时的酶活力为71.36%,热稳定性有显著提高。

图6 游离酶与固定化酶的热稳定性
Fig.6 The thermal stability of free enzymes and immobil enzymes
2.2.3 最适pH值
由图7可知,PAP在pH 7.0时拥有最大酶活力,在pH 5.0~7.0能发挥60%以上的酶活力,在pH 9.0~11.0酶活力快速下降,pH 10.0相对酶活力仅剩10%。酶分子活性基团的解离情况受pH影响,偏离最适pH使酶活性中心的基团解离而产生构象改变,导致酶和底物的特异性结合力降低或结合后不发生酶促反应,甚至造成酶失活[33]。Fe3O4@PMMA-PEI 1800-PAP最适pH为6.0,在pH 9.0时仍具有78%以上的相对酶活力,pH 11.0环境下仍保留29.48%的酶活性,此时游离PAP已完全失活。MOSAFA等[34]将PAP通过强共价键连接到(3-氯丙基)三甲氧基上硅烷改性二氧化硅涂层磁性纳米颗粒上,在pH 9.0能保持大约45%的相对酶活力。Fe3O4@PMMA-PEI 1800-PAP在pH 5.0~10.0环境中酶活力仍能保持60%以上,可能是因为PEI长链上富含氨基基团而改变了反应体系中的微环境,使Fe3O4@PMMA-PEI 1800-PAP具有更宽的pH适应范围,尤其更适应碱性条件下的反应。
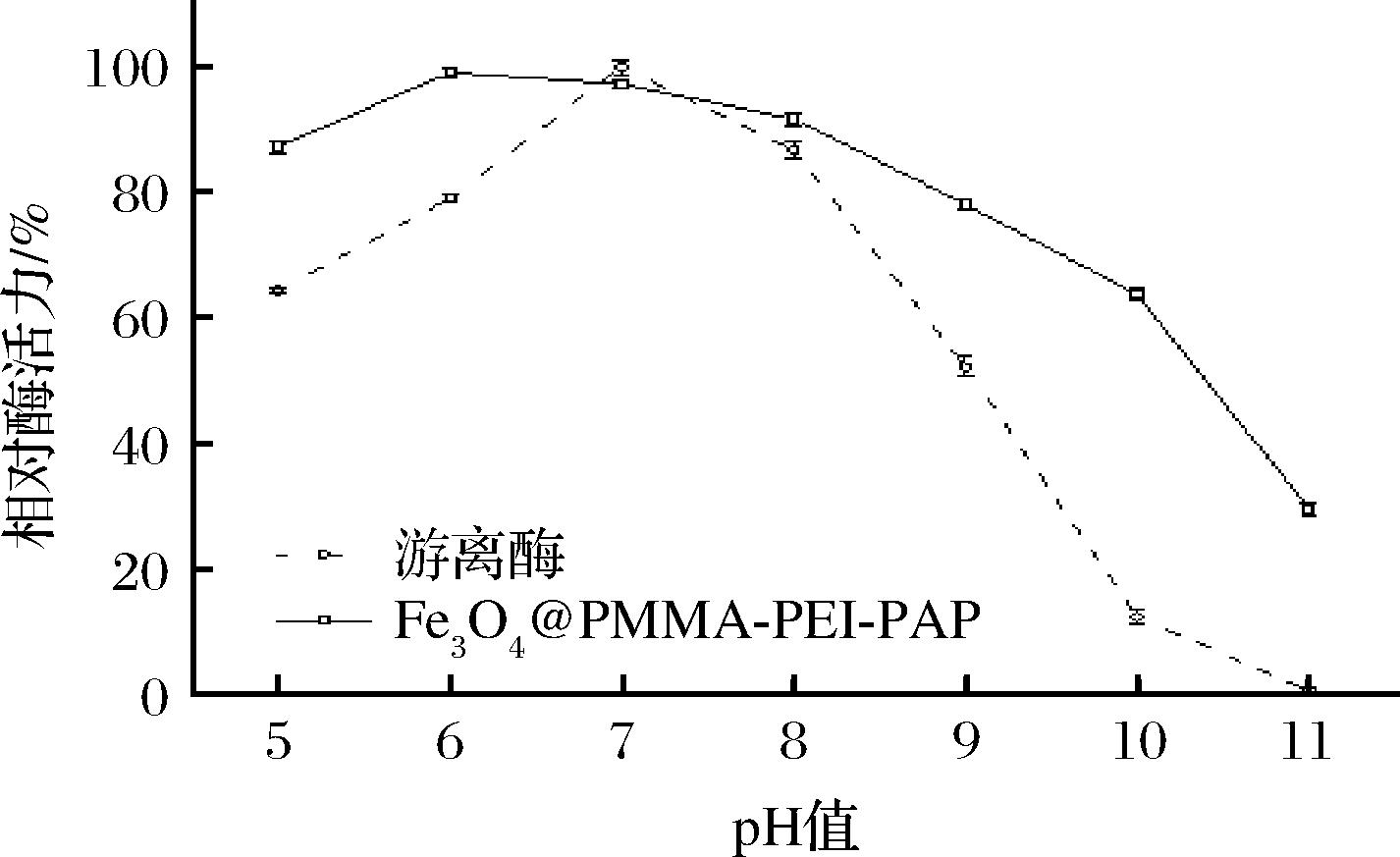
图7 游离酶与固定化酶的最适pH值
Fig.7 The optimal pH for free enzymes and immobil enzymes
2.2.4 操作稳定性
由图8可知,固定化酶活力随洗脱次数缓慢下降,固定化酶可承受一定的振荡作用力,PEI长链形成的三维结构和纳米磁球的介孔结构能维持多次洗脱时酶的少量脱附。经过4次4 h/次洗脱,Fe3O4@PMMA-PEI 1800-PAP相对酶活依旧保持在88.42%;经过7次4 h/次洗脱后仍有71.14%的相对酶活力。李有花[19]通过分子对接技术设计以PS-CL、PS-PEG、PS-PEG-DDI(II)为载体来固定化PAP,其中以PS-PEG-DDI(II)为载体的固定化PAP使用去离子水洗脱12 h后剩余酶活力在70%以上。汤燕明等[35]以CaCO3为模板剂、多巴胺为包覆剂制备的多孔碳材料固定化木瓜蛋白酶在重复使用5次以后酶活力保留了46.7%,多孔碳材料疏松的结构造成酶在重复使用洗脱后容易脱落下来;丁丽君等[36]通过中和沉淀法将改性后的CTS和HNTs制备CTS-HNTs微球,以戊二醛为交联剂通过交联-吸附固定化木瓜蛋白酶,重复洗脱4次以后,固定化酶的相对酶活为26.26%。本文制备的Fe3O4@PMMA-PEI 1800-PAP之所以在操作稳定性上具有优势,与载体的制备方法有关,汤燕明等[35]使用的载体虽然是疏松多孔的碳材料,吸附性能良好,但不够稳定,蛋白酶易于从载体上脱落下来,而丁丽君等[36]制备的CTS-HNTs微球通过戊二醛交联固定蛋白酶,从电镜图中看到微球性状不规则,且球体粒径比Fe3O4@PMMA-PEI 1800大;本文制备的纳米磁球固定化酶反应条件温和,交联反应时使用的戊二醛量约为丁丽君等使用的4%,戊二醛具有较强的化学和生物毒性,过高浓度会对酶活带来负面影响。韦美苹等[37]通过Fe3O4@mSiO2-GLYMO-IDA-Cu2+螯合载体固定化木瓜蛋白酶,重复使用7次以后酶活性降低至原来酶活的7.5%,载体上的Cu2+在多次酶解与洗涤过程中发生解离导致脱落,使载体表面的木瓜蛋白酶量及酶活降低。
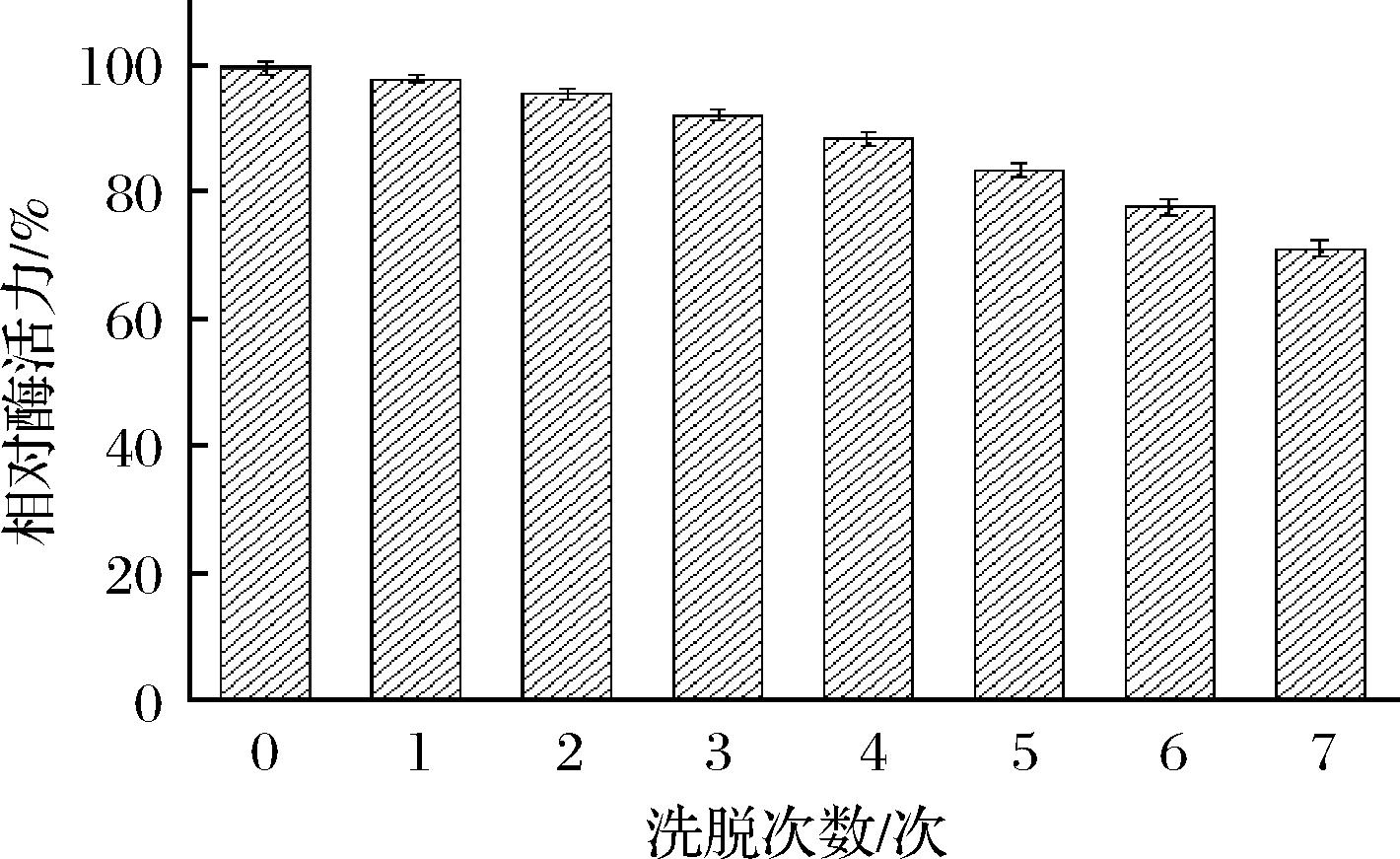
图8 固定化酶的操作稳定性
Fig.8 The operating stability of immobilized enzymes
3 结论
本研究通过悬浮聚合法在磁性微球Fe3O4表面包覆PMMA,制备核-壳结构的磁性Fe3O4@PMMA纳米微球,使PMMA微球表面酯解形成羧基。在Fe3O4@PMMA上接枝PEI 1800,将PAP物理吸附在PEI 1800长链上,通过GA交联封装,构筑具有磁响应且表面富含氨基的亲水性载体Fe3O4@PMMA-PEI 1800,实现PAP的封装固定。
(1)纳米磁球对PAP的固载量可通过接枝不同分子量PEI(600/1 800/70 000)进行调控,Fe3O4@PMMA接枝PEI 1800时对PAP的固载量可达139.80 mg/g,解吸率2.78%。
(2)在电镜下观察纳米磁球的形貌特征,Fe3O4@PMMA-PEI 1800外表面较为光滑平整,球体粒径在100~250 nm,分散性能良好。可清晰的看到Fe3O4@PMMA-PEI 1800-PAP表面有均匀的包覆物。
(3) Fe3O4@PMMA-PEI 1800的比表面积为151.30 m2/g, 孔容0.27 cm3/g,孔径3.27 nm。是多级多孔结构的介孔结构,有利于酶的固定化。
(4) Fe3O4@PMMA-PEI 1800-PAP酶学性质:最适温度从50 ℃提升至60 ℃,在90 ℃下保存2 h依然能保持36.63%酶活力,此时游离PAP已失活,固定化酶热稳定性显著提高。Fe3O4@PMMA-PEI 1800-PAP的最适pH为6.0,在pH 5.0~pH 9.0的环境下仍具有75%以上的相对酶活力,在强碱性下仍然具有29.48%的酶活力,此时游离PAP已变性失活,固定化PAP具有较宽的pH使用范围。经过7次循环使用,酶活力保留在70%以上。Fe3O4@PMMA-PEI 1800-PAP的热稳定性和pH稳定性有较大提升,提高了固定化酶在极端pH下的耐受性。
[1] 朱恒伟. 多级双水相萃取木瓜蛋白酶的研究[D].海口:海南大学, 2023. ZHU H W.Study on multi-stage aqueous two phase extraction of papain[D].Haikou:Hainan University, 2023.
[2] 孙树远, 陈琪, 何静, 等.木瓜蛋白酶与超高压技术嫩化驼肉的研究[J].中国食品学报, 2023, 23(4):239-250. SUN S Y, CHEN Q, HE J, et al.Tenderization and comparison of camel meat by papain and ultra-high pressure technology[J].Journal of Chinese Institute of Food Science and Technology, 2023, 23(4):239-250.
[3] BOTINESTEAN C, HOSSAIN M, MULLEN A M, et al.The influence of the interaction of sous-vide cooking time and papain concentration on tenderness and technological characteristics of meat products[J].Meat Science, 2021, 177:108491.
[4] TACIAS-PASCACIO V G, CASTA EDA-VALBUENA D, MORELLON-STERLING R, et al.Bioactive peptides from fisheries residues:A review of use of papain in proteolysis reactions[J].International Journal of Biological Macromolecules, 2021, 184:415-428.
EDA-VALBUENA D, MORELLON-STERLING R, et al.Bioactive peptides from fisheries residues:A review of use of papain in proteolysis reactions[J].International Journal of Biological Macromolecules, 2021, 184:415-428.
[5] 陈振斌, 周永山, 张霞云.Fe3O4磁性纳米颗粒的RAFT试剂化研究[J].兰州理工大学学报, 2020, 46(5):27-33. CHEN Z B, ZHOU Y S, ZHANG X Y.Functionalization of Fe3O4 magnetic nanoparticles using RAFT reagent[J].Journal of Lanzhou University of Technology, 2020, 46(5):27-33.
[6] HAN C R, ZHAI W L, WANG Y L,et al.A SERS aptasensor for rapiddetection of aflatoxin B1 in coix seed usingsatellite structured Fe3O4@Au nanocomposites[J].Food Control, 2022, 142:109228.
[7] QIU X, WANG S S, MIAO S S, et al.Co-immobilization of laccase and ABTS onto amino-functionalized ionic liquid-modified magnetic chitosan nanoparticles for pollutants removal[J].Journal of Hazardous Materials, 2021, 401:123353.
[8] 毛梦雷, 孟令玎, 高蕊, 等.多孔框架材料固定化酶研究进展[J].化工进展, 2023, 42(5):2516-2535. MAO M L, MENG L D, GAO R, et al.Research progress on enzyme immobilization on porous framework materials[J].Chemical Industry and Engineering Progress, 2023, 42(5):2516-2535.
[9] FU M H, XING J F, GE Z Q.Preparation of laccase-loaded magnetic nanoflowers and their recycling for efficient degradation of bisphenol A[J].The Science of the Total Environment, 2019, 651:2857-2865.
[10] 赵伟, 戴培邦, 田磊.水相沉淀聚合法制备聚甲基丙烯酸甲酯的研究[J].塑料工业, 2022, 50(S1):44-48. ZHAO W, DAI P, TIAN L.Study on Preparation of Poly(methylmethacrylate) by Aqueous Precipitation Polymerization[J].China Plastics Industry, 2022, 50(S1):44-48.
[11] 肖鹭, 周锦涛, 刘振, 等.固定化纳米酶的研究进展[J].食品科学, 2023, 44(11):205-213. XIAO L, ZHOU J, LIU Z, et al.Research Progress on Immobilized Nanoenzymes[J].Food Science, 2023, 44(11):205-213.
[12] 陈孝鹏, 沈炜, 王亚军.固定化细胞催化合成6-氰基-(3R,5R)-二羟基乙酸叔丁酯工艺研究[J].化学反应工程与工艺, 2017, 33(3):236-242. CHEN X P, SHEN W, WANG Y J J.Biocatalytic process of t-Butyl 6-cyano-(3R,5R)-dihydroxylhexanoate by immobilized cells[J].Chemical Reaction Engineering and Technology, 2017, 33(3):236-242.
[13] ZAAK H, KORNECKI J F, SIAR E H, et al.Coimmobilization of enzymes in bilayers using PEI as a glue to reuse the most stable enzyme:Preventing PEI release during inactivated enzyme desorption[J].Process Biochemistry, 2017, 61:95-101.
[14] VIRGEN-ORT Z J J, DOS SANTOS J C S, BERENGUER-MURCIA
Z J J, DOS SANTOS J C S, BERENGUER-MURCIA  B, et al.Polyethylenimine:A very useful ionic polymer in the design of immobilized enzyme biocatalysts[J].Journal of Materials Chemistry B, 2017, 5(36):7461-7749.
B, et al.Polyethylenimine:A very useful ionic polymer in the design of immobilized enzyme biocatalysts[J].Journal of Materials Chemistry B, 2017, 5(36):7461-7749.
[15] 肖云燕. PVAC磁性微球表面构建分子笼封装固定化酶及应用[D]. 保定: 河北大学, 2022. XIAO Y Y. Construction of molecular cage on the surface of PVAC magnetic microspheres to encapsulate immobilized enzyme and its application[D].Baoding: Hebei University, 2022.
[16] 夏玉佩. 磁性微球表面交联封装固定化酶及其催化性能研究[D]. 保定: 河北大学, 2019. XIA Y P. Study on immobilized enzyme encapsulated by cross-linking on the surface of magnetic microspheres and its catalytic performance[D].Baoding: Hebei University, 2019.
[17] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1):248-254.
[18] 高进. 木瓜蛋白酶加工过程中的性质及性质研究[D].天津:天津科技大学, 2018. GAO J.Study on the properties and structure of papain in processing[D].Tianjin:Tianjin University of Science and Technology, 2018.
[19] 李有花. 木瓜蛋白酶的定向固定化研究[D].无锡:江南大学, 2021:37-46. LI Y H.Study on the directional immobilization of papain[D].Wuxi:Jiangnan University, 2021.
[20] 王秀奇, 秦淑媛, 高天慧, 等.基础生物化学实验(第二版)[M].北京:高等教育出版社, 2004:200-230. WANG X Q, QIN S Y, GAO T H, et al.Basic biochemistry experiments(second edition) [M].Beijing:Higher Education Press, 2004:200-230.
[21] 李群艳, 孙路瑶, 韩寿德, 等.分级介孔SiO2空心微球氨基修饰及木瓜蛋白酶固定化[J].高校化学工程学报, 2022, 36(5):708-714. LI Y Q, SUN L Y, HAN D S, et al.Amino modification of hierarchical mesoporous SiO2 hollow microspheres and their application in papain immobilization[J].Journal of Chemical Engineering of Chinese Universities, 2022, 36(5):708-714.
[22] LEE H R, CHUNG M, KIM M I, et al.Preparation of glutaraldehydetreated lipase-inorgnaic hybrid nanoflowers and their catalytic performance as immobilized enzymes[J] Enzyme and Microbial Technology, 2017,105:24-29.
[23] 江维婷, 李翠苹, 姜晓辉, 等.Fe/Fe3C4/Fe3O4@C磁性微球的制备及吸波性能研究[J].材料工程, 2022, 50(11): 81-91. JIANG W T, LI C P, JIANG X H.Preparation and absorbing properties of Fe/Fe3C4/Fe3O4@C magnetic microspheres[J].Journal of Materials Engineering, 2022, 50(11): 81-91.
[24] 桑冀蒙, 李学平, 赵瑾, 等.P(AA-co-MPC)修饰超顺磁性纳米粒子的制备与表征[J].材料工程, 2019, 47(8):82-89. SANG J M, LI X P, ZHAO J.Preparation and characterization of superaramagnetic Fe3O4nanoparticles modified by P(AA-co-MPC)[J].Journal of Materials Engineering, 2019, 47(8):82-89.
[25] 王志琰, 毋伟, 张魁, 等.Pickering乳液法原位制备载药磁性SiO2空心球及缓释性能[J].北京化工大学学报(自然科学版), 2010, 37(3):110-114. WANG Z Y, WU W, ZHANG K, et al.In situ preparation and characterizations of drug-loaded magnetic hollow silica microspheres by a pickering emulsion based route[J].Journal of Beijing University of Chemical Technology(Natural Science Edition), 2010, 37(3):110-114.
[26] DING Q, LIU D F, GUO D W, et al.Shape-controlled fabrication of magnetite silver hybrid nanoparticles with high performance magnetic hyperthermia[J].Biomaterials, 2017, 124(04):35-46.
[27] 高丰琴, 刘洋, 张引莉, 等.羧基功能化Fe3O4固定化酶反应器的构筑及性能研究[J].化学学报, 2023, 81(4):338-344. GAO F Q, LIU Y, ZHANG Y L, et al.Study on construction and performance of immobilized enzyme reactors by carboxyl-functionalized Fe3O4[J].Acta Chimica Sinica, 2023, 81(4):338-344.
[28] 李玲慧. Fe3O4@TiO2磁性纳米粒子的制备及吸附重金属性能研究[D].北京:北京化工大学, 2017. LI L L.Preparation of Fe3O4@TiO2magnetic nanoparticles and study on the adsorption of heavy metals[D].Beijing:Beijing University of Chemical Technology, 2017.
[29] BAO S Y, TANG L H, LI K, et al.Highly selective removal of Zn(II) ion from hot-dipgalvanizing pickling waste with amino-functionalized Fe3O4@SiO2 magnetic nano-adsorbent[J].Journal of colloid and interface science, 2016, 462:235-242.
[30] WANG L L, LOU Z, DENG J N, et al.Ethanol gas detection using a yolk-shell(core-shell) α- Fe2O3nanospheres as sensing material[J].ACS Applied Materials &Interfaces, 2015, 7(23):13098-13104.
[31] 苏二正, 李明亮, 魏东芝.木瓜蛋白酶的原位固定化及理化性质研究[J].南京林业大学学报(自然科学版), 2014, 38(6):99-104. SU E Z, LI M L, WEI D Z.Study on in situ immobilization and characterization of papain[J].Journal of Nanjing Forestry University(Natural Sciences Edition), 2014, 38(6):99-104.
[32] 瞿叶辉. 罗非鱼副产物酶解工艺优化及壳聚糖埃洛石微球固定化木瓜蛋白酶的研究[D]. 广州: 广东工业大学, 2016. QU Y H. Optimization of enzymatic hydrolysis of tilapia byproducts and study on immobilization of papain on chitosan halloysite microspheres[D].Guangzhou: Guangdong University of Technology, 2016.
[33] 胡艺凡, 李正军, 刘长霞.基于磁性Fe3O4粒子的固定化过氧化氢酶的制备及催化性质研究[J].北京化工大学学报(自然科学版),2023, 50(2):53-62. HU Y F, LI Z J, LIU C X.Preparation and catalytic properties of catalase immobilized on magnetic Fe3O4particles[J].Journal of Beijing University of Chemical Technology(Natural Science Edition), 2023, 50(2):53-62.
[34] MOSAFA L, MOGHADAM M, SHAHEDI M.Papain enzyme supported on magnetic nanoparticles:Preparation, characterization and application in the fruit juice clarification[J].Chinese Journal of Catalysis, 2013,34:1897-1904.
[35] 汤燕明, 孙丽霞, 郑燕宁, 等.氮掺杂多孔炭材料固定化木瓜蛋白酶研究[J].食品科技, 2019,44(8):261-267. TANG Y M, SUN L X, ZHENG Y N, et al.Study on immobilized papain by N-drops porous carbon material[J].Food Science and Technology, 2019, 44(8):261-267.
[36] 丁利君, 瞿叶辉, 刘丹.壳聚糖埃洛石纳米管微球的制备及其对木瓜蛋白酶的固定化[J].食品科学, 2017, 38(10):123-129. DING L J, QU Y H, LIU D.Preparation of chitosan-halloysites nanotube microspheres and their application in immobilization of Papain[J].Food Science, 2017,38(10):123-129.
[37] 韦美苹, 庞玉凤, 陈正毅, 等.磁性可再生性固定化酶制备及其在微波辅助蛋白酶解中的应用[J].桂林理工大学学报, 2014, 34(4):748-754. WEI M P, PANG Y F, CHEN Z Y.Preparation of regenerated immobilized enzyme reactor and application in microwave assisted digestion[J].Journal of Guilin University of Technology, 2014, 34(4):748-754.