肥胖是一个以脂肪在组织中大量堆积为特征的世界性公共卫生问题[1]。世界卫生组织发布《2022年欧洲区域肥胖报告》指出,超重和肥胖在欧洲已达“流行病”程度,且“肥胖”被确定为十大慢性疾病之一。据报道,长期高脂饮食会使得脂肪组织发生不同程度的改变,引起炎症、氧化应激[2]、脂质代谢紊乱和肠道菌群失调[3],增加患糖尿病、非酒精性脂肪肝、心血管疾病的风险[4]。目前,传统合成药物治疗肥胖症会导致严重的不良反应,如恶心、呕吐、腹胀、肌肉酸痛等[5-6]。使用安全的天然化合物改善肥胖及其相关的代谢综合征,已经成为研人员关注的热点。
脂质是人类饮食中的关键宏量营养素,摄入的膳食脂肪酸类型和比例会影响机体的健康和生理功能[7]。研究表明,饱和脂肪酸(saturated fatty acid,SFA)对健康有害,而单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)对健康有益。其中,n-3不饱和脂肪酸在减轻体重、改善身体成分和抵消肥胖的不良代谢效果尤为显著[8]。香榧是红豆杉科榧树属常绿乔木,主要分布在中国亚热带的丘陵地区,特别是在浙江会稽山脉一带。因其种籽风味独特,营养价值高,倍受消费群体喜爱[9]。香榧油中富含不饱和脂肪酸,包括亚油酸、油酸和金松酸(5 C,11 C,14 C-二十碳三烯酸)。此外,香榧油中还含有一些生物活性物质,如β,γ生育酚,β-谷甾醇和多酚,具有巨大的潜在营养价值[10]。然而,香榧油对肥胖小鼠干预效果尚不清晰。本研究采用高脂饮食诱导肥胖小鼠模型,研究香榧油干预对肥胖小鼠的降脂、抗氧化和炎症作用机制,为香榧油作为人类饮食中的油或预防肥胖功能性食品的开发提供理论支持。
1 材料与方法
1.1 材料与试剂
香榧种实,于2022年9月采自诸暨斯宅村;香榧油,由浙江省农业科学院蚕桑与茶叶研究所制备提供。甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)、肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白介素6(Interleukin 6,IL-6)试剂盒,南京建成科技有限公司;RIPA裂解液、Fasting gDNA Dispelling RT SuperMix试剂盒、Cell Kit RNA Easy Fast试剂盒,碧云天生物技术有限公司;Hieff®qPCR SYBR Green Master Mix(High Rox Plus),翌圣生物科技(上海)股份有限公司。
24只雄性C57BL/6小鼠,体重(20±2) g,年龄7周,杭州子源实验动物科技有限公司,证书编号SCXK(zhe)2019-0004。小鼠在23~25 ℃、40%~65%的湿度、12 h的光照/黑暗周期下饲养,并允许自由获取饮食(饲料配料表如表1所示)。
表1 小鼠饲料组成成分
Table 1 Composition of mice feed
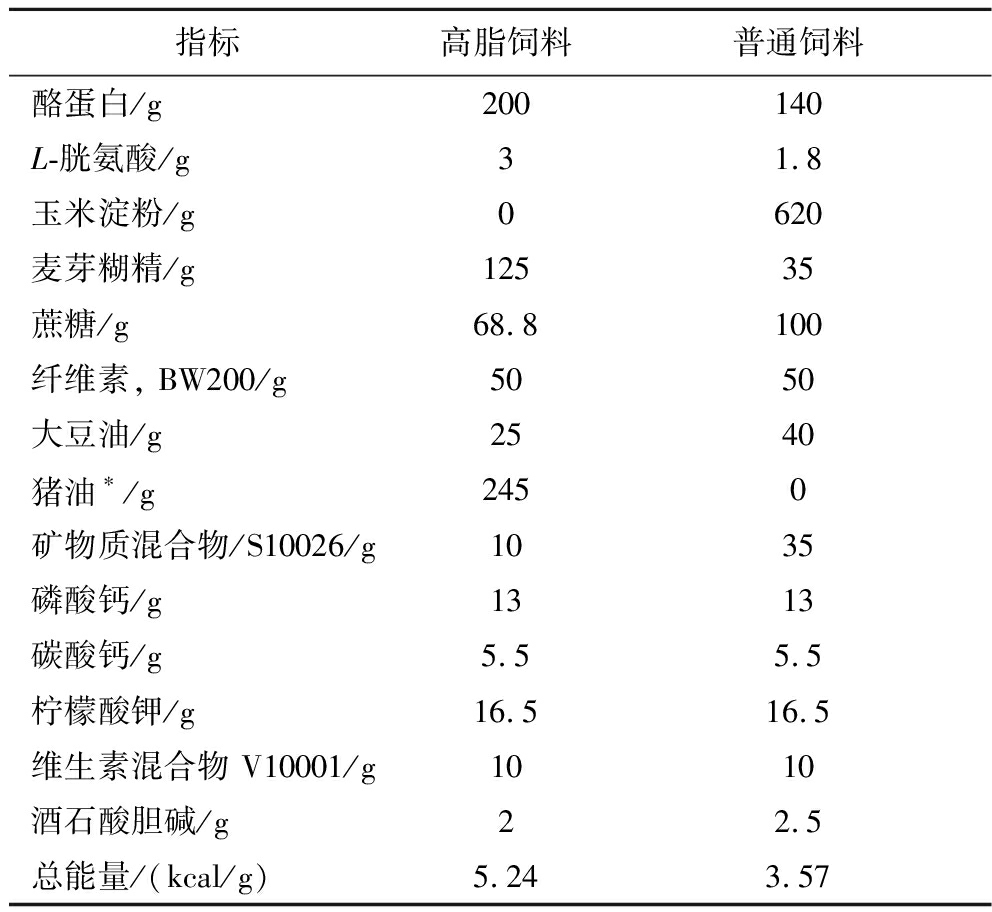
指标高脂饲料普通饲料酪蛋白/g200140L-胱氨酸/g31.8玉米淀粉/g0620麦芽糊精/g12535蔗糖/g68.8100纤维素, BW200/g5050大豆油/g2540猪油∗/g2450矿物质混合物/S10026/g1035磷酸钙/g1313碳酸钙/g5.55.5柠檬酸钾/g16.516.5维生素混合物 V10001/g1010酒石酸胆碱/g22.5总能量/(kcal/g)5.243.57
1.2 仪器与设备
ABI ViiATM 7实时荧光定量PCR仪,Applied Biosystems;Micro21R高速冷冻离心机,赛默飞世尔科技公司; FA1004N型分析天平,上海民桥精密科学仪器有限公司;Tecan Infinite F200型多功能酶标仪,瑞士TECAN集团公司。
1.3 实验方法
1.3.1 动物分组与给药
将24只C57BL/6小鼠在SPF级动物房内适应性饲养1周后,随机分为4组,分别为正常对照组(NC组)、高脂对照组(HFD组)、低剂量香榧油组(SCL组)、高剂量香榧油组(SCH组),每组6只,实验周期8周。在试验期间,NC组小鼠饲喂普通饲料,HFD组、SCL组和SCH组饲喂高脂饲料。SCL组和SCH组小鼠分别灌胃500 mg/kg BW和800 mg/kg BW的香榧油,而NC组和HFD组给予等体积生理盐水。所有实验小鼠饲养于SPF级动物房内,自由摄食,饮水。每日对小鼠精神状态、饮食情况、排泄等进行记录,每周定时称量各组小鼠体重。
1.3.2 血清生化指标检测
8周后,各组小鼠处死前分别称重记录,断颈处死后快速心脏取血,然后分别摘取小鼠肝脏、肾周脂肪组织、附睾脂肪,使用预冷PBS缓冲液漂洗小鼠脏器组织各3次,用滤纸吸干表面水分后称重。一部分肝脏组织和附睾脂肪置于干燥无菌离心管中,贮存在-80 ℃冰箱保持备用;一部分采用4%多聚甲醛进行固定,用于后续HE染色。血液于3 000 r/min离心15 min,取上清液,按试剂盒说明书测定TC、TG、LDL-C、HDL-C、SOD、GSH-Px、IL-6、TNF-α。
1.3.3 组织病理学观察
将固定好的肝脏组织和附睾脂肪,经过无水乙醇脱水、包埋、切片后,用于HE染色观察。
1.3.4 RT-PCR测定肝脏组织脂质代谢相关基因表达
取50 mg肝脏组织加入1 mL组织裂解液进行研磨,随后按照TRIzol法提取细胞总RNA,2 μg总RNA根据Fasting gDNA Dispelling RT SuperMix试剂盒说明书逆转录为cDNA。反应体系:含有10 μL SYBR Green混合液,1 μL cDNA样品,上游引物和下游引物各0.4 μL,用ddH2O补足至20 μL,并在95 ℃,5 s;60 ℃,34 s条件下循环40次。以β-actin为内参基因,通过RT-PCR系统测定靶基因的相对表达水平,计算公式为2-ΔΔCt。测定的目标基为人腺苷酸活化蛋白激酶α(human adenylate activated protein kinase α,AMPKα)、脂肪酸合酶(fatty acid synthase,FAS)、固醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)和β-肌动蛋白(β-actin)(表2)。
表2 基因引物序列
Table 2 Gene primer sequences

目的基因引物序列(5′-3′) AMPKαForwardReverseCCCGACACACCCTAGATGAATGCTCTACACACTTCTGCCAFASForwardReverseGCGGGTTCGTGAAACTGATAAGCAAAATGGGCCTCCTTGATASREBP-1CForwardReverseCTTTGGCCTCGCTTTTCGGTGGGTCCAATTAGAGCCATCTCβ-actionForwardReverseAGTGTGACGTTGACATCCGTGCAGCTCAGTAACAGTCCGC
1.4 数据处理
实验数据用SPSS 19.0进行分析处理,数据均以“平均值±SD”的形式表示,对数据进行ANOVA单因素方差分析和图基检验,P<0.05表示差异显著,采用GraphPad Prism 8软件进行制图。
2 结果与分析
2.1 香榧油抑制肥胖小鼠的体重增长
饲养8周后,小鼠体重均显著增加,其中NC、HFD、SCL和SCH组小鼠与起始比分别增加了20.23%、30.06%、23.12%、21.97%。与HFD组小鼠相比,香榧油干预后,能有效抑制高脂饮食小鼠体重的增长趋势,分别降低了4.51%和6.81%(图1-a)。此外,实验结果发现香榧油能降低肝脏系数和肾周脂肪堆积,其中高剂量效果最佳(图1-b、图1-c),呈显著性差异(P<0.05)。
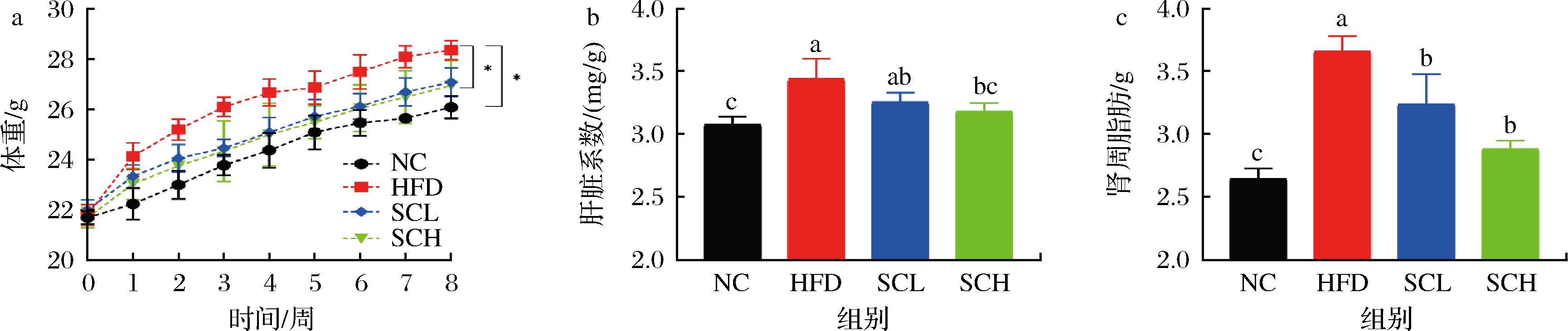
a-体重;b-肝脏系数;c-肾周脂肪
图1 香榧油对肥胖小鼠体重及脏器指数的影响
Fig.1 Effect of Torreya seed oil on body weight and organ index in obese mice
注:不同小写字母表示显著性差异(P<0.05)(下同)。
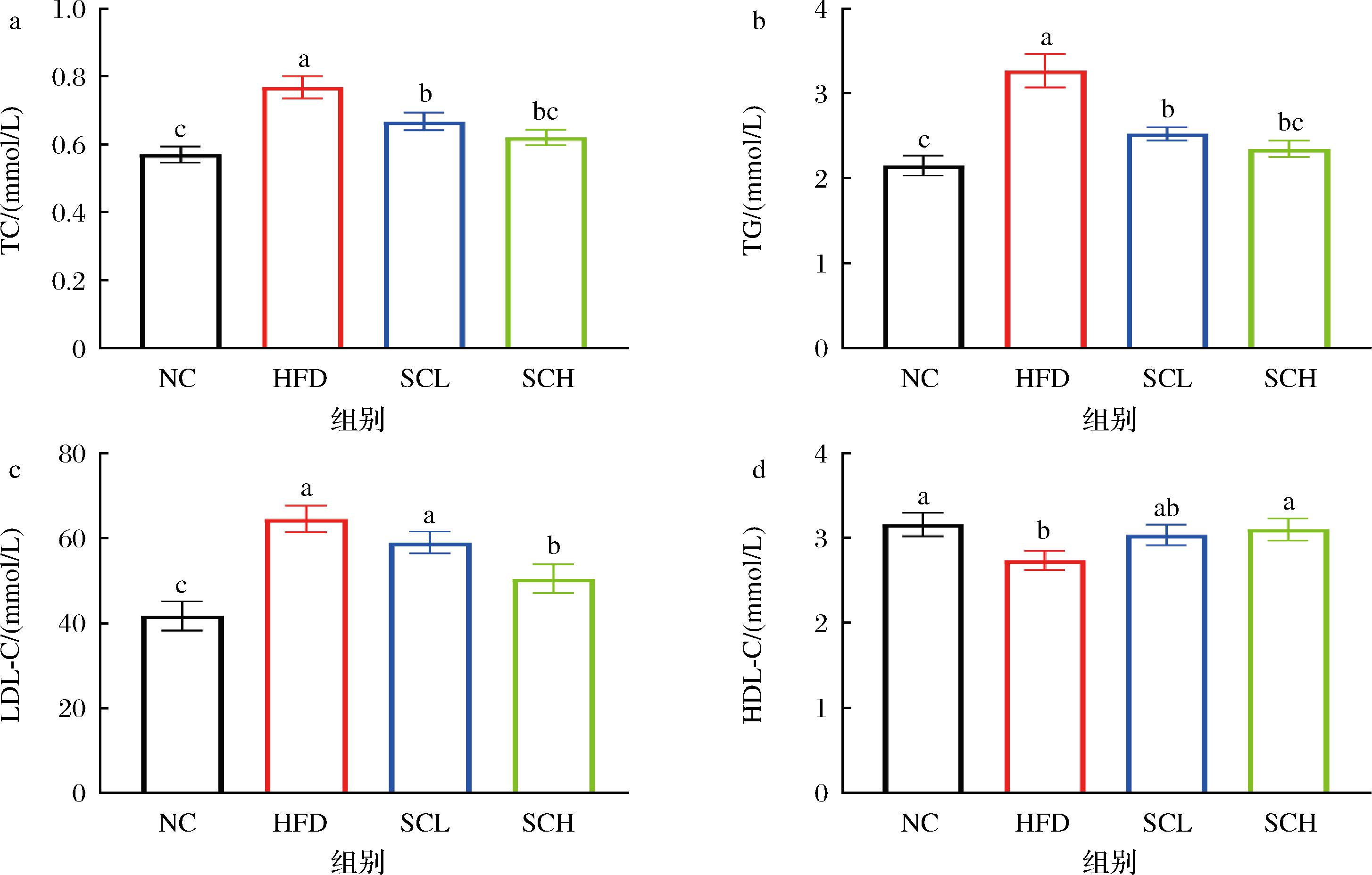
a-TC;b-TG;c-LDL-C;d-HDL-C
图2 香榧油对肥胖小鼠脂质代谢的影响
Fig.2 Effect of Torreya seed oil on lipid metabolism in obese mice
2.2 香榧油改善肥胖小鼠的脂质代谢紊乱
高脂饮食8周后,与NC组相比,HFD小鼠TC、TG、LDL-C水平显著升高(P<0.05),HDL-C水平显著降低(P<0.05),表明肥胖小鼠出现严重的脂质代谢紊乱,并伴随高脂血症(图2)。与HFD组相比,SCL和SCH组小鼠TC、TG水平均显著降低(P<0.05)。其中低剂量香榧油能略微降低LDL-C水平和升高HDL-C水平,但不显著,而高剂量香榧油干预均能逆转这一现象。
2.3 香榧油改善肥胖小鼠的抗氧化能力和炎症反应
长期摄入富含脂肪和胆固醇的饮食会导致高脂血症、肝脏脂质堆积,诱发炎症和氧化应激。如图3所示,与正常组相比,HFD组小鼠GSH-Px、SOD水平显著降低(P<0.05),而IL-6和TNF-α水平显著升高(P<0.05),表明高脂饮食会导致小鼠抗氧化能力下降,出现严重的炎症反应。与HFD组相比,SCL组小鼠GSH-Px水平显著升高(P<0.05),且能降低IL-6和TNF-α水平。另一方面,SCH组小鼠GSH-Px、SOD水平均显著升高(P<0.05),IL-6和TNF-α水平明显降低,接近正常组。表明香榧油对肥胖小鼠的抗氧化能力和炎症具有改善作用,且呈现剂量依赖性。
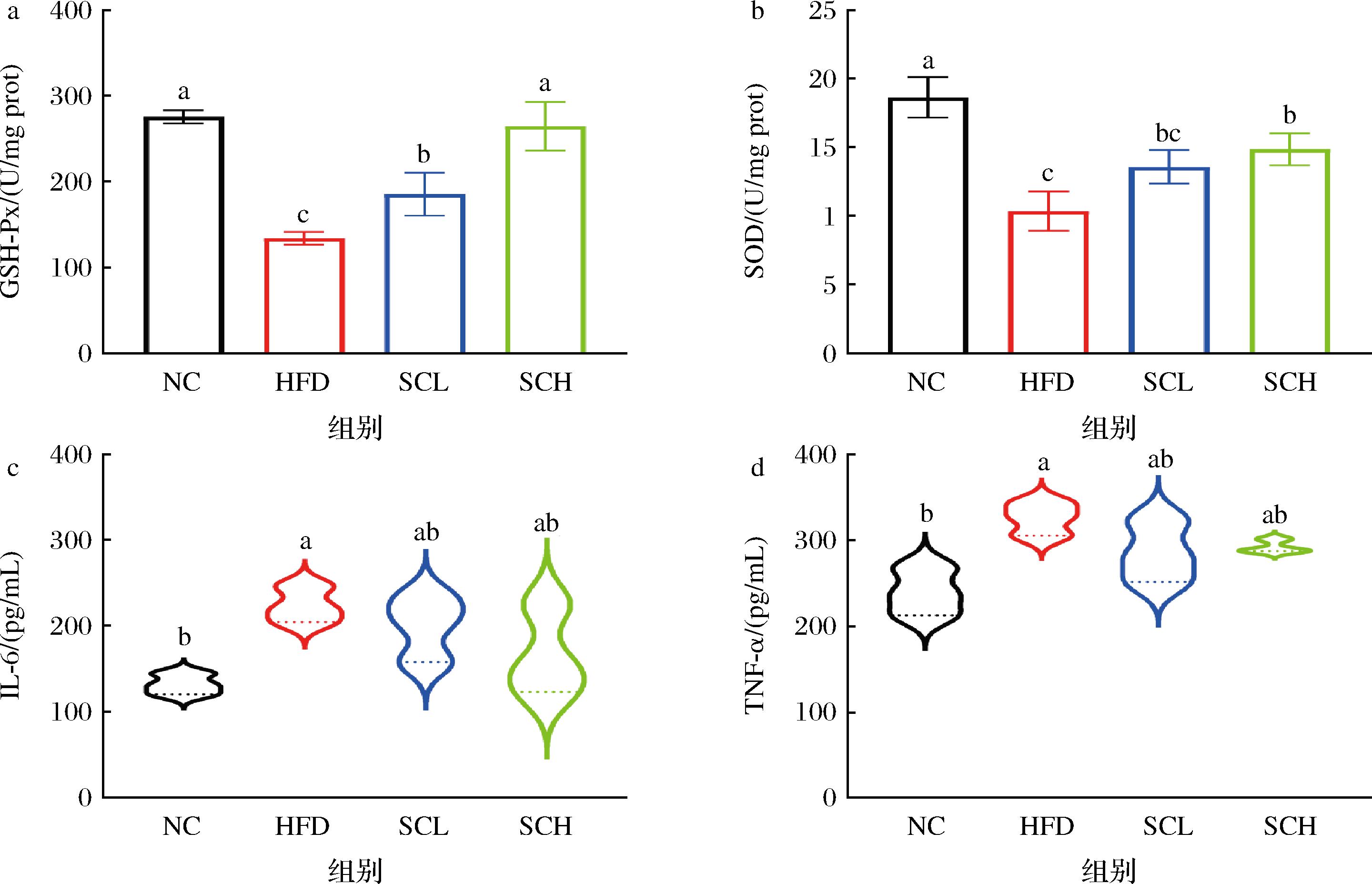
a-GSH-Px;b-SOD;c-IL-6;d-TNF-α
图3 香榧油对肥胖小鼠抗氧化和炎症指标的影响
Fig.3 Effect of Torreya seed oil on antioxidant and inflammatory indexes in obese mice
2.4 小鼠组织病理学观察
为了评估香榧油对肥胖小鼠肝脏组织和附睾脂肪的影响,对肝脏组织和附睾脂肪进行H&E染色观察。如图4-a所示,NC组小鼠的肝脏清晰,形态正常,排列均匀。HFD组小鼠,肝脏组织结构混乱,排列不规则,显示出细胞质空泡化和明显的脂肪变性。SCL和SCH组小鼠组织结构完整,能减轻肝细胞空泡化,抑制肝脏脂肪变性,缓解了肥胖小鼠肝脏的病理过程。如图4-b所示,NC组小鼠附睾脂肪细胞分界清晰,形态规则完整,大小均匀,呈蜂窝状;HFD组小鼠附睾脂肪细胞性状不规则,体积较大,呈现严重炎症反应;SCL组小鼠附睾脂肪相比于HFD组体积明显降低,细胞排列规则;SCH组小鼠附睾脂肪细胞排列规则,分界清晰,但细胞大小不均匀,未见明显炎症反应。这些结果表明,香榧油可以有效的保护肥胖小鼠免受肝脏损伤,减少脂肪堆积。
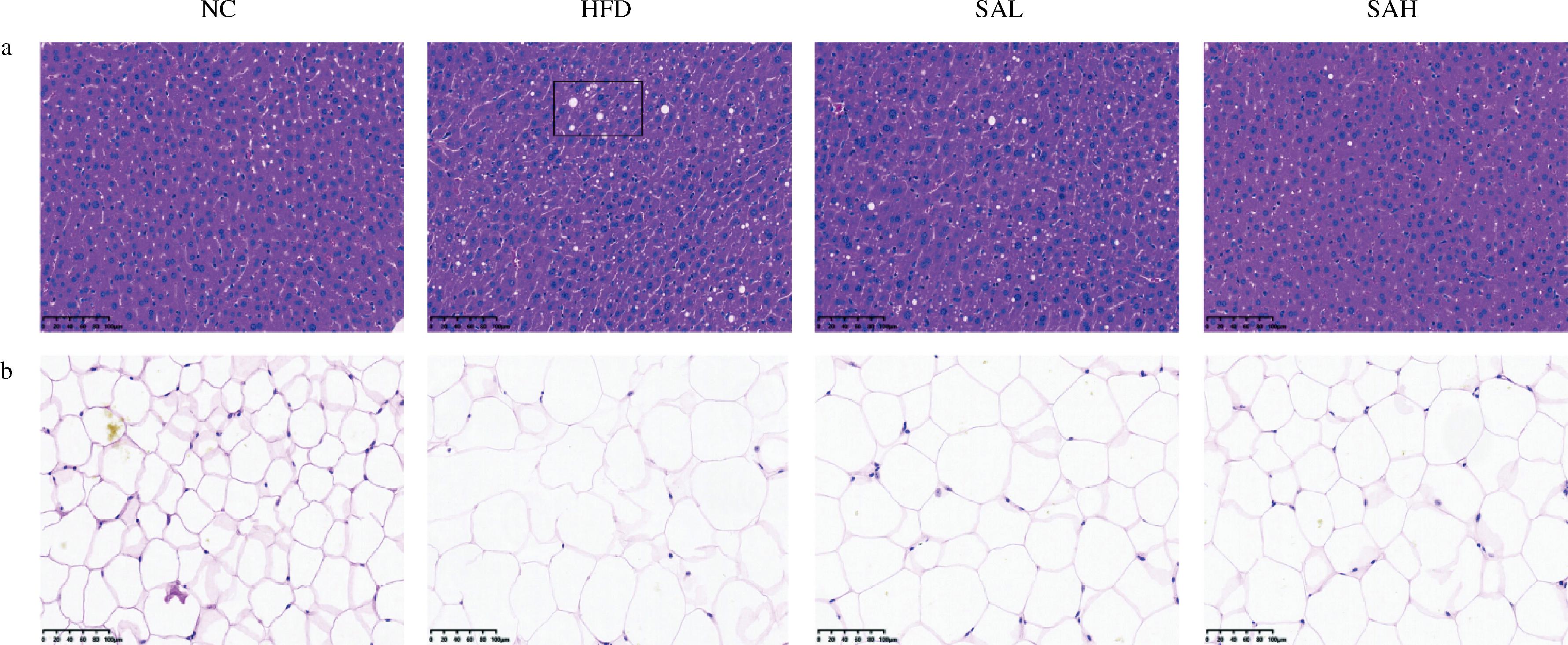
a-肝脏组织;b-附睾脂肪
图4 各组小鼠组织病理学变化(200×)
Fig.4 Histopathological changes of mice in each group (200×)
2.5 香榧油提高肥胖小鼠肝脏脂质代谢基因表达水平
为更进一步分析香榧油改善脂质代谢紊乱的分子机制,测定了与脂质代谢相关基因AMPKα、SPEBP-1c和FAS表达情况。由图5的RT-PCR结果可知,与NC组小鼠相比,HFD组小鼠肝脏组织中AMPKα、SPEBP-1c和FAS的表达均显著升高(P<0.05)。与HFD组小鼠相比,SCL组小鼠SPEBP-1c表达水平显著降低(P<0.05),AMPKα和FAS的表达水平略有降低但不显著;SCH组小鼠AMPKα、SPEBP-1c和FAS表达均显著降低,且与正常组无显著差异。结果表明,香榧油可能通过调控AMPKα/SPEBP-1c通路调控脂质代谢,从而改善肥胖。
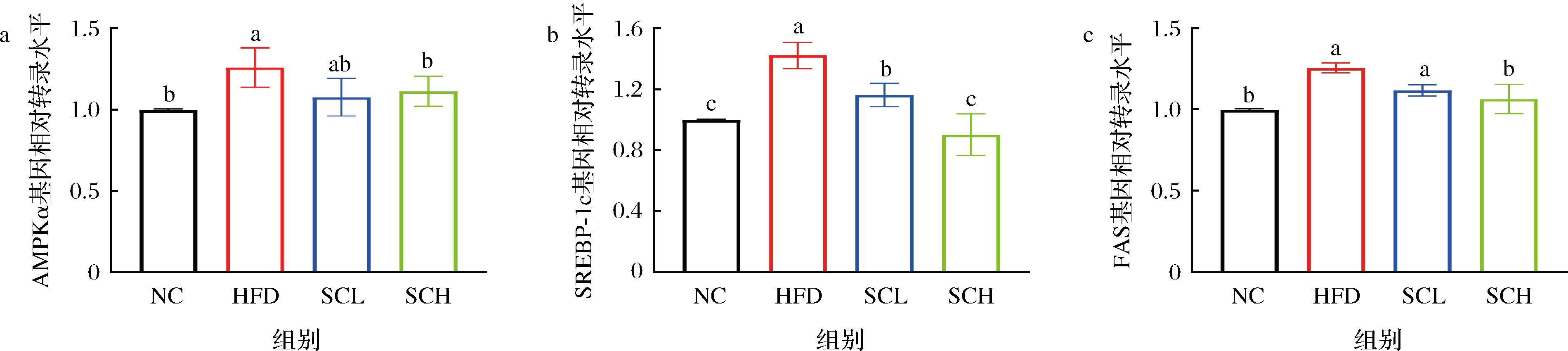
a-AMPK;b-SREBP-1c;c-FAS
图5 肝脏组织中脂质代谢相关基因相对表达量变化
Fig.5 Changes in relative expression of lipid metabolism-related genes in liver tissues
3 结论与讨论
本研究通过高脂饮食建立肥胖小鼠模型,探究了香榧油对肥胖小鼠脂质代谢的影响。肥胖通常是由于体内脂肪堆积所导致,伴随脂肪在组织中的积累(异位脂肪沉积在肝脏,心脏,骨骼肌等),会导致高脂血症、糖尿病以及心血管疾病等[11]。如今越来越多的研究表明,补充富含n-3不饱和脂肪酸的植物油,能有效降低肥胖小鼠的体重和脂肪堆积,对肥胖和高脂血症具有积极作用。例如,石榴籽油的膳食补充剂,含有高水平的石榴酸(9 C,11 T,13 C-十八碳三烯酸),可以显着降低血清甘油三酯和磷脂水平[12]。大蒜油和洋葱油可以改善高脂饮食对体重、脂肪组织重量和血脂异常的影响,具有抗肥胖特性[13]。本研究试验结果再次证明了这一点,香榧油干预8周后,能显著抑制肥胖小鼠体重的增长,降低肝脏系数和肾周脂肪的堆积(P<0.05)。高脂血症的特征是血清中TC,TG和LDL-C水平升高,HDL-C水平降低[14]。据报道,在LDL-C和HDL-C共同作用下,能调节体内胆固醇含量,降低心血管疾病风险[15]。在这项研究中,在补充800 mg/kg BW香榧油的小鼠中观察到血清TC(-19.24%),TG(-28.17%)和LDL-C(-21.81%)降低,血清HDL-C升高(13.28%)。同时,肝脏和附睾脂肪切片的H&E染色表明,香榧油干预后能显著减少高脂饮食诱导的肝脏脂肪变性和附睾脂肪堆积,对肥胖小鼠脂质代谢紊乱具有改善作用。
最新研究表明,活性氧(reactive oxygen species,ROS)和氧化应激在肥胖发展中呈上升趋势。ROS是高反应性物质,由于ROS的影响,几乎所有细胞成分都会发生化学变化,最终导致脂质过氧化的产生,脂质过氧化是氧化应激发展的主要致病因素[16]。氧化应激已被证明在几种与肥胖相关的有害健康后果中起关键作用,包括DNA氧化[17]。实验结果表明,香榧油能显著提高肥胖小鼠血清中SOD和GSH-Px水平(P<0.05),增强抗氧化能力,减轻氧化应激反应。同时,肥胖小鼠血清炎症指标检测结果显示,香榧油能降低TNF-α和IL-6水平,且接近于正常组。先前研究表明,TNF-α和IL-6是重要的促炎症因子,在肥胖相关的疾病发生发展中发挥重要作用[18],包括脂质代谢和胰岛素信号传导,其循环水平随着肥胖而增加,随着体重减轻而降低[19]。AMPKα、SPEBP-1c和FAS是调控脂质代谢的关键基因。AMPKα在调节脂质代谢途径中起着重要作用,通过抑制FAS、ACC表达,促进脂肪酸氧化分解[20]。SREBP-1c是脂肪生成的主要调节因子,参与脂生成中编码限速酶的基因的转录激活,例如FAS,ACC和硬脂酰辅酶A去饱和酶1[21]。SREBP-1c可控制肝脏中葡萄糖脂质的合成,这一过程对于能量贮存至关重要[22]。研究结果表明,800 mg/kg BW香榧油能显著抑制AMPKα、SPEBP-1c和FAS表达水平(P<0.05),改善肥胖小鼠脂质代谢途径。
综上所述,香榧油能抑制肥胖小鼠体重增长,改善高脂血症,并减轻氧化应激和炎症反应,保护肝脏组织。同时,香榧油能调节AMPKα/SREBP-1c信号通路,改善肥胖小鼠脂质代谢紊乱。这些实验结果表明,香榧油具有开发成功能性食用油的潜力,为其高值化利用提供实验依据。
[1] GOODY D, PFEIFER A.MicroRNAs in brown and beige fat[J].Biochimica et Biophysica Acta-Molecular and Cell Biology of Lipids, 2019, 1 864(1):29-36.
[2] FURUKAWA S, FUJITA T, SHIMABUKURO M, et al.Increased oxidative stress in obesity and its impact on metabolic syndrome[J].Journal of Clinical Investigation, 2004, 114(12):1752-1761.
[3] BARLOW G M, YU A, MATHUR R.Role of the gut microbiome in obesity and diabetes mellitus[J].Nutrition in Clinical Practice, 2015, 30(6):787-797.
[4] YANG C, WANG X, DENG Q C, et al.Rapeseed polysaccharides alleviate overweight induced by high-fat diet with regulation of gut microbiota in rats[J].Oil Crop Science, 2021, 6(4):192-200.
[5] KAPOOR K, MADAAN R, KUMAR S, et al.Role of natural products in the treatment of obesity:Nanotechnological perspectives[J].Current Drug Metabolism, 2021, 22(6):451-480.
[6] CAUSEVIC-RAMOSEVAC A, SEMIZ S.Drug interactions with statins[J].Acta Pharmaceutica, 2013, 63(3):277-293.
[7] RATNAYAKE W M N, GALLI C.Fat and fatty acid terminology, methods of analysis and fat digestion and metabolism:A background review paper[J].Annals of Nutrition and Metabolism, 2009, 55(1-3):8-43.
[8] ALBRACHT-SCHULTE K, KALUPAHANA N S, RAMALINGAM L, et al.Omega-3 fatty acids in obesity and metabolic syndrome:A mechanistic update[J].Journal of Nutritional Biochemistry, 2018, 58:1-16.
[9] 李哲斌. 香榧仁油的营养特性研究进展[J].中国油料作物学报, 2022, 44(6):1166-1172. LI Z B.Progress in nutritional property of Torreya grandis kernel oil[J].Chinese Journal of Oil Crop Sciences, 2022, 44(6):1166-1172.
[10] HE Z Y, ZHU H D, LI W L, et al.Chemical components of cold pressed kernel oils from different Torreya grandis cultivars[J].Food Chemistry, 2016, 209:196-202.
[11] PICHÉ M E, TCHERNOF A, DESPRÉS J P.Obesity phenotypes, diabetes, and cardiovascular diseases[J].Circulation Research, 2020, 127(3):e107.
[12] YAMASAKI M, KITAGAWA T, KOYANAGI N, et al.Dietary effect of pomegranate seed oil on immune function and lipid metabolism in mice[J].Nutrition, 2006, 22(1):54-59.
[13] YANG C, LI L H, YANG L G, et al.Anti-obesity and Hypolipidemic effects of garlic oil and onion oil in rats fed a high-fat diet[J].Nutrition &Metabolism, 2018, 15:43.
[14] ZHAO Y, PENG L, LU W, et al.Effect of Eclipta prostrata on lipid metabolism in hyperlipidemic animals[J].Experimental Gerontology, 2015, 62:37-44.
[15] KARR S.Epidemiology and management of hyperlipidemia[J].The American Journal of Managed Care, 2017, 23(9):S139-S148.
[16] REHMAN K, AKASH M S H.Mechanism of generation of oxidative stress and pathophysiology of type 2 diabetes mellitus:How are they interlinked?[J].Journal of Cellular Biochemistry, 2017, 118(11):3577-3585.
[17] BANKOGLU E E, GERBER J, KODANDARAMAN G, et al.Influence of bariatric surgery induced weight loss on oxidative DNA damage[J].Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2020, 853:503194.
[18] YARLA N S, POLITO A, PELUSO I.Effects of olive oil on TNF-α and IL-6 in humans:Implication in obesity and frailty[J].Endocrine, Metabolic &Immune Disorders-Drug Targets, 2018, 18(1):63-74.
[19] SHI C M, ZHU L J, CHEN X H, et al.IL-6 and TNF-α induced obesity-related inflammatory response through transcriptional regulation of miR-146b[J].Journal of Interferon and Cytokine Research, 2014, 34(5):342-348.
[20] LIU Y S, YUAN M H, ZHANG C Y, et al.Puerariae lobatae radix flavonoids and puerarin alleviate alcoholic liver injury in zebrafish by regulating alcohol and lipid metabolism[J].Biomedicine & Pharmacotherapy, 2021, 134:111121.
[21] FANG K, WU F, CHEN G, et al.Diosgenin ameliorates palmitic acid-induced lipid accumulation via AMPK/ACC/CPT-1A and SREBP-1c/FAS signaling pathways in LO2 cells[J].BMC Complementary &Alternative Medicine, 2019, 19(1):255.
[22] FERRÉ P, PHAN F, FOUFELLE F.SREBP-1c and lipogenesis in the liver:An update1[J].Biochemical Journal, 2021, 478(20):3723-3739.