风味是影响食品质量和决定消费者选择的关键因素之一。在饮食过程中,食品中风味物质先释放至口腔,通过鼻咽由后鼻嗅途径进入鼻腔,再与相对应的嗅觉受体细胞相互作用,从而产生风味感知[1]。因此,风味物质在口腔中的释放过程对食品的最终风味感知有重要影响。
近年来,大量研究集中于解析风味物质的口腔释放过程[2]。研究发现,除唾液[3]、口腔黏膜[4]、呼吸速率[5]等生理因素外,食品基质(乙醇体积分数、体系pH等)、风味物质的理化性质(油水分配系数、沸点等)也会影响风味物质在口腔中的释放[2]。乙醇是酒精饮品的重要组成部分,乙醇体积分数会直接影响酒体的整体感知[6]。MU OZ-GONZ
OZ-GONZ LEZ等[7]考察了低乙醇浓度(0.5%、5%、10%,体积分数)对葡萄酒基质中丁酸乙酯、己酸乙酯、壬酸乙酯等6种酯类物质的口腔释放量的影响,实验发现乙醇体积分数的增加会促进丁酸乙酯、戊酸乙酯等log P值(油水分配系数)较低物质的释放,同时也会抑制辛酸乙酯、癸酸乙酯等log P值较高物质的释放。白酒作为我国独具民族特色的蒸馏酒,其中含有非常丰富的风味物质[8-10],相比于葡萄酒,白酒酒精含量相对较高(30%~60%,体积分数),但是在高酒精度下,有关白酒风味物质口腔释放过程的研究相对较少。
LEZ等[7]考察了低乙醇浓度(0.5%、5%、10%,体积分数)对葡萄酒基质中丁酸乙酯、己酸乙酯、壬酸乙酯等6种酯类物质的口腔释放量的影响,实验发现乙醇体积分数的增加会促进丁酸乙酯、戊酸乙酯等log P值(油水分配系数)较低物质的释放,同时也会抑制辛酸乙酯、癸酸乙酯等log P值较高物质的释放。白酒作为我国独具民族特色的蒸馏酒,其中含有非常丰富的风味物质[8-10],相比于葡萄酒,白酒酒精含量相对较高(30%~60%,体积分数),但是在高酒精度下,有关白酒风味物质口腔释放过程的研究相对较少。
口腔顶空固相微萃取技术(oral headspace solid phase micro extraction,Oral-HS-SPME)是一种较为稳定和准确的分析口腔中风味物质的方法[4]。Oral-HS-SPME技术的原理是在品评员饮酒后,香气物质在口腔内释放,将SPME萃取针插入口腔中萃取释放的香气物质,之后,再结合GC-MS等仪器分析由萃取针解吸附出的香气物质[4]。目前,Oral-HS-SPME技术主要应用于分析葡萄酒中的香气物质[4,7,11],近两年,YU等[12-13]优化了Oral-HS-SPME的条件参数,将Oral-HS-SPME技术结合全二维气相色谱-质谱联用仪应用于我国白酒中,分析了酱香型和浓香型白酒香气物质在口腔中的释放,解析了成品白酒中醇、醛、酸、酯等共91种香气物质的释放过程。然而成品白酒基质非常复杂,酒体乙醇体积分数、pH、不同种类化合物等因素都可能会影响香气物质的释放。因此,有必要在一个基质较为简单、影响因素较少的体系中去进一步分析白酒风味物质的释放规律。
酯类物质是酒类饮品最重要的一类香气物质[14-17],为了分析高乙醇体积分数下酯类物质在口腔中的释放过程,本实验控制实验参数,减少其他因素对酯类物质释放的影响,以溶解于较高乙醇体积分数中的酯类物质为研究对象,应用Oral-HS-SPME技术分析不同体积分数乙醇对酯类物质在口腔中吸附和释放过程的影响,研究结果有助于进一步认知香气物质的口腔释放机制。
1 材料与方法
1.1 材料与试剂
本实验参考白酒酯类物质的相关研究[15,18-19],选出20种典型酯类物质进行实验(表1)。所有酯类物质纯度均高于97%、食品级乙醇(纯度≥99%),上海安谱;2-辛醇(123-96-6,纯度≥98%)、碳酸氢钠、氯化钙,上海国药;纯净水,杭州哇哈哈。
表1 本实验所用酯类物质及其相关理化性质
Table 1 Physicochemical properties of the esters employed in this study
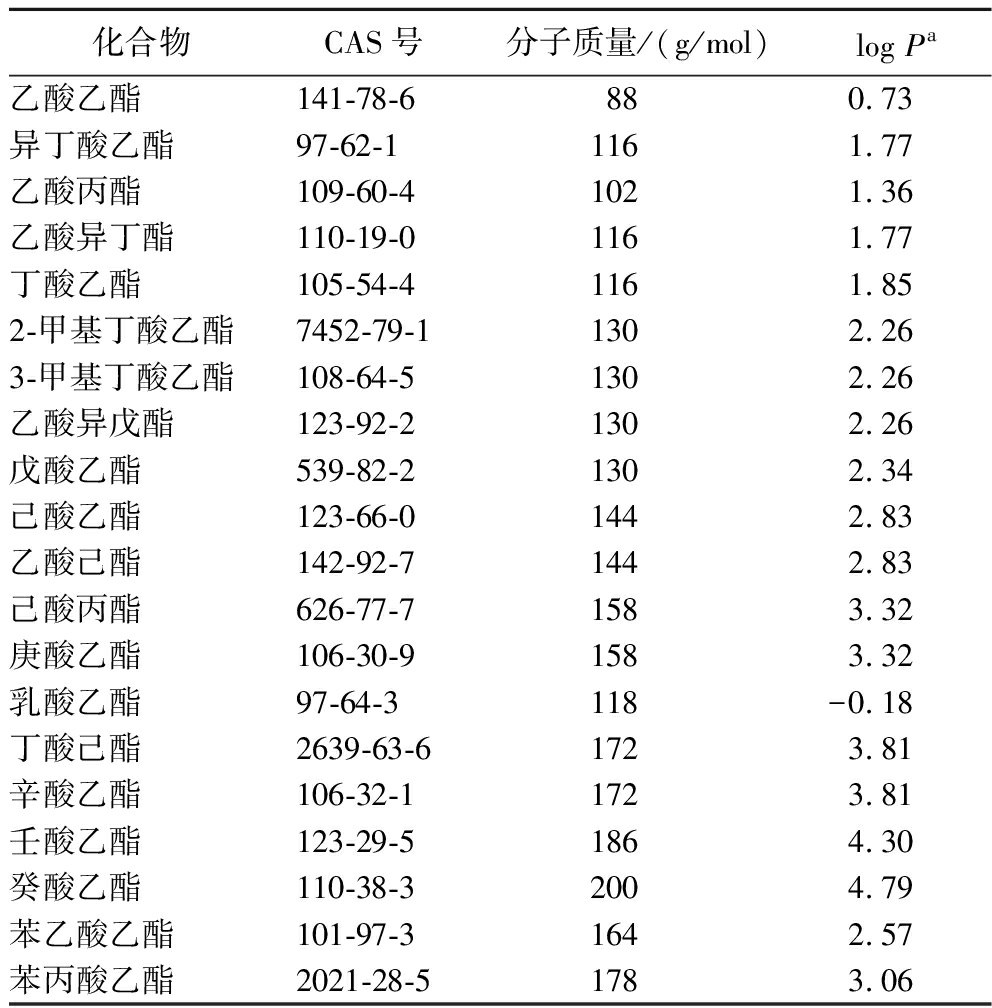
化合物CAS号分子质量/(g/mol)log Pa乙酸乙酯141-78-6880.73异丁酸乙酯97-62-11161.77乙酸丙酯109-60-41021.36乙酸异丁酯110-19-01161.77丁酸乙酯105-54-41161.852-甲基丁酸乙酯7452-79-11302.263-甲基丁酸乙酯108-64-51302.26乙酸异戊酯123-92-21302.26戊酸乙酯539-82-21302.34己酸乙酯123-66-01442.83乙酸己酯142-92-71442.83己酸丙酯626-77-71583.32庚酸乙酯106-30-91583.32乳酸乙酯97-64-3118-0.18丁酸己酯2639-63-61723.81辛酸乙酯106-32-11723.81壬酸乙酯123-29-51864.30癸酸乙酯110-38-32004.79苯乙酸乙酯101-97-31642.57苯丙酸乙酯2021-28-51783.06
注:a log P=油水分配系数由软件EPIWEB4.1计算得出。
1.2 仪器与设备
6890 N-5977A气相色谱-质谱联用仪,美国安捷伦;固相微萃取手柄、DVB/CAR/PDMS三相SPME萃取头,美国Supelco;磁力搅拌器,上海一恒仪器。
1.3 实验方法
1.3.1 酯类混合酒样的制备
根据实验条件,将20种酯类物质溶解至不同体积分数(10%、30%、50%、70%)的乙醇水溶液中,所有混标酒样中酯类物质的质量浓度均为5 mg/L,配制完成后置于-20 ℃冰箱备用。
1.3.2 品评员的培训
由于在本实验中,待测酒样需要经过品评员的口腔加工,因此在实验起始阶段,先要对品评员进行培训,以确保实验能够准确进行。由于品评员的个人差异对风味物质在口腔中的吸附和释放过程有一定影响[11],本实验挑选3名长期从事感官品评实验的品评员(2名女生,1名男生,年龄20~22岁)组成感官品评小组进行实验。为了减少其他因素对实验结果的影响,在实验开始前2 h内,要求3位品评员不允许进食与吸烟;在开始实验前15 min,要求3位品评员依次刷牙,使用稀碳酸氢钠溶液和纯净水漱口;且在每次开始实验前,重复告知品评员具体实验流程。
1.3.3 Spit-off odorant measurement procedure(SOOM)分析方法
为了考察酯类物质在口腔黏膜上的吸附,本研究参考ESTEBAH-FERN NDEZ等[4]和BUETTNER等[20]建立的SOOM法并稍加修改。具体实验流程为:品评员饮入5 mL溶解于50%乙醇水溶液中的酯类混标酒样,不吞咽酒样,使酒样在口中回旋,保持15 s后吐出酒样,收集吐出的酒样。使用饱和氯化钙溶液将收集到的酒样定容至25 mL,处理后的酒样置于-20 ℃冰箱备用。
NDEZ等[4]和BUETTNER等[20]建立的SOOM法并稍加修改。具体实验流程为:品评员饮入5 mL溶解于50%乙醇水溶液中的酯类混标酒样,不吞咽酒样,使酒样在口中回旋,保持15 s后吐出酒样,收集吐出的酒样。使用饱和氯化钙溶液将收集到的酒样定容至25 mL,处理后的酒样置于-20 ℃冰箱备用。
初始酯类混标溶液中酯类物质的分析:取5 mL乙醇的体积分数分别为10%、30%、50%和70%酯类混标酒样,同样使用饱和氯化钙溶液将其定容至25 mL,之后取10 mL,加入2-辛醇(使其最终质量浓度为200 μg/L)作为内标,装入顶空瓶中进行顶空固相微萃取(headspace solid phase microextraction,HS-SPME)。吐出酒样中酯类物质的分析:取已处理完成的品评员吐出酒样10 mL,加入2-辛醇(使其最终质量浓度为200 μg/L)作为内标,装入顶空瓶中进行HS-SPME。HS-SPME条件为:50 ℃预热5 min后,使用磁力转子搅拌萃取吸附50 min,萃取完成后,迅速将萃取针插入温度为250 ℃的GC-MS进样口解吸附5 min,最后进行GC-MS分析。在完成每次进样分析后,需要对萃取头清理10 min以避免风味物质在萃取头上残留。以上所有样品均由3个品评员进行分析,且每个样品分析3次,最后取9个实验结果的平均值。
口腔黏膜对酯类物质吸附率的计算如公式(1)、公式(2)所示:
香气吸附率![]() 吐出酒样中酯类物质回收率
吐出酒样中酯类物质回收率
(1)
吐出酒样中酯类物质回收率![]()
(2)
式中:a前为初始酯类混标酒样中各酯类的色谱峰面积;a后为品评员吐出酒样中与吐前相对应的各酯类的色谱峰面积。
1.3.4 口腔顶空固相微萃取法(Oral-HS-SPME)
实验所用Oral-HS-SPME方法参考PÉREZ-JIM NEZÉ等[21]研究并加以改进。具体实验流程为:品评员饮入标准酯类酒样5 mL,不吞咽酒样,使酒样在口中回旋,保持15 s后吐出酒样(该部分品评过程与前面所述SOOM方法中的品评过程相同);之后迅速屏住嘴巴正常呼吸,保持30 s后,将SPME三相萃取头插入口中进行萃取,萃取过程中仍保持屏住嘴巴正常呼吸,萃取时间2 min;萃取完成后,迅速将萃取针插入温度为250 ℃的GC-MS进样口解吸附5 min,最后进行GC-MS分析。在完成每次进样分析后,需要对萃取头清理10 min以避免风味物质在萃取头上残留。
应用上述方法完成以下实验:品评员分别饮入溶解于体积分数为10%、30%、50%、70%乙醇水溶液中酯类标准溶液5 mL,完成品评后(方法同上),吐出酒样,之后屏住嘴巴正常呼吸,分别保持30 s、2 min、4 min后,进行Oral-HS-SPME结合GC-MS分析。以上所有样品均由3个品评员进行分析,且每个样品分析3次,最后取9个实验结果的平均值。
1.3.5 GC-MS分析条件
色谱条件:VF-WAX色谱柱(60 m×250 μm×0.5 μm),进样口温度为250 ℃,不分流进样,氮气为载气,流速1 mL/min,升温程序:烘箱初始温度50 ℃,保持2 min,以4 ℃/min速率升温到180 ℃,然后以10 ℃/min升到240 ℃,保持5 min。
质谱条件:电子轰击离子源,离子源温度230 ℃,四级杆温度150 ℃,电离能量70 eV,扫描范围m/z 40~400,溶剂延迟5 min。
1.4 数据分析
使用EPIWEB4.1软件计算酯类物质的油水分配系数(log P),使用Microsoft Office Excel 2010对数据进行皮尔森相关性分析和单因素显著性差异分析(P<0.05);数据图使用Origin 9制作,并使用Adobe Illustrator CS4对图进行文字添加与修饰。
2 结果与分析
2.1 不同体积分数乙醇对酯类物质口腔吸附率的影响
当酒体饮入口中,口腔黏膜对酒体有一定的吸附作用,该吸附作用会影响风味物质在口腔中的驻留及释放[11]。为了考查口腔黏膜在不同乙醇体积分数下对酯类物质的吸附,本实验选出20种典型白酒中酯类物质(表1),将其分别溶解于10%、30%、50%和70%(体积分数)乙醇水溶液中配制成质量浓度为5 mg/L酯类混标酒样。参考ESTEBAN-FERN NDEZ等[4]和BUETTNER等[20]的研究方法,通过分析由品评员品评后吐出酒样中酯类物质的回收率,计算酯类物质的口腔吸附率(吸附率=100%-酯类回收率)。
NDEZ等[4]和BUETTNER等[20]的研究方法,通过分析由品评员品评后吐出酒样中酯类物质的回收率,计算酯类物质的口腔吸附率(吸附率=100%-酯类回收率)。
实验结果显示(图1),酯类混标酒样在口中保持15 s后,溶解于10%乙醇水溶液中的20种酯类物质口腔吸附率较低(1.4%~22.9%),除乳酸乙酯、苯乙酸乙酯、苯丙酸乙酯外,其他酯类物质在10%乙醇下的口腔吸附率均显著低于它们相应溶解于30%、50%、70%乙醇水溶液的口腔吸附率(16.8%~76.7%);而溶解于30%、50%、70%乙醇水溶液中酯类物质(除癸酸乙酯)之间的口腔吸附率无显著性差异。实验表明,相较于溶解于10%的酯类物质,体积分数为30%的乙醇能够显著增加酯类物质的口腔吸附率(P<0.05)。
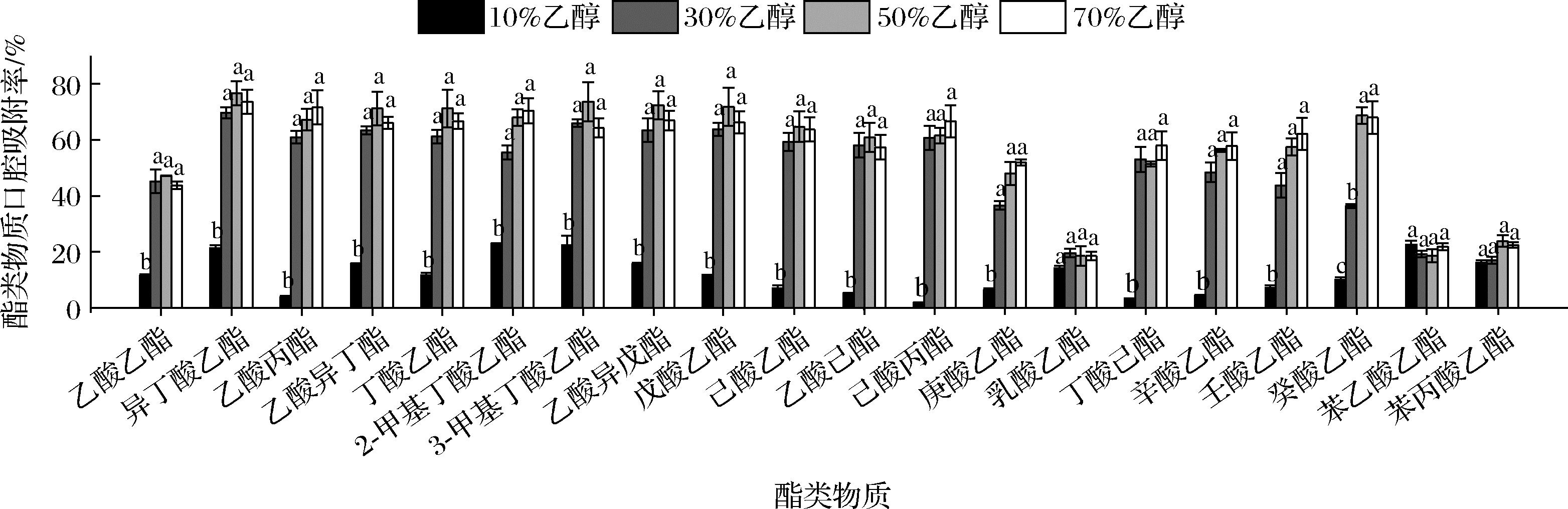
图1 不同乙醇体积分数(10%、30%、50%、70%)口腔黏膜对酯类物质的吸附率
Fig.1 Intra-oral adsorption of the esters by the oral mucosa at different ethanol water solution (10%, 30%, 50%, and 70%, volume fraction)
注:吸附率=100%-吐出酒样中酯类物质回收率;不同字母表示具有显著性差异(P<0.05)(下同)。
在之前研究中,MU OZ-GONZ
OZ-GONZ LEZ等[11]实验结果表明溶解于乙醇体积分数为10%葡萄酒基质中的丁酸乙酯、乙酸异戊酯、戊酸乙酯(油水分配系数log P值较低)的口腔吸附率高于溶解于乙醇体积分数为0.5%葡萄酒基质中的口腔吸附率,但己酸乙酯、壬酸乙酯、癸酸乙酯(log P值较高)的口腔吸附率却低于乙醇体积分数为0.5%的葡萄酒基质。相比于MU
LEZ等[11]实验结果表明溶解于乙醇体积分数为10%葡萄酒基质中的丁酸乙酯、乙酸异戊酯、戊酸乙酯(油水分配系数log P值较低)的口腔吸附率高于溶解于乙醇体积分数为0.5%葡萄酒基质中的口腔吸附率,但己酸乙酯、壬酸乙酯、癸酸乙酯(log P值较高)的口腔吸附率却低于乙醇体积分数为0.5%的葡萄酒基质。相比于MU OZ-GONZ
OZ-GONZ LEZ等[11]研究,本实验将酯类物质溶解于更高体积分数(10%~70%)的乙醇水溶液中,实验结果表明高体积分数乙醇能够增加酯类物质在口腔中的吸附。推测原因可能是在品评员品评酒样后,部分酒体由于被口腔黏膜吸附而驻留在口腔中,而乙醇体积分数的增加能够促使酯类物质更易溶解于驻留在口腔中的酒样里,因此会导致酯类物质吸附率的增加。同时实验也发现乙醇对乳酸乙酯、苯乙酸乙酯、苯丙酸乙酯口腔吸附率的影响效果较小。
LEZ等[11]研究,本实验将酯类物质溶解于更高体积分数(10%~70%)的乙醇水溶液中,实验结果表明高体积分数乙醇能够增加酯类物质在口腔中的吸附。推测原因可能是在品评员品评酒样后,部分酒体由于被口腔黏膜吸附而驻留在口腔中,而乙醇体积分数的增加能够促使酯类物质更易溶解于驻留在口腔中的酒样里,因此会导致酯类物质吸附率的增加。同时实验也发现乙醇对乳酸乙酯、苯乙酸乙酯、苯丙酸乙酯口腔吸附率的影响效果较小。
除以上理化作用外,乙醇也可能会通过生理作用影响口腔中酯类物质的代谢从而影响它们的口腔吸附率[22]。由于乙醇会抑制唾液中酯水解酶的酶活[23],降低了酯水解酶与长链酯类物质的相互作用,从而导致长链酯类物质在口腔中驻留减少。而本实验中酯类物质的口腔吸附率随乙醇体积分数提高而增加的实验现象是理化作用与生理作用共同作用的结果,且理化作用是主导因素。
2.2 不同体积分数乙醇对酯类物质口腔释放过程的影响
进入口腔中的酯类混标酒样先被口腔黏膜吸附,继而陆续释放到口腔顶空中。为了考察酯类物质在不同体积分数乙醇(10%、30%、50%、70%)中的释放过程,本实验要求品评员在吐出混标酒样后,迅速屏住嘴巴同时保持正常呼吸,让酯类物质在口腔内自然释放,并在30 s、2 min和4 min 3个释放时间点进行Oral-HS-SPME结合GC-MS分析,检测这些酯类物质在不同时间点的口腔释放量。
实验结果(图2)显示,质量浓度均为5 mg/L的酯类混标酒样在经过品评吐出后,瞬时释放(30 s)的20种酯类物质均可在口腔中被检测到;随着释放时间的延长(2、4 min),溶解于不同体积分数乙醇水溶液中的20种酯类物质在口腔中的释放量均呈现下降趋势,但下降幅度具有一定差异。释放时间为2 min时,溶解于10%、30%、50%、70%乙醇水溶液中的酯类物质,分别有12、13、11、5种物质的口腔释放量较瞬时口腔释放量(30 s)有显著性降低;释放时间为4 min时,除乙酸乙酯、乳酸乙酯这2个log P值最低的酯类物质外,其他酯类物质在4个体积分数的乙醇水溶液中的口腔释放量较瞬时口腔释放量(30 s)均显著性降低(P<0.05)。
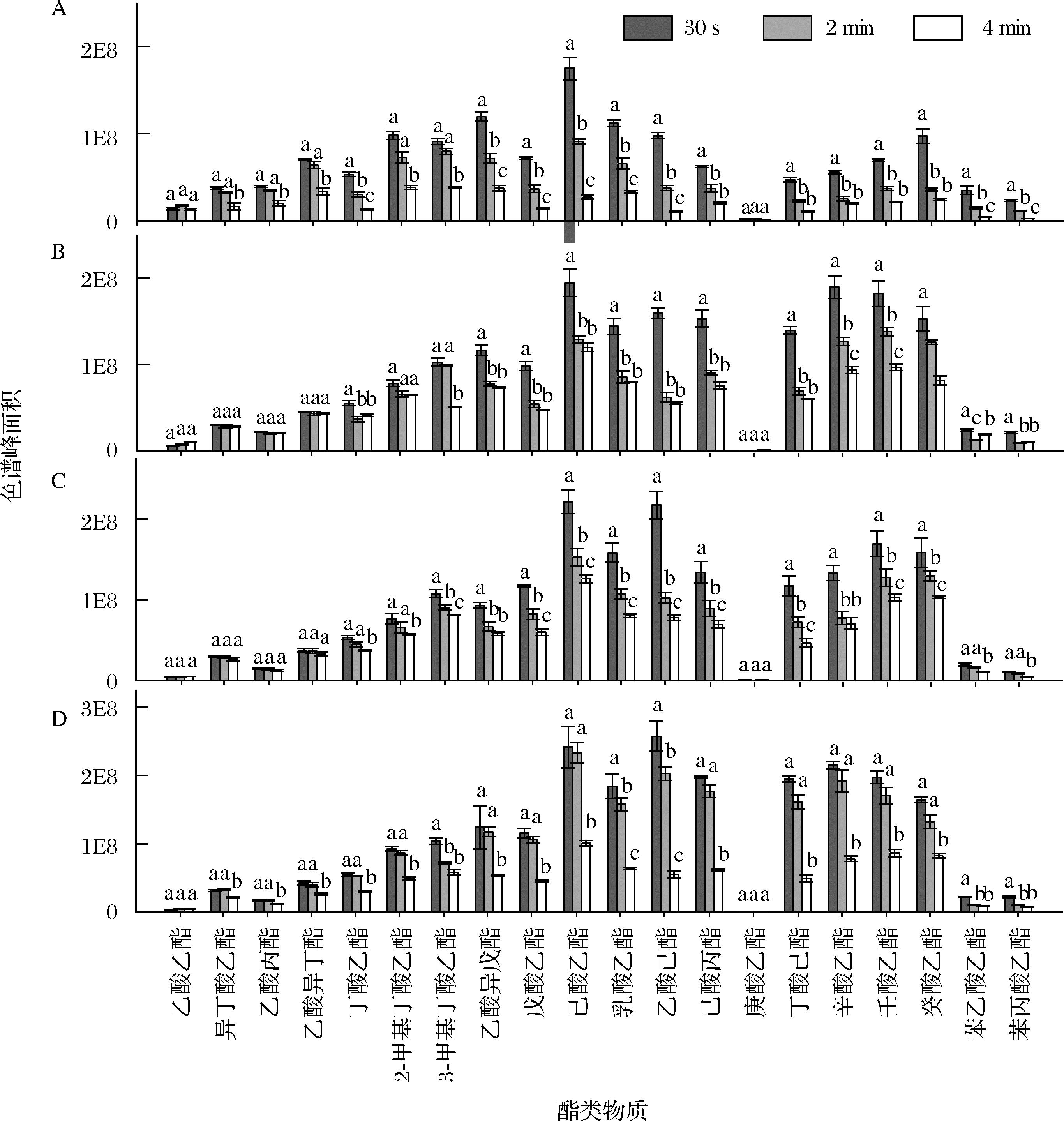
A-10%乙醇水溶液中的酯类混标酒样;B-30%乙醇水溶液中的酯类混标酒样;C-50%乙醇水溶液中的酯类混标酒样; D-70%乙醇水溶液中的酯类混标酒样
图2 驻留口腔中的酯类物质在不同时间点(30 s、2 min、4 min)的口腔释放量
Fig.2 Intra-oral release of esters with different release time (30 s, 2 min, and 4 min)
为了更好地分析乙醇对酯类物质口腔释放量的影响,实验对图2中数据进行整理,比较了在相同释放时间下溶解于不同乙醇体积分数中的20种酯类物质的口腔释放量(图3~图4)。结果显示,随着乙醇体积分数的增加(10%~70%),20种酯类物质的瞬时(30 s)口腔释放量具有不同的变化趋势。乙酸乙酯、异丁酸乙酯、乙酸丙酯、乙酸异丁酯、乳酸乙酯这些log P值较小(-0.18~1.77)酯类物质的口腔释放量有降低趋势;丁酸乙酯、2-甲基丁酸乙酯、3-甲基丁酸乙酯、乙酸异戊酯(1.85~2.26)无明显变化规律;戊酸乙酯、己酸乙酯、壬酸乙酯、癸酸乙酯等log P值较大(2.34~4.79)酯类物质的口腔释放量显著增加(P<0.05)。
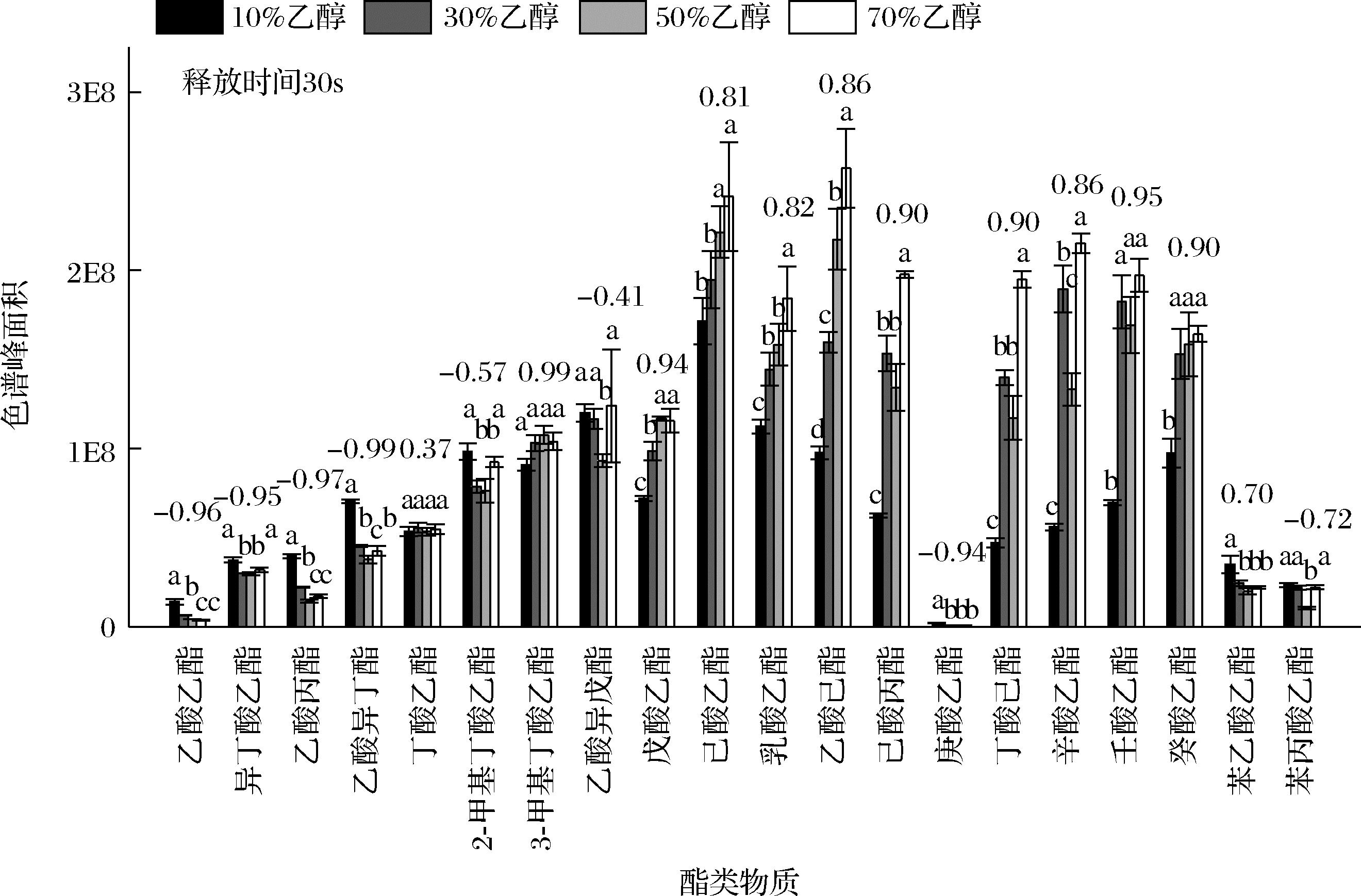
图3 驻留口腔中的酯类物质在不同乙醇体积分数(10%、30%、50%、70%)下的瞬间(30 s)口腔释放量
Fig.3 Intra-oral release of esters dissolved in different ethanol water solution (10%, 30%, 50%, and 70%, volume fraction) at the release time of 30 s
注:棒状上数字表示酯类物质的释放量与吸附率的皮尔森相关系数。
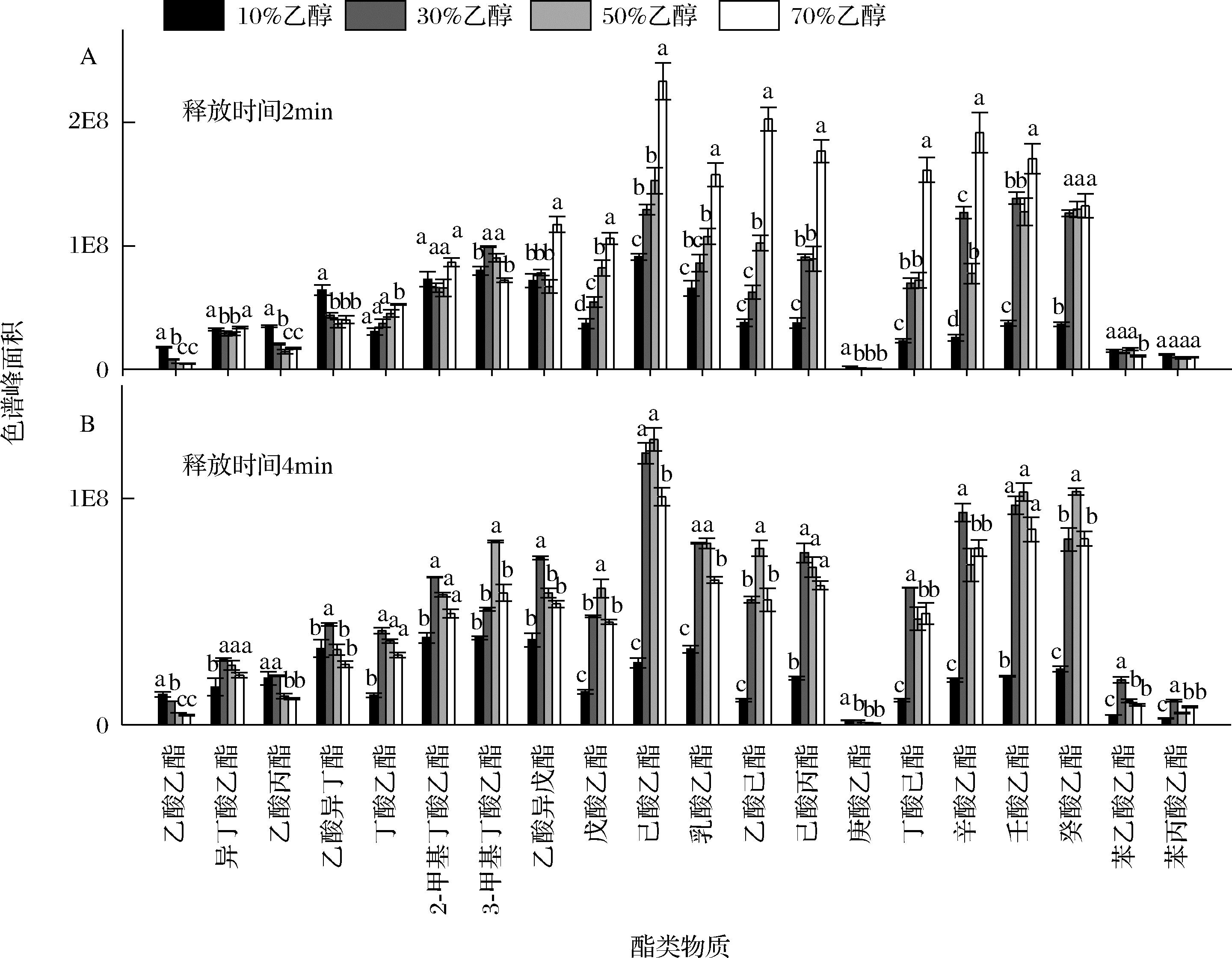
A-释放时间为2 min;B-释放时间为4 min
图4 驻留口腔中的酯类物质在不同乙醇体积分数下(10%、30%、50%、70%)释放时间为2 min和4 min时的口腔释放量
Fig.4 Intra-oral release of esters dissolved in different ethanol water solution (10%, 30%, 50%, and 70%, volume fraction) at the release time of 2 min and 4 min, respectively
之前BOELRIJK等[24]的研究显示,在低乙醇体积分数(<10%)时,乙醇对乙酸乙酯(log P=0.73)和己酸乙酯(log P=2.83)的口腔释放呈促进作用,但随着乙醇体积分数的增加(10%~40%),促进作用逐步变为抑制作用,当抑制作用到达一定程度后,进而趋于稳定,但高体积分数乙醇对log P值相对较低的乙酸乙酯的最终抑制作用要高于对log P值相对较高己酸乙酯的抑制。结合MU OZ-GONZ
OZ-GONZ LEZ等[7]、BOELRIJK等[24]的研究和本实验现象,实验推测高体积分数乙醇对酯类物质的抑制作用可能具有以下规律:随着乙醇体积分数的增加,其对酯类物质的抑制作用也会逐渐增加,当抑制作用增加至一定程度后进而趋于稳定。且高体积分数乙醇对酯类物质的最终抑制作用与它们的log P值有关,对log P较低酯类物质的抑制作用较强,对log P值较高酯类物质的抑制作用相对较弱。
LEZ等[7]、BOELRIJK等[24]的研究和本实验现象,实验推测高体积分数乙醇对酯类物质的抑制作用可能具有以下规律:随着乙醇体积分数的增加,其对酯类物质的抑制作用也会逐渐增加,当抑制作用增加至一定程度后进而趋于稳定。且高体积分数乙醇对酯类物质的最终抑制作用与它们的log P值有关,对log P较低酯类物质的抑制作用较强,对log P值较高酯类物质的抑制作用相对较弱。
同样在本研究中,高体积分数乙醇(>10%)对log P值较小(-0.18~1.77)酯类物质瞬时(30 s)口腔释放的抑制作用较强,且随着乙醇体积分数的增加,其抑制效果也会逐渐增加;对于log P值较大(2.34~4.79)物质的抑制作用相对较弱且趋于稳定。同时,乙醇体积分数的增加也会增加酯类物质的口腔吸附率,即酯类物质在口腔中的驻留量会增加,因此,理论上它们的口腔释放量也会相应增加。而实验中20种酯类物质的实际口腔释放量可能是以上2种因素竞争性作用所形成的结果。例如,对于乙酸乙酯、异丁酸乙酯等log P值较低的物质,乙醇对它们口腔释放的抑制作用更强,且该抑制作用会随着乙醇体积分数的增加而增强,所以,它们的口腔释放量呈下降趋势;而对于壬酸乙酯、癸酸乙酯等log P值较大的物质,乙醇对它们的抑制作用相对较弱且趋于稳定,所以,口腔驻留量的增加是它们口腔释放量的增加的主要因素。此外,通过分析这些酯类物质的口腔吸附率与相应口腔释放量的皮尔森相关系数(图3),也间接验证了以上观点。
在释放时间为2 min时(图4-A),13种酯类物质的口腔释放量随乙醇体积分数的增加而呈现上升趋势,同时溶解于70%乙醇水溶液中的9种酯类物质的口腔释放量显著高于其他乙醇体积分数(P<0.05)。MU OZ-GONZ
OZ-GONZ LEZ等[7]研究认为,酯类物质在口腔释放过程中,乙醇体积分数的增加会改变口腔黏膜的表面张力,进一步影响酒体在口腔中的分布,便于酒体的分散,从而导致其释放量的增加。同时,在酯类物质的释放过程中,乙醇也可能会通过马兰戈尼效应(marangoni effect)增加风味物质的在口腔中的释放。根据马兰戈尼效应,在酒体与口腔顶空界面,乙醇的挥发会导致酒体表面张力的提高,为了维持体系平衡,酒体中的乙醇分子会移动至酒体与口腔顶空界面来降低表面张力,而在乙醇移动的过程中,一些香气物质也会随乙醇移动至该界面,因此增加了它们释放量。
LEZ等[7]研究认为,酯类物质在口腔释放过程中,乙醇体积分数的增加会改变口腔黏膜的表面张力,进一步影响酒体在口腔中的分布,便于酒体的分散,从而导致其释放量的增加。同时,在酯类物质的释放过程中,乙醇也可能会通过马兰戈尼效应(marangoni effect)增加风味物质的在口腔中的释放。根据马兰戈尼效应,在酒体与口腔顶空界面,乙醇的挥发会导致酒体表面张力的提高,为了维持体系平衡,酒体中的乙醇分子会移动至酒体与口腔顶空界面来降低表面张力,而在乙醇移动的过程中,一些香气物质也会随乙醇移动至该界面,因此增加了它们释放量。
在释放时间为4 min时(图4-B),在20种酯类物质中,有18种溶解于30%和50%乙醇水溶液中酯类物质的口腔释放量高于溶解于10%和70%乙醇水溶液中的酯类。说明中等体积分数乙醇(30%~50%)能够增加酯类物质的口腔滞留度。分析原因可能是乙醇体积分数的增加,导致它们在口腔中的驻留量增加,而相比于溶解于70%乙醇水溶液中的酯类,溶解于30%和50%乙醇水溶液中的酯类释放速度相对缓慢,因此导致它们的口腔滞留度增加。而溶解于70%乙醇水溶液中的酯类,高体积分数乙醇加速了它们在口腔中的释放(图4-A),而溶解于30%、50%、70%乙醇水溶液中酯类物质的口腔驻留量并无较大差异(图1),从而导致在4 min时,溶解于70%乙醇水溶液中酯类物质的口腔释放量低于溶解于30%和50%乙醇水溶液中的酯类。
此外,本实验发现不同体积分数乙醇对苯乙酸乙酯和苯丙酸乙酯的口腔吸附率和口腔释放量的影响较小,而BOELRIJK等[24]研究发现乙醇体积分数的增加(2.5%~40%)对2,5-二甲基吡嗪在口腔中的释放无明显影响;由此推测乙醇对该类含芳香环的风味物质在口腔中的释放量影响较小。
风味物质在口腔中的释放是一个复杂的过程,除上述理化因素外,乙醇与唾液中酶类的相互作用也可能影响风味物质在口腔中的释放[16,25],后续实验会从该方面分析乙醇对风味物质口腔释放过程的影响。
3 结论
本研究以溶解于不同体积分数(10%、30%、50%、70%)乙醇水溶液中的20种白酒典型酯类物质为研究对象,考察乙醇对它们在口腔中的吸附和释放过程(30 s、2 min、4 min)的影响。研究表明,a)随着乙醇体积分数的增加(10%~70%),17种酯类物质在30%乙醇水溶液中的口腔吸附率显著高于溶于10%乙醇水溶液中的酯类(P<0.05);b)在酯类物质的口腔释放过程中,乙醇体积分数的增加,会降低log P值(油水分配系数)较低酯类物质的瞬时口腔释放量(30 s),增加log P值较高物质的瞬时口腔释放量,推测该实验现象是高体积分数乙醇对log P值不同酯类物质的抑制效果存在差异和酯类物质在口腔中驻留量的增加两者竞争性作用的结果;c)随着释放时间的延长,在释放时间为2 min时,体积分数为70%的乙醇能够促进酯类物在口腔中的释放;释放时间为4 min时,30%和50%的乙醇能够增加酯类物质的口腔滞留度。此外,酯类物质在口腔释放的过程中,乙醇与唾液中酶类的相互作用也可能影响风味物质在口腔中的释放,后续实验会从该方面分析乙醇对风味物质口腔释放过程的影响。
[1] NEGOIAS S, VISSCHERS R, BOELRIJK A, et al.New ways to understand aroma perception[J].Food Chemistry, 2008, 108(4):1247-1254.
[2] LYU J H, CHEN S, NIE Y, et al.Aroma release during wine consumption:Factors and analytical approaches[J].Food Chemistry, 2021, 346:128957.
[3] BUETTNER A, BEER A, HANNIG C, et al.Observation of the swallowing process by application of videofluoroscopy and real-time magnetic resonance imaging-consequences for retronasal aroma stimulation[J].Chemical Senses, 2001, 26(9):1211-1219.
[4] ESTEBAN-FERN NDEZ A, ROCHA-ALCUBILLA N, MU
NDEZ A, ROCHA-ALCUBILLA N, MU OZ-GONZ
OZ-GONZ LEZ C, et al.Intra-oral adsorption and release of aroma compounds following in-mouth wine exposure[J].Food Chemistry, 2016, 205:280-288.
LEZ C, et al.Intra-oral adsorption and release of aroma compounds following in-mouth wine exposure[J].Food Chemistry, 2016, 205:280-288.
[5] BUETTNER A, BEAUCHAMP J.Chemical input-Sensory output:Diverse modes of physiology-flavour interaction[J].Food Quality and Preference, 2010, 21(8):915-924.
[6] ICKES C M, CADWALLADER K R.Effects of ethanol on flavor perception in alcoholic beverages[J].Chemosensory Perception, 2017, 10(4):119-134.
[7] MU OZ-GONZ
OZ-GONZ LEZ C, PÉREZ-JIMÉNEZ M, CRIADO C, et al.Effects of ethanol concentration on oral aroma release after wine consumption[J].Molecules, 2019, 24(18):3253.
LEZ C, PÉREZ-JIMÉNEZ M, CRIADO C, et al.Effects of ethanol concentration on oral aroma release after wine consumption[J].Molecules, 2019, 24(18):3253.
[8] JIN G Y, ZHU Y, XU Y.Mystery behind Chinese liquor fermentation[J].Trends in Food Science &Technology, 2017, 63:18-28.
[9] HONG J X, ZHAO D R, SUN B G.Research progress on the profile of trace components in Baijiu[J].Food Reviews International, 2023, 39(3):1666-1693.
[10] 凌与听, 陈双, 徐岩, 等.采用顶空固相微萃取结合全二维气相色谱-飞行时间质谱技术解析不同陈酿时间古井贡酒挥发性组分特征[J].食品与发酵工业, 2022, 48(17):241-248. LING Y T, CHEN S, XU Y, et al.Analysis of characteristics in volatile component of Gujinggong Baijiu with different aging times based on HS-SPME-GC×GC-TOFMS[J].Food and Fermentation Industries, 2022, 48(17):241-248.
[11] MU OZ-GONZ
OZ-GONZ LEZ C, PERÉZ-JIMÉNEZ M, POZO-BAY
LEZ C, PERÉZ-JIMÉNEZ M, POZO-BAY N M
N M  .Oral persistence of esters is affected by wine matrix composition[J].Food Research International, 2020, 135:109286.
.Oral persistence of esters is affected by wine matrix composition[J].Food Research International, 2020, 135:109286.
[12] YU Y M, CHEN S, NIE Y, et al.Optimization of an intra-oral solid-phase microextraction (SPME) combined with comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry (GC×GC-TOFMS) method for oral aroma compounds monitoring of Baijiu[J].Food Chemistry, 2022, 385:132502.
[13] YU Y M, NIE Y, CHEN S, et al.Characterization of the dynamic retronasal aroma perception and oral aroma release of Baijiu by progressive profiling and an intra-oral SPME combined with GC×GC-TOFMS method[J].Food Chemistry, 2023, 405(Pt B):134854.
[14] XU Y Q, ZHAO J R, LIU X, et al.Flavor mystery of Chinese traditional fermented baijiu:The great contribution of ester compounds[J].Food Chemistry, 2022, 369:130920.
[15] WANG G N, JING S, WANG X L, et al.Evaluation of the perceptual interaction among ester odorants and nonvolatile organic acids in Baijiu by GC-MS, GC-O, odor threshold, and sensory analysis[J].Journal of Agricultural and Food Chemistry, 2022, 70(43):13987-13995.
[16] CHEN L, WANG Z, LIAO P F, et al.The effect of saliva on the aroma release of esters in simulated baijiu under the impact of high ethanol concentration[J].Journal of Food Composition and Analysis, 2021, 104:104134.
[17] 秦炳伟, 吕志远, 张梦梦, 等.顶空固相微萃取-全二维气相色谱-飞行时间质谱解析泉香型白酒的风味物质[J].食品与发酵工业, 2023, 49(18):289-296. QIN B W, LYU Z Y, ZHANG M M, et al.Analysis of flavor substances in spring-flavor Baijiu by HS-SPME-GC×GC-TOF-MS[J].Food and Fermentation Industries, 2023, 49(18):289-296.
[18] NIU Y W, ZHAO W Q, XIAO Z B, et al.Characterization of aroma compounds and effects of amino acids on the release of esters in Laimao Baijiu[J].Journal of the Science of Food and Agriculture, 2023, 103(4):1784-1799.
[19] NIU Y W, ZHU Q, XIAO Z B.Characterization of perceptual interactions among ester aroma compounds found in Chinese Moutai Baijiu by gas chromatography-olfactometry, odor intensity, olfactory threshold and odor activity value[J].Food Research International, 2020, 131:108986.
[20] BUETTNER A, SCHIEBERLE P.Influence of mastication on the concentrations of aroma volatiles-Some aspects of flavour release and flavour perception[J].Food Chemistry, 2000, 71(3):347-354.
[21] PEREZ-JIMÉNEZ M, CHAYA C, POZO-BAY N M
N M  .Individual differences and effect of phenolic compounds in the immediate and prolonged in-mouth aroma release and retronasal aroma intensity during wine tasting[J].Food Chemistry, 2019, 285:147-155.
.Individual differences and effect of phenolic compounds in the immediate and prolonged in-mouth aroma release and retronasal aroma intensity during wine tasting[J].Food Chemistry, 2019, 285:147-155.
[22] PÉREZ-JIM NEZÉ M, ROCHA-ALCUBILLA N, POZO-BAY N M
N M  .Effect of saliva esterase activity on ester solutions and possible consequences for the in-mouth ester release during wine intake[J].Journal of Texture Studies, 2019, 50(1):62-70.
.Effect of saliva esterase activity on ester solutions and possible consequences for the in-mouth ester release during wine intake[J].Journal of Texture Studies, 2019, 50(1):62-70.
[23] HOENSCH H.Ethanol as enzyme inducer and inhibitor[J].Pharmacology &Therapeutics, 1987, 33(1):121-128.
[24] BOELRIJK A E M, BASTEN W, BURGERING M, et al.The effect of co-solvent on the release of key flavours in alcoholic beverages;comparing in vivo with artificial mouth-MS Nose measurements[C]//Flavour research at the dawn of the twenty-first century:proceedings of the 10th Weurman flavour research symposium.2003:204-207.
[25] FRIEL E N, TAYLOR A J.Effect of salivary components on volatile partitioning from solutions[J].Journal of Agricultural and Food Chemistry, 2001, 49(8):3898-3905.