金花茶(Camellia nitidissima Chi)具有独特的金黄色蜡质花朵及其丰富的天然活性成分,被赋予植物界大熊猫”、“茶族皇后”和“国宝神茶”等美称。目前,金花茶主要研究方向是花色基因保护、栽培技术、植物系分类等,而化学成分、药理作用及机制研究较少[1-3]。在广西民间,金花茶一直被用做传统中草药,其叶和花用于治疗咽喉炎、高血压、痢疾、预防肿瘤、便血、预防肿瘤疾病[4]。而炎症是一种机体对自身的保护性反应,可以抵抗、削弱或者清除机体的有害物质,同时清除受损的组织,促进新组织的生成。因此,炎症是机体的一种自我防御保护机制[5]。现代临床医学多用抗生素或者甾体类药物来治疗过度炎症引起的各类疾病[6],这些药物在起到治疗的同时会给机体带来毒副作用,如胃溃疡、肾衰竭等,长期使用还会引起耐药性[7]。因此,从天然花卉植物中研发出具有抗炎作用的保健食品或者药物具有重要意义。
目前,对金花茶的抗炎作用研究主要是叶片,温静等[8]采用金花茶叶提取物不同萃取部位对脂多糖(lipopolysaccharides,LPS)导致的腹腔巨噬细胞炎症对的抗炎保护作用研究,发现正丁醇萃取部位的抗炎活性最强,猜测主要活性成分为三萜类物质;曾英港等[9]发现金花茶叶提取物对小鼠耳肿胀有抑制作用(P<0.05),其抗炎作用可能是通过减少炎症因子TNF-α、IL-6、IL-1β、IL-17A分泌而实现,但对金花茶花的抗炎作用研究较少。有研究表明含有丰富的黄酮类化合物的花卉植物能够起到良好的抗氧化及抗炎作用[10],在实验室前期研究中发现金花茶花含有丰富的黄酮类化合物,并有良好的抗氧化作用。因此,本研究采用70%(体积分数)乙醇溶液对金花茶花进行超声提取,并对提取物进行分离富集,测定不同组分中总黄酮、总糖、总酚、总皂苷的含量,并基于二甲苯致小鼠耳肿胀实验模型,考察不同组分的抗炎作用,以期为金花茶花活性成分的分离及天然植物抗炎物质的开发提供理论基础。
1 材料与方法
1.1 材料与试剂
健康SPF级4周龄雄性昆明小鼠,购于广州市谨为生物科技有限公司,动物许可证号SYXK (京)2019-0010,饲养温度为22~26 ℃,湿度为50%~60%,光周期为12 h明暗交替,喂以C60辐照维持饲料和蒸馏水。
金花茶花选购自广西防城港市嫦龙金花茶种植园,为广西防城港市普通金花茶花,经过干燥处理,室温下贮藏;甲酸、乙醇、浓硫酸、苯酚、碳酸钠、氢氧化钠,国药控股股份有限公司;亚硝酸钠、九水合硝酸铝,麦克林有限公司;大孔树脂XAD1600、福林酚显色剂、没食子酸标准品(纯度≥95%)、芦丁标准品(纯度≥95%)、葡萄糖标准品(纯度≥98%),上海源叶生物科技有限公司;二甲苯,西陇科学股份有限公司;吲哚美辛片(批号:20220202),上海金不换兰考制药有限公司;小鼠白细胞介素10(IL-10)、白细胞介素6(IL-6)、白细胞介素1β(IL-1β)、小鼠肿瘤坏死因子-α(TNF-α)ELISA试剂盒,江苏酶免实业有限公司;以上试剂除非特别声明,均为分析纯。
1.2 仪器与设备
KQ-500DB数控超声波清洗器,昆山市超声仪器有限公司;HH-S4数显恒温水浴锅,金坛市博朗仪器制造有限公司;Lynx6000高速落地离心机、Varioskan Flash多功能酶标仪,美国赛默飞世尔科技有限公司;N-1100V-W旋转蒸发仪、FDU-1110冷冻干燥机,东京理化器械株式会社;Cary 100紫外可见光分光光度计,美国安捷伦公司。
1.3 实验方法
1.3.1 金花茶花提取物及分离组分制备
金花茶花的超声辅助提取工艺参照本实验室方法[11]并略加修改。金花茶花提取物提取条件:金花茶花粉末按照料液比1∶10(g∶mL)、70%(体积分数)乙醇溶液,在60 ℃浸提30 min后,在超声功率为300 W、温度60 ℃下提取30 min后,在8 000 r/min下离心20 min,收集上清液,滤渣按照上述步骤再提取1次。合并2次滤液,在45 ℃旋转蒸发浓缩,并冷冻干燥后得到金花茶花提取物(Camellia nitidissima Chi flower extract,CNFE)。
金花茶花提取物的分离富集根据本实验室前期研究[12]并略加修改。将金花茶花提取物溶解于水中,配成40 mg/mL的溶液后,经3 000 r/min,离心10 min,取上清液置于处理好的XAD1600型大孔树脂柱上(8.0 cm×60 cm),依次用0、30%、70%、95%(体积分数)乙醇溶液进行梯度洗脱,收集每个组分进行减压浓缩后冷冻干燥即得水洗组(CNFE.A)、30%乙醇组分(CNFE.B)、70%乙醇组分CNFE.C)、95%乙醇组分(CNFE.D),用于后续实验。
1.3.2 金花茶花提取物及分离组分的活性成分分析
1.3.2.1 总黄酮含量测定
采用NaNO2-Al(NO3)3法[13]测定各组分中总黄酮的含量,在510 nm下测定反应后的吸光度,代入芦丁标准曲线方程y=1.008 5x+0.007 2(R2=0.998 1)计算黄酮含量,并表示为芦丁g/100 g各组分。
1.3.2.2 总糖含量测定
采用苯酚-硫酸法[14]并略加修改测定各组分中总糖的含量。在490 nm下测定反应后的吸光度,代入葡萄糖标准曲线方程y=11.982x-0.013 5(R2=0.997 8)计算总糖含量,并表示为葡萄糖g/100 g各组分。
1.3.2.3 总酚含量测定
采用福林-酚比色法[15]并略加修改测定各组分中总酚的含量;在765 nm下测定反应后的吸光度,代入没食子酸标准曲线方程y=12.03x+0.016 9(R2=0.997 5)计算总酚含量,并表示为没食子酸g/100 g各组分。
1.3.2.4 总皂苷含量测定
采用香草醛-冰乙酸法[16]并略加修改测定各组分中总皂苷的含量。在545 nm下测定反应后的吸光度,代入齐墩果酸标准曲线方程y=21.207x-0.008 4(R2=0.997 4)计算总皂苷含量,并表示为齐墩果酸g/100 g各组分。
1.3.3 金花茶花提取物及分离组分的抗炎作用
1.3.3.1 实验动物分组及给药
84只4周龄SPF级昆明小鼠购回后适应性喂养7 d,饲养温度为25 ℃,相对湿度为50%。将小鼠随机分组,为模型组(Model)和阳性对照(吲哚美辛, Indomethacin)组,实验组分别为CNFE组、CNEF.A组、CNFE.B组、CNFE.C组、CNFE.D组。根据预实验结果,各实验组按1.0 g/(kg·d)剂量灌胃,阳性组按10 mg/(kg·d)剂量给药,模型组灌胃等体积蒸馏水,每天1次,连续7 d。
1.3.3.2 二甲苯诱导小鼠急性耳肿胀实验
在最后一次给药1 h后,在各组小鼠的右耳均匀涂抹二甲苯50 μL致炎[17],左耳均不涂抹二甲苯以作对照,30 min后,依次颈椎脱臼处死小鼠,沿耳廓基线剪下其双耳,用8 mm打孔器在双耳的相同部位进行打孔,得到大小一样的耳朵组织,立即进行称重、记录,并分别按公式(1)、公式(2)计算耳肿胀度和耳肿胀抑制率:
耳肿胀度=右耳片质量-左耳片质量
(1)
耳肿胀抑制率/%=
(2)
1.3.3.3 耳朵组织病理学检查
耳片称重后,将右耳片用4%中性甲醛固定、脱水、石蜡包埋、切片,进行苏木精-伊红(hematoxylin-eosin,HE)染色,显微镜下观察各组小鼠耳组织病理学变化。
1.3.3.4 血清中IL-10、IL-6、IL-1β、TNF-α的测定
小鼠摘眼球取血,用1.5 mL离心管收集,室温血液自然凝固20 min, 3 000 r/min离心20 min, 收集上清,用酶联免疫吸附法(ELISA法)测定小鼠血清中IL-10、IL-6、IL-1β、TNF-α。具体步骤按照试剂盒说明书进行。
1.4 统计方法
采用SPSS Statistics 26.0软件进行统计分析处理,并用GraphPad Prism 8.0作图;计量数据资料用 x±s 表示,组间比较采用t检验,多组之间的数据比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果与分析
2.1 金花茶花提取物及分离组分活性成分分析
如图1所示,CNFE呈棕黄色粉末,带有独特的清新花香味,室温放置会受潮;CNFE.A呈金黄色浓稠液体,带有麦芽糖香气,遇冷变硬,遇热变软;CNFE.B带细闪浅棕色粉末,具有淡淡的植物花香,质地轻盈;CNFE.C带细闪棕黄色粉末,带有微微甘涩的花香味,质地较轻;CNFE.D呈淡黄色粉末,带有丝丝清凉的甘草味,质地轻柔、绵软。

a-CNFE;b-CNFE.A;c-CNFE.B;d-CNFE.C;d-CNFE.D
图1 金花茶花提取物及分离组分的色泽质地比较
Fig.1 Comparison of the color and texture of the extracts and isolated fractions of Camellia nitidissima Chi flowers
金花茶花含有丰富的黄酮、皂苷、多酚等多种生物活性物质。由表1可知,金花茶花提取物中活性成分主要是黄酮类化合物和糖类化合物,含量分别为(37.20±4.70) g/100 g和(34.97±4.30) g/100 g,其次是酚类化合物。该结果与吴清孝[18]的测定结果相差不大,但采用超声辅助提取可以减少提取次数、缩短提取时间以及减少乙醇使用量。CNFE经过XAD1600大孔树脂分离后,CNFE.A主要是糖类化合物,含量为(68.11±2.61) g/100 g,其原因是糖类物质在水溶液中的溶解性优于乙醇溶液;活性成分主要是集中在CNFE.B和CNFE.C,均以黄酮类居多,含量分别为(263.7±10.62) g/100 g、(157.57±14.12) g/100 g,其次是酚类化合物。
表1 金花茶花提取物及分离组分活性成分含量
Table 1 Content of active ingredients of of the extracts and isolated fractions of Camellia nitidissima Chi flower
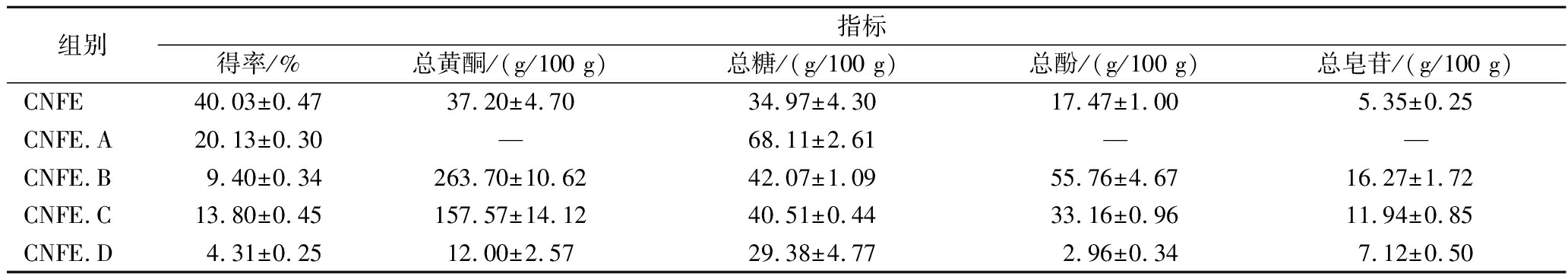
组别指标得率/%总黄酮/(g/100 g)总糖/(g/100 g)总酚/(g/100 g)总皂苷/(g/100 g)CNFE40.03±0.4737.20±4.7034.97±4.3017.47±1.005.35±0.25CNFE.A20.13±0.30—68.11±2.61——CNFE.B9.40±0.34263.70±10.6242.07±1.0955.76±4.6716.27±1.72CNFE.C13.80±0.45157.57±14.1240.51±0.4433.16±0.9611.94±0.85CNFE.D4.31±0.2512.00±2.5729.38±4.772.96±0.347.12±0.50
注:—表示无数据(下同)。
2.2 金花茶花提取物及分离组分的抗炎活性比较
2.2.1 金花茶花提取物及分离组分对二甲苯致小鼠耳肿胀的影响
实验期间,各实验组小鼠状态与实验前无差别,饮食饮水量基本稳定,没有出现异常精神状态或死亡,各组小鼠体重增长没有显著性差异。由表2可知,与Model组相比,CNFE.A组无统计学差异,表明其对小鼠耳肿胀无抑制作用;CNFE组、CNFE.B组、CNFE.C组、CNFE.D组对二甲苯致小鼠耳肿胀均有显著的抑制作用,抑制率分别为34.01%、61.79%、43.71%、42.22%。其中,CNFE.B组与Model组比较有极为显著性差异(P<0.01),其耳肿胀抑制率比Indomethacin组(46.78%)还高15%。表明CNFE对小鼠耳肿胀具有一定的抑制作用,经过分离后,除CNFE.A组对耳肿胀小鼠无抑制作用外,CNFE.B组、CNFE.C组、CNFE.D组的抑制作用均增强,以CNFE.B组抑制率为最高。张震平[19]测得石榴花黄酮粗提物中黄酮含量约28%,其中高剂量组(1 800 mg/kg)对小鼠耳肿胀抑制率32.93%。
表2 金花茶花提取物及分离组分对二甲苯致小鼠耳肿胀的影响
Table 2 Effects of the extracts and isolated fractions of Camellia nitidissima Chi flower on xylene-induced ear swelling in mice
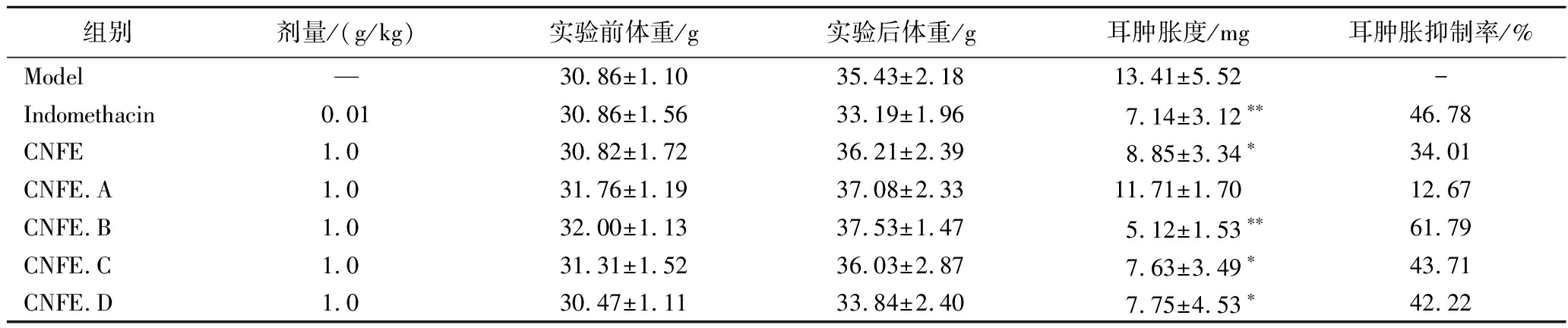
组别剂量/(g/kg)实验前体重/g实验后体重/g耳肿胀度/mg耳肿胀抑制率/%Model—30.86±1.1035.43±2.1813.41±5.52-Indomethacin0.0130.86±1.5633.19±1.967.14±3.12∗∗46.78CNFE1.030.82±1.7236.21±2.398.85±3.34∗34.01CNFE.A1.031.76±1.1937.08±2.3311.71±1.7012.67CNFE.B1.032.00±1.1337.53±1.475.12±1.53∗∗61.79CNFE.C1.031.31±1.5236.03±2.877.63±3.49∗43.71CNFE.D1.030.47±1.1133.84±2.407.75±4.53∗42.22
注:与模型组比较,*表示P<0.05,**表示P<0.01。
2.2.2 金花茶花提取物及分离组分对耳肿胀小鼠耳朵形态及组织病理学影响
由图2可知,Model组的右耳毛细血管清晰可见,耳朵肿大、增厚,肿胀程度较其他实验组明显。与Model组相比,Indomethacin组和CNFE.B组、CNFE.C组均有明显降低毛细血管的通透性、耳朵肿大。二甲苯致小鼠耳肿胀模型因其周期短、操作简单、模型稳定等优点,常用来评价一些合成化合物和植物有效成分的抗炎活性,二甲苯为无色澄清液体,涂抹于小鼠耳廓后,由于其可引起组胺、激肽等炎症介质的释放,可导致局部毛细血管通透性增加及炎症细胞浸润,从而造成耳廓急性炎症[20-21]。对小鼠涂抹二甲苯后,小鼠耳朵在短时间内毛细血管的通透性增强、清晰可见,耳朵肿大、肥大、增厚,小鼠挠耳朵动作次数增加,右耳竖立、焦躁不安。
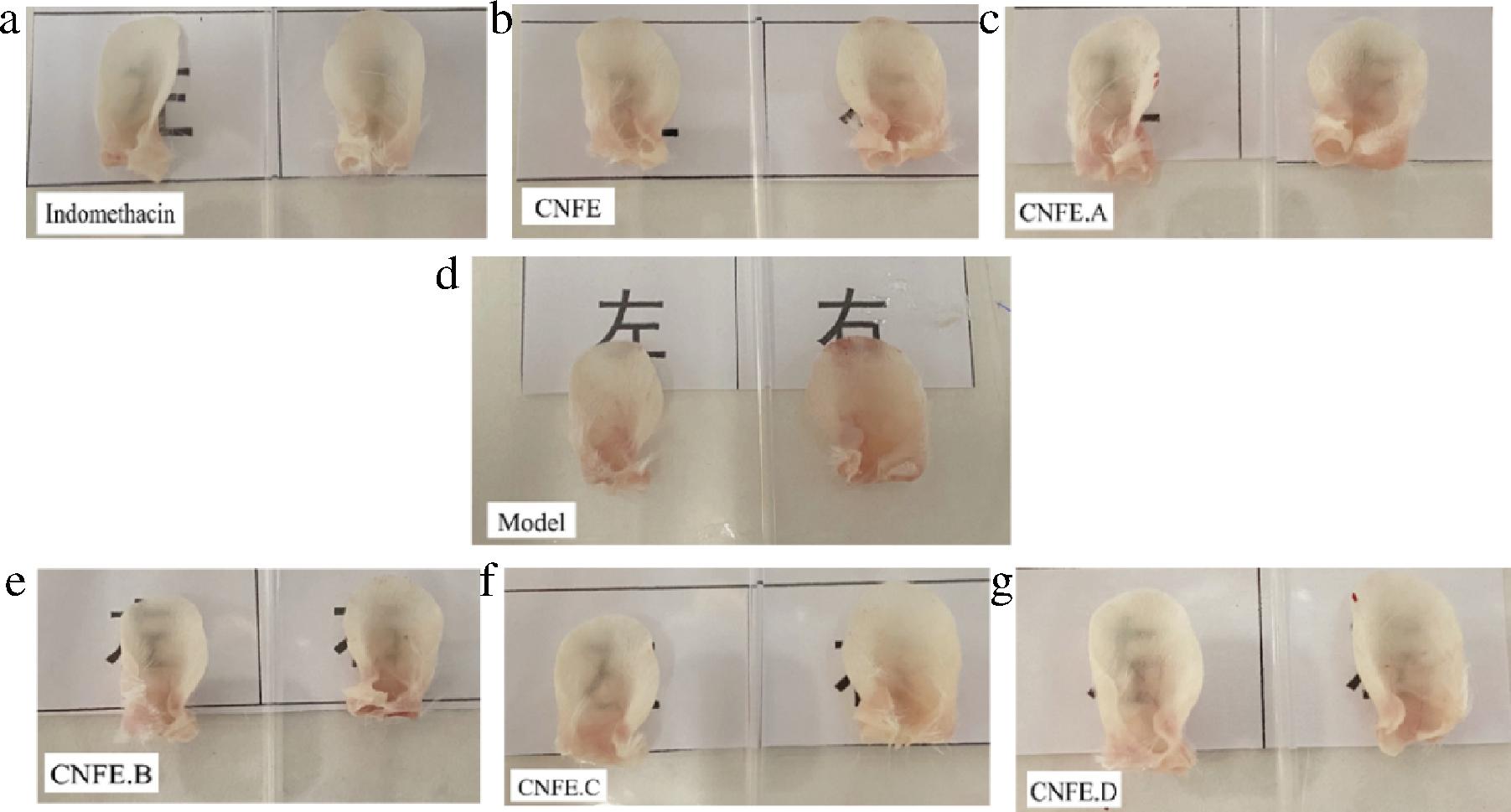
a-Indomethacin组;b-CNFE组;c-CNFE.A组;d-Model组; e-CNFE.B组;f-CNFE.C组;g-CNFE.D组
图2 金花茶花提取物及分离组分对耳肿胀小鼠耳朵形态的影响
Fig.2 Effects of the extracts and isolated fractions of Camellia nitidissima Chi flower on ear morphology of mice with ear swelling
金花茶花提取物及分离组分对耳肿胀小鼠的组织病理学影响如图3所示。Model组棘层增厚,耳软骨与皮下结缔组织被破坏,间隙增宽,横纹肌纤维离散断裂,淋巴细胞、嗜酸性粒细胞大量浸润;与Model组相比,CNFE组可以减轻棘层增厚程度、炎症细胞的浸润;CNFE.A组与Model组病理学观察最为相近,表明其没有起到明显改善小鼠耳肿胀的作用,与2.2.1节的结果保持一致;Indomethacin组、CNFE.B组肿胀程度最轻,棘层肥厚不明显,有少量淋巴细胞、嗜酸性粒细胞浸润,耳软骨与皮下结缔组织轻微破坏,横纹肌纤维未断裂;CNFE.C组、CNFE.D组肿胀程度均有减轻,炎性细胞浸润减少,表明CNFE组、CNFE.B组、CNFE.C组、CNFE.D组都具有一定的抗炎效果,以CNFE.B组为最优。
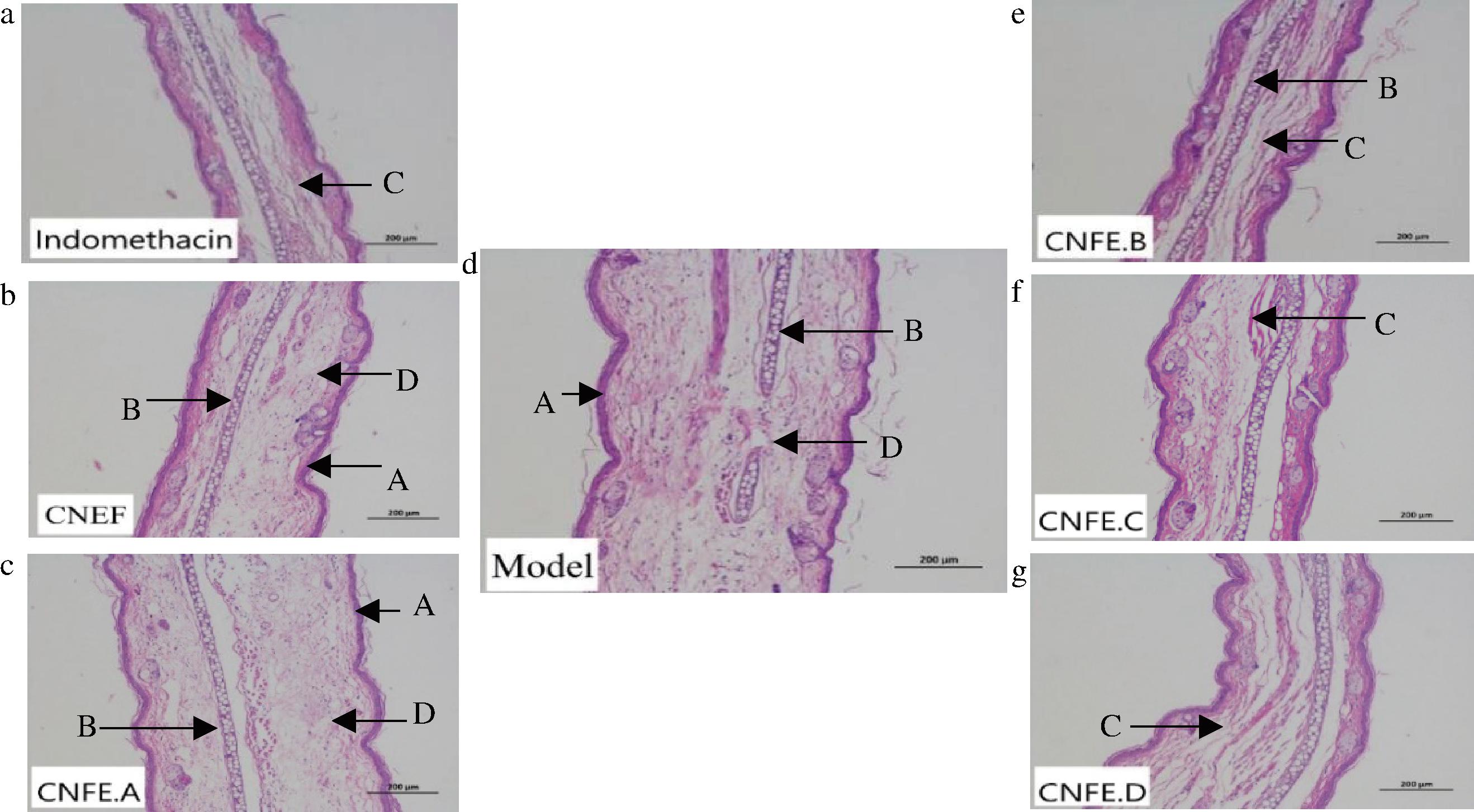
a-Indomethacin组;b-CNFE组;c-CNFE.A组;d-Model组;e-CNFE.B组;f-CNFE.C组;g-CNFE.D组 A-棘层;B-耳软骨;C-横纹肌纤维;D-淋巴细胞
图3 金花茶花提取物及分离组分对耳肿胀小鼠耳朵组织病理学观察结果(HE,×100)
Fig.3 The pathological observation of the extracts and isolated fractions of Camellia nitidissima Chi flower on ear tissue of mice with ear swelling(HE,×100)
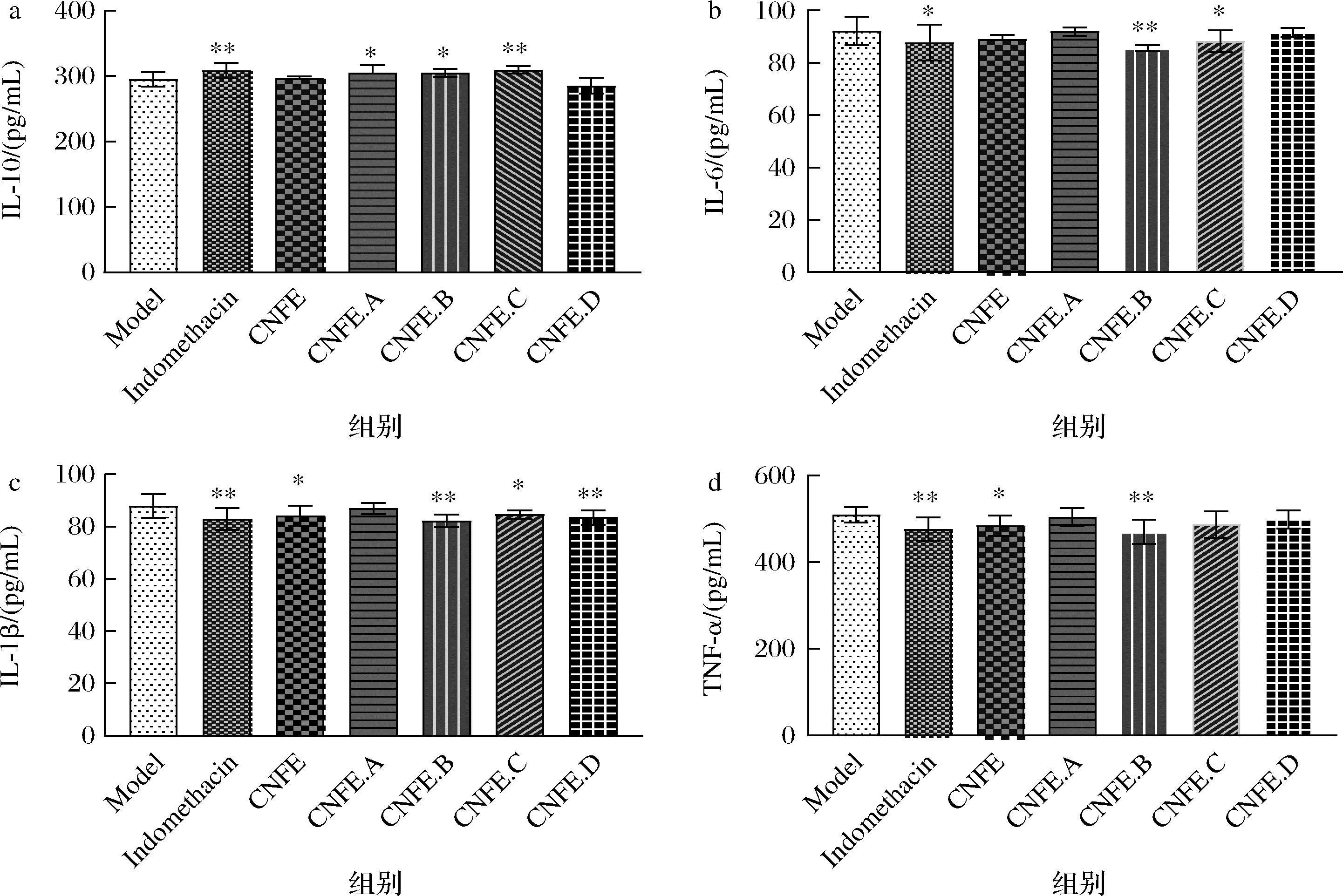
a-IL-10;b-IL-6;c-IL-1β;d-TNF-α
图4 金花茶花提取物及分离组分对小鼠血清中细胞因子水平影响
Fig.4 Effects of the extracts and isolated fractions of Camellia nitidissima Chi flower on cytokine levels in mice serum
注:与模型组比较,*表示P<0.05,**表示P<0.01。
2.2.3 金花茶花提取物及分离组分对耳肿胀小鼠血清中细胞因子水平影响
如图4所示,与Model组相比,CNFE能够降低血清中IL-1β、TNF-α的水平(P<0.05),但对IL-10、IL-6因子的分泌量没有影响;CNFE.A组和CNFE.C组可以提高抗炎因子IL-10的分泌量(P<0.05,P<0.01);Indomethacin组和CNFE.B组能够显著地降低小鼠体内的TNF-α、IL-1β和IL-6炎症因子的含量,并提高IL-10的分泌量(P<0.05,P<0.01),可有效地降低炎症的发生;CNFE.C组和CNFE.D组显著降低了IL-1β的分泌量(P<0.05,P<0.01)。这可能由于金花茶花提取物及分离组分含有的物质不一样,起到抗炎作用的机制通路不一致,造成对不同的炎症因子的响应不同。在炎症发生过程中相关免疫细胞会分泌各种炎症介质,一类为促炎因子TNF-α、IL-1β、IL-6等,一类是抗炎因子如IL-10、IL-4。TNF-α是炎症发生网络中关键因子,可以促使IL-1β、IL-6分泌增加;IL-1β可以调控炎症相关通路、趋化免疫细胞,引起发热、炎症加重。因此IL-1β是调控人体炎症网络中关键介质之一;IL-6是组织受损时迅速而短暂地产生的物质,在炎症早期可以通过抑制巨噬细胞产生白细胞介素和肿瘤坏死因子从而起到抗炎保护作用,在急性和慢性炎症中均起着关键作用;IL-10是一种多功能的抗炎因子,其可以抑制NF-κB通路的磷酸化,降低炎症介质的分泌从而发挥作用。这些介质在炎症前期可以起到消除外来病原体和修复受损的组织器官,随着炎症介质的分泌过量就会对各个器官组织产生破坏性的影响,从而导致疾病的发生[22-24]。
因而,某一种物质能够抑制生物体TNF-α、IL-1β、IL-6等炎症细胞因子产生和提高抗炎因子IL-10的分泌,均具有一定的抗炎作用。因此,CNFE发挥抗炎作用和其机理可能与下调体内炎症因子的分泌量和上调IL-10抗炎因子的含量有一定的关联性,在一定程度上能够抑制炎症因子的恶性分泌循环,防止受损组织进一步损伤。结合耳肿胀抑制率以及耳朵组织病理学观察可得5个组分中,CNFE.B为最优抗炎组分。
3 结论
金花茶花提取物能够有效抑制二甲苯致小鼠耳肿胀程度,具有良好抗炎作用,经大孔树脂分离后,活性成分主要集中在CNEF.B,以黄酮类化合物居多,且其抗炎作用为最佳,其抗炎机制可能与下调体内TNF-α、IL-1β、IL-6炎症因子的分泌量和上调IL-10炎症因子的含量有关。
[1] 石远婷. 基于简化基因组测序技术的德保金花茶和富宁金花茶的保护遗传学研究[D].桂林:广西师范大学, 2022. SHI Y T.Research on conservation genetic of camellia debaoensis and Camellia mingii based on ddRAD-seq[D].Guilin:Guangxi Normal University,2022.
[2] 何秋梅,高慧,李耀燕,等.防城金花茶叶片表型多样性及化学成分关联表型性状分析[J].食品安全质量检测学报, 2022, 13(10):3311-3319. HE Q M,GAO H,LI Y Y,et al.Analysis of phenotypic diversity and chemical composition associated phenotypic traits of Camellia nitidissima Chi leaves[J].Journal of Food Safety and Quality, 2022, 13(10):3311-3319.
[3] 王梓灵,郭瑜婕,朱芸芸,等.金花茶有效部位抑制表皮生长因子受体(EGFR)抗非小细胞肺癌的作用机制研究[J].中国中药杂志, 2021, 46(20):5362-5371. WANG Z L,GUO Y J,ZHU Y Y,et al. Active fractions of Camellia nitidissima inhibit non-small cell lung cancer via suppressing epidermal growth factor receptor[J].China Journal of Chinese Materia Medica, 2021, 46(20):5362-5371.
[4] 陈瑶,龚苏晓,徐旭,等.金花茶化学成分和药理作用研究进展[J].药物评价研究, 2022, 45(3):575-582. CHEN Y,GONG S X,XU X,et al.Research progress on chemical constituents and pharmacological studies of Camellia nitidissima[J].Drug Evaluation Research, 2022, 45(3):575-582.
[5] ADEKOLA M B, AREOLA J O, FAGBOHUN O F, et al.In-vitro antioxidant and anti-inflammatory activities of ethanol stem-bark extract of Blighia sapida K.D.Koenig[J].Journal of Pharmaceutical Analysis, 2022, 12(2):350-354.
[6] ROMANO S, SAVVA G M, BEDARF J R, et al.Meta-analysis of the Parkinson′s disease gut microbiome suggests alterations linked to intestinal inflammation[J].NPJ Parkinson′s Disease, 2021, 7(1):27.
[7] YANG X Y, GAO X L, DU B Z, et al.Ilex asprella aqueous extracts exert in vivo anti-inflammatory effects by regulating the NF-κB, JAK2/STAT3, and MAPK signaling pathways[J].Journal of Ethnopharmacology, 2018, 225:234-243.
[8] 温静,梁伟,王欣晨,等.金花茶化学成分及抗炎抗氧化活性研究[J].中国药物化学杂志, 2020, 30(8):487-492. WEN J, LIANG W, WANG X C,et al.Studies on the chemical constituents of Camellia nitidissima Chi leaves and their anti-inflammatory,anti-oxidant activity[J].Chinese Journal of Medicinal Chemistry, 2020, 30(8):487-492.
[9] 曾英港,陈辉华,钟益宁,等.金花茶叶提取物体内祛痰、抗炎作用及其机制研究[J].亚太传统医药, 2022, 18(7):21-25. ZENG Y G,CHEN H H,ZHONG Y N,et al.Studies on expectorant and anti-inflammatory effects and its mechanism of extract from leaves of Camellia chrysantha[J].Asia-Pacific Traditional Medicine, 2022, 18(7):21-25.
[10] LIU X Q, WANG S Y, CUI L L, et al.Flowers:Precious food and medicine resources[J].Food Science and Human Wellness, 2023, 12(4):1020-1052.
[11] 李石容. 金花茶茶花黄酮类化合物的分离纯化及抗氧化活性的初步研究[D].湛江:广东海洋大学, 2012. LI S R.Study on isolation and antioxidation of flavonoids from the fiowers of Camellia chrysantha[D].Zhanjiang:Guangdong Ocean University, 2012.
[12] ZHANG H L, WU Q X, WEI X, et al.Pancreatic lipase and cholesterol esterase inhibitory effect of Camellia nitidissima Chi flower extracts in vitro and in vivo[J].Food Bioscience, 2020, 37:100682.
[13] 张冀凡. 红花玉兰黄酮类物质的提取纯化及活性研究[D].北京:北京林业大学, 2020. ZHANG J F.Study on extraction, purification and activity of flavonoids from Magnolia wufengensis L.Y.Ma et L.R.Wang[D].Beijing:Beijing Forestry University, 2020.
[14] 葛琦. 金蝉花成分分析及多糖抗氧化活性研究[D]. 镇江: 江苏大学, 2019. GE Q. Analysis of components of cicada flower and study on antioxidant activity of polysaccharide[D]. Zhenjiang: Jiangsu University, 2019.
[15] 杨选平, 曹继武, 黄雪芳, 等. 福林酚比色法测定棕榈花中多酚含量的研究[J]. 黑龙江科技信息, 2017(11):128. YANG X P, CAO J W, HUANG X F, et al. Study on determination of polyphenol content in palm flower by Folin phenol colorimetry[J]. Heilongjiang Science and Technology Information, 2017(11):128.
[16] 张静. 苦瓜醇提物抗肝癌活性成分及作用机制研究[D].武汉:湖北中医药大学, 2020. ZHANG J.Study on the isolation and identification of the anti-hepatoma active components from the alcohol extract of Momordica charantia and its mechanism[D].Wuhan:Hubei University of Chinese Medicine, 2020.
[17] WANG S J, TONG Y, LU S, et al.Anti-inflammatory activity of myricetin isolated from Myrica rubra Sieb.et Zucc.Leaves[J].Planta Medica, 2010, 76(14):1492-1496.
[18] 吴清孝. 金花茶花浸提物体外抑制胃蛋白酶和胰蛋白酶的作用效果研究[D].湛江:广东海洋大学, 2021. WU Q X.Study on the inhibitory effect of Camellia nitidissima Chi flower extract on pepsin and trypsin in vitro[D].Zhanjiang:Guangdong Ocean University,2021.
[19] 张震平. 石榴花活性成分的筛选及小鼠乳房炎模型治疗效果的评价[D].乌鲁木齐:新疆农业大学, 2022. ZHANG Z P.Screening of active ingredients of pomegranate flower and evaluation of therapeutic effect in mouse mastitis model[D].Urumqi:Xinjiang Agricultural University, 2022.
[20] 周娟,张梦军,郭嘉伟,等.小鼠耳肿胀模型及药理应用[J].国际检验医学杂志, 2012, 33(17):2102-2104. ZHOU J,ZHANG M J,GUO J W, et al.Mouse ear swelling model and its pharmacological application[J].International Journal of Laboratory Medicine, 2012, 33(17):2102-2104.
[21] MA Q H, LU Y M, DENG Y, et al.Optimization for ultrasonic-microwave synergetic extraction of total iridoid glycosides and screening of analgesic and anti-inflammatory active fractions from Patrinia scabra Bunge (Valerianaceae)[J].BMC Complementary Medicine and Therapies, 2022, 22(1):7.
[22] 田璐. 艾叶化学成分分析及其抗炎功效研究[D].广州:暨南大学, 2017. TIAN L.Research on chemical constituents and anti inflammatory effects of Artemisia argyi[D].Guangzhou:Jinan University, 2017.
[23] HUANG R L, CHEN G, WANG W J, et al.Synergy between IL-6 and soluble IL-6 receptor enhances bone morphogenetic protein-2/absorbable collagen sponge-induced bone regeneration via regulation of BMPRIA distribution and degradation[J].Biomaterials, 2015, 67:308-322.
[24] 郑振霄,朱凯,戴志远.DPA体外抗炎活性及机制研究[J].中国食品学报, 2021, 21(7):44-51. ZHENG Z X,ZHU K,DAI Z Y.Studies on the anti-inflammatory profile of DPA in vitro and its mechanism [J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(7):44-51.