白酒是全球著名的蒸馏酒之一,2022年全国白酒累积产量为671.24×104 m3,浓香型白酒超过了总产量的60%。浓香型白酒生产关键设施之一的窖池性能显著地影响发酵过程及基酒的品质与风味特征[1-2]。内衬窖泥中栖息微生物群落中的功能菌群结构与丰度至关重要,且新构筑的窖池泥中功能菌群的定向驯化是一个漫长的渐进过程,需要持续使用数十年,甚至百年才能形成稳定的功能菌群[3]。因此,百年窖池的生物学功能不仅难以复刻,也是宝贵的酿酒微生物资源[4],严重地阻碍了行业的持续稳定发展。自20世纪60年代伊始,工业微生物培养技术促进了以功能菌株及优质窖泥为菌源的人工窖泥(artificial pit mud, APM)培养应用技术的开发与应用,显著地推动了浓香型白酒生产技术的进步和核心竞争力的提升[2,5]。但如何选择高活力窖泥资源及对其培养过程群落定向进化的调控面临巨大的挑战。曾报道功能菌群扰动大曲发酵,显著改善了其品质,用于浓香型白酒发酵,不仅改善了基酒的品质及产率[6],且促进了APM的理化性质及群落中功能菌群的定向进化[3],如提高了功能菌群Methanobacteriales和Methanosacinales的丰度。这些成果为开发新的APM培养与应用技术奠定了重要的基础[7]。
本研究以不同窖龄泥为对象,探讨了基于太空(taikong, TK)大曲对窖泥微生物群落及挥发性代谢组分的影响,以优质窖泥的功能菌群及代谢组分为模板[2],进行APM培养及模拟发酵实验,解析TK大曲的贡献特征和主要功能菌与代谢成分的相关性。旨在为人工窖泥高效生产与应用技术的开发奠定理论基础。
1 材料与方法
1.1 窖泥培养和应用
不同窖龄泥,常规(DZ)大曲、强化(QH)大曲、太空(TK)大曲,酒糟及黄水,泸州老窖股份有限公司(四川省泸州市)。QH大曲按照HE等[8]描述的生产工艺,按1∶1比例接种B.velezensis和B.subtilis组成的菌悬液,在曲坯中的初始浓度为2.3×106 CFU/g(以小麦干重计算)。TK大曲是通过接种10 g/kg的母曲生产的,母曲是在神舟十一号飞船的太空舱中停留了一个月的大曲粉经逐批扩大培养得到[9]。DZ大曲是按常规操作规范生产。以下所有实验均设置了3组平行。
窖泥培养物的制备:分别取50年、100年和200年窖龄泥10 g加入90 mL无菌生理盐水中充分分散混匀制备为窖泥菌悬液,以100 mL/L的接种比例接种到灭菌后的培养基中,同时接种2 g/L的TK大曲,置入厌氧瓶,通N2置换瓶中空气后密封。35 ℃条件下厌氧培养10 d。培养基:5 g/L NaHCO3、1 g/L酵母浸粉、1 g/L蛋白胨、3 g/L葡萄糖、0.2 g/L半胱氨酸盐酸盐、170 mL/L盐溶液A[3 g/L KH2PO4、6 g/L NaCl、3 g/L(NH4)2SO4、0.3 g/L CaCl2、0.3 g/L MgSO4],170 mL/L盐溶液B(3 g/L K2HPO4),150 mL/L黄水,115 ℃灭菌30 min,冷却后加0.001 g/L刃天青。
APM培养:不同窖龄泥培养物以5%(体积分数)的接种比例接种到1年龄的新泥(PM0)中,同时接种1%(质量分数)的TK大曲,室温厌氧发酵60 d。不同窖龄泥培养物的APM分别简写为APM50,APM100,APM200。
白酒酿造实验:不同窖龄泥培养物的APM涂挂在5 L塑料容器(28 cm×19 cm×14 cm)中,窖底和四周的厚度分别为4 cm和3 cm。参照企标DB 510500/T36—2016所述的步骤和条件蒸粮、冷却后,分别加入15%(质量分数)的DZ大曲、QH大曲、TK大曲混合均匀后,温度降至24 ℃入窖,常温(26~28 ℃)发酵60 d[6]。其中使用APM50,APM100,APM200和TK大曲发酵后的窖泥简写为PM50TK,PM100TK,PM200TK。使用APM100和DZ大曲及QH大曲发酵后的窖泥简写为PM100DZ和PM100QH。
1.2 仪器与设备
PHS3C pH计,大普仪器有限公司;Agilent 1260高效液相色谱,安捷伦科技有限公司;Alltech OA-1000有机酸柱,格雷斯公司;TRACE 1300-TQS 9000气相质谱联用仪,岛津(上海)实验器材有限公司;NanoDrop ND-1000分光光度计,赛默飞世尔科技公司。
1.3 理化指标检测
水分测量:采用重量法。pH和酸度:分别将窖泥与重蒸水以料液比1∶5(g∶mL)的比例混合后,室温下浸提30 min,然后用pH计测定其pH值。总酸,滴定法用0.1 mol/L NaOH溶液滴定至终点pH 8.2。总酯含量:采用皂化滴定法[6]。
1.4 有机酸含量测定
参照CHEN等[10]描述的方法测定有机酸含量。取5.000 g样品置于50 mL离心管中,加入20 mL H2SO4溶液(9 mmol/L),涡旋5 min(200 r/min)后,超声60 min(100 W,40 kHz),期间每隔15 min将其涡旋1 min,离心(4 ℃、12 000 r/min)15 min。取上清液,经活化的C18 SPE纯化柱纯化后,经0.22 μm滤膜过滤,20 mL滤液通过Agilent 1260高效液相色谱进行分析,色谱柱为Alltech OA-1000(300 mm×7.8 mm)机酸柱。色谱条件:流动相为9 mmol/L的H2SO4,流速0.6 mL/min,柱温75 ℃,紫外检测波长为210 nm。用标准品乳酸、乙酸、丁酸和己酸等的出峰时间和标准曲线对样品进行定性、定量分析。
1.5 挥发性代谢物的检测
顶空固相微萃取-气相质谱联用法[11]:称取0.500 g样品,加入20 μL辛酸甲酯(0.007 9 g/100 mL)作为内标置入萃取瓶,60 ℃水浴中平衡15 min,固相微萃取头(50/30 μm DVB/CAR/PDMS)萃取50 min后,插入气相质谱仪的进样口。GC条件:进样口温度为250 ℃;载气为高纯氦气(>99.999%);流速恒定为1 mL/min;不分流模式。柱温箱的升温程序为:初温40 ℃维持5 min,以4 ℃/min升至100 ℃,再以6 ℃/min升至230 ℃保持10 min。MS条件:离子源温度为250 ℃;传输线温度为300 ℃;电离模式为EI(70 eV);扫描范围为35~400 amu;扫描速率为1 scan/s。定性分析:与NIST 2017数据库比对后,保留正、反相似度>80%的物质进行后续分析。
1.6 微生物检测
荧光原位杂交(fluorescence in situ hybridization,FISH)法:准确称取1.00 g窖泥样品置于50 mL离心管中,加25 mL PBS缓冲液(10 mmol/L,pH 7.2),涡旋振荡5 min,离心10 min(800 r/min,4 ℃)重复洗涤沉淀3次,收集上清液离心(12 000 r/min,4 ℃)10 min,所获微生物沉淀用无菌的PBS缓冲液洗涤3次后,按照DING等[5]描述步骤进行荧光检测。所用寡核苷酸探针委托Sangon(中国上海)合成,5′端采用Cy3标记。
高通量测序:参照MU等[3]描述的方法,使用Omega Mag-bind soil DNA kit试剂盒提取DNA。1%(质量分数)的琼脂糖凝胶电泳和NanoDrop ND-1000分光光度计检测DNA的浓度、纯度和完整性。使用引物338F和806R扩增16S rRNA V3/V4高变异区域。真菌扩增区域为ITS1区。扩增的PCR产物被用于构建文库,然后在Illumina Miseq测序平台对DNA片段进行双端(Paired-end)测序。
原始测序数据主要基于QIIME2(2019.4)进行处理。首先,使用demux插件对原始序列进行解码处理,并利用cutadapt插件进行引物切除。然后使用DADA2插件对序列进行质量过滤、去噪、合并和嵌合体去除等数据处理。对上述获得的序列按100%的序列相似度进行归并,生成特征性序列ASVs以及丰度数据表格,并进一步移除仅在一个样本和单一序列中发现的ASV。最后,根据Silva(v 132)和UNITE(v 8.0)数据库,使用特征分类器插件中的classify-sklearn朴素贝叶斯分类器将物种分类分配至ASV。
1.7 数据处理
统计样本均值之间的差异显著性通过使用SPSS Statistics 22的单因素方差分析进行检验,P<0.05被认为具有统计学意义。采用Excel 2021和Origin 2021软件绘制数据并进行统计分析,结果以均数±标准差表示。采用Chao1指数和香农指数评价微生物群落α-多样性,基于Bray-Curtis距离的主坐标分析评价微生物群落β-多样性。用Simca 14.0软件和pheatmap软件分别对挥发性代谢物进行偏最小二乘判别分析和聚类热图分析。利用vegan包装进行优势菌与理化和有机酸之间的冗余分析,说明发酵环境对微生物群落结构的影响。采用线性判别分析效应量对不同窖泥样品中具有显著代表性的细菌和真菌群落进行判别分析(LDA score≥2),可视化分析在开放访问网站中执行(http://huttenhower.sph.harvard.edu/galaxy/)。
2 结果与分析
2.1 窖泥理化性质的变化
在白酒酿造生态系统中,理化指标显著影响窖泥优势菌群的形成[12],亦与窖泥的质量密切相关。如表1所示,不同窖龄APM和PM间含水率不同,范围为32.78%~34.44%,其中APM200和PM200TK最低。相关研究显示,通常优质或陈年老窖泥的pH值较高或总酸较低[13]。APM的pH值增加,发酵后的窖泥因有机酸积累pH降低。但使用TK大曲发酵后的窖泥pH值均显著高于PM100DZ和PM100QH。窖泥的总酸在强化培养和发酵后,呈现增加的趋势,其中APM100在强化窖泥样品中最高,发酵后相应的PM100TK的增幅显著低于PM100DZ和PM100QH。APM和PM的总酯含量显著增加,且APM100和PM100TK显著高于同组的其他样品。使用发酵后窖泥同企业生产中使用了2年的强化窖泥相比,pH值略高,总酸略低,总酯提高了2倍[14]。因此百年窖泥培养物的微生物代谢活性最强,在发酵过程中TK大曲更有利于控制发酵后窖泥酸度的增加,及酯类化合物的积累,显著改善了窖泥品质。
表1 窖泥理化参数
Table 1 Physicochemical parameters of pit mud
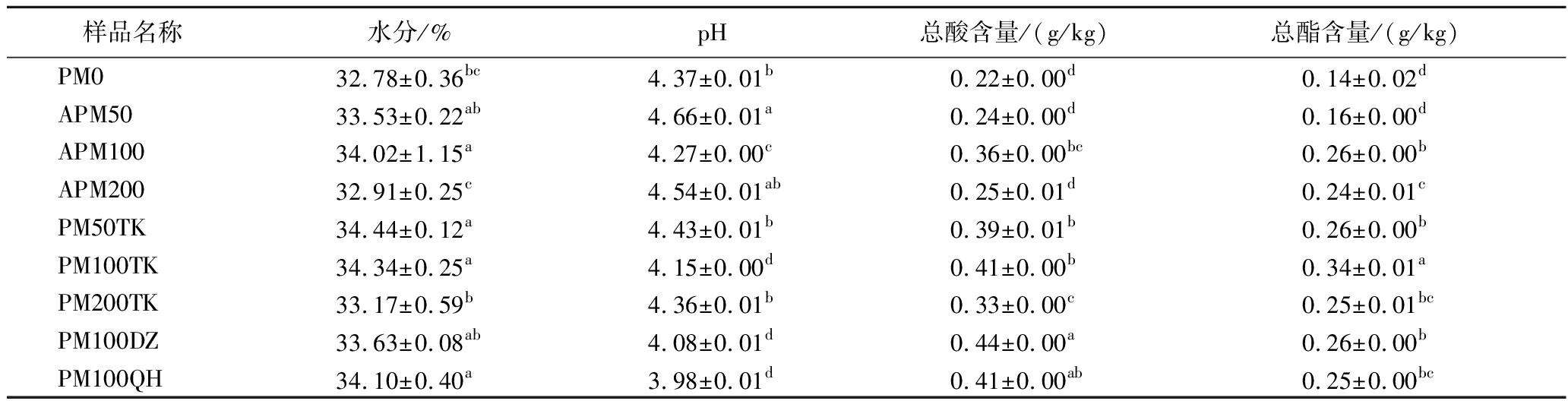
样品名称水分/%pH总酸含量/(g/kg)总酯含量/(g/kg)PM032.78±0.36bc4.37±0.01b0.22±0.00d0.14±0.02dAPM5033.53±0.22ab4.66±0.01a0.24±0.00d0.16±0.00dAPM10034.02±1.15a4.27±0.00c0.36±0.00bc0.26±0.00bAPM20032.91±0.25c4.54±0.01ab0.25±0.01d0.24±0.01cPM50TK34.44±0.12a4.43±0.01b0.39±0.01b0.26±0.00bPM100TK34.34±0.25a4.15±0.00d0.41±0.00b0.34±0.01aPM200TK33.17±0.59b4.36±0.01b0.33±0.00c0.25±0.01bcPM100DZ33.63±0.08ab4.08±0.01d0.44±0.00a0.26±0.00bPM100QH34.10±0.40a3.98±0.01d0.41±0.00ab0.25±0.00bc
注:表中小写字母不同表示窖泥样品间的差异显著(P<0.05)(下同)。
2.2 窖泥中微生物群落多样性
扩增子测序技术解析窖泥群落多样性的结果如图1所示。APM中细菌的丰富度和多样性显著提高,发酵后则降低。真菌群落的结果则相反(图1-A,图1-B),TK大曲和窖泥培养物对APM微生物群落驯化有显著效果。APM的香农指数类似优质窖泥,香农指数高有利于其生态系统功能的实现,推测强化使其具有类似优质窖泥的活性[13]。基于Bray-Curtis距离矩阵的主坐标分析结果表明,PM0,APM和PM间的细菌群落结构差异显著,分别聚为一簇(图1-C)。不同窖龄泥培养物显著影响APM及PM的真菌群落,不同属性大曲使APM100及相应的PM真菌群落结构趋于类似,聚为一簇,APM50和APM200与相应的PM分别聚为一簇(图1-D)。曾报道使用2年的强化窖泥亦有类似的结果[14],由此可见,TK大曲和窖泥培养物对APM的微生物群落的驯化有显著的效果。
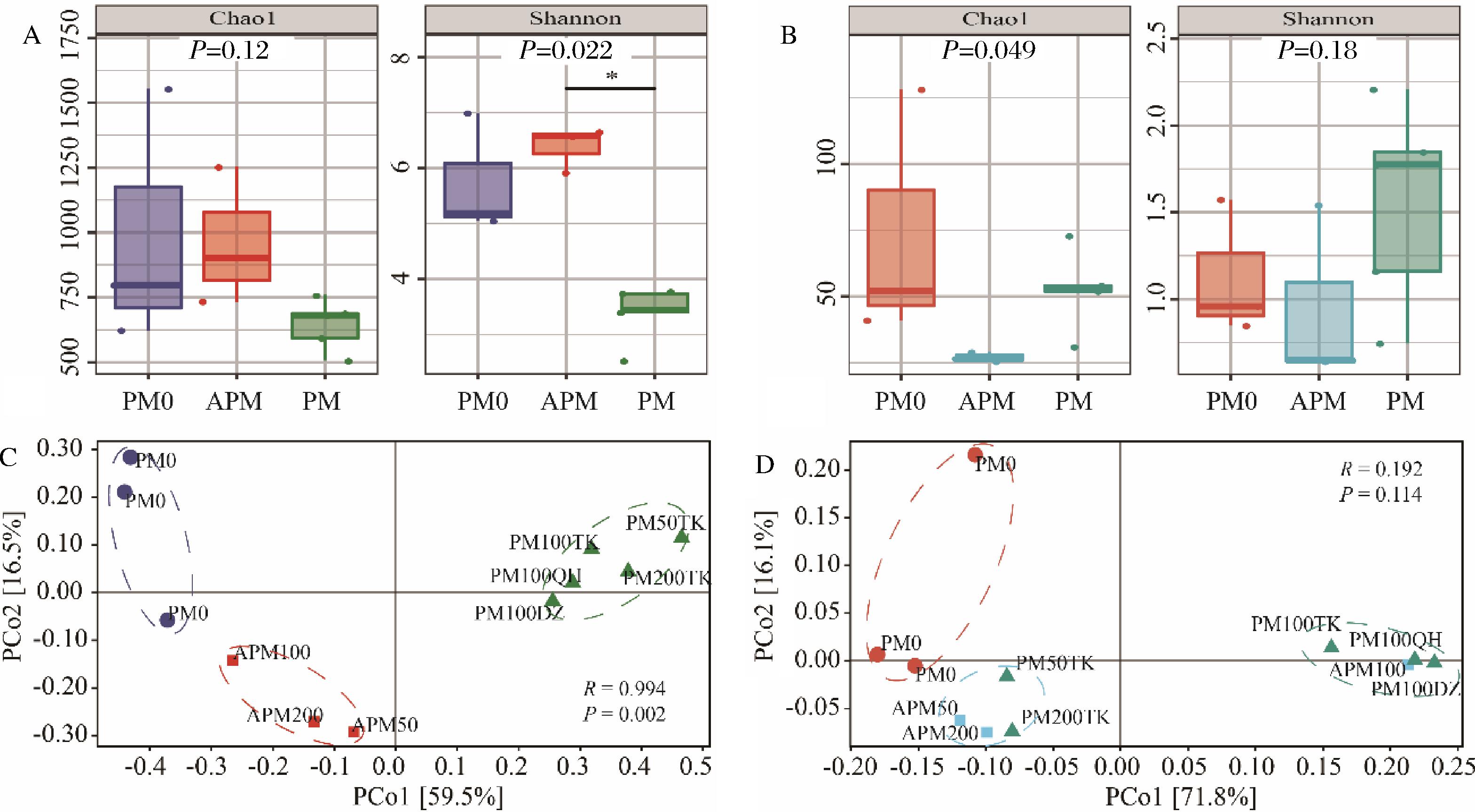
A-细菌α-多样性指数;B-真菌α-多样性指数;C-细菌β-多样性指数;D-真菌β-多样性指数
图1 窖泥样品α-多样性和β-多样性
Fig.1 α-diversity and β-diversity of pit mud samples
2.3 基于FISH技术的微生物定量评估及构成差异性分析
基于FISH技术定量分析的结果如表2所示,相比PM0,APM总菌数增加不显著,而PM显著增加,APM和PM的古菌数均显著高于PM0,但真细菌数则相反,表明APM经发酵后,窖泥中微生物数量增多。产甲烷古菌通常在新窖泥中含量较少[15],但在APM及PM中数量显著增高,且APM100和APM200显著高于APM50。作为评估窖泥质量重要参数的Methanosarcinales在PM中显著增高了2~4倍[16],尤其在PM100TK中的数量高达(9.53±0.63)×109 cells/g,Methanosarcinales具有包括糖酵解和合成己酸的潜在代谢活性。同样的,Methanomicrobiales和Methanobacteriales在PM中显著增高,在PM100TK中数量最高分别为(13.81±0.22)×109 cells/g和(12.12±0.15)×109 cells/g。APM100和TK大曲更有利于窖泥古菌群落的演替富集。此外,作为浓香型白酒酿造的关键功能菌Clostridium和Clostridium kluyveri的变化亦是如此。氢营养型产甲烷菌和Clostridium之间的种间氢转移有助于缓解氢分压对后者的抑制作用,从而有助于己酸和丁酸的形成。人工窖泥新型制备方式能加速窖泥功能菌群定向进化。
表2 FISH检测窖泥中不同微生物含量 单位:×109 cells/g
Table 2 Different microbial contents in pit mud detected by FISH

探针PM0APM50APM100APM200PM50TKPM100TKPM200TKPM100DZPM100QHDAPI40.27±1.10g52.34±0.52f58.54±0.38e52.72±0.15f80.20±0.25b88.54±0.51a88.93±0.22a74.68±0.38d77.20±1.37cEUB3383.15±0.17e6.25±0.29b9.45±0.29a6.54±0.44b5.86±0.37c9.45±0.37a5.48±0.22cd5.23±0.29d9.40±0.72aCLZ0.39±0.22g1.26±0.08f2.59±0.30c1.44±0.17ef1.55±0.15e3.59±0.29b1.99±0.15d3.93±0.30a3.78±0.22aKCLZ0.29±0.15f1.11±0.08e1.61±0.37d1.23±0.15e1.26±0.15e2.31±0.22b1.84±0.22c2.39±0.37ab2.47±0.22aARCH91514.73±0.44f21.86±0.30e27.21±0.08c24.94±0.17d23.29±0.22d34.21±0.37a28.13±0.15b30.48±0.08b31.94±1.49aMB3111.11±0.37d8.56±0.37c11.82±0.47b12.70±0.22a8.95±0.37c12.12±0.15a11.39±0.44b11.98±0.47b12.45±1.03aMG1200b11.73±0.66c5.48±0.22e12.81±0.52b10.44±0.44d12.01±0.30c13.81±0.22a10.37±0.22d12.02±0.52c13.08±0.73bMSMX8602.37±0.37f5.82±0.73e8.34±0.22bc7.80±0.47d6.12±0.44e9.53±0.63a8.33±0.15bc8.09±0.22cd8.49±0.22b
注:DAPI:总菌,EUB338:总真细菌,ARCH915:总古菌,MB311:Methanobacteriales,MG1200b:Methanomicrobiales,MSMX860:Methanosarcinales,CLZ:Clostridium,KCLZ:Clostridium kluyveri。
窖泥样品细菌群落属水平的组成轮廓如图2所示,其中优势细菌有21个属,占细菌总数的73.35%~98.70%(图2-A)。APM中乳杆菌属(Lactobacillus,LL)和梭状芽孢杆菌(Clostridium_sensu_stricto_12)的相对丰度显著高于PM0,且APM间LL的相对丰度差异显著,其相对丰度排序为:APM50(29.52%)>APM200(21.09%)>APM100(10.78%),核心功能菌Clostridium_sensu_stricto_12相对丰度是APM100(15.15%)>APM50(10.68%)>APM200(10.66%),都较PM0增高了2倍以上。结果表明,在该窖泥培养体系中,使用100年窖泥培养物更有利于Clostridium_sensu_stricto_12的增殖和LL的抑制。线性判别分析也表明Clostridium_sensu_stricto_12是APM的潜在生物标志物(图2-B),佐证了ZOU等[17]的研究结果。APM构造的模拟窖池用于发酵后,因受发酵酒醅的影响Lactobaciiius相对丰度增加,但在PM100TK中的增量最少,且PM100DZ和PM100QH中的增量也较低。适量的乳酸可以维持窖泥的理化环境,起到酸碱调节剂的作用,促进糖化和发酵能力,但乳酸含量的激增会导致窖泥微生物群落失衡,降低菌群的稳健性[18]。结果表明,基于百年老窖泥的微生物富集培养物和TK大曲发酵的人工窖泥更有利于维持窖泥群落结构稳定和优势菌Clostridium的富集。窖泥样品中共检出了10种优势真菌(图2-C),其中Candida在所样品中占优势,相对丰度为57.26%~96.13%,PM0的优势真菌是Penicillium和Pichia。Pichia的相对丰度在APM中增加至6.72%~39.90%,PM中Candida和Pichia依然是优势真菌,相对丰度分别为57.26%~88.70%和10.14%~39.07%。Candida产乙醇能力强,且能代谢合成多元醇和呋喃酮[19],Pichia则是产乙醇和高级醇的能力强[20]。线性判别分析的结果也揭示了Pichia是窖泥差异优势菌(图2-D),是浓香型白酒发酵过程中的优势酵母,在乙醇和风味醇的生产中起着关键作用[20]。
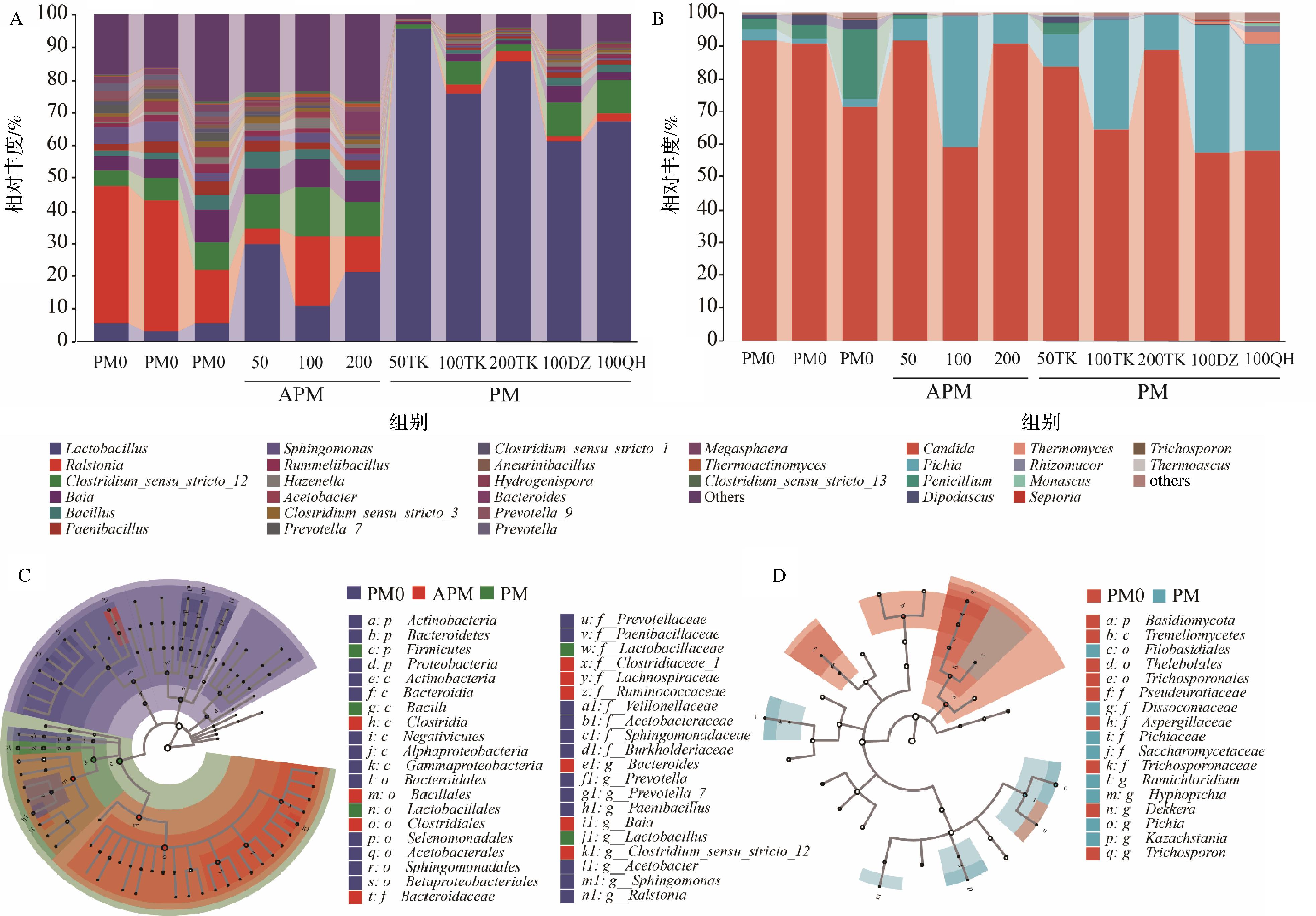
A-细菌组成;B-真菌组成;C-细菌线性判别分析;D-真菌线性判别分析
图2 窖泥微生物群落结构和组成
Fig.2 Microbial community structure and composition in pit mud
2.4 挥发性代谢物的差异分析
乳酸、乙酸、己酸、丁酸是浓香型白酒发酵过程中的关键有机酸[21]。检测结果如图3-A所示,相比APM50和APM200,APM100的乳酸含量最低,乙酸、丁酸和己酸含量最高。APM应用到发酵后,受酒醅影响除丁酸外其余有机酸含量均出现增长的现象。PM100TK乳酸增加量最低,同样的PM100DZ和PM100QH乙酸降低量和己酸增加量最高。TAO等[22]推断,在浓香型白酒发酵过程中,Clostridium能利用乳酸通过链伸长途径合成己酸,提高Clostridium丰度是改善窖泥功能活性的重要举措。窖泥中共鉴定出了120种挥发性代谢物,包括74种酯、15种醇、14种酸、2种醛、7种酮、和8种其他类。这些挥发性代谢物中己酸乙酯、己酸丙酯、己酸丁酯、己酸和丁酸等是优势组分,约占挥发性代谢物总量的55%。TK大曲和窖泥培养物影响挥发性酸、线性或支链酯在强化窖泥中的分布。APM中除酯类物质外,酸类物质的含量也较高,主要是己酸和丁酸,而PM中酯类物质的含量增加,特别是己酸乙酯(图3-B)。变量重要性投影[VIP]≥1的分析结果表明,22种挥发性代谢物被鉴定为主要差异物(P<0.05),包括脂类、酸类和醇类,大部分已被报道为浓香型白酒的芳香活性化合物[23],特别是己酸乙酯、己酸丁酯、己酸、丁酸在白酒的风味中起着至关重要的作用(图3-C)。偏最小二乘判别分析的结果表明,强化窖泥和发酵后窖泥风味化合物的组成发生了显著变化。APM主要风味化合物是己酸、辛酸和丁酸与曾报道的窖泥微生物合成酸相吻合[21]。PM则主要是己酸乙酯、己酸丙酯和2,3-丁二醇(图3-D)。己酸乙酯能产生苹果味,是影响浓香型白酒风味和品质的关键化合物,在PM100TK中的含量最高,TK大曲显著提高了窖泥的代谢活性。而窖泥中Bacillus产生的特定的风味化合物2,3-丁二醇有益于改善最终产品的风味[24]。
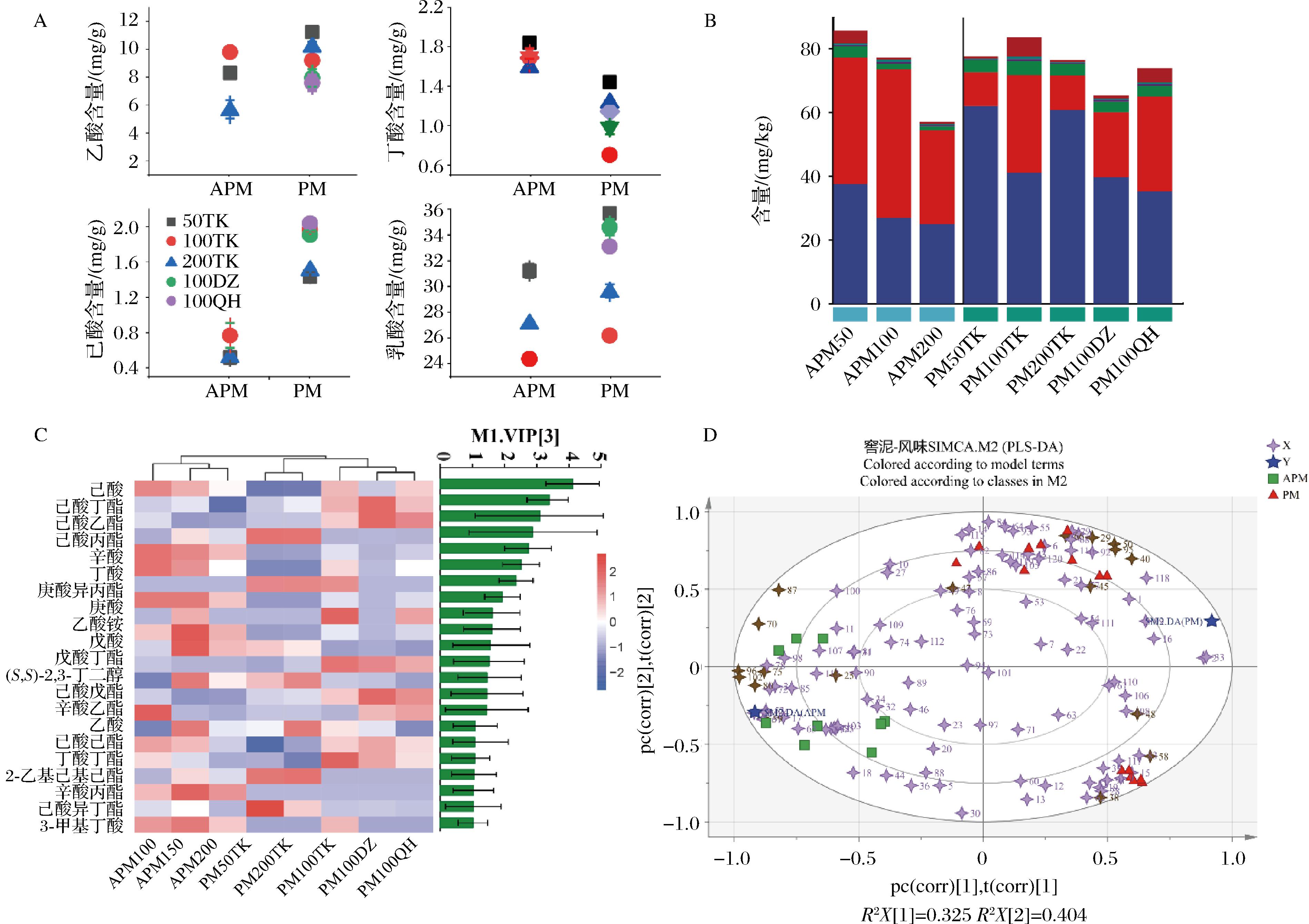
A-有机酸含量;B-挥发性代谢物总量;C-挥发性代谢物热图分析;D-挥发性代谢物偏最小二乘判别分析
图3 窖泥有机酸和挥发性代谢物
Fig.3 Organic acids and volatile metabolites in pit mud
2.5 微生物群落与主要挥发性代谢物和理化性质的关系
采用冗余分析表征窖泥中细菌和真菌群落与有机酸和理化因子之间的相关性,结果分别如图4-A和图4-B所示。酸度和pH是驱动窖泥细菌群落变化最大的非生物因素与LL呈正相关。Clostridium_sensu_stricto_12和Bacillus与丁酸和己酸呈正相关。有机酸与Bacillus呈正相关可能因Bacillus的耐酸性较强[25]。在真菌群落中,Pichia和绝大多数理化指标呈正相关,特别是总酯,总酸和己酸,Candida与pH和丁酸之间呈正相关。主要微生物群落与挥发性代谢物之间的斯皮尔曼相关系数的聚类分析结果表明,挥发性代谢物与微生物群落之间存在显著的相关性。己酸、丁酸与窖泥中主要微生物都呈显著正相关,而Clostridium_sensu_stricto_12主要与己酸、丁酸和2,3-丁二醇等呈显著正相关(图4-C),研究表明,Clostridium_sensu_stricto_12不仅能将乳酸转化为己酸,还能促进各种挥发性化合物的形成[26],这也得到了本研究相关分析的支持。因此,LL的减少和Clostridium的增加可能是窖泥挥发性代谢物含量增加的原因[3]。
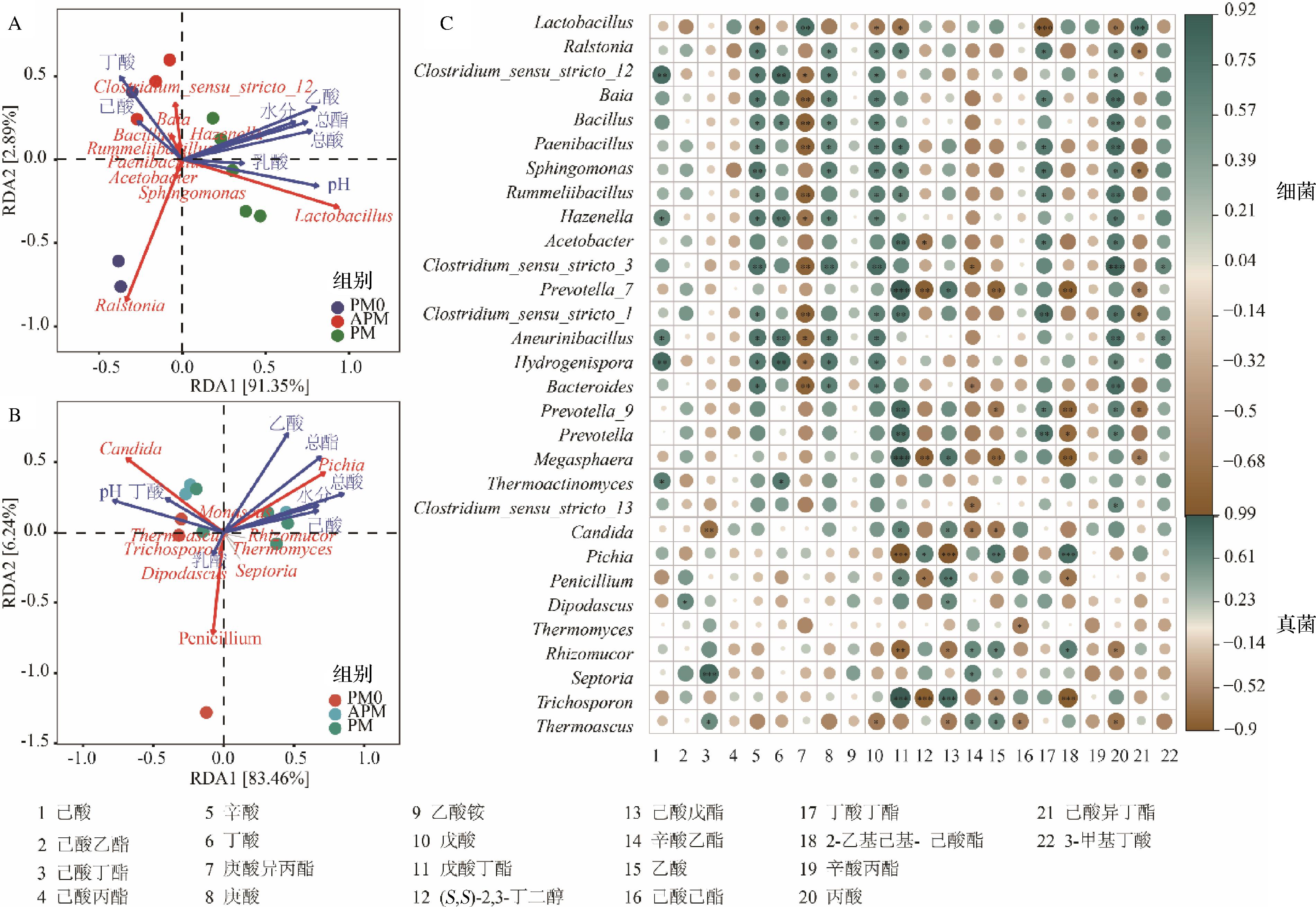
A-细菌冗余分析;B-真菌冗余分析;C-挥发性代谢物与微生物相关性热图分析
图4 理化指标和挥发性代谢物与微生物相关性分析
Fig.4 Correlation analysis of physicochemical index, volatile metabolites and microorganisms
3 结论
基于TK大曲培养不同窖龄窖泥功能菌用于APM培养的结果表明,不同窖龄泥培养物都显著提高了细菌量、群落多样性及功能菌群的数量;100年窖龄窖泥培养物是最适合APM的功能菌群源,APM100及PM100TK的LL的增幅最少,而Clustridums、Methanomicrobiales、Methanobacteriales、Candida和Pichia等功能菌的相对丰度显著提高,发酵亦改善了PM的风味轮廓,己酸乙酯、己酸丙酯、2,3-丁二醇等基酒的骨架成分的含量在PM中也显著提高。研究结果为合理利用优质窖泥资源,开发新型人工窖泥培养技术奠定了理论基础。
[1] DING X F, WU C D, HUANG J, et al.Interphase microbial community characteristics in the fermentation cellar of Chinese Luzhou flavor liquor determined by PLFA and DGGE profiles[J].Food Research International, 2015, 72:16-24.
[2] ZHANG L, ZHOU R, NIU M, et al.Difference of microbial community stressed in artificial pit muds for Luzhou-flavour liquor brewing revealed by multiphase culture-independent technology[J].Journal of Applied Microbiology, 2015, 119(5):1345-1356.
[3] MU Y, HUANG J, ZHOU R Q, et al.Exploring the response patterns of strong-flavor Baijiu brewing microecosystem to fortified Daqu under different pit ages[J].Food Research International, 2022, 155:111062.
[4] SUN Z K, CHEN C, HOU X G, et al.Prokaryotic diversity and biochemical properties in aging artificial pit mud used for the production of Chinese strong flavor liquor[J].3 Biotech, 2017, 7(5):335.
[5] DING X F, WU C D, HUANG J, et al.Eubacterial and archaeal community characteristics in the man-made pit mud revealed by combined PCR-DGGE and FISH analyses[J].Food Research International, 2014, 62:1047-1053.
[6] MAO F J, HUANG J, ZHOU R Q, et al.Effects of different Daqu on microbial community domestication and metabolites in Nongxiang Baijiu brewing microecosystem[J].Frontiers in Microbiology, 2022, 13:939904.
[7] LU M M, ZHOU W C, JI F, et al.Profiling prokaryotic community in pit mud of Chinese strong-aroma type liquor by using oligotrophic culturing[J].International Journal of Food Microbiology, 2021, 337:108951.
[8] HE G Q, DONG Y, HUANG J, et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Science and Technology, 2019, 111:1-8.
[9] MU Y, HUANG J, ZHOU R Q,et al.Comprehensive analysis for the bioturbation effect of space mutation and biofortification on strong-flavor Daqu by high-throughput sequencing, volatile analysis and metabolomics[J].Food Chemistry, 2023, 403:134440.
[10] CHEN S Q, HUANG J, QIN H, et al.Characterizing the interaction relationship of the microbial communities between Zaopei and pit mud disturbing by Daqu[J].Food Science and Biotechnology, 2021, 30(10):1357-1367.
[11] YANG M L, HUANG J, ZHOU R Q, et al.Characterizing the microbial community of Pixian Doubanjiang and analysing the metabolic pathway of major flavour metabolites[J].LWT, 2021, 143:111170.
[12] CHAI L J, QIAN W, ZHONG X Z, et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Applied and Environmental Microbiology, 2021, 87(17):e00885.
[13] HU X L, DU H, REN C, et al.Illuminating anaerobic microbial community and cooccurrence patterns across a quality gradient in Chinese liquor fermentation pit muds[J].Applied and Environmental Microbiology, 2016, 82(8):2506-2515.
[14] MU Y, HUANG J, ZHOU R Q, et al.Effects of Daqu attributes on distribution and assembly patterns of microbial communities and their metabolic function of artificial pit mud[J].Foods, 2022, 11(18):2922.
[15] TAO Y, LI J B, RUI J P, et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Applied and Environmental Microbiology, 2014, 80(7):2254-2260.
[16] FU J X, CHEN L, YANG S Z, et al.Metagenome and analysis of metabolic potential of the microbial community in pit mud used for Chinese strong-flavor liquor production[J].Food Research International, 2021, 143:110294.
[17] ZOU W, ZHAO C Q, LUO H B.Diversity and function of microbial community in Chinese strong-flavor Baijiu ecosystem:A review[J].Frontiers in Microbiology, 2018, 9:671.
[18] CAI W C, XUE Y A, TANG F X, et al.The depth-depended fungal diversity and non-depth-depended aroma profiles of pit mud for strong-flavor Baijiu[J].Frontiers in Microbiology, 2022, 12:789845.
[19] HU X L, WANG K L, CHEN M G, et al.Profiling the composition and metabolic activities of microbial community in fermented grain for the Chinese strong-flavor Baijiu production by using the metatranscriptome, high-throughput 16S rRNA and ITS gene sequencings[J].Food Research International, 2020, 138(Pt A):109765.
[20] YOU L, ZHAO D, ZHOU R Q, et al.Distribution and function of dominant yeast species in the fermentation of strong-flavor Baijiu[J].World Journal of Microbiology and Biotechnology, 2021, 37(2):26.
[21] QIAN W, LU Z M, CHAI L J, et al.Cooperation within the microbial consortia of fermented grains and pit mud drives organic acid synthesis in strong-flavor Baijiu production[J].Food Research International, 2021, 147:110449.
[22] TAO Y, WANG X, LI X Z, et al.The functional potential and active populations of the pit mud microbiome for the production of Chinese strong-flavour liquor[J].Microbial Biotechnology, 2017, 10(6):1603-1615.
[23] LIU M K, LIU C Y, TIAN X H, et al.Bioremediation of degraded pit mud by indigenous microbes for Baijiu production[J].Food Microbiology, 2022, 108:104096.
[24] HOU Q C, WANG Y R, NI H, et al.Deep sequencing reveals changes in prokaryotic taxonomy and functional diversity of pit muds in different distilleries of China[J].Annals of Microbiology, 2022, 72(1):12.
[25] WANG H, HUANG Y G, HUANG Y L.Microbiome diversity and evolution in stacking fermentation during different rounds of Jiang-flavoured Baijiu brewing[J].LWT, 2021, 143:111119.
[26] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Research International, 2017, 102:68-76.