淀粉是日常饮食中的重要碳水化合物,具有来源广泛、成本低廉的优点,广泛应用于食品和非食品领域[1]。通过物理、化学、生物改性等手段改变淀粉的理化、结构特性,可拓展其应用范围或挖掘其功能特性。酰化淀粉是一种将酰基引入淀粉的化学改性淀粉,可改善结构、理化及功能特性。酰化淀粉主要分为乙酰化、丙酰化和丁酰化淀粉3种。研究表明,添加乙酰化淀粉可以增加面条刚度和黏性,提高面条稳定性[2]。YAO等[3]制备了乙酰化淀粉纳米颗粒,它可以作为乳液稳定剂应用在食品和制药乳剂中。近年来,酰化淀粉的消化、发酵及功能特性也得到学者广泛研究。酰化淀粉可以提高淀粉的抗消化性[4],在大肠发酵时能够促进短链脂肪酸(short chain fatty acids,SCFAs)释放[5],对脂肪肝[6]、糖尿病[7]、肠炎[8]等多种疾病具有辅助治疗作用,这表明酰化淀粉可通过不同的干预途径对机体产生有益影响。
酰化淀粉的结构、性质及对代谢性相关疾病的影响已得到广泛研究。然而,酰化抗性淀粉在进入机体后,先经过胃、小肠消化系统,再进入大肠发酵。该过程较为复杂,在消化阶段酰化淀粉的结构变化及消化残余物结构对后续发酵特性的影响尚不明确,不同种类酰化淀粉消化、酵解特性尚缺乏系统研究。因此,本课题以3种酰化淀粉为研究对象,解析其在小鼠体内消化前后结构、性质变化及大肠中的发酵特性。本研究有助于进一步理解酰化淀粉的消化、发酵过程,为功能性食品配料开发提供重要理论依据。
1 材料与方法
1.1 材料与试剂
SPF级雄性BALB/c小鼠[5周龄,(20±2) g],浙江维通利华实验动物技术有限公司。实验动物使用许可证编号SYXK(苏)2021-0056。动物实验方案经实验动物福利与伦理审查委员会批准,批准编号JN.No20220615b0520728[234]。
玉米淀粉,杭州普罗星淀粉有限公司;乙酸酐、丙酸酐,国药集团化学试剂有限公司;丁酸酐,阿法埃莎化学有限公司。
1.2 仪器与设备
FE28-Standard型精密pH计,瑞士Mettler-Toledo仪器有限公司;IS10型傅里叶变换红外光谱仪,美国Thermo Nicolet公司;D2型X-射线衍射仪,德国Bruker AXS公司;高压离子色谱系统,美国Thermo Fisher Scientific公司;TGA2型热重分析仪,瑞士Mettler-Toledo仪器有限公司;GC-MS-QP 2010型气相色谱质谱联用仪,日本岛津公司;Novaseq型Illumina MiSeq测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 酰化淀粉的制备
酰化玉米淀粉的制备参照DAI等[9]的方法制备,作适当修改。将一定量的玉米淀粉(maize starch, MS)分散于去离子水中,配制为30%(质量分数)的淀粉悬浮液,置于加热板上并保持温度为40 ℃。用1 mol/L的NaOH溶液调节悬浮液的pH为8~9,然后在0.5 h内逐滴加入酸酐[乙酸酐∶淀粉=15∶100(mL∶g),丙酸酐∶淀粉=20∶100(mL∶g),丁酸酐∶淀粉=25∶100(mL∶g)],持续反应2 h。最后用1 mol/L的HCl溶液调节体系pH至6.5以终止反应。将所得的酰化淀粉先后经去离子水、乙醇各洗涤2次,然后在40 ℃烘箱中进行烘干,经研磨并过100目筛得到样品。乙酰化、丙酰化和丁酰化淀粉分别命名为MSA、MSP和MSB。
采用LI等[5]的方法测定酰化淀粉取代度,并作部分修改。称取500 mg样品于250 mL锥形瓶中,加入50 mL去离子水使其分散均匀,并加入3滴酚酞作指示剂。之后,在体系中添加25 mL 0.5 mol/L NaOH溶液,反应持续2 h,在此过程中保持不断转动(25 ℃,300 r/min)。反应结束后,用0.5 mol/L HCl溶液滴定过量的碱。原淀粉作为空白对照。最终测得MSA、MSP和MSB的取代度分别为0.157、0.161和0.167。
1.3.2 小鼠饲养和分组
实验小鼠共有52只,其中20只用于小肠消化特性研究,另外32只用于大肠发酵特性研究。
小肠消化特性实验:小鼠经适应1周后,开展实验,进行小肠消化残余物收集。小鼠禁食不禁水19 h后,分别灌胃0.5 mL不同淀粉悬浮液(MS、MSA、MAP和MSB,1.25 g/mL)。灌胃30 min后,小鼠经麻醉脱颈处死,之后进行解剖,提取十二指肠内容物(分别记作MS-d、MSA-d、MSP-d和MSB-d),并置于无菌离心管中,用于后续结构性质测定。
大肠发酵特性研究:32只小鼠分为4组(MS组、MSA组、MSP组和MSB组),每组8只,对照组采用AIN-93G[10]标准纯化饲料进行喂养,MSA、MSP和MSB组分别饲喂添加了对应酰化淀粉的定制饲料。在喂养第4周时,采集小鼠粪便,测定其短链脂肪酸(short chain fatty acids,SCFAs)含量。干预4周结束时,小鼠禁食不禁水14 h,采用异氟烷进行麻醉,脱颈、处死并解剖,提取盲肠内容物于无菌离心管中,于-80 ℃冰箱贮存,用于后续肠道菌群的测定。
1.3.3 短程和长程有序性测定
采用傅里叶变换红外光谱仪测定淀粉的短程有序性[11],将样品与溴化钾按照1∶50的质量比进行混合、研磨、压片,将压片置于模具中进行测定,获得红外图谱,扫描范围为400~4 000 cm-1,并通过傅里叶去卷积处理,计算短程有序性参数。
采用X-射线衍射仪(X-ray diffraction, XRD)测定样品的长程有序性,将样品均匀平铺在载玻片中间的凹槽中,然后将其放在仪器中央的载物台上进行测试,扫描范围和速率分别为4°~40°和4°/min。采用公式(1)计算样品的相对结晶度(relative crystallinity, RC):
(1)
式中:Ac为结晶区面积,Aa为无定形区面积。
1.3.4 链长分布测定
将10 mg样品分散于pH 4.5的醋酸钠缓冲液中,于沸水浴中煮沸30 min,从中取1.5~2 mL于离心管中,待温度降至40 ℃时,加入2 U异淀粉酶,在气浴中反应12 h,反应结束后进行煮沸灭酶,过0.45 μm滤膜后,采用高压离子色谱系统进行测试[12]。
1.3.5 热稳定性测定
利用热重分析仪(thermal gravimetric analyzer,TGA)测定淀粉的热稳定性[13],称取4 mg样品于坩埚中,然后将其放置在自动进样盘中待测试。加热温度为30~600 ℃,升温速率为10 ℃/min。通过对TGA曲线取一阶导数,获得差热分析(differential thermal analysis,DTA)曲线。
1.3.6 短链脂肪酸测定
SCFAs测定参照CHANG等[14]的方法做适当修改。分别测定喂养4周时小鼠粪便中SCFAs含量。取25 mg待测样本于2 mL EP管中,加入纯水并涡旋均匀,在4 ℃条件下离心20 min(5 000 r/min)。取0.8 mL上清液于2 mL EP管中,加入0.1 mL H2SO4溶液(50%)和0.8 mL提取液,离心15 min(4 ℃,10 000 r/min)后于-20 ℃中静置30 min。最后,取上清液于进样瓶中,通过气相色谱质谱联用仪(gas chromatograph-mass spectrometer,GC-MS)进行检测。
色谱条件:色谱柱:Agilent HP-FFAP毛细管柱(30 m×250 μm×0.25 μm);升温程序:80 ℃保持1 min,以10 ℃/min升至200 ℃,保持5 min,以40 ℃/min升至240 ℃,保持1 min;载气(He)流速3 mL/min,进样量1 μL;分流比:5∶1。
质谱条件:电离电压-70 eV;传输线温度240 ℃;离子源温度200 ℃;四级杆温度150 ℃;质量扫描范围m/z 33~150。
1.3.7 菌群多样性测定
采用DNA提取试剂盒从盲肠内容物中提取DNA,以DNA为模板,使用聚合酶链式反应(polymerase chain reaction,PCR)引物扩增原核生物16S rDNA上的可变区,并对PCR产物进行纯化,然后在其末端加上带有Index的接头,随后进行文库的构建,最后通过酶标仪检测文库浓度,使用Illumina MiSeq仪器进行PE250/FE300双端测序,获得测序数据。
1.3.8 数据统计分析
所有测试均重复进行3次。使用IBM SPSS 26.0对数据进行分析,采用邓肯多重范围检验进行显著性分析,P<0.05表示有统计学意义。
2 结果与分析
2.1 短程和长程有序结构变化
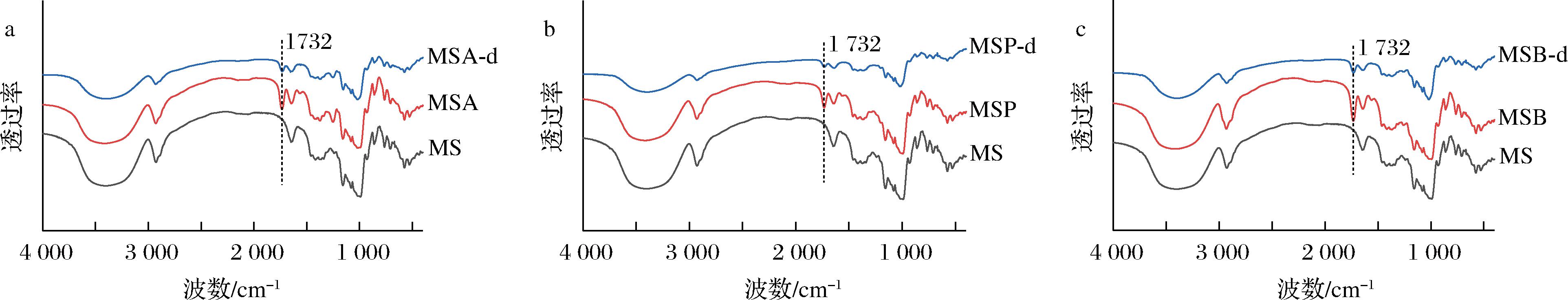
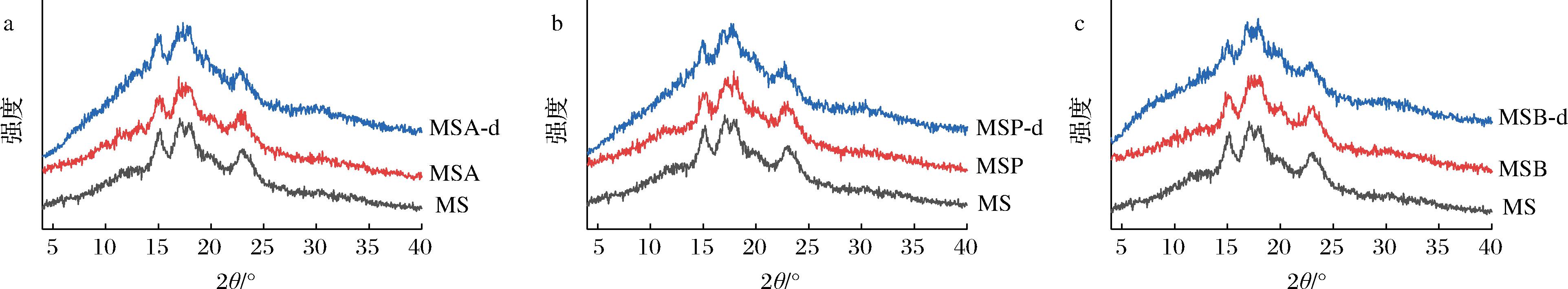
酰化淀粉经十二指肠消化前后的红外图谱和X-射线衍射谱图分别如图1、图2所示。红外特征峰1 732 cm-1处的信号峰对应酰基中的—C![]() O,消化后3种酰化淀粉在该处的峰强均减弱,表明消化过程会引起酰基的损失,这与XIE等[15]的报道一致。酰化淀粉和消化后样品均呈现A-型晶体结构(图2),表明十二指肠消化作用未改变酰化淀粉的晶体类型。
O,消化后3种酰化淀粉在该处的峰强均减弱,表明消化过程会引起酰基的损失,这与XIE等[15]的报道一致。酰化淀粉和消化后样品均呈现A-型晶体结构(图2),表明十二指肠消化作用未改变酰化淀粉的晶体类型。
a-MSA;b-MSP;c-MSB
图1 酰化淀粉经十二指肠消化前后的红外图谱
Fig.1 FT-IR spectra of acylated starches before and after duodenal digestion
a-MSA;b-MSP;c-MSB
图2 酰化淀粉经十二指肠消化前后的X-射线衍射图谱
Fig.2 X-ray diffractogram of acylated starches before and after duodenal digestion
a-MSA;b-MSP;c-MSB
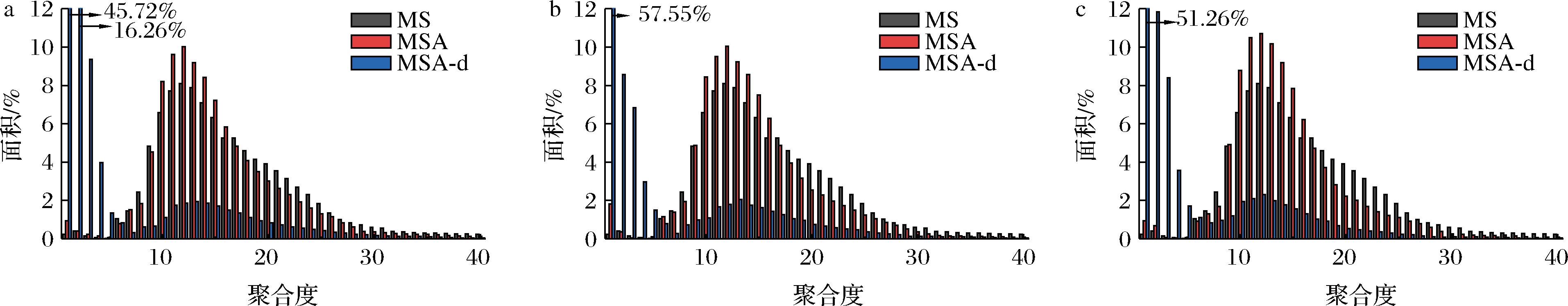
图3 酰化淀粉经十二指肠消化前后的链长分布
Fig.3 Chain length distribution of acylated starches before and after duodenal digestion
经过傅里叶去卷积处理,计算得到比值R1 050/1 020和R990/1 020(表1),分别代表淀粉短程有序性和双螺旋程度,MSA-d、MSP-d及MSB-d的2个比值均低于未消化样品的比值,表明酰化淀粉在消化后其短程有序结构遭到一定程度破坏。MSA-d、MSP-d及MSB-d的RC值较未消化样品降低,分别为11.35%、10.97%及10.51%,这说明经小鼠体内消化作用后,酰化淀粉的晶体结构被显著破坏。
表1 酰化淀粉经十二指肠消化前后的短程有序性 参数和相对结晶度
Table 1 Short-range order parameters and relative crystallinity of acylated starches before and after duodenal digestion
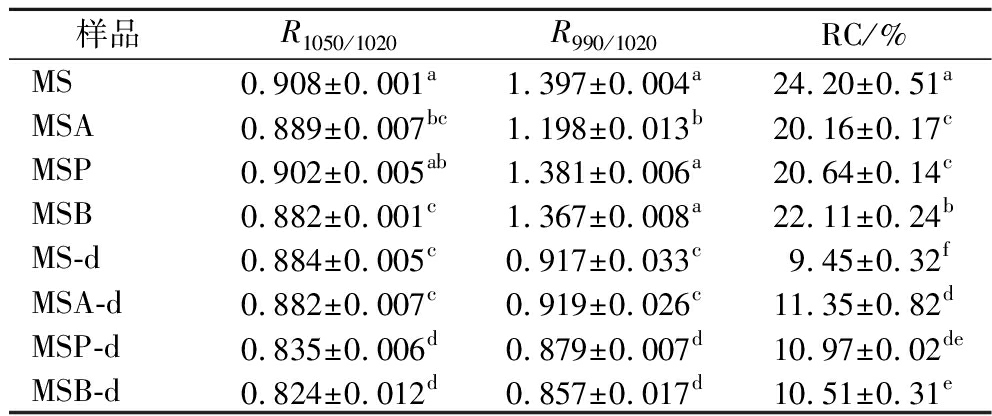
样品R1050/1020R990/1020RC/%MS0.908±0.001a1.397±0.004a24.20±0.51aMSA0.889±0.007bc1.198±0.013b20.16±0.17cMSP0.902±0.005ab1.381±0.006a20.64±0.14cMSB0.882±0.001c1.367±0.008a22.11±0.24bMS-d0.884±0.005c0.917±0.033c9.45±0.32fMSA-d0.882±0.007c0.919±0.026c11.35±0.82dMSP-d0.835±0.006d0.879±0.007d10.97±0.02deMSB-d0.824±0.012d0.857±0.017d10.51±0.31e
注:R1050/1020代表在1050、1020 cm-1处的强度比值,R990/1020代表在990、1 020 cm-1处的强度比值,RC代表相对结晶度。数值为平均值±标准差,同一列不同上标的英文字母代表显著性差异(P<0.05)(下同)。
2.2 链长分布变化
酰化淀粉经十二指肠消化前后的链长分布如图3所示。酰化淀粉的链长分布较原淀粉略向左(低聚合度方向)偏移。
由表2可知,酰化淀粉平均聚合度(degree of polymerization, DP)为15左右。经小鼠十二指肠消化后,各酰化淀粉的链长分布发生了明显的变化,DP≤5的短链显著增加,占比约77%,DP 13~24的中链显著降低,占比11%~13%,MSA、MSP和MSB的平均DP分别从15.09、14.78、14.64降为5.10、4.75、4.56,约为原来的1/3,表明酰化淀粉在经过小鼠胃酸水解、十二指肠消化后,其直链淀粉、支链淀粉均被破坏,产生了大量的短链。结合XRD数据分析结果,酰化淀粉消化后保留了部分耐酶解结构,消化过程中产生的短链也可能会聚集形成微晶结构,可进一步被运至大肠中酵解。
表2 酰化淀粉经十二指肠消化前后的链长分布
Table 2 Chain length distribution of acylated starches before and after duodenal digestion
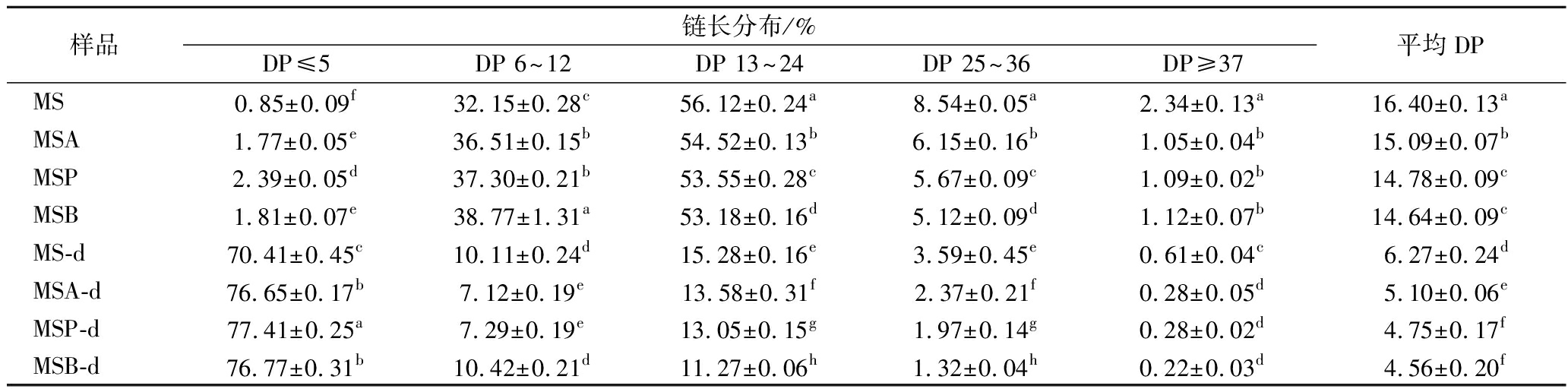
样品链长分布/%DP≤5DP 6~12DP 13~24DP 25~36DP≥37平均DPMS0.85±0.09f32.15±0.28c56.12±0.24a8.54±0.05a2.34±0.13a16.40±0.13aMSA1.77±0.05e36.51±0.15b54.52±0.13b6.15±0.16b1.05±0.04b15.09±0.07bMSP2.39±0.05d37.30±0.21b53.55±0.28c5.67±0.09c1.09±0.02b14.78±0.09cMSB1.81±0.07e38.77±1.31a53.18±0.16d5.12±0.09d1.12±0.07b14.64±0.09cMS-d70.41±0.45c10.11±0.24d15.28±0.16e3.59±0.45e0.61±0.04c6.27±0.24dMSA-d76.65±0.17b7.12±0.19e13.58±0.31f2.37±0.21f0.28±0.05d5.10±0.06eMSP-d77.41±0.25a7.29±0.19e13.05±0.15g1.97±0.14g0.28±0.02d4.75±0.17fMSB-d76.77±0.31b10.42±0.21d11.27±0.06h1.32±0.04h0.22±0.03d4.56±0.20f
2.3 热稳定性变化
酰化淀粉经十二指肠消化前后的TGA和DTA曲线如图4所示。在十二指肠消化后,酰化淀粉在热分解阶段出现了2 ~ 3个热分解温度,表明消化后产生了不同分子质量、不同链长的产物。其中,MSA-d有2个热分解温度,MSP-d和MSB-d有3个热分解温度,表明MSP和MSB的消化残余物链长分布较为分散。此外,三者的热分解温度均低于未消化样品,表明经体内十二指肠消化后,酰化淀粉热稳定性降低;MSA-d、MSP-d和MSB-d最高热分解温度分别为310.33、311.00、317.33 ℃,依次增加,这可能与消化残余物中酰基的种类和数量有关。
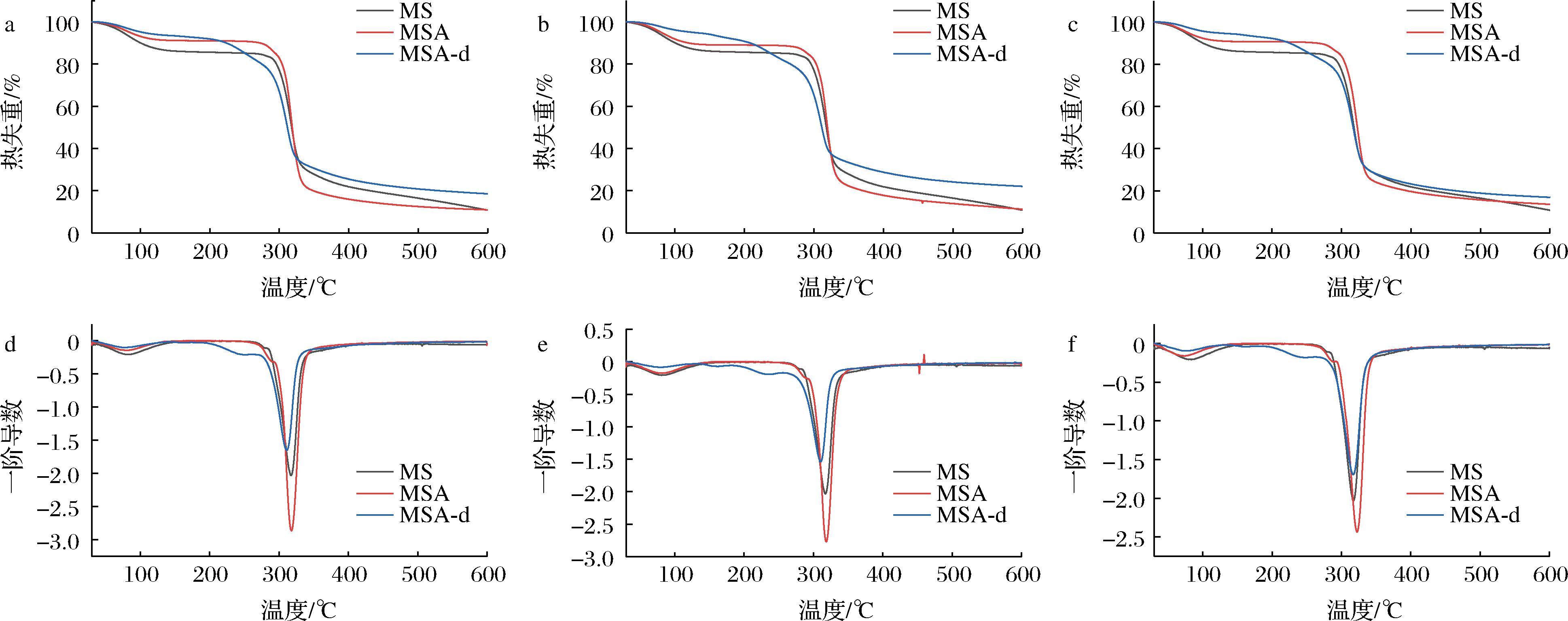
a-MSA TGA曲线;b-MSP TGA曲线;c-MSB TGA曲线;d-MSA DTA曲线;e-MSP DTA曲线;f-MSB DTA曲线
图4 酰化淀粉经十二指肠消化前后的TGA和DTA曲线
Fig.4 TGA and DTA cures of acylated starches before and after duodenal digestion
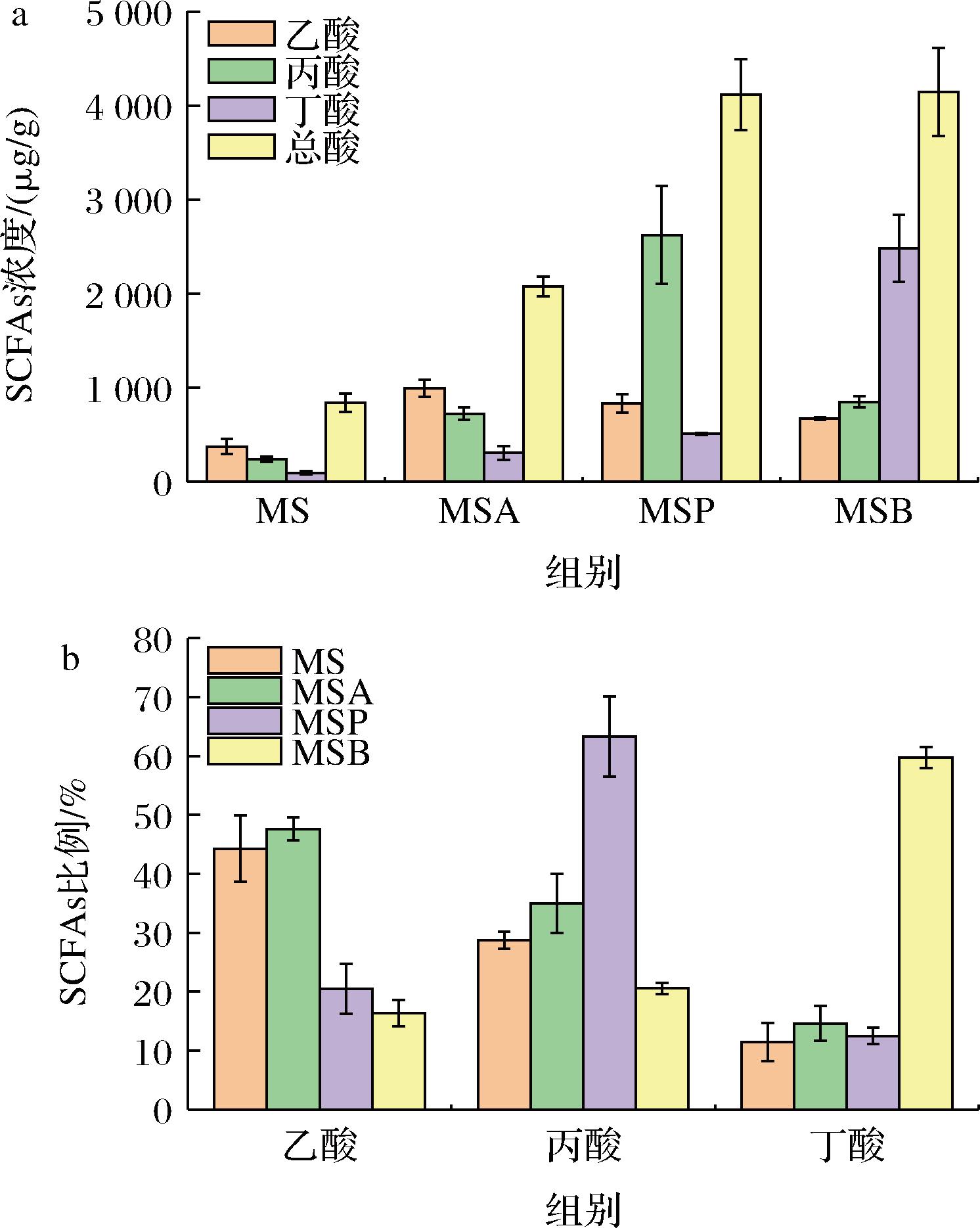
a-SCFAs的含量;b-所占比例
图5 小鼠粪便中SCFAs的含量和所占比例
Fig.5 Contents and ratio of SCFAs in feces of mice
2.4 短链脂肪酸分析
图5展示了干预4周后BALB/c小鼠粪便中SCFAs含量和所占比例。由图5-a可得,酰化淀粉组小鼠粪便中总SCFAs浓度均明显高于MS组,MSA、MSP和MSB组SCFAs质量浓度分别为4 145.23、4 117.34、2 078.37 μg/g,表明在提高总SCFAs含量方面,MSP和MSB组促进程度相当,MSA组促进程度相对较低。
图5-b展示了各SCFAs占总酸的比例。MSA组产生的乙酸占比最高,MSP组丙酸占比最高,MSB组丁酸占比最高,表明MSA、MSP和MSB分别能特异性促进乙酸、丙酸和丁酸的释放,与LI等[5]的研究结果一致。与MS组相比,MSA组的乙酸、丙酸、丁酸占比均略有增加,其中,乙酸增加了3.11%;MSP组的乙酸占比降低,丁酸占比略有增加,丙酸占比增加了34.99%;MSB组的乙酸和丙酸占比均降低,丁酸占比增加了48.59%。结果表明,在微生物作用下,乙酸、丙酸和丁酸之间存在一定的转化[16],3种酰化淀粉促进特定SCFAs的能力由高到低依次是MSB、MSP和MSA。
2.5 肠道菌群分析
酰化淀粉MSA、MSP及MSB和对照组MS在属水平上排名前30的物种分布和聚类热图如图6-a、图6-b所示。从整体来看,与MS组相比,经酰化淀粉干预后,小鼠肠道菌群组成发生了明显变化,且聚类热图表明,MSP和MSB在属水平上较为相似,其次是MSA,最后是MS,表明酰化淀粉可有效调控肠道菌群。选取8种关键菌科(属):毛螺菌科(f__Lachnospiraceae)、副拟杆菌属(Parabacteroides)、粪小杆菌属(Faecalibaculum)、乳杆菌属(Lactobacillus)、f__Oscillospiraceae、Colidextribacter、嗜胆菌属(Bilophila)、毛梭菌属(Lachnoclostridium),对其相对丰度进行详细展示(图6-c)。其中,f__Lachnospiraceae、Faecalibaculum和Lactobacillus属于Firmicutes,Parabacteroides属于Bacteroidetes[17]。酰化淀粉组小鼠的f__Lachnospiraceae相对丰度均高于原淀粉,Lachnospiraceae能分解糖类、淀粉等从而促进SCFAs产生,有助于调节氨基酸、激素等的代谢[18],表明酰化淀粉相较于原淀粉更有助于维持机体稳态,其中,MSP的促进效果略高于MSA和MSB。张廷婷等[19]报道Parabacteroides也可以促进SCFAs的产生,该菌属的增加能够预防肥胖和非酒精性脂肪肝的发生[20]。本研究中3种酰化淀粉组小鼠的Parabacteroides均明显增加,从高到低分别是MSB、MSP和MSA。Faecalibaculum是开发益生菌最有前途的菌群之一,与机体健康息息相关[21],酰化淀粉组该菌属的相对丰度均高于原淀粉,彰显了酰化淀粉良好的功能特性;且MSB组Faecalibaculum相对丰度最高(1.19%),MS组仅有0.06%,这是因为Faecalibaculum主要促进丁酸产生[22]。Lactobacillus是常用益生菌之一,具有抗癌活性,能够参与机体代谢,对疾病预防具有重要作用[23],MS组小鼠盲肠中的Lactobacillus相对丰度仅有0.032 5%,经酰化淀粉干预后,MSA组相对丰度变化不大,而MSP和MSB组相对丰度均增加,分别达到0.845%和0.195%,表明MSP对Lactobacillus具有特异性促进作用。除此之外,酰化淀粉的干预还能够抑制有害菌的生长。f__Oscillospiraceae和Colidextribacter通常与一些急性肠炎等有关,能够引起胃肠道感染[24];NATIVIDAD等[25]报道携带高水平Bilophila的个体更容易引发炎症和代谢性疾病;有研究发现Lachnoclostridium与结直肠腺瘤和癌症直接相关[26]。上述4种有害菌属的相对丰度在酰化淀粉组小鼠肠道中均降低,其中,Lachnoclostridium相对丰度降低最多,Colidextribacter相对丰度降低较少。在3种酰化淀粉中,MSA主要抑制了Bilophila生长,MSB在降低Colidextribacter和Lachnoclostridium相对丰度中效果最好,而对f__Oscillospiraceae抑制效果弱于MSA和MSP。综上可知,经过3种不同酰化淀粉膳食干预后,小鼠的肠道菌群均发生了有利变化,既促进了益生菌生长,同时降低了有害菌丰度,不同酰化淀粉可以特异性地促进或抑制相关菌生长。

a-物种分布;b-聚类热图;c-8种关键菌属
图6 属水平上的物种分布、聚类热图及8种关键菌
Fig.6 Species distribution, cluster heatmap, and eight kinds of key bacteria
3 结论与讨论
本研究系统解析了3种酰化淀粉在小鼠体内消化前后的结构和性质变化,并阐明其对小鼠大肠代谢产物和肠道菌群影响规律。经小鼠十二指肠消化后,酰化淀粉的多尺度结构均被不同程度破坏,为大肠中微生物发酵提供更多作用位点。酰化淀粉长期干预可提高小鼠粪便中总SCFAs含量,且MSA、MSP和MSB分别特异性促进乙酸、丙酸和丁酸的释放,促进程度由高到低依次是MSB、MSP和MSA。在肠道菌群组成方面,酰化淀粉均促进了有益菌属Parabacteroide和Faecalibaculum生长,特别是MSB和MSP分别显著提高了Faecalibaculum和Lactobacillus相对丰度,为酰化淀粉在食品功能配料中的广泛应用提供潜在可能。
本研究也存在一些不足之处,一方面,热加工处理会影响淀粉结构和性质,还需进一步研究热加工对酰化淀粉结构、消化特性和发酵特性的影响,另外在发酵特性方面,本文侧重分析不同酰化淀粉对代谢产物及肠道菌群的影响规律,可以进一步分析并筛选差异代谢物和差异表达基因。
[1] ZHU F, LIU P Z.Starch gelatinization, retrogradation, and enzyme susceptibility of retrograded starch:Effect of amylopectin internal molecular structure[J].Food Chemistry, 2020, 316:126036.
[2] 张克, 陆启玉.小麦乙酰化淀粉的理化性质及对面条品质的影响[J].中国食品学报, 2019, 19(1):111-116. ZHANG K, LU Q Y.The physical and chemical properties of wheat starch and its effect on the quality of noodle[J].Journal of Chinese Institute of Food Science and Technology, 2019, 19(1):111-116.
[3] YAO X C, LIN R H, LIANG Y S, et al.Characterization of acetylated starch nanoparticles for potential use as an emulsion stabilizer[J].Food Chemistry, 2023, 400:133873.
[4] LI M, WANG F F, WANG J, et al.Manipulation of the internal structure of starch by propionyl treatment and its diverse influence on digestion and in vitro fermentation characteristics[J].Carbohydrate Polymers, 2021, 270:118390.
[5] LI M, WANG J, WANG F F, et al.Insights into the multi-scale structure of wheat starch following acylation:Physicochemical properties and digestion characteristics[J].Food Hydrocolloids, 2022, 124:107347.
[6] LI M, WANG J, WANG F F, et al.Microbiota fermentation characteristics of acylated starches and the regulation mechanism of short-chain fatty acids on hepatic steatosis[J].Food &Function, 2021, 12(18):8659-8668.
[7] LI M, WANG F F, WANG J, et al.Starch acylation of different short-chain fatty acids and its corresponding influence on gut microbiome and diabetic indexes[J].Food Chemistry, 2022, 389:133089.
[8] LI L J, CHENG L, LI Z F, et al.Butyrylated starch protects mice from DSS-induced colitis:Combined effects of butyrate release and prebiotic supply[J].Food &Function, 2021, 12(22):11290-11302.
[9] DAI D D, SUN S L, HONG Y, et al.Structural and functional characteristics of butyrylated maize starch[J].LWT, 2019, 112:108254. [10] KIMURA-TODANI T, HATA T, MIYATA N, et al.Dietary delivery of acetate to the colon using acylated starches as a carrier exerts anxiolytic effects in mice[J].Physiology &Behavior, 2020, 223:113004.
[11] LU H, TIAN Y Q, MA R R.Assessment of order of helical structures of retrograded starch by Raman spectroscopy[J].Food Hydrocolloids, 2023, 134:108064.
[12] MA R R, WANG X T, LU H, et al.Debranched starch:Preparation and hydrophobic cavity characterization using carbon nanotubes[J].LWT, 2022, 153:112548.
[13] CHANG R R, LU H, BIAN X L, et al.Ultrasound assisted annealing production of resistant starches type 3 from fractionated debranched starch:Structural characterization and in-vitro digestibility[J].Food Hydrocolloids, 2021, 110:106141.
[14] CHANG R R, XU K J, ZHANG R, et al.A combined recrystallization and acetylation strategy for resistant starch with enhanced thermal stability and excellent short-chain fatty acid production[J].Food Chemistry, 2024, 430:136970.
[15] XIE Z Q, WANG S K, WANG Z G, et al.In vitro fecal fermentation of propionylated high-amylose maize starch and its impact on gut microbiota[J].Carbohydrate Polymers, 2019, 223:115069.
[16] XU Q, MA R R, ZHAN J L, et al.Acylated resistant starches:Changes in structural properties during digestion and their fermentation characteristics[J].Food Hydrocolloids, 2023, 139:108578.
[17] ZHU Y Y, DONG L E, HUANG L, et al.Effects of oat β-glucan, oat resistant starch, and the whole oat flour on insulin resistance, inflammation, and gut microbiota in high-fat-diet-induced type 2 diabetic rats[J].Journal of Functional Foods, 2020, 69:103939.
[18] 尚玮璇, 刘璐, 雷素珍, 等.莲子抗性淀粉与乳酸钠协同作用对大鼠小肠菌群及代谢产物的影响[J].食品科学, 2022, 43(17):12-23. SHANG W X, LIU L, LEI S Z, et al.Synergistic effect of lotus seed resistant starch and sodium lactate on intestinal flora and metabolism in rats[J].Food Science, 2022, 43(17):12-23.
[19] 张廷婷, 赵文颖, 谢倍珍, 等.黑木耳及其多糖对高脂饮食大鼠的降血脂和肠道菌群调节作用[J].中国食品学报, 2021, 21(9):89-101. ZHANG T T, ZHAO W Y, XIE B Z, et al.Effects of Auricularia auricula and its polysaccharides on hypolipidemic and regulating intestinal flora in high-fat diet rats[J].Journal of Chinese Institute of Food Science and Technology, 2021, 21(9):89-101.
[20] 尚玮璇, 刘璐, 雷素珍, 等.功能性碳水化合物通过调节肠道菌群和代谢物改善非酒精性脂肪肝的作用机制[J].食品与发酵工业, 2022, 48(14):311-318. SHANG W X, LIU L, LEI S Z, et al.Mechanism of functional carbohydrates alleviating non-alcoholic fatty liver disease by regulating intestinal flora and metabolites[J].Food and Fermentation Industries, 2022, 48(14):311-318.
[21] DE FILIPPIS F, PASOLLI E, ERCOLINI D.Newly explored Faecalibacterium diversity is connected to age, lifestyle, geography, and disease[J].Current Biology, 2020, 30(24):4932-4943.
[22] LOUIS P, FLINT H J.Diversity, metabolism and microbial ecology of butyrate-producing bacteria from the human large intestine[J].FEMS Microbiology Letters, 2009, 294(1):1-8.
[23] HUANG R J, WU F, ZHOU Q, et al.Lactobacillus and intestinal diseases:Mechanisms of action and clinical applications[J].Microbiological Research, 2022, 260:127019.
[24] 刘峻恺, 王绍康, 顾志鹏, 等.化学交联改性对高链玉米淀粉体外大肠发酵特性的调控机制[J].食品科学, 2022, 43(24):174-181. LIU J K, WANG S K, GU Z P, et al. In vitro colonic fermentation characteristics of chemically crosslinked high-amylose maize starches and their regulation mechanism on gut microbiota[J].Food Science, 2022, 43(24):174-181.
[25] NATIVIDAD J M, LAMAS B, PHAM H P, et al.Bilophila wadsworthia aggravates high fat diet induced metabolic dysfunctions in mice[J].Nature Communications, 2018, 9(1):2802.
[26] LIANG J Q, LI T, NAKATSU G, et al.A novel faecal Lachnoclostridium marker for the non-invasive diagnosis of colorectal adenoma and cancer[J].Gut, 2020, 69(7):1248-1257.