蜂蜜是一种天然药食同源物质,富含丰富的糖类、酶类、维生素、氨基酸、矿物质等,素有“玉液琼浆”、“天然抗生素”之称,有调节肠胃功能、增强免疫力及抗衰老等功效[1-3]。随着生活水平提高,消费者对蜂蜜产品需求量和质量品质要求不断增加。然而,常有关于蜂蜜中药物残留超标、掺假等事件报道,使人们对蜂蜜的消费信心和产业发展都受到很大的影响,除营养价值外,药物残留问题也一直是衡量蜂蜜品质的一项重要指标[4]。蜂蜜中农药来源可能是养蜂生产过程不合理喷施杀螨剂等农药引起的,也可能是蜜蜂采集被农药污染的花蜜、花粉等迁移至蜂蜜中导致污染[5-6],都将影响消费者的人身安全。因此,对蜂蜜中药物残留分析技术的建立及对蜂产品的安全监测,对保障消费者的健康和维护蜂产品产业发展具有重要作用。
双甲脒(amitraz,AMZ)和杀虫脒是2种高效有机氮杀螨剂,它们主要应用于蔬菜、茶叶和棉花等作物中害虫防治,此类农药也能有效控制蜂虫病,且对蜜蜂毒性小,在蜂巢除螨中被广泛应用[7-8]。双甲脒、杀虫脒的化学性质不够稳定,易被水解生成相应代谢产物,研究表明此类农药母体及代谢产物均对人体肝脏等器官有较大损伤,具有潜在的三致(致癌、致畸、致突变)作用,而且其代谢产物的毒性远远大于母体[9]。现有研究多主要是针对农药母体或部分代谢物分析,存在农药种类或代谢物种类分析不全的问题。农药及其代谢物的同时监测,对食品安全具有更重要的价值。同时测定蜂蜜中双甲脒、杀虫脒及其代谢产物的方法少见报道,需要建立快速、有效的同步检测检测方法。
目前,报道的蜂蜜或其他基质中双甲脒、杀虫脒及其代谢产物测定方法大多为气相色谱法[10]、液相色谱法[4,11-12]、气相色谱串联质谱法[13-14]、液相色谱串联质谱法[15-16]、胶体金法[17]等,有些方法具有一定的局限性。比如采用气相色谱法及色谱质谱法分析时需要对母体农药先进行水解再进行衍生上机分析,过程相对复杂繁琐,液相色谱法基质干扰对目标色谱峰出峰影响较大,方法灵敏度低,耗时长。液相色谱串联质谱法因其良好的灵敏度及分离效率,近年来被越来越多地用于各种农药的检测分析。且大多数方法前处理方式都采用固相萃取净化模式,其操作比较费时、溶剂消耗量大、分析成本偏高[11,16]。分散固相萃取(dispersive solid phase extraction,DSPE)技术是基于固相萃取方法开发的一种新型快速样品前处理技术,将固体净化吸附剂加入待测样品萃取液中,直接对目标物质或杂质进行吸附,该技术因具有快速高效优点已被广泛应用在样品前处理过程中[14,18]。本研究采用分散固相萃取技术,对色谱、质谱、提取溶剂、净化方式等仪器条件和前处理条件进行优化,结合超高效液相色谱-串联质谱技术,建立了针对蜂蜜中双甲脒、单甲脒(N-2, 4-dimethylphenyl-N-methyl-formamidine,DMPF)、2, 4-二甲基苯基甲酰胺(2, 4-dimethylformamidine,DMF)、2, 4-二甲基苯胺(2, 4-dimethylaniline,DMA)、杀虫脒、4-氯邻甲苯胺同时快速检测方法。结果表明,本方法简便准确,可以满足蜂蜜中痕量农药及代谢物的快速检测要求,为蜂蜜产品中双甲脒、杀虫脒及其代谢物残留分析提供一些检测技术方法与基础实验数据。
1 材料与方法
1.1 材料与试剂
AMZ、DMPF、DMF、DMA、杀虫脒、4-氯邻甲苯胺,1 000 μg/mL,天津阿尔塔科技有限公司;甲醇、乙腈(均为色谱纯),德国默克公司;甲酸、乙酸铵、氨水(均为色谱纯),美国Sigma公司;氯化钠(分析纯),国药集团化学试剂北京有限公司;N-丙基乙二胺(primary secondary amine,PSA)、氨基键合硅胶(amino bonded silicone,NH2)、十八烷基硅烷键合硅胶(octadecylsilane,C18)、中性氧化铝、碱性氧化铝,天津艾杰尔公司。
实验样品:蜂蜜样品,昆明市超市和农贸市场,4 ℃冰箱内下贮存备用。
1.2 仪器与设备
API 5500 Q TRAP三重四极杆/线性离子阱质谱仪,美国AB SCIEX公司;1290超高效液相色谱仪,美国Agilent公司;BAS224S-CW电子分析天平(感量0.1 mg),北京赛多利斯科学仪器有限公司;TGL-10B-6D高速离心机,上海安亭科学仪器厂;Vortex3型涡旋振荡器,德国IKA公司;KQ-500DB超声波清洗仪,昆山市超声仪器有限公司;GENTRA R200纯水机,英国威立雅水处理技术有限公司;0.22 μm有机微孔滤膜,天津津腾仪器有限公司。
1.3 实验方法
1.3.1 标准溶液配制
混合标准中间液配制:准确吸取上述6种单标标准物质各1 mL用甲醇定容到10 mL,先配制成质量浓度为100.0 μg/mL的标准储备液,低温贮存备用。
混合标准系列配制:再准确吸取上述各储备液于容量瓶中并用甲醇定容,得到6种混合标准中间储备液,低温避光保存。系列标准工作溶液分别用甲醇和空白基质配制,现用现配制。
1.3.2 样品前处理
(1)提取
准确称取2 g(精确至0.01 g)蜂蜜试样置于50 mL离心管中,吸取10 mL的纯化水加入到蜂蜜样品中,涡旋振荡30 s使蜂蜜与水完全混合,放置2 min后加入10 mL的1%(体积分数)氨化乙腈,涡旋振荡提取1 min,加入6 g氯化钠固体,涡旋振荡提取1 min,进行超声辅助提取30 min,5 000 r/min条件下离心5 min,待净化。
(2)净化
称取净化材料PSA、C18和NH2各50 mg置于净化管中,吸取2.0 mL上述未净化的上清液置于净化管中,充分涡旋振荡30 s,以5 000 r/min条件离心5 min,吸取上层溶液过滤膜后供UPLC-MS/MS测定分析。
1.3.3 色谱条件
ACQUITY UPLC BEH C18(2.1 mm×50 mm,1.7 μm)色谱柱,柱温:40 ℃;进样量:1 μL。流动相A为0.1%(体积分数)甲酸水溶液,B为甲醇,梯度洗脱条件见表1。
表1 梯度洗脱条件
Table 1 Program of gradient elution
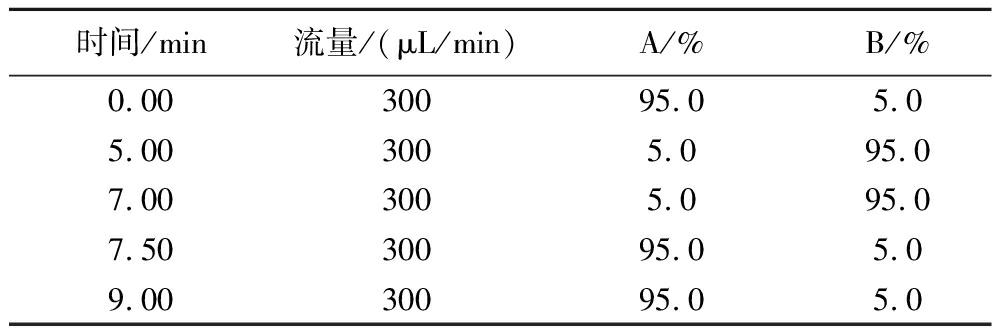
时间/min流量/(μL/min)A/%B/%0.0030095.05.05.003005.095.07.003005.095.07.5030095.05.09.0030095.05.0
1.3.4 质谱色谱条件
采用电喷雾源离子源(electrospray source ion,ESI),多反应监测模式(multiple response monitoring,MRM),正离子扫描,其中电喷雾电压为5 500 V,离子源温度为550 ℃,气帘气压力值为0.226 MPa,辅助加热气压力值为0.379 MPa,雾化气压力值为0.369 MPa。6种农药的质谱条件参数见表2。
表2 六种目标农药的质谱参数
Table 2 Mass spectrometric (MS) parameters for detection of 6 pesticides

化合物保留时间/min质荷比母离子子离子去簇电压/V碰撞能量/VAMZ5.82294.2 163.2∗,122.240 22,40DMPF2.53163.2 107.1∗,122.180 33,23DMF3.84150.2 107.1∗,132.180 28,19DMA2.33122.1 107.1∗,79.180 23,17杀虫脒2.33197.1 89.0∗,117.160 67,364-氯邻苯甲胺2.57142.1107.1∗,125.190 24,29
注:*定量离子。
2 结果与分析
2.1 色谱和质谱条件的优化
2.1.1 色谱条件的优化
流动相体系对于各农药的离子化效率、色谱保留出峰时间都由有较大的影响作用。本试验考察了各目标农药在流动相为乙腈和甲醇作为有机相时的色谱分离效果,甲醇条件下目标农药峰形尖锐、基线平稳且分离效果更好,所以本实验有机相选择甲醇。
双甲脒等农药在ESI源下易形成[M+H]+离子峰,通常情况下在流动相中加入一些甲酸可以提高农药的离子化效率。本试验对无机相水溶液内添加不同量的甲酸进行对比试验,加入甲酸(体积分数)分别为0%、0.02%、0.05%、0.1%、0.2%。结果显示,DMPF农药受流动相体系酸度影响较大,不加酸或者酸含量低的情况DMPF出峰响应值很低,其他5种化合物响应值受酸度影响相对较小,同时流动相体系不同酸浓度对各个农药出峰保留时间影响较大。一般情况为改善待测农药峰形或提高响应灵敏度,会考虑在流动相中加入乙酸铵等缓冲盐,本实验考察流动相体系加入不同浓度的乙酸铵对目标农药的影响,结果显示加入缓冲盐会严重抑制DMA农药的色谱峰响应值。综合考虑各个农药的化学性质,本实验最终选择甲醇、0.1%(体积分数)的甲酸水溶液为流动相体系。
2.1.2 质谱条件的优化
采用针泵直接进样方式,在正离子模式下,吸取质量浓度为0.1 μg/mL的6种农药混合标准溶液,先进行一级母离子扫描,确定各农药的母离子准离子峰,再分别进行二级子离子扫描,选择其中响应值和特异性较高的2~3个子离子,在MRM模式下对碰撞能量(collision energy,CE)、去簇电压(declustering potential,DP)、离子源温度及毛细管电压等必要质谱参数进行优化。选择离子丰度最大且基质干扰小的一个子离子作为定量离子,再选一个子离子作为定性离子。确定最优质谱条件,使各农药的离子化效率最佳。相关参数如表2所示。
2.2 前处理条件的优化
2.2.1 样品稀释体积优化
由于蜂蜜内含糖分较高,水分少且黏度大。所以在对蜂蜜样品进行分析时,本实验先加入一定体积去离子水溶液对蜂蜜样品进行稀释,起到去除一定的基质干扰作用,再进行有机溶剂提取。实验对加水体积进行优化,考察1∶1、1∶2、1∶5、1∶10、1∶20 (g∶mL)稀释条件下各农药的响应值情况,并与纯水中各农药的响应值做比较。结果显示稀释倍数对各农药都有影响,特别对AMZ和DMPF影响明显,当稀释比例为1∶5时,各农药基本都能达到很好的响应,因此本实验选择2.0 g蜂蜜试样加入10.0 mL水进行稀释。
2.2.2 样品提取溶剂和体积优化
目前在对食品、农产品中农药残留进行提取时大多选择甲醇、乙腈等作为提取溶剂。本实验考虑到甲醇亲水的特性,提取液中含有部分水分会使AMZ易发生水解,而乙腈溶剂渗透性较强,通过加标回收法考察,乙腈溶剂提取总体回收率效果好,同时在加入盐后乙腈易于水相分层更容易后期分析,所以本实验选用乙腈溶液作为提取试剂。
目前有一些研究已经表明,AMZ类农药在酸性环境下非常不稳定易发生降解[15],同时AMZ等为胺类化合物,属于两性化合物,在碱性条件下会形成游离分子形态更易被有机试剂溶解提取,结合目标农药酸性条件易降解的特性。本实验考虑使用在乙腈溶剂中加入不同体积分数的氨水,来保持提取溶剂的酸碱度,提高前处理过程中目标农药的稳定性,对不同体积分数氨水乙腈溶液(0.2%、0.5%、1%、2%、5%、10%、20%)进行优化,考察每个提取液对目标药物的总体影响。结果显示,不同体积分数的氨化乙腈溶液的对AMZ和DMPF两种农药影响明显,当提取溶剂中氨水比例大于10%时,DMPF的回收率明显下降,而DMF、DMA回收率明显升高,可能是提取液的PH升高影响了DMPF的稳定性,超过一定pH值时部分降解生成代谢物。当氨水比例在0.5%~5%时,6种目标物质的回收率能满足大于80%且小于120%,提取效果较理想;但AMZ在提取液浓度为1%时,回收率和峰形相对最好。综合考虑选用1%(体积分数)氨水乙腈作为本实验的提取试剂。同时也考察不同提取液体积(10、15、20、25 mL)对目标农药的提取效果,结果显示,加入10 mL乙腈时目标农药基本能得到充分提取,考虑到节约试剂问题,本实验选择提取溶剂体积为10 mL。
2.2.3 净化方法的优化
本实验首先考察上清提取液不净化上机分析的效果,结果显示AMZ的回收率较低,其他5种目标农药的回收率较高,可能由于蜂蜜提取液内含成分复杂,产生一定基质效应影响。因此,本实验考察不同净化材料对样品提取液净化效果,以减少蜂蜜中糖、有机酸等内含物对目标农药分析的影响。主要考察了PSA、C18、NH2、中性氧化铝、碱性氧化铝和酸性氧化铝6种分散固相萃取净化材料对提取液的净化效果,并对用量进行优化。结果显示,使用中性氧化铝、碱性氧化铝和酸性氧化铝净化时,AMZ、杀虫脒的代谢物回收率偏高,均大于120%;使用PSA、C18、NH2净化时,6种目标物质的回收率为85%~107%,对目标化合物的吸附较小,能满足净化要求。考虑到每种净化材料针对去除的干扰杂质类型不同,PSA主要吸附一些糖、有机酸等极性干扰物质,C18可有效吸附一些脂类非极性物质,NH2适合吸附一些有机酸等极性干扰物质。因此,本实验选择PAS、C18和NH2三种混合作为净化材料。
净化剂比例和用量会决定处理液的干净程度和农药回收率结果。进一步考察C18、PSA、NH2不同用量比例(质量比分别为1∶1∶1、1∶3∶1、2∶2∶1、3∶1∶1)及不同总用量(50、100、150、200 mg)对净化效果影响。结果如图1所示,AMZ、DMPF、DMA、杀虫脒和4-氯邻甲苯胺5种目标农药对于所有的净化材料用量比例提取净化效果都较好,但代谢物DMF在质量比为1∶3∶1、2∶2∶1、3∶1∶1时净化时回收率相对偏高,所以确定3种净化材料C18、PSA、NH2的质量比为1∶1∶1。考察净化材料总用量方面,在超过150 mg时6种目标农药的净化效果没有加强且回收率略有下降,可能用量加大对目标农药有一定吸附,因此确定净化材料总用量为150 mg。
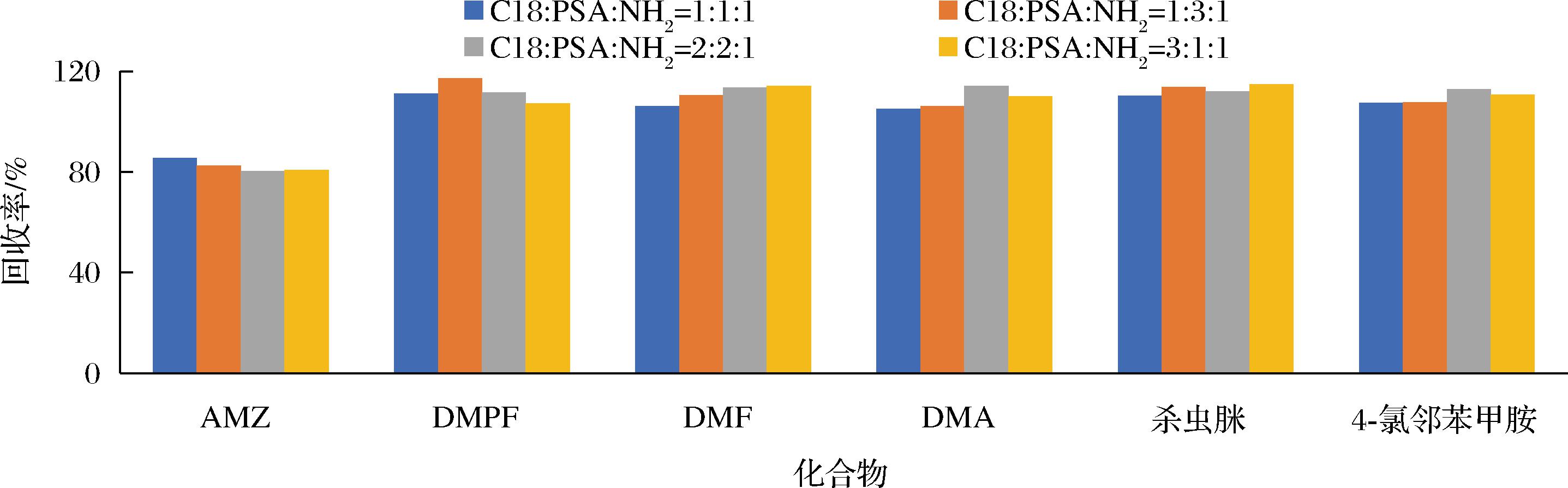
图1 不同比例用量C18、PSA和NH2对净化结果的影响
Fig.1 Effect of different dosage of PSA, C18, and NH2 on purification result
2.3 基质效应
用液相色谱串联质谱对基质中的农药残留进行色谱分离时,常会有一些共洗脱下来的干扰物质对待测成分的离子化效率产生影响,引起分析物信号的抑制或增强,这种现象就是基质效应(matrix effects,ME)。本实验比较溶剂标标准曲线和基质标标准曲线的斜率对基质效应的强弱进行评价,结果见表2,仅有DMPF、DMA的|ME|值大于20%且小于50%表现为中等基质效应,其余农药|ME|均小于20%表现为弱基质效应。本实验采用基质匹配标准曲线外标法定量克服基质效应影响。
2.4 方法学评价
2.4.1 线性范围和检出限
按照本实验的最优分析条件,配制6种农药的系列混合基质标准溶液经测定后,以定量离子的峰面积对其各自的浓度进行线性回归,生成各农药的标准曲线。6种农药的方法检出限(limit of detection,LOD)和定量限(limit of quantitation,LOQ)分别以3倍和10倍信噪比计算。结果见表3,本方法6种农药在0.001~0.2 μg/mL线性范围内线性关系良好(相关系数r>0.999 1),LOD为0.2~0.8 μg/kg,LOQ为0.7~2.5 μg/kg,该方法6种农药的相关检出限相对较低,能够满足农药残留的测定要求。
表3 六种农药的线性方程、线性范围、相关系数、检出限、定量限及基质效应
Table 3 Linear equations,linear ranges,correlation coefficients, LOD, LOQ, and quantitation matrix effects of 6 pesticides
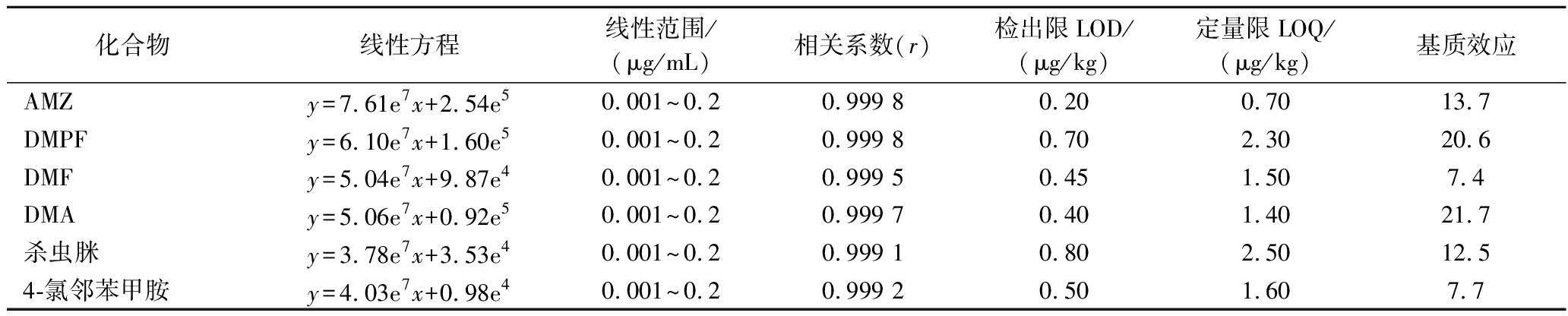
化合物线性方程线性范围/(μg/mL)相关系数(r)检出限LOD/(μg/kg)定量限LOQ/(μg/kg)基质效应AMZy=7.61e7x+2.54e50.001~0.20.999 80.200.7013.7DMPFy=6.10e7x+1.60e50.001~0.20.999 80.702.3020.6DMFy=5.04e7x+9.87e40.001~0.20.999 50.451.507.4DMAy=5.06e7x+0.92e50.001~0.20.999 70.401.4021.7杀虫脒y=3.78e7x+3.53e40.001~0.20.999 10.802.5012.54-氯邻苯甲胺y=4.03e7x+0.98e40.001~0.20.999 20.501.607.7
2.4.2 方法回收率和精密度
在空白蜂蜜样品中按约各农药定量限值的1倍、5倍、10倍进行3个水平添加回收实验,每个水平平行6次。结果见表4,AMZ、DMPF、DMF、DMA、杀虫脒和4-氯邻苯甲胺的平均回收率为84.1%~113.8%,RSD值为0.9%~6.0%,本实验建立的方法回收率和重现性良好,适用于蜂蜜中双甲脒、杀虫脒及相关代谢物残留的同时分析测定。
表4 六种农药的平均回收率和相对标准偏差(n=6)
Table 4 Average recoveries and relative standard deviation of 6 pesticides (n=6)
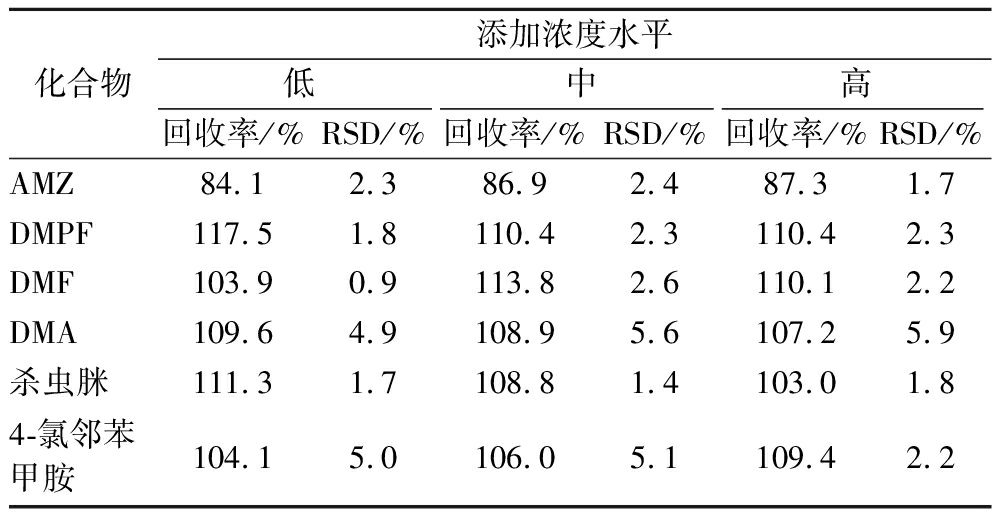
化合物添加浓度水平低中高回收率/%RSD/%回收率/%RSD/%回收率/%RSD/%AMZ84.1 2.3 86.9 2.4 87.3 1.7 DMPF117.51.8 110.4 2.3 110.4 2.3 DMF103.9 0.9 113.8 2.6 110.1 2.2DMA109.6 4.9 108.9 5.6 107.2 5.9 杀虫脒111.3 1.7 108.8 1.4 103.0 1.84-氯邻苯甲胺104.1 5.0 106.0 5.1 109.4 2.2
2.5 实际样品检测
对采集的12个不同品牌种类的蜂蜜样品应用本实验建立的方法进行分析测定,其中2个样品检出DMPF和DMF,但检出含量不高(小于0.02 mg/kg),其他农药均未检出。
3 结论
本文建立了蜂蜜产品中双甲脒、杀虫脒及代谢物残留的分散固相萃取-超高效液相色谱-串联质谱快速检测方法。以体积比为1%氨水乙腈作为提取溶液,PSA、C18和NH2混合材料净化,基质标准曲线外标法定量,该方法前处理操作过程简单快速,具有较好的准确度和精确度,能够快速实现蜂蜜产品中双甲脒、杀虫脒及代谢物的定性和定量分析,满足复杂基质痕量农药分析要求。该方法的应用能提高蜂蜜相关农产品中双甲脒、杀虫脒及其代谢物残留的监测效率,为保障蜂蜜产品的质量安全提供实验基础和理论依据。
[1] TERZO S, MUL F, AMATO A. Honey and obesity-related dysfunctions: A summary on health benefits[J]. The Journal of Nutritional Biochemistry, 2020, 82:108401.
F, AMATO A. Honey and obesity-related dysfunctions: A summary on health benefits[J]. The Journal of Nutritional Biochemistry, 2020, 82:108401.
[2] SOARES S, AMARAL J S, OLIVEIRA M B P P, et al. A comprehensive review on the main honey authentication issues: Production and origin[J]. Comprehensive Reviews in Food Science and Food Safety, 2017, 16(5):1072-1100.
[3] UGUSMAN A, SHAHRIN S A S, AZIZAN N H, et al. Role of honey in obesity management: A systematic review[J]. Frontiers in Nutrition, 2022, 9:924097.
[4] 谭璟慧, 谢宏斌, 李贵荣, 等. 超高效液相色谱法同时测定蜂蜜中双甲脒及其代谢物残留量[J]. 食品安全质量检测学报, 2020, 11(12):4091-4096. TAN J H, XIE H B, LI G R, et al. Simultaneous determination of amitraz and its metabolite (2, 4-dimethylaniline) residues in honey by ultra-performance liquid chromatography[J]. Journal of Food Safety &Quality, 2020, 11(12):4091-4096.
[5] 戴雪香, 董霞. 农药对养蜂业的影响[J]. 蜜蜂杂志, 2016, 36(10):12-15. DAI X X, DONG X. The effects of pesticides on apiculture[J]. Journal of Bee, 2016, 36(10):12-15.
[6] GOULSON D, NICHOLLS E, BOT AS C, et al. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers[J]. Science, 2015, 347(6229):1255957.
AS C, et al. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers[J]. Science, 2015, 347(6229):1255957.
[7] 黄永舜. 蜂蜜中农药残留的研究进展[J]. 现代食品, 2018(13):66-68. HUANG Y S. Research progress of pesticide residues in honey[J]. Modern Food, 2018(13):66-68.
[8] KREPPER G, PISTONESI M F, DI NEZIO M S. Adsorptive square wave voltammetric determination of amitraz in Argentine honeys with a microwave-assisted sample treatment[J]. Microchemical Journal, 2019, 150:104068.
[9] BOMMURAJ V, BIRENBOIM M, CHEN Y, et al. Depletion kinetics and concentration- and time-dependent toxicity of a tertiary mixture of amitraz and its major hydrolysis products in honeybees[J]. Chemosphere, 2021, 272:129923.
[10] AMOLI J S, HASAN J, HEJAZY M. Determination of amitraz residue by headspace gas chromatography in honey and beeswax samples from Iran[J]. American Journal of Food Technology, 2008, 4(1):56-59.
[11] 杨媛, 石磊, 张开春, 等. 固相萃取-高效液相色谱法测定水果中单甲脒的残留量[J]. 分析化学, 2010, 38(9):1342-1344. YANG Y, SHI L, ZHANG K C, et al. Determination of semiamitraz residue in fruits by solid phase extraction-high performance liquid chromatography[J]. Chinese Journal of Analytical Chemistry, 2010, 38(9):1342-1344.
[12] TOKMAN N, SOLER C, LA FARRÉ M, et al. Determination of amitraz and its transformation products in pears by ethyl acetate extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography. A, 2009, 1216(15):3138-3146.
[13] FUENTE-BALLESTEROS A, BRUGNEROTTO P, COSTA A C O, et al. Determination of acaricides in honeys from different botanical origins by gas chromatography-mass spectrometry[J]. Food Chemistry, 2023, 408:135245.
[14] 谭亚军, 赵甲慧, 李伟, 等. 柑橘类水果中双甲脒及其代谢物的QuEChERS-GC/MS测定法[J]. 职业与健康, 2022, 38(17):2328-2332. TAN Y J, ZHAO J H, LI W, et al. Determination of amitraz and its metabolites in citrus fruits by QuEChERS-GC/MS[J]. Occupation and Health, 2022, 38(17):2328-2332.
[15] 黄娟, 桂茜雯, 高玲, 等. 高效液相色谱-串联质谱法测定蔬菜水果中双甲脒及其代谢产物[J]. 色谱, 2019, 37(1):1-7. HUANG J, GUI Q W, GAO L, et al. Determination of amitraz and its metabolites in vegetables and fruits by high performance liquid chromatography-tandem mass spectrometry[J]. Chinese Journal of Chromatography, 2019, 37(1):1-7.
[16] 侯建波, 谢文, 曾淦宁, 等. 液相色谱-串联质谱法测定蜂王浆中双甲脒及其代谢物的残留量[J]. 质谱学报, 2019, 40(2):131-138. HOU J B, XIE W, ZENG G N, et al. Simultaneous determination of amitraz and its metabolites in royal jelly by HPLC-MS/MS[J]. Journal of Chinese Mass Spectrometry Society, 2019, 40(2):131-138.
[17] 智军海, 孟超, 周嘉明. 双甲脒胶体金免疫快速检测试纸条研制及其在蜂蜜中的应用[J]. 食品安全质量检测学报, 2022, 13(10):3290-3295. ZHI J H, MENG C, ZHOU J M. Development of amitraz colloidal gold rapid immunoassay strip and its application in honey[J]. Journal of Food Safety &Quality, 2022, 13(10):3290-3295.
[18] WANG F Q, LI S H, FENG H, et al. An enhanced sensitivity and cleanup strategy for the nontargeted screening and targeted determination of pesticides in tea using modified dispersive solid-phase extraction and cold-induced acetonitrile aqueous two-phase systems coupled with liquid chromatography-high resolution mass spectrometry[J]. Food Chemistry, 2019, 275:530-538.