高温大曲主要以小麦为原料,通过网罗制曲自然空间环境中的微生物接种发酵,微生物在曲坯中此消彼长,自然积温转化并风干而形成的一种多酶多菌的微生态制品[1-2]。高温大曲是白酒生产过程中的关键糖化发酵剂,其品质的好坏直接影响基酒酒质的优劣[3]。在发酵过程中,重要风味成分的前体氨基酸可视为高温大曲质量评价的重要指标之一[4-5]。因此,实时监测不同生产环节下高温大曲中氨基酸含量对生产优质高温大曲尤为重要。
高温大曲作为白酒香气及其前体物的重要来源之一,其氨基酸种类及含量是白酒中重要风味成分的前体物之一,主要来源于小麦中蛋白质酶降解、发酵过程中微生物代谢产物及其发酵后微生物细胞自溶等途径[5-6]。在高温发酵条件下,氨基酸与还原糖发生美拉德反应,形成一系列缩合、脱羧、脱氨、脱氢等交叉反应,进而生成多种类风味成分,其中,吡嗪类具有特殊的焙烤香、坚果香,酚类具有焦香、似焦糖香,呋喃、吡喃具有酱味,噻唑、噻吩具有焙烤香等,贡献了白酒中多种香味成分及其前体物[1,4-6]。
一测多评法(quantitative analysis of multi-components by single-marker, QAMS)作为一种多成分质量评价新方法,已在食品领域的多成分检测中得到成功应用,特别是解决多成分定量分析中对照品短缺和检测成本高的问题[7-9]。QAMS法通过测定一个成分而实现多个成分的同步测定,大幅度降低成本和实验人员的工作量,比传统质量控制方法更加经济、高效、简单[10-11]。目前,关于不同基质样品中氨基酸含量的测定方法较多[12],主要有GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》中氨基酸自动分析法、液相色谱法[13-16]、液相色谱-串联质谱法[17-21]等,国内外尚未建立结合QAMS法快速测定高温大曲中多种氨基酸的检测方法。其次,质量控制图是一种既便于直观地判断分析质量,又能全面、连续地反映分析测试结果波动状况的图形,是常规检测质量控制的一种有效方法,可实现对实验室分析方法和工作程序进行审视性的连续评价[22-24]。当前,基于Minitab软件可方便制作质量控制图,并对数据自动分析,及时发现过程中的异常,实现对生产过程的有效监控[25]。目前,国内外未见关于质量控制图在高温大曲生产过程中氨基酸含量分析应用的相关报道。
因此,针对高温大曲中重要风味成分前体氨基酸的分析多采用氨基酸自动分析仪进行测定,而考虑到氨基酸自动分析仪检测成本高且耗时长、液相色谱法需柱前衍生处理后上机分析,为更好地评价生产过程中高温大曲的品质,对其多种氨基酸含量进行全面、准确的分析与控制,通过建立超高效液相色谱-质谱-一测多评(ultra-high-performance liquid chromatography high-resolution mass spectrometry-quantitative analysis of multi-components by single-marker, UPLC-HRMS-QAMS)法开展高温大曲中多种氨基酸含量的测定,该方法简便快捷,稳定可靠,仅在消耗参照物情况下便可全面地反映高温大曲其他重要风味成分前体物氨基酸含量分布。同时,结合质量控制图可实现在生产过程中高温大曲的品质监控,这将有助于提升高温大曲生产过程中品质控制水平,进一步推动酿造白酒的优质优产。
1 材料与方法
1.1 材料与试剂
1.1.1 试材
高温大曲样品由贵州省某知名酱酒企业提供,选择该企业制曲车间6间生产曲仓的仓前(上、中、下)、仓中(上、中、下)、仓后(上、中、下)不同位置进行样品采集,每个曲仓具体取样位置见图1。其中,曲仓前上(S11)、曲仓前中(S12)、曲仓前下(S13)采集样品等比例混匀为曲仓前高温大曲样品(S1),依此类推。依据高温大曲生产工艺可分为“一次翻曲”、“二次翻曲”、“拆曲”3个生产环节,每个生产环节各采集18个样品,其样品编号为:S1~S18,共采集3个生产环节54个高温大曲样品于-20 ℃条件下贮存备用。
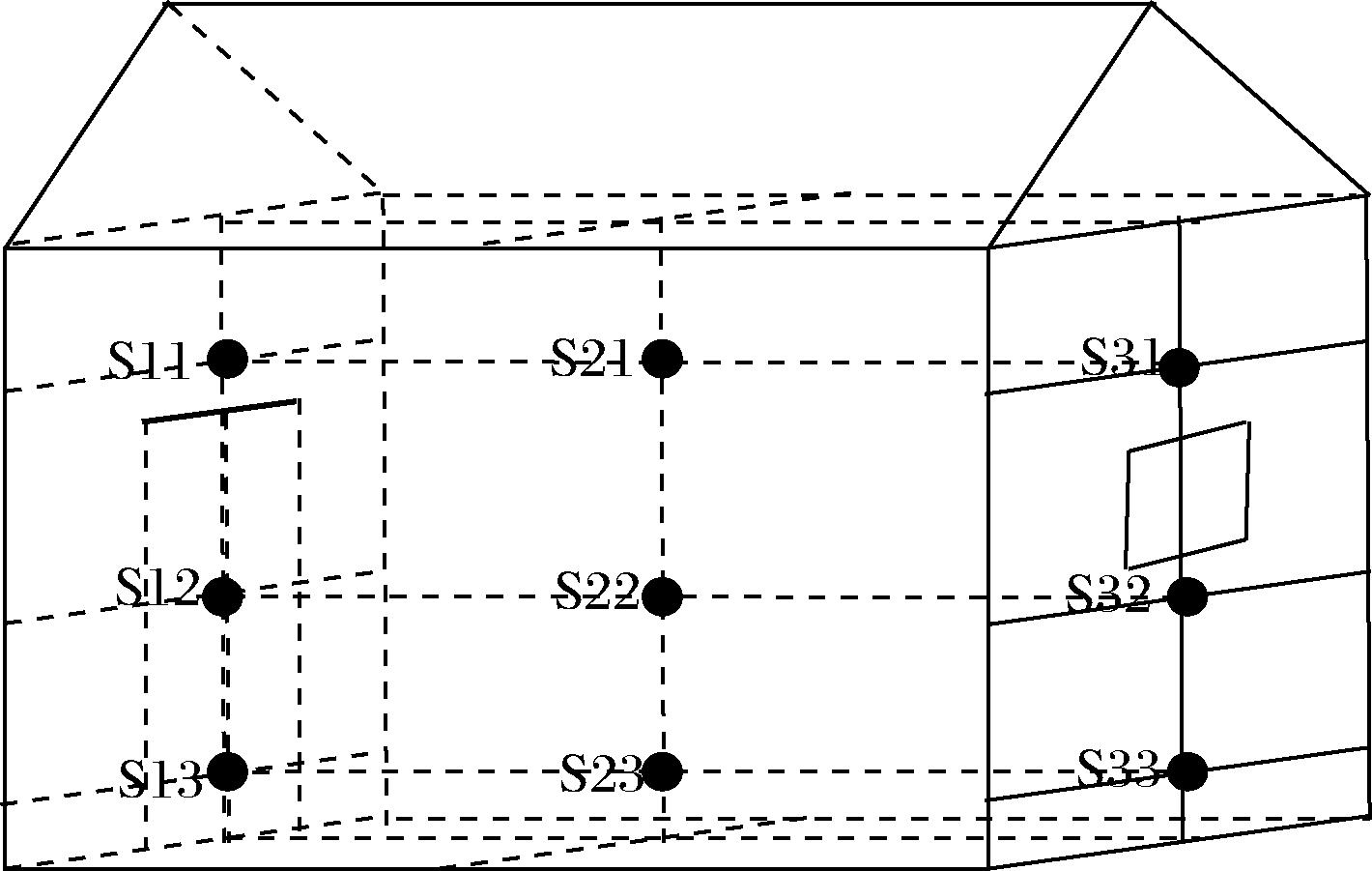
图1 高温大曲曲仓内9个取样位点分布
Fig.1 Distribution of 9 sampling sites in high temperature Daqu warehouse
1.1.2 主要试剂
色谱级甲醇,德国Merck公司;质谱级甲酸,美国Fisher公司;10种氨基酸混合标准溶液(2.5 mmol/L L-亮氨酸、L-异亮氨酸、L-缬氨酸、L-苯丙氨酸、L-酪氨酸、L-色氨酸、L-甲硫氨酸、L-天冬氨酸、L-苏氨酸、L-赖氨酸),Merck公司;标准品L-亮氨酸(98.1%)、L-异亮氨酸(99.2%),上海源叶生物科技有限公司;标准品L-正亮氨酸(98%)、L-茶氨酸(98%),北京索莱宝科技有限公司。
1.2 仪器与设备
UPLC-QE Focus高分辨质谱联用仪,Thermo Fisher Scientific;QT-1旋涡混合器,上海琪特分析仪器有限公司;HC-3518高速离心机,安徽中科中佳科学仪器公司;AR2140万分之一分析天平,梅特勒-托利多仪器(上海)有限公司;艾科普超纯水机,美国Millipore公司。
1.3 实验方法
1.3.1 前处理方法
待测高温大曲样品经干燥粉碎后过0.5 mm孔径筛网,精确称取0.1 g过筛样品于50 mL离心管内,添加适宜浓度的L-正亮氨酸、L-茶氨酸内标标准溶液,加入30 mL超纯水振荡混匀2 min,超声15 min,于10 000 r/min下离心5 min,取上清液过0.22 μm滤膜后上机分析。
1.3.2 仪器条件
UPLC条件为:选用Thermo Hypersil Gold(150 mm×2.1 mm,1.9 μm)超高压液相色谱柱;采用0.1%甲酸水溶液(A)和甲醇(B)为流动相,洗脱程序为0~2 min 100% A,9~13 min 5% A,13.1~16 min 100% A;柱温为40 ℃,进样量为2 μL,流速0.2 mL/min,分析时长为16 min。
QE Focus高分辨质谱离子源条件:加热电喷雾电离源;鞘气流量:40 arb;辅助气流量:10 arb;喷雾电压:3.2 kV;离子源温度:350 ℃;毛细管温度:320 ℃。
QE Focus高分辨质谱扫描条件:采用全扫描/数据依赖性二级扫描(Full MS/ddMS2)的正离子扫描采集模式;一级扫描范围为m/z 50.0~400.0 Da;一级扫描分辨率70 000;自动增益控制进入轨道阱中的离子数(AGC target):1e6;最大注入时间(Maximum IT):30 ms;二级扫描分辨率:17 500;AGC target:5e4;Maximum IT:50 ms;归一化碰撞能量:10、20、30 eV。12种氨基酸化合物信息及高分辨质谱参数见表1,采用内标法定量,仪器采集数据的定性定量分析采用Xcalibur 4.1软件。
表1 各待测组分化合物信息及高分辨质谱参数
Table 1 HRMS parameters of objects and compound information
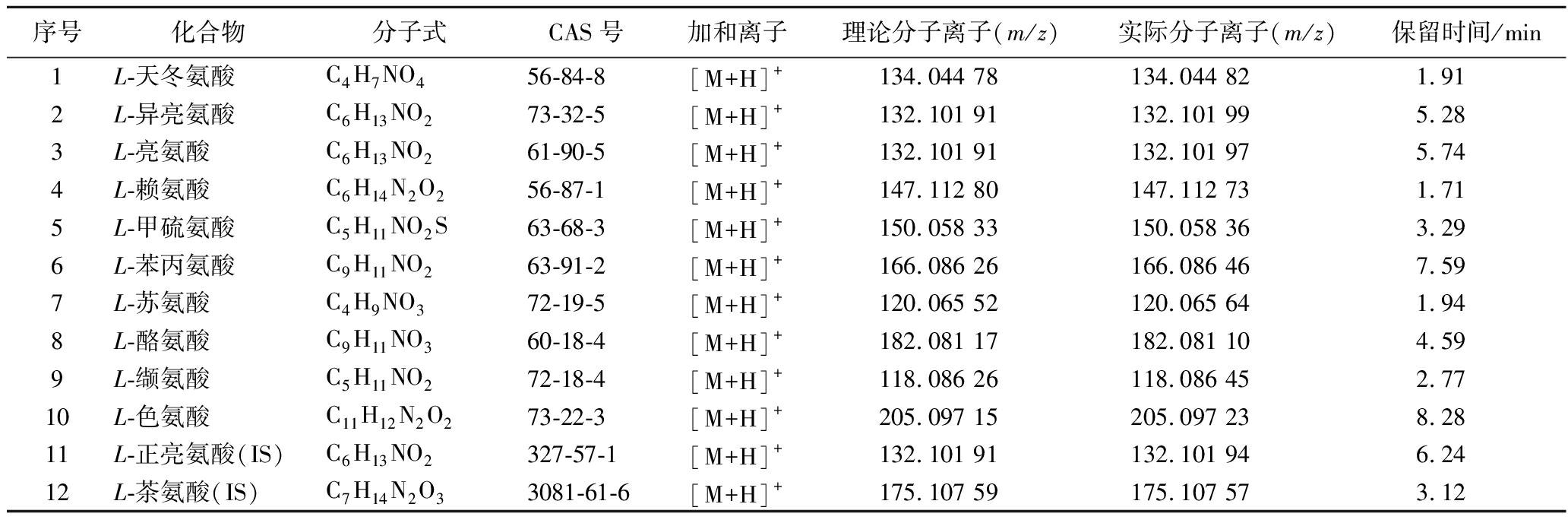
序号化合物分子式CAS号加和离子理论分子离子(m/z)实际分子离子(m/z)保留时间/min1L-天冬氨酸C4H7NO456-84-8[M+H]+134.044 78134.044 821.912L-异亮氨酸C6H13NO273-32-5[M+H]+132.101 91132.101 995.28 3L-亮氨酸C6H13NO261-90-5[M+H]+132.101 91132.101 975.744L-赖氨酸C6H14N2O256-87-1[M+H]+147.112 80147.112 731.715L-甲硫氨酸C5H11NO2S63-68-3[M+H]+150.058 33150.058 363.296L-苯丙氨酸C9H11NO263-91-2[M+H]+166.086 26166.086 467.597L-苏氨酸C4H9NO372-19-5[M+H]+120.065 52120.065 641.948L-酪氨酸C9H11NO360-18-4[M+H]+182.081 17182.081 104.599L-缬氨酸C5H11NO272-18-4[M+H]+118.086 26118.086 452.7710L-色氨酸C11H12N2O273-22-3[M+H]+205.097 15205.097 238.2811L-正亮氨酸(IS)C6H13NO2327-57-1[M+H]+132.101 91132.101 946.2412L-茶氨酸(IS)C7H14N2O33081-61-6[M+H]+175.107 59175.107 573.12
1.3.3 标准溶液配制
将10种氨基酸混合标准溶液用超纯水配制成浓度为100.0 μmol/L的混合标准中间溶液,贮存于4 ℃下备用;精确称取一定量的L-正亮氨酸(98%)、L-茶氨酸(98%)用超纯水溶解后置于10 mL棕色容量瓶中,并定容至刻度,配制成浓度分别为4.57、3.39 mmol/L的混合标准储备液,避光贮存于4 ℃下备用。
以超纯水为试剂,配制成10种氨基酸混合标准系列溶液浓度为0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0 μmol/L(L-正亮氨酸上机浓度为0.457 μmol/L、L-茶氨酸上机浓度为0.339 μmol/L,其中L-正亮氨酸作为L-亮氨酸、L-异亮氨酸和L-缬氨酸的内标物,L-茶氨酸作为L-苯丙氨酸、L-酪氨酸、L-色氨酸、L-甲硫氨酸、L-天冬氨酸、L-苏氨酸和L-赖氨酸的内标物)。
1.3.4 计算相对校正因子
根据1.3.3节中制备的不同质量浓度的混合对照品溶液进样上机分析测定得到的各氨基酸对应的峰面积,以L-赖氨酸为参照物,L-赖氨酸对待测氨基酸的相对校正因子fk/m,计算L-天冬氨酸、L-苏氨酸、L-缬氨酸、L-甲硫氨酸、L-酪氨酸、L-异亮氨酸、L-亮氨酸、L-苯丙氨酸、L-色氨酸的fk/m值。其计算如公式(1)所示:
(1)
式中:Cm、Ck为L-赖氨酸(参照物)和待测氨基酸组分的含量,μmol/L;,Am、Ak为L-赖氨酸和待测氨基酸组分的峰面积。
1.3.5 计算供试品溶液中L-赖氨酸的含量
通过配制0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0、20.0 μmol/L L-赖氨酸标准系列工作溶液,然后按照1.3.2节中所使用的超高效液相色谱串联高分辨质谱仪以及对应的参数进行上机分析,得到标准溶液L-赖氨酸的含量与峰面积对应的标准曲线,根据供试品溶液中L-赖氨酸的峰面积计算出供试品溶液中L-赖氨酸的含量Cm。
1.3.6 计算供试品溶液中其他氨基酸的含量
根据上述计算得到的相对校正因子fk/m以及供试品溶液中L-赖氨酸的含量Cm,得出供试品溶液中其他待测氨基酸组分的含量。其计算如公式(2)所示:
(2)
式中:Cx为供试品溶液中其他待测氨基酸组分的含量,μmol/L;Cm为供试品溶液中L-赖氨酸的含量,μmol/L;Am、Ax为待测样品中L-赖氨酸和其他氨基酸的峰面积。
1.4 数据处理
试验数据采用Excel软件进行数据简单汇总分析,运用Origin 8.5软件进行绘图,利用Minitab 15.0软件绘制高温大曲样品的质量控制图。
2 结果与分析
2.1 前处理方法优化
选择不同体积比的甲醇-水溶液对高温大曲样品中提取待测化合物的色谱峰情况进行分析,结果如图2所示。结果表明,以L-缬氨酸、L-甲硫氨酸、L-酪氨酸为例,随着V(甲醇)∶V(水)比例逐渐降低至 0∶100,即仅以超纯水作为提取溶液时,L-缬氨酸、L-甲硫氨酸与L-酪氨酸色谱峰响应值最高,同时,L-甲硫氨酸和L-酪氨酸色谱峰峰宽较窄,且色谱峰峰形明显较好。因此,该结果表明当V(甲醇)∶V(水)=0∶100时,高温大曲中重要风味成分前体氨基酸提取效果较佳。
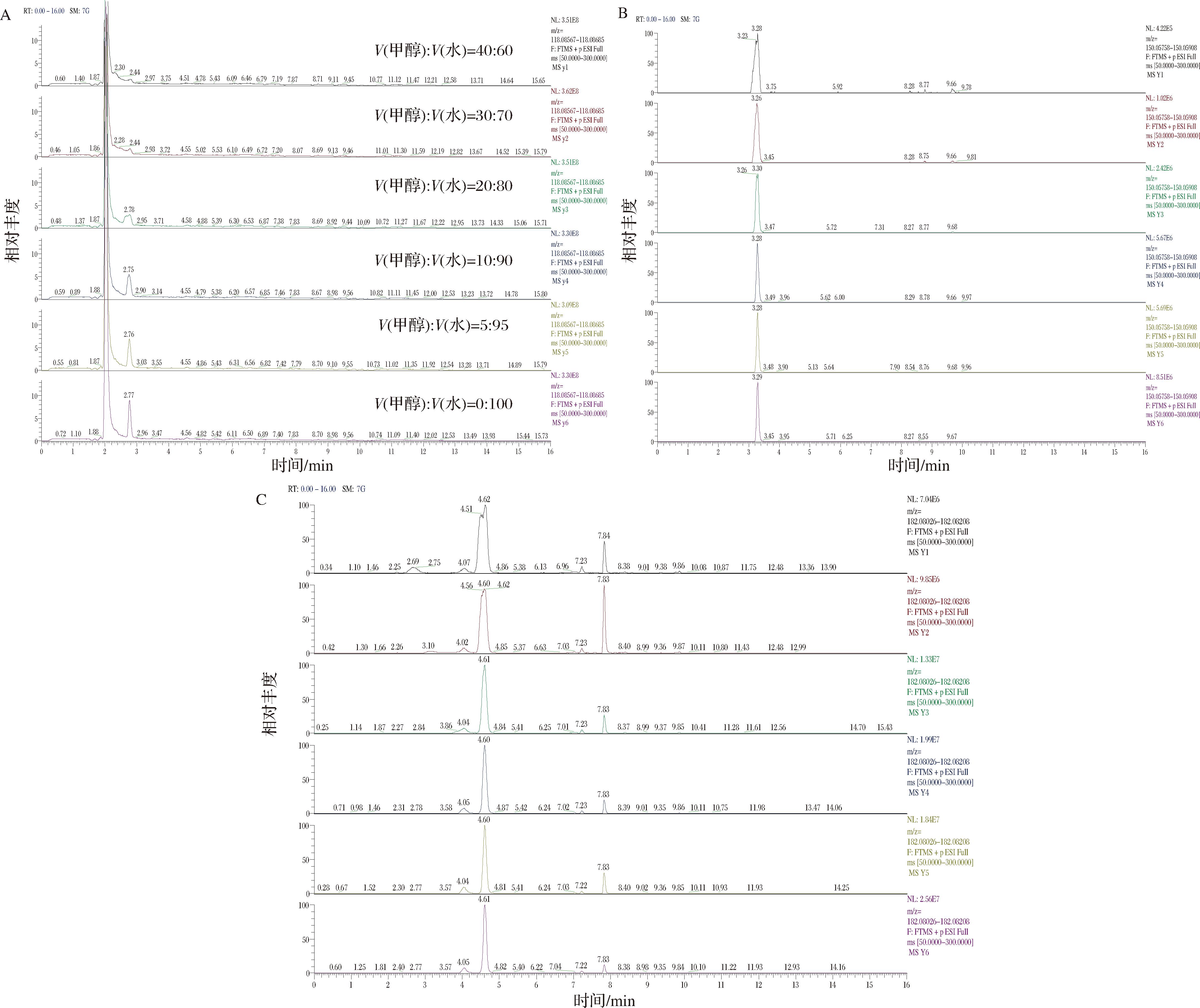
A-L-缬氨酸;B-L-甲硫氨酸;C-L-酪氨酸
图2 不同体积比甲醇-水提取溶液对高温大曲中待测化合物的影响
Fig.2 Effect of different volume ratios of methanol-water extraction solution on the compounds to be measured in high temperature Daqu
2.2 方法学考察
2.2.1 各化合物检测方法的线性范围和检出限及定量限
通过配制浓度为0.05、0.1、0.2、0.5、1.0、2.0、5.0、10.0 μmol/L的10种氨基酸混合标准系列溶液(L-正亮氨酸上机浓度为0.457 μmol/L、L-茶氨酸上机浓度为0.339 μmol/L),按上述的仪器条件进样测定,采用内标法定量。以各氨基酸标准品系列溶液浓度(μmol/L)为X轴,以各氨基酸标准品系列溶液峰面积与相对应内标物质峰面积比值为Y轴进行线性回归拟合,绘制标准曲线,即得相关线性回归方程;以信噪比(signal-to-noise ratio, S/N)为3,计算得到各待测组分的检出限(limit of detection, LOD),S/N为10计算得定量限(limit of quantitation, LOQ),具体内容详见表2。由表2可知,各待测氨基酸线性范围为0.05~10.0 μmol/L,且拟合线性方程的线性关系良好(R2≥0.997 0),同时,除L-苏氨酸(0.1 μmol/L)、L-缬氨酸(0.2 μmol/L),其他8种氨基酸的检出限均低于0.05 μmol/L,这可实现高温大曲中微量及痕量氨基酸的精确定性定量分析。
表2 各氨基酸标准工作系列溶液的线性方程、检出限和定量限
Table 2 Linear equation, LOD, and LOQ of each amino acid standard working series solution

序号化合物线性范围/(μmol/L)线性方程相关系数(R2)LOD/(μmol/L)LOQ/(μmol/L)1L-天冬氨酸0.1~5.0 Y=0.037 144+0.363 358X0.997 90.05 0.1 2L-苏氨酸0.2~5.0 Y=0.092 790 7+0.453 917X0.997 00.1 0.2 3L-缬氨酸 0.5~10.0 Y=0.251 995+0.999 746X0.999 10.2 0.5 4L-甲硫氨酸0.05~2.0 Y=0.008 866 23+1.122 48X0.999 70.02 0.05 5L-酪氨酸0.1~5.0 Y=0.063 129 1+1.003 81X0.999 20.05 0.1 6L-异亮氨酸0.1~5.0 Y=0.125 632+2.202 45X0.999 80.05 0.1 7L-亮氨酸0.1~5.0Y=0.181 833+2.464 73X0.999 20.05 0.1 8L-苯丙氨酸0.05~2.0 Y=0.078 931 5+2.184 08X0.998 50.02 0.05 9L-色氨酸0.05~5.0 Y=0.044 170 1+1.275 67X0.999 70.02 0.0510L-赖氨酸 0.1~5.0 Y=-0.009 601 32+0.357 098X0.998 10.05 0.1
2.2.2 各氨基酸测定方法的回收率和精密度
在高温大曲样品中根据各氨基酸的定量限,加入3个不同含量的氨基酸标准溶液,使其配制成加标样品,前处理后利用超高效液相色谱串联高分辨质谱仪进行分析,每个加标水平做3次平行,每个平行重复测定6次,计算平均回收率,以验证测定方法的准确度、精密度及稳定性,分析结果见表3。对于3种不同的加标水平,其平均回收率为77.71%~109.56%,且相对标准偏差(relative standard deviation, RSD)为0.24%~4.20%。可见,该测定方法对高温大曲中多种重要风味成分前体氨基酸具有良好的回收率、精密度及稳定性,同时,前处理方法对样品中重要风味成分前体氨基酸损失较低。
表3 各待测组分测定方法的回收率和精密度
Table 3 Recovery rate and precision of objects to be measured
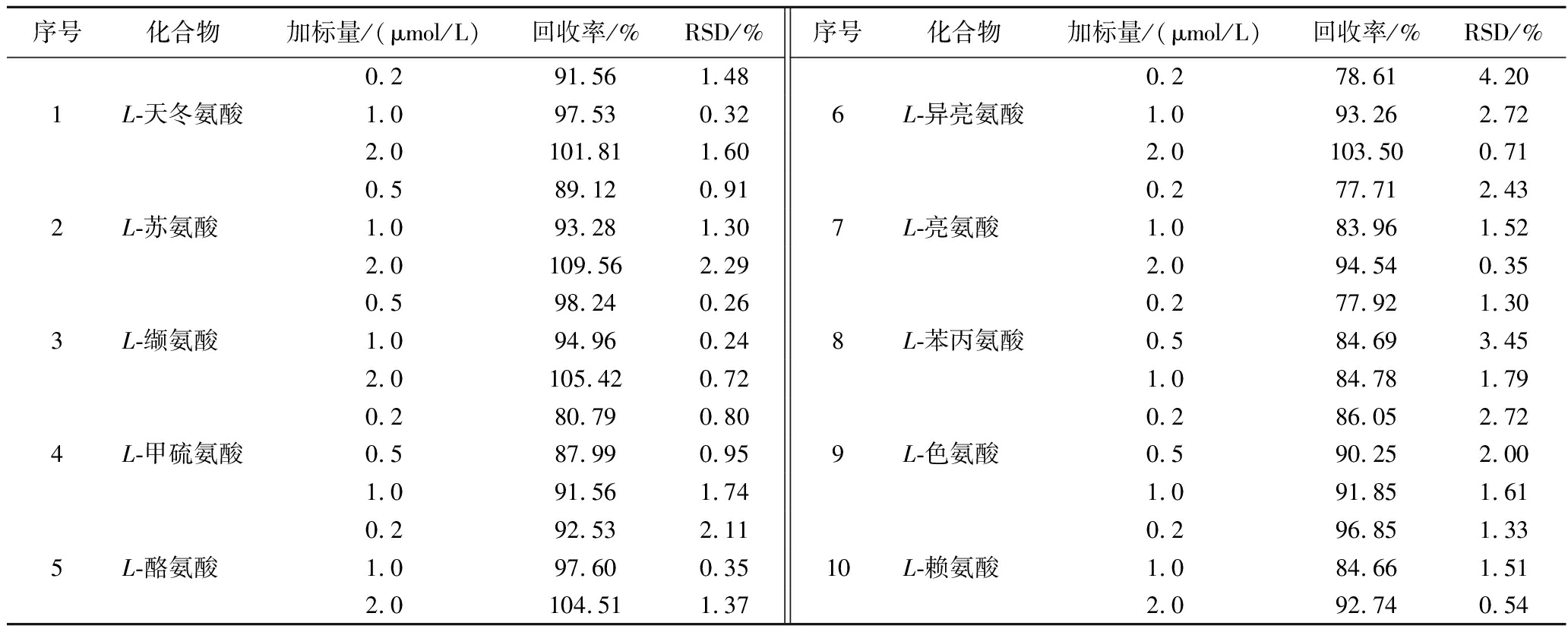
序号化合物加标量/(μmol/L)回收率/%RSD/%序号化合物加标量/(μmol/L)回收率/%RSD/%0.2 91.561.480.2 78.614.201L-天冬氨酸1.0 97.530.326L-异亮氨酸1.0 93.262.722.0101.811.602.0 103.500.710.5 89.120.910.277.712.432L-苏氨酸 1.0 93.281.307L-亮氨酸 1.0 83.961.522.0 109.562.292.094.540.350.598.240.260.2 77.921.303L-缬氨酸 1.094.960.248L-苯丙氨酸0.5 84.693.452.0 105.420.721.0 84.781.790.2 80.790.800.2 86.052.724L-甲硫氨酸0.5 87.990.959L-色氨酸 0.5 90.252.001.0 91.561.741.0 91.851.610.2 92.532.110.296.851.335L-酪氨酸 1.097.600.3510L-赖氨酸 1.0 84.661.512.0 104.511.372.0 92.740.54
2.3 不同生产过程高温大曲中重要风味前体物含量分析
结合仪器测定和计算可得高温大曲中L-天冬氨酸、L-苏氨酸、L-缬氨酸、L-甲硫氨酸、L-酪氨酸、L-异亮氨酸、L-亮氨酸、L-苯丙氨酸、L-色氨酸的fk/m值分别为0.965、0.776、0.559、0.349、0.357、0.295、0.263、0.156、0.250。
通过建立UPLC-HRMS-QAMS法测定不同生产环节下高温大曲样品中9种重要风味成分前体氨基酸含量,分析结果见附图1~附图3(https://doi.org/10.13995/j.cnki.11-1802/ts.036825)。由附图1~附图3可知,在同一生产环节下不同曲仓内不同取样位置的重要风味前体氨基酸含量均在一定范围内波动,其中,不同生产环节下高温大曲中L-甲硫氨酸和L-色氨酸含量均低于其他氨基酸含量,且2种氨基酸含量变化幅度较小;不同生产环节下高温大曲中L-亮氨酸和L-缬氨酸含量均高于其他氨基酸含量。这些实验监测数据可用于绘制高温大曲样品不同生产环节下质量控制图,便于后续持续监测高温大曲生产过程变化情况,以达到有效监控高温大曲生产过程中品质保障。
为进一步评估UPLC-HRMS-QAMS法测定高温大曲样品中重要风味成分前体氨基酸含量的可行性与适用性。分别采用UPLC-HRMS-QAMS法和内标法分析高温大曲样品中对应重要风味成分前体氨基酸的含量,对比分析内标法与UPLC-HRMS-QAMS法的标准法差值(standard method difference, SMD)评价UPLC-HRMS-QAMS法测定样品中重要风味成分前体物氨基酸含量的可行性与适用性。其计算如公式(3)所示:
(3)
式中:CIS与CQAMS分别表示内标法与UPLC-HRMS-QAMS法测定高温大曲样品中重要风味成分前体物氨基酸的含量。
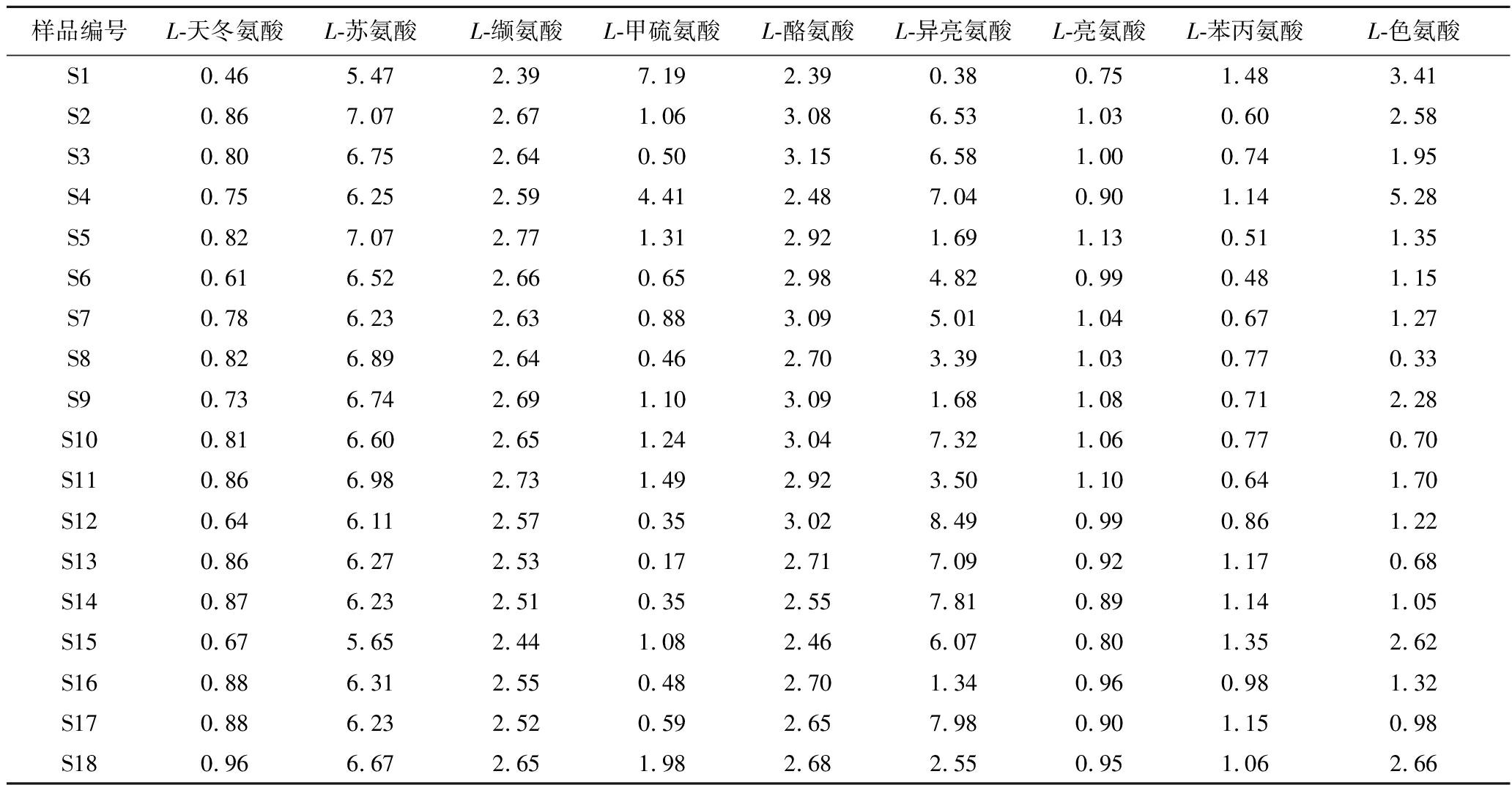
通过对“一次翻曲”环节下高温大曲样品中的重要风味成分前体氨基酸含量进行测定,通过内标法与UPLC-HRMS-QAMS法分别分析“一次翻曲”下高温大曲样品中9种重要风味成分前体氨基酸的含量并计算二者间的SMD,具体如表4所示。其中,各重要风味成分前体氨基酸含量的SMD分别小于0.96%、7.07%、2.77%、7.19%、3.09%、8.49%、1.13%、1.48%、5.28%,实验结果表明,通过UPLC-HRMS-QAMS法可实现“一次翻曲”高温大曲样品中各重要风味成分前体氨基酸含量的测定。
表4 “一次翻曲”高温大曲样品中重要风味成分前体氨基酸含量的SMD值 单位:%
Table 4 SMD of 9 amino acid of important flavor components precursors in high-temperature Daqu under “first flip” phase
样品编号L-天冬氨酸L-苏氨酸L-缬氨酸L-甲硫氨酸L-酪氨酸L-异亮氨酸L-亮氨酸L-苯丙氨酸L-色氨酸S10.465.472.397.192.390.380.751.483.41S20.867.072.671.063.086.531.030.602.58S30.806.752.640.503.156.581.000.741.95S40.756.252.594.412.487.040.901.145.28S50.827.072.771.312.921.691.130.511.35S60.616.522.660.652.984.820.990.481.15S70.786.232.630.883.095.011.040.671.27S80.826.892.640.462.703.391.030.770.33S90.736.742.691.103.091.681.080.712.28S100.816.602.651.243.047.321.060.770.70S110.866.982.731.492.923.501.100.641.70S120.646.112.570.353.028.490.990.861.22S130.866.272.530.172.717.090.921.170.68S140.876.232.510.352.557.810.891.141.05S150.675.652.441.082.466.070.801.352.62S160.886.312.550.482.701.340.960.981.32S170.886.232.520.592.657.980.901.150.98S180.966.672.651.982.682.550.951.062.66
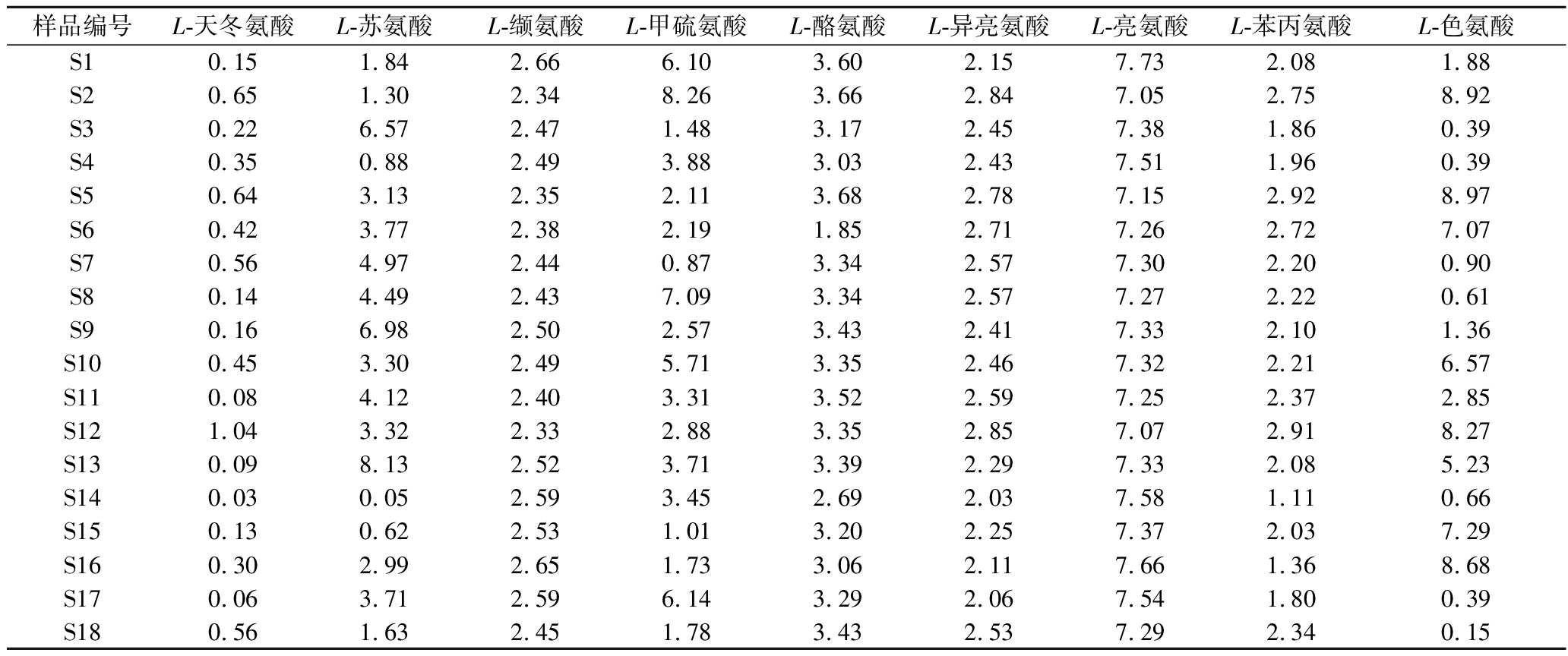
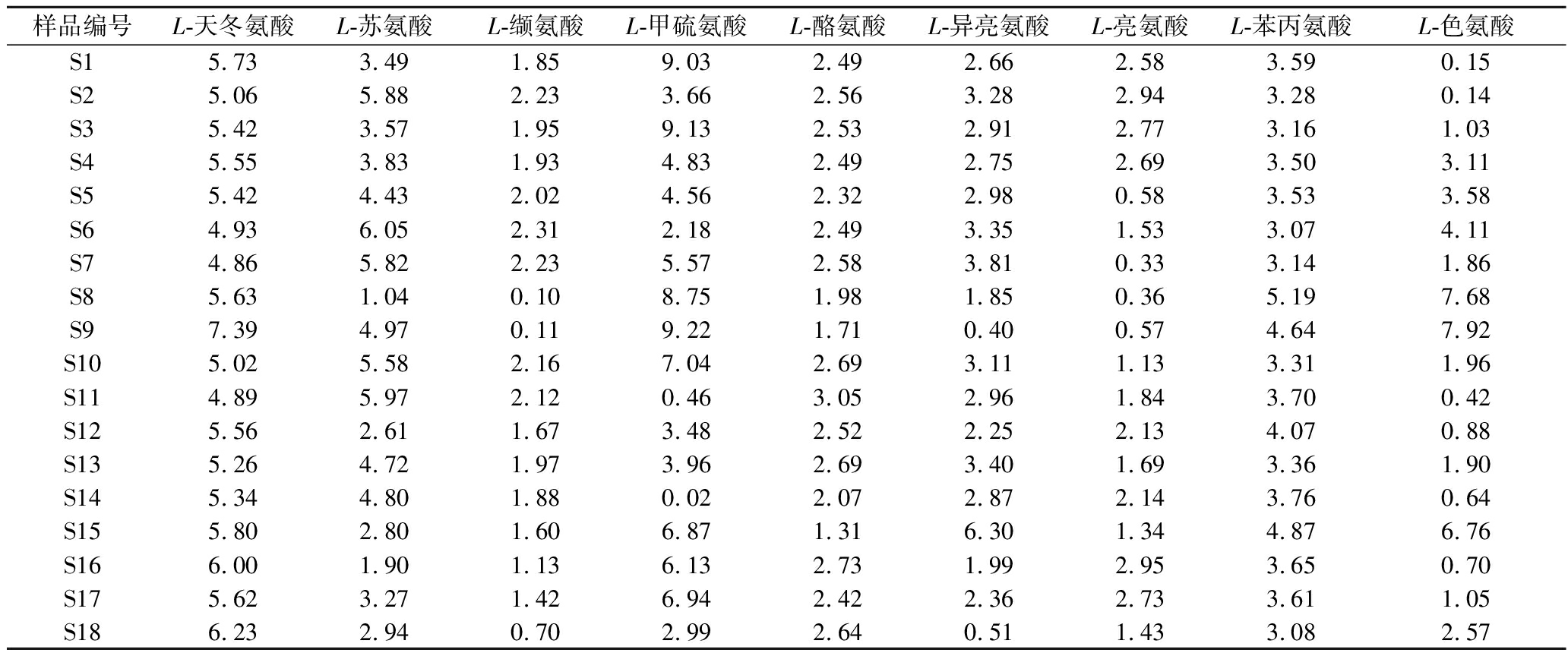
同理,对“二次翻曲”、“拆曲”环节下高温大曲样品中的重要风味成分前体氨基酸的含量进行测定。通过内标法与UPLC-HRMS-QAMS法分别分析“二次翻曲”、“拆曲”下高温大曲样品中9种重要风味成分前体物氨基酸含量并计算二者间的SMD,分析结果见表5和表6。其中,由表6可知,各重要风味成分前体氨基酸含量的SMD分别小于0.65%、8.13%、2.66%、8.26%、3.68%、2.85%、7.66%、2.92%、8.97%,表明通过UPLC-HRMS-QAMS法可实现“二次翻曲”高温大曲样品中各重要风味成分前体氨基酸含量的测定。“拆曲”环节下高温大曲样品的分析结果见表7,各重要风味成分前体氨基酸含量的SMD分别小于7.39%、6.05%、2.31%、9.22%、2.73%、6.30%、2.95%、5.19%、7.92%,表明通过UPLC-HRMS-QAMS法可实现“拆曲”高温大曲样品中各重要风味成分前体氨基酸含量的测定。
表5 “二次翻曲”高温大曲样品中重要风味成分前体氨基酸含量的SMD 单位:%
Table 5 SMD of 9 amino acid of important flavor components precursors in high-temperature Daqu under “second flip” phase
样品编号L-天冬氨酸L-苏氨酸L-缬氨酸L-甲硫氨酸L-酪氨酸L-异亮氨酸L-亮氨酸L-苯丙氨酸L-色氨酸S10.151.842.666.103.602.157.732.081.88S20.651.302.348.263.662.847.052.758.92S30.226.572.471.483.172.457.381.860.39S40.350.882.493.883.032.437.511.960.39S50.643.132.352.113.682.787.152.928.97S60.423.772.382.191.852.717.262.727.07S70.564.972.440.873.342.577.302.200.90S80.144.492.437.093.342.577.272.220.61S90.166.982.502.573.432.417.332.101.36S100.453.302.495.713.352.467.322.216.57S110.084.122.403.313.522.597.252.372.85S121.043.322.332.883.352.857.072.918.27S130.098.132.523.713.392.297.332.085.23S140.030.052.593.452.692.037.581.110.66S150.130.622.531.013.202.257.372.037.29S160.302.992.651.733.062.117.661.368.68S170.063.712.596.143.292.067.541.800.39S180.561.632.451.783.432.537.292.340.15
表6 “拆曲”高温大曲样品中重要风味成分前体氨基酸含量的SMD 单位:%
Table 6 SMD of 9 amino acid of important flavor components precursors in high-temperature Daqu under “tear down” phase
样品编号L-天冬氨酸L-苏氨酸L-缬氨酸L-甲硫氨酸L-酪氨酸L-异亮氨酸L-亮氨酸L-苯丙氨酸L-色氨酸S15.733.491.859.032.492.662.583.590.15S25.065.882.233.662.563.282.943.280.14S35.423.571.959.132.532.912.773.161.03S45.553.831.934.832.492.752.693.503.11S55.424.432.024.562.322.980.583.533.58S64.936.052.312.182.493.351.533.074.11S74.865.822.235.572.583.810.333.141.86S85.631.040.108.751.981.850.365.197.68S97.394.970.119.221.710.400.574.647.92S105.025.582.167.042.693.111.133.311.96S114.895.972.120.463.052.961.843.700.42S125.562.611.673.482.522.252.134.070.88S135.264.721.973.962.693.401.693.361.90S145.344.801.880.022.072.872.143.760.64S155.802.801.606.871.316.301.344.876.76S166.001.901.136.132.731.992.953.650.70S175.623.271.426.942.422.362.733.611.05S186.232.940.702.992.640.511.433.082.57
2.4 结合质量控制图监测高温大曲生产过程品质变化
将质量控制图应用于高温大曲生产过程品质指标评价,使制曲环节的质控水平由传统管理阶段跃升为先进的统计控制阶段,这为保证高温大曲生产过程稳定受控,减少其生产过程质量波动,最终实现高温大曲质量的持续改进提供技术保障[25-26]。质量控制图是对质量特性值加以测定、记录并进行控制的一种图。根据控制指标,基于Minitab 15.0软件利用休哈特控制图中的单值-移动极差控制图原理用于建立高温大曲品质监控的质量控制图,其中,CL表示样本质量特性值的平均值,控制上限UCL和控制下限LCL依据“3σ准则”按公式(4)~公式(6)计算,移动极差(R)质量控制图按公式(7)~公式(9)计算,如下所示:
(4)
(5)
(6)
(7)
(8)
LCLR=0
(9)
式中:![]() 为不同生产批次高温大曲中同一氨基酸的平均值;
为不同生产批次高温大曲中同一氨基酸的平均值;![]() 为平均移动极差,其中:R=|Xi+1-Xi|,Xi为高温大曲中第i氨基酸含量。
为平均移动极差,其中:R=|Xi+1-Xi|,Xi为高温大曲中第i氨基酸含量。
基于Minitab软件计算得到高温大曲品质监控的质量控制图,如附图4~附图6所示(https://doi.org/10.13995/j.cnki.11-1802/ts.036825),质量控制图是对质量特性值加以测定、记录并进行控制的一种图,图中纵坐标为质量特性值,设有中心CL值、控制上限UCL值、控制下限LCL值;横坐标为不同生产厂房下不同生产位点下高温大曲样本号。
以控制指标的中心CL值、控制上限UCL值、控制下限LCL值确定不同关键节点高温大曲中所述氨基酸含量的合格与不合格区域;若所测定得到的氨基酸含量不在计算得到的质量控制图的范围内,则判定为高温大曲的品质出现了异样,若所测定得到的氨基酸含量在计算得到的质量控制图的范围内,则判定为高温大曲的品质正常。以此通过测定实验数据计算得到的质量控制图来实现高温大曲生产过程中的品质的监控。
3 结论
相比测定高温大曲中氨基酸含量的传统方法,基于UPLC-HRMS-QAMS法可有效解决高温大曲中多种氨基酸定性定量分析及其质量控制中存在对照品缺乏的问题,在降低检测成本的同时实现了多氨基酸同步质量控制可反映生产过程中高温大曲品质。而基于质量控制图的UPLC-HRMS-QAMS法优势在于只有既符合质量控制图的要求又符合含量要求双重标准的产品才是符合生产要求的高温大曲,对于控制不同生产环节间高温大曲的品质一致性具有重要意义。其次,运用质量控制图大大提高了生产过程中高温大曲品质评价的效率,具有即时、快速反应的特点,实现了大曲质量的客观化、系统化评价,可为白酒企业在控制高温大曲品质方面提供了参考方法。
该研究以收集不同生产环节下高温大曲为实验样品,以L-赖氨酸为参照物通过UPLC-HRMS-QAMS法定性定量分析高温大曲中9种重要风味成分前体物氨基酸含量,解决了高温大曲多成分定量和多指标质量控制中存在的对照品缺乏问题。同时,所建立的UPLC-HRMS-QAMS法测定多种氨基酸含量具有快速、简单、灵敏度高、精密度高,稳定性好等优势。其次,基于Minitab软件利用休哈特控制图中单值-移动极差控制图构建不同生产环节下高温大曲品质监控的质量控制图,应用该方式可实现对不同生产环节下高温大曲品质的有效监控,进而为制曲生产工艺调整提供数据参考,为实现白酒企业高温大曲优质优产提供数据支撑及技术保障。此外,基于UPLC-HRMS-QAMS法结合质量控制图的高温大曲质量控制模式与现有企业内部标准相比,可反映各重要风味成分前体氨基酸含量的控制水平,也能为进一步完善高温大曲在生产使用过程中质量控制标准提供依据。
[1] 周晨曦, 郑福平, 李贺贺, 等.白酒大曲风味物质研究进展[J].中国酿造, 2019, 38(5):6-12. ZHOU C X, ZHENG F P, LI H H, et al.Research progress on flavor compounds of Baijiu Daqu[J].China Brewing, 2019, 38(5):6-12.
[2] 陈孝, 温承坤, 巩园园, 等.酒曲的研究进展[J].中国酿造, 2019, 38(10):7-11. CHEN X, WEN C K, GONG Y Y, et al.Research progress on Jiuqu[J].China Brewing, 2019, 38(10):7-11.
[3] 牛姣, 沈毅, 张贵虎, 等.白酒酿造原料与酒体品质关系的研究进展[J].食品与发酵工业, 2023, 49(3):322-328. NIU J, SHEN Y, ZHANG G H, et al.Research progress on the relationship between raw materials and Baijiu quality[J].Food and Fermentation Industries, 2023, 49(3):322-328.
[4] 张巧玲, 吕锡斌, 秦兴, 等.酱香型白酒高温大曲游离氨基酸比较分析[J].中国酿造, 2019, 38(4):53-57. ZHANG Q L, LV X B, QIN X, et al.Comparative analysis of free amino acids in high temperature Daqu of Moutai-flavor Baijiu[J].China Brewing, 2019, 38(4):53-57.
[5] 程度, 曹建兰, 王珂佳, 等.高粱对酱香型白酒品质影响的研究进展[J].食品科学, 2022, 43(7):356-364. CHENG D, CAO J L, WANG K J, et al.Progress in understanding the effect of sorghum on the quality of Maotai-flavor baijiu[J].Food Science, 2022, 43(7):356-364.
[6] 钟敏, 张健.原料糯高粱对酱香型白酒品质影响的研究现状[J].中国酿造, 2022, 41(1):32-36. ZHONG M, ZHANG J.Research status of effect of raw glutinous sorghum on quality of sauce-flavor Baijiu[J].China Brewing, 2022, 41(1):32-36.
[7] 杨慧丽, 杜莹, 汪建文, 等.一测多评法测定羊肚菌中17种氨基酸的含量[J].食品工业科技, 2021, 42(21):294-302. YANG H L, DU Y, WANG J W, et al.Determination of seventeen amino acids in Morchella esculenta by quantitative analysis of multi-components by single-marker method[J].Science and Technology of Food Industry, 2021, 42(21):294-302.
[8] 陈乃东, 王宇, 王荣花, 等.一种采用一测多评法测定石斛中游离氨基酸含量的方法:中国, CN113176357A[P].2021-07-27. CHEN N D, WANG Y, WANG R H, et al.A method for the determination of free amino acid content in Dendrobium dendrobium by one test and multiple evaluation method:China, CN113176357A[P].2021-07-27.
[9] 张丽先, 范毅, 魏悦, 等.一测多评法同时测定野菊花中12个成分[J].药物分析杂志, 2020, 40(2):218-226. ZHANG L X, FAN Y, WEI Y, et al.Determination of twelve components in Chrysanthemum indicum by quantitative analysis of multi-components by single marker[J].Chinese Journal of Pharmaceutical Analysis, 2020, 40(2):218-226.
[10] NING Z C, LIU Z L, SONG Z Q, et al.A single marker choice strategy in simultaneous characterization and quantification of multiple components by rapid resolution liquid chromatography coupled with triple quadrupole tandem mass spectrometry (RRLC-QqQ-MS)[J].Journal of Pharmaceutical and Biomedical Analysis, 2016, 124:174-188.
[11] STAVRIANIDI A, STEKOLSHCHIKOVA E, POROTOVA A, et al.Combination of HPLC-MS and QAMS as a new analytical approach for determination of saponins in ginseng containing products[J].Journal of Pharmaceutical and Biomedical Analysis, 2017, 132:87-92.
[12] FERRÉ S, GONZ LEZ-RUIZ V, GUILLARME D, et al.Analytical strategies for the determination of amino acids:Past, present and future trends[J].Journal of Chromatography B, 2019, 1132:121819.
LEZ-RUIZ V, GUILLARME D, et al.Analytical strategies for the determination of amino acids:Past, present and future trends[J].Journal of Chromatography B, 2019, 1132:121819.
[13] 李国辉, 钟其顶, 高红波, 等.GC-FID测定黄酒中17种游离氨基酸[J].食品与发酵工业, 2012, 38(12):147-151. LI G H, ZHONG Q D, GAO H B, et al.Determination of 17 free amino acids in rice wine by gas chromatography-flame ionization detector (GC-FID)[J].Food and Fermentation Industries, 2012, 38(12):147-151.
[14] LI M, LI D X, TAI Y L, et al.Determination of free amino acids in tea by a novel method of reversed-phase high performance liquid chromatography applying 6-Aminoquinolyl-N-Hydroxysuccinimidyl carbamate reagent[J].Journal of Food Science and Technology, 2018, 55(10):4276-4286.
[15] 申兆栋, 黄冬梅, 孔聪, 等.HPLC法在线衍生测定中华绒螯蟹中17种氨基酸含量[J].分析试验室, 2021, 40(5):552-557. SHEN Z D, HUANG D M, KONG C, et al.Determination of 17 amino acids in eriocheir sinensis by HPLC on line derivatization[J].Chinese Journal of Analysis Laboratory, 2021, 40(5):552-557.
[16] 秦慧彬, 田翔, 王海岗, 等.超高效液相色谱法测定传统发酵酸粥的游离氨基酸含量[J].食品科技, 2021, 46(4):273-280. QIN H B, TIAN X, WANG H G, et al.Determination of free amino acids in traditional fermented acidic-gruel by ultra-high performance liquid chromatography[J].Food Science and Technology, 2021, 46(4):273-280.
[17] 周金波, 朱智甲.液相色谱-串联质谱法同时测定化妆品中19种氨基酸[J].日用化学工业, 2019, 49(10):688-693. ZHOU J B, ZHU Z J.Simultaneous determination of 19 amino acids in cosmetics by liquid chromatography-tandem mass spectrometry[J].China Surfactant Detergent &Cosmetics, 2019, 49(10):688-693.
[18] LIYANAARACHCHI G V V, MAHANAMA K R R, SOMASIRI H P P S, et al.Development and validation of a method for direct, underivatized analysis of free amino acids in rice using liquid chromatography-tandem mass spectrometry[J].Journal of Chromatography A, 2018, 1568:131-139.
[19] ZHANG L, ZHENG W, LI X, et al.A merged method for targeted analysis of amino acids and derivatives using parallel reaction monitoring combined with untargeted profiling by HILIC-Q-Orbitrap HRMS[J].Journal of Pharmaceutical and Biomedical Analysis, 2021, 203:114208.
[20] 袁光蔚, 吴毅, 王海波, 等.基于超高效液相色谱-四极杆-静电场轨道阱高分辨质谱快速测定水果中18种游离氨基酸[J].食品工业科技, 2021, 42(5):243-249. YUAN G W, WU Y, WANG H B, et al.Determination of eighteen kinds of free amino acids in fruits by ultra performance liquid chromatography-quadrupole-exactive orbitrap mass spectrometry[J].Science and Technology of Food Industry, 2021, 42(5):243-249.
[21] 乔敏莎, 王凡, 山其木格, 等.超高效液相色谱质谱法测定酱香型酒曲原料中氨基酸含量[J].食品与发酵工业, 2023, 49(12):278-284. QIAO M S, WANG F, SHAN Q G M, et al.Direct determination of 19 amino acids in raw materials of Moutai-flavor Jiuqu by ultra performance liquid chromatography-tandem mass spectrometry[J].Food and Fermentation Industries, 2023, 49(12):278-284.
[22] 廖若昕, 杨慧, 叶倩, 等.基于质量控制图的蔬菜中矮壮素和赤霉素残留预警模式初探[J].食品工业科技, 2017, 38(13):225-228;296. LIAO R X, YANG H, YE Q, et al.Research on early-warning models of chlormequat chloride and gibberellins residues in vegetables based on quality control chart[J].Science and Technology of Food Industry, 2017, 38(13):225-228;296.
[23] STAVRIANIDI A.A classification of liquid chromatography mass spectrometry techniques for evaluation of chemical composition and quality control of traditional medicines[J].Journal of Chromatography A, 2020, 1609:460501.
[24] ZHANG Z Y, SHA M, LIU J, et al.Rapid quantitative analysis of Chinese Gu-Jing-Gong spirit for its quality control[J].Journal of the Institute of Brewing, 2017, 123(3):464-467.
[25] 赵统梅, 冯声宝, 许迎春.质量控制图在青稞酒质量控制中的应用研究[J].酿酒, 2022, 49(2):78-82. ZHAO T M, FENG S B, XU Y C.Application of quality control chart in quality control of highland barley liquor[J].Liquor Making, 2022, 49(2):78-82.
[26] 闫希军, 李长文, 梁慧珍, 等.一种酱香型白酒大曲生产的质量控制方法:中国, CN102071124A[P].2011-05-25. YAN X J, LI C W, LIANG H Z, et al.A method of quality control for the production of Jiang-flavor Daqu:China, CN102071124A[P].2011-05-25.
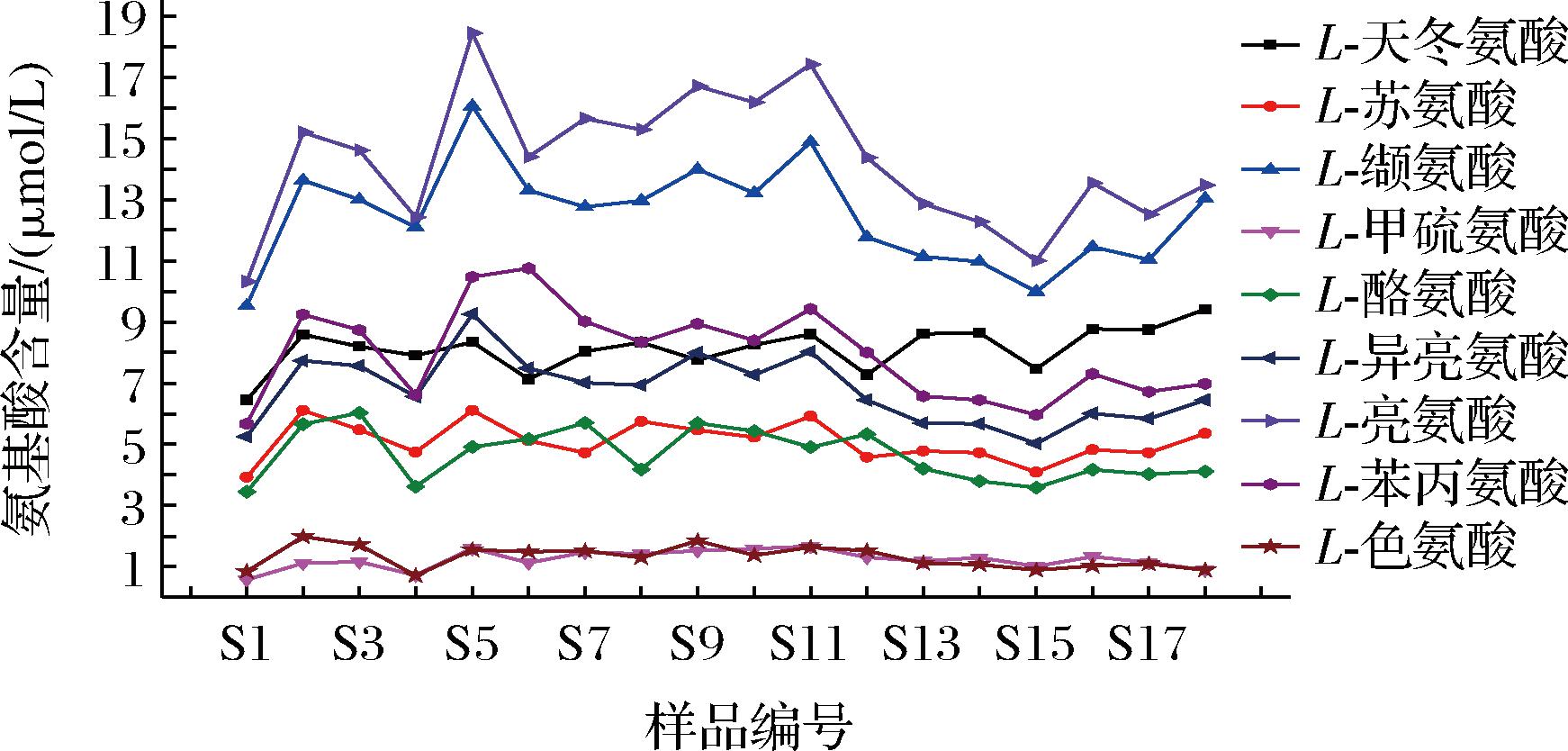
附图1 “一次翻曲”环节下高温大曲中9种重要风味成分前体氨基酸含量
Fig.1 Contents of 9 amino acid of important flavor components precursors in high-temperature Daqu under “first flip” phase
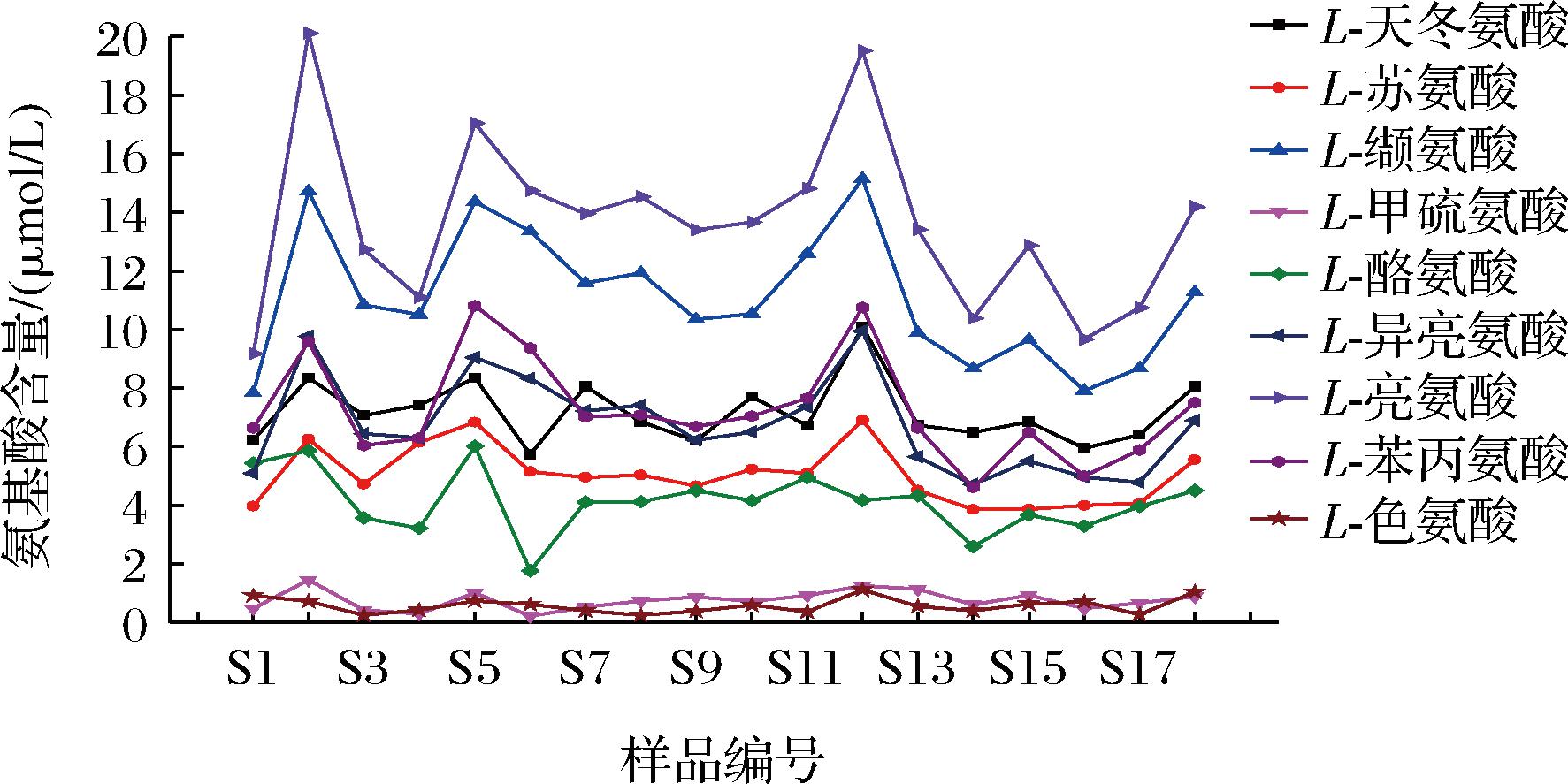
附图2 “二次翻曲”环节下高温大曲中9种重要风味成分前体氨基酸含量
Fig.2 Contents of 9 amino acid of important flavor components precursors in high-temperature Daqu under “second flip” phase
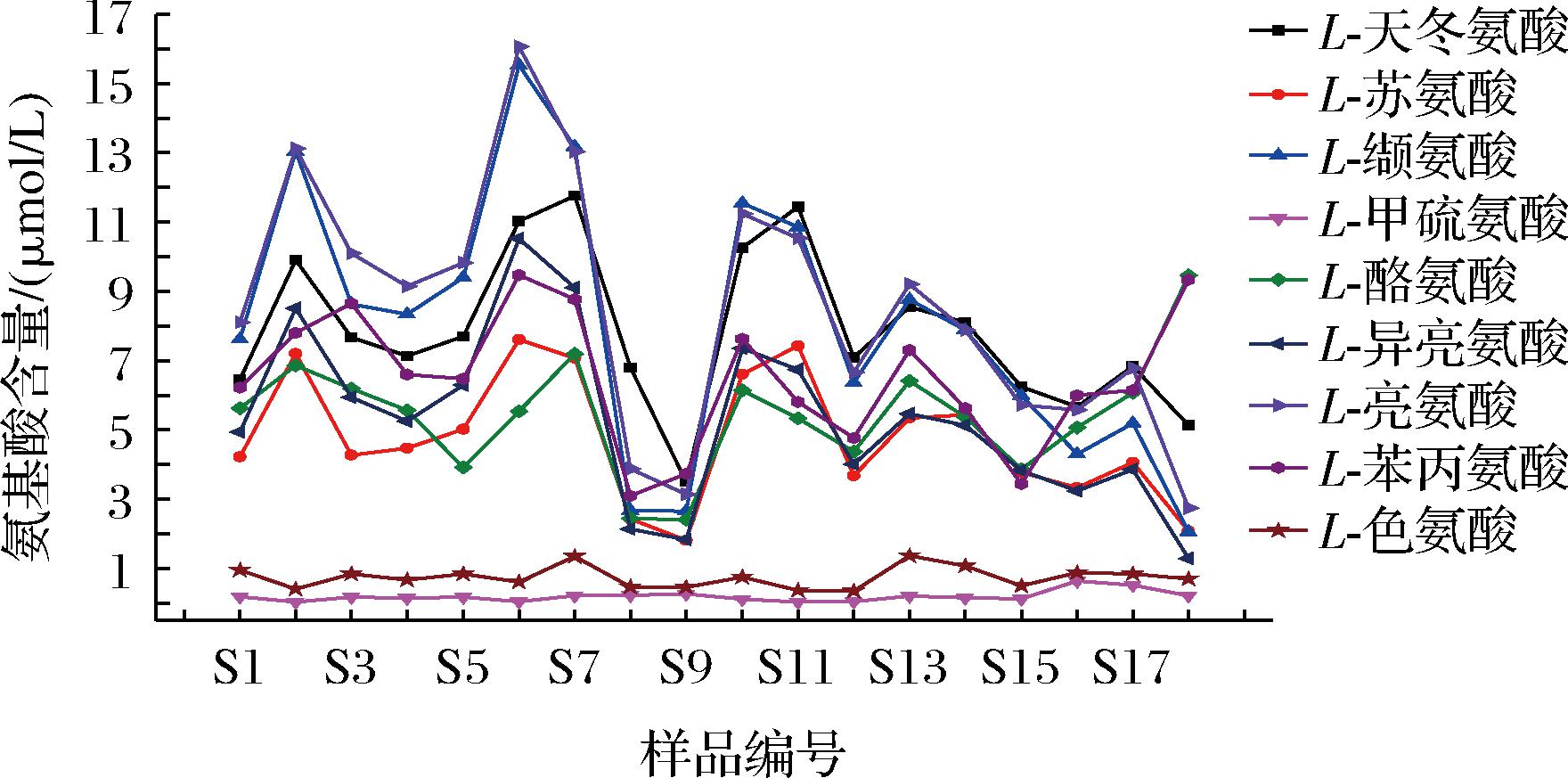
附图3 “拆曲”环节下高温大曲中9种重要风味成分前体氨基酸含量
Fig.3 Contents of 9 amino acid of important flavor components precursors in high-temperature Daqu under “tear down” phase
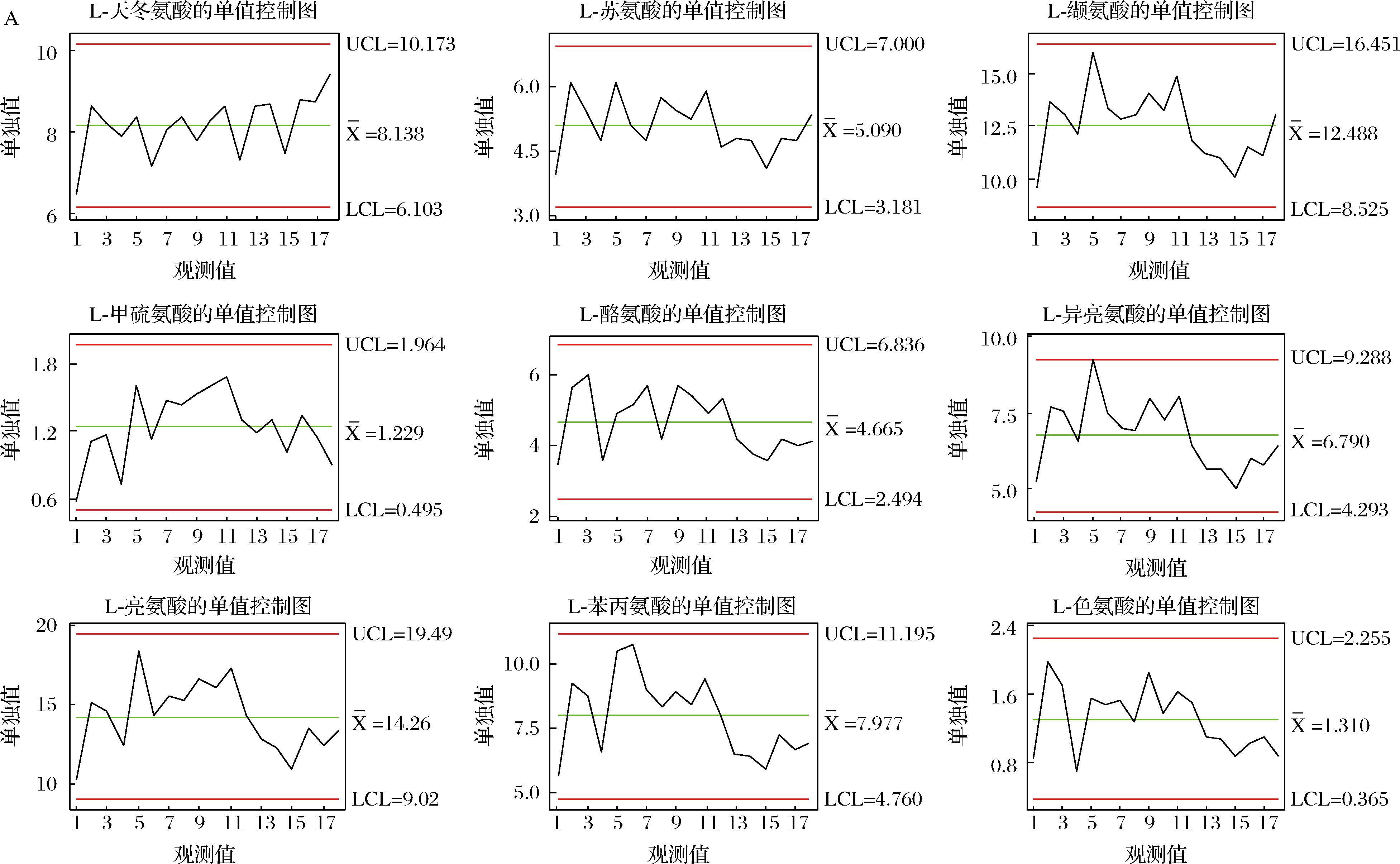
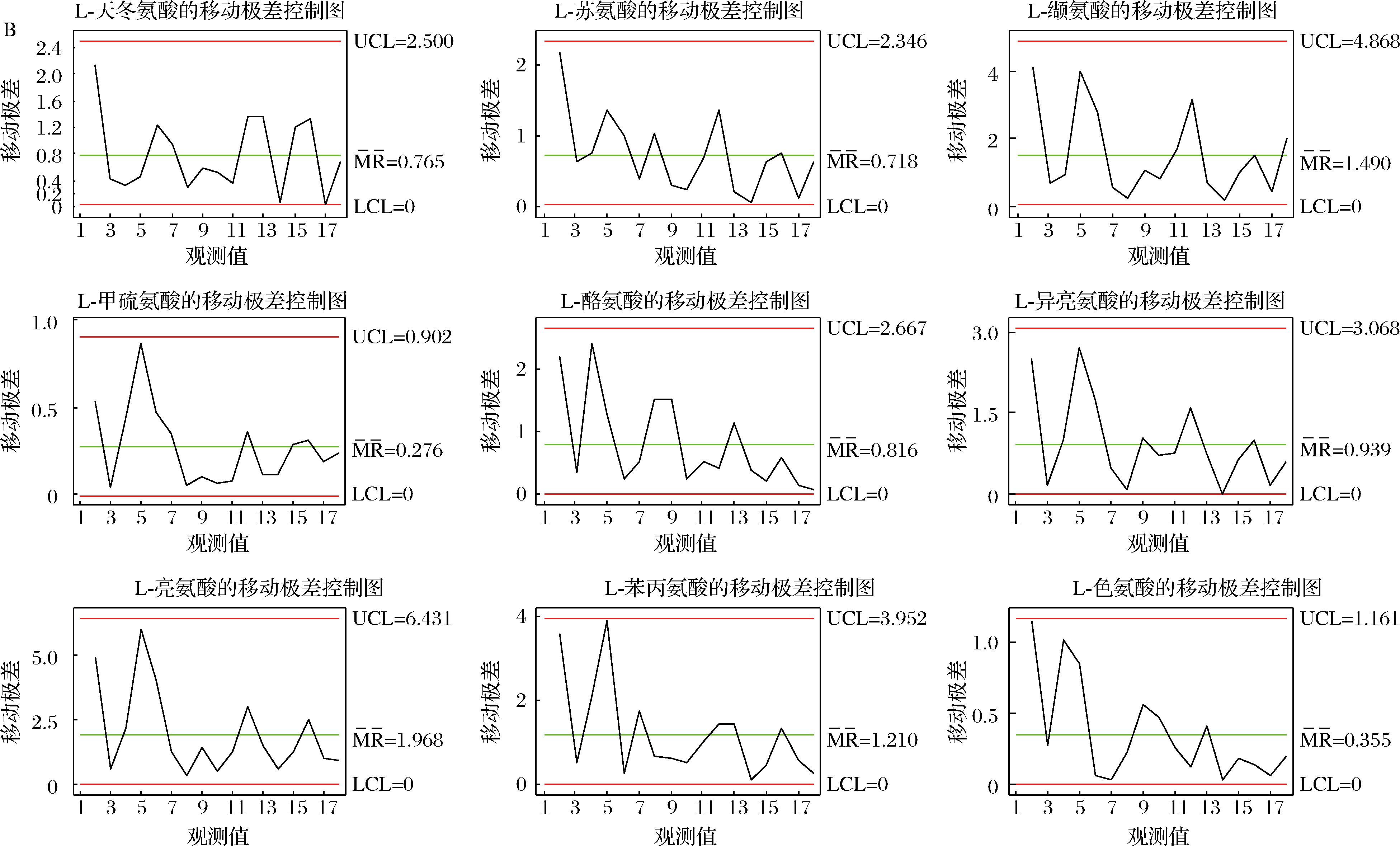
A-单值控制图;B-移动极差控制图
附图4 “一次翻曲”高温大曲样品中各氨基酸单值控制图和移动极差控制图
Fig.4 Single value control diagram and moving range control diagram of each amino acid in high-temperature Daqu under “first flip” phase
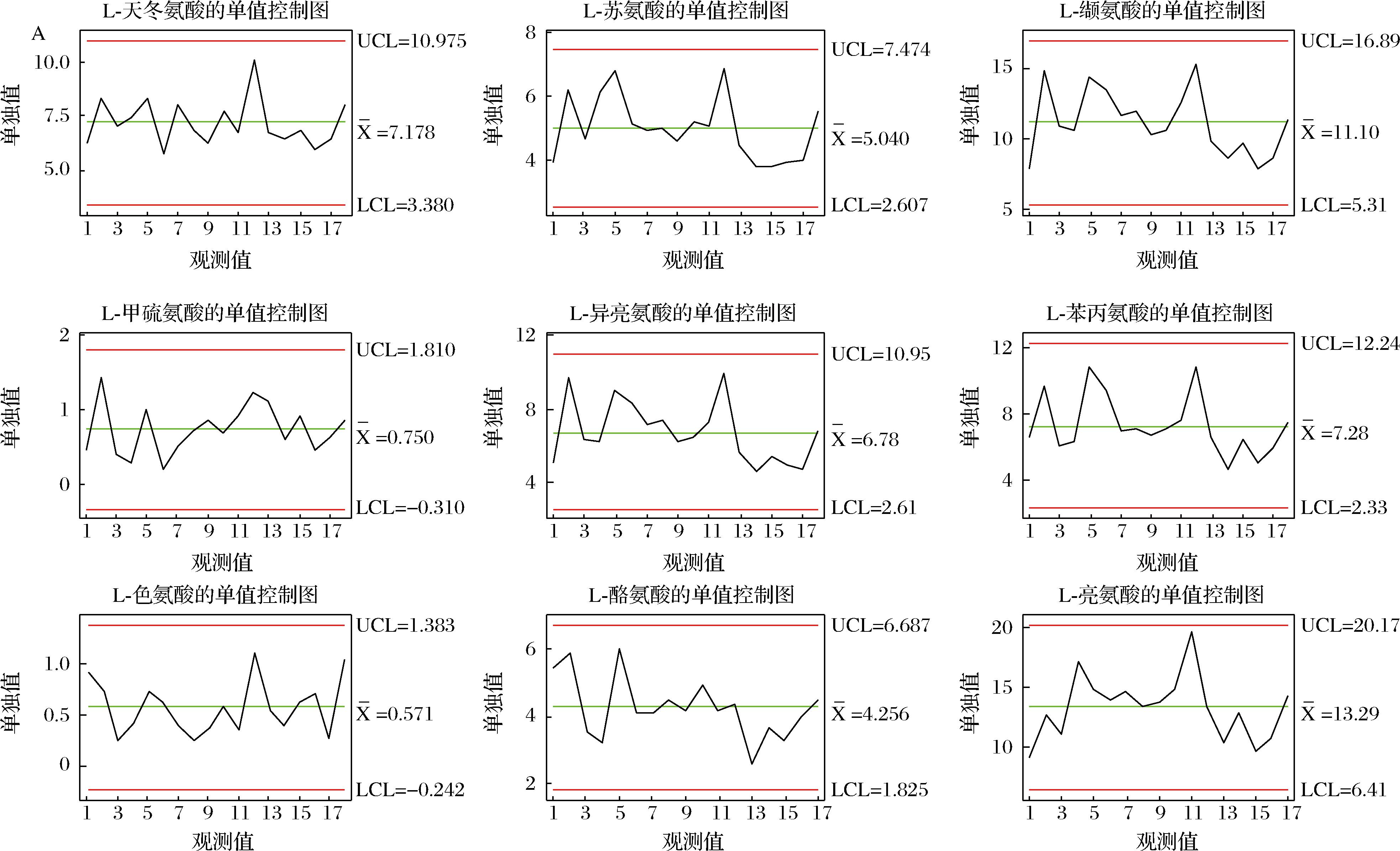
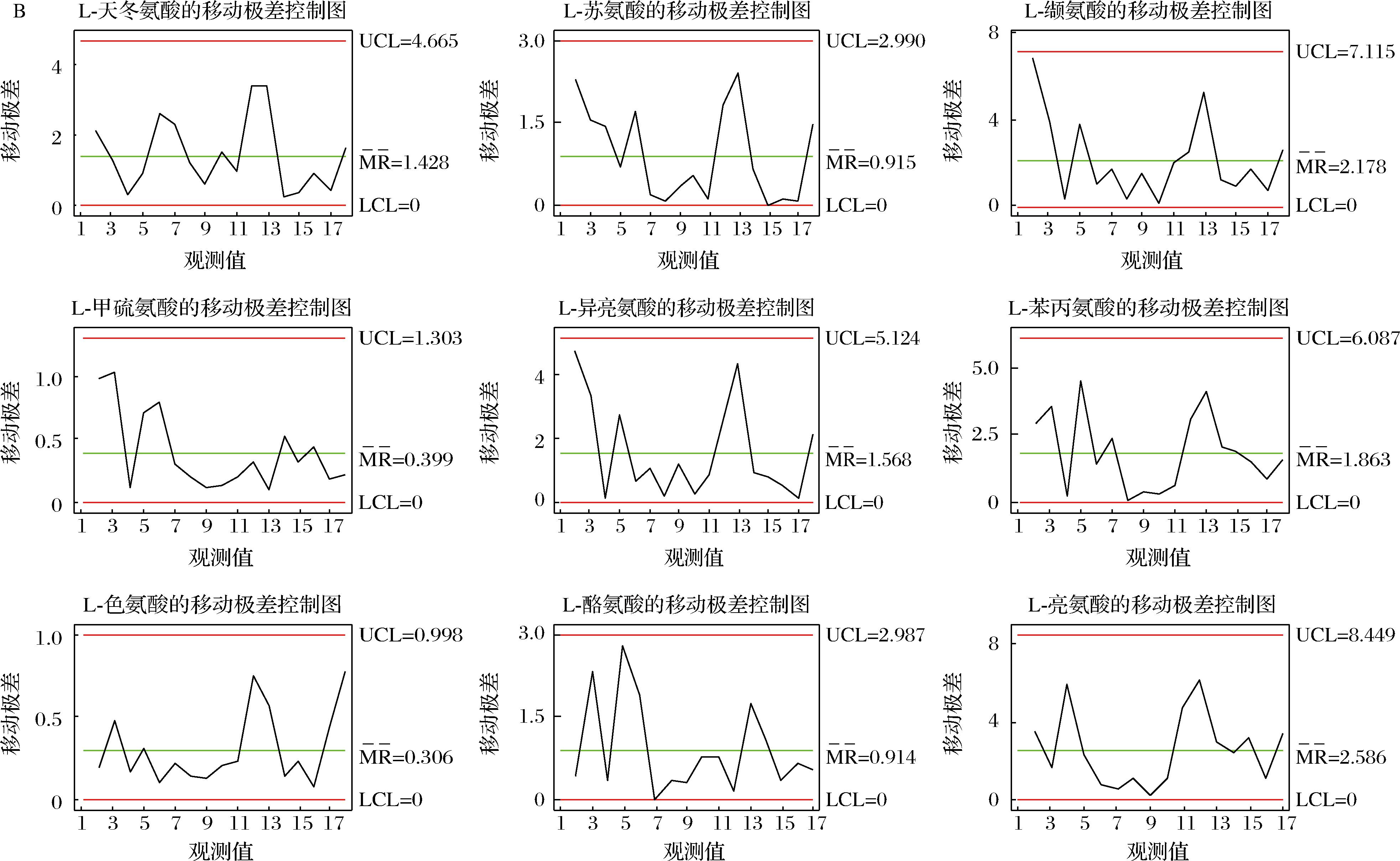
A-单值控制图;B-移动极差控制图
附图5 “二次翻曲”高温大曲样品中各氨基酸单值控制图和移动极差控制图
Fig.5 Single value control diagram and moving range control diagram of each amino acid in high-temperature Daqu under “second flip” phase
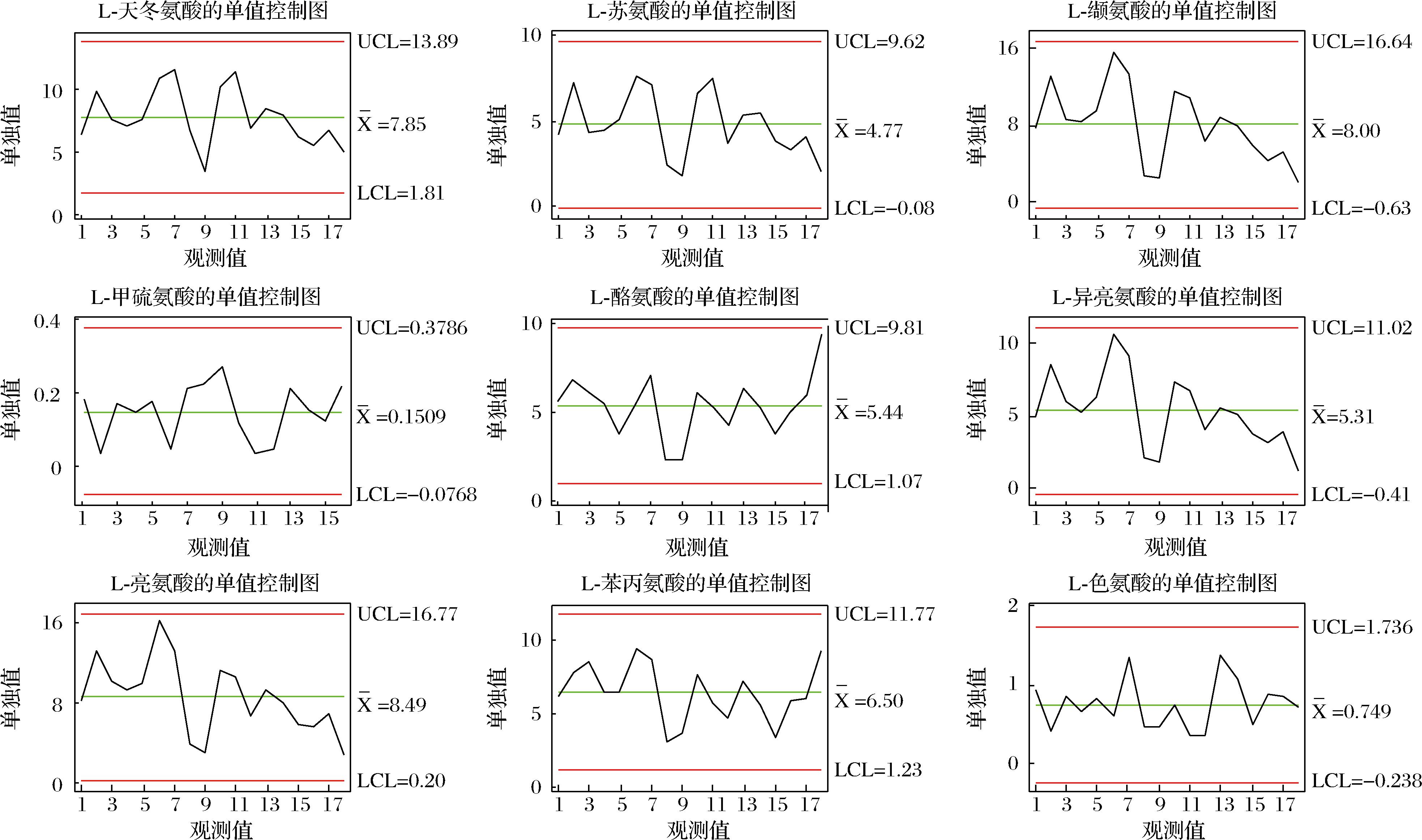
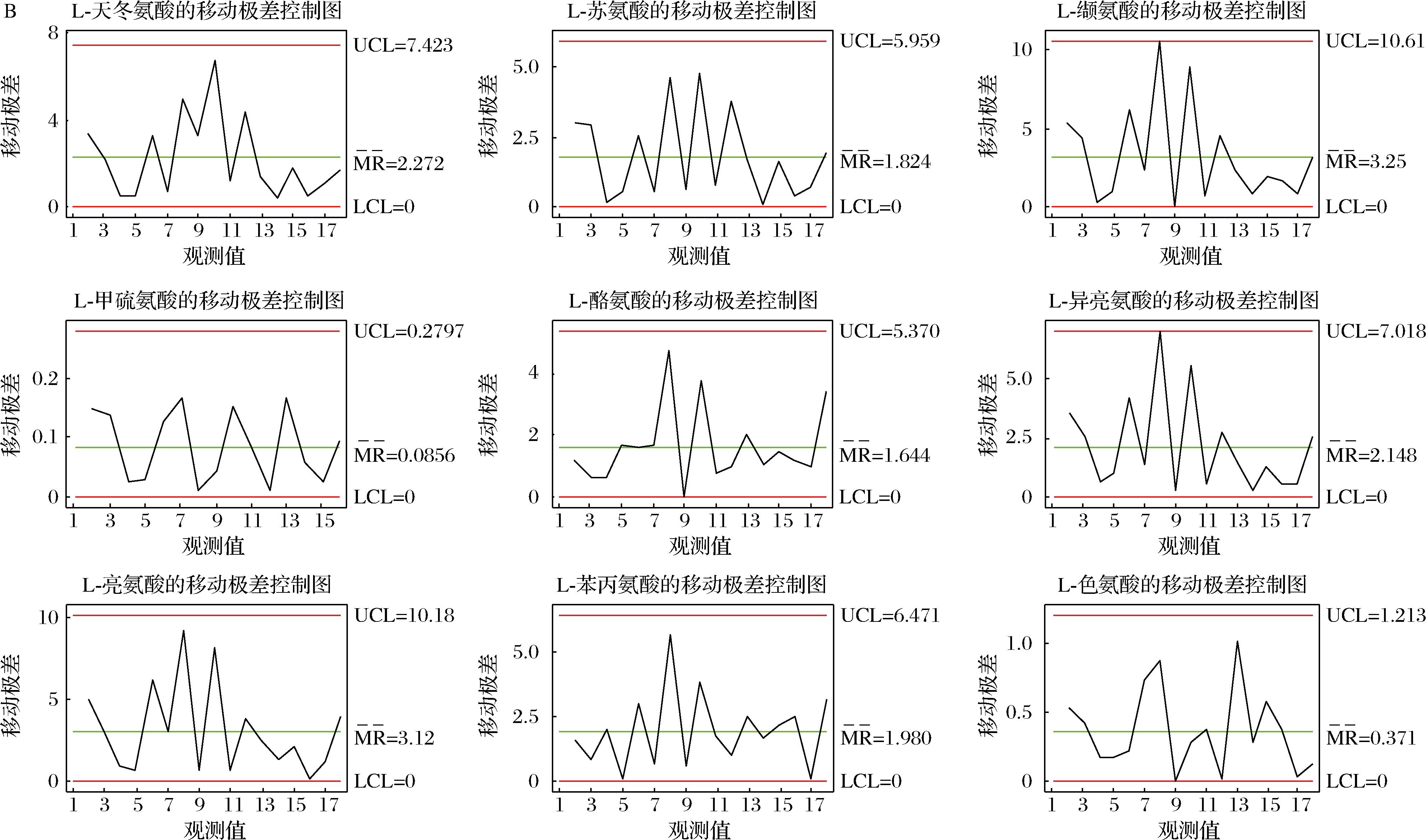
A-单值控制图;B-移动极差控制图
附图6 “拆曲”高温大曲样品中各氨基酸单值控制图和移动极差控制图
Fig.6 Single value control diagram and moving range control diagram of each amino acid in high-temperature Daqu under “tear down” phase