GB 2758—2012《食品安全国家标准 发酵酒及其配制酒》中规定啤酒中甲醛含量为≤2 mg/L,但尚未出台蒸馏酒中甲醛含量的测定方法和明确限量标准。2006年甲醛被世界卫生组织旗下的国际癌症机构列为第1类致癌物,即对人体有明确致癌作用的物质,长期暴露可对人体造成损伤[1-2]。目前,白酒中甲醛含量的测定除气相色谱法、高效液相色谱法及气相色谱-质谱仪法等外,多参照GB/T 5009.49—2008《发酵酒及其配制酒卫生标准的分析方法》中乙酰丙酮法,相较而言,分光光度法运行成本低,简单易操作,更受中、小酒企的青睐。但有学者发现白酒若同啤酒等经蒸馏处理后甲醛的损耗较大,使得检测结果偏低,故多在此方法上进行优化[3-4]。直接法和稀释法测定白酒中甲醛的含量不经蒸馏,避免了处理过程中的损失,且操作简单、快捷。其中直接法以纯酒样为对象进行测定,避免了稀释液对结果的影响,但对于高含量甲醛的酒样,测定结果不稳定且重现性不佳。而稀释法不仅可以拓宽检测的线性范围,也能弥补直接法的不足。故本文以稀释法为主,研究测定过程中取样体积、显色剂用量、体系pH、稀释液的种类及显色条件及其他醛类等对甲醛含量的影响,并追踪白酒中的甲醛含量,旨在为白酒中甲醛含量的测定和变化规律的研究提供一定的参考依据。
1 材料与方法
1.1 材料与试剂
酒样均为浓香型白酒。
甲醛溶液(质量分数为37%)、乙酰丙酮、冰乙酸、无水乙醇、浓硫酸、碘、碘化钾、氢氧化钠、硫代硫酸钠、可溶性淀粉等,国药集团化学试剂有限公司;乙酸铵,上海麦克林生化科技股份有限公司,所有试剂均为分析纯。
1.2 仪器与设备
TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;S400-B pH计,梅特勒-托利多国际贸易(上海)有限公司;HH-8数显恒温水浴锅,常州无有实验仪器有限公司。
1.3 实验方法
1.3.1 甲醛标准溶液的配制及标定
甲醛标准溶液的配制及标定均参照GB/T 5009.49—2008《发酵酒及其配制酒卫生标准的分析》,标定后得甲醛标准溶液的浓度为10.008 mg/mL,此为甲醛标准溶液贮备液,用以用水稀释配制甲醛标准使用液。
1.3.2 标准曲线的绘制
甲醛标准使用液的质量浓度为5.004 mg/L,标准曲线的绘制如表1所示。得标准曲线方程y=0.248 8x+0.037 3,R2=0.999 5,表明甲醛质量浓度为0~2.085 mg/L,线性关系良好。
表1 标准曲线的绘制
Table 1 The drawing of standard curves
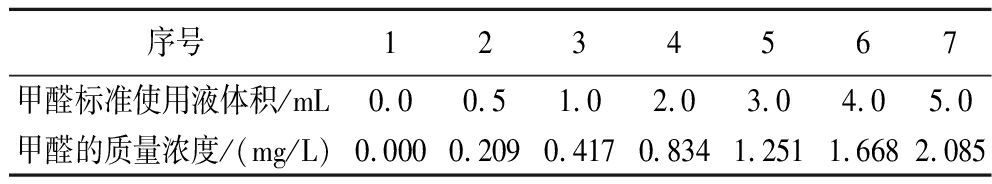
序号1234567甲醛标准使用液体积/mL0.00.51.02.03.04.05.0甲醛的质量浓度/(mg/L)0.0000.2090.4170.8341.2511.6682.085
1.3.3 酒样中甲醛含量的测定方法
甲醛含量的测定方法参照GB/T 5009.49—2008《发酵酒及其配制酒卫生标准的分析》并略有调整。取一定体积的酒样于10 mL比色管中,用稀释液定容至刻度线,加一定量的显色液,混匀后置于恒温水浴锅中显色,待冷却后于415 nm处测定吸光值,并对测定结果进行分析。
只改变单一因素,其他条件不变,依次研究取样体积、显色剂用量、稀释液的种类、体系pH、显色条件及其他醛类物质对测定结果的影响,并通过重现性和加标回收率对方法进行验证。
1.3.4 成品酒中甲醛含量的变化规律
选取不同酒度、不同产品系列、不同档次的20个酒样,贮存于阴凉的环境下,不定期取样测定酒样中甲醛的含量,每个酒样均测定3个时间点,并对测试结果进行分析。
1.4 数据处理
试验结果以3次测定结果的平均值表示,利用SPSS 22.0进行(P<0.05和P<0.01)显著性分析,用Origin 2017进行作图分析。
2 结果与分析
2.1 样品前处理过程对甲醛含量的影响
样品处理过程中可对酒样中的甲醛浓度产生影响的因素主要有取样体积、稀释液的种类、显色剂用量和反应体系pH。图1为处理过程中各因素对酒样中甲醛含量测定的影响结果。
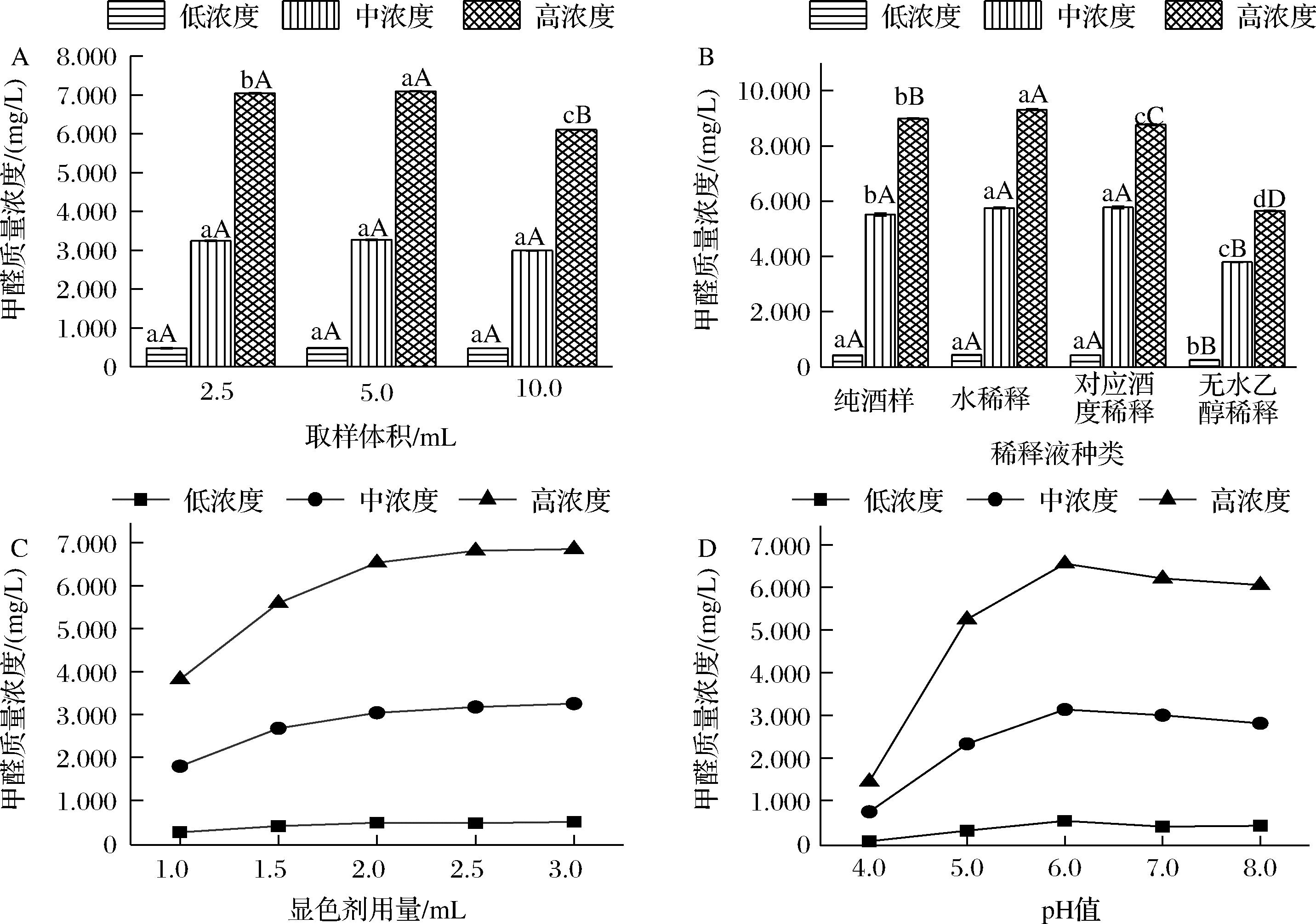
A-取样体积;B-稀释液种类;C-显色剂用量;D-反应体系pH
图1 样品前处理过程中各因素对甲醛浓度的影响
Fig.1 The influence of various factors on formaldehyde concentration during sample preparation
注:图中小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01)(下同)。
以纯酒样(取样体积10 mL)中的甲醛含量为参比,由图1-A可知,低、中浓度纯酒样中的甲醛含量分别为0.48 mg/L和3.24 mg/L,取样体积2.5 mL和5.0 mL稀释后的测定结果与纯酒样的结果相近,无显著性差异;同条件下,高浓度纯酒样中的甲醛含量为6.11 mg/L,取样体积为2.5 mL和5.0 mL稀释后的测定结果分别是7.05 mg/L和7.10 mg/L,二者无显著性差异,但较纯酒样增加约13.63%,其原因可能是10 mL酒样中甲醛的含量相对较高,反应不彻底所致,故延长纯酒样的反应时间至40 min,其结果为6.95 mg/L,与稀释后的结果相近。
稀释液的种类常用蒸馏水、与酒样同酒度的乙醇溶液和无水乙醇。由图1-B可知,以纯酒样中的甲醛含量为对比,当甲醛含量为0.42 mg/L时,取样体积2.5 mL经水和与其同酒度的乙醇溶液稀释,稀释前后的甲醛含量几乎一致;当甲醛含量为5.52 mg/L时,取样体积2.5 mL经水和与其同酒度的乙醇溶液稀释,稀释后的结果分别为5.76 mg/L和5.77 mg/L,相对标准偏差分别是4.15%和4.48%;当甲醛含量为8.99 mg/L时,取样体积2.5 mL经水和与其同酒度的乙醇溶液稀释后的结果分别为9.31 mg/L和8.78 mg/L,相对标准偏差分别是3.51%和2.47%。以无水乙醇作为稀释液时,3个浓度的酒样其甲醛含量均有所下降,约降低31.23%~39.33%,猜测可能与反应体系中的乙醇浓度有关。故以水稀释后酒样中的甲醛浓度为对照,用不同浓度的乙醇溶液为稀释液进行验证,验证结果如图2所示。甲醛的浓度随稀释液中乙醇含量的增加,其结果均有所下降。其中稀释液的乙醇浓度在42%vol~52%vol,甲醛的浓度略有变化,但无显著性差异,乙醇浓度≥58%vol时下降较为显著,约下降了9.42%~11.74%。此外,同温度下酒样经水稀释比乙醇溶液稀释,反应的颜色更快更明显,查阅相关文献知酒样中甲醛与乙酰丙酮反应的温度多高于水中甲醛的测定温度,这可能是因为白酒中醛类物质可与其他化合物(如醇类)缩合生成结合态醛,从而使得反应滞缓,故需要更高的反应温度或较长的反应时间。1,1-二乙氧基甲烷是甲醛和乙醇的缩合物,在一定条件下又可转化成游离醛,刚蒸馏出的原酒中不含1,1-二乙氧基甲烷,而大多年份酒中1,1-二乙氧基甲烷的浓度随贮存时间有所增加,1,1-二乙氧基甲烷在葡萄酒、朗姆酒等酒中均有检出[5-9]。
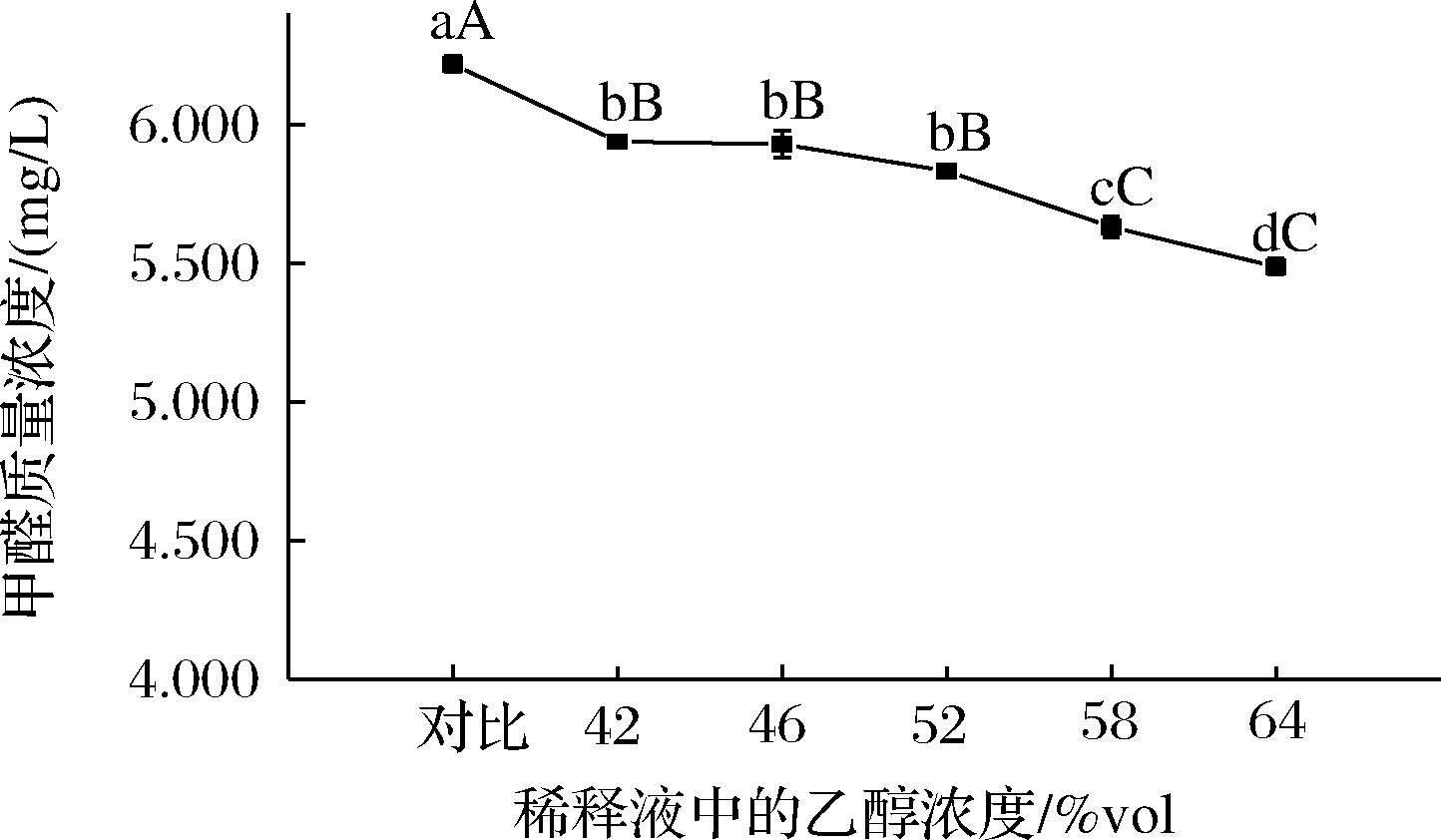
图2 稀释液中的乙醇浓度对甲醛浓度的影响
Fig.2 Effect of alcohol content of diluent on formaldehyde concentration
图1-C为显色剂的用量对甲醛含量的影响。由图可知,显色剂用量在1.0~2.0 mL,甲醛浓度的测定结果与显色剂用量呈正相关,甲醛浓度越高增幅越明显;当显色剂用量在2.0~2.5 mL时,浓度略有所增加,但增幅较为平缓;当显色剂用量在2.5~3.0 mL范围内时,3个浓度的酒样中甲醛浓度结果趋于稳定,测定结果的相对标准偏差(relative standard deviation,RSD)分别为5.57%、2.36%和0.60%。其中当酒样中的甲醛含量为0.53 mg/L,显色剂用量2.0 mL时反应完全;当酒样中的甲醛含量为3.29 mg/L和6.89 mg/L时,显色剂用量2.5 mL时显色完全。此外发现,同浓度的甲醛标准液和酒样,同等条件下酒样需要更长的显色时间才能反应完全,猜测与酒样中复杂的体系成分有关。白酒经纯粮固态多菌种发酵,体系成分达上百种且彼此影响,而标准液是由水逐级稀释,体系单一。
图1-D为反应体系pH值对甲醛含量的影响。反应体系pH对酒样中甲醛含量测定的影响较大,且与酒样中甲醛含量的大小无关,3个浓度的酒样测定条件均在pH=6时最佳,这与该反应的原理是吻合的[10]。
2.2 其他醛类物质对甲醛含量的影响
有机物若具有相同的官能团,其化学性质也多相似。白酒中除甲醛外,还有乙醛、乙缩醛、糠醛和苯甲醛等醛类物质,由于酒样中糠醛和苯甲醛等含量极低,故根据酒样中乙醛和乙缩醛的含量分布,人为添加3个浓度级别的乙醛和乙缩醛来探究其他醛类物质的存在对甲醛浓度的测定的影响,结果如表2所示。原酒样中甲醛的含量为(4.844±0.057 5) mg/L,人为添加乙醛和乙缩醛后甲醛含量均略有增加,与汪咏曾等[11]研究结果一致,但由于其他醛类物质造成的结果相对偏差在0.785%~6.245%,影响较小,说明该方法的选择性佳。
表2 其他醛类物质对甲醛浓度的影响
Table 2 Effect of other aldehydes on formaldehyde concentration

指标乙醛添加水平乙缩醛添加水平123123质量浓度/(mg/100 mL)204060102030甲醛含量/(mg/L)4.990±0.031 5abA5.050±0.009 5abA5.146±0.048 0bA4.882±0.081 3aA4.990±0.125 5aA4.932±0.099 0aA相对偏差/%3.0144.2536.2450.7853.0141.827
注:小写字母不同表示差异显著(P<0.05),大写字母不同表示差异极显著(P<0.01)(下同)。
2.3 反应条件对甲醛含量的影响
在测定过程中发现,酒样与乙酰丙酮溶液在室温下即可发生不同程度的显色反应,但反应不彻底,需通过加热使反应更完全。图3为反应条件对甲醛浓度测定的影响。由图3-A可知,当酒样中的甲醛含量为0.45 mg/L时,在60 ℃恒温水浴反应15 min时即显色完全;当酒样中的甲醛含量为6.00 mg/L时,在80 ℃恒温水浴反应15 min时显色趋于稳定;而当酒样中的甲醛含量为9.16 mg/L时,则需更高的温度才可反应完全。为使反应彻底,后续实验在96 ℃下进行。
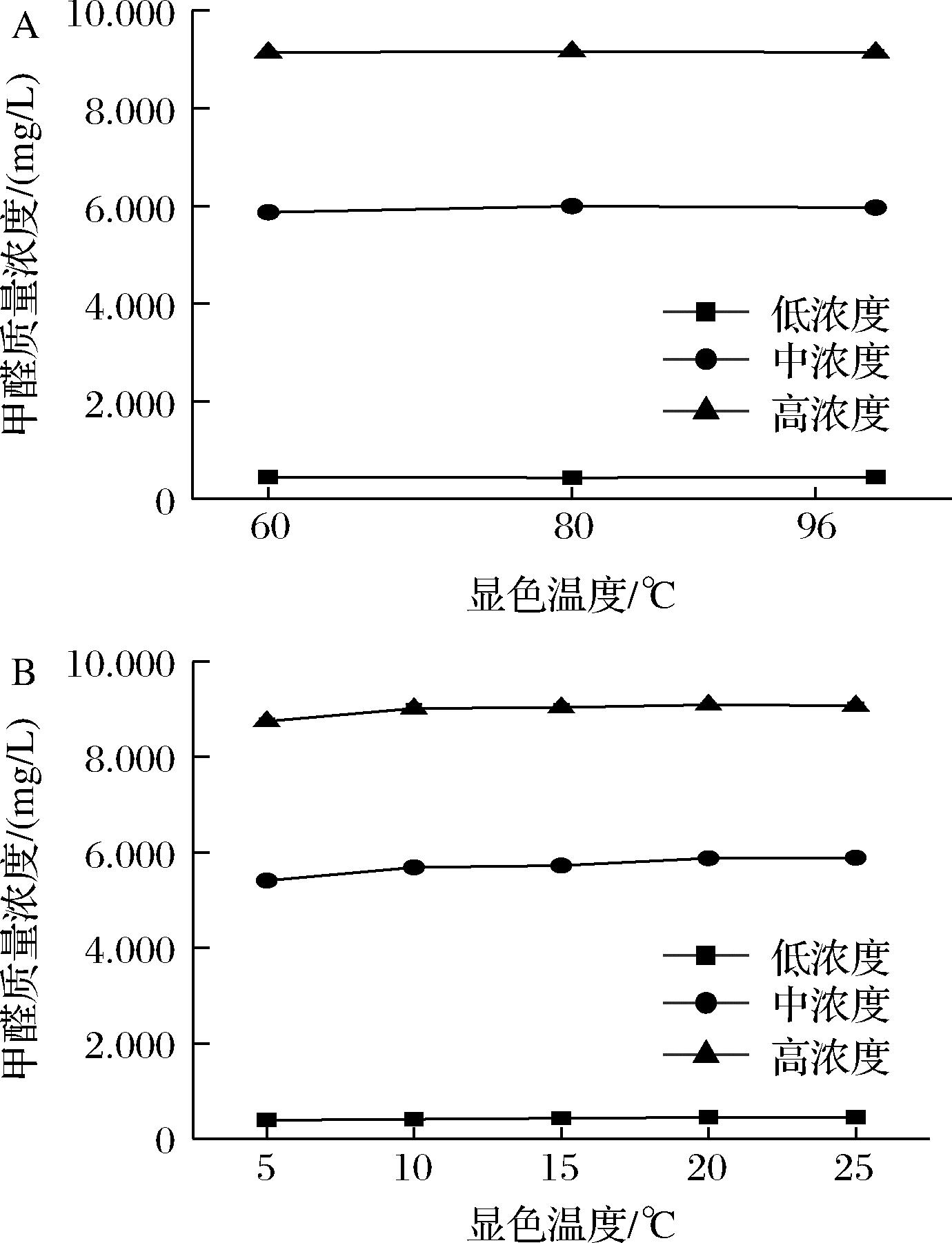
A-显色温度;B-显色时间
图3 反应条件对甲醛浓度的影响
Fig.3 Effect of reaction condition on formaldehyde concentration
图3-B为显色时间对甲醛浓度测定的影响。由图可知,甲醛的浓度与显色时间呈正比。当酒样中的甲醛含量为0.45 mg/L时,显色10 min时已趋于稳定,当酒样中的甲醛含量在6.00~9.16 mg/L时,需20 min时显色更为彻底。其次,反应条件也与同批次测定的样品数量有关,若样品数量多,则可将样品分布在多个盛有热水的玻璃烧杯中(玻璃烧杯的导热性要优于塑料烧杯),每个烧杯中样品数量≤10,置于恒温水浴锅反应,以免受热不均致反应进行不彻底,从而使得检测结果偏低或平行性不佳。
2.4 方法学验证
基于对稀释法测定白酒中甲醛含量的影响因素的考察,确定实验条件为:取样体积2.5 mL、水为稀释液、显色剂用量2.5 mL,96 ℃恒温水浴中显色20 min,通过检出限、定量限、重现性和加标回收率对该方法进行验证。
2.4.1 方法检出限和定量限[12]
采用响应的标准偏差和斜率确定方法的检出限和定量限,检出限和定量限的计算公式如公式(1)、公式(2)所示。其中σ为空白响应的标准偏差;m为校正曲线的斜率。
检出限![]()
(1)
定量限![]()
(2)
由表3中空白溶液的响应值,计算得空白溶液的吸光度标准偏差 σ=0.000 534 5。根据表1数据进行曲线拟合,得吸光度与浓度的线性关系为:y=0.248 8x+0.037 3,R2=0.999 5。故校正曲线的斜率m为0.248 8,根据公式计算得检出限值为0.007 088 702 mg/L,定量限值为0.021 480 914 mg/L。
表3 空白溶液的响应值
Table 3 Response values of the blank solution
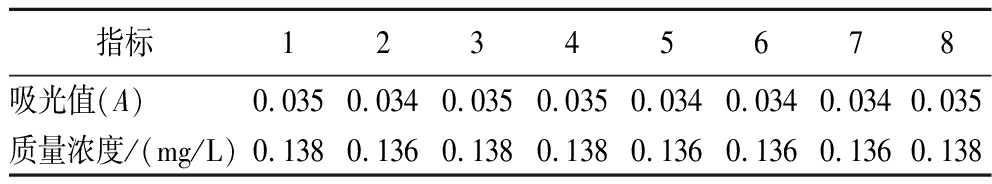
指标12345678吸光值(A)0.0350.0340.0350.0350.0340.0340.0340.035质量浓度/(mg/L)0.138 0.136 0.1380.1380.136 0.136 0.136 0.138
注:空白溶液的浓度是通过朗伯比尔定律A=εbc和表1数据计算出摩尔吸收系数ε平均值为7.643×104 L/(mol·cm)后得出。
2.4.2 方法重现性
3个浓度级别的酒样独立重复8次,计算RSD,结果如表4所示,低、中、高3个浓度级别的RSD分别是3.074%、2.391%和1.492%,RSD值越低则重现性越佳。
表4 重现性实验结果 单位:mg/L
Table 4 Results of reproducibility experiment
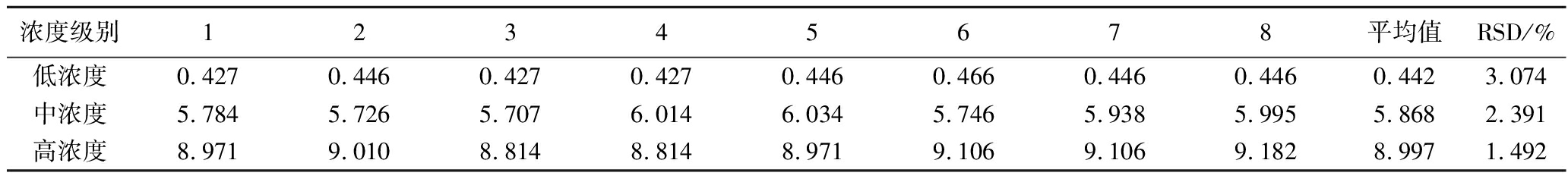
浓度级别12345678平均值RSD/%低浓度0.4270.4460.4270.4270.4460.4660.4460.4460.4423.074中浓度5.7845.7265.7076.0146.0345.7465.9385.9955.8682.391高浓度8.9719.0108.8148.8148.9719.1069.1069.1828.9971.492
2.4.3 方法回收率
由于低浓度酒样中甲醛的质量浓度较低,为0.44 mg/L,故以基底100%添加标准,中高浓度的酒样较高,以基底的10%添加标准。由表5可知,低、中、高3个浓度级别的加标回收率分别为114.76%、114.91%和97.89%,表明该方法准确度高,可以适用于白酒中甲醛含量的测定。
表5 样品的回收率
Table 5 The recovery rates of the samples
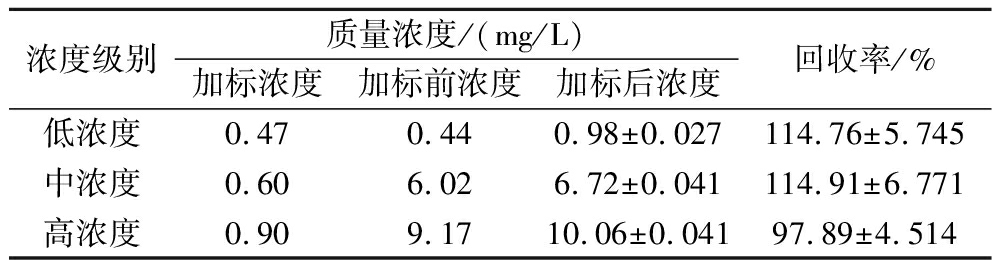
浓度级别质量浓度/(mg/L)加标浓度加标前浓度加标后浓度回收率/%低浓度0.470.440.98±0.027114.76±5.745中浓度0.606.026.72±0.041114.91±6.771高浓度0.909.1710.06±0.04197.89±4.514
综上所述,通过对方法的线性曲线、检出限、定量限、重现性及回收率的考察,说明该方法可用于白酒中甲醛浓度的测定。
2.5 白酒中甲醛浓度的变化规律
随机对20个市售浓香型白酒产品中的甲醛的浓度进行追踪,每个酒样各追踪3个时间点,贮存时间初始值以出厂日期计(表6)。
表6 浓香型白酒中甲醛浓度的变化
Table 6 The changes of formaldehyde concentration in Nong-flavor Baijiu
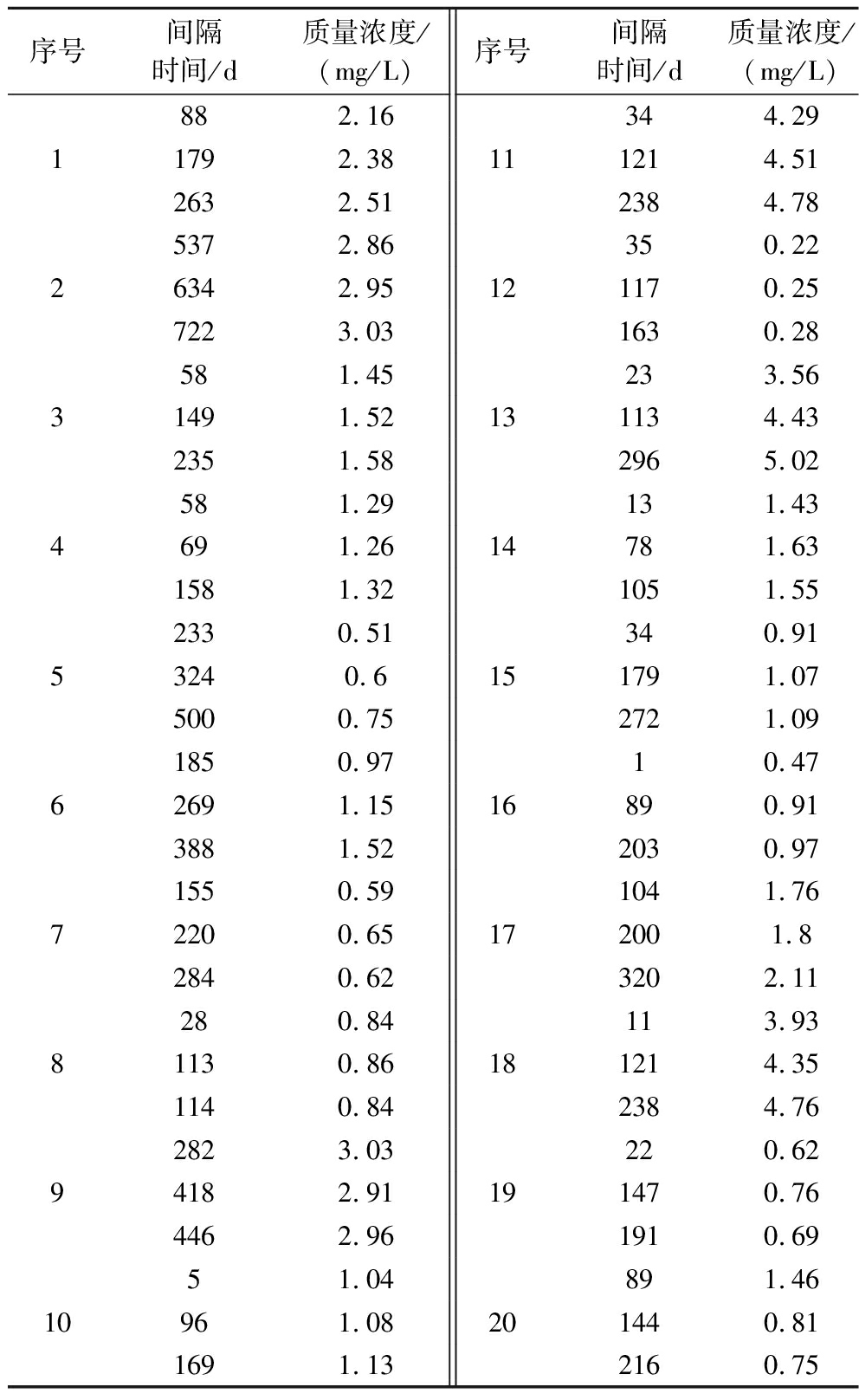
序号间隔时间/d质量浓度/(mg/L)序号间隔时间/d质量浓度/(mg/L)882.16344.2911792.38111214.512632.512384.785372.86350.2226342.95121170.257223.031630.28581.45233.5631491.52131134.432351.582965.02581.29131.434691.2614781.631581.321051.552330.51340.9153240.6151791.075000.752721.091850.9710.4762691.1516890.913881.522030.971550.591041.7672200.65172001.82840.623202.11280.84113.9381130.86181214.351140.842384.762823.03220.6294182.91191470.764462.961910.6951.04891.4610961.08201440.811691.132160.75
由表6可知,各产品中甲醛的浓度随贮存时间的延长均有所增加(20号产品除外),整体呈贮存前期增幅大,中期增幅较平缓,后期基本趋于稳定,但各个产品的变化增幅不同,猜测与每个产品中的酒体成分的种类和含量等有关;此外每个产品达到甲醛浓度稳定的时间也大不同,少则约1~2个月即可趋于稳定,多则长达2~3年,且在实验
探究中发现启封后的酒样比贮酒罐体中酒样,甲醛的浓度增幅更为明显,这可能跟启封后酒样与氧气接触、放置的环境等条件有关。
“掐头去尾”是纯粮固态法白酒酿造过程中必不可少的环节。由于甲醛的沸点低、易挥发且具有醇溶性,该工艺能可有效控制白酒中甲醛的浓度,故经测定新蒸原酒中几乎不含甲醛。但原酒到成品酒需经过很多道工序,经历很长时间。朱梦旭等[13]研究不同年份产原酒中甲醛的变化,发现生产年份较早的原酒中甲醛浓度高于生产年份较晚的原酒(2012年产原酒甲醛质量浓度为0.66 mg/L,1984年原酒高达4.03 mg/L),推测是贮存过程中甲醇被非酶氧化生成甲醛,这与PANOSYAN等[14]发现白兰地中甲醇浓度与贮存时间成反比吻合。为深入探究白酒中甲醛的变化规律以便更好的控制甲醛含量,后续可同时监测酒样中的甲醛、甲醇和1,1-二乙氧基甲烷等。
3 结论与讨论
分光光度法测定白酒中的甲醛含量,其主要因素在于酒样中的甲醛含量,可根据甲醛的含量适当改变取样体积、反应时间和温度,使得反应更为彻底;需要稀释时,以蒸馏水或低浓度乙醇溶液为佳。新蒸原酒中几乎不含甲醛,但成品中不仅含有甲醛,且其含量随时间的推移逐渐增加,整体呈现“前涨中缓后稳定”的趋势,稳定时间少则数月,多则2~3年。但目前对酒体中甲醛的生成或转化途径、变化规律及控制措施等鲜有报道,后续可围绕这些方面进行深入的探究。
[1] 蔡晓辉, 林青. 甲醛的污染现状及其生殖发育毒性[C]. 中华医学会全国计划生育学学术会议. 中华医学会, 2014. CAI X H, LIN Q. Contamination status of formaldehyde and its reproductive and developmental toxicity[C]. National Academic Conference on Family Planning of Chinese Medical Association. National Medical Association of China, 2014.
[2] GOLDEN R. Identifying an indoor air exposure limit for formaldehyde considering both irritation and cancer hazards[J]. Critical Reviews in Toxicology, 2011, 41(8):672-721.
[3] 胡杨, 李先芝, 刘洋, 等. HPLC法测定市售白酒中的甲醛含量[J]. 酿酒科技, 2021(8):114-117. HU Y, LI X Z, LIU Y, et al. Determination of formaldehyde content in Baijiu by HPLC[J]. Liquor-Making Science &Technology, 2021(8):114-117.
[4] 黄静, 章发盛. 两种前处理方法检测白酒中甲醛含量的比较[J]. 农业与技术, 2021, 41(6):22-24. HUANG J, ZHANG F S. Comparison of two pretreatment methods for detecting formaldehyde content in liquor[J]. Agriculture and Technology, 2021, 41(6):22-24.
[5] 朱梦旭. 白酒中易挥发的有毒有害小分子醛及其结合态化合物研究[D]. 无锡: 江南大学, 2016. ZHU M X. Volatile, Toxic and small molecular aldehydes and their derivatives in Chinese liquor[D]. Wuxi: Jiangnan University, 2016.
[6] PERESTRELO R, BARROS A S, C MARA J S, et al. In-depth search focused on furans, lactones, volatile phenols, and acetals as potential age markers of Madeira wines by comprehensive two-dimensional gas chromatography with time-of-flight mass spectrometry combined with solid phase microextraction[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7):3186-3204.
MARA J S, et al. In-depth search focused on furans, lactones, volatile phenols, and acetals as potential age markers of Madeira wines by comprehensive two-dimensional gas chromatography with time-of-flight mass spectrometry combined with solid phase microextraction[J]. Journal of Agricultural and Food Chemistry, 2011, 59(7):3186-3204.
[7] TAIRA J, TSUCHIYA A, FURUDATE H. Initial volatile aroma profiles of young and aged awamori shochu determined by GC/MS/pulsed FPD[J]. Food Science and Technology Research, 2012, 18(2):177-181.
[8] PINO J A, TOLLE S, GÖK R, et al. Characterisation of odour-active compounds in aged rum[J]. Food Chemistry, 2012, 132(3):1436-1441.
[9] SAVCHUK S A, KOLESOV G M. Chromatographic techniques in the quality control of cognacs and cognac spirits[J]. Journal of Analytical Chemistry, 2005, 60(8):752-771.
[10] 徐馨. 乙酰丙酮法测定甲醛含量的影响因素研究[J]. 广州化工, 2021, 49(6):87-89; 102. XU X. Study on influencing factors of determination of formaldehyde content by acetylacetone spectrophotometry[J]. Guangzhou Chemical Industry, 2021, 49(6):87-89; 102.
[11] 汪咏曾, 祝胡仙, 朱教胜. 酒类产品中甲醛检测方法(紫外分光法)研究与改进[J]. 农产品加工, 2022(10):79-81. WANG Y Z, ZHU H X, ZHU J S. Research and improvement of detection method of formaldehyde in alcohol products (UV spectrophotometry)[J]. Farm Products Processing, 2022(10):79-81.
[12] 刘卓钦, 郭仁宏. 分光光度法测定生活用纸中的乙二醛残留量[J]. 造纸科学与技术, 2016, 35(4):35-39. LIU Z Q, GUO R H. Determination of the glyoxal residue in tissue products by spectrophotometry[J]. Paper Science &Technology, 2016, 35(4):35-39.
[13] 朱梦旭, 范文来, 徐岩. 我国白酒蒸馏过程以及不同年份产原酒和成品酒中甲醛的研究[J]. 食品与发酵工业, 2015, 41(9):153-158. ZHU M X, FAN W L, XU Y. Characterization of formaldehyde from distillation cut, raw liquor of different vintage, and finished Chinese liquor[J]. Food and Fermentation Industries, 2015, 41(9):153-158.
[14] PANOSYAN A G, MAMIKONYAN G V, TOROSYAN M, et al. Determination of the composition of volatiles in cognac (brandy) by headspace gas chromatography-mass spectrometry[J]. Journal of Analytical Chemistry, 2001, 56(10):945-952.