小麦淀粉是小麦(Triticum aestivum L.)籽粒的主要组成成分(65%~75%,以干重计)[1]。传统上,小麦淀粉的生产主要通过马丁法或巴特面糊法;近年来,逐步发展了阿尔法拉伐/瑞休工艺、面团-面糊工艺(旋流器法)和高压碎解工艺(三相卧螺离心机法),生产效率和淀粉品质均得到大幅提高[2]。小麦淀粉在粒度上呈典型的双峰分布,即大颗粒(23~28 μm)小麦A淀粉,呈圆盘状或透镜状;小颗粒(2~11 μm)小麦B淀粉,呈球状或不规则形状[3]。小麦淀粉是人类主要能量来源,被用于生产各种食品,还具有广泛的工业用途和较高的商业价值[4]。小麦淀粉是馒头、面条、意大利面食的主要成分,同时被用于面包、馅饼、蛋糕等烘焙产品。小麦淀粉颜色亮白,几乎不含色素,蛋白质、灰分和纤维含量低,在我国,小麦淀粉作为配料还广泛用于水晶饺子皮、凉皮、鱼糜制品、香肠、预拌粉等产品。
尽管天然小麦淀粉丰富且价格便宜,但功能特性的有限性阻碍了其更为广泛的用途。当前对小麦淀粉的改良主要包括遗传学、物理学、化学、酶学等手段。通过遗传学手段可得到高直链小麦淀粉或蜡质小麦淀粉[5],新型淀粉为实现相关制品美味和营养间的平衡提供了原料支持。除了广泛采取的化学改性外,过热蒸汽、湿热、退火、球磨等物理法也频繁用于小麦淀粉改性。在小麦制品生产中,经常对面团等中间产品进行发酵处理,研究发现发酵改善面团性能的一部分原因是对小麦淀粉结构和性能也产生了影响[6]。同样,酶处理通过改变小麦淀粉的组成结构,进而改善小麦淀粉的加工性能。
近年来,酶法用于小麦淀粉改性受到重视。酶法改性采用食品酶制剂,不引入化学成分,符合“清洁标签”理念[7]。酶制剂可直接作为配料加入。例如在面包生产中,淀粉酶直接作用于淀粉颗粒,可实现对小麦淀粉的原位改性[8]。酶法改性具有绿色环保、作用条件温和等优点,在改性的同时可保留淀粉颗粒形态[9-10]。酶可以针对性作用于淀粉颗粒的特定部位,相比于化学改性更具有选择性,例如酶法用于多孔淀粉的生产[11]。当前,淀粉酶制剂在烘焙工业[12]的应用十分普遍,基于此,本文围绕小麦淀粉酶法改性的研究进展,系统论述了小麦淀粉的酶法改性所用的酶类、改性方式,以及酶处理对小麦淀粉的组成结构、理化性质和小麦淀粉制品品质的影响,以期为促进酶改性小麦淀粉的食品工业应用提供参考。
1 改性淀粉用酶
如表1所示,淀粉的酶法改性通常采用的酶包括糖基转移酶(EC 2.4.x.y)和糖基水解酶(EC 3.2.1.x)两类[13]。糖基转移酶能够催化糖基从一种糖苷(供体)转移到另一种糖苷(受体),并形成新的糖苷键[13]。目前,用于小麦淀粉改性的糖基转移酶主要包括转葡萄糖苷酶、淀粉分支酶和麦芽糖转糖基酶。糖基水解酶是催化糖苷键水解的酶。用于小麦淀粉改性的糖基水解酶目前主要包括α-淀粉酶、β-淀粉酶、麦芽糖α-淀粉酶、普鲁兰酶、葡萄糖淀粉酶、产麦芽六糖α-淀粉酶、产麦芽四糖α-淀粉酶和α-葡萄糖苷酶等。
表1 小麦淀粉改性使用的酶
Table 1 Enzymes used in wheat starch modification
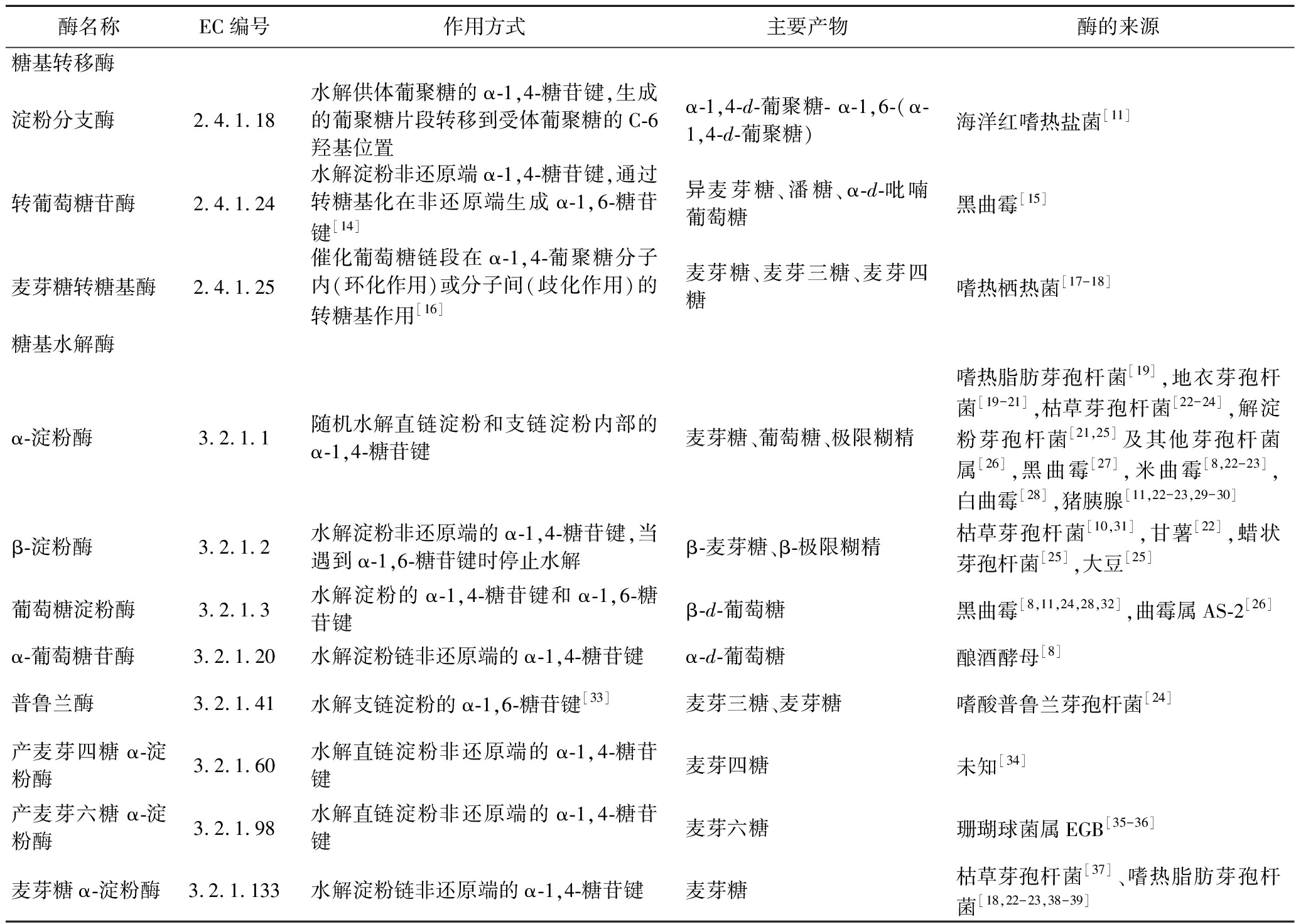
酶名称EC编号作用方式主要产物酶的来源糖基转移酶淀粉分支酶2.4.1.18水解供体葡聚糖的α-1,4-糖苷键,生成的葡聚糖片段转移到受体葡聚糖的C-6羟基位置α-1,4-d-葡聚糖- α-1,6-(α-1,4-d-葡聚糖)海洋红嗜热盐菌[11]转葡萄糖苷酶2.4.1.24水解淀粉非还原端α-1,4-糖苷键,通过转糖基化在非还原端生成α-1,6-糖苷键[14]异麦芽糖、潘糖、α-d-吡喃葡萄糖黑曲霉[15]麦芽糖转糖基酶2.4.1.25催化葡萄糖链段在α-1,4-葡聚糖分子内(环化作用)或分子间(歧化作用)的转糖基作用[16]麦芽糖、麦芽三糖、麦芽四糖嗜热栖热菌[17-18]糖基水解酶α-淀粉酶3.2.1.1随机水解直链淀粉和支链淀粉内部的α-1,4-糖苷键麦芽糖、葡萄糖、极限糊精嗜热脂肪芽孢杆菌[19],地衣芽孢杆菌[19-21],枯草芽孢杆菌[22-24],解淀粉芽孢杆菌[21,25]及其他芽孢杆菌属[26],黑曲霉[27],米曲霉[8,22-23],白曲霉[28],猪胰腺[11,22-23,29-30]β-淀粉酶3.2.1.2水解淀粉非还原端的α-1,4-糖苷键,当遇到α-1,6-糖苷键时停止水解β-麦芽糖、β-极限糊精枯草芽孢杆菌[10,31],甘薯[22],蜡状芽孢杆菌[25],大豆[25]葡萄糖淀粉酶3.2.1.3水解淀粉的α-1,4-糖苷键和α-1,6-糖苷键β-d-葡萄糖黑曲霉[8,11,24,28,32],曲霉属AS-2[26]α-葡萄糖苷酶3.2.1.20水解淀粉链非还原端的α-1,4-糖苷键α-d-葡萄糖酿酒酵母[8]普鲁兰酶3.2.1.41水解支链淀粉的α-1,6-糖苷键[33]麦芽三糖、麦芽糖嗜酸普鲁兰芽孢杆菌[24]产麦芽四糖α-淀粉酶3.2.1.60水解直链淀粉非还原端的α-1,4-糖苷键麦芽四糖未知[34]产麦芽六糖α-淀粉酶3.2.1.98水解直链淀粉非还原端的α-1,4-糖苷键麦芽六糖珊瑚球菌属EGB[35-36]麦芽糖α-淀粉酶3.2.1.133水解淀粉链非还原端的α-1,4-糖苷键麦芽糖枯草芽孢杆菌[37]、嗜热脂肪芽孢杆菌[18,22-23,38-39]
2 酶改性方式
酶法改性小麦淀粉在操作上主要有3种方式:单一酶法、复合酶法以及酶法与其他方法结合。酶作用时的淀粉形态可以是天然淀粉颗粒,也可以是糊化淀粉。对于天然淀粉颗粒,制备淀粉悬液后在水浴中升温到酶作用温度,加入一定量的酶制剂,保温反应一定时间后终止反应[37]。对于糊化淀粉,首先将淀粉制备成一定质量分数的淀粉悬液,升温搅拌使其糊化,然后降温到酶作用的温度条件进行酶反应,反应结束后灭酶[15]。张国权等[40]采用双酶法生产小麦微孔淀粉,研究表明,α-淀粉酶和糖化酶在制备小麦微孔淀粉过程中可发挥协同作用,使水解效率提高。研究还发现,酶反应的顺序或加酶顺序对产物的结构和性能具有显著影响[11,41]。GUO等[11]分别采取α-淀粉酶→葡萄糖淀粉酶、分支酶→葡萄糖淀粉酶、α-淀粉酶→分支酶→葡萄糖淀粉酶等组合方式处理小麦淀粉,产物中直链淀粉含量分别降低12.66%、5.44%和48.33%,不同处理方式得到的多孔小麦淀粉具有不同的孔道结构和吸附性能。
为提升酶改性效果,通常采用酶处理与辅助手段联合的方式。MAJZOOBI等[42]研究发现,先进行酶处理(α-淀粉酶添加量0.4%,45 ℃反应24 h)再超声波处理(35 kHz、240 W、40 min)的小麦淀粉具有最佳的水合能力、持油性和吸附性能。SHEN等[20]将小麦淀粉采用α-淀粉酶处理后采用介质阻挡放电等离子体(40 V、1 A)处理,结果表明等离子体处理降低了直链淀粉含量,加剧了支链淀粉长侧链的解聚和结晶度下降;酶处理使小麦淀粉中抗性淀粉含量从7.09%增加到11.69%,而后续的等离子体处理使其含量增加到16.20%。陈彩雯等[43]研究发现小麦淀粉经加酶挤压后的糊化焓值、水合能力高于挤压淀粉,而相对结晶度、淀粉糊粘度低于挤压淀粉。
3 酶法改性对小麦淀粉组成结构的影响
3.1 直链淀粉含量
直链淀粉是决定淀粉性能及淀粉制品品质的重要因素之一。不同酶对该指标的影响存在差异。首先, 小麦淀粉颗粒经水解酶处理通常会降低直链淀粉含量。α-淀粉酶优先水解无定形区中直链淀粉的α-1,4-糖苷键,随着酶添加量增加,直链淀粉含量下降程度增大[20]。UTHUMPORN等[28]采用兼具α-淀粉酶和葡萄糖淀粉酶活性的复合酶制剂STARGEN 001作用小麦淀粉颗粒得到酶解淀粉,直链淀粉含量从原来的23.8%降低到18.5%。CHENG等[10]报道β-淀粉酶处理造成小麦淀粉的直链淀粉含量下降(21.20%→18.67%)。熊柳等[44]报道β-淀粉酶处理(34.33 U,56.5 ℃,32.2 min)可使小麦淀粉的直链淀粉含量从25.40 g/100 g降低到21.80 g/100 g。ZHAI等[37]报道麦芽糖α-淀粉酶处理没有引起小麦淀粉直链淀粉含量显著变化,这可能是由于该酶同时水解了小麦淀粉的直链淀粉和支链淀粉。其次,糊化的小麦淀粉经转移酶作用,其直链淀粉含量增加。LI等[15]报道,小麦淀粉糊化后加入转葡萄糖苷酶,随着酶解进行,表观直链淀粉含量从25.33%逐渐增加到59.00%。转葡萄糖苷酶对1,4-α-葡聚糖具有随机水解能力,可将支链淀粉聚合度(degree of polymerization,DP)≥50的长侧链水解为可以与碘结合的较短链(DP 40~50),在去除外侧链后,碘分子得以与支链淀粉内侧链或/和外侧链结合,从而使表观直链淀粉含量大幅增加。糊化的小麦淀粉经普鲁兰酶处理,其直链淀粉比例增加,这是由于该酶选择性水解支链淀粉的α-1,6-糖苷键,形成线性短链[45]。
3.2 小麦淀粉分子结构
不同酶处理使小麦淀粉的分子结构发生不同程度变化,并反映在分子质量、DP、分支化度、链长分布等方面(表2)。首先,水解酶处理使小麦淀粉分子质量降低,该过程主要涉及α-1,4-糖苷键的水解。α-淀粉酶使小麦支链淀粉重均分子质量(Mw)从1.261×107 g/mol下降到4.12×105 g/mol,直链淀粉Mw从1.20×105 g/mol增加到3.99×105 g/mol,这可能是支链淀粉及中间组分水解导致直链淀粉DP的增加[20]。β-淀粉酶使小麦淀粉的Mw从2.390×106 g/mol降至1.355×106 g/mol[31]。转葡萄糖苷酶使糊化的小麦淀粉的Mw大幅降低(4.12×107 g/mol→1.22×105 g/mol)[15]。其次,转葡萄糖苷酶、分支酶等糖基转移酶作用于小麦淀粉可提高其分支化度,分支化度的变化程度主要与糖基转移酶的种类、酶的作用条件及酶的作用顺序有关。LI等[15]报道,随着转葡萄糖苷酶处理时间的延长(0→20 h),糊化的小麦淀粉在酶的作用下支化度从14.11%增加到17.97%。GUO等[11]报道,α-淀粉酶→葡萄糖淀粉酶未引起支化度的显著变化,而分支酶→葡萄糖淀粉酶、α-淀粉酶→分支酶→葡萄糖淀粉酶处理使小麦淀粉的支化度分别增加21.51%和70.35%,这表明α-淀粉酶对分支酶的转糖基反应可能具有协同效应。第三,酶处理可以影响小麦淀粉的链长分布。KOROMPOKIS等[17]报道,随着麦芽糖转糖基酶添加量的增加(1.8→9 U/g),直链淀粉的色谱峰逐渐消失,支链淀粉的色谱峰右移,这表明该酶通过水解小麦直链淀粉,产生的线性葡聚糖片段经转糖基化作用转移到支链淀粉上,其侧链被延长。支链淀粉的侧链按照DP通常分为A链(DP 6~12)、B1链(DP 13~24)、B2链(DP 25~36)和B3链(DP>36)。SHEN等[20]报道,小麦淀粉颗粒经α-淀粉酶处理,短链(A、B1链)的比例增加,中长侧链(B2和B3链)的比例减小。ZHAI等[37]报道小麦淀粉颗粒经麦芽糖α-淀粉酶处理后,支链淀粉的极短链(DP<6)比例上升,随着加酶量的增加(2.5→15 U/g),B1链和B2链的比例均呈下降趋势。LI等[31]报道小麦淀粉颗粒经β-淀粉酶处理,B1链占比下降,短侧链(DP 2~12)占比提高。类似地,糊化小麦淀粉经β-淀粉酶处理,支链淀粉的平均链长下降[44]。糊化的小麦淀粉经转葡萄糖苷酶处理,支链淀粉的A链占比从21.97%增加到41.17%,B2链和B3链占比大幅下降,平均链长从19.49 DP缩短为16.10 DP[15]。LEMAN等[23]将淀粉酶添加到小麦淀粉悬液中,采用快速黏度分析仪模拟热加工过程酶对淀粉分子的修饰作用,结果表明,添加枯草芽孢杆菌α-淀粉酶(添加量0.17 EU/g)或米曲霉α-淀粉酶(0.780 EU/g)使小麦支链淀粉的链长分布没有发生显著变化,而添加猪胰腺α-淀粉酶(3.50 EU/g)或嗜热芽孢杆菌麦芽糖α-淀粉酶(9.03 EU/g)使支链淀粉的短链(DP<9)比例从23.7%分别增加到28.7%、44.2%。这表明,不同来源的淀粉酶可在不同程度上影响小麦直链淀粉的分子结构及支链淀粉的链长分布,进而影响淀粉的工艺性能。
表2 酶法改性对小麦淀粉的分子结构及聚集态结构的影响
Table 2 Effects of enzymatic modification on molecular structure and aggregation structure of wheat starch

改性用酶作用条件主要发现参考文献转葡萄糖苷酶1 650 U/g淀粉干基,pH 5.1,60 ℃,4/8/12/16/20 h•随处理时间↑,分支化度↑,A链比例↑,B链比例↓,Mw↓•随处理时间↑,R1047/1022↓[15]麦芽糖转糖基酶0.45/1.8/4.5/9/18/27/45 U/g淀粉干基,pH 6.0•随加酶量↑,去支化支链淀粉DP先↑后保持不变,直链淀粉色谱峰逐渐消失[17]α-淀粉酶20/40/60 U/g淀粉干基,pH 6.9,25 ℃,2 h•随加酶量↑,直链淀粉Mw↑,支链淀粉Mw↓;A链比例↑,B1链整体呈↑趋势,B2链呈先↑后↓趋势,B3链比例总体呈↓趋势•A型晶体保持不变,随加酶量↑,RC总体呈↓趋势,R1047/1022↓[20]α-淀粉酶、分支酶、葡糖α-淀粉酶:100 U/g淀粉干基,pH 6.9,45 ℃,10 h;分支酶:100 U/g,pH 6.5,45 ℃,10 h;葡萄糖淀粉酶:1 500 U/g,pH 5.5,48 ℃,12 h•BE→GA、AA→BE→GA分支化度↑,AA→GA支化度未发生显著变化•AA→GA、AA→BE→GA均使极短链(DP<6)、A链比例↑,B链比例↓,平均链长↓;BE→GA使极短链(DP<6)、A链比例↑,B1、B2链比例↓,B3链比例无显著变化[11]α-淀粉酶、葡萄糖淀粉酶葡萄糖淀粉酶/α-淀粉酶(1 U /3 U),pH 5.8,50 ℃,8 h•A+V型保持不变,RC↓(28.92%→26.90%),R1047/1022和R1022/995无显著变化[29]α-淀粉酶、麦芽糖α-淀粉酶0.170 EU/g BSuA、0.780 EU/g TAKA、3.500 EU/g PPA、9.030 EU/g BStA,RVA糊化•PPA、BStA使短链(DP<9)比例均↑,使中长链、长链比例均↓,使平均链长均↓;BSuA、TAKA未使链长分布出现显著变化[23]麦芽糖α-淀粉酶2.5/5/7.5/10/15 U/g淀粉干基,pH 5.0,55 ℃,1 h•随加酶量↑,极短链(DP<6)比例↑,A、B链比例均↓•A+V型晶体保持不变,RC整体↓,但随着加酶量↑,RC呈先↑后↓趋势;SAXS散射峰强度↓,结晶片层变薄,无定形片层变厚[37]β-淀粉酶20 U/g淀粉干基,50 ℃,10/20/30/40/50/90/180/300 min•随处理时间↑,Mw和Mn均↓,Rw↓,PI呈先↑后↓趋势;A链比例↓,B1链比例呈先↑后↓趋势,B2链比例↓,B3链比例呈先↓后↑趋势[31]β-淀粉酶34.33 U,56.50 ℃,32.20 min•支链淀粉侧链平均长度↓(DP 21→14)[44]普鲁兰酶6 U/mg,pH 5.5,55 ℃,4 h•直链淀粉比例↑(23.60%→47.13%),支链淀粉比例↓(76.40%→52.87%)•A→V型,RC↓(24.73%→15.31%)[45]
注:Mw:重均分子质量,Mn:数均分子质量,R1047/1022:在1 047 cm-1处和1 022 cm-1处的吸收峰强度比值,R1022/995:在1 047 cm-1处和1 022 cm-1处的吸收峰强度比值,RC:相对结晶度,BE:分支酶,GA:葡萄糖淀粉酶,AA:α-淀粉酶,RVA:快速黏度分析仪,SAXS:X-射线小角衍射,BSuA:枯草芽孢杆菌α-淀粉酶,TAKA:米曲霉α-淀粉酶,PPA:猪胰腺α-淀粉酶,BStA:嗜热芽孢杆菌麦芽糖α-淀粉酶。
3.3 淀粉聚集态结构
淀粉颗粒是由若干淀粉分子组成的聚集体,淀粉分子通过排列形成淀粉颗粒中的无定形区和结晶区。在X-射线衍射图谱上,明显的尖锐衍射峰反映淀粉的结晶区,而弥散的不明显的衍射峰反映淀粉的无定形区。由表2可知,酶处理可以引起小麦淀粉相对结晶度、短程有序结构、片层结构等发生不同程度的变化。XIE等[29]在采用α-淀粉酶和葡萄糖淀粉酶制备多孔小麦淀粉时发现复合酶处理并未引起相对结晶度显著变化。SHEN等[20]研究发现,α-淀粉酶处理使小麦淀粉的相对结晶度从36.25%下降到31.44%,这可能是由于α-淀粉酶“表面侵蚀”水解模式改变了微晶取向,降低了淀粉的有序分子结构,同时酶水解产生了较多的短侧链,这种由短侧链组成的结晶区不稳定,导致相对结晶度下降。ZHAI等[37]报道,小麦淀粉颗粒经麦芽糖α-淀粉酶处理后,20°(2θ)处直链淀粉-脂质复合物衍射峰未受其影响,但是酶改性小麦淀粉的相对结晶度高于对照组,这表明麦芽糖α-淀粉酶主要作用于无定形区。在X-射线小角衍射图谱上,小麦淀粉在麦芽糖α-淀粉酶处理前后均在散射矢量(q)约为0.06 Å-1存在明显的散射峰,处理后散射峰值强度下降,这表明酶处理破环了小麦淀粉颗粒的半结晶层状结构[37]。有学者研究了糊化后的小麦淀粉经普鲁兰酶处理后的聚集态结构的变化,酶解后小麦淀粉酶改性产物的相对结晶度15.31%,而原淀粉的相对结晶度为24.73%,这表明酶解产物有更多无定形区[45]。酶处理一般不会引起小麦淀粉结晶类型变化[20,37];但是糊化后的小麦淀粉经普鲁兰酶处理,酶改性产物的晶体结构由A型转变为V型,这是因为在反应结束后的醇沉处理过程中,线性葡聚糖链和乙醇分子之间形成了复合物[45]。
4 酶法改性对小麦淀粉理化性质的影响
4.1 溶解度和膨胀力
酶可以水解小麦淀粉颗粒的一些特定区域,在一定程度上破坏了颗粒的完整性,从而使小麦淀粉的水合能力发生一定变化。MAJZOOBI等[42]研究发现,小麦淀粉经α-淀粉酶处理后成为多孔淀粉,水合能力从原来的2.22%大幅提高到27.00%。SHEN等[20]报道,α-淀粉酶处理(25 ℃、2 h)使小麦淀粉颗粒上出现凹坑和孔洞,小麦淀粉的膨胀力在低加酶量时(20、40 U/g)未发生显著性变化,仅在高加酶量时(60 U/g)有所下降。LI等[31]报道β-淀粉酶(20 U/g)处理使小麦淀粉的溶解性(95 ℃)显著增加,且随着酶处理时间延长(0→180 min)而持续增大,而膨胀力则随着酶解而降低。同样地,ZHAI等[37]报道小麦淀粉颗粒经麦芽糖α-淀粉酶改性后,其膨胀性显著降低(4.58 g/g→3.67 g/g,P<0.05),随着加酶量的增加,膨胀性降低幅度越大。VAN等[38]报道添加0.05%麦芽糖α-淀粉酶(Novamyl®)处理使小麦淀粉的膨胀力(95 ℃)从23.9 g/g增加到25.4 g/g,而处理时添加5.0%硬脂酰乳酸钠则使膨胀力增加到31.2 g/g,研究认为,硬脂酰乳酸钠有可能吸附在淀粉颗粒表面,从而增加其膨胀力。UTHUMPORN等[28]使用复合酶(α-淀粉酶和葡萄糖淀粉酶)处理小麦淀粉(35 ℃、24 h),颗粒上出现了孔洞,但其溶解性和膨胀力均无显著性变化。XIE等[29]报道,就溶解性而言,小麦A淀粉低于B淀粉,而二者的膨胀力无显著差异;经复合酶(α-淀粉酶和葡萄糖淀粉酶)处理后,小麦A淀粉(6.81%→80.93%)和B淀粉(11.72%→76.49%)的溶解性(80 ℃)均大幅升高,A淀粉膨胀力(80 ℃)从10.25 g/g增加到25.17 g/g,B淀粉则从9.28 g/g增加到24.22 g/g,因为酶水解促进了无定形区域直链淀粉浸出,使淀粉颗粒形成多孔结构,削弱了淀粉的结构强度;研究还发现,在酶解前对淀粉颗粒进行湿热处理可造成淀粉的溶解性及膨胀力的增幅有所下降。这可归因于湿热处理引起颗粒内部淀粉分子链重排,增强了淀粉链之间的相互作用。姬娜等[34]将小麦淀粉糊化后加入产麦芽四糖α-淀粉酶得到酶改性产物,其溶胀度和可溶性指数均明显低于原小麦淀粉。LIU等[45]将小麦淀粉糊化后加入普鲁兰酶Promozyme D2于55 ℃处理4 h,经真空干燥后粉碎过筛的酶解产物,可部分溶于37 ℃凉水(溶解性~51%),而原小麦淀粉几乎不溶。研究还发现,在凉水中分散后可进一步形成水凝胶。这表明,小麦淀粉颗粒溶解性、膨胀力等水合能力变化与淀粉及酶的来源有关。
4.2 热特性
淀粉的热特性反映淀粉颗粒在糊化过程中升温引起淀粉聚集态结构的变化。淀粉颗粒结晶结构的多样性使其糊化温度处在一个区间范围。起始糊化温度(To)表示较弱的结晶首先融熔,而终止糊化温度(Tc)反映最稳定的结晶结构;峰值糊化温度(Tp)可反映有效的双螺旋长度,用来评价淀粉中微晶质量的优劣程度;糊化焓(ΔHg)反映淀粉双螺旋有序结构解离所需的能量。在酶处理过程中,淀粉颗粒表面及内部的无定形区域最先被酶水解,进而结晶区的分子链发生有限水解,从而导致淀粉热特性的变化。CHENG等[10]研究发现,小麦淀粉经β-淀粉酶处理后,糊化温度参数To、Tp及Tc均升高,糊化温度区间(To~Tc)则随着酶解程度呈先升高后降低趋势,这可能与不同酶解程度下淀粉链结构的特性有关,糊化温度区间增加意味着双螺旋结构的多样性增加;此外,酶处理导致小麦淀粉的ΔHg降低,这表明酶处理使结晶结构中氢键破坏所需能量减小。ZHAI等[37]研究发现小麦淀粉颗粒经麦芽糖α-淀粉酶(2.5~15 U/g,55 ℃,1 h)处理后,To~Tc与对照组(未加酶)无显著性差异,但ΔHg显著降低(P<0.05),研究认为其变化主要来自韧化作用,淀粉在过量水分及低于糊化温度下其双螺旋发生重排,形成更为完美的晶体结构,相比于原淀粉,To、Tp、Tc升高而To~Tc下降;但是,韧化结合麦芽糖α-淀粉酶对淀粉链的水解作用使得分子有序度下降,ΔHg降低。UTHUMPORN等[28]报道,复合酶(α-淀粉酶和葡萄糖淀粉酶)处理没有引起小麦淀粉的糊化温度和糊化焓显著性变化。XIE等[29]采用复合酶(α-淀粉酶和葡萄糖淀粉酶)制备多孔小麦淀粉,与原淀粉相比,多孔淀粉的To、Tp升高,Tc保持不变,糊化温度区间(Tc~To)缩短;原淀粉在酶解前进行两次湿热处理,Tc~To进一步减小,这表明酶解清除了淀粉颗粒中较弱的结晶结构,增强了结晶结构的均一性。SHEN等[20]则报道,α-淀粉酶提高了小麦淀粉的糊化温度和糊化焓,使小麦淀粉的抗糊化能力增强。由此可见,淀粉酶对小麦淀粉热特性的影响是多方面的,对于热特性参数的变化整体上似乎缺乏明显规律。多数研究报道酶处理可以增强小麦淀粉结构的稳定性,这很可能是无定形区被水解了的缘故,具体原因有待深入研究。
4.3 糊化特性
根据加工环节的不同,酶对小麦淀粉的作用,或发生在天然淀粉颗粒阶段,或在小麦淀粉相关制品加热熟化过程中[46]。对于前一种情况,通常是酶反应一定时间后,通过离心或其他方式终止反应,测定小麦淀粉颗粒的糊化特性变化。SHEN等[20]将小麦淀粉与α-淀粉酶溶液混合,室温(25 ℃)反应2 h后,加入1 mol/L NaOH溶液终止反应,离心、水洗沉淀后进行表征,结果发现酶处理使小麦淀粉更容易糊化,糊化温度(pasting temperature,PV)、峰值黏度(peak viscosity,PV)、谷值黏度(trough viscosity,TV)、最终黏度(final viscosity,FV)、回升值(setback,SB)均随着酶的添加而降低。ZHAI等[37]发现小麦淀粉颗粒经麦芽糖α-淀粉酶处理后,糊化特性曲线整体下移,且下移幅度随加酶量增加而加大,PV从2 789.67 cP下降到498.81 cP,FV从3 927.46 cP降低到401.07 cP,研究认为,PV下降与淀粉颗粒完整性的破坏及其膨胀性降低有关,同时,酶处理导致直链淀粉水解,支链淀粉侧链变短,减少了淀粉链之间的缠结,使其FV下降;麦芽糖α-淀粉酶处理使小麦淀粉的SB显著降低(2 035.68 cP→232.32 cP),这表明酶处理有效抑制了小麦淀粉的短期回生。CHENG等[10]观测到β-淀粉酶处理使小麦淀粉的糊化特性曲线显著下移,PV降低表明酶处理造成小麦淀粉膨胀性下降,同时,随着加酶量(10→50 U/g淀粉干基)的增加,PV以后的曲线变化更为平缓,崩解值(breakdown,BD)逐渐减小,这表明酶处理增加了淀粉颗粒抗剪切力和热稳定性;小麦淀粉经酶处理到一定程度后,其糊化特性不再呈显著性变化,研究推测这主要是β-淀粉酶“由外至内”的水解模式,小麦淀粉颗粒结构的破坏程度逐渐增加,直到能够被水解区域作用完全。对于后一种情况,则在加酶后对体系进行加热,淀粉酶在因温度导致其变性失活前,能够持续地对淀粉进行酶解。为考察这一动态过程酶处理对其糊化特性变化的影响,可将添加酶的淀粉悬液直接进行快速黏度分析(rapid visco analyzer,RVA)[23]。LEMAN等[22]研究发现小麦淀粉糊化特性变化与淀粉酶的种类及加酶量密切相关,枯草芽孢杆菌α-淀粉酶(0.092 EU/g淀粉)、米曲霉α-淀粉酶(0.434 EU/g淀粉)可使其FV增加,而高加酶量使其FV下降;嗜热硬脂芽孢杆菌麦芽糖α-淀粉酶在各加酶量下均使FV升高,猪胰腺α-淀粉酶及甘薯β-淀粉酶在各加酶量下使FV下降。VAN等[38]向小麦淀粉悬液(8%,质量浓度)中添加麦芽糖α-淀粉酶,然后进行RVA测试,结果发现,PV较未加酶的对照组降低56.8%。有研究将淀粉糊化后进行酶处理,反应结束后,收集酶解产物,干燥后粉碎、过筛,得到酶改性淀粉。姬娜等[34]将小麦淀粉糊化后冷却至室温,加入产麦芽四糖α-淀粉酶,于55 ℃保温24 h,得到酶改性小麦淀粉,酶改性小麦淀粉PV、TV和FV与原小麦淀粉相比,分别降低37.57%、32.88%和15.49%,而SB从360 RVU增加到469 RVU,增幅30.28%。LIU等[45]将小麦淀粉悬液在Brabender®黏度分析仪上按程序升温糊化,在降温到55 ℃时加入普鲁兰酶,在该温度下保温60 min进行酶反应,结果发现,酶加入后体系黏度迅速下降,其黏度仅为未加酶对照组黏度的5.3%。
4.4 老化特性
酶处理对小麦淀粉的老化特性具有调节作用。ZHAI等[37]报道小麦淀粉经麦芽糖α-淀粉酶处理,在4 ℃贮藏期间回生焓(ΔHr)低于相同贮藏条件下的原淀粉,并且随着加酶量增加(2.5→15 U/g),贮藏28 d时的ΔHr降低率从83.13%增加到97.07%,可见酶处理显著抑制了小麦淀粉的长期回生。LI等[15]将小麦淀粉糊化后加入转葡萄糖苷酶60 ℃反应4~20 h,将得到的产物在沸水浴中糊化后于4 ℃贮藏15 d进行观测,结果表明,随着酶水解时间的延长(4 h→20 h),低场核磁自旋-自旋弛豫时间T21和T22持续降低而T23持续升高,这表明酶解淀粉体系中水分子流动性增加,老化过程中形成较低结晶度的重结晶结构,回生小麦淀粉的相对结晶度从原来的24.33%降低至14.50%,ΔHr从原来的6.71 J/g降至3.15 J/g,这是因为转葡萄糖苷酶处理增加了小麦淀粉支链淀粉的分支化度(14.11%→17.97%),缩短了支链淀粉的平均链长(17.91→16.10 DP),减少了双螺旋结构的形成,使淀粉分子链不易聚集缠结,从而降低了小麦淀粉的回生速率。CHENG等[10]研究发现β-淀粉酶处理可以使小麦淀粉贮藏21 d时的ΔHr从原来3.03 J/g下降到1.95 J/g,增加酶量或延长酶解时间都可以使ΔHr降低,同时,β-淀粉酶处理降低了小麦淀粉凝胶新制备时以及4 ℃贮藏时的硬度;由此可见β-淀粉酶可抑制小麦淀粉的回生作用。后续研究发现[31],β-淀粉酶处理可以使小麦淀粉凝胶在贮藏过程中水分迁移受到抑制,凝胶的持水性增强。熊柳等[44]的研究证实β-淀粉酶处理可以抑制小麦淀粉的回生,降低小麦淀粉凝胶的硬度。KOROMPOKIS等[17]报道,麦芽糖转糖基酶在低添加量时(0.45 U/g 淀粉干基)不会引起小麦淀粉ΔHr显著变化,当加酶量增加到1.80 U/g,ΔHr从0.78 J/g增加到2.39 J/g,且随着加酶量增加一直呈增加趋势,当加酶量为45.00 U/g时,ΔHr增加到7.73 J/g。这是由于麦芽糖转糖基酶通过修饰支链淀粉增加了侧链长度,从而促进了淀粉分子的重结晶,提高了老化程度。这表明,选择合适的酶可起到延缓或促进淀粉老化的作用。麦芽糖α-淀粉酶、β-淀粉酶、转葡萄糖苷酶等缩短淀粉链长度和/或增加分支化度,通过增强水分子流动性和抑制双螺旋结构形成,延缓小麦淀粉的重结晶,它们在小麦淀粉抗回生应用中具有潜在价值;麦芽糖转糖基酶通过增加支链淀粉的侧链长度促进小麦淀粉老化,可进一步研究其在提升小麦淀粉营养特性或抗性淀粉比例中的应用。
4.5 消化特性
酶处理可以影响颗粒小麦淀粉的消化性。SHEN等[20]报道小麦淀粉经α-淀粉酶处理(60 U/g,2 h),快消化淀粉及慢消化淀粉含量显著下降,抗性淀粉含量从7.09%增加到11.69%。酶处理使小麦淀粉分子的A链和B1链增加,促进了线性短链迁移和有序化重排,从而使其对酶的敏感性下降。KOROMPOKIS等[17]研究发现,麦芽糖转糖基酶对小麦淀粉消化性的影响受加酶量的控制,低加酶量(0.45 U/g、1.80 U/g)时淀粉的消化速率不受其影响,加酶量达到4.5 U/g时,消化速率显著下降,当加酶量继续增加(4.5→45 U/g),消化速率(min-1)从0.33逐步下降到0.20。研究认为,麦芽糖转糖基酶使支链淀粉侧链长度增加,淀粉链之间更易聚集,促进了淀粉的重结晶,进而增加了淀粉对猪胰α-淀粉酶的抗性。LIU等[45]将糊化的小麦淀粉采用普鲁兰酶于55 ℃处理4 h,得到脱支小麦淀粉,经测定,消化率仅为50%左右,而原小麦淀粉消化率约90%。ARP等[47]报道,普鲁兰酶可用于抗性小麦淀粉的制备,与不加酶得到的样品对比,普鲁兰酶大幅度降低了样品的消化速率(min-1),估计血糖生成指数eGI较原小麦淀粉降幅达到66%。由此可见,酶法改性在降低小麦淀粉消化性和低GI食品制造等方面可发挥积极作用。
5 酶法改性对小麦淀粉相关制品的影响
5.1 多孔小麦淀粉
多孔淀粉是一种微孔化的变性淀粉。多孔淀粉具有独特的孔道结构,较大的比表面积,可作为功能性成分的包埋剂或吸附载体,应用十分广泛。多孔淀粉通常以酸解或酶解法制备。相比于酸解法,酶解法制备多孔淀粉因其作用的选择性和可控性更有优势。NAGULESWARAN等[48]采用扫描电镜和激光共聚焦观测发现,小麦淀粉经α-淀粉酶和葡萄糖淀粉酶复合酶处理(30 ℃,24 h),大颗粒比小颗粒出现更为清晰的孔道结构,由于酶对无定形区的剥蚀作用,大颗粒内部的狭缝状裂纹更加清晰、可辨。张国权等[49]以小麦A淀粉为材料,采用α-淀粉酶与糖化酶双酶水解法制备小麦微孔淀粉,经工艺优化后,制备的小麦微孔淀粉的吸油率为103.46%,而原淀粉的吸油率为51.24%。MAJZOOBI等[42]研究发现,α-淀粉酶和超声波技术联用可以得到高性能小麦多孔淀粉,0.4%α-淀粉酶和40 min超声波处理,使小麦淀粉对甲基紫的吸附容量从2.79%增加到49.17%。XIE等[29]将反复湿热处理和复合酶联用制备小麦多孔淀粉,相比于单独酶处理,双改性使多孔淀粉的比表面积、总孔体积、持油力和甲基蓝吸附容量均显著增加。在此基础上,XIE等[50]对制备的小麦多孔淀粉进行交联处理,由此造成产品的孔洞结构更加稠密,吸附容量进一步增加。为进一步提升其吸附性能,GUO等[11]研究表明,多酶作用顺序是小麦多孔淀粉特性的重要影响因素,按照“α-淀粉酶→脱支酶→葡萄糖淀粉酶”的顺序制备的多孔淀粉对油脂、染料和重金属离子均具有较好的吸附性能。
5.2 面条
有证据表明,淀粉酶可通过改善淀粉的性能来调整面条的品质。LI等[21]研究发现,在挤压式面条加工中添加耐热或中温α-淀粉酶可以改善产品的组织结构和食味品质,中温α-淀粉酶的提升效果更佳,其添加量从0.0‰增加到1.6‰,面条的整体可接受度从4.57增加到7.10。QIAN等[46]采用普鲁兰酶处理普通面粉,接着将其以一定比例(0%、3%、6%、9%、12%、15%)替换原面粉添加制作白盐面条,结果表明,普通面粉经普鲁兰酶处理后,直链淀粉含量提高62%,白盐面条吸水率、蒸煮损失、亮度及硬度增加,而烹煮得率下降,尽管如此,烹煮后面条的慢消化淀粉比例显著增加,普鲁兰酶处理使白盐面条的淀粉消化性得到改善。目前,淀粉酶在面条加工中的应用尚不多见,有待深入研究。
5.3 面包
酶制剂作为面包改良剂的应用已有相当长的历史。为提升改良效果,通常采用复合酶制剂,这些酶包括淀粉酶、脂肪酶、木聚糖酶、葡萄糖氧化酶等。小麦淀粉颗粒在淀粉酶的作用下,水解释放葡萄糖等可发酵糖,促进酵母发酵产气,从而起到增大面包体积的作用;有些淀粉酶作用于淀粉颗粒释放寡糖,对淀粉回生具有抑制作用,从而延长面包贮存期。ZHANG等[36]报道了一种产麦芽六糖α-淀粉酶,在面团制作和醒发过程中作用于小麦淀粉颗粒,产生相当比例的麦芽低聚糖,促进面团醒发,改善面团性能、增大面团体积;相比于对照组,添加淀粉酶的面包切片有更加致密的气孔结构,而且在面包贮存过程中通过抑制淀粉的老化,从而提升面包品质和贮藏性。STRUYF等[8]研究了α-淀粉酶、α-葡萄糖苷酶和葡萄糖淀粉酶对面团醒发中酵母发酵以及面包中糖含量的影响,结果表明,α-淀粉酶及葡萄糖淀粉酶提高了面团中可发酵糖的水平,而α-葡萄糖苷酶仅仅影响了葡萄糖与麦芽糖的比例,因此α-淀粉酶及葡萄糖淀粉酶使酵母总发酵时间延长。KOROMPOKIS等[18]研究了在面包制作时加入麦芽糖淀粉酶或麦芽糖转糖基酶对白面包质地、组织结构和淀粉消化性能的影响,结果表明,麦芽糖淀粉酶添加使贮藏阶段淀粉老化及面包瓤硬化的速度下降,同时,新鲜及存放后的白面包的淀粉体外消化速率下降;然而,麦芽糖转糖基酶仅使面包瓤硬化的速度有所下降,淀粉消化性未受其影响。DILER等[51]在软质小麦面团制作时加入葡萄糖淀粉酶(添加量1100 AGU/kg面粉),通过优化面条调制工艺,使葡萄糖淀粉酶作用于小麦淀粉颗粒充分产生葡萄糖,加工出的三明治面包在无需额外加糖的情况下即可具有满意的甜味。ÜNAL等[27]从热泉中分离得到23种产α-淀粉酶的真菌,将其中酶活力最高的黑曲霉α-淀粉酶用于面包加工,酶添加使面包体积增加,有效延缓了贮藏过程面包的质地劣化。YANG等[35]将产麦芽六糖α-淀粉酶用于面包制作,结果表明,该酶的加入使淀粉相对结晶度下降,加工出的面包的体积增加9.74%,慢消化淀粉含量增加7.56%,达到了改善面包质地和营养特性的双重效果。面包烘焙是十分复杂的过程,伴随的化学以及酶反应对淀粉结构及产品品质具有显著影响。FUENTES等[39]研究了α-淀粉酶对面包加工的影响,通过提取面包中的淀粉进行分析,结果发现,α-淀粉酶造成淀粉降解,使淀粉的分支化程度增加。LAGRAIN等[52]研究发现,热稳定的α-淀粉酶可在面包加工过程中持续地降解淀粉,甚至在烘焙结束面包冷却过程中仍然能够发挥作用,相比于空白对照组,添加酶的面包的气孔体积更大,该研究也表明淀粉的性能对面包的品质具有重要作用。
5.4 其他
研究表明,α-淀粉酶能影响小麦粉面团的馒头加工适应性。LIU等[53]报道添加0.000 6%或0.001 0%的α-淀粉酶,馒头加工用面团的稳定性下降,面团软化倾向和延展性增强。SADEGHIAN等[54]报道酸性热稳定α-淀粉酶对无麸质蛋糕的品质具有改善作用。LI等[41]研究发现,小麦淀粉依次经过β-淀粉酶、转葡萄糖苷酶和普鲁兰酶的修饰,小麦淀粉的成糊性和凝胶性发生改变,改性后的小麦淀粉更适宜于软糖、布丁、甜点等制品的加工。
6 结论和展望
通过酶法改性,小麦淀粉仍保持着分子的层次结构甚至颗粒结构,但获得独特的性能,提升了相关制品的品质,同时减少了改性过程化学试剂使用,是一类绿色的淀粉改性手段,符合当前食品工业的“清洁标签”理念。为更好地推动酶法改性小麦淀粉的发展,未来的研究可侧重于:a)高效修饰小麦淀粉的酶资源挖掘。已报道的酶主要来源于微生物,从安全、活性、反应条件及底物选择性等角度,可采取定向进化、理性设计等手段提升酶的性能,以促进其工业应用;采用可食性植物来源的酶(如大麦α-淀粉酶、大麦β-淀粉酶、甘薯β-淀粉酶等)改性小麦淀粉也值得研究。b)酶法用于定向改造小麦淀粉特定方面性能的研究技术和方法的建立。酶处理可改善小麦淀粉的凝胶性能、消化性能,抑或是作为微孔淀粉的吸附/荷载性能,但对其进行改性的分子机制尚不明确,而且缺乏有效的调控手段。c)酶改性小麦淀粉的工业化生产技术。与化学改性淀粉建立了成熟的工业化手段不同,酶改性小麦淀粉的工业化技术及产品面世尚待时日。d)酶改性小麦淀粉的应用性能研究。酶改性小麦淀粉的应用目前主要集中在面包等产品,其在传统食品如面条、馒头、凉皮、饺子皮等的应用研究有待加强。此外,酶改性小麦淀粉在可食膜、抗性淀粉、功能活性物质载体、3D打印等方面的新兴应用也值得开展研究。
[1] WANG Z, MA S, SUN B H, et al.Effects of thermal properties and behavior of wheat starch and gluten on their interaction:A review[J].International Journal of Biological Macromolecules, 2021,177:474-484.
[2] VAN DER BORGHT A, GOESAERT H, VERAVERBEKE W S, et al.Fractionation of wheat and wheat flour into starch and gluten:Overview of the main processes and the factors involved[J].Journal of Cereal Science, 2005,41(3):221-237.
[3] GAO X, TONG J Y, GUO L, et al.Influence of gluten and starch granules interactions on dough mixing properties in wheat (Triticum aestivum L.)[J].Food Hydrocolloids, 2020,106:105885.
[4] SHEWRY P R, HAWKESFORD M J, PIIRONEN V, et al.Natural variation in grain composition of wheat and related cereals[J].Journal of Agricultural and Food Chemistry, 2013,61(35):8295-8303.
[5] KIM K H, KIM J Y.Understanding wheat starch metabolism in properties, environmental stress condition, and molecular approaches for value-added utilization[J].Plants, 2021,10(11):2282.
[6] ZHAO T, LI X P, ZHU R Z, et al.Effect of natural fermentation on the structure and physicochemical properties of wheat starch[J].Carbohydrate Polymers, 2019,218:163-169.
[7] PARK S, KIM Y R.Clean label starch:Production, physicochemical characteristics, and industrial applications[J].Food Science and Biotechnology, 2020,30(1):1-17.
[8] STRUYF N, VERSPREET J, VERSTREPEN K J, et al.Investigating the impact of α-amylase, α-glucosidase and glucoamylase action on yeast-mediated bread dough fermentation and bread sugar levels[J].Journal of Cereal Science, 2017,75:35-44.
[9] BANGAR S P, ASHOGBON A O, SINGH A, et al.Enzymatic modification of starch:A green approach for starch applications[J].Carbohydrate Polymers, 2022,287:119265.
[10] CHENG W, SUN Y J, XIA X Z, et al.Effects of β-amylase treatment conditions on the gelatinization and retrogradation characteristics of wheat starch[J].Food Hydrocolloids, 2022,124:107286.
[11] GUO L, YUAN Y H, LI J H, et al.Comparison of functional properties of porous starches produced with different enzyme combinations[J].International Journal of Biological Macromolecules, 2021,174:110-119.
[12] PARK S H, NA Y, KIM J, et al.Properties and applications of starch modifying enzymes for use in the baking industry[J].Food Science and Biotechnology, 2017, 27(2):299-312.
[13] Carbohydrate Active Enzymes datebase[EB/OL].http://www.cazy.org/.
[14] ZHONG Y Y, XU J C, LIU X X, et al.Recent advances in enzyme biotechnology on modifying gelatinized and granular starch[J].Trends in Food Science &Technology, 2022,123:343-354.
[15] LI J H, YUAN Y H, ZHANG H X, et al.Structural, physicochemical and long-term retrogradation properties of wheat starch treated using transglucosidase[J].Food Chemistry, 2022, 380:132226.
[16] CHEN Y H, MCCLEMENTS D J, PENG X W, et al.Research progresses on enzymatic modification of starch with 4-α-glucanotransferase[J].Trends in Food Science &Technology, 2023,131:164-174.
[17] KOROMPOKIS K, DELEU L J, DE BRIER N, et al.Use of amylomaltase to steer the functional and nutritional properties of wheat starch[J].Foods, 2021,10(2):303.
[18] KOROMPOKIS K, DELEU L J, DE BRIER N, et al.Investigation of starch functionality and digestibility in white wheat bread produced from a recipe containing added maltogenic amylase or amylomaltase[J].Food Chemistry, 2021,362:130203.
[19] SAKINTUNA B, BUDAK O, DIK T, et al.Hydrolysis of freshly prepared wheat starch fractions and commercial wheat starch using α-amylase[J].Chemical Engineering Communications, 2003,190(5-8):883-897.
[20] SHEN H S, GE X Z, ZHANG Q, et al.Dielectric barrier discharge plasma improved the fine structure, physicochemical properties and digestibility of α-amylase enzymatic wheat starch[J].Innovative Food Science &Emerging Technologies, 2022,78:102991.
[21] LI J P, RASHED M M A, DENG L, et al.Thermostable and mesophilic α-amylase:Effects on wheat starch physicochemical properties and their applications in extruded noodles[J].Journal of Cereal Science, 2019,87:248-257.
[22] LEMAN P, BIJTTEBIER A, GOESAERT H, et al.Influence of amylases on the rheological and molecular properties of partially damaged wheat starch[J].Journal of the Science of Food and Agriculture, 2006,86(11):1 662-1 669.
[23] LEMAN P, GOESAERT H, DELCOUR J A.Residual amylopectin structures of amylase-treated wheat starch slurries reflect amylase mode of action[J].Food Hydrocolloids, 2009,23(1):153-164.
[24] NEBESNY E.Changes of carbohydrate compositions during enzymatic hydrolysis of starches of various origin[J].Starch-Stärke, 1993,45(12):426-429.
[25] SARIKAYA E, HIGASA T, ADACHI M, et al.Comparison of degradation abilities of α- and β-amylases on raw starch granules[J].Process Biochemistry, 2000,35(7):711-715.
[26] SONI S K, KAUR A, GUPTA J K.A solid state fermentation based bacterial α-amylase and fungal glucoamylase system and its suitability for the hydrolysis of wheat starch[J].Process Biochemistry, 2003,39(2):185-192.
[27] ÜNAL A, SUBA
 A S, MALKOÇ S, et al.Potential of fungal thermostable alpha amylase enzyme isolated from hot springs of Central Anatolia (Turkey) in wheat bread quality[J].Food Bioscience, 2022,45:101492.
A S, MALKOÇ S, et al.Potential of fungal thermostable alpha amylase enzyme isolated from hot springs of Central Anatolia (Turkey) in wheat bread quality[J].Food Bioscience, 2022,45:101492.
[28] UTHUMPORN U, KARIM A A, FAZILAH A.Defatting improves the hydrolysis of granular starch using a mixture of fungal amylolytic enzymes[J].Industrial Crops and Products, 2013,43:441-449.
[29] XIE Y, LI M N, CHEN H Q, et al.Effects of the combination of repeated heat-moisture treatment and compound enzymes hydrolysis on the structural and physicochemical properties of porous wheat starch[J].Food Chemistry, 2019,274:351-359.
[30] RODER N, GERARD C, VEREL A, et al.Factors affecting the action of α-amylase on wheat starch:Effects of water availability.An enzymic and structural study[J].Food Chemistry, 2009,113(2):471-478.
[31] LI Y, CHENG W, QIU X, et al.Effects of β-amylase hydrolysis on the structural, physicochemical and storage properties of wheat starch[J].Journal of Cereal Science, 2023,109:103605.
[32] WANG D L, MA X B, YAN L F, et al.Ultrasound assisted enzymatic hydrolysis of starch catalyzed by glucoamylase:Investigation on starch properties and degradation kinetics[J].Carbohydrate Polymers, 2017,175:47-54.
[33] LIU G D, GU Z B, HONG Y, et al.Structure, functionality and applications of debranched starch:A review[J].Trends in Food Science &Technology, 2017,63:70-79.
[34] 姬娜, 卜祥辉, 孙庆杰.G4淀粉酶抑制小麦淀粉老化研究[J].粮食与油脂, 2011,24(9):15-17. JI N, BU X H, SUN Q J.Study of G4 amylase on inhibiting retrogradation of wheat starch[J].Journal of Cereals &Oils, 2011,24(9):15-17.
[35] YANG T, ZHONG L L, JIANG G S, et al.Comparative study on bread quality and starch digestibility of normal and waxy wheat (Triticum aestivum L.) modified by maltohexaose producing α-amylases[J].Food Research International, 2022,162(Pt A):112034.
[36] ZHANG L, LI Z K, QIAO Y, et al.Improvement of the quality and shelf life of wheat bread by a maltohexaose producing α-amylase[J].Journal of Cereal Science, 2019,87:165-171.
[37] ZHAI Y, LI X X, BAI Y X, et al.Maltogenic α-amylase hydrolysis of wheat starch granules:Mechanism and relation to starch retrogradation[J].Food Hydrocolloids, 2022,124:107256.
[38] VAN STEERTEGEM B, PAREYT B, BRIJS K, et al.Combined impact of Bacillus stearothermophilus maltogenic alpha-amylase and surfactants on starch pasting and gelation properties[J].Food Chemistry, 2013,139(1-4):1113-1120.
[39] FUENTES C, ZIELKE C, PRAKASH M, et al.The effect of baking and enzymatic treatment on the structural properties of wheat starch[J].Food Chemistry, 2016,213:768-774.
[40] 张国权, 张艳, 张洁, 等.双酶法制备小麦微孔淀粉的动力学[J].食品科学, 2012,33(23):184-188. ZHANG G Q, ZHANG Y, ZHANG J, et al.Kinetics of enzymatic hydrolysis of wheat starch by α-amylase and glucoamylase for preparation of microporous starch[J].Food Science, 2012,33(23):184-188.
[41] LI H, LI J H, GUO L.Rheological and pasting characteristics of wheat starch modified with sequential triple enzymes[J].Carbohydrate Polymers, 2020,230:115667.
[42] MAJZOOBI M, HEDAYATI S, FARAHNAKY A.Functional properties of microporous wheat starch produced by α-amylase and sonication[J].Food Bioscience, 2015,11:79-84.
[43] 陈彩雯, 李丹丹, 陶阳, 等.加酶挤压对小麦淀粉结构和理化性质的影响[J].食品工业科技, 2022,43(15):50-57. CHEN C W, LI D D, TAO Y, et al.Effect of enzyme extrusion on structure and physicochemical properties of wheat starch[J].Science and Technology of Food Industry, 2022,43(15):50-57.
[44] 熊柳, 南冲, 孙庆杰, 等.酶法修饰抑制小麦淀粉回生工艺优化及机理探讨[J].中国粮油学报, 2013,28(1):31-36. XIONG L, NAN C, SUN Q J, et al.Techniques optimization and mechanism study on the inhibition of wheat starch retrogradation by enzyme modification[J].Journal of the Chinese Cereals and Oils Association, 2013,28(1):31-36.
[45] LIU G D, HONG Y, GU Z B, et al.Pullulanase hydrolysis behaviors and hydrogel properties of debranched starches from different sources[J].Food Hydrocolloids, 2015,45:351-360.
[46] QIAN H F, YE R, WANG L, et al.In vitro digestibility and quality attributes of white salted noodles supplemented with pullulanase-treated flour[J].International Journal of Biological Macromolecules, 2019,123:1157-1164.
[47] ARP C G, CORREA M J, FERRERO C.Production and characterization of Type Ⅲ resistant starch from native wheat starch using thermal and enzymatic modifications[J].Food and Bioprocess Technology, 2020,13(7):1181-1192.
[48] NAGULESWARAN S, LI J H, VASANTHAN T, et al.Amylolysis of large and small granules of native triticale, wheat and corn starches using a mixture of α-amylase and glucoamylase[J].Carbohydrate Polymers, 2012,88(3):864-874.
[49] 张国权, 张兰月, 罗勤贵, 等.双酶法制备小麦微孔淀粉的工艺条件优化[J].食品研究与开发, 2013,34(12):1-5, 9. ZHANG G Q, ZHANG L Y, LUO Q G, et al.Optimum preparation conditions for wheat micorporous starch by double enzyme hydrolysis method[J].Food Research and Development, 2013,34(12):1-5; 9.
[50] XIE Y, ZHANG B, LI M N, et al.Effects of cross-linking with sodium trimetaphosphate on structural and adsorptive properties of porous wheat starches[J].Food Chemistry, 2019,289:187-194.
[51] DILER G, RANNOU C, GUYON C, et al.Use of amyloglucosidase in a soft wheat dough:Impact of process and formulation on glucose production[J].Applied Food Research, 2021,1(2):100007.
[52] LAGRAIN B, LEMAN P, GOESAERT H, et al.Impact of thermostable amylases during bread making on wheat bread crumb structure and texture[J].Food Research International, 2008,41(8):819-827.
[53] LIU W J, BRENNAN M A, SERVENTI L, et al.Effect of cellulase, xylanase and α-amylase combinations on the rheological properties of Chinese steamed bread dough enriched in wheat bran[J].Food Chemistry, 2017,234:93-102.
[54] SADEGHIAN MOTAHAR S F, ARIAEENEJAD S, SALAMI M, et al.Improving the quality of gluten-free bread by a novel acidic thermostable α-amylase from metagenomics data[J].Food Chemistry, 2021,352:129307.