中国是动物源性食品生产消费大国,肉、蛋、奶等动物源性食品是人类非常重要的蛋白质来源,动物源性食品中的抗生素类兽药残留对人类健康产生重要影响。如何提升抗生素类兽药残留检测手段,成为了保证国民食品安全、促进我国食品贸易的关键。近年来,随着畜牧业养殖和水产规模快速发展,抗生素类兽药除了被广泛用于预防和治疗畜禽疾病外,还被用做饲料添加剂以促进动物生长[1]。据统计,全世界每年用于畜牧业和水产养殖等领域的兽用抗生素消耗量至少为63 000 t,预计到2030年增至106 600 t。使用量较大的兽药包括喹诺酮类、四环素类、磺胺类等。抗生素被动物摄入后,在动物组织、器官和食用产品中富集残留,进而危害消费者的健康[2]。食品中兽药检查常用的方法包括液相色谱法、液相色谱质谱联用法、气相色谱质谱联用法、酶联免疫吸附法等。尽管这些方法通常用于目标化合物的验证,但也存在着设备昂贵、样品前处理耗时费力、操作复杂等问题,不能满足实际监管检测需求。因此,建立快速、高效和可信的检测兽药残留方法具有重要意义。
荧光化学传感器因其操作简便、便于携带、可观察和高灵敏度的特点,提供了一种新兴的检测手段。不同种类的材料如共轭聚合物、纳米材料和量子点作为兽用抗生素的荧光传感器已被报道[3]。值得注意的是,荧光特性主要由荧光的来源决定,这在检测目标分析物中起着关键作用。发光金属-有机框架(metal-organic frameworks,MOFs)作为一种新型多孔杂化材料在各种荧光传感器中脱颖而出,它由有机桥接配体连接体和金属连接节点组成,是有效缓解食品安全监测问题的有力选择[4]。由于MOFs的组成构件具有多样性,荧光可以来自MOFs内的金属中心和配体,并且可以通过构件之间的相互作用来调节其光学特性[5]。除了从MOFs的子单元产生荧光外,一些光响应成分也可以被包覆在MOFs中以诱导荧光,从而实现广泛的应用。荧光MOFs与溶胶-凝胶热法结合被用于许多目标化学物的检测[6],包括有毒化学物质,挥发性有机化合物、生物大分子、气体,甚至目标条件(如湿度、温度和pH)。另外,MOFs的灵活设计方式能够使其与食品检测系统的复杂环境兼容。发光MOFs的荧光变化主要依赖于目标分子和相关MOFs之间的电子/能量转移。其中,MOFs中的超高孔隙率和功能位点有助于目标物的可逆性浓缩,从而提高检测的特异性和选择性。MOFs固有的荧光特性和独特的结构相结合,为设计新型发光MOFs材料以满足日益严格的食品安全和食品质量要求提供了绝佳的机会。重要的是,发光MOFs可以通过修饰各种识别分子定制其构建模块以实现其对目标分子的特定识别[7]。相应地,荧光可以通过多个荧光中心之间的相互作用/互动来调节,从而开发出新型的双发射比率传感器。随着多个荧光单元的引入,发光MOFs具有更短的响应时间、更高的灵敏度、更好的抗干扰能力和远程监控的可能性,可以在食品行业的许多意想不到的领域中应用。与传统的传感技术相比,这些材料在食品基质中的稳定性和可调控性为抗生素类兽药残留分析提供了独特的应用机会。
到目前为止,构建策略的多样性和对多种目标分析物的不同荧光响应使发光MOFs具有更广泛的应用[8]。本文重点是对发光MOFs在抗生素类兽药残留领域的传感应用进行概述(图1)。首先对发光MOFs用于传感检测的不同荧光机理进行阐明和详细分类,列出针对目标分析物的传感机制,然后讨论了基于发光MOFs的检测技术在抗生素类兽药残留检测方面的应用。最后,该文提出了该领域未来研究的挑战和前景。
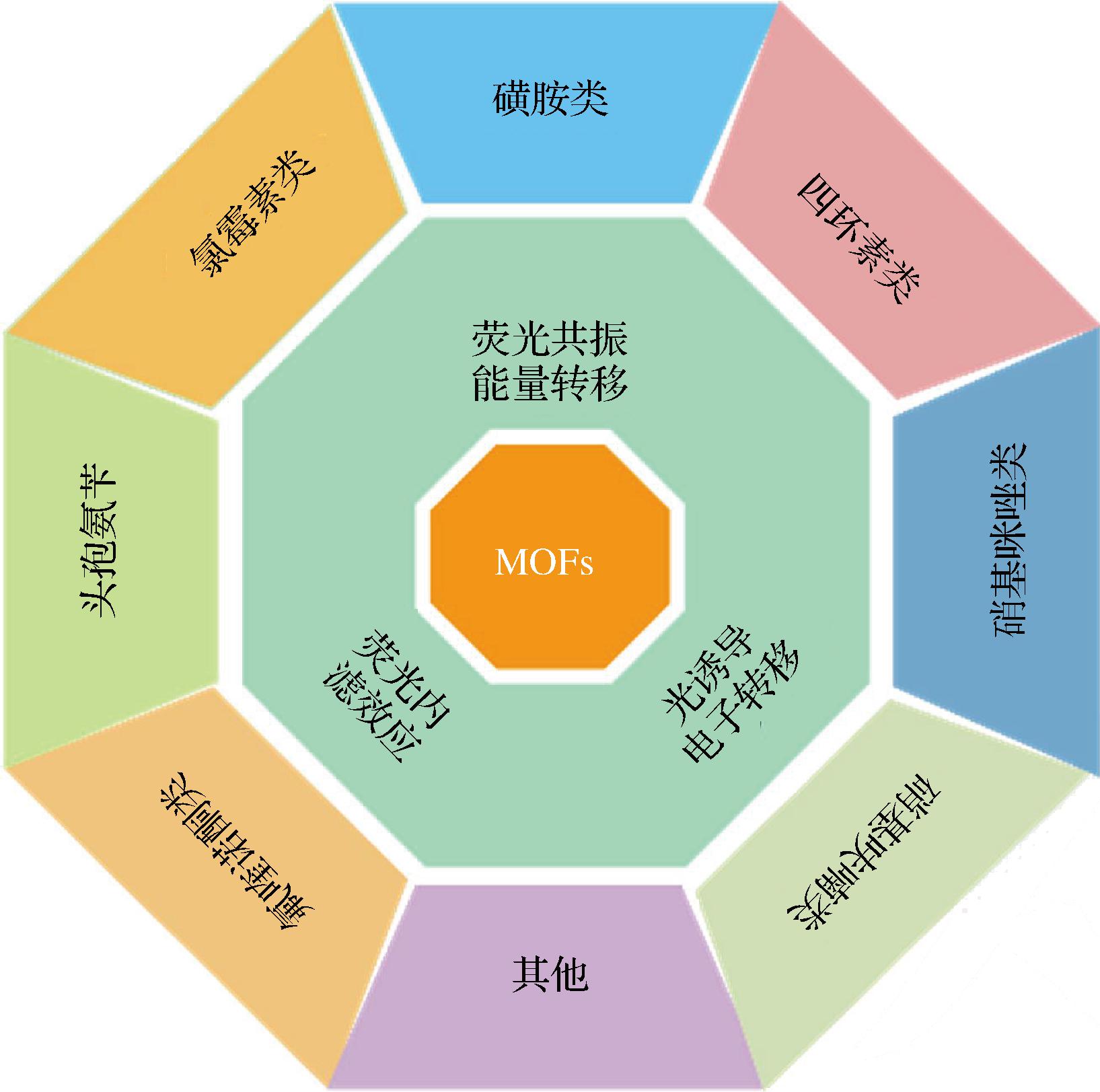
图1 MOFs 荧光传感机制和在抗生素类兽药残留中应用
Fig.1 MOFs fluorescence sensing mechanism and its application in veterinary antibiotics residues
1 MOFs荧光传感器原理
光致发光为冷发光的一种类型,被定义为由电子或振动激发态电子自发辐射。分子发光的机制可以概括为光子的吸收和电子从基态(S0)到激发态。激发态包括不稳定的第一激发态S1和第二激发态S2。从S1或S2返回到S0的电子产生荧光。MOFs是一类以金属离子(或金属团簇)和有机配体通过多种配位方式自组装形成的三维晶态多孔材料,MOFs选择具有合理功能的金属离子和有机配体。荧光功能的实现可以通过金属离子、配体或客体分子,配体和金属之间的电荷转移增强了其荧光[9](图2)。发光材料的特性是由引入各种配体的过程决定的,例如配体-金属电荷转移(ligand metal charge transfer,LMCT)、金属配体电荷转移(metal ligand charge transfer,MLCT)、金属基发射、配体基发光发射(配体局部发射)、天线效应、吸附物发射,准分子/激发态络合物发射和表面活性。配位双发射MOFs的发射机制主要包括配体到配体的电荷转移(ligand-ligand charge transfer,LLCT)、金属中心发射(如LMCT)和配体中心发射(如MLCT)[10]。MLCT和LMCT与MOFs中最低激发态能级的相对高度有关。如果有机配体的最低激发态能级的能量低于金属离子,则电荷可以从金属离子转移到有机配体上发光,这是MLCT过程。相反,如果有机配体的最低激发态能级的能量高于金属离子,则电荷从有机配体到金属离子的电荷转移发光过程是LMCT过程[11]。
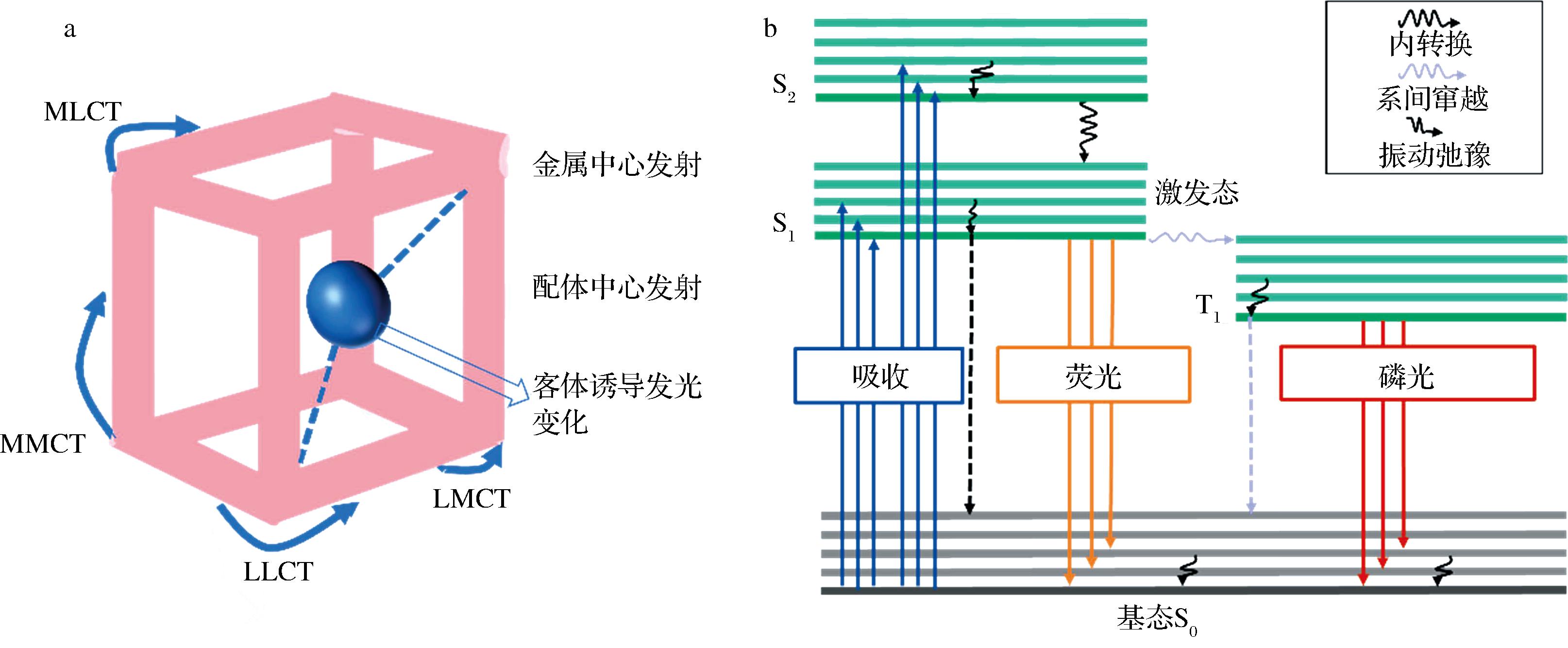
a-MOFs中的可能发射模式;b-MOFs能量传递原理图
图2 MOFs的发光机理
Fig.2 Luminescence mechanism of MOFs
1.1 基于金属中心的发射
金属中心通常存在于镧系MOFs(Ln-MOFs)或异金属有机框架(heterometal-organic framework,HMOFs)中,镧系离子的荧光特性与MOFs的多孔特性相结合,为设计新的荧光材料提供了充分的可能性。然而,由于Laporte f-f禁阻跃迁阻碍了镧系离子的直接激发,并导致低的吸附效率,镧系离子的发光需要被有机配体“敏化”[12]。在这种情况下,在发光MOFs中引入有机发光配体可以促进或破坏能量转移的过程,从而促成能量从配体转移到镧系离子,增强其光吸收能力。这被生动地称为“天线效应”。例如,镧系金属有机框架(Ln-MOFs)的性能可以通过引入硼酸(Ba)来定制,并作为比率荧光传感器检测金属离子、H2O2和葡萄糖。在Ln-MOFs(Ba-Eu-MOF)中引入Ba,用于检测Hg2+和CH3Hg+[12]。由于Ba基团的电子吸收效应可能导致“天线效应”,在水中观察到了弱的红色反应。在Hg2+的存在下,金属转移反应也引发了“天线效应”,导致了红色发射的增强。所制备的发光MOFs对Hg2+具有良好的选择性,检测限(limit of detection,LOD)为220 nmol/L,对CH3Hg+为440 nmol/L,线性范围为2~80 μmol/L。
1.2 基于有机配体的发射
配体发射主要依赖于MOF框架结构中使用各种配体电荷转移来实现,包括MLCT、LLCT和配体内电荷转移。MOF的MLCT发光是指金属离子受到光的照射,将能量转移到配体上,使激发态由金属变为配体,配体从外界吸收发光能量跃迁到基态S0并发出荧光的过程,这种荧光通常出现在具有氧化性d6、d8、d10电子构型和p受体配体的配合物中[13]。配合物通过吸收可见光,将受激的MLCT通过系间跨越转化为三重激发态MLCT。电子从单重激发态MLCT返回到基态(S0)后出现荧光发射,从三重激发态MLCT返回到S0后出现磷光发射。MLCT发生的可能性随着金属离子还原性和配体氧化性的增强而增加。具有共轭π电子的有机配体对LLCT的发光有显著的促进作用。在这种情况下,有机配体是框架的骨架,也是MOF特征发射的主要贡献者。如WANG等[14]设计了2种由π共轭有机羧酸配体BUT-14和BUT-15组成的Lewis碱基位点的荧光MOF,所设计的π共轭有机配体提供了有效的荧光。Lewis碱基位点作为功能位点与金属离子相互作用,金属节点与配体之间的强配位键使所制备的MOF具有较高的稳定性。MOFs在相应的有机羧酸配体的相同激发下表现出相似的发射特性,表明荧光主要来自所设计的π共轭有机配体。
此外,通过各种方法(如配体交换、原位合成或合成后修饰)将光子功能的官能团引入到非荧光配体中使有机配体功能化而不破坏框架。MOFs的多样性通过这些有机配体进行调整[15-16],MOFs的发光可以很容易地被功能性配体调整。非荧光配体的常见修饰是羟基化、羧基化和胺化。例如,合成了发光的羟基功能化MOF,用于检测Fe3+。羟基官能团可以提供孤对电子,并导致与Fe3+的电子转移,导致LC发射的荧光猝灭和新发射的增强,从而可以对Fe3+进行荧光感应。
1.3 基于客体分子的发射
除了有机配体和金属离子产生的荧光外,客体分子在开发发光MOFs中也起着重要作用,例如载覆发光物质以提高荧光,或添加与分析物特异性结合的官能团。MOFs具有多孔性的独特网络结构可以捕获客体分子,为客体分子提供了自然栖息地,增加了客体与主体的相互作用,从而提高了灵敏度。
被吸附的客体分子不仅可以促进发光MOF的发射,还可以使发光MOF在复杂的食品系统中对不同的靶标发挥多种功能。MOFs的结构多样性、可操作性和模块化特性使它非常适合作为功能分子的载体以实现所需的功能,它可以被专门定制,从而在食品安全领域具有高度的实用价值。将碳点(carbon dots,CDs)、染料和Ln离子等荧光基团纳入多孔框架,构建具有荧光性能的MOFs复合材料,以准确识别所需分析物。例如,通过将Eu3+封装到UiO-66(Zr)-(COOH)2的孔隙中,得到了一种高效的镧系功能化MOF[17]。UiO-66(Zr)-(COOH)2中镧系元素对强烈红色荧光Eu3+的敏化阻碍了配体中心的发射。Cd2+离子的存在下,可以观察到荧光的增强,这是由于Cd2+离子与Eu3+@UiO-66(Zr)-(COOH)2内的Lewis基团羧基氧位点之间的相互作用促进了能量从配体到Eu3+离子的转化效率。此外,镧系MOFs已经被用作荧光探针,由于配体到金属离子的分子内能量转移。Eu3+@UiO-66(20)也是通过Eu3+后期功能化设计出Zr-MOFs中,它表现出Fe3+明显的荧光猝灭效应。
1.4 基于聚集诱导发光的发射
AIEgens功能化MOF不仅继承了AIEgens AIE特性和MOF的许多优点,而且由于这种强大的结合使其荧光发射效率和传感性能显著提高。因此,可以预期,在刚性多孔MOF基体中引入AIE功能基团将使其在特定应用领域具有优越的发光性能。SHUSTOVA等[18]首次使用新设计的1,1,2,2-四(4-羧基苯基)乙烯配体构建基于四苯乙烯(tetraphenylethylene,TPE)的荧光MOF,该配体在识别有机小分子方面具有应用前景。随后,HU等[19]和ZHANG等[20]利用延长的TPE基羧酸连接剂与ZrCl4在多种竞争酸性基团存在下反应,得到2种不同拓扑结构的强荧光Zr MOF。此外,HU等[19]利用吡啶修饰的TPE配体构建了荧光MOF,用于高效、选择性地检测真菌毒素。这些开创性的研究揭示了MOF和AIE组合的巨大潜力。
1.5 基于分子内运动受限的发射
2001年,香港科技大学唐本忠教授首次提出了“聚集诱导发光”(aggregation-induced emission,AIE)的科学概念。AIE分子与ACQ(aggregation-caused quenching,ACQ)材料不同的是,具有AIE性质的分子(AIEgens)在稀溶液中荧光发射较弱,而在固态或聚集态时荧光强度较高。因此,具有AIE基团结构的MOF具有较高的荧光发射性能。其后,唐本忠课题组的ZHANG等[21]又在大量实验和理论的基础上,提出了分子内运动受限(restriction of intramolecular motion,RIM)的AIE工作机制。基于RIM机理,人们设计了许多不同的基于AIEgens的有机单元来构筑MOF,其中TPE衍生物的应用最为广泛。人们认为TPE基碎片中苯环的快速旋转和乙烯中C![]() C键的扭转振动是刚性框架中高度发光和AIE效应的原因。
C键的扭转振动是刚性框架中高度发光和AIE效应的原因。
1.6 基于框架变形的发射
开发有信号的AIE MOF的关键是尽量减少其荧光背景。尽管原位分子内运动受限机制是一种有效的方法,但需要仔细设计框架中的激发态分子动态AIE过程。因此,基于框架变形(framework deformation,FD)开关的机制提供了一个可行的途径。基于FD的AIE MOF的信号关闭状态可以通过在构建单元中掺入荧光猝灭剂来简单实现,由于MOF的变形和连接体的自聚集,FD信号可以被分析物开启。本研究小组报告了一种基于AIEgen的MOF的猝灭-脱离发射策略,用于分析细胞器内谷胱甘肽。以四苯基乙烯衍生物(tetra(4-pyridylphenyl)ethylene,TPPE)为连接体,以CuII为金属节点的Cu-tpMOF表现出非常弱的发射,因为电子从连接体转移到CuII的过程。加入谷胱甘肽(glutathione,GSH)后,Cu-tpMOF在中性pH值下可以变亮并发出绿色信号,这是由于CuII在框架中通过GSH的竞争性结合而部分脱离。在酸性环境中,Cu-tpMOF可以完全被GSH解离,并且这一过程因TPPE的质子化而加速。因此,Cu-tpMOF可用于细胞器中GSH的双通道比率成像及细胞质和溶酶体的相关治疗。猝灭-局部区域发射策略为AIE MOF在活细胞中的传感和生物成像提供了一个新的例子[22]。
2 发光MOF荧光传感器对抗生素类兽药的识别
抗生素已广泛用于治疗人类和动物的细菌性疾病。此外,抗生素曾被作为饲料添加剂以促进动物生长。然而,许多研究表明,大量使用抗生素可导致多重耐药细菌的形成,这些细菌可通过食物摄入在人类体内引发耐药基因,造成重大健康风险。根据美国卫生部的数据,美国每年约有200万人感染抗生素耐药细菌,导致约2.3万人死亡[23]。因此,开发一种快速、经济的用于食品样品中抗生素类兽药残留现场检测的传感器对人类健康和环境安全至关重要。
2.1 发光MOF传感器对四环素的识别
为了评估In-sbdc检测四环素(tetracycline,TC)的识别能力,研究人员测试了对其他常用抗生素的识别反应,包括磺胺类药物、大环内酯类药物、氨基糖苷类药物、氯霉素类药物、β-内酰胺类药物、糖肽、甲硝唑(metronidazole,MNZ)、二甲硝唑(dimetronidazole,DMZ)和硝基呋喃(furazolidone,FZD)。除MNZ、FZD和DMZ外,多种抗生素均未显著改变In-sbdc的荧光光谱(I0/I-1<±0.03)。然而,含有硝基的抗生素通常导致MOF猝灭及在In-sbdc系统中观察到荧光发射减弱[24]。研究人员将FZD、MNZ和DMZ的猝灭作用归因于硝基(强吸电子基团)引起的电子缺乏。连二亚硫酸钠(Na2S2O4)作为探测探针的掩蔽元素,通过还原作用将硝基转化为氨基以减少分子中硝基的数量[25]。据报道,ESI-MS证实参与反应的是FZD、MNZ和DMZ还原产物。在5等量Na2S2O4存在的情况下,MNZ和DMZ对In-sbdc光谱的影响不明显,FZD诱导的荧光猝灭达到了令人满意的水平(60 mmol/L时I0/I-1=0.452)。相反,Na2S2O4改变了In-sbdc对TC的荧光响应。荧光共振能量转移(fluorescence resonance energy transfer,FRET)是该系统的主要机制。FRET发生的概率取决于传感器和分析物之间的光谱重叠程度。In-sbdc的导带能级低于TC抗生素的最低未占分子轨道。因此,In-sbdc可以作为掩蔽元件Na2S2O4实现对TC类抗生素的特异性检测。最后,研究人员实现了MOF传感器对TC响应的选择性检测,与其他传感器材料相比,它可以成为一种很好的传感器探针。GAN等[26]建议使用由荧光铕基MOF组成的便携式试纸条来快速、直观地检测食品样品中的TC。Eu-MOF荧光被显著猝灭,这意味着该检测系统可能存在内滤效应(internal filtration effect,IFE)和FRET,因为荧光团的荧光寿命几乎完全由FRET而不是IFE控制。为了进一步研究猝灭机理,还对Eu-MOF和Eu-MOF-TC的荧光寿命进行了评价。因此,电子可以从配体的最低未占据分子轨道转移到TC的最低未占据分子轨道,表明PET的存在。发现IFE和PET对Eu-MOF的荧光猝灭有促进作用。基于Eu-MOF传感器获得的牛奶和牛肉中TC的LOD分别为22.71、21.24 μmol/L。采用简单的水热法合成Eu/Zr-MOF材料,并将其用于检测和高效去除TC。在TC分子中,芳香族结构的p-p相互作用有利于静电吸附。应用于加标后的水样,Eu/Zr-MOF能够优先吸附TC类抗生素,检出限较低(在存在其他抗生素的情况下为0.92 mg/mL),具有显著的回收率,回收率为93.16%~104.16%[27]。ZHAO等[28]利用Eu节点和基于5-溴间苯二甲酸配体构建了一种快速检测和去除TC的传感器。由于Eu节点强大的主客体功能、天线效应、p-p相互作用、氢键和TC与Eu-MOF之间的静电吸附等优势,抗生素的存在使Eu-MOF的荧光被猝灭,从而使Eu-MOF的PL光致发光强度被猝灭。这种猝灭效果在0.05~60 mol/L内与TC浓度成正比,在自来水中LOD低至3 nmol/L。
2.2 发光MOF传感器对氯霉素的识别
AMIRIPOUR等[29]制备了分子印迹聚合物/金属有机框架(molecularly imprinted polymer,MIP)MIP/Zr-LMOF,用于荧光检测抗生素氯霉素(chloramphenicol,CAP)。配体中的p-p*跃迁导致Zr-LMOF出现发射峰。配体到金属电子跃迁途径中配体对苯二甲酸ATA与Zr-O簇配合产生Zr-LMOF框架。研究了Zr-LMOF中Zr-O簇与2-NH2-ATA对苯二甲酸的相互作用,以及CAP对Zr-LMOF荧光强度的增强作用。这种MOF具有高灵敏度、选择性、稳定性和可重复性等优点。Zr-LMOF对实际样品(牛奶和蜂蜜)的检出限分别为0.11、0.13 mg/L。ZHOU等[30]通过选择膦酸配体4-吡啶基二异氰酸酯(CH2PO3H2)2(H4L)和配体2,2′-双咪唑(H2biim),通过控制反应温度,水热法合成了2种结构和性质不同的镉基Cd-MOF [Cd1.5(HL)(H2biim)0.5](1)和(H4biim)0.5·[Cd2(L)(H2biim)Cl](2)。基于高物理化学稳定性和优异的发光稳定性,这两种MOF材料在水中、模拟环境系统和真实鱼水系统中对不同LODs的CAP进行了快速、可重复、高灵敏度和选择性的发光传感。进一步的传感机理研究表明,静态猝灭、弱相互作用、PET、IFE和竞争吸收的协同效应导致了CAP的高猝灭效应。Cd-MOF(1)和Cd-MOF(2)的在水中的检出限分别为7.50×10-7、3.23×10-8 mol/L。
2.3 发光MOF传感器对含氮抗生素的识别
2.3.1 发光MOF传感器对硝基咪唑类抗生素的识别
ZHANG等[31]制备了金属有机框架/分子印迹聚合物MIL-53(Fe)@MIP和MIL-53(Fe)两种MOF复合材料,提出了利用荧光传感器检测抗生素甲硝唑的方法。这些MOF的荧光猝灭特性各不相同。出现这种荧光猝灭现象的原因是MIL-53(Fe)@MIP的氧化程度较低,此外,电荷从MNZ分子转移到MOF分子。MIL-53(Fe)@MIP具有显著的荧光猝灭能力,可以用作发光传感平台。制备的MIL-53(Fe)@MIP具有较高的灵敏度,LOD为53.4 nmol/L。YANG等[32]利用对称的1,3,5-三苯甲酸配体制备了一种检测硝基咪唑的Tb-MOF。由于Tb-MOF的孔径非常小,其表面发生荧光猝灭。此外,Tb-MOF的寿命几乎保持不变,这表明在MNZ和DMZ的整个反应过程,Tb-MOF与分析物之间没有大量的非共价相互作用,而是一个静态猝灭过程中。由于对激发能量的竞争性吸附,Tb-MOF可以选择性地、灵敏地检测少量硝基咪唑类抗生素,该系统在缓冲溶液和水样的LOD为2.40 mmol/L。
2.3.2 发光MOF传感器对硝基呋喃类抗生素的识别
ZHANG等[33]利用Ln-MOF的抗干扰能力,创建用于抗生素识别的Ln-MOF传感器。他们首先使用混合基质膜开发了一种检测硝基呋喃抗生素(nitrofuran antibiotics,NFAs)的化学传感器,硝基呋喃酮(nitrofurazone,NFZ)和呋喃妥英(nitrofurantoin,NFT)的LOD分别为0.35、0.30 mmol/L。此外,采用Co3O4纳米锚固法制备了不锈钢丝网和镧系金属有机骨架(Ln-MOF)薄膜Eu-BCA(BCA为2,2 0-联喹啉-4,4 0 二羧酸盐)。NFZ和NFT的LOD分别为0.16、0.21 mmol/L。该方法已用于牛血清和河水样品中NFAs的检测。因此,合成的Ln-MOF传感器可以应用于NFAs。WANG等[34]合成了2种稳定的等结构Zr(IV)基MOF(BUT-12和BUT-13)。为了更好地理解BUT-12和-13对NFAs和硝基芳烃的荧光猝灭作用,本研究提出了一种猝灭机制。电子转移和共振能量转移共存导致NFAs和硝基芳烃的光致发光猝灭效应高于其他分析物。研究结果表明,BUT-12和BUT-13对NFZ的最大Ksv值分别为1.1×105、7.5×104 L/mol,BUT-12和BUT-13对NFT的最大Ksv值分别为3.8×104、6.0×104 L/mol。BUT-12和BUT-13的Ksv值和标准偏差表明,它们的荧光可以被微量的NFZ和NFT有效地熄灭。BUT-12和BUT-13化学传感器在可高效检测水溶液中的NZF,LOD分别为58、90 mg/L。合成Eu-MOF1检测硝基苯和硝基呋喃。在固态和乙醇溶液中,Eu-MOF1发出典型Eu3+离子的强红色荧光。“天线”效应诱导Eu-MOF1发光,其中间苯二丙烯酸配体将能量传递给Eu3+离子。如果硝基苯分子存在时,间苯二丙烯酸和硝基苯之间可能发生能量转移,通过FRET过程导致荧光猝灭。此外,NFZ (-2.609 eV)和NFT (-2.820 eV)的最低未占据分子轨道能量低于MOF的配体,这表明电子可以从配体转移到缺电子的NFA分析物。此外,计算得出的最低未占据分子轨道能值与猝灭效率相匹配。因此,硝基苯和硝基呋喃抗生素具有快速高效的荧光猝灭作用。此外,硝基呋喃的LOD为1.08×10-6 mol/L。因此,可以采用Eu-MOF1传感器以高灵敏度和选择性的方式识别硝基呋喃[35]。
2.4 发光MOF传感器对磺胺类抗生素的识别
近年来,镧系元素发光MOFs被认为是检测磺胺类抗生素的理想传感器。这是因为镧系元素具有天线效应、大斯托克位移、长发光寿命和强发射等光学特性。REN等[36]构建了一种水稳定的二维铕金属有机框架(Eu-MOF),并将其作为一种潜在的探针,用于对磺胺甲恶唑(sulfamethoxazole,SMZ)进行灵敏、可逆的发光传感,该探针在不同抗生素中对SMZ具有很高的选择性。采用水热法合成了一个著名的经典有机构筑单元—1,3,5-三(4-羧基苯基)苯(H3BTB)。H3BTB具有刚性的大分子结构,而且还可以作为共轭电子供体敏化稀土金属。Eu-MOF完全分散在水中,由于敏化剂H3BTB向Eu(III)离子进行了有效的能量转移,因此显示出典型的高分辨铕红色荧光发射。在水中逐步添加SMZ抗生素后,由于IFE效应,观察到Eu-MOF的发射强度逐渐减弱。这种Eu-MOF有可能成为一种灵敏、可逆和选择性检测水环境中SMZ的传感器,其LOD在0.65 μmol/L水平。
刺激响应型金属有机凝胶(metal-organic gels,MOGs)因其低密度、高比表面积和多孔性,被认为是高效检测抗生素的智能传感探针。2018年,QIN等[37]报道了一种抗水解稳定发光的Tb(III)基金属有机凝胶MOG(Tb),该凝胶由Al基MOG通过Tb(III)对Al(III)金属节点取代构建而成,可用于水介质中抗生素的高效检测。由于天线效应,铽基金属有机凝胶(MOG(Tb))在615、585、544、491 nm波长处发出典型的绿色荧光,衰减寿命长达1.27 ns,量子产率高达18.5%。在MOG(Tb)干凝胶中加入磺胺类抗生素SMZ和磺胺嘧啶(sulfadiazine,SDZ)后,发现荧光猝灭效果很强(>99%),这是因为抗生素有效吸收了激发能量,导致铽(Ⅲ)离子的敏化作用减弱。MOGs对SMZ和SDZ的最高KSV值分别为8.0×104、4.1×104 L/mol,说明MOGs与磺胺类抗生素具有高亲和力。对磺胺类药物的LOD为mg/L级。这种绿色合成策略可进一步扩展到开发智能MOG,使其在不同领域得到广泛应用。
2.5 发光MOF传感器对氟喹诺酮类抗生素的识别
氟喹诺酮类抗生素(fluoroquinolone antibiotics,FRQ)被广泛用于治疗多种细菌感染。例如,环丙沙星就是一种常见的氟喹诺酮类抗生素,在全球范围内用于治疗与呼吸道、泌尿道和关节等有关的各种感染。FRQ分为4种喹诺酮类衍生物,属于广谱杀菌剂,可同时对抗革兰氏阴性菌和革兰氏阳性菌。ZHONG等[38]合成了2种结构独特且异构的基于In(III)三维开放框架结构,即BUT-172和BUT-173,用于在水中选择性地识别FRQ抗生素。利用一种大型三位配体H3CTTA通过水热法有效地转化成In(III) MOFs。BUT-172和BUT-173显示出优异的高孔隙率,其微孔体积和表面积分别为0.66 cm3/g和 0.67 cm3/g、1 357 m2/g和1 366 m2/g。这2种MOFs的荧光发射光谱相似,在380 nm波长处观察到配体的发射最大值,在FRQ抗生素尤其是诺氟沙星和环丙沙星存在的情况下,即使在50 μg/L的水平上也能有效猝灭。有趣的是,其他类型的抗生素和非氟喹诺酮类抗生素的猝灭效果很差。在不同常见干扰物质如金属阳离子、酸和离子等存在下,进一步验证了其高选择性。作者推测,有效的荧光猝灭是由于MOFs和抗生素之间的竞争性光吸收以及MOFs与抗生素之间的共振能量转移造成的。这些In(III)MOFs在水中具有可重复性、低LOD和高稳定性,因此是在竞争性环境中有效检测FRQ抗生素的理想传感器。
2.6 发光MOF传感器对β-内酰胺类抗生素的识别
JALILI等[39]构建了一种复合MOF材料(gCDc/AuNCs@ZIF-80),作为比率荧光探针传感器用于头孢氨苄(cephalexin,CFX)检测。该探针在520、630 nm处观察到双荧光发射中心。CFX选择性猝灭ZIF-8中的gCDc/AuNC。该探针改善了CFX的传感性能。gCDc/AuNCs@ZIF-8的LOD较低(0.4 ng/mL),线性范围较大(0.1~6 ng/mL)。该探针具有高灵敏度和选择性,可以在痕量水平上更可靠地定量检测CFX。此外,所制备的传感探针成功地检测了牛奶样品中的CFX。
XING等[40]最近还开发了一种基于Cd-MOF的荧光探针,用于在水中选择性地灵敏检测抗生素头孢曲松钠(ceftriaxone sodium, CRO)。将1,4-双(2-甲基-咪唑-1-基)丁烷和1,2-苯二乙酸有机连接体与Cd(NO3)2·4H2O混合形成Cd-MOF。该探针能够在pH=4~11检测CRO。有机配体与镉(II)离子显示出独特的配位,即增加了配体构象的刚性,p-p*跃迁降低了配体激发态的辐射衰减并产生可观察到的发射带。从Cd-MOF到分析物的共振能量转移是导致Cd-MOF荧光猝灭的主要原因之一。计算得出CRO的LOD为μg/L级。进一步的研究证实,Cd-MOF也可用作荧光探针检测工业废水和污水中的CRO。
2.7 发光MOF传感器对其他兽用抗生素的识别
YI等[41]通过在MIL-53(Al)中包埋Eu3+,合成了一种简便有效的Eu3+后功能化MIL-53(Al)荧光探针(Eu3+@MIL-53 [Al])。研制的荧光探针首次用于水产养殖水体和水产品中孔雀石绿(malachite green,MG)的检测。该探针具有高选择性识别能力、高灵敏度和良好的再生能力。通过荧光共振能量转移MG有效地关闭Eu3+@MIL-53(Al)发光,从而实现MG传感。正如预期的那样,Eu3+@MIL-53(Al)是一种令人满意的荧光传感器,可以快速、可逆地识别养殖水体和水产品中非法添加的MG。所测样品的LOD为0.057 μmol/L,定量限(limit of quantitation,LOQ)为0.19 μmol/L。
LIU等[42]以ZIF-8@TPE为荧光团,以适配体为识别单元,研究了一种检测卡那霉素(kanamycin, Kana)的新型无标记荧光适配体传感器。ZIF-8@TPE的荧光可被ATP通过竞争性配位反应猝灭。利用ZIF-8@TPE上的Kana-aptamer与靶标卡那霉素结合前后的构象变化,可以实现对卡那霉素的高灵敏度监测。该方法线性范围宽,检出限低,特异性好。此外,通过改变适体序列,为食品样品分析中其他抗生素的敏感检测提供了可行的方法。
3 结论与展望
本文简要介绍了发光MOFs的传感机制和优势,及其在食品中抗生素类兽药残留分析物的荧光传感检测方面的应用。表1列出了本文中总结的检测结果。
表1 发光MOFs传感器在抗生素类兽药残留检测中的应用
Table 1 Some applications of luminescent MOFs based sensors for veterinary antibiotics residues detection
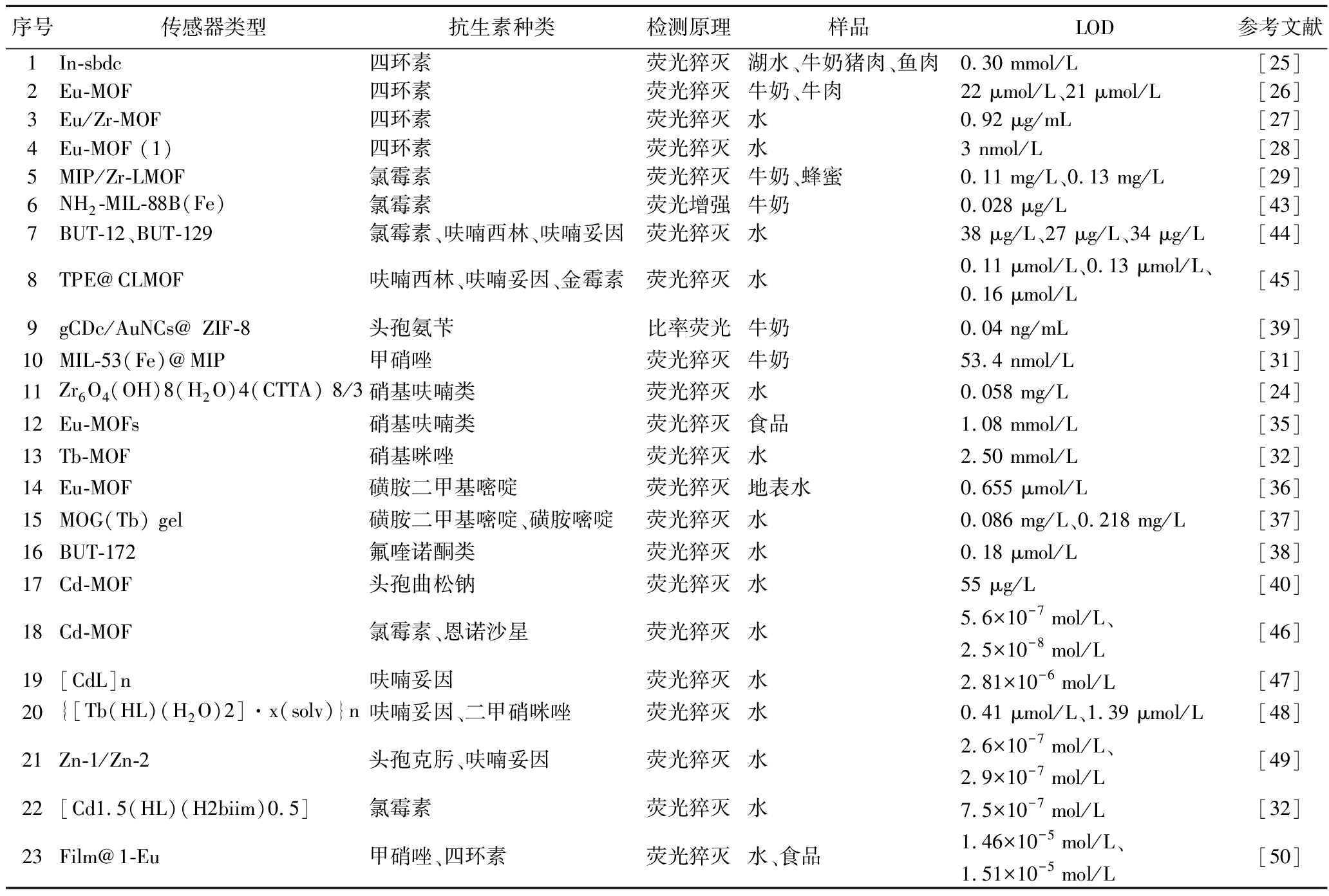
序号传感器类型抗生素种类检测原理样品LOD参考文献1In-sbdc四环素荧光猝灭湖水、牛奶猪肉、鱼肉0.30 mmol/L[25]2Eu-MOF四环素荧光猝灭牛奶、牛肉22 μmol/L、21 μmol/L[26]3Eu/Zr-MOF四环素荧光猝灭水0.92 μg/mL[27]4Eu-MOF (1)四环素荧光猝灭水3 nmol/L[28]5MIP/Zr-LMOF氯霉素荧光猝灭牛奶、蜂蜜0.11 mg/L、0.13 mg/L[29]6NH2-MIL-88B(Fe)氯霉素荧光增强牛奶0.028 μg/L[43]7BUT-12、BUT-129氯霉素、呋喃西林、呋喃妥因荧光猝灭水38 μg/L、27 μg/L、34 μg/L[44]8TPE@CLMOF呋喃西林、呋喃妥因、金霉素荧光猝灭水0.11 μmol/L、0.13 μmol/L、0.16 μmol/L[45]9gCDc/AuNCs@ ZIF-8头孢氨苄比率荧光牛奶0.04 ng/mL[39]10MIL-53(Fe)@MIP甲硝唑荧光猝灭牛奶53.4 nmol/L[31]11Zr6O4(OH)8(H2O)
4(CTTA) 8/3硝基呋喃类荧光猝灭水 0.058 mg/L[24]12Eu-MOFs硝基呋喃类荧光猝灭食品1.08 mmol/L[35]13Tb-MOF硝基咪唑荧光猝灭水2.50 mmol/L[32]14Eu-MOF磺胺二甲基嘧啶荧光猝灭地表水0.655 μmol/L[36]15MOG(Tb) gel磺胺二甲基嘧啶、磺胺嘧啶荧光猝灭水0.086 mg/L、0.218 mg/L[37]16BUT-172氟喹诺酮类荧光猝灭水0.18 μmol/L[38]17Cd-MOF头孢曲松钠荧光猝灭水55 μg/L[40]18Cd-MOF氯霉素、恩诺沙星荧光猝灭水5.6×10-7 mol/L、2.5×10-8 mol/L[46]19[CdL]n呋喃妥因荧光猝灭水2.81×10-6 mol/L[47]20{[Tb(HL)(H2O)2]·x(solv)}n呋喃妥因、二甲硝咪唑荧光猝灭水0.41 μmol/L、1.39 μmol/L[48]21Zn-1/Zn-2头孢克肟、呋喃妥因 荧光猝灭水2.6×10-7 mol/L、2.9×10-7 mol/L[49]22[Cd1.5(HL)(H2biim)0.5]氯霉素荧光猝灭水7.5×10-7 mol/L[32]23Film@1-Eu甲硝唑、四环素荧光猝灭水、食品1.46×10-5 mol/L、1.51×10-5 mol/L[50]
本文介绍了临床常用几种兽药,这些分析物导致了发光MOFs及其复合物的荧光发射响应。基于发光MOFs的荧光传感器大多数仍属于“信号关闭”机制,少数传感器基于“信号开启”机制。鉴于有毒有害物质种类繁多,对食品和环境安全的影响巨大,设计更多基于发光MOFs的传感器是当务之急。近年来,MOF材料的研究取得了显著的进展,尤其是在食品中有害物质的检测方面。为了全面评价目前的研究现状,对发光MOF材料的研究需要重视以下几个方面:
a)提高发光MOF的水稳定性和可重复性。这可以通过在发光MOFs中引入高价金属和含氮、磷多齿有机配体来实现。
b)提高发光MOFs的荧光稳定性,尤其是在目标物检测方面。可以通过强化高稳定配位键、引入疏水基团、使连接配体刚性化、增加连接数等策略提高发光MOF的稳定性,或者在MOFs表面包覆疏水分子、聚合物等方法提高其稳定性。
c)提高目标物定量分析的吸附效率:①精确控制发光MOFs的通道,孔径与目标物分子尺寸相匹配;②提高MOF孔隙亲和力,可通过调整有机配体亲电基团的数量来增加结合目标物;③增加氢键结合位点,可通过在MOFs上引入含氧官能团来增强其对目标物的结合力。
总之,基于发光MOFs的荧光传感器可以为食品相关分析物的化学传感以及微生物和细胞的生物检测应用开辟一个新的方向。因此,通过荧光传感和其他功能的结合将扩大功能化发光MOFs在医疗诊断和治疗以及光电器件等领域的潜在应用。
[1] KIM C, RYU H D, CHUNG E G, et al.A review of analytical procedures for the simultaneous determination of medically important veterinary antibiotics in environmental water:Sample preparation, liquid chromatography, and mass spectrometry[J].Journal of Environmental Management, 2018, 217:629-645.
[2] WAGIL M, KUMIRSKA J, STOLTE S, et al.Development of sensitive and reliable LC-MS/MS methods for the determination of three fluoroquinolones in water and fish tissue samples and preliminary environmental risk assessment of their presence in two rivers in northern Poland[J].The Science of the Total Environment, 2014, 493:1006-1013.
[3] DING R, CHEN Y, WANG Q S, et al.Recent advances in quantum dots-based biosensors for antibiotics detection[J].Journal of Pharmaceutical Analysis, 2022, 12(3):355-364.
[4] ZHANG L, WANG J, REN X Y, et al.Internally extended growth of core-shell NH2-MIL-101(Al)@ZIF-8 nanoflowers for the simultaneous detection and removal of Cu(II)[J].Journal of Materials Chemistry A, 2018, 6(42):21029-21038.
[5] FANG X, ZONG B Y, MAO S.Metal-organic framework-based sensors for environmental contaminant sensing[J].Nano-Micro Letters, 2018, 10(4):64.
[6] PAN M F, LI H L, YANG J Y, et al.Review:Synthesis of metal organic framework-based composites for application as immunosensors in food safety[J].Analytica Chimica Acta, 2023, 1266:341331.
[7] DONG J, ZHAO D, LU Y, et al.Photoluminescent metal-organic frameworks and their application for sensing biomolecules[J].Journal of Materials Chemistry A, 2019, 7(40):22744-22767.
[8] YI F Y, CHEN D X, WU M K, et al.Chemical sensors based on metal-organic frameworks[J].ChemPlusChem, 2016, 81(8):675-690.
[9] ZHANG H, LIN C S, SHENG T L, et al.A luminescent metal-organic framework thermometer with intrinsic dual emission from organic lumophores[J].Chemistry, 2016, 22(13):4 460-4 468.
[10] ZHANG M X, LIN X C, YI Z R, et al.Enhanced reactive oxidation species generation by ligand-to-metal-charge transfer between oxygen vacancy-rich ZnO mesocrystal with ciprofloxacin pollutants[J].Applied Catalysis B:Environmental, 2023, 321:122033.
[11] CHEN L, LIU D H, PENG J, et al.Ratiometric fluorescence sensing of metal-organic frameworks:Tactics and perspectives[J].Coordination Chemistry Reviews, 2020, 404:213113.
[12] WANG H, WANG X L, LIANG M S, et al.A boric acid-functionalized lanthanide metal-organic framework as a fluorescence “turn-on” probe for selective monitoring of Hg2+ and CH3Hg[J].Analytical Chemistry, 2020, 92(4):3366-3372.
[13] LI Y R, WANG Z W, XIA T, et al.Implementing metal-to-ligand charge transfer in organic semiconductor for improved visible-near-infrared photocatalysis[J].Advanced Materials, 2016, 28(32):6959-6965.
[14] WANG B, YANG Q, GUO C, et al.Stable Zr(IV)-based metal-organic frameworks with predesigned functionalized ligands for highly selective detection of Fe(III) ions in water[J].ACS Applied Materials &Interfaces, 2017, 9(11):10286-10295.
[15] WEI Y L, LI Y, CHEN Y Q, et al.Pd(II)-NHDC-functionalized UiO-67 type MOF for catalyzing heck cross-coupling and intermolecular benzyne-benzyne-alkene insertion reactions[J].Inorganic Chemistry, 2018, 57(8):4379-4386.
[16] DOLGOPOLOVA E A, RICE A M, MARTIN C R, et al.Photochemistry and photophysics of MOFs:Steps towards MOF-based sensing enhancements[J].Chemical Society Reviews, 2018, 47(13):4710-4728.
[17] HAO J N, YAN B.A water-stable lanthanide-functionalized MOF as a highly selective and sensitive fluorescent probe for Cd(2.)[J].Chemical Communications, 2015, 51(36):7737-7740.
[18] SHUSTOVA N B, ONG T C, COZZOLINO A F, et al.Phenyl ring dynamics in a tetraphenylethylene-bridged metal-organic framework:Implications for the mechanism of aggregation-induced emission[J].Journal of the American Chemical Society, 2012, 134(36):15061-15070.
[19] HU Z C, LUSTIG W P, ZHANG J M, et al.Effective detection of mycotoxins by a highly luminescent metal-organic framework[J].Journal of the American Chemical Society, 2015, 137(51):16209-16215.
[20] ZHANG Q, SU J, FENG D W, et al.Piezofluorochromic metal-organic framework:A microscissor lift[J].Journal of the American Chemical Society, 2015, 137(32):10064-10067.
[21] ZHANG J Y, ZHANG H K, LAM J W Y, et al.Restriction of intramolecular motion(RIM):Investigating AIE mechanism from experimental and theoretical studies[J].Chemical Research in Chinese Universities, 2021, 37(1):1-15.
[22] ZHU L Y, C RDOVA WONG B J, LI Y, et al.Quencher-delocalized emission strategy of AIEgen-based metal-organic framework for profiling of subcellular glutathione[J].Chemistry, 2019, 25(18):4665-4669.
RDOVA WONG B J, LI Y, et al.Quencher-delocalized emission strategy of AIEgen-based metal-organic framework for profiling of subcellular glutathione[J].Chemistry, 2019, 25(18):4665-4669.
[23] FLEMING-DUTRA K E, DEMIRJIAN A, BARTOCES M, et al.Variations in antibiotic and azithromycin prescribing for children by geography and specialty-United States, 2013[J].The Pediatric Infectious Disease Journal, 2018, 37(1):52-58.
[24] ZHOU Z, HAN M L, FU H R, et al.Engineering design toward exploring the functional group substitution in 1D channels of Zn-organic frameworks upon nitro explosives and antibiotics detection[J].Dalton Transactions, 2018, 47(15):5359-5365.
[25] LIU Q, NING D, LI W J, et al.Metal-organic framework-based fluorescent sensing of tetracycline-type antibiotics applicable to environmental and food analysis[J].The Analyst, 2019, 144(6):1916-1922.
[26] GAN Z Y, HU X T, XU X C, et al.A portable test strip based on fluorescent europium-based metal-organic framework for rapid and visual detection of tetracycline in food samples[J].Food Chemistry, 2021, 354:129501.
[27] LI Y J, WANG J Y, HUANG Z J, et al.An Eu-doped Zr-metal-organic framework for simultaneous detection and removal of antibiotic tetracycline[J].Journal of Environmental Chemical Engineering, 2021, 9(5):106012.
[28] ZHAO Y J, WANG Q Z, WANG H H, et al.Europium-based metal-organic framework containing characteristic metal chains:A novel turn-on fluorescence sensor for simultaneous high-performance detection and removal of tetracycline[J].Sensors and Actuators B:Chemical, 2021, 334:129610.
[29] AMIRIPOUR F, GHASEMI S, AZIZI S N.Design of turn-on luminescent sensor based on nanostructured molecularly imprinted polymer-coated zirconium metal-organic framework for selective detection of chloramphenicol residues in milk and honey[J].Food Chemistry, 2021, 347:129034.
[30] ZHOU Y N, WANG L, YU J H, et al.Two stable Cd-MOFs as dual-functional materials with luminescent sensing of antibiotics and proton conduction[J].Inorganic Chemistry, 2022, 61(49):20111-20122.
[31] ZHANG Z P, LIU Y, HUANG P C, et al.Polydopamine molecularly imprinted polymer coated on a biomimetic iron-based metal-organic framework for highly selective fluorescence detection of metronidazole[J].Talanta, 2021, 232:122411.
[32] YANG H W, XU P, WANG X G, et al.A highly stable (4, 8)-connected Tb-MOF exhibiting efficiently luminescent sensing towards nitroimidazole antibiotics[J].Zeitschrift Für Anorganische Und Allgemeine Chemie, 2020, 646(1):23-29.
[33] ZHANG F, YAO H, CHU T S, et al.A lanthanide MOF thin-film fixed with Co3 O4 nano-anchors as a highly efficient luminescent sensor for nitrofuran antibiotics[J].Chemistry, 2017, 23(43):10293-10300.
[34] WANG B, LV X L, FENG D, et al.Highly stable Zr(IV)-based metal-organic frameworks for the detection and removal of antibiotics and organic explosives in water[J].Journal of the American Chemical Society, 2016, 138(19):6204-6216.
[35] SUN S L, SUN X Y, SUN Q, et al.Europium metal-organic framework containing helical metal-carboxylate chains for fluorescence sensing of nitrobenzene and nitrofunans antibiotics[J].Journal of Solid State Chemistry, 2020, 292:121701.
[36] REN K, WU S H, GUO X F, et al.Lanthanide organic framework as a reversible luminescent sensor for sulfamethazine antibiotics[J].Inorganic Chemistry, 2019, 58(7):4223-4229.
[37] QIN Z S, DONG W W, ZHAO J, et al.A water-stable Tb(III)-based metal-organic gel (MOG) for detection of antibiotics and explosives[J].Inorganic Chemistry Frontiers, 2018, 5(1):120-126.
[38] ZHONG W B, LI R X, LV J, et al.Two isomeric In(III)-MOFs:Unexpected stability difference and selective fluorescence detection of fluoroquinolone antibiotics in water[J].Inorganic Chemistry Frontiers, 2020, 7(5):1161-1171.
[39] JALILI R, IRANI-NEZHAD M H, KHATAEE A, et al.A ratiometric fluorescent probe based on carbon dots and gold nanocluster encapsulated metal-organic framework for detection of cephalexin residues in milk[J].Spectrochimica Acta.Part A, Molecular and Biomolecular Spectroscopy, 2021, 262:120089.
[40] XING P C, WU D, CHEN J S, et al.A Cd-MOF as a fluorescent probe for highly selective, sensitive and stable detection of antibiotics in water[J].The Analyst, 2019, 144(8):2656-2661.
[41] YI K Y, ZHANG L.Designed Eu(III)-functionalized nanoscale MOF probe based on fluorescence resonance energy transfer for the reversible sensing of trace Malachite green[J].Food Chemistry, 2021, 354:129584.
[42] LIU S S, CHEN Y M, RUAN Z J, et al.Development of label-free fluorescent biosensor for the detection of kanamycin based on aptamer capped metal-organic framework[J].Environmental Research, 2022, 206:112617.
[43] WANG X, YUN Y J, SUN W, et al.A high-performance fluorescence immunoassay based on pyrophosphate-induced MOFs NH2-MIL-88B(Fe) hydrolysis for chloramphenicol detection[J].Sensors and Actuators B:Chemical, 2022, 353:131143.
[44] ZHAO Y L, CHEN Q, LV J, et al.Specific sensing of antibiotics with metal-organic frameworks based dual sensor system[J].Nano Research, 2022, 15(7):6430-6437.
[45] SUN X Z, QIAO Y F, ZHANG M, et al.AIE-based cyclodextrin metal-organic frame material for fluorescence detection of nitrofuran and tetracycline antibiotics in aqueous solution[J].Microchemical Journal, 2023, 190:108687.
[46] CONG Z Z, SONG Z F, MA Y X, et al.Highly emissive metal-organic frameworks for sensitive and selective detection of nitrofuran and quinolone antibiotics[J].Chemistry, an Asian Journal, 2021, 16(13):1773-1779.
[47] LI Q Q, WEN M J, ZHANG Y S, et al.Multiple fluorescence response behaviors towards antibiotics and bacteria based on a highly stable Cd-MOF[J].Journal of Hazardous Materials, 2022, 423(Pt B):127132.
[48] LEI M Y, GE F Y, GAO X J, et al.A water-stable Tb-MOF As a rapid, accurate, and highly sensitive ratiometric luminescent sensor for the discriminative sensing of antibiotics and D2O in H2O[J].Inorganic Chemistry, 2021, 60(14):10513-10521.
[49] ZHOU Z D, LI S Q, LIU Y, et al.Two bis-ligand-coordinated Zn(II)-MOFs for luminescent sensing of ions, antibiotics and pesticides in aqueous solutions[J].RSC Advances, 2022, 12(13):7780-7788.
[50] LI Y, WANG M, YANG G P, et al.Fabrication of the antibiotic sensor by the multifunctional stable adjustable luminescent lanthanide metal-organic frameworks[J].Inorganic Chemistry, 2023, 62(11):4735-4744.